Abstract
目的
研究使用基于滋养层细胞表面抗原2(trophoblast cell-surface antigen 2, Trop2)纳米抗体构建的嵌合抗原受体(chimeric antigen receptor, CAR)T(CAR-T)细胞是否可用于治疗Trop2阳性的非小细胞肺癌。
方法
构建Trop2特异性噬菌体展示纳米抗体文库,用于筛选Trop2特异性纳米抗体。利用间接ELISA检测Trop2的3种(8#、14#和48#)纳米抗体结合抗原的能力,并通过表面等离子共振测定纳米抗体的亲和力。基于Trop2特异性纳米抗体构建CAR-T,将其与表达萤光素酶的Trop2阳性细胞系NCI-H292以及Trop2阴性细胞系A549细胞共培养,通过多功能酶标仪读取效靶比分别为4∶1、2∶1、1∶1、1∶2的萤光素酶值以测定杀伤效率,利用ELISA方法检测效靶比为4∶1的上清中白细胞介素(interleukin, IL)-2、干扰素γ(interferon γ, IFN-γ)和肿瘤坏死因子α(tumor necrosis factorα, TNF-α)细胞因子的水平。本研究还在NCG免疫缺陷小鼠中建立NCI-H292异种移植模型,分为空白组(PBS组)、Mock-T组和Trop2 CAR-T组(n=5),通过尾静脉输注1×107个Trop2 CAR-T细胞。实验期间每日观察小鼠生长状态和存活情况,每3 d测量一次肿瘤大小并分析生存期。
结果
通过纳米抗体文库成功筛选到Trop2特异性纳米抗体,利用间接ELISA初步测定48#纳米抗体的亲和力最强。随后,通过表面等离子共振测定48#纳米抗体的亲和力在2.49×10-8 M数量级,属于高亲和力抗体,并基于该纳米抗体成功制备Trop2 CAR-T细胞。体外实验结果表明,Trop2 CAR-T细胞以剂量依赖性方式杀死Trop2阳性的NCI-H292非小细胞肺癌细胞。通过ELISA检测发现,共培养体系中的细胞因子(IL-2、IFN-γ和TNF-α)分泌明显增加,进一步验证了其抗肿瘤活性。在NCI-H292异种移植小鼠模型中,与PBS组和Mock-T组相比,Trop2 CAR-T组肿瘤体积缩小(P<0.001),荷瘤小鼠生存期延长(P<0.05)。
结论
本研究结果证实基于Trop2纳米抗体构建的CAR-T细胞可有效治疗Trop2阳性的非小细胞肺癌。
Keywords: 滋养层细胞表面抗原2, 非小细胞肺癌, 嵌合抗原受体
Abstract
Objective
To investigate whether chimeric antigen receptor (CAR) T cells constructed with nanobodies based on trophoblast cell-surface antigen 2 (Trop2) can be used to treat Trop2-positive non-small cell lung cancer.
Methods
A Trop2-specific phage display nanobody library was constructed to screen for Trop2-specific nanobodies. The antigen-binding capacities of three Trop2 nanobodies (8#, 14#, and 48#) were assessed using indirect enzyme-linked immunosorbent assay (ELISA), and their binding affinities were analyzed through surface plasmon resonance (SPR) analysis. CAR-T cells were constructed with Trop2-specific nanobodies and were then co-cultured with the Trop2-positive NCI-H292 cell line expressing luciferase and the Trop2-negative A549 cell line. Luciferase values at effector-to-target ratios of 4∶1, 2∶1, 1∶1, and 1∶2 were measured using a multifunctional microplate reader to assess the killing efficiency. The levels of interleukin (IL)-2, interferon γ (IFN-γ), and tumor necrosis factor α (TNF-α) cytokines in the supernatant at an effector-to-target ratio of 4∶1 were measured using the ELISA method. We also established in this study an NCI-H292 xenograft model in NCG immunodeficient mice, which were divided into three groups, a phosphate-buffered saline (PBS) control group, a Mock-T group, and a Trop2 CAR-T group (n = 5). A total of 1×107 Trop2 CAR-T cells were administered via tail vein injection. Throughout the experimental period, the growth and survival status of the mice were observed daily, and tumor sizes were measured once every three days to analyze the survival time.
Results
A Trop2-specific nanobody was successfully screened from the nanobody library, and indirect ELISA initially indicated that nanobody 48# had the strongest affinity. Subsequently, surface plasmon resonance analysis revealed that nanobody 48# exhibited an affinity in the range of 2.49×10-8 M, indicating that it was a high-affinity antibody. Based on this nanobody, Trop2 CAR-T cells were successfully constructed. Furthermore, in vitro experiments demonstrated that Trop2 CAR-T cells killed Trop2-positive NCI-H292 non-small cell lung cancer cells in a dose-dependent manner. ELISA showed a significant increase in the secretion of cytokines (IL-2, IFN-γ, and TNF-α) in the co-culture system, further validating their antitumor activity. In the NCI-H292 xenograft mouse model, the Trop2 CAR-T group exhibited reduced tumor size (P < 0.001) and prolonged survival time of tumor-bearing mice (P < 0.05) compared to the PBS and Mock-T groups.
Conclusion
These findings demonstrate that CAR T cells constructed with Trop2 nanobodies can effectively treat Trop2-positive non-small cell lung cancer.
Keywords: Trophoblast cell-surface antigen 2, Non-small cell lung cancer, Chimeric antigen receptor
近年来,嵌合抗原受体(chimeric antigen receptor, CAR)T(CAR-T)细胞疗法作为一种前沿的免疫治疗手段,已在治疗血液系统恶性肿瘤中展现出令人瞩目的临床成效[1-3]。CAR-T细胞是一种通过基因工程技术将T细胞赋予特定抗原识别和杀伤能力的免疫细胞,通过此种方式来实现对肿瘤细胞的定向清除。然而,尽管在血液系统恶性肿瘤治疗中取得显著成果,CAR-T细胞在实体瘤的应用中却面临着诸多挑战,其治疗效果尚未达到令人满意的水平[4-8]。因此,寻找适合用于实体瘤治疗的新靶标具有重要的临床意义。
滋养层细胞表面抗原2(trophoblast cell-surface antigen 2, Trop2)是一种广泛过表达于多种实体瘤细胞表面的肿瘤相关抗原,因其在非小细胞肺癌等恶性肿瘤中的高表达,被认为可能是治疗该类肿瘤的潜在靶点[9]。Trop2在非小细胞肺癌的作用机制尚未完全明确,但一些研究表明,Trop2能够激活多条与癌症相关的信号通路,包括磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)和丝裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶(ERK)信号通路,这些信号通路与细胞增殖、存活和迁移密切相关[10]。同时,Trop2与上皮-间质转化(epithelial–mesenchymal transition, EMT)过程有联系。Trop2高表达可以促进EMT的发生,从而使非小细胞肺癌细胞更容易转移。也有研究表明,Trop2可能通过影响信号通路来调节细胞因子和趋化因子的分泌,从而在免疫微环境中发挥作用[11]。此外,Trop2的胞外结构可以与肿瘤微环境中的其他分子相互作用,进一步增强癌细胞的浸润性[12]。以Trop2作为CAR-T细胞的靶向抗原,有望为实体瘤治疗带来突破。
纳米抗体是一种小型抗体分子,来源于骆驼、羊驼或美洲驼等动物。相比传统抗体,纳米抗体有更好的抗原结合能力和组织渗透性,适用于诊断、治疗和研究[13-15]。特别是在免疫治疗和肿瘤标志物检测方面具有潜在应用。基于此,本研究旨在探索利用基于Trop2纳米抗体构建的CAR-T细胞,用作治疗Trop2阳性非小细胞肺癌的潜在新策略。本研究采用新型抗Trop2的纳米抗体构建CAR结构,设计针对Trop2的CAR-T细胞,并对其体外和体内抗肿瘤活性进行了深入研究,为CAR-T细胞疗法在实体瘤领域的拓展提供实验依据。
1. 材料与方法
1.1. 细胞系
细胞系NCI-H292、A549和HEK 293购自ATCC(American Type Culture Collection, Manassas),并在含有10%胎牛血清(Gibco,美国)和青霉素-链霉素(Gibco,美国)的DMEM(Gibco,美国)中培养。
1.2. 生信分析
分析TCGA数据库(The Cancer Genome Atlas)中非小细胞肺癌(含肺腺癌、肺鳞癌)Trop2基因表达情况的样本数据,可以得到Trop2基因在非小细胞肺癌以及正常组织中的表达情况。
1.3. 流式细胞术检测非小细胞肺癌细胞系Trop2的表达
在进行流式细胞术之前,计数所需的NCI-H292和A549细胞,并将1×106个细胞放入流式细胞术管中。用PBS洗涤细胞一次,然后用人Fc阻断剂在室温下封闭30 min。封闭后,在管中加入适量的Trop2抗体(eBioscience,美国),充分混合,避光孵育40 min。孵育后用PBS洗涤细胞,离心3 min,弃上清液。最后加入200 μL PBS重悬细胞沉淀,用流式细胞术分析细胞,每个实验均包括同型对照。
1.4. 构建纳米抗体文库
本研究通过人源Trop2 cDNA ORF Clone载体(义翘神州生物公司)扩增了Trop2免疫抗原基因的胞外片段(extracellular domain, ECD),将其插入到pcDNA3.1-mouse Fc(Addgene, USA),成功获得Trop2(ECD)-mouse Fc(mFc)融合蛋白瞬时表达载体。随后,利用HEK 293细胞表达Trop2(ECD)-mFc重组蛋白,并利用Protein G(博格隆)纯化该蛋白,获得Trop2(ECD)-mFc蛋白。随后,本研究对2岁的双峰驼(内蒙古阿拉善盟)进行了5次抗原免疫。免疫完成,采集双峰驼200 mL外周血,分离外周血单个核细胞(PBMC),并使用RNA提取试剂盒(天根生物)提取RNA,再将提取的RNA反转录成cDNA。通过巢式PCR,分别使用1st和2nd的引物(由擎科生物合成)扩增单域抗体基因VHH(又称纳米抗体,Nanobody)(扩增引物见表1);将扩增得到的VHH片段克隆到噬菌体展示载体pMECS(本实验室保存),并电穿孔到感受态细胞TG1(Lucigen,美国)中,构建噬菌体展示VHH抗体文库。
表 1. VHH amplification primer sequence.
VHH扩增引物序列
| Primer | Sequence (5′ to 3′) |
| 1st-F | GTCCTGGCTCTCTTCTACAAGG |
| 1st-R | GGTACGTGCTGTTGAACTGTTCC |
| 2nd F | GATGTGCAGCTGCAGGAGTCTGGAGGAGG |
| 2nd R | GGACTAGTGCGGCCGCTGCAGACGGTGACCTGGGT |
1.5. 靶向Trop2特异性噬菌体展示纳米抗体文库的筛选
本研究首先将Trop2-mFc融合蛋白每孔包被在ELISA板上,每孔使用100 μg蛋白,并将其置于4 ℃冰箱过夜。在37 ℃下使用2%脱脂奶粉封闭1 h,随后加入100 μL(7.5×1011 CFU)噬菌体,即1.4构建的噬菌体展示纳米抗体文库,并在室温下作用2 h。然后,用含0.05%吐温-20的PBST洗涤孔板4次,以洗掉未结合的噬菌体。最后,使用Triethylamine解离与Trop2特异性结合的噬菌体,并感染对数生长期的TG1,扩增收集噬菌体,重复3轮该筛选过程。
经过3轮淘选和漂洗后,通过ELISA评估Trop2特异性噬菌体颗粒的富集。此后,使用HRP标记的山羊抗M13 IgG抗体(义翘神州)的间接ELISA随机选择单个克隆进行单克隆鉴定。最终,所有阳性鉴定的克隆都根据其互补决定区(complementarity-determining region, CDR)的氨基酸序列进行测序分析。进一步将上述获得的纳米抗体序列,通过PCR扩增(扩增引物见表2)插入到pcDNA3.1(Addgene, USA),成功获得纳米抗体融合hFc〔Nanobody(Nb)-Human Fc(hFc)〕瞬时表达载体。利用1.4中蛋白纯化的方法纯化重组纳米抗体。
表 2. Amplification primer sequences of pcDNA3.1 transient expression vector.
pcDNA3.1瞬时表达载体扩增引物序列
| Primer | Sequence (5′ to 3′) |
| Nanobody-hFc-F | CCAGATTACGCTCTGCAGGGATCCCAGGTGCAGCTGCAGGAG |
| Nanobody-hFc-R | AGGTGAACCGCCTCCACCGAATTCTGAGGAGACGGTGACCTG |
1.6. 间接ELISA检测Trop2纳米抗体结合抗原的能力
①包被Trop2(ECD)-mFc抗原:100 μL抗原蛋白溶液,4 ℃过夜;②弃包被蛋白溶液,PBST洗涤2~3次,用2%脱脂牛奶37 ℃封闭1 h;③弃液体,PBST洗涤2~3次,加100 μL 1.5中纯化的Trop2纳米抗体,100 μL 2%脱脂牛奶,于37 ℃孵育2 h;④弃液体,PBS洗涤3次,0.1%PBST洗涤10次,PBS再洗涤3次;⑤HRP-goat anti-human抗体用1% BSA 1∶8000稀释,加50 μL于每孔,室温孵育1 h;⑥重复④步骤洗板;⑦加入50 μL TMB显色液,于37 ℃孵育显色10 min;⑧加50 μL 2 mol/L硫酸终止反应;⑨终止后立刻于450 nm处测量OD值,利用Graphpad软件绘制结合曲线,以确定Trop2纳米抗体结合抗原的能力。
1.7. 免疫荧光检测Trop2纳米抗体特异性结合能力
将预先制备好的对数生长期细胞NCI-H292接种到细胞培养板中,过夜培养后,用体积分数为4%多聚甲醛固定,5%BSA封闭。室温下孵育针对目标蛋白的一抗(1.5中获得的Trop2纳米抗体)1 h,再用594荧光标记山羊抗人的二抗(Jackson,美国)孵育1 h。经过额外的PBS洗涤步骤后,用含有DAPI的荧光淬灭固定剂封片。使用共聚焦显微镜获取显微图像。
1.8. Trop2纳米抗体亲和力测定
通过表面等离子共振验证候选Trop2纳米抗体亲和力,并确定其结合动力学常数(Kd)。使用GEBiacoreTM 8K仪器,利用氨基偶联试剂盒(GE,美国)中的偶联缓冲液将抗小鼠IgG抗体(GE,美国)固定在CM5芯片(GE,美国)表面,再将Trop2(ECD)-mFc以2倍系列稀释捕获到CM5芯片上;之后让纯化的Trop2纳米抗体流过芯片的表面,机器读取ka (1/Ms)、kd (1/s)、Kd (M),即测量到重组纳米抗体的亲和力。
1.9. T细胞分离培养
通过密度梯度离心法从健康供体血样(川北医学院附属医院肿瘤科提供)中分离PBMC。分离的T细胞在X-vivo培养基(Lonza)中培养,培养基中添加10%灭活胎牛血清、人白细胞介素(interleukin, IL)-7(Miltenyi)、人IL-15(Miltenyi)和青霉素-链霉素(100 U/mL)。用T cell TransactTM(Miltenyi)激活细胞72 h。
1.10. T细胞转导
将1.5筛选获得的编码抗Trop2纳米抗体基因克隆到第二代CAR-BBz载体(Addgene,美国)中,以产生靶向Trop2的特异性CAR。通过转染HEK 293细胞产生慢病毒上清液,将浓缩后的CAR慢病毒立即保存于-80 ℃备用。后续将慢病毒加入到T细胞中感染96 h,以获得CAR-T细胞,并将CAR-T细胞与Trop2-mFc蛋白37 ℃孵育1 h,孵育后用PBS洗涤细胞,离心3 min,弃上清液。接着加入FITC荧光标记山羊抗小鼠的二抗(Proteintech,中国)37 ℃孵育1 h,最后加入200 μL PBS重悬细胞沉淀,用流式细胞术分析细胞,每个实验均包括同型对照,最终通过流式结果明确CAR在T细胞表面的表达情况。
1.11. Trop2 CAR-T细胞体外细胞毒性实验
将含萤光素酶基因质粒FUGW(Addgene,美国)转染至NCI-H292细胞,构建NCI-H292-mCherry.ffLuc靶细胞系。为评估靶向Trop2的CAR-T细胞功能,将其与表达萤光素酶的抗原阳性细胞系NCI-H292-mCherry.ffLuc,以及抗原阴性的A549细胞共培养24 h,以评估CAR-T细胞杀伤肿瘤细胞的能力。设置PBS、Mock T细胞和Trop2 CAR-T组,分别按照效靶比4∶1、2∶1、1∶1、1∶2接种细胞于96孔板,共同培养24 h后,通过多功能酶标仪读取萤光素酶值以测定杀伤效率(specific lysis);利用ELISA试剂盒(ThermoFisher)检测效靶比为4∶1的上清中IL-2、干扰素γ(interferon γ, IFN-γ)和肿瘤坏死因子α(tumor necrosis factor α, TNF-α)细胞因子的水平。
1.12. Trop2 CAR-T细胞对非小细胞肺癌的体内疗效
所有动物实验均按照川北医学院附属医院生物医学伦理委员会批准的方案进行(批件号:2023ER96-1)。雌性NCG小鼠,7~8周龄,购自南京集萃药康公司。本研究利用NCG免疫缺陷小鼠建立NCI-H292异种移植小鼠模型,当注射肿瘤细胞后第7天,肿瘤体积约为100 mm3时,在D7、D14、D21和D28,试验组每只小鼠尾静脉输注1×107个Trop2 CAR-T细胞,设置空白对照组(输注与给药等体积的PBS)以及Mock-T细胞组(输注1×107个T细胞),每组5只小鼠。给药示意图详见2.5部分。每日观察小鼠的生长状态和存活情况,分析其生存期。同时,每3 d测量小鼠肿瘤大小。移植瘤平均体积按照公式V=1/2(L×W2)计算,其中L代表瘤体的长度,W代表瘤体的宽度。当小鼠肿瘤体积达到1500 mm3或者肿瘤表面出现明显溃破时,则处死小鼠,结束动物实验。
1.13. 统计学方法
使用GraphPad Prism软件进行统计分析。数据以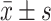 表示,组间比较采用t检验或单因素方差分析,然后进行Tukey事后检验。利用Kaplan-Meier估计值对模型小鼠的生存率进行分析,并通过对数秩检验评估差异显著性。实验包括来自每个供体的3个生物学重复,并重复两次。P<0.05为差异有统计学意义。
表示,组间比较采用t检验或单因素方差分析,然后进行Tukey事后检验。利用Kaplan-Meier估计值对模型小鼠的生存率进行分析,并通过对数秩检验评估差异显著性。实验包括来自每个供体的3个生物学重复,并重复两次。P<0.05为差异有统计学意义。
2. 结果
2.1. Trop2基因水平和细胞水平的表达
在TCGA数据库中分析非小细胞肺癌(含肺腺癌、肺鳞癌)Trop2基因表达情况,与正常组织相比,Trop2在肺腺癌、肺鳞癌中均有不同程度的表达(图1A)。为了Trop2确定是否是CAR-T疗法治疗非小细胞肺癌的靶点,本研究使用商业抗Trop2抗体通过流式细胞术检测了2种非小细胞肺癌细胞系Trop2的表达水平,如图1B所示,NCI-H292细胞为阳性,A549细胞为阴性。
图 1.

Detection of Trop2 expression at the tissue (A) and cellular (B) levels
Trop2在组织(A)和细胞水平(B)的表达情况检测
LUAD: lung adenocarcinoma (tumor, n = 276; normal, n = 237); LUSC: lung squamous cell carcinoma (tumor, n = 276; normal, n = 237). ** P < 0.01, **** P < 0.0001.
2.2. VHH文库构建及靶向Trop2纳米抗体筛选
重组Trop2(ECD)蛋白采用HEK 293表达系统表达,经SDS-PAGE验证,结果显示成功表达并纯化Trop2-mFc蛋白。然后用Trop2(ECD)-mFc蛋白对双峰驼进行5次免疫,第4次免疫后滴度达到1∶256000(图2A)。从200 mL骆驼血样中获得3×108个PBMC。从PBMC中提取RNA作为文库模板。逆转录后,成功扩增出VHH(约400 bp)的目标条带。然后将VHH序列插入pMECS并转化到TG1细胞中。通过计算菌落数评估文库大小为7.3×109,并对挑选出的50个克隆进行PCR检测,插入率为96.2%。
图 2.

Construction of the nanobody library and screening of anti-Trop2 nanobodies
纳米抗体文库构建及抗Trop2纳米抗体筛选
A, Determination of Trop2-specific antibody titers: measurement of the Trop2-specific antibody titers in serum from dromedary camels (n = 2 per group); B, phage enrichment: specific phage enrichment folds after three rounds of panning for the nanobody library (n = 1 per group); C, ELISA for positive clones: identification of positive clones through ELISA analysis (a, Trop2-mFc; b, unrelated control); D, affinity assessment: determination of the binding affinity of recombinant nanobodies using ELISA (n = 5 per group); E, immunofluorescence of Trop2 nanobody: specific binding of Trop2 nanobodies to NCI-H292 cells, visualized by immunofluorescence.
随着Trop2重组蛋白的几轮淘选,针对Trop2(ECD)-mFc蛋白的特异性纳米抗体颗粒被富集,表现为富集倍数由第1轮的9倍增加到第3轮的333倍(图2B)。然后通过单克隆ELISA测定从文库中挑选出3个可以结合Trop2-mFc蛋白的克隆(图2C)。对每个阳性克隆进行测序后,根据CDR的氨基酸序列获得3个独特的纳米抗体(8#、14#、48#),然后将它们全部克隆到表达载体中以产生重组纳米抗体。
进一步,利用间接ELISA检测Trop2的3个纳米抗体结合抗原的能力,将hFc作为对照组,结果显示,3个纳米抗体均能结合Trop2抗原,其中48#纳米抗体的亲和力最强(图2D)。随后,通过免疫荧光进行48#纳米抗体的结合特异性鉴定。免疫荧光结果表明,Trop2的候选纳米抗体能够特异性结合细胞NCI-H292(图2E)。同时,通过表面等离子共振验证48#纳米抗体的亲和力,并确定其结合动力学常数(Kd)。亲和力测定结果显示,48#纳米抗体能够特异性结合Trop2-mFc蛋白,亲和力在2.49×10-8 M数量级,属于高亲和力抗体,动力学特征显示,48#纳米抗体具有较慢的解离速率,ka (1/Ms)为1.05×104,kd (1/s)为2.60×10-4。
2.3. CAR的设计和功能特性
在本研究中,CAR的结构包括CD8信号肽、抗原结合结构域、CD8的ECD、CD28跨膜结构域(TM)、4-1BB胞内共刺激结构域和CD3ζ信号转导结构域。进一步,将慢病毒转导T细胞96 h后,将CAR-T细胞与Trop2-mFc蛋白孵育,以明确CAR在T细胞表面的表达情况。结果表明,Trop2 CAR在T细胞上成功表达,转导后表达率为68.58%。
2.4. Trop2 CAR-T可有效杀死Trop2+非小细胞肺癌细胞
为评估靶向Trop2的CAR-T细胞功能,将其与表达萤光素酶的抗原阳性细胞系NCI-H292以及抗原阴性细胞系A549细胞共培养,结果表明,靶向Trop2的CAR-T细胞以剂量依赖性方式杀死表达Trop2的肿瘤细胞(图3A、3B)。此外,靶向Trop2的CAR-T细胞与肿瘤细胞共培养中,Trop2 CAR-T细胞组中TNF-α、IFN-γ和IL-2的含量高于Mock T细胞组(P<0.0001)(图3C)。
图 3.
Trop2 CAR-T cells effectively kill Trop2+non-small cell lung cancer cells
Trop2 CAR-T细胞可有效杀死Trop2+非小细胞肺癌细胞
A and B, Cytotoxicity assay: killing efficiency of CAR-T cells co-cultured for 24 h with luciferase-expressing Trop2-positive NCI-H292 cells and Trop2-negative A549 cells (n = 5 per group); C, cytokine secretion analysis: levels of interleukin (IL)-2, interferon γ (IFN-γ), and tumor necrosis factor α (TNF-α) in the supernatants after 24 h of co-culture, measured by ELISA (n = 5 per group). **** P < 0.0001.
2.5. Trop2 CAR-T有效抑制非小细胞肺癌异种移植肿瘤的生长
给药示意图见图4A。Trop2 CAR-T细胞治疗NCI-H292异种移植小鼠模型的结果表明,与对照组(空白对照组和Mock T细胞组)相比,实验组的肿瘤体积变小(P<0.001)(图4B)。小鼠肿瘤生存曲线表明,实验组观察到明显的肿瘤进展的延缓,荷瘤小鼠的生存时间明显延长(P<0.05)(图4C)。
图 4.

Trop2 CAR-T cells prolong the survival in tumor-bearing mice
Trop2 CAR-T细胞延长了荷瘤小鼠的生存期
A, The schematic of in vivo treatment: illustration of the dosing regimen for CAR-T cell therapy in tumor-bearing mice; B, tumor volume measurement: comparison of tumor volumes between treatment groups over time (n = 5 per group); C, Kaplan-Meier survival analysis: survival analysis of mice using the Kaplan-Meier method. Statistical significance between groups was assessed using the log-rank test (Mantel-Cox). The data are presented as  from three independent experiments. ***
P < 0.001.
from three independent experiments. ***
P < 0.001.
3. 讨论
CAR-T细胞疗法在血液系统恶性肿瘤中的成功促使人们进行广泛的研究以扩大其在实体肿瘤中的应用[16-18]。使用Trop2特异性纳米抗体开发CAR-T细胞代表了靶向癌症免疫治疗领域的一种新方法。纳米抗体源自骆驼重链抗体,具有明显的优势,包括体积小、稳定性高和组织穿透效率高[19]。将这些纳米抗体整合到CAR-T细胞设计中为增强CAR-T细胞疗法的特异性和有效性提供了一条有希望的途径[20-22]。
本研究利用筛选得到的Trop2特异性纳米抗体,成功构建了基于纳米抗体的CAR,并通过慢病毒载体将该CAR导入人T细胞,制备了Trop2 CAR-T细胞。相比传统单克隆抗体,纳米抗体因其小分子量、稳定性高和特异性强的优势,能够更高效地识别肿瘤相关抗原Trop2。实验结果表明,Trop2 CAR在T细胞表面能够高效表达,表明CAR的构建和细胞工程化操作成功,这为后续体内外抗肿瘤研究提供了基础。
体外实验结果表明,Trop2 CAR-T细胞在与Trop2阳性的NCI-H292非小细胞肺癌细胞共培养时表现出明显的细胞毒性。通过ELISA检测发现,共培养体系中的细胞因子(IL-2、IFN-γ和TNF-α)分泌明显增加,进一步验证了其抗肿瘤活性。在NCI-H292异种移植小鼠模型中,Trop2 CAR-T细胞能够明显抑制肿瘤生长,并延长荷瘤小鼠的生存期。Kaplan-Meier生存分析和肿瘤体积监测均显示,Trop2 CAR-T细胞在体内具有良好的抗肿瘤效应。这种抗肿瘤效应可能源于Trop2 CAR-T细胞与Trop2抗原特异性结合后,激活了下游信号通路,从而诱导T细胞的效应功能。然而,实验中发现,Trop2阴性的A549细胞未引起明显的CAR-T细胞杀伤作用,表明Trop2 CAR-T细胞的抗肿瘤作用具有高度特异性。此外,多项研究指出,Trop2在免疫微环境和炎性反应的调控中扮演着重要角色,尤其在肿瘤环境中尤为显著。Trop2的高表达不仅与肿瘤细胞的增殖、侵袭和转移密切相关,还与细胞因子和趋化因子的表达变化密切关联。在肿瘤微环境中,Trop2的过表达可能通过激活特定信号通路(如MAPK/ERK和PI3K/AKT),诱导多种炎性细胞因子的分泌,包括IL-6、IL-8和TNF-α等。这些炎性细胞因子的升高可能促进肿瘤的生长、侵袭以及免疫逃逸[23-25]。相比其他研究中的实体瘤CAR-T疗法,本研究进一步验证了Trop2作为非小细胞肺癌治疗靶点的潜力。然而,尽管在实验中显示出良好效果,但其抗肿瘤机制仍需更深入地探索,包括对肿瘤微环境影响的研究。
本研究虽然初步证明了Trop2 CAR-T细胞在非小细胞肺癌中的治疗潜力,但仍存在一些局限性:①动物模型的局限性:所采用的异种移植模型并不能完全模拟人体肿瘤的微环境和免疫反应。未来需要构建更接近临床的自体或人源化小鼠模型。②安全性评估不足:虽然在本研究中未观察到明显毒性,但CAR-T细胞可能引起严重的副作用如细胞因子释放综合征,需进一步验证其安全性。③异质性问题:肿瘤组织中Trop2表达的异质性可能影响CAR-T细胞的治疗效果,需进一步探索如何优化CAR-T设计以应对这一挑战。
总之,本研究结果为治疗非小细胞肺癌提供了新思路和新方案,并为后期靶向实体瘤的CAR-T细胞产品研发及临床转化提供实验依据。未来研究应关注以下方向:①优化CAR设计:通过改进共刺激结构域或采用双靶点设计提高抗肿瘤效应和特异性。②探索联合疗法:结合免疫检查点抑制剂或其他疗法,以克服肿瘤微环境的免疫抑制作用。③临床前安全性验证:通过更全面的动物实验和体外毒性评估,确保疗法的临床转化安全性。④机制研究:深入探讨Trop2 CAR-T细胞抗肿瘤的分子机制,以及其与肿瘤微环境的相互作用。
* * *
作者贡献声明 温静负责论文构思和初稿写作,李鑫负责论文构思、研究方法、提供资源和审读与编辑写作。所有作者已经同意将文章提交给本刊,且对将要发表的版本进行最终定稿,并同意对工作的所有方面负责。
Author Contribution WEN Jing is responsible for conceptualization and writing--original draft. LI Xin is responsible for conceptualization, methodology, resources, and writing--review and editing. All authors consented to the submission of the article to the Journal. All authors approved the final version to be published and agreed to take responsibility for all aspects of the work.
利益冲突 所有作者均声明不存在利益冲突
Declaration of Conflicting Interests All authors declare no competing interests.
Funding Statement
川北医学院2020年度校级科研发展计划项目(No. CBY20-QA-Y35)资助
Contributor Information
静 温 (Jing WEN), Email: 352857958@qq.com.
鑫 李 (Xin LI), Email: 13438771519@163.com.
References
- 1.GLOBERSON L A, RIVIÈRE I, ESHHAR Z, et al CAR T cells: building on the CD19 paradigm. Eur J Immunol. 2021;51(9):2151–2163. doi: 10.1002/eji.202049064. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.CAPPELL K M, KOCHENDERFER J N Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 2023;20(6):359–371. doi: 10.1038/s41571-023-00754-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.SHI M, WANG J, HUANG H, et al Bispecific CAR T cell therapy targeting BCMA and CD19 in relapsed/refractory multiple myeloma: a phase Ⅰ/Ⅱ trial. Nat Commun. 2024;15(1):3371. doi: 10.1038/s41467-024-47801-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.FLUGEL C L, MAJZNER R G, KRENCIUTE G, et al Overcoming on-target, off-tumour toxicity of CAR T cell therapy for solid tumours. Nat Rev Clin Oncol. 2023;20(1):49–62. doi: 10.1038/s41571-022-00704-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.MAALEJ K M, MERHI M, INCHAKALODY V P, et al CAR-cell therapy in the era of solid tumor treatment: current challenges and emerging therapeutic advances. Mol Cancer. 2023;22(1):20. doi: 10.1186/s12943-023-01723-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.ZHANG K, CHEN H, LI F, et al Bright future or blind alley? CAR-T cell therapy for solid tumors. Front Immunol. 2023;14:1045024. doi: 10.3389/fimmu.2023.1045024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.LIU S, ZHANG Y Challenges and interventions of chimeric antigen receptor-T cell therapy in solid tumors. Chin J Cancer Res. 2023;35(3):239–244. doi: 10.21147/j.issn.1000-9604.2023.03.03. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.ALAGOZ M, KHERAD N Advance genome editing technologies in the treatment of human diseases: CRISPR therapy (Review) Int J Mol Med. 2020;46(2):521–534. doi: 10.3892/ijmm.2020.4609. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.KUSHIYAMA S, YASHIRO M, YAMAMOTO Y, et al Clinicopathologic significance of TROP2 and phospho-TROP2 in gastric cancer. Mol Clin Oncol. 2021;14(5):105. doi: 10.3892/mco.2021.2267. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.ZHENG W P, HUANG F Y, DAI S Z, et al Toxicarioside O inhibits cell proliferation and epithelial-mesenchymal transition by downregulation of Trop2 in lung cancer cells. Front Oncol. 2020;10:609275. doi: 10.3389/fonc.2020.609275. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.MOGHBELI M PI3K/AKT pathway as a pivotal regulator of epithelial-mesenchymal transition in lung tumor cells. Cancer Cell Int. 2024;24(1):165. doi: 10.1186/s12935-024-03357-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.WEN Y, OUYANG D, ZOU Q, et al A literature review of the promising future of TROP2: a potential drug therapy target. Ann Transl Med. 2022;10(24):1403. doi: 10.21037/atm-22-5976. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.BATHULA N V, BOMMADEVARA H, HAYES J M Nanobodies: the future of antibody-based immune therapeutics. Cancer Biother Radiopharm. 2021;36(2):109–122. doi: 10.1089/cbr.2020.3941. [DOI] [PubMed] [Google Scholar]
- 14.DENG Y, SHENG Y, ZHANG G, et al A novel strategy for an anti-idiotype vaccine: nanobody mimicking neutralization epitope of porcine circovirus type 2. J Virol. 2024;98(2):e0165023. doi: 10.1128/jvi.01650-23. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.SUN S, DING Z, YANG X, et al Nanobody: a small antibody with big implications for tumor therapeutic strategy. Int J Nanomedicine. 2021;16:2337–2356. doi: 10.2147/ijn.S297631. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.RAJE N, BERDEJA J, LIN Y, et al Anti-BCMA CAR T-cell therapy bb2121 in relapsed or refractory multiple myeloma. N Engl J Med. 2019;380(18):1726–1737. doi: 10.1056/NEJMoa1817226. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.CHEN P H, LIPSCHITZ M, WEIRATHER J L, et al Activation of CAR and non-CAR T cells within the tumor microenvironment following CAR T cell therapy. JCI Insight. 2020;5(12):e134612. doi: 10.1172/jci.insight.134612. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.PAN K, FARRUKH H, CHITTEPU V, et al CAR race to cancer immunotherapy: from CAR T, CAR NK to CAR macrophage therapy. J Exp Clin Cancer Res. 2022;41(1):119. doi: 10.1186/s13046-022-02327-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.DONG Y, WAN Z, GAO X, et al Reprogramming immune cells for enhanced cancer immunotherapy: targets and strategies. Front Immunol. 2021;12:609762. doi: 10.3389/fimmu.2021.609762. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.LI H, ZHONG D, LUO H, et al Nanobody-based CAR T cells targeting intracellular tumor antigens. Biomed Pharmacother. 2022;156:113919. doi: 10.1016/j.biopha.2022.113919. [DOI] [PubMed] [Google Scholar]
- 21.De MUNTER S, INGELS J, GOETGELUK G, et al Nanobody based dual specific CARs. Int J Mol Sci. 2018;19(2):403. doi: 10.3390/ijms19020403. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.XIE Y J, DOUGAN M, JAILKHANI N, et al Nanobody-based CAR T cells that target the tumor microenvironment inhibit the growth of solid tumors in immunocompetent mice. Proc Natl Acad Sci U S A. 2019;116(16):7624–7631. doi: 10.1073/pnas.1817147116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.LIU X, MA L, LI J, et al Trop2-targeted therapies in solid tumors: advances and future directions. Theranostics. 2024;14(9):3674–3692. doi: 10.7150/thno.98178. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.LENÁRT S, LENÁRT P, ŠMARDA J, et al Trop2: Jack of all trades, master of none. Cancers (Basel) 2020;12(11):3328. doi: 10.3390/cancers12113328. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.LIU X, DENG J, YUAN Y, et al Advances in Trop2-targeted therapy: novel agents and opportunities beyond breast cancer. Pharmacol Ther. 2022;239:108296. doi: 10.1016/j.pharmthera.2022.108296. [DOI] [PubMed] [Google Scholar]



