Abstract
目的
观察自体富血小板血浆(PRP)联合Meek微型皮片修复严重烧伤患者四肢创面的效果,并探讨其机制。
方法
采用前瞻性对照研究方法。解放军联勤保障部队第909医院烧伤整形科2016年9月—2020年1月收治16例符合入选标准的大面积深度烧伤患者(男9例、女7例,年龄18~69岁)。8例患者两侧患肢损伤程度相近,按随机数字表法将患肢分为Meek植皮+PRP组和单纯Meek植皮组;将另8例患者损伤较重一侧患肢纳入Meek植皮+PRP组,另一侧患肢纳入单纯Meek植皮组。2组患肢创面进行相应治疗。术后10 d,观察Meek微型皮片成活和融合情况,并计算皮片成活率和融合率,苏木精-伊红染色观察Meek微型皮片基底组织形态,免疫组织化学染色观察Meek微型皮片基底组织微血管增生情况并计数。对数据进行配对样本t检验。
结果
术后10 d,Meek植皮+PRP组患肢创面较干燥,绝大部分Meek微型皮片与基底贴合牢固;单纯Meek植皮组患肢创面可见少量分泌物,小部分Meek微型皮片脱落或与基底贴合不牢固。术后10 d,Meek植皮+PRP组患肢创面皮片成活率、融合率分别为(94±3)%、(86±4)%,明显高于单纯Meek植皮组的(89±4)%、(79±4)%(t=3.633、4.229,P < 0.01)。术后10 d,Meek植皮+PRP组患肢创面Meek微型皮片基底表皮与真皮连接紧密,有较多炎症细胞浸润,微血管增生活跃;单纯Meek植皮组患肢创面Meek微型皮片基底表皮与真皮连接欠紧密,真皮层下胶原纤维变性明显,炎症细胞浸润较少,微血管增生情况欠佳。术后10 d,Meek植皮+PRP组患肢创面Meek微型皮片基底组织微血管呈簇状密集分布,单纯Meek植皮组患肢创面皮片基底组织微血管呈散在、稀疏、点状分布;Meek植皮+PRP组患肢创面Meek微型皮片基底每400倍视野下的微血管数为(36±6)条,明显多于单纯Meek植皮组的(29±7)条(t=2.671,P < 0.05)。
结论
自体PRP可能通过促进皮片基底微血管新生,提高严重烧伤患者四肢创面削痂后移植的Meek微型皮片的成活率和融合率。
Keywords: 烧伤, 富血小板血浆, Meek微型皮片
Abstract
Objective
To observe the effect of autologous platelet-rich plasma (PRP) combined with Meek microskin grafts in repairing the wounds of limbs in severely burned patients, and to explore the mechanism.
Methods
The prospective controlled research method was used. From September 2016 to January 2020, 16 patients aged 18-69 years, with extensive deep burns, including 9 males and 7 females, who met the selection criteria were admitted to the Department of Burns and Plastic Surgery of the 909th Hospital of the Joint Logistic Support Force of PLA. The bilateral limbs with similar injury in 8 patients were divided into Meek skin grafting+PRP group and Meek skin grafting alone group according to the random number table; in the other 8 patients, the limbs with severer injury were included in Meek skin grafting+PRP group, and the limbs on the other side were included in Meek skin grafting alone group. The wounds of affected limbs in the two groups were treated correspondingly. On post surgery day (PSD) 10, the survival and fusion of Meek microskin grafts were observed and the survival rate and fusion rate were calculated; the histological morphology and the angiogenesis of the basal tissue of Meek microskin graft were observed by hematoxylin-eosin staining and immunohistochemical staining, respectively, with the microvessels being counted. Data were statistically analyzed with paired sample t test.
Results
On PSD 10, the wounds of affected limbs in Meek skin grafting+PRP group were dry, and most of the transplanted skin grafts were closely adhered to the basal tissue; while a small amount of exudate could be found in the wounds of affected limbs in Meek skin grafting alone group, and a small part of the transplanted microskin grafts fell off or poorly attached to the basal tissue. On PSD 10, the survival rate and the fusion rate of Meek microskin grafts in the wounds of affected limbs in Meek skin grafting+PRP group were (94±3)% and (86±4)%, which were significantly higher than (89±4)% and (79±4)% of Meek skin grafting alone group, respectively (t=3.633, 4.229, P < 0.01). On PSD 10, the basal epidermis was closely connected with dermis of Meek microskin grafts in the wounds of affected limbs in Meek skin grafting+PRP group, with more inflammatory cell infiltration and active microvascular hyperplasia, while the basal epidermis was less closely connected with dermis of Meek microskin grafts in the wounds of affected limbs in Meek skin grafting alone group, with obvious degeneration of collagen fibers under the dermis, less inflammatory cell infiltration, and slightly poor microvascular hyperplasia. On PSD 10, the distribution of microvessels in basal tissue of Meek microskin grafts in the wounds of affected limbs in Meek skin grafting+PRP group were densely clustered, while the distribution of microvessels in Meek skin grafting alone group were scattered, sparse, and dotted. On PSD 10, the number of microvessels in basal tissue of Meek microskin grafts in the wounds of affected limbs in Meek skin grafting+PRP group was 36±6 in each 400-fold visual field, which was significantly more than 29±7 of Meek skin grafting alone group (t=2.671, P < 0.05).
Conclusions
Autologous PRP can effectively promote the survival rate and fusion rate of Meek microskin grafts in the wounds of limbs after escharectomy in severely burned patients by promoting angiogenesis at the base of Meek microskin grafts.
Keywords: Burns, Platelet-rich plasma, Meek microskin grafts
Meek微型皮片移植术是近年来在国内临床应用的皮肤移植技术[1],大面积深度烧伤患者Meek微型皮片移植术后的预后情况与烧伤严重程度和移植皮片成活率有关[2]。皮片成活需要经过局部血管再生及建立血液循环,VEGF是促进血管生成的有效生长因子,在体内外均能直接促进血管新生。
富血小板血浆(PRP)是第1代血小板浓缩物,是将全血经过离心后得到的富含血小板的血浆。PRP中所含的血小板经过激活后可以释放包括VEGF等在内的多种生长因子,对创面修复有多重作用,不仅可以促进创面愈合,并且能够提高创面愈合质量[3]。
本研究团队的前期研究表明,自体PRP可以促进全层皮肤缺损猪移植皮片的生长,该作用的机制可能与PRP激活,诱导VEGF释放,促进皮片基底血管新生有关;此外,PRP在促进随意皮瓣、游离皮瓣成活等方面也具有显著效果[4-7]。在前期研究的基础上,本研究旨在观察自体PRP对严重烧伤患者四肢创面削痂后移植Meek微型皮片成活和融合的影响,并探讨其可能的机制。
1. 资料与方法
本前瞻性对照研究经解放军联勤保障部队第909医院(厦门大学附属东南医院)伦理委员会批准,批号:2016-010-01。
1.1. 主要试剂与仪器来源
Meek植皮机及配套耗材购自上海贵群经贸有限公司,电动取皮机购自美国捷迈公司,HEAEUS CRYOFUHE 6000i型低温大容量离心机购自北京东迅天地医疗仪器有限公司,NGL-XCF-3000型血液成分分离机购自上海伊沐医疗器械有限公司,IXUS210型数码相机购自日本佳能公司,WI93961型医学图像分析系统购自北京北瑞达医药科技有限公司,DM4B型生物显微镜购自德国徕卡公司。即用型鼠抗人CD34单克隆抗体、即用型辣根过氧化物酶标记的山羊抗鼠IgG多克隆抗体均购自福州迈新生物技术开发有限公司。
1.2. 入选标准
纳入标准:年龄≥18岁,性别不限,烧伤总面积≥30%TBSA,四肢对称部位深Ⅱ~Ⅲ度烧伤,致伤原因为火焰或热液烧伤,伤后1 d内入院,伤后4~8 d有手术适应证。排除标准:中重度贫血患者。
1.3. PRP制备方法
行Meek微型皮片移植术前1 d,行全血细胞分析检查,进行血小板计数后,采集300~400 mL全血,选择以下2种方法中的1种制备PRP:(1)二次离心法。采用大容量离心机进行离心,第1次以500×g离心5 min,收集上、中层以及紧邻中层的部分下层液体;第2次以4 650×g离心6 min,收集下1/4部分液体,即为PRP(30~40 mL)。对PRP中血小板进行计数后,放置于血小板振荡仪中,于22 ℃下水平振荡保存备用。制备过程中剩余的红细胞和血浆转移到其他转移袋中,添加保存液,悬浮红细胞并放置于4 ℃冰箱保存,将血浆制备成冰冻血浆放置于-22 ℃冰箱保存,在需要的时候进行回输。(2)血液成分分离机制备法(一次离心法)。使用血液成分分离机专用PRP采集耗材和血液成分分离机一次离心制备PRP,离心速度为2 100×g,使血液分层,自动提取PRP,将剩余的血液成分通过管路回输到患者体内。一个循环可分离出30~40 mL PRP。2种方法制备的PRP血小板计数均为全血中血小板计数的4倍以上,符合PRP中对血小板计数的要求[8]。
1.4. 临床资料与分组及治疗方法
解放军联勤保障部队第909医院烧伤整形科2016年9月—2020年1月收治16例符合入选标准的大面积深度烧伤患者,其中男9例、女7例;年龄18~69岁,平均46岁。由解放军联勤保障部队第909医院烧伤整形科3名高级职称医师按中华医学会烧伤外科学分会制订的“三度四分法”进行患肢损伤严重程度判定。8例患者两侧患肢损伤程度相近,按随机数字表法将患肢分为Meek植皮+PRP组和单纯Meek植皮组;于另8例患者中,将损伤较重的一侧患肢纳入Meek植皮+PRP组,另一侧患肢纳入单纯Meek植皮组。伤后4~8 d,患者平稳度过休克期,生命体征稳定后进行Meek微型皮片移植术。手术在全身麻醉下进行,四肢功能部位创面尽量取自体躯干或大腿大张中厚皮或者全厚皮修复;其余创面采用自体头部、四肢或躯干刃厚皮,制成Meek微型皮片修复,Meek微型皮片扩展比例为1∶4或1∶6,2组患肢创面采用的Meek微型皮片扩展比例相同。Meek植皮+PRP组患肢创面削痂后,用一次性注射器抽取制备好的自体PRP均匀喷涂于创面基底,每1%体表总面积创面喷涂5 mL PRP,PRP喷涂后立即行Meek微型皮片移植;单纯Meek植皮组患肢创面削痂后行Meek微型皮片移植。术后5 d换药,逐层去除外层敷料,避免微型皮片搓动脱落。若双绉纱与创面贴附良好,下方无积液、积血现象,予保留双绉纱,用纳米银抗菌功能性敷料覆盖,无菌敷料包扎;若双绉纱下有积液、积血现象,则剪除局部双绉纱,适当引流后,用纳米银抗菌功能性敷料覆盖,无菌敷料包扎。术后10 d再次换药,去除术区敷料及双绉纱。术后2~4周,7例患者再次行邮票皮移植修复患肢残余创面。
1.5. 观测指标
1.5.1. 皮片成活率
术后10 d,对2组患肢创面行Meek微型皮片移植区域进行拍照,采用医学图像分析系统统计成活皮片数和移植皮片总数,并计算皮片成活率。皮片与基底贴合牢固,颜色转红,提示皮片成活。皮片成活率=成活皮片数÷移植皮片总数×100%。
1.5.2. 皮片融合率
术后10 d,对2组患肢创面行Meek微型皮片移植区域进行拍照,采用医学图像分析系统分析已融合皮片面积和皮片覆盖总面积,并计算皮片融合率。已融合皮片面积为移植皮片成活、扩展、融合后已覆盖创面的面积,皮片覆盖总面积为术后即刻皮片覆盖的创面总面积。皮片融合率=已融合皮片面积÷皮片覆盖总面积×100%。
1.5.3. 皮片基底组织形态及微血管计数
术后10 d,在2组患肢创面行Meek微型皮片移植区域对称部位取0.5 cm×0.5 cm×0.5 cm皮片基底组织,用体积分数4%中性甲醛固定,常规脱水、透明、浸蜡后定向石蜡包埋,制作4 μm厚切片,行常规HE染色和EnVision法免疫组织化学染色。免疫组织化学中加入即用型鼠抗人CD34单克隆一抗,37 ℃孵育1 h。滴加即用型辣根过氧化物酶标记的山羊抗鼠IgG多克隆二抗,37 ℃孵育30 min。二氨基联苯胺显色,苏木精复染,分化、反蓝、脱水后用中性树胶封片。在100倍生物显微镜下观察皮片基底组织形态和CD34的阳性表达(以此反映微血管情况)。CD34阳性表达以血管内皮细胞呈棕色或棕黄色染色为标准,被染成棕黄色的单个内皮细胞或内皮细胞簇作为1条血管计数;结构不相连的血管,其分支结构也计为1条血管;排除有较厚的平滑肌及管腔直径 > 8个红细胞直径的血管。任意选取5个高倍镜(400倍)视野,分别计数微血管,结果取均值。
1.6. 统计学处理
采用SPSS 26.0统计软件对数据进行处理。所有数据均符合正态分布,以x±s表示,行配对样本t检验。P < 0.05为差异有统计学意义。
2. 结果
术后10 d,Meek植皮+PRP组患肢创面较干燥,绝大部分Meek微型皮片与基底贴合牢固,皮片成活率为(94±3)%;单纯Meek植皮组患肢创面可见少量分泌物,小部分皮片脱落或与基底贴合不牢固,皮片成活率为(89±4)%。术后10 d,Meek植皮+PRP组患肢创面Meek微型皮片成活率明显高于单纯Meek植皮组(t=3.633,P=0.002)。术后10 d,Meek植皮+PRP组患肢创面Meek微型皮片融合率为(86±4)%,明显高于单纯Meek植皮组的(79±4)%(t=4.229,P=0.001)。术后10 d,Meek植皮+PRP组患肢创面Meek微型皮片基底表皮与真皮连接紧密,有较多炎症细胞浸润,微血管增生活跃;单纯Meek植皮组患肢创面皮片基底表皮与真皮连接欠紧密,真皮层下胶原纤维变性明显,炎症细胞浸润较少,微血管增生情况欠佳。术后10 d,Meek植皮+PRP组患肢创面Meek微型皮片基底组织微血管呈簇状密集分布,单纯Meek植皮组患肢创面Meek微型皮片基底组织微血管呈散在、稀疏、点状分布。Meek植皮+PRP组患肢创面Meek微型皮片基底每400倍视野下微血管数为(36±6)条,明显多于单纯Meek植皮组的(29±7)条(t=2.671,P=0.017)。
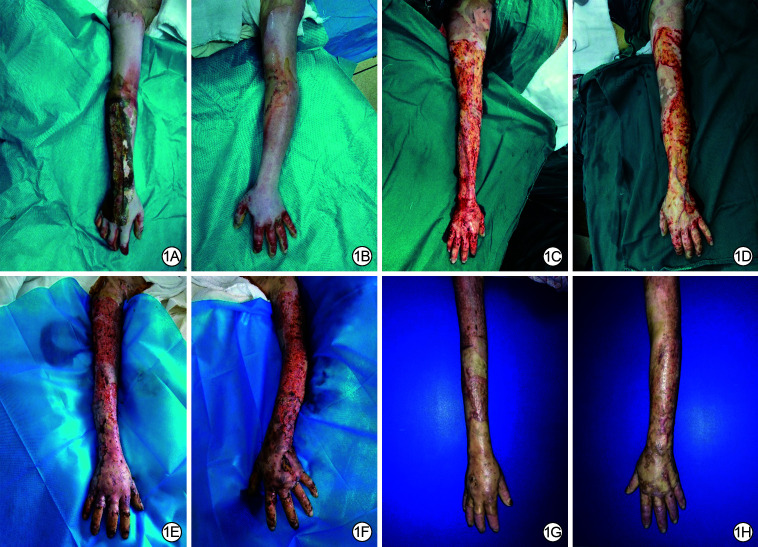
典型病例:患者女,54岁,2016年10月7日因全身多处火焰烧伤后肿痛伴口渴、咽痛1 h余入院,诊断为特重度烧伤,烧伤总面积71%TBSA;烧伤休克;吸入性损伤。入院后予急诊气管切开、焦痂切开减张,补液抗休克,创面清创,躯干、双下肢创面包扎,面颈部及双上肢创面暴露及抗感染、镇痛、维持内环境稳定、保护重要脏器功能、上悬浮床等治疗,病情好转后于2016年10月12日在全身麻醉下行双上肢创面削痂、皮片移植术。术前1 d在无菌条件下取患者自体全血400 mL(血小板计数132×109/L),采用二次离心法提取40 mL自体PRP(血小板计数890×109/L),其余血液制成红细胞悬液和血浆保存备用。术中将烧伤较严重的右上肢纳入Meek植皮+PRP组,左上肢纳入单纯Meek植皮组,将术前提取PRP后制成的自体红细胞悬液和血浆回输至患者体内。双侧患肢创面行削痂后,右上肢创面喷涂自体PRP,左上肢创面不喷涂PRP。双上臂和双前臂行刃厚头皮制作的Meek微型皮片移植,皮片扩展比例为1∶4;双手取腹部和左大腿大张自体皮片修复。术后5 d换药见双上肢术区双绉纱下无明显积血和分泌物,予保留双绉纱,外用纳米银抗菌功能性敷料、无菌敷料覆盖包扎。术后10 d换药,右上肢创面皮片成活率为96%、融合率为84%,高于左上肢的90%和80%。取双上臂对称部位Meek微型皮片外侧缘基底组织,同前进行HE染色见右上臂移植皮片基底微血管增生活跃;免疫组织化学染色见右上臂微血管呈密集分布,左上臂微血管呈散在分布,右上臂微血管数为41条,左上臂微血管数为24条。2016年11月4日,在全身麻醉下行头部邮票皮移植修复患肢残余创面。第1次术后1个月,患者双上肢创面均愈合良好。见图 1~3。
图 1.
Meek微型皮片移植+富血小板血浆(PRP)和单纯Meek植皮分别治疗严重烧伤患者右、左上肢创面。1A、1B.分别为术中右、左上肢,呈深度烧伤征象,右前臂和右手背行焦痂切开减张后;1C、1D.分别为右、左上肢削痂后,多深达断层脂肪层,右上肢部分达深筋膜浅层并喷涂PRP,左上肢部分达断层真皮层;1E、1F.分别为右、左上肢术后10 d创面愈合情况,右上肢创面愈合比左上肢好;1G、1H.分别为术后1个月右、左上肢,均愈合良好
图 3.
严重烧伤患者行Meek植皮+富血小板血浆治疗的右上臂和行单纯Meek植皮的左上臂创面术后10 d皮片基底组织微血管(棕色或棕黄色)情况 二氨基联苯胺-苏木精×100,图中标尺为200 μm。3A.右上臂微血管呈簇状密集分布;3B.左上臂微血管呈散在、稀疏、点状分布,数量明显少于图 3A
注:图中箭头示微血管

图 2.
严重烧伤患者行Meek植皮+富血小板血浆治疗的右上臂和行单纯Meek植皮的左上臂创面术后10 d皮片基底组织形态学观察 苏木精-伊红×100,图中标尺为100 μm。2A.右上臂皮片基底表皮与真皮连接紧密,较多炎症细胞浸润,微血管增生活跃;2B.左上臂表皮与真皮连接欠紧密,胶原纤维变性明显,可见真皮浅层少量微血管
注:红色箭头示表皮与真皮连接处,黑色箭头示微血管,绿色箭头示炎症细胞浸润,蓝色箭头示胶原纤维

3. 讨论
目前PRP主要用于口腔颌面外科、骨科、烧伤和难以愈合的创伤治疗、组织工程等领域[9-12],PRP应用于创面可提高创面愈合质量,缩短创面愈合时间[13-15]。PRP在临床上的应用已经十分广泛,但其联合皮片移植治疗创面的研究较少。PRP能在短时间内释放大量的生长因子,这些生长因子能够有效地促进微血管新生及细胞迁移、增殖,从而提高组织愈合和修复能力。
PRP制备简便[16-17],制备方法多种多样,目前尚未有统一的标准制备方案。由于PRP的质量会影响其临床应用效果[18-19],越来越多的学者通过调整制备方法,以提高血小板数量和质量[20-23]。临床要求行自体PRP移植的患者一般情况良好,能够耐受300~400 mL血液离体,血红蛋白 > 110 g/L,血小板计数 > 100×109/L。本研究团队2018年以前采用二次离心法制备PRP;2019年1月起,随着血液成分分离机专用PRP采集耗材的开发应用,临床开始应用血液成分分离机一次离心法制备PRP。二次离心法制作简便,但非同步回输剩余的红细胞和血浆,对患者血流动力学影响较大。血液成分分离机制备法需要专用的血液成分分离机,并使用配套的一次性耗材,对仪器和耗材的要求较高,但提取PRP后剩余的血液成分可同步回输,对患者血流动力学影响小。无论采用何种方法制备,均要严格进行无菌操作,规范保存PRP,尽量缩短使用前的储存时间,避免破坏血小板活性[24-25]。
PRP应用于组织修复中具有以下优势[26]:(1)来源于自身,避免免疫排斥和疾病传播。(2)能够快速、足量释放多种生长因子,且与人体自身生长因子成分比例一致,能有效促进组织修复。(3)提取PRP后的血液剩余成分可以同步或者制作成红细胞悬液及血浆后即刻安全回输到体内,也可以储存后在术中、术后回输,以保证患者血容量。(4)PRP也可以制备成PRP凝胶,从而持续释放生长因子[27],延长PRP的作用时间,减少术后换药次数。
Meek微型皮片移植术已在烧伤外科领域普遍应用[28-29],与传统邮票皮移植比较,Meek微型皮片面积小、皮片间隙大,且皮片间隙需要皮片成活、拓展后才能融合,移植皮片成活率相对较低,创面愈合时间较长,且更易出现创面感染,从而影响创面愈合[30]。但Meek微型皮片移植可减少供皮区面积,扩大移植皮片修复面积,从而在烧伤治疗领域得到广泛应用。针对影响Meek微型皮片成活的因素,很多学者开展了研究,希望通过控制感染、加强营养、局部应用生长因子等方法提高皮片成活率,更好救治大面积烧伤患者[31-33]。
基于目前Meek微型皮片移植术的现状以及PRP的特性,本研究团队在动物实验研究的基础上,将PRP联合Meek微型皮片用于修复重度烧伤患者四肢创面,旨在提高Meek微型皮片的成活率和融合率,改善大面积深度烧伤患者的预后。本研究结果表明,术后10 d Meek植皮+PRP组患肢创面皮片成活率和融合率均明显高于单纯Meek植皮组,皮片基底炎症细胞和微血管数量明显多于单纯Meek植皮组,提示PRP可通过促进皮片基底微血管增生,使Meek微型皮片快速微血管化,促进移植皮片的成活,并提高皮片融合率。皮片移植后皮片下积血和感染情况也是影响皮片成活的关键因素,PRP不但能通过纤维蛋白原参与止血的过程,而且还能介导创面的炎症反应,抵抗病原菌的入侵,降低创面的感染风险,促进其融合,而皮片基底炎症细胞的聚集增多,可能与局部炎症反应增强有关,同时也不能排除局部感染的可能。
综上所述,自体PRP可提高四肢烧伤创面削痂后Meek微型皮片的成活率和融合率,其机制可能与PRP促进创面微血管增生、降低感染风险等相关。PRP中含有的各种生长因子可能在微型皮片建立血运及扩展生长过程中发挥积极的作用,但是究竟哪些生长因子发挥主导作用,以及PRP的最佳作用剂量和作用方式,仍有待深入研究。另外,目前第2代血小板浓缩物,即富血小板纤维蛋白也受到越来越多的关注[34-35]。相信随着研究的进一步深入,血小板浓缩物在临床上会有越来越广阔的应用前景。
Funding Statement
南京军区医学科技创新课题(11MA079);福建省自然科学基金(2019J01143)
Medical Science and Technology Innovation Project of Nanjing Military Region of China (11MA079); Natural Science Foundation of Fujian Province of China (2019J01143)
Footnotes
利益冲突 所有作者均声明不存在利益冲突
References
- 1.中华医学会烧伤外科学分会MEEK植皮技术中心协作组, 海军军医大学第一附属医院烧伤外科, 全军烧伤研究所. MEEK微型皮片移植技术临床操作规范[J/CD]. 中华损伤与修复杂志: 电子版, 2019, 14(4): 311-313. DOI: 10.3877/cma.j.issn.1673-9450.2019.04.015.
- 2.林 陆添. 影响Meek植皮术治疗大面积深度烧伤疗效的多因素分析. 中国现代手术学杂志. 2018;22(6):454–457. doi: 10.16260/j.cnki.1009-2188.2018.06.011. [DOI] [Google Scholar]
- 3.Fernandez-Moure JS, Van Eps JL, Cabrera FJ, et al. Platelet-rich plasma: a biomimetic approach to enhancement of surgical wound healing. J Surg Res. 2017;207:33–44. doi: 10.1016/j.jss.2016.08.063. [DOI] [PubMed] [Google Scholar]
- 4.郑 健生, 胡 君玲, 陈 文, et al. 富血小板血浆对猪自体移植皮片成活和生长的影响. 中华烧伤杂志. 2016;32(2):112–116. doi: 10.3760/cma.j.issn.1009-2587.2016.02.011. [DOI] [Google Scholar]
- 5.Wang B, Geng Q, Hu J, et al. Platelet-rich plasma reduces skin flap inflammatory cells infiltration and improves survival rates through induction of angiogenesis: an experiment in rabbits. J Plast Surg Hand Surg. 2016;50(4):239–245. doi: 10.3109/2000656X.2016.1159216. [DOI] [PubMed] [Google Scholar]
- 6.郑 健生, 王 彪, 耿 秋华, et al. 富血小板血浆局部应用对皮瓣成活的影响. 中华医学美学美容杂志. 2017;23(2):129–132. doi: 10.3760/cma.j.issn.1671-0290.2017.02.017. [DOI] [Google Scholar]
- 7.李 洋, 郑 健生, 王 彪, et al. 自体富血小板血浆对游离皮瓣修复兔软组织缺损的影响. 中华烧伤杂志. 2019;35(9):683–689. doi: 10.3760/cma.j.issn.1009-2587.2019.09.007. [DOI] [PubMed] [Google Scholar]
- 8.Eppley BL, Pietrzak WS, Blanton M. Platelet-rich plasma: a review of biology and applications in plastic surgery. Plast Reconstr Surg. 2006;118(6):147e–159e. doi: 10.1097/01.prs.0000239606.92676.cf. [DOI] [PubMed] [Google Scholar]
- 9.Lubkowska A, Dolegowska B, Banfi G. Growth factor content in PRP and their applicability in medicine. J Biol Regul Homeost Agents. 2012;26(2 Suppl 1):S3–22. [PubMed] [Google Scholar]
- 10.Chen L, Ding Y, Cheng G, et al. Use of platelet-rich fibrin in the treatment of periodontal intrabony defects: a systematic review and meta-analysis. Biomed Res Int. 2021;2021:6669168. doi: 10.1155/2021/6669168. [DOI] [PMC free article] [PubMed] [Google Scholar] [Retracted]
- 11.Alsousou J, Thompson M, Hulley P, et al. The biology of platelet-rich plasma and its application in trauma and orthopaedic surgery: a review of the literature. J Bone Joint Surg Br. 2009;91(8):987–996. doi: 10.1302/0301-620X.91B8.22546. [DOI] [PubMed] [Google Scholar]
- 12.Knighton DR, Ciresi KF, Fiegel VD, et al. Classification and treatment of chronic nonhealing wounds. Successful treatment with autologous platelet-derived wound healing factors (PDWHF) Ann Surg. 1986;204(3):322–330. doi: 10.1097/00000658-198609000-00011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Emer J. Platelet-rich plasma (PRP): current applications in dermatology. Skin Therapy Lett. 2019;24(5):1–6. [PubMed] [Google Scholar]
- 14.Everts P, Onishi K, Jayaram P, et al. Platelet-rich plasma: new performance understandings and therapeutic considerations in 2020. Int J Mol Sci. 2020;21(20):7794. doi: 10.3390/ijms21207794. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Peng GL. Platelet-rich plasma for skin rejuvenation: facts, fiction, and pearls for practice. Facial Plast Surg Clin North Am. 2019;27(3):405–411. doi: 10.1016/j.fsc.2019.04.006. [DOI] [PubMed] [Google Scholar]
- 16.Croisé B, Paré A, Joly A, et al. Optimized centrifugation preparation of the platelet rich plasma: literature review. J Stomatol Oral Maxillofac Surg. 2020;121(2):150–154. doi: 10.1016/j.jormas.2019.07.001. [DOI] [PubMed] [Google Scholar]
- 17.Gentile P, Calabrese C, De Angelis B, et al. Impact of the different preparation methods to obtain autologous non-activated platelet-rich plasma (A-PRP) and activated platelet-rich plasma (AA-PRP) in plastic surgery: wound healing and hair regrowth evaluation. Int J Mol Sci. 2020;21(2):431. doi: 10.3390/ijms21020431. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Kesy L, Kopczyński P, Baszczuk A, et al. Methods of preparation of the platelet-rich plasma used in medicine as an accelerator of tissue regeneration. Pol Merkur Lekarski. 2014;36(214):283–286. [PubMed] [Google Scholar]
- 19.Davis VL, Abukabda AB, Radio NM, et al. Platelet-rich preparations to improve healing. Part Ⅱ : platelet activation and enrichment, leukocyte inclusion, and other selection criteria. J Oral Implantol. 2014;40(4):511–521. doi: 10.1563/AAID-JOI-D-12-00106. [DOI] [PubMed] [Google Scholar]
- 20.Amable PR, Carias RB, Teixeira MV, et al. Platelet-rich plasma preparation for regenerative medicine: optimization and quantification of cytokines and growth factors. Stem Cell Res Ther. 2013;4(3):67. doi: 10.1186/scrt218. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Giraldo CE, Álvarez ME, Carmona JU. Effects of sodium citrate and acid citrate dextrose solutions on cell counts and growth factor release from equine pure-platelet rich plasma and pure-platelet rich gel. BMC Vet Res. 2015;11:60. doi: 10.1186/s12917-015-0370-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Fukuda K, Kuwano A, Kuroda T, et al. Optimal double-spin method for maximizing the concentration of platelets in equine platelet-rich plasma. J Equine Sci. 2020;31(4):105–111. doi: 10.1294/jes.31.105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Ozer K, Kankaya Y, Colak O, et al. The impact of duration and force of centrifugation on platelet content and mass in the preparation of platelet-rich plasma. Aesthetic Plast Surg. 2019;43(4):1078–1084. doi: 10.1007/s00266-019-01375-9. [DOI] [PubMed] [Google Scholar]
- 24.Niu W, Wang P, Ge S, et al. Effects of platelet concentrates used in alveolar ridge preservation: a systematic review. Implant Dent. 2018;27(4):498–506. doi: 10.1097/ID.0000000000000797. [DOI] [PubMed] [Google Scholar]
- 25.van der Meer PF. PAS or plasma for storage of platelets? A concise review. Transfus Med. 2016;26(5):339–342. doi: 10.1111/tme.12325. [DOI] [PubMed] [Google Scholar]
- 26.Xu P, Wu Y, Zhou L, et al. Platelet-rich plasma accelerates skin wound healing by promoting re-epithelialization[J/OL]. Burns Trauma, 2020, 8: tkaa028[2021-07-01]. https://pubmed.ncbi.nlm.nih.gov/32821743/. DOI: 10.1093/burnst/tkaa028.
- 27.Kazakos K, Lyras DN, Verettas D, et al. The use of autologous PRP gel as an aid in the management of acute trauma wounds. Injury. 2009;40(8):801–805. doi: 10.1016/j.injury.2008.05.002. [DOI] [PubMed] [Google Scholar]
- 28.Quintero EC, Machado JFE, Robles RAD. Meek micrografting history, indications, technique, physiology and experience: a review article. J Wound Care. 2018;27(Suppl 2):S12–18. doi: 10.12968/jowc.2018.27.Sup2.S12. [DOI] [PubMed] [Google Scholar]
- 29.Klosová H, Němečková Crkvenjaš Z, Štětinský J. MEEK micrografting technique and its use in the treatment of severe burn injuries at the University Hospital Ostrava Burn Center. Acta Chir Plast. 2017;59(1):11–17. [PubMed] [Google Scholar]
- 30.栗 申, 郭 素娟. 邮票皮、meek微型皮与微粒皮三种植皮方式在修复大面积皮肤缺损创面中的疗效对比研究. 四川解剖学杂志. 2018;26(2):81–83. doi: 10.3969/j.issn.1005-1457.2018.02.030. [DOI] [Google Scholar]
- 31.张 鹏, 原 莉莉, 罗 佳, et al. 严重烧伤患者Meek植皮术后皮片存活情况的影响因素及其预测价值. 中华烧伤杂志. 2021;37(3):243–249. doi: 10.3760/cma.j.cn501120-20201127-00503. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Rode H, Martinez R, Potgieter D, et al. Experience and outcomes of micrografting for major paediatric burns. Burns. 2017;43(5):1103–1110. doi: 10.1016/j.burns.2017.02.008. [DOI] [PubMed] [Google Scholar]
- 33.李 兴照, 蔡 晨, 徐 庆连, et al. 重度烧伤患儿Meek微型皮片移植失败的原因及治疗措施. 中华烧伤杂志. 2019;35(7):525–531. doi: 10.3760/cma.j.issn.1009-2587.2019.07.009. [DOI] [PubMed] [Google Scholar]
- 34.Choukroun J, Diss A, Simonpieri A, et al. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part Ⅳ: clinical effects on tissue healing. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006;101(3):e56–60. doi: 10.1016/j.tripleo.2005.07.011. [DOI] [PubMed] [Google Scholar]
- 35.Ozer K, Colak O. Leucocyte- and platelet-rich fibrin as a rescue therapy for small-to-medium-sized complex wounds of the lower extremities[J/OL]. Burns Trauma, 2019, 7: 11[2020-04-27]. https://pubmed.ncbi.nlm.nih.gov/31080838/. DOI: 10.1186/s41038-019-0149-0.