RESUME
Introduction: La pneumonie lipidique est une affection rare de l’adulte dont la fréquence augmente avec l’âge. La pneumonie lipidique exogène résulte de la pénétration, le plus souvent par inhalation, dans le parenchyme pulmonaire, de substances huileuses. Objectif: Étudier les présentations clinico-radiologiques des pneumonies lipidiques exogènes et préciser les stratégies thérapeutiques.Méthodes: Nous avons procédé à une étude monocentrique, rétrospective d’observations de patients suivis dans le service de Pneumologie du CHU Hédi Chaker de Sfax durant la période entre 2004 et 2023. Le diagnostic de pneumonie lipidique exogène a été confirmée par un lavage broncho-alvéolaire avec coloration OilRed O positive ou par la présence des histiocytes spumeux chargés de lipides à l’examen anatomopathologique.Résultats: Nous avons colligé 9 dossiers de patients d’âge moyen de 46 ans. La dyspnée et la toux ont été les symptômes révélateurs les plus fréquents. La tomodensitométrie thoracique a objectivé des images en verre dépoli dans 5 cas, des condensations parenchymateuses dans 3 cas et un crazy paving dans 3 cas. Les facteurs favorisants ont été l’exposition professionnelle à un lipide dans 5 cas et la consommation d’un produit lipidique dans 4 cas. Un reclassement professionnel et une déclaration de maladie professionnelle a été préconisée pour 4 patients Une corticothérapie systémique a été indiquée chez 6 patients. Conclusion: La pneumonie lipidique exogène constitue une entité nosologique de rencontre rare. Ce travail met en lumière le diagnostic difficile en raison d’une présentation clinico-radiologique parfois trompeuse en l’absence d’exposition évoquée d’emblée.
ABSTRACT
Introduction: Lipoid pneumonia is a rare disease affecting adults’ which frequency increases with age. Exogenous lipoid pneumonia results from the penetration, usually by inhalation, of oily substances into the pulmonary parenchyma. Aim: To study the clinical and radiological features of exogenous lipoid pneumonia and to define therapeutic strategies. Methods: We performed a monocentric, retrospective study of patients followed in the Pneumology Department of the Hedi Chaker Hospital in Sfax between 2004 and 2023. The diagnosis of exogenous lipoid pneumonia was confirmed by bronchoalveolar lavage with positive Oil Red O staining or by biopsy with anatomopathological examination showing lipid-laden foamy histiocytes. Results: During this period, we collected nine patients with an average age of 46. Dyspnea and cough were the most frequent symptoms. Chest computed tomography revealed ground-glass opacity in five cases, parenchymal condensations in three cases and crazy paving in three cases. The frequent risk factors were occupational exposure to a lipid in five cases and consumption of a lipid product in four cases. In terms of treatment, four patients underwent occupational reclassification and a declaration of occupational disease. Systemic corticotherapy was indicated in six patients. Conclusion: Exogenous lipoid pneumonia is a rare entity. This study highlights the difficulty of making a diagnosis, due to misleading clinico-radiological presentation in the absence of exposure.
Introduction
La pneumonie lipidique est une affection rare de l’adulte dont la fréquence augmente avec l’âge.
Elle résulte d'une accumulation pulmonaire de lipides dans les alvéoles.
Ces composés graisseux peuvent être d'origine animale, végétale ou minérale (1).
La pneumonie lipidique exogène (PLE) résulte de la pénétration, par inhalation le plus souvent, dans le parenchyme pulmonaire, de substances huileuses qui s’accumulent dans les alvéoles et l’interstitium pulmonaire, à l’état libre ou incluses dans des macrophages et qui déterminent des réactions tissulaires variables en fonction des lipides en cause(2).
Elle peut être sous-diagnostiquée car confondue avec d'autres altérations comme la pneumonie bactérienne, une tumeur pulmonaire, une tuberculose ou une pneumonie organisée (3) vu sa présentation non spécifique et l’absence d’exposition évoquée d’emblée.
Les résultats radiologiques pulmonaires de la pneumonie lipidique exogène ne sont pas spécifiques et varient selon les patients (4).
Le diagnostic repose sur les données anatomopathologiques.
Actuellement, il n'existe pas de recommandations spécifiques pour le traitement de cette maladie.
C’est dans le cadre de rares études sur cette pathologie que s’inscrit ce travail qui a pour objectifs d’étudier les présentations clinico-radiologiques des pneumonies lipidiques et de préciser leurs stratégies thérapeutiques.
Méthodes
Il s’agit d’une étude monocentrique, rétrospective menée auprès des patients diagnostiqués avec une PLE suivi au service de pneumologie à l’hôpital Hédi Chaker Sfax, Tunisie sur une période s’étalant sur 19 ans de 2004 à 2023.
Les critères d’inclusion étaient les patients ayant un lavage broncho-alvéolaire (LBA) avec coloration Oil Red O (ORO) positive ou ayant une biopsie avec un examen anatomopathologique montrant des histiocytes spumeux chargés de lipides.
Nous avons recueilli les données sociodémographiques(le sexe, l’âge, les antécédents personnels médicauxet chirurgicaux, le tabagisme en paquet/année, la profession, une exposition particulière), les données cliniques (les signes fonctionnels initiaux, les données de l’examen clinique), les aspects scannographiques, le moyen de confirmation qu’il peut s’agir d’une fibroscopie bronchique avec LBA et biopsies étagées ou d’une biopsie transpariétale sous scanner ou d’une biopsie pulmonaire sur pièce opératoire ainsi que les résultats de l’examen anatomopathologique.
La coloration ORO permet d'identifier les macrophages chargés de lipides(5).
L’ORO est un colorant liposoluble pour la coloration des triglycérides et des lipides neutres dans les coupes de tissus congelés ou les lames cytologiques non fixées(6).
Nous avons précisé les principes de prise en charge thérapeutique.
Résultats
Nous avons inclus dans notre travail 9 cas dont 4 femmes et 5 hommes.
L’âge moyen était de 46 ans, avec des extrêmes allant de 17 ans à 66 ans.
Six cas étaient non tabagiques, 2 tabagiques sevrés et un patient tabagique actif.
L’exposition professionnelle était notée chez 5 patients (2 patients travaillaient en tant que mécanicien de voitures, un mécanicien d’avion militaire, un technicien dans une société pétrolière, un dans une usine de fabrication d’huile d’olive associée à une consommation d’un produit lipidique pour un reflux gastro-oesophagien), trois patients avaient comme facteur favorisant une consommation de produits lipidiques et un patient avait une exposition accidentelle.
La dyspnée et la toux étaient les symptômes de consultation dans 7 cas, la douleur thoracique dans un cas, l’hémoptysie dans un cas, la fièvre dans un cas et des expectorations dans un cas.
L’examen clinique était strictement normal dans 4 cas, des râles crépitants à l’auscultation pulmonaire étaient présents dans 5 cas.
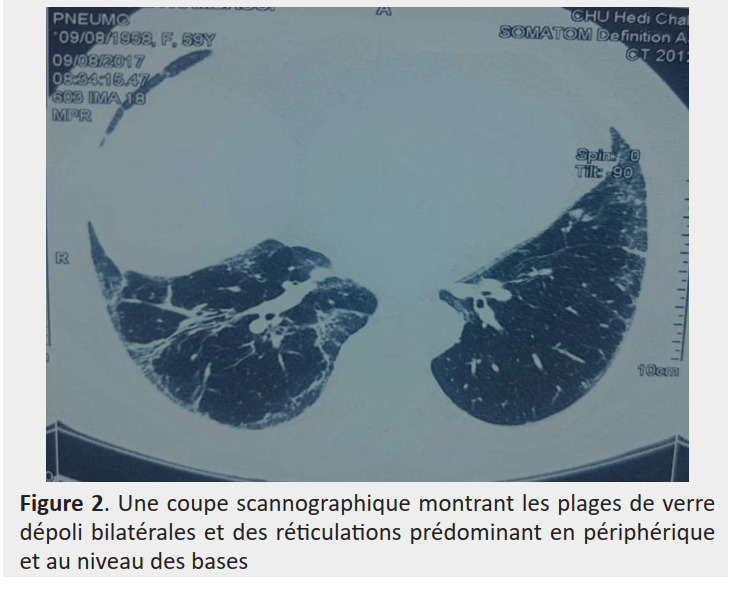
L’aspect en verre dépoli a été présent dans 5 cas, les condensations dans 3 cas, un aspect de crazy paving dans 3 cas, une bronchiolite constrictive dans un cas (Figure 1) et un aspect de pneumopathie interstitielle non spécifique dans un cas (Figure 2).
La localisation bilatérale était présente dans 6 cas parmi eux 3 cas avaient une prédominance des lésions au niveau des lobes inférieurs et un cas avait une prédominance à droite.
Une localisation droite unique était présente dans 3 cas.

Le LBA a été pratiqué seul pour 4 patients et en association avec des biopsies bronchiques chez 3 patients (Figure 3).
Une biopsie pulmonaire chirurgicale a été réalisée dans 1 cas et une biopsie transpariétale sous contrôle scannographique dans 1 cas.
L’éviction du facteur favorisant était le moyen thérapeutique dans 8 des cas, par un reclassement professionnel et une déclaration de maladie professionnelle pour 4 patients ou par éviction de la consommation de produits lipidiques pour 4 patients.
Une corticothérapie systémique a été indiquée chez 6 patients.
Le traitement du reflux gastroœsophagien a été indiqué chez 1 patient.
L’évolution a été marquée par une amélioration clinique et scannographique dans 4 cas, une stabilité dans 3 cas et une aggravation chez deux patients.
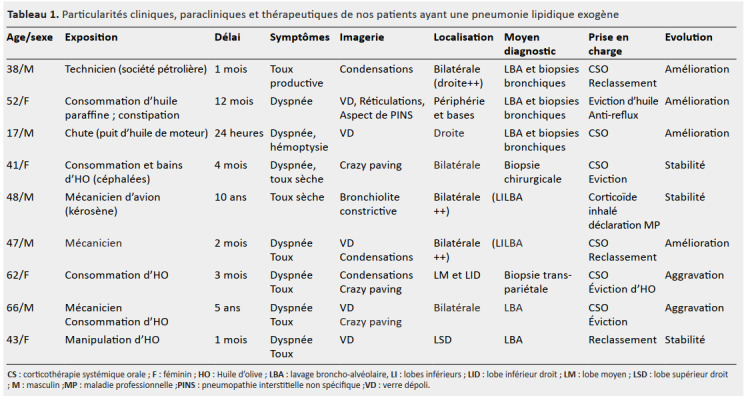
Le tableau 1 résume les particularités cliniques, paracliniques et thérapeutiques de nos patients ayant une PLE.

Discussion
La pneumonie lipidique est une affection rare qui résulte d'une accumulation pulmonaire de lipides dans les alvéoles.
Ces composés graisseux peuvent être d'origine animale, végétale ou minérale (1).
Parmi les huiles minérales les plus incriminés, on cite les laxatifs à base d'huile pour le traitement de la constipation (huile de paraffine) (7), les décongestionnants nasaux pour les maladies rhinopharyngées chroniques (8), le vapotage (9), les gélules d'huile de poisson (10), l’essence dans le poumon de cracheur de feu (11).
Les huiles végétales concernées sont les huiles de coco, de sésame ou de tournesol (12).
Les huiles animales sont aussi incriminées mais moins fréquemment, provoquant une inflammation intense et une fibrose selon la teneur en acides gras libres (13).
Parfois, plus d'une substance est identifiée.
La PLE est classée en deux catégories : aigu et chronique.
La forme aiguë est généralement causée par un épisode d'aspiration d'une grande quantité de produits à base de pétrole, tandis que la forme chronique résulte d'épisodes répétés d'aspiration ou d'inhalation de lipides sur une période prolongée (2).
L’exposition à la substance incriminée peut remonter à plusieurs années, voire des décennies (14).
Une altération de la déglutition par une anomalie anatomique ou fonctionnelle du pharynx et de l'œsophage (une hernie hiatale, un reflux gastroœsophagien, un mégaœsophage, le diverticule de Zenker,l’achalasie) peut être un facteur favorisant l’aspiration, de même pour les maladies neuromusculaires affectant la motilité du pharynx ou le réflexe de la toux, les troubles psychiatriques, les épisodes de perte de conscience (4,15).
L’âge moyen des patients selon les séries varie entre 45 et 68,5 ans (14, 16-19).
Dans notre série, l’âge moyen était de 46 ans, avec des extrêmes allant de 17 ans à 66 ans.
Les données de la littérature sur la répartition selon le sexe sont divergentes (14, 16-19).
La PLE peut être de découverte fortuite à l’occasion d’une radiographie de thorax réalisée dans le cadre d’un bilan préopératoire ou d’un contrôle habituel (20-22).
La toux, la dyspnée sont les signes cliniques les plus fréquents.
Les expectorations et la douleur thoracique ne sont pas rares.
L’hémoptysie est exceptionnelle (16, 18, 19).
Les aspects radiologiques sont multiples et souvent associés.
Aucun de ces aspects ne constitue une caractéristique radiologique spécifique de la PLE(4).
L’anomalie radiologique la plus fréquente est la condensation parenchymateuse.
Les images en verre dépoli sont toutefois, fréquemment décrites dans les séries(14, 23, 24).
L’aspect en crazy paving a été rapporté dans la PLE (25).
La PLE peut se présentée comme un nodule pulmonaire (29).
L’anomalie la plus caractéristique du PLE est la présence de zones avec une valeur d'atténuation de la graisse négative, entre -30 UH et -150 UH, mesurée au scanner de base dans les consolidations ou les nodules, avec ou sans réaction fibreuse périphérique (1).
D'autres anomalies radiologiques peuvent être observées, notamment des pneumatocèles, des pneumomédiastins, des pneumothorax et des épanchements pleuraux 15).
La topographie de ces lésions est un argument diagnostique fondamental car l’atteinte prédomine nettement dans les régions déclives (lobes inférieurs, lobe moyen, lingula)(27, 28).
L'examen de choix pour un diagnostic de confirmation est le LBA avec biopsie (16).
Le LBA peut révéler un liquide trouble ou blanchâtre avec des gouttelettes de graisse visibles à l’œil nu à la surface.
Une biopsie transpariétale sous scanner peut être un moyen de diagnostic et dans certains cas, une biopsie chirurgicale, peut s'avérer nécessaire (14, 18, 24, 29).
Les spécimens histologiques ne peuvent pas être conservés dans la paraffine, car les lipides sont dissous par le xylol et d'autres substances utilisées lors du traitement(4).
Les différentes caractéristiques des huiles peuvent être détectées en fonction des réactions histochimiques sur la coloration ORO (30).
La PLE était découverte en post mortem (30).
Le diagnostic différentiel d’une PLE peut se poser avec les hamartomes (31), les lipomes (27), la pneumopathie lipidique endogène, le carcinome broncho-alvéolaire(32), la protéinose alvéolaire (33).
Le traitement des PLE est largement controversé.
La suppression du produit incriminé permet d’observer une amélioration voire la régression complète des lésions en quelques mois.
Cette évolution dépend de l’étendue et du stade des lésions (19).
La corticothérapie a été considéré comme efficace dans certains cas (34-36).
Son effet est d’atténuer la réponse inflammatoire aux matériels aspirés.
Cependant, les corticostéroïdes ne sont pas toujours indiqués et ne doivent être utilisés que si la lésion pulmonaire est sévère et continue (15).
Le schéma thérapeutique incluant la nature de la molécule, la dose et la durée n’est pas codifié et la décision est équipe dépendante.
Selon l'état et les complications des patients, un LBA segmentaire ou un lavage du poumon entier peut être effectué.
Le mécanisme principal à l'origine des effets thérapeutiques du lavage pulmonaire pourrait être sa capacité à éliminer les substances aspirées, les facteurs inflammatoires provoqués par les réponses immunitaires de l’organisme et le surfactant, qui pourraient nuire aux échanges gazeux et déclencher un processus de fibrose pulmonaire (37).
Dans une revue de la littérature incluant 90 patients traités par lavage broncho-alvéolaire (seul ou en association à un autre traitement) (37), 87 patients ont présentés une amélioration clinique et 3 cas de décès en intra-hospitalier.
L’arrêt de la substance huileuse ne peut pas être toujours suivi d’effet chez des patients souvent très dépendants de leur traitement.
Si tel est le cas, le traitement d’un facteur favorisant pourra au moins limiter l’inhalation de la substance huileuse.
Dans notre série, un traitement anti-reflux a été prescrit chez un patient souffrant d’un reflux gastro-œsophagien.
La chirurgie a peu de place dans le traitement des pneumonies lipidiques.
Elle est souvent indiquée pour le diagnostic et serait à type de segmentectomie ou de lobectomie ou d’un wedge.
Cependant, le diagnostic peut être confirmé sans recours aux procédures invasives par une bonne connaissance des causes et des manifestations de cette affection, lorsque les antécédents, l’exposition, les résultats cliniques, radiologiques et cytologiques sont concordants (38).
Conclusion
La PLE constitue une entité nosologique rare.
Il s’agit d’une pathologie de l’adulte dont la fréquence augmente avec l’âge.
L’exposition à l’agent étiologique est en règle chronique.
Des cas secondaires à une exposition unique et accidentelle ont été cependant rapportés.
L’évolution se fait le plus souvent vers la stabilité ou l’aggravation lente des lésions entraînant une altération de la fonction ventilatoire.
Le traitement demeure non codifié.
Toutefois, l’éviction de l’exposition, si précoce, constitue un moyen thérapeutique efficace permettant la régression des lésions ou leur stabilité.
C’est dire donc, l’importance d’une meilleure connaissance et d’une prévention pouvant réduire l’incidence et les conséquences sur la fonction respiratoire de cette affection.
References
- Cozzi D, Bindi A, Cavigli E, Grosso AM, Luvarà S, Morelli N. Exogenous lipoid pneumonia: when radiologist makes the difference. Radiol med. 2021;126(1):22–28. doi: 10.1007/s11547-020-01230-x. [DOI] [PubMed] [Google Scholar]
- Betancourt SL, Martinez-Jimenez S, Rossi SE, Truong MT, Carrillo J, Erasmus JJ. Lipoid Pneumonia: Spectrum of Clinical and Radiologic Manifestations. American Journal of Roentgenology. 2010;194(1):103–109. doi: 10.2214/AJR.09.3040. [DOI] [PubMed] [Google Scholar]
- Rea G, Perna F, Calabrese G, Molino A, Valente T, Vatrella A. Exogenous lipoid pneumonia (ELP): when radiologist makes the difference. Transl Med UniSa. 2016;14:64–68. [PMC free article] [PubMed] [Google Scholar]
- Marchiori E, Zanetti G, Mano CM, Hochhegger B. Exogenous lipoid pneumonia. Clinical and radiological manifestations. Respiratory Medicine. 2011;105(5):659–666. doi: 10.1016/j.rmed.2010.12.001. [DOI] [PubMed] [Google Scholar]
- Basset Léobon C, Lacoste-Collin L, Aziza J, Bes JC, Jozan S, Courtade-Saïdi M. Cut-off values and significance of Oil Red O-positive cells in bronchoalveolar lavage fluid. Cytopathology. 2010;21(4):245–250. doi: 10.1111/j.1365-2303.2009.00677.x. [DOI] [PubMed] [Google Scholar]
- Wang Y, Goulart RA, Pantanowitz L. Oil red O staining in cytopathology. Diagnostic Cytopathology. 2011;39(4):272–273. doi: 10.1002/dc.21390. [DOI] [PubMed] [Google Scholar]
- Jeelani HM, Sheikh MM, Sheikh B, Mahboob H, Bharat A. Exogenous Lipoid Pneumonia Complicated by Mineral Oil Aspiration in a Patient With Chronic Constipation: A Case Report and Review. Cureus. 2020;12(7):e9294. doi: 10.7759/cureus.9294. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Osman GA, Ricci A, Terzo F, Falasca C, Giovagnoli MR, Bruno P. Exogenous lipoid pneumonia induced by nasal decongestant. ClinRespir J. 2018;12(2):524–531. doi: 10.1111/crj.12557. [DOI] [PubMed] [Google Scholar]
- Maddock SD, Cirulis MM, Callahan SJ, Keenan LM, Pirozzi CS, Raman SM. Pulmonary Lipid-Laden Macrophages and Vaping. N Engl J Med. 2019;381(15):1488–1489. doi: 10.1056/NEJMc1912038. [DOI] [PubMed] [Google Scholar]
- Nielsen MH, Madsen LB, Bendstrup E. Exogenous lipoid pneumonia due to silent aspiration following surgery and radiotherapy for cancer of the tongue. Respir Med Case Rep. 2022;40:101767. doi: 10.1016/j.rmcr.2022.101767. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Pielaszkiewicz-Wydra M, Homola-Piekarska B, Szcześniak E, Ciołek-Zdun M, Fall A. Exogenous lipoid pneumonia – a case report of a fire-eater. Pol J Radiol. 2012;77(4):60–64. doi: 10.12659/pjr.883631. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Wong CF, Yan SW, Wong WM, Ho RSL. Exogenous lipoid pneumonia associated with oil pulling: Report of two cases. Monaldi Arch Chest Dis. 2018;88(3):922. doi: 10.4081/monaldi.2018.922. [DOI] [PubMed] [Google Scholar]
- Rajagopala S, Selvam N. An unusual cause of respiratory distress. J Postgrad Med. 2019;65(1):38–40. doi: 10.4103/jpgm.JPGM_496_17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Samhouri BF, Tandon YK, Hartman TE, Harada Y, Sekiguchi H, Yi ES. Presenting Clinicoradiologic Features, Causes, and Clinical Course of Exogenous Lipoid Pneumonia in Adults. Chest. 2021;160(2):624–632. doi: 10.1016/j.chest.2021.02.037. [DOI] [PubMed] [Google Scholar]
- Hadda V, Khilnani GC. Lipoid pneumonia: an overview. Expert Review of Respiratory Medicine. 2010;4(6):799–807. doi: 10.1586/ers.10.74. [DOI] [PubMed] [Google Scholar]
- Acharya V, Dsouza NV, Sreeram S, Rai SPV, Achappa B. Shine like gold and sparkle like glitter: Three cases of lipoid pneumonia. Respiratory Medicine Case Reports. 2021;33:101380. doi: 10.1016/j.rmcr.2021.101380. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Aliaga F, Chernilo S, Fernández C, Valenzuela H, Rodríguez JC. Exogenous lipoid pneumonia. Report of three cases. Revista médica de Chile. 2017;145(11):1495–1499. doi: 10.4067/s0034-98872017001101495. [DOI] [PubMed] [Google Scholar]
- Gondouin A, Manzoni Ph, Ranfaing E, Brun J, Cadranel J, Sadoun D. Exogenous lipid pneumonia: a retrospective multicentre study of 44 cases in France. European Respiratory Journal. 1996;9(7):1463–1469. doi: 10.1183/09031936.96.09071463. [DOI] [PubMed] [Google Scholar]
- Han C, Liu L, Du S, Mei J, Huang L, Chen M. Investigation of rare chronic lipoid pneumonia associated with occupational exposure to paraffin aerosol. J Occup Health. 2016;58(5):482–488. doi: 10.1539/joh.16-0096-CS. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Doubková M, Doubek M, Moulis M, Skřičková J. Exogenous lipoid pneumonia caused by chronic improper use of baby body oil in adult patient. Revista Portuguesa de Pneumologia. 2013;19(5):233–236. doi: 10.1016/j.rppneu.2013.05.002. [DOI] [PubMed] [Google Scholar]
- Nakashima S, Ishimatsu Y, Hara S, Kitaichi M, Kohno S. Exogenous Lipoid Pneumonia Successfully Treated With Bronchoscopic Segmental Lavage Therapy. Respir Care. 2015;60(1):e1–e5. doi: 10.4187/respcare.03225. [DOI] [PubMed] [Google Scholar]
- Ohwada A, Yoshioka Y, Shimanuki Y, Mitani K, Kumasaka T, Dambara T. Exogenous Lipoid Pneumonia Following Ingestion of Liquid Paraffin. Intern Med. 2002;41(6):483–486. doi: 10.2169/internalmedicine.41.483. [DOI] [PubMed] [Google Scholar]
- Pellegrino R, Viegi G, Brusasco V, Crapo RO, Burgos F, Casaburi R. Stratégies d’interprétation des explorations fonctionnelles respiratoires. Revue des Maladies Respiratoires. 2007;24(3):83–108. [PubMed] [Google Scholar]
- Marchiori E, Zanetti G, Mano CM, Irion KL, Daltro PA, Hochhegger B. Lipoid Pneumonia in 53 Patients After Aspiration of Mineral Oil: Comparison of High-Resolution Computed Tomography Findings in Adults and Children. Journal of Computer Assisted Tomography. 2010;34(1):9–12. doi: 10.1097/RCT.0b013e3181a9ec9f. [DOI] [PubMed] [Google Scholar]
- Choi HK, Park CM, Goo JM, Lee HJ. Pulmonary alveolar proteinosis versus exogenous lipoid pneumonia showing crazy-paving pattern: Comparison of their clinical features and high-resolution CT findings. Acta Radiol. 2010;51(4):407–412. doi: 10.3109/02841850903575332. [DOI] [PubMed] [Google Scholar]
- Harris K, Chalhoub M, Maroun R, Abi-Fadel F, Zhao F. Lipoid pneumonia: A challenging diagnosis. Heart Lung. 2011;40(6):580–584. doi: 10.1016/j.hrtlng.2010.12.003. [DOI] [PubMed] [Google Scholar]
- Ukkola-Pons E, Weber-Donat G, Teriitehau C, Calcina P, Baccialone J, Vaylet F. Imagerie de la pneumopathie huileuse. Feuillets de Radiologie. 2010;50(1):3–9. [Google Scholar]
- Guo M, Liu J, Jiang B. Exogenous lipid pneumonia in old people caused by aspiration: Two case reports and literature review. Respir Med Case Rep. 2019;27:100850. doi: 10.1016/j.rmcr.2019.100850. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Khilnani G, Hadda V. Lipoid pneumonia: An uncommon entity. Indian J Med Sci. 2009;63(10):474. [PubMed] [Google Scholar]
- Rana D, Kaushik N, Sadhu S, Kalra R, Sen R. Idiopathic Lipoid Pneumonia: An incidental finding in autopsy specimen. Autops Case Rep. 2020;10(1):e2020143. doi: 10.4322/acr.2020.143. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Gaerte SC, Meyer CA, Winer-Muram HT, Tarver RD, Conces DJ. Fat-containing Lesions of the Chest. RadioGraphics. 2002;22(suppl_1):S61–S78. doi: 10.1148/radiographics.22.suppl_1.g02oc08s61. [DOI] [PubMed] [Google Scholar]
- da Costa FM, Cerezoli MT, Medeiros AK, Magalhães MAF, Castro SN. Small samples, big problems: lipoid pneumonia mimicking lung adenocarcinoma. J Bras Pneumol. 2023;49(3):e20230147. doi: 10.36416/1806-3756/e20230147. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Jouneau S, Kerjouan M, Briens E, Lenormand JP, Meunier C, Letheulle J. La protéinose alvéolaire pulmonaire. Revue des Maladies Respiratoires. 2014;31(10):975–991. doi: 10.1016/j.rmr.2014.08.009. [DOI] [PubMed] [Google Scholar]
- Park S, Park JE, Lee J. A case of lipoid pneumonia associated with occupational exposure to solvents in a dry-cleaning worker. Respirology Case Reports. 2021;9(6):e00762. doi: 10.1002/rcr2.762. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Alzghoul BN, Innabi A, Mukhtar F, Jantz MA. Rapid Resolution of Severe Vaping-induced Acute Lipoid Pneumonia after Corticosteroid Treatment. Am J Respir Crit Care Med. 2020;202(2):e32–e33. doi: 10.1164/rccm.201909-1826IM. [DOI] [PubMed] [Google Scholar]
- Lococo F, Cesario A, Porziella V, Mulè A, Petrone G, Margaritora S. Idiopathic lipoid pneumonia successfully treated with prednisolone. Heart Lung. 2012;41(2):184–187. doi: 10.1016/j.hrtlng.2011.01.003. [DOI] [PubMed] [Google Scholar]
- Shang L, Gu X, Du S, Wang Y, Cao B, Wang C. The efficacy and safety of therapeutic lung lavage for exogenous lipoid pneumonia: A systematic review. Clin Respir J. 2021;15(2):134–146. doi: 10.1111/crj.13273. [DOI] [PubMed] [Google Scholar]
- Chardin D, Nivaggioni G, Viau P, Butori C, Padovani B, Grangeaon C. False positive 18FDG PET-CT results due to exogenous lipoid pneumonia secondary to oily drug inhalation. Medicine (Baltimore) 2017;96(22):e6889. doi: 10.1097/MD.0000000000006889. [DOI] [PMC free article] [PubMed] [Google Scholar]


