Abstract
目的
探讨电针(EA)预处理通过调节肠道微生物群和Nrf2/HO-1信号通路以及抑制铁死亡来减轻脑缺血再灌注损伤(CIRI)的潜力。
方法
诱导CIRI的大鼠接受大脑中动脉堵塞(MCAO)手术,并分为假手术组、模型组和EA治疗组,10只/组。EA治疗在百会穴(DU20)和足三里穴(ST36)于MCAO前3 d进行。评估神经功能缺损和开放场行为,使用TTC、Nissl和HE染色检查脑梗死和海马病理。通过ELISA测定脑组织中丙二醛、活性氧和超氧化物歧化酶水平,利用qRT-PCR和Western blotting分析Bax、Bcl-2、Nrf2、HO-1、GPX4和SLC7A11的表达。免疫组化检测脑组织中GPX4、Nrf2和HO-1的水平,并收集粪便样本以分析肠道微生物群。
结果
EA预处理降低了大鼠的神经功能缺损评分(P<0.05),改善了自愿运动的频率和持续时间(均P<0.05)。TTC染色显示EA组的缺血性梗死面积小于模型组(P<0.05)。Nissl染色结果显示,模型组海马神经元数量减少且Nissl物质丢失,而EA组神经元存活率提高,Nissl物质含量恢复(P<0.05)。HE染色结果显示,模型组海马神经元排列不规则且病理变化明显,而EA组的结构和活力有所改善(P<0.05)。ELISA检测显示,模型组的丙二醛和活性氧水平升高,超氧化物歧化酶水平下降(均P<0.05);EA组则相反。EA治疗降低了Bax蛋白表达,增加了Bcl-2蛋白表达(均P<0.05),同时上调了铁死亡关键调控蛋白GPX4和SLC7A11的表达,免疫组化结果一致。EA上调Nrf2(P<0.05)和HO-1(P<0.05)的表达,激活Nrf2/HO-1信号通路,并改善肠道微生物群。
结论
电针预处理通过调节肠脑轴、激活Nrf2/HO-1信号通路、抑制细胞凋亡和铁死亡,有效缓解了大鼠脑缺血再灌注损伤,为其在缺血性脑血管疾病中的临床应用提供了科学依据。
Keywords: 电针, 脑缺血再灌注损伤, 氧化应激, 肠道微生物, 铁死亡
Abstract
Objective
To investigate the neuroprotective effects of electroacupuncture (EA) preconditioning against cerebral ischemia-reperfusion injury (CIRI) mediated by gut microbiota modulation, Nrf2/HO-1 pathway activation, and ferroptosis suppression.
Methods
Adult male SD rats were divided into sham operation group, CIRI model group, and EA preconditioning group. In the latter two groups, rat models of CIRI were established by middle cerebral artery occlusion (MCAO), and in EA preconditioning group, EA was applied at Baihui (DU20) and Zusanli (ST36) for 3 days before modeling. Neurological deficits, cerebral infarction, and hippocampal pathology of the rats were evaluated using behavioral tests, TTC staining, and Nissl and HE staining, and the oxidative stress markers (MDA, ROS, and SOD), apoptosis/ferroptosis-related proteins (Bax, Bcl-2, GPX4, and SLC7A11), and changes in gut microbiota were analyzed.
Results
EA preconditioning significantly reduced neurological deficits, decreased infarct volume, promoted hippocampal neuronal survival, and improved structural integrity of the hippocampal neurons in MCAO rats. EA preconditioning also significantly lowered MDA and ROS and increased SOD levels, upregulated Bcl-2, GPX4, and SLC7A11 expressions, and downregulated Bax expression in the hippocampal tissue of the rats, causing also activation of Nrf2/HO-1 signaling and improvement of gut microbiota composition.
Conclusion
EA preconditioning alleviates CIRI in rats by suppressing ferroptosis and apoptosis, enhancing antioxidant defenses via activating Nrf2/HO-1 signaling, and regulating the gut-brain axis.
Keywords: electroacupuncture, cerebral ischemia-reperfusion injury, oxidative stress, gut microbiota, ferroptosis
脑缺血再灌注损伤(CIRI)是缺血性卒中溶栓治疗后的核心病理事件,其病理生理机制涉及氧化应激、线粒体功能障碍、炎症级联反应及程序性细胞死亡(包括铁死亡、凋亡与焦亡)等多种分子途径的交互作用[1]。临床证据表明,CIRI可导致血脑屏障破坏、神经元不可逆损伤及远期神经功能缺损[2]。尽管现行治疗方案(如静脉溶栓与血管内取栓)可部分恢复脑血流,但其疗效受限于严格的时间窗(如重组组织型纤溶酶原激活剂需在发病4.5 h内应用),且无法有效干预再灌注后自由基爆发与炎症因子风暴等关键机制[3, 4]。因此,开发能够多靶点干预CIRI病理机制的新型治疗策略具有重要临床意义。
肠脑轴(GBA)在CIRI中的调控作用日益受到关注。作为双向通讯系统,GBA通过神经-内分泌-免疫网络介导肠道微生物群与中枢神经系统(CNS)的双向调控。例如,Zhang等[5]发现口服藏红花苷通过肠道微生物群介导的代谢转化对CIRI具有保护作用。Liu等[6]提出黄芩苷能够重塑小鼠的肠道微生物群,从而改善CIRI的神经病理特征。Sun等[7]则证明,丁酸梭菌通过调节肠道微生物群减轻糖尿病小鼠的CIRI。然而,电针(EA)如何通过调控GBA干预CIRI仍亟待阐明。
尽管EA在CIRI中的临床疗效已被初步证实[8],但其作用是否依赖于GBA调控仍缺乏直接证据。值得注意的是,EA在CNS疾病中的多效性可能与其对GBA的靶向调节密切相关。EA作为结合传统针灸与电刺激的治疗技术,广泛应用于中风等疾病的康复,且在改善感觉和运动功能恢复方面显示了显著效果[9]。此外,EA在治疗帕金森病[10]、结肠炎[11]、过敏性气道炎症[12]及失眠中也表现出疗效,且其机制可能与调节肠道微生物群有关[13]。研究已证实EA可降低神经功能缺损评分、缩小脑梗死范围,并改善患者生活质量[14]。近年来,EA通过调节GBA影响CIRI病理进程的假说被提出[15],但相关机制尚未充分解析。例如,EA可能通过调节肠道微生物群组成、降低肠道通透性、抑制脂多糖(LPS)等微生物产物易位,进而减轻系统性炎症反应,这一机制值得通过菌群移植及代谢组学分析进一步验证。
在分子机制层面,Nrf2/HO-1信号通路作为细胞抗氧化防御系统的核心调控网络,其与铁死亡的交互作用在CIRI中具有关键地位。生理状态下,Nrf2通过与Keap1结合滞留于胞质;氧化应激条件下,Nrf2易位入核并启动HO-1、NAD(P)H醌氧化还原酶1(NQO1)等Ⅱ相解毒酶的表达。研究表明,EA刺激“百会”与“足三里”可显著促进Nrf2核转位,并通过各种途径抑制铁死亡,如在CIRI模型中,EA可降低铁死亡标志物(脂质过氧化产物4-HNE、铁离子沉积)水平,并上调GPX4和SLC7A11的表达,维持细胞内氧化还原稳态[16]。EA预处理还可通过激活YAP信号增强Nrf2/HO-1通路的抗氧化效应,减少神经元凋亡[17]。值得注意的是,肠道菌群代谢产物已被证实可通过HDAC抑制效应增强Nrf2转录活性[18],提示EA可能通过重塑菌群-代谢物谱间接调控Nrf2/HO-1通路,但其具体分子桥梁尚未明确。
基于现有证据,我们推测EA可能通过GBA与Nrf2/HO-1通路形成双向调控网络,一方面通过调节菌群-免疫-代谢轴抑制外周炎症向CNS传播;另一方面直接激活抗氧化通路,阻断铁死亡级联反应。因此,系统研究EA预处理基于GBA、Nrf2/HO-1通路及铁死亡的多靶点神经保护机制,将深化对CIRI发病机制的理解,并为缺血性脑血管疾病的治疗提供新策略。
1. 材料和方法
1.1. 材料
HE染色液、过氧化物酶标记的山羊抗小鼠IgG(H+L)抗体(1∶2000)和过氧化物酶标记的山羊抗兔IgG(H+L)抗体(1∶2000,中生北生物科技);Nissl染色液、伊红染色液、Scott蓝溶液(索拉比奥科技);超净高级封片胶(YZB,BASO);TRIzol试剂、超纯RNA提取试剂盒(CWBIO);HiScript II Q RT SuperMix用于qPCR(含gDNA清除剂)、SYBR qPCR Master Mix(Vazyme);大鼠超氧化物歧化酶(SOD)ELISA试剂盒、大鼠丙二醛(MDA)ELISA试剂盒(美满生物);大鼠活性氧(ROS)检测试剂盒(Abcam);抗GPX4、Nrf2、Bcl-2抗体(Proteintech);抗HO-1、Bax、GPX4抗体、抗SLC7A11抗体(Affinity);DAB底物试剂盒、中性胶(CWBIO)。
1.2. MCAO模型
健康成年雄性无特异病原体SD大鼠30只,体质量230~270 g,购自SJA实验动物有限公司(SCXK 20190104)。动物实验经贵州中医药大学实验动物伦理审查委员会批准(伦理批号:2020379)。实验动物适应标准环境,温度为22±2 ℃,12 h∶12 h明暗交替的光照周期,并可以自由获取食物和水。使用40 mg/kg的戊巴比妥钠腹腔麻醉大鼠。剃毛并消毒后,在颈部中线处做一个纵向切口。钝性分离胸锁乳突肌及颈部肌肉,以暴露右侧颈动脉,避免损伤迷走神经。随后结扎右颈动脉近段和颈外动脉近段,夹持颈内动脉。将一根4-0尼龙单丝插入右颈外动脉,诱导大脑中动脉(MCA)闭塞2 h。随后去除闭塞物,给予72 h再灌注。缝合切口,醒后转笼。将实验大鼠随机分为3组:假手术组、模型组和电针组,n=10。模型组和电针组大鼠行大脑中动脉缺血处理,假手术组仅暴露血管但未结扎。
1.3. EA预处理
在MCAO前3 d,采用0.3 mm×25.0 mm的无菌针灸针在百会穴(DU20)和患侧足三里穴(ST36)进行EA预处理。两穴位通过电针仪(南京济生医疗)连接形成回路,设置参数为疏密波(2 Hz/15 Hz交替,波宽0.5 ms)。电流强度1 mA(以大鼠局部肌肉轻微颤动为度),每日固定时段干预30 min,1次/d,连续3 d。EA预处理通过激活内源性神经保护机制,为后续缺血模型建立提供基础。
1.4. 神经功能缺损评估
在2 h缺血后进行72 h的再灌注,以评估神经功能评分。评分标准为:0分表示无神经功能缺损,1分表示前肢伸展不完全,2分表示向对侧旋转,3分表示向对侧跌倒,4分表示意识丧失及无法行走。采用该评分标准可定量评估大鼠在缺血再灌注过程中的神经功能缺损程度。
1.5. 旷场试验
旷场试验通过记录大鼠穿越格子数(水平运动)及运动时间(探索行为),反映其神经功能恢复程度及焦虑状态。实验采用方形箱体(100 mm×100 mm×40 mm),底面划分为25格。将每只大鼠置于方形箱中央的安静环境中适应1 min,随后记录5 min内大鼠的活动次数(穿越格子数)及活动持续时间(运动总时间)。活动次数和时间减少提示神经功能缺损或焦虑样行为,EA预处理的改善作用可通过这些指标评估。
1.6. TTC染色
2,3,5-三苯基四氯化氮(TTC)染色评估再灌注72 h后梗死体积。脑组织切成2 mm厚切片,37 ℃TTC(2%溶液)处理15 min,4%多聚甲醛保存。切片显示玫瑰红的正常区和白色的梗死区。将每只大鼠的脑切片按顺序排列并拍照。采用Image J软件对图像进行分析,测量各切片的梗死面积和总面积。
1.7. Nissl染色
脑组织样本经4%多聚甲醛固定24 h后,依次用70%、80%、90%、95%和100%乙醇梯度脱水(1 h/步骤)。随后,组织经二甲苯透明化(2次,30 min/次)并浸蜡包埋。将包埋后的组织切成5 μm厚切片,贴附于载玻片。脱蜡后,切片依次用100%、95%、90%、80%和70%乙醇复水(5 min/步骤),随后浸泡于0.1%焦油紫染色液10 min,蒸馏水冲洗。用95%乙醇分化5~10 s,直至背景清晰。最后,切片经100%乙醇脱水(2次,5 min/次)、二甲苯透明(2次,5 min/次),中性树胶封片。染色切片于光学显微镜下观察,评估神经元存活状态及Nissl物质分布。
1.8. HE染色
组织样本在流动水中冲洗数小时,并用70%、80%和90%的乙醇脱水。组织在100%乙醇和二甲苯等体积的混合溶液中脱蜡15 min后,在二甲苯Ⅱ中处理15 min,然后在二甲苯和石蜡等体积的混合溶液中培养15 min,在石蜡Ⅰ和Ⅱ中分别渗透50~60 min。石蜡包埋切片后,组织切片脱蜡、水洗、苏木精液染色3 min。在酸性酒精中分化15 s,染蓝15 s后,自来水水洗、伊红反染色3 min。最后水洗、脱水、清洗、裱片,在显微镜下观察。
1.9. 16S rRNA基因测序用于识别肠道微生物群
所有粪便样本均进行16S rRNA测序。从大鼠粪便样本中提取基因组DNA。测定浓度后,DNA片段经1%琼脂糖电泳测定,-20 ℃保存备用。扩增16S rRNA基因的V4-V5区域,扩增产物使用Roche/454平台进行焦磷酸测序。每个样品30 g PCR产物经1.2%琼脂糖电泳分离纯化,与测序文库混合后上机测序。
1.10. qRT-PCR
从细胞或组织中收集的RNA样本经反转录生成cDNA,作为进行PCR的模板。以β-肌动蛋白为内参,采用2-ΔΔCt法计算基因表达量。引物序列由通用生物(安徽)股份有限公司合成(表1)。
表1.
目标基因的引物序列
Tab.1 PCR primers for target genes
| Target gene | Forward primer | Reverse primer |
|---|---|---|
| Nrf2 | CTTCTGGGGATACAGTACAGCC | CTCCTTGGACATCATTTCATTG |
| HO-1 | AGGTCCTGAAGAAGATTGCG | GGCGAAGAAACTCTGTCTGTGA |
| Bax | GCGATGAACTGGACAACAAC | GCAAAGTAGAAAAGGGCAACC |
| Bcl-2 | GCGTCAACAGGGAGATGTCA | TTCCACAAAGGCATCCCAGC |
| β-actin | GCCATGTACGTAGCCATCCA | GAACCGCTCATTGCCGATAG |
1.11. 免疫印迹检测
细胞在4 ℃裂解液中裂解30 min, 12 000×g离心10 min,收集上清制备蛋白样品,-20 ℃保存。相同浓度的蛋白质样品在60 V的堆积凝胶中,在80 V的分解凝胶中,用SDS-PAGE分离120 min。根据内参蛋白和目标蛋白的分子大小,将凝胶切成条带。采用湿转法在恒定电流300 mA转膜90 min,并在含有3%脱脂牛奶的1×TBST中浸泡1h。膜在4 ℃下与按1∶1000稀释于3%脱脂牛奶-TBST的一抗孵育过夜,在1×TBST(10 min×3)中洗涤,随后在室温下用按1∶5000稀释于3%脱脂牛奶-TBST的二抗孵育2 h。1×TBST洗涤(10 min×3)后,使用增强化学发光(ECL)试剂进行免疫印迹检测。
1.12. 免疫组化染色
石蜡包埋的组织切片经过脱蜡处理后,置于柠檬酸缓冲液中进行抗原修复,并在压力锅中高压加热处理(121 ℃, 2 min)后自然冷却。经过PBS洗涤后,将切片放置在室温下的湿盒中,加入新鲜配制的3% H2O2以抑制内源性过氧化物酶活性。10 min后,使用PBS洗涤切片(5 min×3次),用吸水纸吸去切片周围残留液体。然后在37 ℃下以5%牛血清白蛋白(BSA)室温封闭30 min,随后将切片在4 ℃下与按1∶200稀释于5% BSA-PBS的一抗孵育过夜,PBS洗涤(5 min×3次)后,在37 ℃下与按1∶500稀释于5% BSA-PBS的二抗孵育30 min,最后用DAB溶液进行染色,苏木素复染后,流水冲洗返蓝,梯度脱水,中性树胶封片。
1.13. 统计学分析
采用SPSS20.0及GraphPad Prism 6进行统计分析。本研究数据经Shapiro-Wilk检验证实符合正态分布(P>0.05)。独立样本t检验前通过Levene检验验证方差齐性,若方差不齐则采用Welch校正。单因素方差分析后,选择Student-Newman-Keuls检验进行探索性多重比较,该检验通过均值分层聚类识别差异子集。P<0.05为差异有统计学意义。
2. 结果
2.1. EA预处理改善大鼠脑缺血再灌注损伤后的神经功能缺陷
与假手术组相比,模型组大鼠神经功能缺损评分升高(P<0.05),而EA预处理组评分较模型组降低(P<0.05)(图1A)。在旷场试验中,模型组大鼠的活动次数和活动持续时间减少(P<0.05),EA预处理组大鼠的活动次数和活动持续时间增加(P<0.05,图1B、C)。
图1.
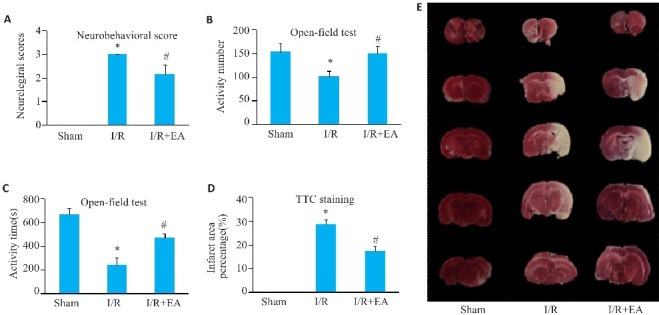
EA对神经功能缺损评分和梗死面积的影响
Fig.1 Effect of electroacupuncture (EA) preconditioning on neurological deficit scores and cerebral infarct volume in rats with cerebral ischemia-reperfusion injury (CIRI). A: Neurological deficit scores of the rats. B: Locomotor activity counts of the rats. C: Locomotor activity duration. D, E: TTC staining for determining cerebral infarct volume percentage in the rats. Data are presented as Mean±SE (n=10). *P<0.05 vs sham group; # P<0.05 vs I/R group.
2.2. EA预处理减少脑梗死面积并缓解海马神经元的病理变化
与假手术组相比,模型组的脑梗死范围增大,EA组的缺血性梗死面积百分比低于模型组(图1D~E)。Nissl染色结果显示,CIRI导致神经元数量减少、尼氏小体(Nissl bodies丢失及细胞形态破坏,而EA预处理改善了这些病理变化,增加了神经元存活率并恢复了Nissl物质的含量(P<0.05)。HE染色显示,模型组脑组织的海马神经元呈现不规则松散排列,染色不均匀、细胞边界模糊、细胞核浓缩、核仁不清晰,以及细胞质完整性丧失。EA组的这些病理变化改善,神经元结构和存活率提高(P<0.05,图2)。
图2.
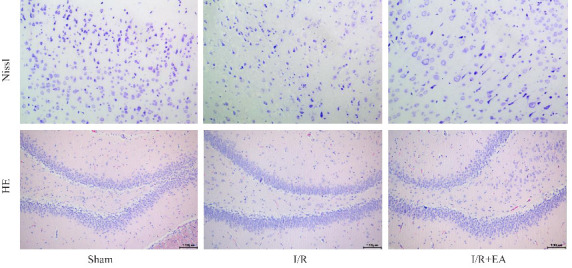
脑组织Nissl和HE染色代表图
Fig.2 Histopathological examination of rat brain tissue with Nissl and HE staining (Original magnification: ×200).
2.3. EA预处理降低脑I/R损伤大鼠脑组织中ROS、MDA水平,升高SOD水平
与假手术组相比,模型组大鼠的MDA、ROS水平升高,而SOD水平降低(P<0.05);与模型组比较,EA预处理降低大鼠脑组织MDA、ROS水平,升高SOD水平(P<0.05,图3)。
图3.
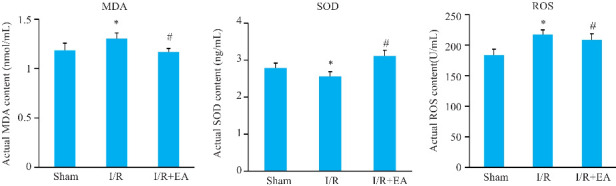
ELISA检测血清中MDA、SOD和ROS的水平
Fig.3 Serum levels of MDA, SOD and ROS in the rats detected by ELISA. *P<0.05 vs sham group; # P<0.05 vs I/R group.
2.4. EA预处理对脑缺血再灌注损伤大鼠细胞凋亡的抑制作用
与假手术组相比,模型组Bax的mRNA和蛋白表达水平上调(P<0.05),而Bcl-2的mRNA和蛋白表达水平下调(P<0.05)。与模型组相比,EA预处理降低了Bax的表达水平(P<0.05),同时提高了Bcl-2的表达水平(P<0.05,图4A~C)。免疫组化结果显示,模型组Bax的免疫反应性增强,而Bcl-2的免疫反应性减弱;EA预处理组则表现出Bax免疫反应性减弱和Bcl-2免疫反应性增强的趋势(图4D~E),与qRT-PCR和Western blotting结果一致。且EA预处理提高了铁死亡关键调控蛋白谷胱甘肽过氧化物酶4(GPX4)及胱氨酸/谷氨酸逆向转运体(SLC7A11)的表达水平(P<0.05,图4F)。
图4.
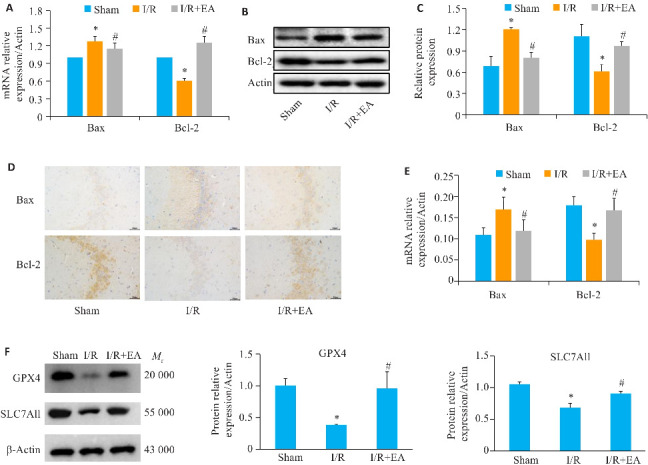
Western blotting检测脑组织中Bax和Bcl-2蛋白的表达
Fig.4 Protein expressions of Bax, Bcl-2, GPX4 and SLC7A11 in rat brain tissue. A-C: Western blotting for Bax and Bcl-2 protein expressions in the brain tissue. D, E: Immunofluorescence staining of Bax and Bcl-2 expression in the brain tissue (×400). F: Western blotting of GPX4 and SLC7A11 protein expressions in the brain tissue. Data are presented as Mean±SE (n=10). *P<0.05 vs sham group; # P<0.05 vs I/R group.
2.5. EA预处理激活脑缺血再灌注损伤大鼠Nrf2/HO-1信号通路
EA组大鼠脑组织中Nrf2和HO-1的表达显著高于模型组(P<0.05,图5)。与I/R组相比,EA组的Nrf2和HO-1表达明显上升(P<0.05,图6)。
图5.
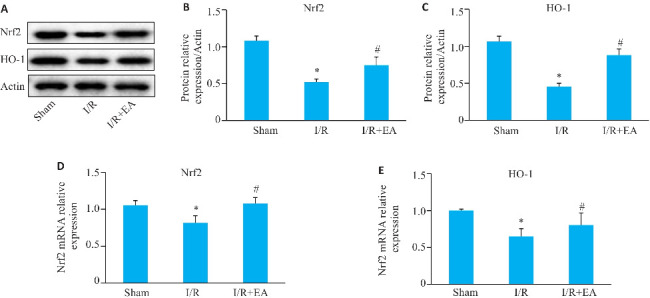
Nrf2和HO-1在脑组织中的相对表达
Fig.5 Relative protein and mRNA expressions of Nrf2 and HO-1 in rat brain tissues. A-C: Western blotting for Nrf2 and HO-1 protein expressions. D, E: mRNA expression levels of Nrf2 and HO-1. Data are presented as Mean±SE (n=10). *P<0.05 vs sham group; # P<0.05 vs I/R group.
图6.
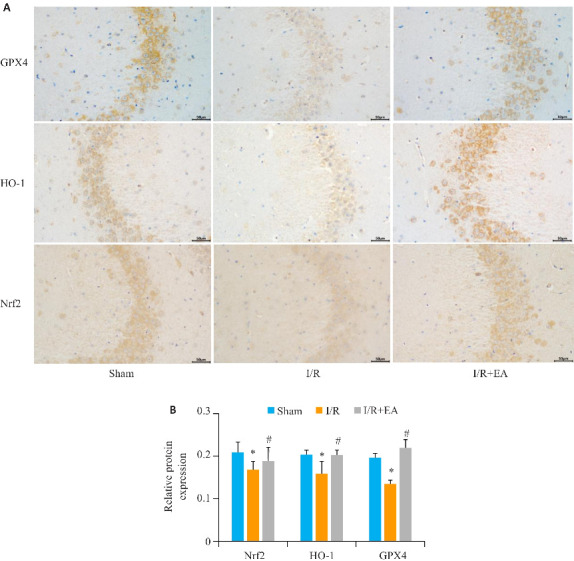
各组中Nrf2、HO-1、GPX4的表达水平
Fig.6 Expression levels of Nrf2, HO-1 and GPX4 in each group. A, B: Immunofluorescence staining of Nrf2, HO-1 and GPX4 expression in rat brain tissue (×50). *P<0.05 vs sham group; # P<0.05 vs I/R group.
2.6. EA预处理改善脑缺血-再灌注损伤大鼠肠道菌群
在OTU水平上的主成分分析(PCA)显示3组之间的显著分离(图7A)。其中,第一和第二主成分分别解释了37.1%和19.48%的变异。假手术组肠道微生物群的主要成分包括厚壁菌门(75.40%)、变形菌门(2.51%)、拟杆菌门(10.37%)和放线菌门(8.95%),而模型组则分别为厚壁菌门(42.09%)、变形菌门(45.52%)、拟杆菌门(11.00%)和放线菌门(0.92%)。EA组分别为厚壁菌门(62.16%)、变形菌门(14.41%)、拟杆菌门(19.74%)和放线菌门(2.88%)。与假手术组相比,模型组中厚壁菌门和放线菌门的丰度降低,而变形菌门的丰度升高。同时,EA预处理增加了厚壁菌门和放线菌门的丰度,降低了变形菌门的丰度(图7B~D)。
图7.
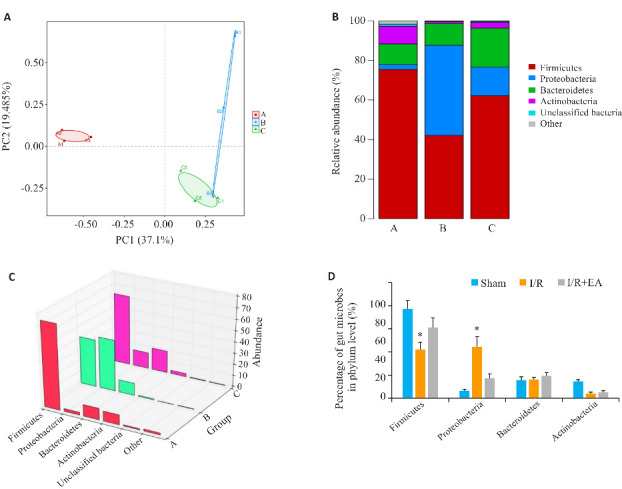
电针预处理改善脑缺血再灌注大鼠肠道微生物群
Fig.7 EA pretreatment improves gut microbiota in rats with cerebral ischemia-reperfusion injury. A: Principal component analysis (PCA) of OTU level. B: Relative abundance of gut microbiota. C: Heatmap of gut microbiota abundance. D: Percentage composition of gut microbiota (%). *P<0.05 vs sham group.
3. 讨论
Nrf2/HO-1信号通路在CIRI中的抗氧化作用已被广泛证实[19, 20]。研究显示,Nrf2通过调节抗氧化基因的表达,减轻氧化应激,从而保护神经细胞免受损伤,Nrf2相关机制已在多个领域得到验证,如杨静静等[21]研究发现桃叶珊瑚苷通过Nrf2介导的抗氧化应激减轻了阿霉素诱导的心肌损伤。王琪等[22]也表明Nrf2在调节H2O2诱导的黑素细胞氧化应激和抗氧化基因表达中发挥关键作用。此外,Huang等[23]指出,Saikosaponin A和D通过激活PI3K/AKT/Nrf2通路减少氧化应激,缓解慢性肾病引起的骨骼肌萎缩。Luo等[24]进一步揭示ZMYND8通过上调NRF2减少乳腺癌干细胞中的ROS和铁依赖性凋亡,形成增强抗氧化防御和干性维持的正反馈回路,从而促进BCSC扩增和肿瘤发生。尽管Nrf2/HO-1通路的抗氧化作用已被广泛证实,但其在传统中医干预(如电针)中的调控机制仍待阐明。本研究聚焦于Nrf2/HO-1通路,发现EA预处理“百会”和“足三里”穴显著上调CIRI大鼠脑组织中的Nrf2和HO-1水平,表明其通过激活该通路增强抗氧化能力。值得注意的是,已有研究表明,PI3K/Akt通路可能通过磷酸化修饰或协同作用调控Nrf2的活性[25],但本研究中EA预处理是否通过PI3K/Akt通路间接激活Nrf2,尚需通过抑制剂干预或磷酸化检测进一步验证。
除了氧化应激,凋亡也在CIRI的发生发展中发挥重要作用[26-28]。凋亡被认为是脑缺血再灌注(I/R)损伤后神经元损伤的一个关键环节。缺血再灌注期间促凋亡蛋白Bax与抗凋亡蛋白Bcl-2之间的平衡影响海马神经元的生死[29]。已知,神经元凋亡程度与脑损伤严重程度呈正相关,包括Bax上调和Bcl-2下调。越来越多的证据表明,抑制凋亡有助于缓解急性缺血性中风引起的脑损伤。例如,在脑缺血损伤的大鼠中观察到Bax/Bcl-2比率增加,而lupeol通过降低Bax/Bcl-2比率和抑制神经元凋亡在MCAO大鼠中发挥保护作用[30]。Zhang等[31]也表明,银杏叶提取物通过调节Bax/Bcl-2的表达抑制中风小鼠海马神经元的凋亡。与此一致,本研究发现EA预处理显著上调了Bcl-2表达并下调了Bax,从而减少了海马神经元的凋亡。
铁死亡作为一种铁依赖性的非凋亡性细胞死亡形式,其与CIRI的关联近年备受关注[29]。GPX4是铁死亡的关键调控蛋白,能够通过还原脂质过氧化物来抑制铁死亡的发生。此外,SLC7A11(胱氨酸/谷氨酸逆向转运体系统的重要组成部分)通过调控细胞内谷胱甘肽的合成,也在铁死亡中发挥重要作用[32]。本研究结果显示,CIRI降低了GPX4和SLC7A11的表达水平,表明铁死亡在CIRI中可能发挥了重要作用。然而,EA预处理上调了GPX4和SLC7A11的表达,抑制了脂质过氧化物的积累,从而减轻了铁死亡的发生。这一结果进一步支持了EA预处理通过多靶点机制发挥神经保护作用的观点。尽管铁死亡与氧化应激通过脂质过氧化和谷胱甘肽耗竭密切相关,但EA是否通过其他机制(如调节铁代谢相关蛋白FTH1或ACSL4)影响铁死亡仍需进一步探讨。
此外,肠道微生物群的正常功能对于调节免疫系统和防御病原微生物的入侵至关重要。[33]。肠道微生物群与 CNS疾病的发展密切相关[34-37]。中风后,免疫功能显著下降,导致肠道微生物群失调。有研究表明[38],MCAO后的交感神经活动降低了肠道蠕动,并改变了肠道微生物群的组成。本研究观察到模型组大鼠的肠道微生物群组成发生了显著变化,而EA预处理能够使其恢复至正常水平。EA显著增加了厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)的丰度,并降低了变形菌门(Proteobacteria)的丰度,这一结果与先前的研究一致[39]。然而,肠道菌群与脑损伤的因果关系需通过菌群移植(FMT)或抗生素清除实验进一步验证。未来需明确肠道菌群是EA保护作用的核心介导因素,还是仅为伴随现象。
然而,本研究仍存在一些局限性。首先,研究主要聚焦于Nrf2/HO-1通路及肠道菌群调节,尚未系统探讨其他潜在信号通路(如PI3K/Akt、MAPK、NF-κB等)的参与,因此无法完全排除这些通路对结果的潜在影响。其次,尽管观察到肠道菌群组成与脑损伤的关联性,但二者间的因果关系尚未通过直接干预实验(如抗生素清除菌群或粪便微生物移植)明确验证,未来需进一步解析肠道菌群是否作为核心介导因素参与EA的神经保护作用。此外,实验设计中未设置假针组(非穴位浅刺或低强度电刺激),因此无法完全区分EA的特异性效应(穴位刺激、电参数选择)与物理刺激的非特异性作用(针刺机械刺激或电流的基础激活)。未来研究需增设假针组,以明确EA的生物学效应是否依赖于传统针灸理论中的“穴位特异性”或电刺激参数优化。未来研究可通过多通路联合分析、菌群干预实验及临床转化探索,进一步完善EA的分子机制。
综上所述,本研究发现EA预处理通过多机制协同作用,包括上调Nrf2/HO-1信号通路抑制氧化应激、调节Bax/Bcl-2平衡抑制细胞凋亡、上调GPX4和SLC7A11抑制铁死亡,以及通过肠-脑轴重塑肠道微生物群,显著缓解了大鼠CIRI。这些结果为EA预处理在 CNS保护中的作用提供了新的分子机制支持,并为其在缺血性脑血管疾病中的临床应用奠定了科学基础。
基金资助
国家自然科学基金(82060896);贵州省基础研究项目(QianKeHeJiChu-ZK [2021] General 505);贵州省教育厅青年科技人才成长项目(QianJiaoHe KY Zi [2021]210);贵州省卫健委科技基金项目(gzwkj2021-072);贵州省中医药管理局中药与民族医药科学技术研究项目(QZYY-2021-015);贵州中医药大学第一附属医院博士启动基金[GYZYYFY-BS-2021(01),GYZYYFY-BS-2021(02)]
Supported by National Natural Science Foundation of China (82060896).
参考文献
- 1. Hu XM, Michael De Silva T, Chen J, et al. Cerebral vascular disease and neurovascular injury in ischemic stroke[J]. Circ Res, 2017, 120(3): 449-71. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Alonso de Leciñana M, Egido JA, Casado I, et al. Guidelines for the treatment of acute ischaemic stroke[J]. Neurologia, 2014, 29(2): 102-22. [DOI] [PubMed] [Google Scholar]
- 3. Virani SS, Alonso A, Benjamin EJ, et al. Heart disease and stroke statistics-2020 update: a report from the American heart association[J]. Circulation, 2020, 141(9): e139-596. [DOI] [PubMed] [Google Scholar]
- 4. Herpich F, Rincon F. Management of acute ischemic stroke[J]. Crit Care Med, 2020, 48(11): 1654-63. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Zhang Y, Geng JL, Hong Y, et al. Orally administered crocin protects against cerebral ischemia/reperfusion injury through the metabolic transformation of crocetin by gut microbiota[J]. Front Pharmacol, 2019, 10: 440. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Liu JF, Zhang TH, Wang YY, et al. Baicalin ameliorates neuropathology in repeated cerebral ischemia-reperfusion injury model mice by remodeling the gut microbiota[J]. Aging, 2020, 12(4): 3791-806. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Sun J, Wang FY, Ling ZX, et al. Clostridium butyricum attenuates cerebral ischemia/reperfusion injury in diabetic mice via modulation of gut microbiota[J]. Brain Res, 2016, 1642: 180-8. [DOI] [PubMed] [Google Scholar]
- 8. 金深辉, 张明晓, 梁冬冬, 等. 电针治疗对脑缺血患者的临床分析[J]. 中国现代医生, 2017, 55(23): 73-6. [Google Scholar]
- 9. Han JQ, Liu CL, Wang ZY, et al. Anti-inflammatory properties of lipoxin A4 protect against diabetes mellitus complicated by focal cerebral ischemia/reperfusion injury[J]. Neural Regen Res, 2016, 11(4): 636-40. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. 针刺通过调节肠道微生物和抑制炎症因子释放发挥对帕金森病运动功能的改善效应[J]. J Acupunct Tuina Sci, 2022, 20(5): 339-53. [Google Scholar]
- 11. 周 伟, 汪昌参, 张 辽, 等. 电针通过恢复肠道微生物群和抑制LPS-TLR4-NF-κB轴减轻大鼠实验性类风湿性关节炎[J]. 长春中医药大学学报, 2024, 40(5): 517-22. [Google Scholar]
- 12. Zhu Y, Xiong Y, Gu Y, et al. Chiropractic therapy modulated gut microbiota and attenuated allergic airway inflammation in an immature rat model[J]. Med Sci Monit, 2020, 26: e926039. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Hong JJ, Chen J, Kan JM, et al. Effects of acupuncture treatment in reducing sleep disorder and gut microbiota alterations in PCPA-induced insomnia mice[J]. Evid Based Complement Alternat Med, 2020, 2020: 3626120. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Chang QY, Lin YW, Hsieh CL. Acupuncture and neuroregeneration in ischemic stroke[J]. Neural Regen Res, 2018, 13(4): 573-83. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Zhang QQ, Deng PY, Chen SH, et al. Electroacupuncture and human iPSC-derived small extracellular vesicles regulate the gut microbiota in ischemic stroke via the brain-gut axis[J]. Front Immunol, 2023, 14: 1107559. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Yang XC, Jin YJ, Ning R, et al. Electroacupuncture attenuates ferroptosis by promoting Nrf2 nuclear translocation and activating Nrf2/SLC7A11/GPX4 pathway in ischemic stroke[J]. Chin Med, 2025, 20(1): 4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. 陈思佳, 张安琪, 戴勤学, 等. YAP在电针预处理改善大鼠脑缺血再灌注损伤中的作用研究[J]. 中国针灸, 2021, 41(6): 651-6. DOI: 10.13703/j.0255-2930.20201108-k0003 [DOI] [Google Scholar]
- 18. Ando M, Nagata K, Takeshita R, et al. The gut lactic acid bacteria metabolite, 10-oxo- cis-6, trans-11-octadecadienoic acid, suppresses inflammatory bowel disease in mice by modulating the NRF2 pathway and GPCR-signaling[J]. Front Immunol, 2024, 15: 1374425. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. 罗 佳, 吴 宇, 刘京东, 等. 香叶醇通过调控Nrf2/HO-1途径调节氧化应激减轻大鼠脑缺血/再灌注损伤[J]. 中国药理学通报, 2024, 40(3): 431-9. DOI: 10.12360/CPB202310025 [DOI] [Google Scholar]
- 20. Lan XB, Wang Q, Liu Y, et al. Isoliquiritigenin alleviates cerebral ischemia-reperfusion injury by reducing oxidative stress and ameliorating mitochondrial dysfunction via activating the Nrf2 pathway[J]. Redox Biol, 2024, 77: 103406. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. 杨静静, 可海霞, 张海柱, 等. 桃叶珊瑚苷通过Nrf2介导的抗氧化应激减轻阿霉素诱导的心肌损伤[J]. 中国循证心血管医学杂志, 2024, 16(2): 173-6, 179. [Google Scholar]
- 22. 王 琪, 倪清蓉, 姜兆婷, 等. 抗氧化因子Nrf2对H2O2诱导的人黑素细胞氧化应激水平和抗氧化基因表达的影响[J]. 中国皮肤性病学杂志, 2022, 36(7): 744-50. [Google Scholar]
- 23. Huang MN, Yan Y, Deng ZH, et al. Saikosaponin A and D attenuate skeletal muscle atrophy in chronic kidney disease by reducing oxidative stress through activation of PI3K/AKT/Nrf2 pathway[J]. Phytomedicine, 2023, 114: 154766. [DOI] [PubMed] [Google Scholar]
- 24. Luo MW, Bao L, Xue YY, et al. ZMYND8 protects breast cancer stem cells against oxidative stress and ferroptosis through activation of NRF2[J]. J Clin Invest, 2024, 134(6): e171166. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25. Wei C, Chen XL, Chen DW, et al. Dihydromyricetin enhances intestinal antioxidant capacity of growing-finishing pigs by activating ERK/Nrf2/HO-1 signaling pathway[J]. Antioxidants, 2022, 11(4): 704. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Zhang H, Hui XR, Wang YL, et al. Angong Niuhuang Pill ameliorates cerebral ischemia/reperfusion injury in mice partly by restoring gut microbiota dysbiosis[J]. Front Pharmacol, 2022, 13: 1001422. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Kishimoto M, Suenaga J, Takase H, et al. Oxidative stress-responsive apoptosis inducing protein (ORAIP) plays a critical role in cerebral ischemia/reperfusion injury[J]. Sci Rep, 2019, 9(1): 13512. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. 谢 明, 钟 朕, 欧阳训彦, 等. 川芎嗪防治大鼠脑缺血/再灌注损伤后炎症反应与细胞凋亡的作用[J]. 解剖学报, 2021, 52(6): 845-54. DOI: 10.16098/j.issn.0529-1356.2021.06.002 [DOI] [Google Scholar]
- 29. 王 琼, 李 佳, 许辛寅, 等. 针刺对急性脑缺血大鼠昼夜节律蛋白Clock和Bmal1的影响[J]. 中华物理医学与康复杂志, 2020, 42(9): 839-42. DOI: 10.3760/cma.j.issn.0254-1424.2020.09.017 [DOI] [Google Scholar]
- 30. Su F, Yang HJ, Guo AC, et al. Mitochondrial BKCa mediates the protective effect of low-dose ethanol preconditioning on oxygen-glucose deprivation and reperfusion-induced neuronal apoptosis[J]. Front Physiol, 2021, 12: 719753. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31. Xiong F, Wei WP, Liu YB, et al. Long noncoding RNA XIST enhances cerebral ischemia-reperfusion injury by regulating miR-486-5p and GAB2[J]. Eur Rev Med Pharmacol Sci, 2021, 25(4): 2013-20. [DOI] [PubMed] [Google Scholar]
- 32. Lv Q, Niu HY, Yue LZ, et al. Abnormal ferroptosis in myelodysplastic syndrome[J]. Front Oncol, 2020, 10: 1656. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33. Li YZ, Zhu HC, Du Y, et al. Silencing lncRNA SLC16A1-AS1 induced ferroptosis in renal cell carcinoma through miR-143-3p/SLC7A11 signaling[J]. Technol Cancer Res Treat, 2022, 21: 15330338221077803. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34. Wang N, Nie H, Zhang YY, et al. Dexmedetomidine exerts cerebral protective effects against cerebral ischemic injury by promoting the polarization of M2 microglia via the Nrf2/HO-1/NLRP3 pathway[J]. Inflamm Res, 2022, 71(1): 93-106. [DOI] [PubMed] [Google Scholar]
- 35. Winek K, Meisel A, Dirnagl U. Gut microbiota impact on stroke outcome: Fad or fact[J]? J Cereb Blood Flow Metab, 2016, 36(5): 891-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36. Benakis C, Brea D, Caballero S, et al. Commensal microbiota affects ischemic stroke outcome by regulating intestinal γδ T cells[J]. Nat Med, 2016, 22(5): 516-23. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37. Winek K, Dirnagl U, Meisel A. The gut microbiome as therapeutic target in central nervous system diseases: implications for stroke[J]. Neurotherapeutics, 2016, 13(4): 762-74. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38. Houlden A, Goldrick M, Brough D, et al. Brain injury induces specific changes in the caecal microbiota of mice via altered autonomic activity and mucoprotein production[J]. Brain Behav Immun, 2016, 57: 10-20. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39. Wu WF, Sun YH, Luo N, et al. Integrated 16S rRNA gene sequencing and LC-MS analysis revealed the interplay between gut microbiota and plasma metabolites in rats with ischemic stroke[J]. J Mol Neurosci, 2021, 71(10): 2095-106. [DOI] [PubMed] [Google Scholar]


