Abstract
目的
分析并比较前列腺癌根治性放射治疗中两种体位固定方式(截石位碳纤维全身固定架与常规碳纤维人体固定架结合热塑膜)的分次间摆位误差, 并计算两种方式下的临床靶区(clinical target volume, CTV)-计划靶区(planning target volume, PTV)外扩距离(margin for planning target volume, MPTV), 以优化体位固定方式和放射治疗流程。
方法
连续性纳入2021年8月至2023年3月在北京大学第一医院接受前列腺癌根治性放射治疗的37例患者的病例资料进行回顾性分析, 按体位固定方式分为两组[A组采用截石位碳纤维全身固定架18例, 共450组锥形束CT(cone-beam computed tomography, CBCT)图像, B组采用常规碳纤维人体固定架结合热塑膜19例, 共461组CBCT图像]。所有患者均行每日锥形束CT图像引导, 采用骨配准结合手动配准方法获取左右(X轴)、头脚(Y轴)及前后(Z轴)方向上的摆位误差数据。采用独立样本t检验和Mann-Whitney U检验和卡方检验比较两组摆位误差, 计算平均摆位误差、系统摆位误差(Σ)和随机摆位误差(δ), 并利用公式MPTV=2.5Σ+0.7δ计算CTV-PTV外扩距离。
结果
两组患者在三维方向上的摆位误差差异均有统计学意义(P均 < 0.01), A组X、Y、Z轴方向误差绝对值的M (P25, P75)分别为0.40(0.20, 0.70) cm、0.50(0.30, 0.80) cm和0.35(0.20, 0.60) cm, 而B组相应数值显著降低至0.20(0.10, 0.40) cm、0.40(0.20, 0.70) cm和0.20(0.10, 0.40) cm。Mann-Whitney U检验结果显示各方向差异具有统计学意义(X轴: z=-6.86;Y轴: z=-2.76;Z轴: z=-5.71)。在摆位误差位移量≤0.5 cm的累积分布中, A组和B组的比例分别为X轴297(66.0%)和408(88.5%)(P0.01)、Y轴250(55.6%)和285(61.8%)(P=0.055)、Z轴308(68.4%)和391(84.8%)(P < 0.01)。两组的CTV-PTV外扩距离分别为X轴0.66 cm和0.35 cm, Y轴0.67 cm和0.45 cm, Z轴0.54 cm和0.42 cm。
结论
常规碳纤维人体固定架结合热塑膜能显著减少摆位误差。在X、Y、Z轴三个方向上, 截石位碳纤维全身固定架的摆位误差较常规碳纤维人体固定架结合热塑膜更大, 因此需要进一步优化其摆位流程。由于截石位碳纤维全身固定架固定方法是经会阴超声引导技术中不可或缺的体位固定方式, 未来需针对其进行深入研究和改进, 以实现更高的摆位精度。
Keywords: 前列腺癌, 锥形束CT, 摆位误差, 体位固定, 热塑膜
Abstract
Objective
To analyze and compare the interfractional setup errors between two body positioning fixation methods (lithotomy position with carbon fiber full-body fixation frame vs. conventional carbon fiber body fixation frame combined with thermoplastic membrane) in radical radiotherapy for prostate cancer, and to calculate the clinical target volume (CTV) to planning target volume (PTV) margin (MPTV) for both methods to optimize immobilization techniques and radiotherapy workflows.
Methods
A retrospective analysis was conducted on 37 consecutive patients who underwent radical prostate radiotherapy at Peking University First Hospital between August 2021 and March 2023. The patients were divided into two groups based on the immobilization method: Group A (18 patients, 450 CBCT image sets) used a carbon fiber whole-body fixator in the lithotomy position, while Group B (19 patients, 461 CBCT image sets) used a conventional carbon fiber fixator combined with a thermoplastic mask. All the patients underwent daily cone-beam computed tomography (CBCT) image guidance. Bone registration combined with manual registration was used to obtain the setup error data in the left-right (X), cranio-caudal (Y) and anterior-posterior (Z) directions. The positioning errors of the two groups were compared by using the independent sample t-test, the Mann-Whitney U test and the chi-square test. The average positioning error, systematic positioning error (Σ) and random positioning error (δ) were calculated, and the CTV-PTV extension distance was calculated by using the (MPTV=2.5Σ+0.7δ).
Results
The analysis of the setup errors in the three-dimensional direction showed significant differences between the two groups (all P < 0.01). Specifically, the median (quartile) absolute values of the errors in the X, Y, and Z directions of group A were [0.40 (0.20, 0.70) cm, 0.50 (0.30, 0.80) cm, and 0.35 (0.20, 0.60) cm], respectively. In group B, the corresponding values were significantly reduced to [0.20 (0.10, 0.40) cm, 0.40 (0.20, 0.70) cm and 0.20 (0.10, 0.40) cm]. The results of Mann-Whitney U test showed that the differences in each direction were highly statistically significant (X: z=-6.86; Y: z=-2.76; Z: z=-5.71). The cumulative distribution ratio of the setup error displacement within 0.5 cm in the X, Y, and Z directions in group A and group B were 297 (66.0%) and 408 (88.5%) (P < 0.01), 250 (55.6%) and 285 (61.8%) (P=0.055), 308 (68.4%) and 391 (84.8%) (P < 0.01), respectively. The CTV-PTV margins in three directions were X 0.66 cm in group A and 0.35 cm in group B; Y 0.67 cm and 0.45 cm; Z 0.54 cm and 0.42 cm.
Conclusion
Conventional carbon fiber human body fixator combined with thermoplastic film can significantly reduce the setup error. However, the carbon fiber whole-body fixator in the lithotomy position demonstrated larger setup errors in the X, Y, and Z directions compared with the conventional fixator combined with a thermoplastic mask, indicating the need for further workflow optimization. Given that the lithotomy position is essential for transperineal ultrasound-guided techniques, further research and improvements are required to achieve higher positioning accuracy.
Keywords: Prostate cancer, Cone-beam computed tomography, Setup error, Immobilization, Thermoplastic mask
近年来随着科技的发展和进步,肿瘤放射治疗已被广泛应用于临床,对于局限期的前列腺癌,根治性放射治疗的疗效已与手术相当[1]。为了更好地保护患者正常组织并提高靶区的照射剂量,精准的体位固定方式和图像引导技术显得尤为重要。目前,锥形束CT(cone-beam computed tomography,CBCT)是临床应用最广泛的图像引导技术,通过骨配准和软组织配准可以有效纠正分次间的摆位误差,常规采用碳纤维人体固定架结合热塑膜的方式进行体位固定。由于前列腺的位置和形态受膀胱充盈程度和患者身体活动的影响[2-3],因此,经会阴实时超声(transperineal ultrasound,TPUS)图像引导技术应运而生,TPUS图像引导技术借助可自动扫描的超声探头,能够对照射过程中器官的运动即分次内的摆位误差进行实时动态监测。然而,TPUS图像引导需要结合特定的体位固定方式(即截石位碳纤维全身固定架),由于其体位特殊且无热塑膜束缚,对于分次间的摆位误差,其实际应用效果尚需进一步验证。本研究通过分析前列腺癌根治性放射治疗患者在两种不同体位固定方式下的分次间摆位误差,即常规碳纤维人体固定架结合热塑膜与截石位碳纤维全身固定架,探讨其摆位误差及对临床靶区(clinical target volume,CTV)-计划靶区(planning target volume,PTV)外扩距离(margin for planning target volume,MPTV)的影响,为优化体位固定方式和改进放射治疗流程提供参考依据。
1. 资料与方法
1.1. 病例选择
本研究连续纳入了北京大学第一医院放射治疗科2021年8月至2023年3月接受前列腺癌根治性放射治疗并符合入组条件患者的图像数据进行回顾性分析。入组标准:放射治疗靶区为前列腺,可包含部分精囊,并根据需要加入淋巴结引流区的预防照射;患者无淋巴结或远处转移;接受每日CBCT图像引导放射治疗。排除标准:放射治疗过程中因直肠移位等原因导致更改照射野的患者或未完成全部放射治疗的患者。为尽可能减少混杂因素的干扰,本研究在病例纳入阶段严格控制了相关变量, 所有患者均接受每日图像引导,放射治疗技师团队及摆位流程标准统一,包含明确的直肠排空和膀胱充盈程度,如影像引导放射治疗(image-guided radiation therapy,IGRT)图像与定位不一致则重新准备并再次摆位。同时,研究对象限定为无淋巴结转移患者,确保配准时的高剂量靶区范围仅为前列腺。此外,对可能影响摆位误差的年龄、体重指数(body mass index,BMI)等临床因素进行了分组间的统计学比较。
1.2. 设备与材料
大孔径计算机断层扫描(computed tomography,CT)模拟机(brilliance, 飞利浦公司, 荷兰)获取患者定位图像,并将图像传输至放射治疗计划系统(treatment planning system,TPS;monaco 5.11, 医科达公司,瑞典),由医生勾画靶区和危机器官,物理师完成调强计划设计。治疗计划通过直线加速器(synergy, 医科达公司, 瑞典)进行验证并实施放射治疗。
1.3. 定位和治疗计划
本研究采用回顾性研究设计,不涉及放射治疗定位、放射治疗计划及放射治疗实施的干预。常规治疗流程CT定位时,所有患者需提前排空直肠,并在定位前30~60 min缓慢饮用400~600 mL温水,以适度充盈膀胱(200~300 mL)。定位前至少20 min通过静脉注射碘造影剂以显影膀胱。
使用截石位碳纤维全身固定架固定体位的患者定义为A组,膝托仰卧,双臂上台交叉置于头顶,平躺于特制体架上,双腿放置于腿架内,根据激光灯在患者皮肤表面标记十字线,并记录与体架刻度线的对应位置(图 1A)。
图 1.
前列腺癌放射治疗体位固定装置
Positioning and fixation devices for prostate cancer radiotherapy
A, a carbon fiber whole-body fixator in lithotomy position; B, a conventional carbon fiber human body fixator and thermoplastic film.
使用常规碳纤维人体固定架的患者定义为B组,采取仰卧位,下肢伸直,双手上举并抱肘至额头位置,通过低温热塑膜固定体位,随后选择中心点,记录体架刻度线与体模激光灯十字线的对应关系(图 1B)。
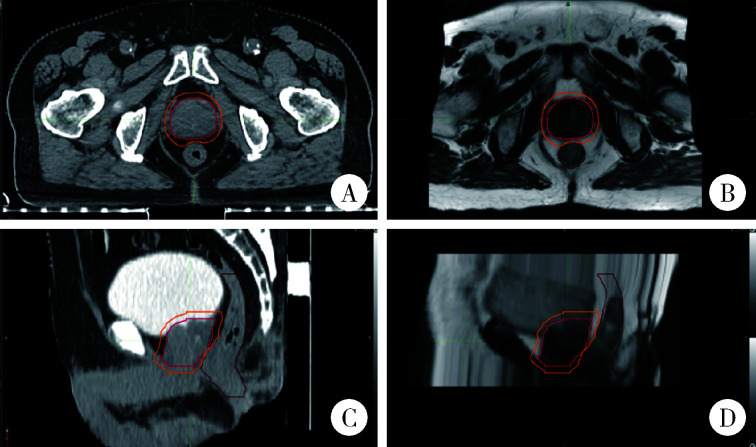
两组患者均采用常规CT扫描进行定位,扫描参数为管电压120 kV、层厚3 mm。采集到的图像传输至MIM Maestro 7.1.6(MIM)软件, 与患者既往的磁共振(magnetic resonance imaging,MRI)图像进行融合。医生在融合图像上进行靶区勾画,PTV为CTV向各个方向外扩5 mm,其中直肠前壁区域的PTV被适当收回以减少正常组织受量(图 2显示了前列腺根治性放射治疗患者的CBCT图像,其中红色线表示CTV,橙色线表示PTV,直肠侧的PTV已收回,图 2A和图 2B分别为CT的轴位图像和矢状位图像,图 2C和图 2D为MRI的轴位和矢状位图像)。所有患者的定位图像传输至Monaco治疗计划系统,由物理师完成计划设计并进行验证。
图 2.
前列腺癌放射治疗患者的定位CT与MRI图像及靶区
Localization computed tomography (CT) and magnetic resonance imaging (MRI) images and target volumes of a patient treated with definitive radiotherapy for prostate cancer
A, axial CT images; B, sagittal CT images; C, axial MRI T2WI sequence images; D, sagittal MRI T2WI sequence images.
1.4. 图像扫描及配准
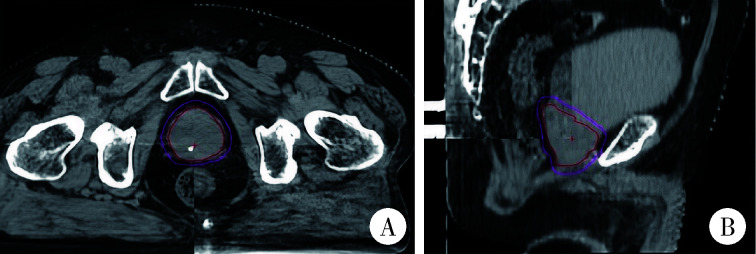
所有患者均采用每日CBCT图像引导放射治疗技术,在放射治疗前采集CBCT图像,选取感兴趣区与定位CT图像进行配准,配准首先通过骨性结构进行自动配准,然后由医生和技师根据靶区位置进行手动微调,调整时参考前列腺、直肠和膀胱的解剖关系,重点关注前列腺区域的匹配,避免直肠前壁误入靶区(图 3)。最终摆位误差结果由系统计算,包含患者实际摆位与治疗计划中心位置在左右(X轴)、头脚(Y轴)、前后(Z轴)方向上的位移误差绝对值。记录摆位误差并比较两组的误差绝对值,以评估摆位精度。
图 3.
前列腺癌放射治疗患者的CBCT匹配图像
Cone-beam computed tomography(CBCT)-matched images of patients receiving radiotherapy treatment for prostate cancer
A, axial matching images of the CBCT for the patient; B, sagittal matched images of the CBCT for the patients.
1.5. 摆位误差分析和PTV外扩边界计算
摆位误差分为系统摆位误差和随机摆位误差。依据van Herk[4]的研究方法,分别计算以下参数:(1)平均摆位误差:各患者摆位误差平均值的整体平均值;(2)系统摆位误差(Σ):各患者摆位误差平均值的标准差;(3)随机摆位误差(δ):各患者摆位误差标准差的整体平均值;(4)PTV外扩边界根据以下公式计算[4-5]:MPTV=2.5Σ+0.7δ。
1.6. 统计学分析
使用SPSS 22.0软件,计量资料依据分布特征进行描述,经正态性Shapiro-Wilk检验及方差齐性检验(Levene检验)证实符合正态分布者,以 x±s表示,组间比较使用独立样本t检验;若数据呈非正态分布,则采用M(P25,P75)表示,组间比较采用Mann-Whitney U非参数检验;分类变量以n(%)表示,组间比较采用卡方检验。所有假设检验均采用双侧检验,P < 0.05认为差异具有统计学意义。所有统计分析采用R语言进行可视化分析,绘制累积分布曲线图,展示两组数据在X轴、Y轴和Z轴方向的误差分布。
2. 结果
2.1. 一般情况
本研究连续纳入2021年8月至2023年3月北京大学第一医院在医科达Synergy直线加速器上接受前列腺癌根治性放射治疗的患者共37例, 患者中位年龄76(73,81)岁。由于部分图像回传损失,共获得A组(截石位碳纤维全身固定架)18例患者的450套CBCT图像和B组(常规碳纤维人体固定架结合热塑膜)19例患者的461套CBCT图像。
为验证两组潜在混杂变量的可比性,对年龄和BMI进行组间比较。年龄分布特征经Shapiro-Wilk正态性检验提示呈非正态分布,A组77(72.5,82.3)岁,B组74(72.0,79.0)岁,组间差异无统计学意义(z=-1.324,P=0.185)。BMI分布特征:符合正态分布,A组(24.5±3.0) kg/m2,B组(24.7± 2.8) kg/m2,组间差异无统计学意义(t=-0.209,P=0.836)。年龄和BMI两组间差异均无统计学意义(P>0.05),表明两组在影响摆位误差的关键基础特征上具有良好的可比性,为后续结果分析提供了基础保障。
2.2. 摆位误差分析
B组在X轴(左右)、Y轴(头脚)和Z轴(前后)方向上的摆位误差均显著小于A组,差异具有统计学意义(P < 0.05,表 1)。
表 1.
A组与B组摆位误差比较
Comparison of setup errors between group A and group B
| Parameters | Group A | Group B | z | P |
| Data were M(P25, P75). | ||||
| X (left-right)/cm | 0.40 (0.20, 0.70) | 0.20 (0.10, 0.40) | -6.86 | < 0.001 |
| Y (cranio-caudal)/cm | 0.50 (0.30, 0.80) | 0.40 (0.20, 0.70) | -2.76 | 0.006 |
| Z (anterior-posterior)/cm | 0.35 (0.20, 0.60) | 0.20 (0.10, 0.40) | -5.71 | < 0.001 |
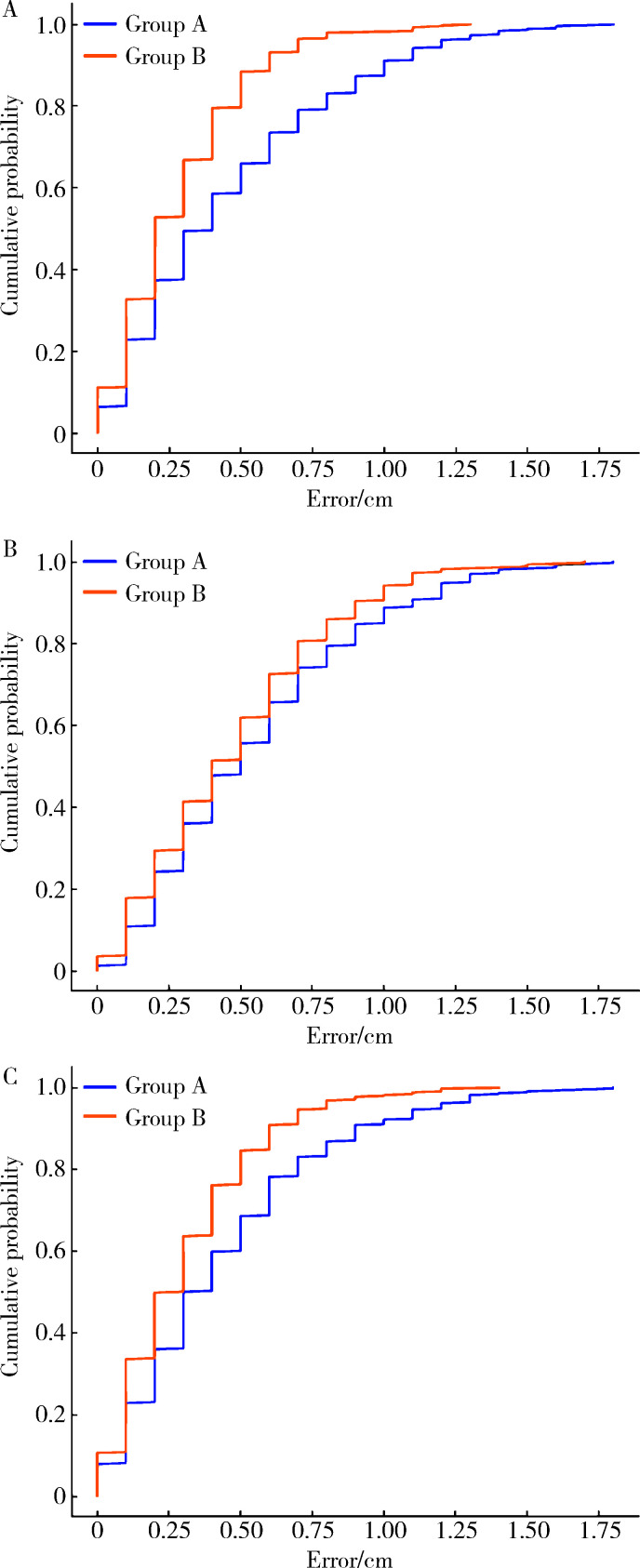
2.3. 位移误差累积分布
在X轴和Z轴方向上,B组位移误差在0.5 cm内的累积分布比例显著高于A组(P < 0.01)。Y轴方向上,B组摆位误差位移量在0.5 cm以内的累积分布比例虽有增高趋势,但差异无统计学意义(P=0.055, 表 2)。A组与B组在三个方向上的摆位误差累积分布见图 4, 可见B组在三个方向上的累积分布曲线均比A组更陡峭,即B组摆位误差数据更加集中于较小的范围,误差分布更稳定、集中。
表 2.
A组与B组不同方向摆位误差位移量在0.5 cm内的累积分布比例
Cumulative distribution proportion of setup error displacement in different directions within 0.5 cm in group A and group B
| Parameters | Group A (n=450) | Group B (n=461) | P |
| Data were n (%). | |||
| X (left-right) | 297 (66.0) | 408 (88.5) | < 0.001 |
| Y (cranio-caudal) | 250 (55.6) | 285 (61.8) | 0.055 |
| Z (anterior-posterior) | 308 (68.4) | 391 (84.8) | < 0.001 |
图 4.
A、B组摆位误差的累积分布
Cumulative distribution of setup errors in groups A and B
A, cumulative distribution probability of setup errors in the X-axis direction; B, cumulative distribution probability of setup errors in the Y-axis direction; C, cumulative distribution probability of setup errors in the Z-axis direction.
2.4. PTV外放边界
根据CTV向PTV的外放边界计算结果,B组在X轴、Y轴和Z轴方向上的外放边界均小于A组。此外,A组与B组在不同方向上的平均摆位误差、分次间摆位误差的系统误差(Σ)和随机误差(δ)的具体数值也显示出B组的摆位误差控制更优(表 3)。
表 3.
A组与B组CTV-PTV外放边界及分次间摆位误差的Σ、δ
CTV-PTV margin and inter-fractional setup Errors (Σ- and δ-clusters) in group A and group B
| Parameters | MPTV/cm | Average setup error/cm | Σ/cm | δ/cm |
| MPTV, margin for planning target volume; Σ, systematic error; δ, random error. Group A, n=450; Group B, n=461. | ||||
| X (left-right) | ||||
| Group A | 0.66 | 0.46 | 0.175 | 0.321 |
| Group B | 0.35 | 0.285 | 0.084 | 0.206 |
| Y (cranio-caudal) | ||||
| Group A | 0.67 | 0.552 | 0.178 | 0.314 |
| Group B | 0.45 | 0.48 | 0.094 | 0.311 |
| Z (anterior-posterior) | ||||
| Group A | 0.54 | 0.438 | 0.126 | 0.321 |
| Group B | 0.42 | 0.302 | 0.107 | 0.218 |
3. 讨论
本研究比较分析了常规碳纤维人体固定架结合热塑膜与截石位碳纤维全身固定架两种固定方法的分次间摆位误差,发现截石位碳纤维全身固定架在X、Y、Z轴三个方向上的摆位误差均高于常规碳纤维人体固定架结合热塑膜,在摆位时需重点关注。
随着放射治疗图像引导技术的不断更新,前列腺癌高剂量放射治疗、大分割治疗已逐渐成为一种趋势[3, 5-9],摆位误差对正常组织和靶区剂量的影响愈发重要,过大的摆位偏差可能导致部分正常组织暴露于高剂量辐射,而部分靶区剂量相对不足,从而降低肿瘤局部控制率并增加严重并发症的发生风险。目前临床上常用的体位固定方法包括热塑膜固定法、真空垫固定法和发泡胶固定法等。然而,由于前列腺在体内具有一定的形变和运动特性,为了更精确地监测放射治疗过程中分次内的运动误差,临床上采用了多种先进的图像引导技术,如X射线透视、电磁粒子转发器和经会阴四维超声图像引导技术等,其中,X射线透视和电磁粒子图像引导技术属于有创方法,需要在前列腺内植入金标或电磁粒子。而经会阴超声是一种无创监测方法,能够实时监测分次内的运动,患者更易接受,且更适合临床应用。新技术为前列腺癌的精准放射治疗提供了重要保障,也为进一步优化治疗效果奠定了基础。
由于超声探头需置于会阴部,必须采用支撑并抬高、分开双侧大腿的固定架进行体位固定。相比传统热塑膜固定方式,这种固定方式对摆位误差的影响如何,值得进一步探讨。本研究选取接受根治性放射治疗、仅照射前列腺且无转移淋巴结及淋巴结照射的患者作为研究对象,避免了因淋巴结与肠道相对位置变化所带来的影响。本研究发现,在截石位碳纤维全身固定架固定状态下,X轴、Y轴和Z轴方向的摆位误差均相对较大,其中,Y轴方向的误差在两组中均相对突出,但B组的整体误差显著小于A组。然而,在5 mm以内的误差范围分析中,B组的优势不够明显。进一步分析显示,X轴方向误差较大的原因可能与未使用热塑膜固定相关,由于体表皮肤及软组织松弛以及髋关节活动度较高,固定效果受限。Y轴方向误差较大的原因可能与呼吸幅度及内脏运动范围的增加有关。Z轴方向误差较大可能是由于截石位固定需要为超声探头预留空间,双腿置于腿架上时腰骶部与体架的贴合度较低,从而导致Z轴方向的位移变化。结合数据分析,本课题组针对两种不同摆位方式的患者推荐了相应的MPTV值,以优化治疗靶区的精准性,从而提供更精准的治疗范围。
研究认为放射治疗体位误差达到5 mm疗效会下降18.4%[5, 10-11];根据本文数据结果,两种体位固定方式均存在误差超出5 mm的情况,其中Y轴超出比例较为显著。因此,针对Y轴方向的摆位误差问题,有必要进一步优化解决方案。这表明,精准的体位固定结合每日IGRT等图像引导技术,对于确保靶区剂量覆盖及降低正常组织副反应至关重要[12]。借助每日IGRT技术,不仅可以有效控制摆位误差,还能够适当缩小CTV到PTV的扩展范围,从而实现更精准、更安全的治疗效果。
前列腺癌常规分割与大分割调强放疗比较研究协作组(Conventional or Hypofractionated High-dose Intensity-modulated Prostate Radiotherapy Collaborative Group,CHHiP)曾对前列腺癌PTV外扩边界及图像引导放射治疗进行随机分组研究,研究比较了标准PTV外扩边界与减少PTV外扩边界结合每日影像引导放射治疗的方法,并评估其对急性和晚期盆腔副作用的影响,对于肠道毒性,无图像引导放射治疗组、标准PTV外扩+每日影像引导放射治疗组和减少PTV外扩+每日影像引导放射治疗组的2年报告率分别为8.3%、8.3%和5.8%;对于尿路系统毒性,对应数据为8.4%、4.6%和3.9%,三组疗效差异无统计学意义,说明每日CBCT可支持减少PTV外扩边界的放射治疗顺利进行[13]。北京大学第一医院放射治疗科长期以来一直采用每日CBCT图像引导技术,配准时重点对准前列腺及直肠前壁,因此在PTV外扩边界上,将直肠侧的PTV收至直肠前壁[14]。然而,由于直肠充盈程度的变化,常导致Z轴方向位移较大。在此情况下,需更加注意减少Z轴方向摆位误差,可通过采用热塑膜固定方式优化定位效果。
此外,自适应放射治疗(adaptive radiotherapy, ART)作为一种能够动态调整计划以适应患者解剖结构变化的技术,在前列腺癌放射治疗中展现出广阔的应用前景[15],其可结合每日CBCT或MRI图像,实时评估靶区和危及器官的位置变化,按需调整治疗计划,从而实现“量体裁衣”式的精准治疗。对于截石位这样因摆位限制导致误差偏大的体位,ART有望在不改变治疗方案的前提下提高适应性,降低误差积累,优化整体治疗效果。
本研究存在一定局限性,主要表现为样本量较小且为回顾性研究设计。期待未来通过更大样本量的前瞻性研究进一步验证本研究结论,以提升结果的可靠性与普适性。
综上所述,常规碳纤维人体固定架结合热塑膜的固定方法在减少分次间摆位误差方面优于截石位碳纤维全身固定架。然而,经会阴超声能够监测门控前列腺癌放射治疗过程中的分次内运动误差,其体位固定方法仍有进一步优化的空间。结合每日IGRT技术,经会阴超声和改良的体位固定方法可以更加精准地实现对前列腺癌放射治疗分次间与分次内的摆位误差与运动误差的监测与纠正,从而进一步提升治疗效果。
Funding Statement
国家重点研发计划项目(2022YFC2404606) 和北京市自然科学基金(L232126)
Supported by the National Key Research and Development Program of China (2022YFC2404606) and the Beijing Natural Science Foundation (L232126)
Footnotes
利益冲突 所有作者均声明不存在利益冲突。
作者贡献声明 刘杰:撰写论文;马茗微:提出研究思路,总体把关和审定论文;王庆安、石明、尹金鹏、王占平、申静涛:收集数据,修改论文;高献书:技术指导,修改论文。
References
- 1.Wolff RF, Ryder S, Bossi A, et al. A systematic review of randomised controlled trials of radiotherapy for localised prostate cancer. Eur J Cancer. 2015;51(16):2345–2367. doi: 10.1016/j.ejca.2015.07.019. [DOI] [PubMed] [Google Scholar]
- 2.Butler WM, Merrick GS, Reed JL, et al. Intrafraction displacement of prone versus supine prostate positioning monitored by real-time electromagnetic tracking. J Appl Clin Med Phys. 2013;14(2):4141. doi: 10.1120/jacmp.v14i2.4141. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Daşu A. Is the alpha/beta value for prostate tumours low enough to be safely used in clinical trials. Clin Oncol (R Coll Radiol) 2007;19(5):289–301. doi: 10.1016/j.clon.2007.02.007. [DOI] [PubMed] [Google Scholar]
- 4.van Herk M. Errors and margins in radiotherapy. Semin Radiat Oncol. 2004;14(1):52–64. doi: 10.1053/j.semradonc.2003.10.003. [DOI] [PubMed] [Google Scholar]
- 5.Pommer T, Oh JH, Rosenschöld PMA, et al. Simulating intrafraction prostate motion with a random walk model. Adv Radiat Oncol. 2017;2(3):429–436. doi: 10.1016/j.adro.2017.03.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Aluwini S, Pos F, Schimmel E, et al. Hypofractionated versus conventionally fractionated radiotherapy for patients with prostate cancer (HYPRO): Late toxicity results from a randomised, non-inferiority, phase 3 trial. Lancet Oncol. 2016;17(4):464–474. doi: 10.1016/S1470-2045(15)00567-7. [DOI] [PubMed] [Google Scholar]
- 7.Aluwini S, Pos F, Schimmel E, et al. Hypofractionated versus conventionally fractionated radiotherapy for patients with prostate cancer (HYPRO): Acute toxicity results from a randomised non-inferiority phase 3 trial. Lancet Oncol. 2015;16(3):274–283. doi: 10.1016/S1470-2045(14)70482-6. [DOI] [PubMed] [Google Scholar]
- 8.Dearnaley D, Syndikus I, Mossop H, et al. Conventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol. 2016;17(8):1047–1060. doi: 10.1016/S1470-2045(16)30102-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.King CR, Freeman D, Kaplan I, et al. Stereotactic body radiotherapy for localized prostate cancer: Pooled analysis from a multi-institutional consortium of prospective phase Ⅱ trials. Radio-ther Oncol. 2013;109(2):217–221. doi: 10.1016/j.radonc.2013.08.030. [DOI] [PubMed] [Google Scholar]
- 10.马 广栋, 洪 莉. 宫颈癌的图像引导放疗研究综述. 中国医疗设备. 2018;33(5):117-120, 129. [Google Scholar]
- 11.于 松茂, 孟 繁里, 康 加阜, et al. 真空垫制作方式对肺癌立体定向放疗摆位精度影响研究. 医疗卫生装备. 2019;40(12):33-35, 40. [Google Scholar]
- 12.马 茗微, 王 淑莲, 覃 仕瑞, et al. 面罩及乳腺托架固定下乳腺癌保乳术后放疗锁骨上下区摆位误差分析. 中华放射肿瘤学杂志. 2019;28(3):217–221. [Google Scholar]
- 13.Murray J, Griffin C, Gulliford S, et al. A randomised assessment of image guided radiotherapy within a phase 3 trial of conventional or hypofractionated high dose intensity modulated radiotherapy for prostate cancer. Radiother Oncol. 2020;142:62–71. doi: 10.1016/j.radonc.2019.10.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.高 研, 高 献书, 马 茗微, et al. 前列腺癌放疗时CBCT使用频率和匹配策略的剂量学分析. 中华放射肿瘤学杂志. 2024;33(8):733–739. [Google Scholar]
- 15.Ghilezan M, Yan D, Martinez A. Adaptive radiation therapy for prostate cancer. Semin Radiat Oncol. 2010;20(2):130–137. doi: 10.1016/j.semradonc.2009.11.007. [DOI] [PMC free article] [PubMed] [Google Scholar]