RESUME
L’infection à Helicobacter pylori est la maladie infectieuse la plus répondue dans le monde. Elle est associée à la maladie ulcéreuse duodénale et gastrique et au risque de survenue de néoplasie gastrique. La prise en charge de l’infection à Helicobacter pylori représente actuellement un vrai challenge pour le clinicien, vu la perpétuelle augmentation du taux de résistance de Helicobacter pylori aux différents antibiotiques. Nous présentons dans ce consensus, des recommandations adaptées au contexte tunisien des indications de la recherche de l’infection à Hélicobacter pylori, des indications de l’utilisation des différents moyens diagnostiques ainsi que la stratégie thérapeutique de la prise en charge de l’infection à Helicobacter pylori.
ABSTRACT
Helicobacter pylori infection is the most common infectious disease worldwide. It is associated with duodenal and gastric ulcer disease and the risk of gastric neoplasia. The management of helicobacter pylori infection currently represents a real challenge for clinicians, given the ever-increasing rate of resistance of Helicobacter pyolori to various antibiotics. In this consensus document, we present recommendations adapted to the Tunisian context, including indications for the detection of helicobacter pylori infection, indications for the use of different diagnostic methods, and a therapeutic strategy for the management of Helicobacter pylori infection.
INTRODUCTION-MÉTHODOLOGIE
Helicobacter pylori (H. pylori) est un bacille Gram négatif, flagellé qui a été identifié pour la première fois en 1982 par Warren et Marshall (1). L’infection par H. pylori peut être responsable de la gastrite associée à H. pylori, de la maladie ulcéreuse duodénale et gastrique, du lymphome du « mucosa-associated lymphoid tissue » (MALT) et de l’adénocarcinome gastrique. H. pylori a été identifié comme carcinogène du groupe 1 par l’Agence Internationale de Recherche sur le Cancer depuis 1994 (2).
L’identification de l’infection par H. pylori comme véritable maladie infectieuse, implique de plus en plus un traitement systématique de cette infection même pour les formes asymptomatiques. Cependant, l’éradication de H.pylori représente actuellement un vrai challenge pour le clinicien, vue l’augmentation des taux de résistance primaire et secondaire aux différents antibiotiques. Le dernier consensus Maastricht VI (3) recommande d’adapter le choix des différents schémas thérapeutiques aux taux de résistance locale et dans la mesure du possible aux taux de résistance individuelle en cas de haute résistance aux différents antibiotiques notamment la clarithromycine. Le dernier consensus tunisien détaillant la prise en charge de l’infection à H. pylori dans le cadre de la maladie ulcéreuse gastroduodénale non compliquée de l’adulte (4) remonte à l’année 2006. D’où le besoin d’établir une actualisation, adaptée au contexte tunisien, des recommandations en fonction de l’évolution des données épidémiologiques et thérapeutiques.
Dans ce cadre, la Société Tunisienne de Gastro-Entérologie (STGE), en collaboration avec la Société Tunisienne de pédiatrie et de Microbiologie, ont élaboré ce consensus d’experts de la prise en charge de l’infection par helicobacter pylori pour homogénéiser les pratiques professionnelles des médecins de famille et des médecins spécialistes en gastroentérologie. Le groupe de travail a inclus des experts de mode d’exercice libéral et hospitalo-universitaire exerçant dans différentes régions de la Tunisie.
Pour répondre à cet objectif, le comité de rédaction s’est proposé de répondre aux questions suivantes :1/ Quelle est l’épidémiologie de l’infection par Helicobacter en Tunisie ? 2/Quand faut-il chercher une infection par Helicobacter pylori ? 3/ quel est le moyen diagnostique de l’infection par Helicobacter pylori le plus approprié pour chaque situation clinique ? 4/ Quelle est la stratégie thérapeutique empirique et guidée par la résistance aux antibiotiques, adaptée au contexte tunisien ?
Pour répondre à ces questions, les experts ont analysé les données de la littérature et rédigé le document sous la direction du président du groupe de travail et de 3 coordinateurs responsables des sous-groupes. La recherche bibliographique a privilégié les recommandations thérapeutiques, les conférences de consensus, les essais cliniques, les méta-analyses et les revues de synthèse. Les recommandations résultent d’un accord professionnel au sein de chaque groupe puis entre les différents groupes. Le texte élaboré a été soumis par la suite à un groupe de lecture pour évaluation. La validation finale était réalisée au cours de plusieurs séances plénières, en présence des coordinateurs de groupes, le comité de lecture et les sociétés impliquées.
EPIDÉMIOLOGIE
Prévalence
Dans le monde : Selon l’organisation mondiale de santé, plus de la moitié de la population mondiale est infectée par H. pylori. Le taux d’infection varie en fonction de nombreux critères tels que l’âge, l’origine géographique et les conditions socio-économiques. Sa prévalence est plus importante dans les pays en voie de développement où elle peut atteindre 80 à 90 % de la population des adultes contre 30-50% dans les pays développés (5).
En Tunisie: Dans des études tunisiennes les plus anciennes, la prévalence de l’infection à H. pylori chez les adultes variait entre 56 et 82,7% pour les sujets asymptomatiques et entre 52 et 98,7% pour les patients symptomatiques (6 -9). Concernant la population pédiatrique, Siai et al ont noté une séroprévalence de l’infection à H. pylori de 51,4 % chez 1055 enfants scolarisés en première année primaire (10). Dans une étude épidémiologique, menée en 2020 (données non encore publiées), incluant 1800 donneurs de sang répartis dans différents centres (Tunis, Sfax, Sousse, Gafsa et Jendouba), les anticorps anti- H. pylori (Immunoglobulines G) étaient positifs chez 71,7% des sujets. Le taux de séropositivité variait entre 52,1 et 85,1% en fonction des régions. Dans une autre étude multicentrique menée en 2022 sous l’égide de la STGE, l’infection à H. pylori a été recherchée chez des patients symptomatiques nécessitant une endoscopie digestive haute. La recherche a été effectuée grâce à différents tests (test à l’uréase, examen direct, test PCR et examen antomopathologique). Sur les 1061 patients inclus, l’infection à H pylori a été diagnostiquée grâce au test d’amplification génique (PCR) dans 60,9 %, l’examen anatomopathologique dans 57,2 %, le test à l’uréase dans 40,5 % et l’examen direct dans 32,1% (données non encore publiées).
Les modes de transmission et les facteurs de risque
Le réservoir de H. pylori est exclusivement humain, au niveau de l’estomac et du duodénum. La transmission est interhumaine et essentiellement intra familiale. L’infection se fait le plus souvent à la petite enfance et persiste à vie en l’absence de traitement d’éradication. Plusieurs voies de transmission ont été identifiées : - La transmission oro-fécale: elle représente le mode de contamination le plus fréquent, essentiellement par « les mains sales ». L’infection par l’eau contaminée reste controversée. En effet, plusieurs études ont démontré que H. pylori résisterait aux différents processus de traitement des eaux, ce qui pourrait représenter une source de contamination (11-12). -La transmission oro-orale: plusieurs études ont démontré que H. pylori pourrait coloniser la cavité buccale au niveau de différents sites (plaque dentaire, salive, canaux radiculaires, langue, amygdales...). De ce fait, les principaux facteurs de risque de l’infection à H. pylori sont liés à la promiscuité et aux mauvaises conditions socio-économiques et hygiéniques.
LES INDICATIONS DE LA RECHERCHE ET DE L’ÉRADICATION DE H. PYLORI
H. pylori est incriminé dans la genèse de multiples pathologies digestives et extra- digestives (13, 14). Les indications de la recherche et de l’éradication de H. pylori ont été bien définies par le consensus de Maastricht VI (3). Elles ont été adaptées au contexte tunisien et détaillées dans ce chapitre selon leur niveau de preuve. Les différentes indications sont résumées dans le tableau 1.
Tableau 1 : Indications de la recherche et de l’éradication de H. pylori selon leur niveau de preuve .
|
Indications |
Niveau de preuve |
|
|
Les indications avec un haut niveau de preuve
La maladie ulcéreuse duodénale et gastrique
Le rôle de H. pylori dans la maladie ulcéreuse duodénale et gastrique est bien établi. La prévalence de H. pylori, chez les patients ayant une gastrite était de 89% dans une étude Tunisienne publiée en 1995 par Djmel et al (6). Dans une autre étude menée par Ben Ammar et al, la prévalence de H. pylori, chez les patients atteints d’un ulcère duodénal, était de 98,7% en 2002 (7). Cependant, dans une étude récente multicentrique menée par la STGE, la prévalence de l’infection à H. pylori en cas d’ulcère duodénal était de 63,23% (données non encore publiées). Ainsi, la réalisation de biopsies gastriques est recommandée en cas de maladie ulcéreuse duodénale et gastrique, afin de rechercher une infection par H. pylori et évaluer les lésions de gastrite et les lésions pré néoplasiques associées (3). En cas d’ulcère gastrique, il est recommandé de réaliser aussi des biopsies au niveau des berges de l’ulcère, à la recherche de signes de malignité.
L’éradication de H. pylori permet de cicatriser l’ulcère duodénal et gastrique et permet de prévenir la survenue de récidive et de complications (14, 15 ).
Le Lymphome de MALT
H. pylori est la principale cause du lymphome de MALT. La recherche d’une infection par H. pylori est indiquée chez tous les patients. Elle se fait en premier lieu par l’étude anatomopathologique. En cas d’absence de mise en évidence de H. pylori, la réalisation d’une sérologie de H. pylori est indiquée. Le traitement d’éradication de H. pylori est indiqué indépendamment du statut positif ou négatif de H. pylori et du stade évolutif de la maladie (3). Il constitue le traitement de première ligne pour les stades localisés. Des anomalies génétiques telles que la translocation t (11, 18) sont une cause de résistance au traitement d’éradication (16).
La prise d’anti-inflammatoires non stéroïdiens (AINS) ou d’aspirine à faible dose
L’infection par H. pylori augmente le risque de survenue de maladie ulcéreuse duodénale et gastrique en cas de prescription au long cours d’AINS ou d’aspirine à faible dose. Avant de débuter un traitement au long cours par les AINS ou l’aspirine, la recherche et l’éradication de H. pylori est obligatoire pour les patients ayant des antécédents de maladie ulcéreuse duodénale et gastrique et elle est recommandée dans les autres cas (3).
La dyspepsie chronique
La gastrite à H. pylori peut être responsable de la dyspepsie chronique. L’objectif de l’éradication de H. pylori, serait d’améliorer les symptômes liés à la dyspepsie, de prévenir la maladie ulcéreuse duodénale et gastrique et le cancer gastrique. Le diagnostic de dyspepsie fonctionnelle ne peut être retenu que si les symptômes cliniques persistent 6 à 12 mois après l’éradication de H. pylori (13, 14).
Devant toute dyspepsie chronique, il est recommandé de réaliser une endoscopie oeso- gastroduodénale (EOGD) avec biopsies gastriques systématiques à la recherche d’une infection à H. pylori. Ceci permettra de classer la gastrite et de ne pas passer à côté de lésions pré-néoplasiques ou néoplasiques.
Les indications avec un niveau de preuve moyen
Les sujets à risque de développer un cancer gastrique
La recherche et l’éradication de H. pylori s’avère nécessaire dans le groupe de sujets à risque de développer un cancer de l’estomac notamment : - Les personnes ayant des antécédents familiaux de cancer gastrique au premier degré - Les personnes remplissant les critères du syndrome de Lynch - Les personnes ayant eu une résection gastrique partielle pour cancer gastrique - Les personnes ayant eu une résection endoscopique d’un cancer gastrique superficiel - Les personnes ayant une atrophie gastrique, une métaplasie intestinale ou une dysplasie gastrique. Le risque de cancer gastrique est corrélé au degré et à l’étendue de ces lésions. En effet, même après éradication de H. pylori, la surveillance endoscopique est recommandée selon un rythme dicté par les classifications OLGA et OLGIM (17).
L’anémie ferriprive inexpliquée
L’infection par H. pylori est un facteur de risque de l’anémie ferriprive. Les mécanismes évoqués sont la captation du fer par la bactérie pour assurer sa croissance, la malabsorption de la vitamine C, l’augmentation de l’hepcidine due à l’inflammation chronique, l’hypochlorhydrie et le saignement occulte par les ulcérations gastroduodénales. Il est recommandé de chercher systématiquement et de traiter l’infection par H. pylori pour tout patient présentant une anémie ferriprive avec un bilan étiologique négatif (3, 18 , 19).
La carence en vitamine B12 sans cause retrouvée
La recherche de H. pylori est recommandée en cas de carence en vitamine B12 sans cause évidente. En effet, l’infection chronique par H. pylori pourrait être responsable d’une malabsorption vitaminique notamment la vitamine B12. Les mécanismes sont l’atrophie fundique sévère et l’hypochlorhydrie qui s’interposent à l’absorption de la cobalamine (14, 20).
Le purpura thrombopénique idiopathique (PTI)
Différentes études ont montré que l’éradication de H. pylori chez les patients atteints de PTI était associée à une augmentation du taux de plaquettes ( 21). Par conséquent, il est recommandé de rechercher et traiter une infection à H. pylori chez les patients atteints de PTI.
Les indications à faible niveau de preuve
Le traitement par les inhibiteurs de la pompe à protons (IPP) au long cours
Le traitement par IPP au long cours est défini par une durée de prescription dépassant les 6 mois. Au fait, les IPP modifient la disposition de la gastrite à H. pylori d’une pangastrite ou une gastrite prédominante au niveau de l’antre vers une pangastrite prédominante au niveau du fundus. Cet effet est obtenu quelques jours à quelques semaines après le début du traitement. Etant donné que la gastrite fundique expose au risque d’atrophie, de métaplasie intestinale et de cancer gastrique, il est recommandé de rechercher et d’éradiquer H. pylori avant de débuter un traitement par IPP au long cours (13).
Avant une chirurgie bariatrique
Il est recommandé de rechercher une infection à H. pylori chez les patients candidats à une chirurgie bariatrique par by-pass qui isole une partie de l‘estomac et empêche sa surveillance endoscopique ultérieure (17).
Autres pathologies probablement associées à H. pylori
L’association de l’infection à H. pylori avec de nombreuses affections digestives et extradigestives reste encore débattue. Il s’agit notamment de maladies dermatologiques (rosacée, alopécie, psoriasis, urticaire chronique, maladies bulleuses auto-immunes), cardiovasculaires (athérosclérose, purpura rhumatoïde), hématologiques (neutropénies auto- immunes, syndromes myéloprolifératifs, syndrome des antiphospholipides), digestives (cancers coliques et hépatobiliaires), métaboliques (syndrome métabolique, diabète de type 2 et dénutrition), neurologiques (maladie de Parkinson, démence, maladie d’Alzheimer, sclérose en plaques, encéphalopathie hépatique), obstétricales (hypotrophie fœtale), oculaires (choriorétinite séreuse centrale) et rénales (aggravation des néphropathies chroniques) (17,22). Le niveau de preuve des données de la littérature ne permet pas actuellement de recommander la recherche et l’éradication systématique de H. pylori chez les patients présentant ces pathologies.
LES MÉTHODES DIAGNOSTIQUES DE L’INFECTION À H. PYLORI
Les méthodes invasives
Les méthodes invasives nécessitent la pratique d’une endoscopie oeso-gastroduodénale(EOGD) avec biopsies gastriques. Celles-ci sont idéalement réalisées au moins 2 semaines après l’arrêt d’un traitement par IPP et au moins 4 semaines après l’arrêt d’un traitement par des antibiotiques, afin d’améliorer la rentabilité diagnostique. Leur sensibilité est diminuée en cas d’hémorragie digestive haute et en cas d’atrophie gastrique étendue. Les méthodes invasives incluent l’examen anatomopathologique, la culture, la PCR et le test rapide à l’uréase (tableau 2).
Tableau 2 : Méthodes diagnostiques invasives de l’infection à H. pylori .
|
diagnostiques |
Avantages |
Inconvénients |
|---|---|---|
|
Examen anatomopathologique |
|
|
|
Test rapide à l’uréase |
|
|
|
Culture |
|
|
|
PCR temps réel |
|
|
L’examen anatomopathologique
L’étude anatomopathologique des biopsies gastriques est l’examen le plus fréquemment utilisé pour la détection de l’infection à H. pylori, avec une sensibilité de 95 % et une spécificité de 98%. Cet examen a l’avantage de diagnostiquer et de classer la gastrite associée à H. pylori (23). La présence d’une gastrite chronique active est un signe indirect de l’infection à H. pylori.
Selon le système de Sydney, cinq biopsies doivent être réalisées : 2 antrales (petite et grande courbure), 2 fundiques (petite et grande courbure) et une au niveau de l’angle de la petite courbure gastrique (24). Il est préférable que ces biopsies soient mises dans des flacons séparés (un flacon pour les fragments fundiques et un autre flacon pour les fragments antraux et celui de l’angle de la petite courbure).
L’examen repose sur l’identification de la bactérie. Plusieurs colorations sont disponibles pour la mise en évidence de H. pylori telles que la coloration à l’hématoxyline-éosine, Giemsa, Warthine-Starry, la coloration de H. pylori silver, toluidine blue, acridine orange, McMullen, Genta, Dieterle. La coloration de Giemsa est la plus utilisée dans la pratique courante. Sa spécificité était de 100% et sa sensibilité de 80,4% dans l’étude de Shukla et al ( 25). L’immunohistochimie (IHC) permet d’améliorer la détection de H. pylori avec une spécificité et une sensibilité de 100% (25). En effet, elle détecte les formes coccoïdes de H. pylori qui sont fréquentes après une cure d’éradication de H. pylori et elle permet aussi de poser le diagnostic en cas d’une faible densité bactérienne (8, 13, 26 ).
Le test rapide à l’uréase
Le test à l’uréase est utile pour un diagnostic rapide de l’infection à H. pylori, en salle d’endoscopie. Il est moins sensible et moins spécifique que l’examen anatomopathologique.
Ce test est fondé sur l’activité uréase de la bactérie, qui rend alcalin un milieu riche en urée. Il se base sur la mise de deux fragments biopsiques au contact de l’urée et d’un réactif (indicateur de pH) qui change de couleur en présence d’ammoniaque (13).
La sensibilité de ce test peut diminuer en cas de faible densité bactérienne et chez les enfants âgés de moins de cinq ans (23). Sa spécificité peut être diminuée en présence d’autres bactéries productrices d’uréase (Proteus mirabilis, Klebsiella pneumoniae, Citrobacter freundii, Enterobacter cloacae, Staphylococcus aureus…) avec un risque de faux positifs (27).
La négativité de ce test n’exclut pas une infection active à H. pylori et son utilisation n’est pas recommandée pour le contrôle de l’éradication. Ce test est de moins en moins recommandé à travers le monde. Actuellement il n’est plus recommandé en France à cause de l’absence de prise en charge et de l’utilisation fréquente d’IPP lors de la réalisation de l’endoscopie digestive haute (28). Son utilisation est réservée aux cas où les autres moyens diagnostiques ne sont pas disponibles.
La culture de H. pylori
La culture est la méthode de référence de détection de H. pylori. L’intérêt de la culture est principalement l’étude de la sensibilité de H. pylori à tous les antibiotiques à savoir l’amoxicilline, la clarithromycine, la lévofloxacine, la tétracycline et le métronidazole. Sa spécificité est de 100 % et sa sensibilité est de 76-90 %, lorsqu’elle est réalisée dans des conditions optimales (29). Pour augmenter la rentabilité diagnostique de cette méthode, il est nécessaire de prélever quatre fragments biopsiques (deux antraux et deux fundiques) qui seront mises dans un flacon stérile contenant du sérum physiologique. Le prélèvement doit être acheminé rapidement au laboratoire sinon utiliser un milieu de transport spécifique (ex : Portagerm Pylori®).
Les tests moléculaires
L’amplification génique par réaction en chaîne par polymérase (PCR) permet de détecter H. pylori sur les biopsies gastriques et de déterminer les principales mutations impliquées dans la résistance à la clarithromycine. La PCR permet un diagnostic rapide et sûr de l’infection à H. pylori avec une sensibilité de 91% et une spécificité de 97% (30). Les conditions de transport sont moins contraignantes et le prélèvement peut être conservé à -80°C pour une étude ultérieure. La PCR en temps réel permet la détection du gène cible 23 S de H. pylori. Elle permet également de détecter la résistance à la clarithromycine avec trois mutations connues comme associées à cette résistance.
Les méthodes non invasives
Il s’agit de la sérologie, du test respiratoire et de la détection d’antigénique dans les selles. Les deux dernières détectant une infection active et leur sensibilité est diminuée par la prise d’IPP et d’antibiotiques (tableau 3).
Tableau 3 : Méthodes diagnostiques non invasives de l’infection à H. pylori .
|
Méthodes diagnostiques |
Avantages |
Inconvénients |
|---|---|---|
|
Sérologie |
|
|
|
Test respiratoire |
|
|
|
Antigène de H. pylori dans les selles |
|
|
La sérologie de H. pylori
La sérologie détecte les anticorps Ig G spécifiques de H. pylori dans le sérum. La recherche des anticorps spécifiques dans la salive ou les urines n’est pas indiquée du fait du faible taux des anticorps à ce niveau (13). Le test ELISA présente la meilleure sensibilité et spécificité dépassant les 90% (31).
Etant donné les différences régionales en termes de prévalence et de souches de H. pylori, le développement de kits de sérologie de H. pylori devrait idéalement être fait en utilisant des souches locales de H. pylori et des titres locaux doivent être établis. Tous les kits de sérologie de H. pylori doivent être validés localement (13). Ceci n’a pas été réalisé en Tunisie.
Les principaux avantages de la sérologie de H. pylori sont : son faible coût, sa large disponibilité et la rapidité de sa réalisation, mais elle ne permet pas de contrôler l’éradication puisque la séropositivité peut persister des mois voire des années après l’éradication de la bactérie (32-34). Ses résultats ne sont pas perturbés par la prise d’IPP ou d’antibiotiques.
Elle est utile pour le diagnostic positif quand l’inoculum bactérien est faible : ulcère hémorragique, gastrite atrophique, lymphome de MALT et carcinome gastrique (13). Elle trouve aussi sa place dans les études épidémiologiques.
Le test respiratoire à l’urée marquée
Il détecte une infection active par la mise en évidence de l’activité uréase de H. pylori. En présence de H. pylori, l’ingestion d’urée marquée par un isotope non radioactif du carbone est suivie du rejet dans l’air expiré de CO2 marqué qui peut être quantifié.
On distingue 2 types de test respiratoire à l’urée : marqué au C13 (13C-UBT) et marqué au C14 (14C UBT). Le 13C-UBT est la meilleure approche pour diagnostiquer l’infection à H. pylori en raison de sa simplicité et de sa haute précision. Le 14C UBT ne peut pas être utilisé chez les enfants et la femme enceinte en raison du risque d’irradiation (35, 36). Les deux méthodes avaient une performance comparable avec une sensibilité variant entre 95 et 97% et une spécificité variant entre 91 et 95% (37 , 38). Le test respiratoire est actuellement considéré comme le test de référence pour le contrôle de l’éradication, sous réserve de sa réalisation au moins 4 semaines après l’arrêt des antibiotiques et au moins deux semaines après l’arrêt d’un traitement par IPP (13, 39). La prise d’anti-H2 influence peu le résultat du test (un arrêt de 48 heures est recommandé). Les antiacides ne modifient pas la sensibilité du test respiratoire. Sa sensibilité est diminuée en cas d’ulcère gastrique ou duodénal compliqué d’hémorragie, de lymphome de MALT gastrique et d’atrophie gastrique ou de métaplasie intestinale étendue (40-43).
La recherche de l’antigène de H. pylori dans les selles
La recherche de l’antigène de H. pylori est considérée comme une alternative pour le diagnostic positif de l’infection à H. pylori surtout chez les enfants ainsi que pour le contrôle de l’éradication (44, 45).
Ce test est réalisé sur un échantillon de selles fraiches ou conservées au frais au maximum 24 heures et recueillies sur un pot stérile sinon congelées à -20°C ou -80°C. L’utilisation des anticorps monoclonaux sur immuno-chromatographie est la méthode la plus performante pour le diagnostic et le contrôle d’éradication de H. pylori avec une sensibilité variant entre 86 et 91,6 % et une spécificité variant entre 92 et 98,4 % (20, 21, 46-50). La sensibilité de ce test est diminuée en cas de faible densité de H. pylori dans l’estomac et une faible charge dans les selles, situation qu’on voit lors de l’utilisation de sels de bismuth, d’IPP ou d’antibiotiques et lors de l’utilisation de selles non moulées ou aqueuses (51, 52). Le non- respect des conditions de prélèvement et de conservation peut influencer la sensibilité de ce test (53).
Une synthèse des différentes méthodes diagnostiques et les indications de leurs utilisations est détaillée dans le tableau 4
Tableau 4 : Synthèse des indications des moyens diagnostiques de l’infection à H. pylori .
| Méthode | Recherche directe de H. pylori | Diagnostic initial | Contrôle d’éradication |
|---|---|---|---|
| Non invasives |
|
Non | Oui*lymphome, cancer gastrique, HDH |
| Oui | Oui | ||
| Non | Oui | ||
| Invasives |
|
Oui | Oui |

LA PRISE EN CHARGE THÉRAPEUTIQUE DE L’INFECTION À H. PYLORI
Vu que la Tunisie est une région de haute résistance à la clarithromycine, il est souhaitable de proposer aux patients des schémas thérapeutiques guidés par le taux de résistance individuelle aux antibiotiques. Ce traitement à la carte permet de diminuer le taux de résistance secondaire, de diminuer la durée et le cout du traitement ainsi que le nombre d’antibiotiques utilisés. On a proposé dans cette partie deux stratégies thérapeutiques : une stratégie empirique et une stratégie guidée par la sensibilité individuelle aux antibiotiques.
Moyens thérapeutiques
Pour chaque médicament, on a mentionné seulement les interactions et les associations contre indiquées avec les médicaments les plus fréquemment utilisés. Pour plus d’information, consulter le site https://ansm.sante. fr/documents/reference/thesaurus-des-interactions-medicamenteuses-1. Pour le risque de la prise des médicaments lors de la grossesse et l’allaitement, on a consulté le site du Centre de Référence sur les Agents Tératogènes https://lecrat.fr/spip.php?pagearticle&id_ article=500.
Les inhibiteurs de la pompe à proton
Molécules et présentation: Les IPP sont les antis sécrétoires recommandés en première intention dans l’éradication de H. pylori en association avec les antibiotiques. Le but du traitement par les IPP est d’augmenter le pH gastrique pour optimiser l’action des antibiotiques en favorisant leur stabilité. De plus, le maintien d’un pH intra gastrique >5, permet aussi de garder H. pylori dans un état non réplicatif. Le contrôle optimal du pH intra gastrique repose sur l’utilisation de la dose standard d’IPP en deux prises par jour. Les différentes molécules d’IPP sont détaillées dans le tableau 5.
Tableau 5 : Les différentes molécules d’IPP .
|
Molécules |
Dose standard (pleine dose) |
|
Oméprazole |
20 mg |
|
Esoméprazole |
40 mg |
|
Lansoprazole |
30 mg |
|
Pantoprazole |
40 mg |
|
Rabéprazole |
20 mg |
Biodisponibilité: L’efficacité de l’IPP dépend de la variabilité interindividuelle de son métabolisme qui est déterminé par le polymorphisme du cytochrome 2C19 et MDR1. Ces polymorphismes peuvent influencer le taux d’éradication de H. pylori selon que le statut métaboliseur est lent ou rapide. Le métabolisme de certains IPP comme l’oméprazole et le lansoprazole est dépendant du polymorphisme des gènes du cytochrome 2C19 et de MDR1 alors que l’ésoméprazole ou le rabéprazole semblent être moins influencés. En raison d’un taux important de métaboliseurs rapides chez les caucasiens, il est préférable d’utiliser l’ésoméprazole ou le rabéprazole (54).
Les interactions médicamenteuses: l’utilisation concomitante des IPP et du clopidogrel peut diminuer l’activité anti-agrégante du clopidogrel vu qu’il est aussi métabolisé par le cytochrome 2C19. Le pantoprazole et l’ésoméprazole présentent moins d’interaction avec le clopidogrel. La substitution du clopidogrel par le prasugrel peut être aussi proposée (pas d’interaction avec les IPP dans les études in vivo et cliniques)
Tolérance et effets indésirables: Les IPP sont généralelement bien tolérés. Les effets indésirables les plus fréquents, lors d’une prise de courte durée, sont les céphalées, douleurs abdominales, nausées, vomissements, flatulence, diarrhée, constipation, pullulation microbienne du grêle.
Les antibiotiques
L’amoxicilline: L’amoxicilline est un antibiotique de la famille des bêtalactamines, du groupe des aminopénicillines. Il est actif sur les germes aérobies à Gram négatifs dont H. pylori.
Présentation: Comprimé ou gélule à 500 / 1000 mg. Contre-indications: Allergie aux antibiotiques de la famille des bêtalactamines (pénicillines et céphalosporines) ou à l’un des autres constituants.
Interactions médicamenteuses et précautions d’emploi: l’association avec le méthotrexate est déconseillée. Effets indésirables: nausées, diarrhée, céphalées, éruption cutanée, candidose cutanéo- muqueuse. Grossesse et allaitement: ce médicament peut être pris pendant la grossesse et l’allaitement Résistance primaire: elle est exceptionnelle. Dans l’étude multicentrique de Ben Mansour et al menée entre 2005 et 2007, les auteurs ont inclut 273 patients (adultes et enfants) naïfs, le taux de résistance primaire de H. pylori à l’amoxicilline était nulle (55).
La clarithromycine: La clarithromycine est un antibiotique de la famille des macrolides, qui peut être utilisé chez l’adulte et l’enfant de plus de 12 ans.
Présentation: Comprimé à 250 / 500 mg. Contre-indications: l’Allergie aux macrolides, l’hypokaliémie, l’allongement de l’intervalle QT, les antécédents de troubles du rythme cardiaque notamment une torsade de pointe, l’insuffisance rénale associée à une insuffisance hépatique sévère. Interactions médicamenteuses et précautions d’emploi: l’association avec les dérivés de l’ergot de seigle et la colchicine est contre indiquée. Effets indésirables: diarrhée, nausées, vomissements, douleurs abdominales, troubles du goût, céphalées et insomnie. Grossesse et allaitement: ce médicament peut être pris pendant la grossesse et l’allaitement Résistance primaire: le taux de résistance primaire à la clarithromycine est un facteur déterminant dans le choix thérapeutique de la cure d’éradication de H. pylori. Le seuil de 15% défini les régions de haute résistance à la clarithromycine (> 15%) et les régions de faible résistance à la clarithromycine (≤ 15%). Le groupe européen Helicobacter et Microbiote a rapporté un taux de résistance de 21,4% dans les pays européens (56).
Dans une étude tunisienne mono centrique, menée entre 2017 et 2020 dans le service de gastroentérologie de l’hôpital Hédi chaker de Sfax et incluant 124 patients,le taux de résistance primaire à la clarithromycine était de 25,3% (57). Dans une étude tunisienne transversale multicentrique étendue sur 2 ans (2021-2022) incluant 651 patients naïfs ayant une infection à H. pylori, le taux de résistance primaire de H. pylori à la clarithromycine était de 27,9%. Ainsi, la Tunisie est classée comme un pays de haute résistance à la clarithromycine. Résistance secondaire: En Tunisie, le taux de résistance secondaire à la clarithromycine était de 62,5% (57).
Le métronidazole: Le métronidazole est un antibiotique et un antiparasitaire, utilisé chez l’adulte et l’enfant âgé de plus de 6 ans dans l’éradication de H. pylori. Présentation: Comprimé à 250 / 500 mg. Contre-indications: Hypersensibilité à la substance active ou à l’un des excipients. Interactions médicamenteuses et précautions d’emploi: Il doit être utilisé avec précaution en cas d’association avec un anticonvulsivant, les inducteurs enzymatiques, la rifampicine et le lithium. La consommation d’alcool est déconseillée durant la période du traitement.
Effets indésirables: diarrhée, nausées, céphalées, épigastralgies, goût métallique. Grossesse et allaitement: L’utilisation du métronidazole est possible quel que soit le terme de la grossesse. Son utilisation au cours de l’allaitement est permise pour une durée de traitement ≤ 14 jours. Quelques rares cas de diarrhée bénigne et de candidose buccale ont été rapportés chez les nouveaux nés. Résistance primaire: Le taux de résistance primaire au métronidazole influence le choix des cures d’éradication de H. pylori, mais à un moindre degré que la clarithromycine. En effet et contrairement à la résistance à la clarithromycine, la résistance au métronidazole peut être partiellement surmontée en augmentant les doses, la fréquence et la durée de l’administration de l’antibiotique ou en ajoutant du bismuth. Selon le taux de résistance au métronidazole, les régions sont classées en : zone de faible résistance (< 15%), zone de résistance intermédiaire (15-40%) et zone de haute résistance (≥ 40%). Le taux de résistance primaire au métronidazole était de 62,4% en France et de 39% en Europe (56 , 58). Dans l’étude multicentrique de Ben Mansour et al, le taux de résistance primaire de H. pylori au métronidazole était de 51,3% (55). La Tunisie serait vraisemblablement un pays de haute résistance primaire au métronidazole. Mais on ne dispose pas d’études récentes et à large échelle pour confirmer cette donnée.
La lévofloxacine: La lévofloxacine est l’antibiotique de la famille des fluoroquinolones (FQ), le plus utilisé chez l’adulte pour l’éradication de H. pylori. Présentation: Comprimé à 250/500 mg. Contre-indications: Allergie aux antibiotiques de la famille des FQ, antécédent de tendinite lors de l’utilisation d’une FQ ou d’épilepsie (risque de diminution du seuil épileptogène). La lévofloxacine est aussi contre indiquée chez l’enfant et l’adolescent (< 18 ans).
Interactions médicamenteuses et précautions d’emploi: Il y a un risque surajouté de rupture tendineuse en cas d’association avec les corticoïdes et un risque de majoration de l’effet anticoagulant de la warfarine. Il existe aussi un risque de survenue de crise épileptique en cas d’utilisation concomitante de théophylline ou d’AINS.
Effets indésirables: diarrhée, nausées, vomissements, insomnie, céphalées, vertiges, augmentation des transaminases, tendinite (rare). Grossesse et allaitement: L’utilisation de ce médicament est à éviter chez la femme enceinte en raison d’un risque théorique de lésion du cartilage pour le fœtus. Il n’y a pas de données publiées sur les risques chez les enfants allaités par des mères sous lévofloxacine. Résistance primaire: Une région est considérée à haute résistance pour la lévofloxacine si le taux de résistance est ≥ 15%. La résistance primaire à la lévofloxacine en France et en Europe est de 17,1% et 15,8% respectivement (56 , 58). On ne dispose pas du taux de résistance primaire d’H. pylori à la lévofloxacine en Tunisie. Dans une étude pilote qui s’est déroulée à l’hôpital la Rabta et incluant 96 patients naifs, le taux de résistance primaire à la lévofloxacine était de 14,28%. Résistance secondaire: On ne dispose pas du taux de résistance secondaire de H. pylori à la Lévofloxacine en Tunisie.
La tétracycline: La tétracycline est un antibiotique, utilisé chez l’adulte et l’enfant de plus de 8 ans (risque de coloration permanente des dents en jaune, gris, brun). Présentation: n’est disponible qu’à dose fixe (125 mg) en association avec le métronidazole et les sels de bismuth. Contre-indications :allergie aux antibiotiques de la famille des tétracyclines Effets indésirables: diarrhée, nausées, céphalées, épigastralgies, réactions allergiques (urticaire, rash, prurit), réactions de photosensibilisation. Interactions médicamenteuses et précaution d’emploi: L’association avec les rétinoïdes administrés par voie orale est contre indiquée. L’utilisation des antiacides contenant l’aluminium/calcium / magnésium, les supplémentations à base de fer, zinc peuvent diminuer l’absorption de la tétracycline. Il existe un risque de majoration de l’effet anticoagulant avec les anticoagulants oraux. Grossesse et allaitement: L’administration de ce médicament est contre-indiquée à partir du 2ème trimestre de grossesse. Son administration est à éviter pendant l’allaitement. Résistance primaire et secondaire: Elle est nulle en France et en Europe (56, 58). On ne dispose pas de données tunisiennes.
La rifabutine: La rifabutine est un antibiotique de la famille des rifamycines. Elle est utilisée chez l’adulte dans le traitement des mycobactéries atypiques et multirésistantes. Son utilisation dans l’éradication de H. pylori doit être limitée aux thérapies de sauvetage. Elle est disponible en Tunisie sur commande. Présentation: Gélule à 150 mg. Contre-indications: Hypersensibilité à la substance active ou à l’un des excipients. L’utilisation de la rifabutine est contre indiquée en cas d’insuffisance rénale et elle n’est pas recommandée chez les enfants âgés de moins de 12 ans. Effets indésirables: coloration rouge-orange des selles, des urines, des sécrétions, de la peau, rash, myalgies, arthralgies, modification du goût. Grossesse et allaitement: L’effet de ce médicament pendant la grossesse ou l’allaitement est mal connu. Résistance primaire: Elle est nulle en France et en Europe (56, 58). Résistance secondaire: Elle est de 2,6% en France (58 ).
L’association (Bismuth-Métronidazole-Tétracycline): Présentation: Gélule contenant 140 mg de sel de bismuth, 125 mg de métronidazole et 125 mg de tétracycline. Actuellement, elle est commercialisée en Tunisie sous le nom de Pylera® et de Tri pylori®. Contre-indications: Hypersensibilité aux substances actives, aux autres dérivés nitro- imidazolés ou à l’un des excipients Elle est contre-indiquée chez l’enfant < 12 ans et déconseillée chez les enfants âgés entre 12 et 18 ans. La sécurité de son emploi et de son efficacité n’ont pas été établies chez les patients insuffisants hépatiques ou rénaux. Son utilisation est contre-indiquée en cas d’insuffisance rénale ou hépatique. Interactions médicamenteuses et précautions d’emploi : Voir partie interactions médicamenteuses de la tétracycline et du métronidazole. Son utilisation avec des médicaments métabolisés par CYP3A4 et CYP2C9 est à éviter (ondansétron, amiodarone, dompéridone), vu le risque d’allongement de l’intervalle QT. La prise d’alcool est à éviter pendant le traitement et jusqu’à 24 h après la dernière prise. Il est recommandé de ne pas consommer de produits laitiers ou de boissons riches en calcium pendant la durée du traitement. Effets indésirables: selles noires, douleurs abdominales, diarrhée, nausées, vomissements, anorexie, dysgueusie (goût métallique), langue noire, céphalées, vertiges, somnolence, candidose digestive/vaginale. Grossesse et allaitement: ce médicament est contre indiqué pendant la grossesse et l’allaitement.
Les règles de bonne pratique de prescription de la cure d’éradication de H. pylori
- Une cure d’éradication de H. pylori est considérée efficace si le taux d’éradication de H. pylori est > 90%. - Il est recommandé de rechercher à l’interrogatoire une prise de clarithromycine durant les 6 derniers mois et d’éviter dans ce cas la prescription du schéma incluant la clarithromycine vu le taux élevé de résistance secondaire. - Après échec d’une cure contenant de la clarithromycine ou de la lévofloxacine, il est recommandé de ne pas réutiliser une autre cure à base de l’antibiotique utilisé. Par contre le réemploi du métronidazole est permis car la résistance au métronidazole est non corrélée à l’échec surtout en association avec le bismuth qui présente un effet synergique. - Un contrôle d’éradication de H. pylori est recommandé, vu la perpétuelle augmentation des taux de résistance aux antibiotiques.
Les schémas thérapeutiques
Les schémas empiriques
Le choix des différents schémas thérapeutiques en empirique est essentiellement guidé par le taux de résistance local à la clarithromycine, au métronidazole et aux FQ (3). En zone de haute résistance à la clarithromycine, les schémas thérapeutiques qui ont prouvé leur efficacité sont : - La quadrithérapie concomitante Bismuthée (QTB) IPP dose standard en deux prises (matin et soir) + 3 Gélules (140 mg de sel de bismuth, 125 mg de métronidazole et 125 mg de tétracycline) x 4/j 2 La prise des gélules se fait après les repas (petit déjeuner, déjeuner et dîner) et avant le coucher après une collation, avec un grand verre d’eau. Selon l’autorisation de mise sur le marché, il est recommandé d’utiliser l’oméprazole dans la QTB. Toutefois, l’efficacité de la QTB a été aussi prouvée avec d’autres IPP tels que l’ésoméprazole et le lansoprazole (59-61). Durée : 10 jours - La quadrithérapie concomitante non Bismuthée (QTCNB) IPP dose standard en deux prises (matin et soir) + amoxicilline 1000 mg x*2/j + métronidazole 500 mg x *2/j + clarithromycine 500 mgx2/j Durée : 14 jours - La trithérapie à base de Lévofloxacine IPP dose standard en deux prises (matin et soir) + amoxicilline 1000 mgx2/j + lévofloxacine 500 mg en une prise ou en deux prises Durée : 10 - 14 jours - La trithérapie à base de Rifabutine IPP dose standard en deux prises (matin et soir) + Amoxicilline 1000 mg x 2/j + Rifabutine 300 mg en une prise ou en deux prises Durée : 10 à 14 jours - La bithérapie à forte dose Son efficacité est expliquée essentiellement par trois facteurs : Le maintien de la concentration d’amoxicilline au-dessus de la concentration minimale inhibitrice, la capacité à maintenir un pH intra-gastrique élevé et la durée du traitement (62). Elle est définie par l’utilisation d’une dose quotidienne d’amoxicilline ≥ 2 g/j associée à la dose standard d’l’IPP en 3 ou 4 prises (63). Plusieurs schémas thérapeutiques ont été adoptés dans la littérature, le plus utilisé est : IPP dose standard x4/j + Amoxicilline 750 mg*4/j Durée: 14jours
Les schémas guidés par la sensibilité individuelle aux antibiotiques
Le traitement se base sur une trithérapie associant un IPP (dose standard en deux prises) et deux antibiotiques : amoxicilline (1000 mg x 2/j) + soit la clarithromycine (500 mg x 2/j) soit le métronidazole (500 mg x 2/j) soit la lévofloxacine (500 mg/j). Durée : 10 -14 jours. L’optimisation de la trithérapie: Le taux d’éradication de la trithérapie peut être augmenté de 5 à 10 % en cas de prolongation de la durée du traitement à 14 jours et l’emploi de fortes doses d’IPP (64, 65). La haute autorité de santé française recommande aussi d’adapter la dose d’amoxicilline au poids (50 mg/kg/j) et de fractionner les doses en 3-4 prises ce qui permet d’augmenter la biodisponibilité de l’amoxicilline au niveau du mucus gastrique et de prolonger son effet bactéricide sur H. pylori (66, 67 ).
L’infection réfractaire à H. pylori
Durant la réunion d’experts de l’association américaine de gastroentérologie, une infection à H. pylori est dite réfractaire en cas d’échec d’une ou de plusieurs cures d’éradication de H. pylori en présence de ces trois conditions (68): - Un test de H. pylori non sérologique qui persiste positif. - Le test doit être réalisé au moins 4 semaines après une ou plusieurs cures complètes d’éradication de H. pylori parmi les traitements recommandés par les lignes directrices actuelles. - L’arrêt préalable de tout médicament qui pourrait avoir un impact sur la sensibilité du test. L’infection réfractaire à H. Pylori doit être différenciée de l’infection récurrente qui est définie par un test non sérologique qui était initialement négatif après l’éradication, et qui est redevenu positif. L’infection récurrente peut être secondaire à une exposition intrafamiliale continue. La meilleure prise en charge consiste à tester les membres de la famille et à traiter ceux qui sont H.pylori positifs.
Les indications thérapeutiques
Stratégie empirique de l’éradication de H. pylori
La stratégie empirique de l’éradication de H. pylori est résumée dans la figure n°1
Figure 1. Stratégie empirique de l’éradication de H. pylori .
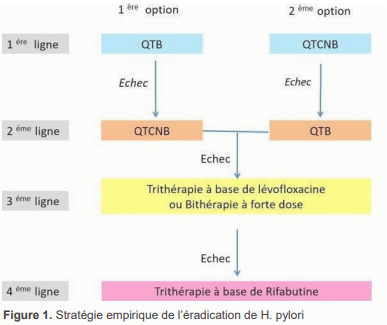
Traitement de première ligne

Argumentaires : En Europe qui est une zone de haute résistance à la clarithromycine, le taux d’éradication de H. pylori avec la QTB, utilisée en empirique, était > 90% (69, 70). En Tunisie, on ne dispose pas d’études évaluant l’efficacité de la QTB. Dans les pays à haute résistance à la clarithromycine, le taux d’échec des schémas thérapeutiques incluant la clarithromycine, en empirique serait élevé. Toutefois, parmi les schémas proposés, seule la QTCNB a permis de donner des taux d’éradication satisfaisants. En effet, dans une revue récente de la littérature, le taux d’éradication de H. pylori après une QTCNB en première ligne était de 92% en zone de haute résistance à la clarithromycine (71). En Tunisie, deux études monocentriques tunisiennes récentes ont été menées au service de gastroentérologie de l’hôpital Mahmoud Matri à l’Ariana et au service de gastro-entérologie de l’hôpital Fattouma Bourguiba à Monastir, le taux d’éradication de H. pylori après la QTCNB était respectivement de 80,3% et 81% (données non publiées). Dans une étude tunisienne multicentrique transversale récente, 414 patients naïfs ont été traités par QTCNB (données non publiées). Le taux d’éradication d’H.pylori était de 88,2% (365/414). Au vu de ces données, La QTB est l’option thérapeutique à privilégier en première intention vue qu’elle présente l’avantage de contourner la résistance à la clarithromycine et de vaincre la résistance au métronidazole. Quant à la QTCNB, elle pourrait être proposée comme une alternative thérapeutique vu que le taux d’éradication d’H. pylori avec ce schéma avoisine les 90% en Tunisie.
Traitement de 2ème ligne

Argumentaires : Vu l’efficacité prouvée de la QTCNB en Tunisie, l’utilisation de la quadrithérapie non utilisée en première ligne parait une option thérapeutique adéquate. Cette stratégie a été recommandée aussi par le groupe français de l’étude des Helicobacters et la haute autorité de santé française (72). Quant au dernier consensus Maastricht VI (3), les auteurs ont proposé la triple ou la quadrithérapie à base de lévofloxacine en traitement de 2ème ligne seulement en cas de faible résistance communautaire aux FQ. Or, en Tunisie, on ne dispose pas des chiffres du taux de résistance de H. pylori à la lévofloxacine. De plus, on a assisté ces dernières années à une augmentation importante de la prescription de la lévofloxacine, ce qui exposerait au risque de majoration des résistances des différentes bactéries à la lévofloxacine notamment le pneumocoque et le mycobactérium tuberculosis. Sur ces données, nous n’avons pas opté pour l’utilisation d’un schéma d’éradication de H. pylori à base de lévofloxacine en 2 ème ligne, en l’absence d’une étude de la sensibilité individuelle ou communautaire de H. pylori à la lévofloxacine.
Traitement de 3ème ligne

Argumentaires: Dans les données du « European registry on H. pylori management » (HpEuReg), la trithérapie à base de Lévofloxacine en 3 éme ligne, après échec de QTCNB et de la QTB, permettait d’éradiquer H. pylori dans 74-75% des cas (73). Dans une méta-analyse récente, une trithérapie à base de Lévofloxacine prise pendant 10 jours a permis d’obtenir un taux d’éradication global de 80 %, après l’échec d’une QTCNB (74). La durée classique de la trithérapie à base de Lévofloxacine était de 10 jours, mais des données récentes ont démontré un meilleur taux d’éradication avec une durée de traitement de 14 jours (75, 76). Le problème majeur avec la trithérapie à base de Lévofloxacine, c’est le risque d’augmentation du taux de résistance de H. pylori aux FQ. Une étude de la sensibilité individuelle est recommandée dans la mesure du possible, avant l’utilisation de la lévofloxacine. Une méta-analyse récente (12 études randomisées contrôlées ayant inclus 2249 patients) a suggéré que la bithérapie à forte dose était similaire en termes d’efficacité (87,5 % vs 90,1 %, OR :0.98, 95% CI 0.95- 1.02) et d’observance (94,3 % vs 93,5 %, OR : 1.11, 95% CI 0.78-1.59) aux autres schémas recommandés (77). La bithérapie à forte dose présentait moins d’effets secondaires (12,9 % vs 28 %, OR : 0.53, 95% CI 0.37- 0.76). En analysant un sous-groupe de 7 essais cliniques randomisés (1302 patients), la bithérapie à forte dose était aussi efficace en tant que traitement de sauvetage (OR : 0,97, 95%CI : 0,89-1,05, p=0,19) que de première intention (OR: 0,97, 95%CI : 0,93-1,02, p=0,45). Dans une méta analyse récente, la bithérapie à forte dose était aussi efficace que la QTB et la QTCNB (RR: 1 ; IC 95% : 0,96- 1,05, p = 0,87) (63).
Traitement de 4ème ligne

Argumentaires : Plusieurs études récentes ont mis en évidence l’efficacité de la cure de sauvetage à base de la rifabutibne en 3ème et 4ème ligne dans des populations ayant des taux élevés de résistance aux différents antibiotiques. Dans une revue récente de la littérature incluant 3052 patients, le taux moyen d’éradication de H. pylori avec les régimes contenant de la rifabutine était de 73% (78). Les taux respectifs pour les traitements de deuxième, troisième, quatrième et cinquième ligne de traitement, étaient de 79 %, 69 %, 69 % et 72 %. Dans la plupart des études, la rifabutine a été administrée à la dose de 300 mg/jour, ce qui semble être plus efficace que 150 mg/jour. La durée optimale de la cure à base de rifabutine reste incertaine, mais une administration pendant 10 à 12 jours était généralement recommandée. Les effets indésirables de la cure d’éradication de H.pylori à base de rifabutine étaient relativement peu fréquents (15 %), et les effets indésirables graves étaient exceptionnels. Toutefois, la préoccupation majeure avec l’utilisation de la rifabutine dans l’éradication de H. pylori reste le risque d’émergence de souche de mycobacterium résistante à la rifabutine (79). De plus, la disponibilité de la rifabutine est limitée. Cette molécule peut occasionner également une myélotoxicité. Pour toutes ces raisons, ce médicament doit être strictement réservé aux options thérapeutiques de sauvetage avec une indication formelle de l’éradication de H. pylori. La nécessité du recours à la rifabutine devrait être discutée en réunion de concertations multidisciplinaires.
Stratégie de l’éradication de H pylori guidée par la sensibilité individuelle aux antibiotiques
Cette stratégie se base sur l’étude, en premier lieu, de la sensibilité à la clarithromycine puis en 2 éme lieu, de la sensibilité à la lévofoxacine. Deux stratégies sont proposées selon que la souche de H. pylori est sensible à la clarithromycine (figure n°2) ou résistante à la clarithromycine (figure 3).
Figure 2. La stratégie thérapeutique guidée pour l’éradication de H. pylori sensible à la clarythromycine .

Figure 3. Stratégie thérapeutique guidée pour l’éradication de H. pylori resistant à la clarythromycine .

Allergie à la pénicilline
Dans les pays développés, le taux d’allergie à la pénicilline variait entre 5 et 15% ( 80). Les options thérapeutiques chez les patients allergiques à la pénicilline sont très restreintes, notamment dans les régions à haute résistance à la clarithromycine. Il serait souhaitable de s’assurer du diagnostic de l’allergie par la réalisation de tests d’hypersensibilité. La négativité des tests immuno allergiques permet d’exclure l’allergie à la pénicilline. Les études évaluant l’efficacité des régimes thérapeutiques de l’éradication de H. pylori en cas d’allergie à la pénicilline sont peu nombreuses et à effectif réduit (81).

Argumentaires: Des données rétrospectives ont objectivé un taux d’éradication de H. pylori de 91 % après administration de la QTB chez les patients présentant une allergie à la pénicilline (82). Deux autres études prospectives ont rapporté des taux d’éradication de 74 % pour une durée de traitement de 10 jours (83) et de 84,8 % pour une durée de 14 jours (84). Aucun essai contrôlé randomisé évaluant l’efficacité des régimes thérapeutiques en 2ème intention en cas d’allergie à la pénicilline n’est disponible à ce jour (3, 80). Les données du HP-EuReg ont montré que le taux d’éradication de H. pylori avec la trithérapie (IPP-Lévofloxacine-clarithromycine) prise en 2ème ligne était de l’ordre de 71% (82). Quelques études ont proposé la substitution de l’amoxicilline par le céfuroxime ( 81) ou l’utilisation de schéma thérapeutique à base de tétracycline semi synthétique (exemple la doxycycline), de sitafoxacin, bismuth ou vonoprazan (80, 82 , 85). Il semblerait que ces alternatives pourraient améliorer le taux d’éradication de H. pylori.Dans une étude récente chinoise, les auteurs ont prescrit à 112 patients allergiques à la pénicilline des schémas thérapeutiques, en fonction de la sensibilité aux antibiotiques (86). Le taux d’éradication global de H. pylori était de 92,9% pour une durée de traitement de 14 jours. Tenant compte du profil de résistance bactérienne et de la non-disponibilité de certaines molécules en Tunisie, un traitement de deuxième ligne ne pourra être envisagé sans l’étude de la sensibilité aux différents antibiotiques.
Grossesse/allaitement
Chez la femme enceinte, l’administration d’une cure d’éradication de H. pylori est déconseillée. Elle devrait être différée, dans la mesure du possible, après l’accouchement (87). La haute autorité de santé française estime que le traitement n’est pas urgent et qu’en cas de grossesse ou d’allaitement, le traitement doit être retardé (88). Si une cure d’éradication s’avère nécessaire, le schéma thérapeutique qui peut être prescrit chez la femme enceinte et allaitante est la QTCNB. La patiente doit être avisée des éventuels risques notamment en rapport avec la prise du métronidazole.
Sujet âgé
Pour le sujet âgé, il n’existe pas de contre-indications spécifiques concernant les différents schémas thérapeutiques préconisés. Cependant, quelques considérations spécifiques aux sujets âgés doivent être prises en compte (87): - Un historique complet des antibiotiques pris peut aider à déterminer les classes d’antibiotiques spécifiques qui doivent être évitées. - L’adaptation de la posologie des antibiotiques en tenant compte de la fonction hépatique, rénale et cardiaque. - Les interactions médicamenteuses. - La surveillance des effets indésirables.
Population pédiatrique

Argumentaire : Les différentes sociétés savantes de pédiatrie, recommandent l’utilisation, en empirique dans les zones de haute résistance à la clarithromycine, la trithérapie à base d’IPP- Amoxicilline – Métronidazole (89-91). Une durée de 14 jours a été préconisée par la majorité des sociétés savantes (90, 91). Pour le traitement de 2 éme ligne, les différentes sociétés savantes recommandent de guider les choix thérapeutiques en fonction de la sensibilité de H. pylori à la clarithromycine et au métronidazole. A défaut, une optimisation de la trithérapie par l’augmentation des doses d’amoxicilline peut être proposée. L’adaptation des doses des différents antibiotiques selon le poids est détaillée dans le tableau 6
Tableau 6 : Adaptation des doses pédiatriques des différentes molécules utilisées dans les schémas thérapeutiques (90) .
|
Molécules |
Dose standard /j |
Dose maximale /j |
|
Esoméprazole/oméprazole/rabéprazolele Lansoprazole |
2 mg/kg |
80 mg |
|
Amoxicilline |
Dose élevée d’amoxicilline |
|
|
50 mg/kg |
2000 mg |
|
|
75 mg/kg |
3000 mg |
|
|
Clarithromycine |
20 mg/kg |
1000 mg |
|
Métronidazole |
20 mg/kg |
1500 mg |
Insuffisance rénale
La quadrithérapie bismuthée est contre-indiquée en cas d’insuffisance rénale. Une adaptation des doses de certains antibiotiques est nécessaire en fonction du débit de filtration glomérulaire (DFG) (tableau 7).
Tableau 7 : Adaptation de la dose des antibiotiques selon le débit de filtration glomérulaire .
| Molécules | Débit de filtration glomérulaire | Adaptation des doses |
|---|---|---|
| IPP | Pas d’adaptation des doses | |
| Métronidazole | Pas d’adaptation des doses | |
| Clarithromycine | 10 < DFG < 30 ml/mn | DFG < 10 ml/mn / hémodialyse : 500 mg x 2/24h, 500 mg/24h |
| Lévofloxacine | 20 < DFG < 50 ml/mn | DFG < 20 ml/mn / hémodialyse : 250 mg/ 24h, 125 mg/24h |
| QTB | Contre indiquée |
Insuffisance hépatique
La QTB est contre-indiquée en cas d’insuffisance hépatique. La clarithromycine est contre-indiquée en cas d’insuffisance hépatique sévère associée à une insuffisance rénale.
Les probiotiques

Argumentaire : Dans une méta analyse récente incluant 40 études et 5792 patients, les auteurs ont démontré que l’administration concomitante de probiotiques avec la cure d’éradication de H. pylori permettait de diminuer significativement l’incidence de l’ensemble des effets indésirables (OR= 0.56, IC à 95% : 0,45-0, 70, P < 0,00001). L’analyse des différents sous- groupes a montré que cet effet bénéfique des probiotiques a été observé chez les adultes et non pas chez les enfants. Pour les effets indésirables digestifs (qui étaient les plus fréquents), le traitement par les probiotiques a permis de diminuer significativement l’incidence des vomissements (OR : 0,72, IC à 95% : 0,60-0,86, P = 0,0004), de la diarrhée ( OR : 0,49, 95% IC à 95% : 0,31-0,75, P= 0,001), de la constipation (OR : 0,59, IC à 95%: 0,38- 0,91, P =0,02), des épigastralgies (OR : 0,72, IC à 95%: 0,53–,.97, P= 0.03) et la dysgueusie (OR : 0,78, 95% IC à 95% : 0,62– 0,99, P= 0.04) . L’impact des probiotiques sur l’incidence des effets indésirables n’était pas dose dépendant mais durée dépendant. En effet, la réduction significative des effets indésirables a été observée seulement à partir d’une durée moyenne d’administration orale des probiotiques d’au moins 10 jours. Les probiotiques à souche unique étaient plus efficaces que les probiotiques à souches multiples. Cette donnée a été confirmée par d’autres études qui ont prouvé l’efficacité des probiotiques à base de Lactobacilles (93, 94) et de Saccharomyces boulardii (95, 96 ).
CONCLUSION
L’infection à H. pylori est associée à plusieurs pathologies digestives et extra-digestives. Le diagnostic d’une infection à H. pylori repose sur l’utilisation des moyens diagnostiques adaptés à la situation clinique. La prise en charge de l’infection à H. pylori est considérée actuellement comme un vrai challenge pour le clinicien. Une stratégie thérapeutique guidée par le taux de résistance locale et idéalement individuelle aux différents antibiotiques s’avère nécessaire pour contrôler l’augmentation perpétuelle des résistances de H. pylori aux différents antibiotiques et pour diminuer le coût global de la prise en charge de l’infection à H. pylori.
References
- Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984;323:1311–1315. doi: 10.1016/s0140-6736(84)91816-6. [DOI] [PubMed] [Google Scholar]
- World health organization Schistosomes, Liver Flakes and Helicobacter pylori. Iarc monographs on the evaluation of carcinogenic risks to humans. Iarc monographs on the evaluation of carcinogenic risks to humans. 1994;61:1–241. [PMC free article] [PubMed] [Google Scholar]
- Malfertheiner P, Megraud F, Rokkas T. Management of Helicobacter pylori infection : the Maastricht VI/Florence consensus report. Gut. 2022;71:1724–1762. [Google Scholar]
- santetunisie.rns.tn/images/articles/ULCEREUSE.pdf. 2022.
- worldgastroenterology.org/UserFiles/file/guidelines/helicobacter-pylori-french-2010.pdf. 2022.
- Djemel N, Khammasi S, Bouzaidi S. Prévalence de l’Hélicobacter pylori en Tunisie chez des témoins asymptomatiques et au cours de la dyspepsie non ulcéreuse et de l’ulcère duodénal. Etude prospective de 183 cas. Tunisie Med. 1995;73:373–377. [PubMed] [Google Scholar]
- Ben Ammar A, Cheikh I, Ouerghi H, Chaabouni H, Kchaou M, Ben Mami N. Prévalence de l’infection à Helicobacter pylori dans la maladie ulcéreuse duodénale. Résultats d’une étude prospective à propos de 78 ulcéreux duodénaux AINS négatifs. Tunisie Med. 2002;80:599–604. [PubMed] [Google Scholar]
- Bouali R, Ben Moussa M, Jemaa A. High prevalence of helicobacter pylori infection in Tunisia. The American Journal of Gastroenterology. 2003;98(Suppl. 1):S40. [Google Scholar]
- Jmaa R, Aissaoui B, Golli L. Les particularités de la gastrite chronique à Helicobacter pylori au centre ouest de la Tunisie. Tunisie Medicale. 2010;88:147–151. [PubMed] [Google Scholar]
- Siai K, Ghozzi M, Ezzine H, Medjahed N, Azzouz MM. Prevalence and risk factors of Helicobacter pylori infection in Tunisian children: 1055 children in Cap-Bon (northeastern Tunisia) Gastroenterol Clin Biol. 2008;32:881–886. doi: 10.1016/j.gcb.2008.03.021. [DOI] [PubMed] [Google Scholar]
- Bai X, Xi C, Wu J. Survival of Helicobacter pylori in the wastewater treatment process and the receiving river in Michigan, USA. J Water Health. 2016;14:692–698. doi: 10.2166/wh.2016.259. [DOI] [PubMed] [Google Scholar]
- Ranjbar R, Khamesipour F, Jonaidi-Jafari N, Rahimi E. Helicobacter pylori in bottled mineral water: genotyping and antimicrobial resistance properties. BMC Microbiol. 2016;16:1–10. doi: 10.1186/s12866-016-0647-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Malfertheiner P, Megraud F, O’Morain CA. Management of Helicobacter pylori infection—the Maastricht V/Florence Consensus Report. Gut. 2017;66:6–30. doi: 10.1136/gutjnl-2016-312288. [DOI] [PubMed] [Google Scholar]
- De Korwin JD. Helicobacter pylori : quand rechercher une infection et la traiter chez l’adulte ? Rev Médecine Interne. 2021;42(0):482–491. doi: 10.1016/j.revmed.2020.11.012. [DOI] [PubMed] [Google Scholar]
- Andoulo FA, Noah Noah D, Tagni-Sartre M, Ndjitoyap EC, Ngu Blackett K. Epidémiologie de l’infection à Helicobacter Pylori à Yaoundé: de la particularité à l’énigme Africaine. Pan Afr Med J. 2013;16(0):115–115. doi: 10.11604/pamj.2013.16.115.3007. Disponible sur: http://www.panafrican-med-journal.com/content/article/16/115/full/ [DOI] [PMC free article] [PubMed] [Google Scholar]
- Du MQ, Isaccson PG. Gastric MALT lymphoma: from aetiology to treatment. Lancet Oncol. 2002;3(0):97–104. doi: 10.1016/s1470-2045(02)00651-4. [DOI] [PubMed] [Google Scholar]
- Lamarque D, Burucoa C, Courillon-Mallet A. Révision des recommandations françaises sur la prise en charge de l’infection par Helicobacter pylori. Hépato Gastro. 2012;19(0):475–502. [Google Scholar]
- Jung HK, Kang SJ, Lee YC. Evidence-Based Guidelines for the Treatment of Helicobacter pylori Infection in Korea 2020. Gut Liver. 2021;15(0):168–195. doi: 10.5009/gnl20288. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Kato M, Ota H, Okuda M. Guidelines for the management of Helicobacter pylori infection in Japan: 2016 Revised Edition. Helicobacter. 2019;0(0):e12597. doi: 10.1111/hel.12597. [DOI] [PubMed] [Google Scholar]
- Stabler SP. Vitamin B12 deficiency. N Engl J Med. 2013;368(0):2041–2042. doi: 10.1056/NEJMc1304350. [DOI] [PubMed] [Google Scholar]
- Kim BJ, Kim HS, Jang HJ, Kim JH. Helicobacter pylori Eradication in Idiopathic Thrombocytopenic Purpura: A Meta-Analysis of Randomized Trials. Gastroenterol Res Pract. 2018;9:1–8. doi: 10.1155/2018/6090878. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Pellicano R, Ianiro G, Fagoonee S, Settanni CR, Gasbarrini A. Extragastric diseases and Helicobacter pylori. Helicobacter. 2020;25(S1):e12741. doi: 10.1111/hel.12741. [DOI] [PubMed] [Google Scholar]
- Dore MP, Pes GM. What Is New in Helicobacter pylori diagnosis. An Overview. J Clin Med. 2021;10:2091. doi: 10.3390/jcm10102091. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney System. Am J Surg Pathol. 1996;20:1161–1181. doi: 10.1097/00000478-199610000-00001. [DOI] [PubMed] [Google Scholar]
- Shukla S, Pujani M, Agarwal A, Pujani M, Rohtagi A. Correlation of serology with morphological changes in gastric biopsy in Helicobacter pylori infection and evaluation of immunohistochemistry for H. pylori identification. Saudi J Gastroenterol. 2012;18:369–374. doi: 10.4103/1319-3767.103428. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Wang XI, Zhang S, Abreo F, Thomas J. The role of routine immunohistochemistry for Helicobacter pylori in gastric biopsy. Ann Diagn Pathol. 2010;14:256–259. doi: 10.1016/j.anndiagpath.2010.05.002. [DOI] [PubMed] [Google Scholar]
- Cerqueira L, Fernandes RM, Ferreira RM, et al Validation of a fluorescence in situ hybridization method using peptide nucleic acid probes for detection of Helicobacter pylori clarithromycin resistance in gastric biopsy specimens. J Clin Microbiol. 2013;51:1887–1893. doi: 10.1128/JCM.00302-13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Heluwaert F. Helicobacter Pylori: diagnostic, indications et modalités d’éradication. Post’U. 2022. https://www.fmcgastro.org/texte-postu/postu-2022/helicobacter-pylori-diagnostic-indications-et-modalitesderadication/
- Lee JY, Kim N. Diagnosis of Helicobacter pylori by invasive test: histology. Ann Transl Med. 2015;3:10. doi: 10.3978/j.issn.2305-5839.2014.11.03. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Gong RJ, Xu CX, Li H, Liu XM. Polymerase chain reaction-based tests for detecting Helicobacter pylori clarithromycin resistance in stool samples: A meta-analysis. World J Clin Cases. 2021;9:133–147. doi: 10.12998/wjcc.v9.i1.133. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Burucoa C, Delchier JC, Courillon-Mallet A, et al Comparative evaluation of 29 commercial Helicobacter pylori serological kits. Helicobacter. 2013;18:169–179. doi: 10.1111/hel.12030. [DOI] [PubMed] [Google Scholar]
- Blecker U, Vandenplas Y. Helicobacter pylori serology. J Clin Microbiol. 1993;31:173. doi: 10.1128/jcm.31.1.173-.1993. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Malfertheiner P, Mégraud F, O’Morain CA, et al. Management of Helicobacter pylori infection – the Maastricht IV/Florence Consensus Report. Gut. 2012;61:646–664. doi: 10.1136/gutjnl-2012-302084. [DOI] [PubMed] [Google Scholar]
- DeKorwin JD, Kalach N, Raymond J, Burucoa C. Prise en charge diagnostique et thérapeutique en cas d’infection à Helicobacter pylori. EMC-gastroentérologie. 2014;93:1–11. [Google Scholar]
- Logan RPH. Urea breath tests in the management of Helicobacter pylori infection. Gut. 1998;43:S47–S50. doi: 10.1136/gut.43.2008.s47. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Leide-Svegborn S, Stenström K, Olofsson M, et al. Biokinetics and radiation doses for carbon-14 urea in adults and children undergoing the Helicobacter pylori breath test. Eur. J. Nucl. Med. Mol. Imaging. 1999;26:573–580. doi: 10.1007/s002590050424. [DOI] [PubMed] [Google Scholar]
- Best LM, Takwoingi Y, Siddique S, et al. Non-invasive diagnostic tests for Helicobacter pylori infection. Cochrane Database Syst. Rev. 2018;3:CD012080. doi: 10.1002/14651858.CD012080.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Ferwana M, Abdulmajeed I, Alhajiahmed A, et al. Accuracy of urea breath test in Helicobacter pylori infection: meta-analysis. World J Gastroenterol. 2015;21:1305–1314. doi: 10.3748/wjg.v21.i4.1305. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Vaira D, Vakil N, Menegatti M. The stool antigen test for detection of Helicobacter pylori after eradication therapy. Ann Intern Med. 2002;136:280–287. doi: 10.7326/0003-4819-136-4-200202190-00007. [DOI] [PubMed] [Google Scholar]
- Gisbert JP, Abraira V. Accuracy of Helicobacter pylori diagnostic tests in patients with bleeding peptic ulcer: a systematic review and meta-analysis. Am J Gastroenterol. 2006;101:848–863. doi: 10.1111/j.1572-0241.2006.00528.x. [DOI] [PubMed] [Google Scholar]
- Liu WZ, Xie Y, Lu H. Fifth Chinese National Consensus Report on the management of Helicobacter pylori infection. Helicobacter. 2018;23:e12475. doi: 10.1111/hel.12475. [DOI] [PubMed] [Google Scholar]
- Choi YJ, Kim N, Lim J. Accuracy of diagnostic tests for Helicobacter pylori in patients with peptic ulcer bleeding. Helicobacter. 2012;17:77–85. doi: 10.1111/j.1523-5378.2011.00915.x. [DOI] [PubMed] [Google Scholar]
- Gisbert JP, Pajares JM. Review article: 13C-urea breath test in the diagnosis of Helicobacter pylori infection -- a critical review. Aliment Pharmacol Ther. 2004;20:1001–1017. doi: 10.1111/j.1365-2036.2004.02203.x. [DOI] [PubMed] [Google Scholar]
- Kato S, Shimizu T, Toyoda S. The updated JSPGHAN guidelines for the management of Helicobacter pylori infection in childhood, 2018. J. Jpn. Soc. Pediatric Gastroenterol Hepatol Nutr. 2018;32:92–136. doi: 10.1111/ped.14388. [DOI] [PMC free article] [PubMed] [Google Scholar]
- El-Serag HB, Kao JY, Kanwal F. Houston consensus conference on testing for Helicobacter pylori infection in the United States. Clin Gastroenterol Hepatol. 2018;16:992–1002. doi: 10.1016/j.cgh.2018.03.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Opekun AR, Zierold C, Rode A. Clinical Performance of the Automated LIAISON® Meridian H. pylori SA Stool Antigen Test. Biomed Res Int. 2020;19:7189519. doi: 10.1155/2020/7189519. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Deguchi R, Matsushima M, Suzuki T. Comparison of a monoclonal with a polyclonal antibody-based enzyme immunoassay stool test in diagnosing Helicobacter pylori infection after eradication therapy. J. Gastroenterol. 2009;44:713–716. doi: 10.1007/s00535-009-0069-z. [DOI] [PubMed] [Google Scholar]
- Domínguez J, Forné M, Blanco S. Comparison of a monoclonal with a polyclonal antibody-based enzyme immunoassay stool test in diagnosing Helicobacter pylori infection before and after eradication therapy. Aliment Pharmacol Ther. 2006;23:1735–1740. doi: 10.1111/j.1365-2036.2006.02936.x. [DOI] [PubMed] [Google Scholar]
- Gisbert JP, Pajares JM. Stool antigen test for the diagnosis of Helicobacter pylori infection: A systematic review. Helicobacter. 2004;9:347–368. doi: 10.1111/j.1083-4389.2004.00235.x. [DOI] [PubMed] [Google Scholar]
- Gisbert JP, Pajares JM. Diagnosis of Helicobacter pylori infection by stool antigen determination: A systematic review. Am J Gastroenterol. 2001;96:2829–283. doi: 10.1111/j.1572-0241.2001.04235.x. [DOI] [PubMed] [Google Scholar]
- Attumi TA, Graham DY. Follow-Up testing after treatment of Helicobacter pylori infections: Cautions, caveats, and recommendations. Clin Gastroenterol Hepatol. 2011;9:373–375. doi: 10.1016/j.cgh.2010.12.025. [DOI] [PubMed] [Google Scholar]
- Attumi TA, Graham DY. High-Dose extended-release lansoprazole (dexlansoprazole) and amoxicillin dual therapy for Helicobacter pylori infections. Helicobacter. 2014;19:319–322. doi: 10.1111/hel.12126. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Shimoyama T. Stool antigen tests for the management of Helicobacter pylori infection. World J Gastroenterol. 2013;19:8188–8191. doi: 10.3748/wjg.v19.i45.8188. [DOI] [PMC free article] [PubMed] [Google Scholar]
- McNicholl AG, Linares PM, Nyssen OP, Calvet X, Gisbert JP. Meta-analysis: esomeprazole or rabeprazole vs. first-generation pump inhibitors in the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther. 2012;36:414–425. doi: 10.1111/j.1365-2036.2012.05211.x. [DOI] [PubMed] [Google Scholar]
- Ben Mansour K, Burucoa C, Zribi M, Masmoudi A, Karoui S, Kallel L. Primary resistance to clarithromycin, metronidazole and amoxicillin of Helicobacter pylori isolated from Tunisian patients with peptic ulcers and gastritis: a prospective multicenter study. Ann Clin Microbiol Antimicrob. 2010;9:2–7. doi: 10.1186/1476-0711-9-22. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Megraud F, Bruyndonckx R, Coenen S, Wittkop L, Huang TD, Hoebeke M. Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 2021;70:1815–1822. doi: 10.1136/gutjnl-2021-324032. [DOI] [PubMed] [Google Scholar]
- Chtourou L, Moalla M, Mnif B. Prevalence of Helicobacter pylori resistance to clarithromycin in Tunisia. J Med Microbiol. 2022;71(8) doi: 10.1099/jmm.0.001561. [DOI] [PubMed] [Google Scholar]
- Benejat L, Ducournau A, Domingues Martins C, et al. Epidémiologie de l’infection à Helicobacter pylori en France en 2020 : Données de surveillance du CNR Campylobacters et Helicobacters. Bull Epidémiol Hebd. 2021:275–282. [Google Scholar]
- Tursi A, Di Mario F, Franceschi M, De Bastiani R, Elisei W, et al. New bismuth-containing quadruple therapy in patients infected with Helicobacter pylori: A first Italian experience in clinical practice. Helicobacter. 2017;22(e12371) doi: 10.1111/hel.12371. [DOI] [PubMed] [Google Scholar]
- Tursi A, Franceschi M, Allegretta L, Savarino E, De Bastiani R, Elisei W, et al. Effectiveness and safety of Pylera® in patients infected by Helicobacter Pylori: A Multicenter, Retrospective, Real Life Study. Dig Dis. 2018;36:264–268. doi: 10.1159/000487391. [DOI] [PubMed] [Google Scholar]
- De Boer WA, Van Etten RJ, Van De Wouw BA, Schneeberger PM, Van Oijen AH, Jansen JBJ, et al. Bismuth-based quadruple therapy for Helicobacter pylori - a single triple capsule plus lansoprazole. Aliment Pharmacol Ther. 2000;14:85–89. doi: 10.1046/j.1365-2036.2000.00686.x. [DOI] [PubMed] [Google Scholar]
- Matsumoto H, Shiotani A, Graham DY, et al. Current and Future Treatment of Helicobacter pylori Infections. Advances in experimental medicine and biology. 2019;1149:211–225. doi: 10.1007/5584_2019_367. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Zhu YJ, Zhang Y, Wang TY, Zhao JT, Zhao Z, Zhu JR, et al. High dose PPI-amoxicillin dual therapy for the treatment of Helicobacter pylori infection: a systematic review with meta-analysis. Therap Adv Gastroenterol. 2020;13:1–12. doi: 10.1177/1756284820937115. cité 26 avri 2023; Disponible sur https://journals.sagepub.com/doi/epub/10.1177/1756284820937115. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Yuan Y, Ford AC, Khan KJ. Optimum duration of regimens for Helicobacter pylori eradication. Cochrane Database Syst Rev. 2013;12:1–276. doi: 10.1002/14651858.CD008337.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Calvet X, Garcia N, Lopez T. A meta-analysis of short versus long therapy with a proton pump inhibitor, clarithromycin and either metronidazole or amoxicillin for treating Helicobacter pylori infection. Aliment Pharmacol Ther. 2000;14:603–609. doi: 10.1046/j.1365-2036.2000.00744.x. [DOI] [PubMed] [Google Scholar]
- Haute autorité de santé Traitement guidé de l’infection par Helicobacter pylori chez l’adulte. Disponible surhttps://www.has-sante.fr/jcms/p_3282789/fr/choix-et-duree-de-lantibiotherapie-traitement-guide-de-l-infection-par-helicobacter-pylorichez-l-adulte. 2023.
- Lamarque D, Burucoa C, Courillon-Mallet A, De Korwin JD, Delchier JC, Heluwaert F. Recommandations sur le traitement de l’infection à Helicobacter pylori chez l’adulte. Hépato Gastro et Oncologie digestive 2017;24:157–170. [Google Scholar]
- Shah SC, Iyer PG, Moss SF. AGA Clinical Practice Update on The Management of Refractory Helicobacter pylori Infection: Expert Review. Gastroenterology. 2021;160:1831–1841. doi: 10.1053/j.gastro.2020.11.059. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Nyssen OP, Perez-Aisa A, Castro-Fernandez M. European registry on Helicobacter pylori management: Single-capsule bismuth quadruple therapy is effective in real-world clinical practice. United European Gastroenterol J. 2021;9:38–46. doi: 10.1177/2050640620972615. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Howden CW, Graham DY. Recent developments pertaining to H. pylori infection. Am J Gastroenterol. 2021;116:1–3. doi: 10.14309/ajg.0000000000001031. [DOI] [PubMed] [Google Scholar]
- Rahman AU, Choudhary MI, editors. Frontiers in anti-infective drug discovery. Bentham Science Publishers; 2020. Eradication of Helicobacter pylori infection with non-bismuth quadruple concomitant therapy; pp. 1–34. [Google Scholar]
- Choix et durée de l’antibiothérapie : Traitement probabiliste de l’infection par Helicobacter pylori chez l’adulte. Haute autorité de santé. 2023. https://www.has-sante.fr/jcms/p_3282793/fr/choix-et-duree-de-l-antibiotherapie-traitement-probabiliste-de-l-infection-par-helicobacter-pylori-chez-l-adulte https://www.has-sante.fr/jcms/p_3282793/fr/choix-et-duree-de-l-antibiotherapie-traitement-probabiliste-de-l-infection-par-helicobacter-pylori-chez-l-adulte
- Niv Y, Vaira D, Nyssen OP, et al. European registry on H. pylori management (HpEuReg): analysis of 1,782 empirical rescue therapies on third and subsequent lines. United European Gastroenterology Journal. 2020;8:38. [Google Scholar]
- Marin AC, Nyssen OP, McNicholl AG, Gisbert JP. Efficacy and Safety of Quinolone Containing Rescue Therapies After the Failure of Non-Bismuth Quadruple Treatments for Helicobacter pylori Eradication: Systematic Review and Meta-Analysis. Drugs. 2017;77:765–776. doi: 10.1007/s40265-017-0730-4. [DOI] [PubMed] [Google Scholar]
- Fallone CA, Chiba N, van Zanten SV, Fischbach L, Gisbert JP, Hunt RH. The Toronto Consensus for the Treatment of Helicobacter pylori Infection in Adults. Gastroenterology. 2016;151:51–69. doi: 10.1053/j.gastro.2016.04.006. [DOI] [PubMed] [Google Scholar]
- Miehlke S, Krasz S, Schneider-Brachert W, Kuhlisch E, Berning M, Madisch A. Randomized trial on 14 versus 7 days of esomeprazole, moxifloxacin, and amoxicillin for second-line or rescue treatment of Helicobacter pylori infection. Helicobacter. 2011;16:420–426. doi: 10.1111/j.1523-5378.2011.00867.x. [DOI] [PubMed] [Google Scholar]
- Gao CP, Zhang D, Zhang T, Wang JX, Han SX, Graham DY, et al. PPI-amoxicillin dual therapy for Helicobacter pylori infection: An update based on a systematic review and meta analysis. Helicobacter. 2020;25:e12692. doi: 10.1111/hel.12692. [DOI] [PubMed] [Google Scholar]
- Gisbert JP. Rifabutin for the Treatment of Helicobacter Pylori Infection: A Review. Pathogens. 2020;10:1–29. doi: 10.3390/pathogens10010015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Georgopoulos SD, Papastergiou V, Karatapanis S. Current options for the treatment of Helicobacter pylori. Expert Opinion on Pharmacotherapy. 2013;14:211–223. doi: 10.1517/14656566.2013.763926. [DOI] [PubMed] [Google Scholar]
- Amit KD, Perminder SP. Treatment of Helicobacter pylori infection in the presence of penicillin allergy. World J Gastroenterol. 2021;27:7661–7668. doi: 10.3748/wjg.v27.i44.7661. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Blumenthal KG, Peter JG, Trubiano JA, Phillips EJ. Antibiotic allergy. Lancet. 2019;393:183–191. doi: 10.1016/S0140-6736(18)32218-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Nyssen OP, Pérez-Aisa Á, Tepes B, Rodrigo-Sáez L, Romero PM, Lucendo A, et al. Helicobacter pylori first-line and rescue treatments in patients allergic to penicillin: Experience from the European Registry on H pylori management (Hp-EuReg). Helicobacter. 2020;25:e12686. doi: 10.1111/hel.12686. [DOI] [PubMed] [Google Scholar]
- Gisbert JP, Barrio J, Modolell I, Molina-Infante J, Aisa AP, Castro-Fernández M, Rodrigo L, et al. Helicobacter pylori first-line and rescue treatments in the presence of penicillin allergy. Dig Dis Sci. 2015;60:458–464. doi: 10.1007/s10620-014-3365-2. [DOI] [PubMed] [Google Scholar]
- Long X, Chen Q, Yu L, Liang X, Liu W, Lu H. Bismuth improves efficacy of proton- pump inhibitor clarithromycin, metronidazole triple Helicobacter pylori therapy despite a high prevalence of antimicrobial resistance. Helicobacter. 2018;23:1–6. doi: 10.1111/hel.12485. [DOI] [PubMed] [Google Scholar]
- Song Z, Fu W, Zhou L. Cefuroxime, levofloxacin, esomeprazole, and bismuth as first line therapy for eradicating Helicobacter pylori in patients allergic to penicillin. BMC Gastroenterol. 2019;19:1–9. doi: 10.1186/s12876-019-1056-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Laisheng L, Yu H, Xiao L, Yingjie J, Lou Y, Hong L. Susceptibility-guided therapy for Helicobacter pylori-infected penicillin-allergic patients: A prospective clinical trial of first-line and rescue therapies. Helicobacter. 2020;25:1–8. doi: 10.1111/hel.12699. [DOI] [PubMed] [Google Scholar]
- Nguyen Cynthia T, Davis Kyle A, Nisly Sarah A, Li Julius. Treatment of Helicobacter pylori in Special Patient Populations. Pharmacotherapy. 2019;39:1012–22. doi: 10.1002/phar.2318. [DOI] [PubMed] [Google Scholar]
- Haute autorité de santé Traitement de l’infection par Helicobacter pylori chez l’adulte. [27 avril 2023]. https://www.hassante.fr/upload/docs/application/pdf/201706/dir83/helicobacter_fiche_pertinence_traitement.pdf
- Seiichi K, Toshiaki S, Shigeru T, Benjamin DG, Shinobu I, Takashi I. The updated JSPGHAN guidelines for the management of Helicobacter pylori infection in childhood. Pediatrics International. 2020;62:1315–31. doi: 10.1111/ped.14388. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Galicia Poblet G, Alarcón Cavero T, Alonso Pérez N, Borrell Martínez B, Botija Arcos G, Cilleruelo Pascual ML, et al. Management of Helicobacter pylori infection in the pediatric age. An Pediatr. 2021;95:e1–e9. doi: 10.1016/j.anpede.2021.05.004. [DOI] [PubMed] [Google Scholar]
- Jones NL, Koletzko S, Goodman K, Bontems P, Cadranel S, Casswall T, et al. Joint ESPGHAN/NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016) J Pediatr Gastroenterol Nutr. 2017;64:991–1003. doi: 10.1097/MPG.0000000000001594. [DOI] [PubMed] [Google Scholar]
- Zhang M, Zhang C, Zhao J, Zhang H, Zhai O, Chen W, et al. Meta-analysis of the efficacy of probiotic-supplemented therapy on the eradication of H. pylori and incidence of therapy-associated side effects. Microb Pathog. 2020;147:1–10. doi: 10.1016/j.micpath.2020.104403. [DOI] [PubMed] [Google Scholar]
- Dang Y, Reinhardt JD, Zhou X, et al. The effect of probiotics supplementation on Helicobacter pylori eradication rates and side effects during eradication therapy: a meta-analysis. PLoS One. 2014;9:e111030. doi: 10.1371/journal.pone.0111030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Lv Z, Wang BEN, Zhou X, et al. Efficacy and safety of probiotics as adjuvant agents for Helicobacter pylori infection: a meta-analysis. Exp Ther Med. 2015;9:707–716. doi: 10.3892/etm.2015.2174. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Zhou B-G, Chen L-X, Li B, et al. Saccharomyces boulardii as an adjuvant therapy for Helicobacter pylori eradication: a systematic review and meta-analysis with trial sequential analysis. Helicobacter. 2019;24:e12651. doi: 10.1111/hel.12651. [DOI] [PubMed] [Google Scholar]
- Szajewska H, Horvath A, Kołodziej M. Systematic review with meta-analysis: Saccharomyces boulardii supplementation and eradication of Helicobacter pylori infection. Aliment Pharmacol Ther. 2015;41:1237–1245. doi: 10.1111/apt.13214. [DOI] [PubMed] [Google Scholar]


