Abstract
Hintergrund
Die Kerndokumentation der Regionalen Kooperativen Rheumazentren erfasst jährlich Versorgungsdaten von Patient:innen mit entzündlich rheumatischen Erkrankungen.
Methodik
Für rheumatoide Arthritis (RA), Psoriasisarthritis (PsA), axiale Spondyloarthritis (axSpA), systemischen Lupus erythematodes (SLE), systemische Sklerose (SSc), Sjögren-Syndrom (SjS), idiopathische inflammatorische Myositiden (IIM), Polymyalgia rheumatica (PMR), Riesenzellerarteriitis (RZA), ANCA-assoziierte Vaskulitiden (AAV), Morbus Behçet (BD), „adult-onset Still’s disease“ (AOSD) und autoinflammatorische Erkrankungen (AIE) werden Daten aus dem Jahr 2023 berichtet. Angaben umfassen u. a. die ärztlich eingeschätzte Krankheitsaktivität auf einer numerischen Ratingskala (NRS) von 0–10, Therapien und patientenberichtete Outcomes. Für ausgewählte Diagnosen werden Entwicklungen von 2010 bis 2023 zu der ärztlichen Einschätzung der Krankheitsaktivität und zu Therapien dargestellt.
Ergebnisse
Aus 14 Einrichtungen wurden 13.884 Patient:innen dokumentiert, am häufigsten RA (5734), PsA (1741) und axSpA (1494). Das mittlere Alter lag zwischen 45 (BD) und 73 Jahren (RZA), die Krankheitsdauer betrug im Median 3 (PMR) bis 16 Jahre (axSpA). Die Krankheitsaktivität war überwiegend niedrig, bei 6 % (BD) bis 15 % (axSpA) stuften die Rheumatolog:innen sie moderat bis hoch (> 4 auf numerischer Ratingskala) ein. Biologische (b)DMARDs wurden am häufigsten bei axSpA (65 %), AOSD (58 %), PsA (53 %) und RZA (41 %) verordnet. Häufig waren Tumornekrosefaktor(TNF)-Inhibitoren bei axSpA (53 %), BD (30 %) und PsA (28 %), Interleukin(IL)-1-Inhibitoren bei AOSD (51 %) und AIE (50 %), IL-6Ri bei RZA (38 %), IL-17i bei PsA (17 %) und Rituximab bei AAV (29 %). Höhere Einschränkungen hinsichtlich Schmerz, Fatigue, Schlafstörungen und Wohlbefinden dokumentierten v. a. Betroffene mit IIM, SSc, axSpA und AIE. Von den unter 65-Jährigen waren 58 % (SSc) bis 77 % (axSpA) erwerbstätig. Eine Berentung wegen der rheumatischen Erkrankung hatten 5 % (AOSD) bis 18 % (AAV). In der Entwicklung seit 2010 ist der Anteil an Patienten in Remission oder sehr niedriger Krankheitsaktivität (NRS 0–1) diagnoseübergreifend gestiegen. Bei den Therapien sind ein Anstieg an b/tsDMARDs und ein Rückgang von Glukokortikoiden bei verschiedenen Diagnosen sichtbar.
Schlussfolgerung
Die Ergebnisse zeigen die Vielfältigkeit der entzündlich rheumatischen Diagnosen und das kontinuierlich wachsende Therapiespektrum in der Rheumatologie, einhergehend mit einer guten Krankheitskontrolle bei vielen Patient:innen.
Schlüsselwörter: Versorgungsforschung, Rheumatologie, Rheumatische Erkrankungen, Langzeitbeobachtung, „Disease-modifying antirheumatic drugs“(DMARD)-Therapie
Abstract
Background
Data of patients with inflammatory rheumatic diseases are annually recorded within the National Database of the German Collaborative Rheumatology Centers.
Methods
For rheumatoid arthritis (RA), psoriatic arthritis (PsA), axial spondylarthritis (axSpA), systemic lupus erythematosus (SLE), systemic sclerosis (SSc), Sjögren’s syndrome (SjS), idiopathic inflammatory myositis (IIM), polymyalgia rheumatica (PMR), giant cell arteritis (GCA), ANCA-associated vasculitis (AAV), Behçet’s disease (BD), adult onset Still’s disease (AOSD) and autoinflammatory diseases (AID) data are reported from 2023. Information includes physician-reported disease activity on a numeric rating scale (NRS) of 0–10, treatment and patient-reported outcomes. For selected diagnoses, developments from 2010 to 2023 are presented regarding physicians’ assessments of disease activity and treatment.
Results
A total of 13,884 patients were documented from 14 rheumatology centers, most frequently with RA (5734), PsA (1741) and axSpA (1494). The mean age ranged from 45 years (BD) to 73 years (GCA) and the median disease duration ranged from 3 years (PMR) to 16 years (axSpA). Disease activity was predominantly low, with 6% (BD) to 15% (axSpA) rated moderate to high (> 4 on the NMR) by rheumatologists. Biological disease-modifying antirheumatic drugs (bDMARD) were most frequently prescribed for axSpA (65%), AOSD (58%), PsA (53%) and GCA (41%). Tumor necrosis factor (TNF) inhibitors were frequently used in axSpA (53%), BD (30%) and PsA (28%), interleukin (IL)-1 inhibitors in AOSD (51%) and AID (50%), IL-6Ri in GCA (38%), IL17i in PsA (17%) and rituximab in AAV (29%). Higher levels of pain, fatigue, sleep disturbances and reduced well-being were reported by patients with IIM, SSc, axSpA and AID. Among those younger than 65 years, 58% (SSc) to 77% (axSpA) were employed. The percentage of early retirement due to rheumatic diseases was 5% (AOSD) to 18% (AAV). Since 2010 the development in the proportion of patients in remission or with very low disease activity (NRS 0-1) has increased across all diagnoses. In terms of treatment there has been an increase in b/tsDMARDs and a decrease in glucocorticoids for various diagnoses.
Conclusion
The results show the diversity of inflammatory rheumatic diagnoses and the continuously growing range of treatment in rheumatology along with good disease control in many patients.
Keywords: Health services research, Rheumatology, Rheumatic diseases, Long-term observational research, DMARD therapy
In der Kerndokumentation der Regionalen Kooperativen Rheumazentren werden jährlich ärztlich und patientenberichtete Daten zur rheumatologischen Versorgung und Krankheitslast von Patient:innen mit entzündlich rheumatischen Erkrankungen erhoben. Der Jahresbericht beinhaltet aktuelle Daten zu Krankheitsaktivität, Therapie und patientenberichtete Outcomes für das gesamte Spektrum rheumatischer Diagnosen. Erstmals werden auch Daten für das Still-Syndrom des Erwachsenen („adult-onset Still’s disease“ [AOSD]) und für genetische autoinflammatorische Erkrankungen (AIE) berichtet. Diese umfassen u. a. familiäres Mittelmeerfieber und Cryopyrin- bzw. Tumornekrosefaktor-assoziierte periodische Fiebersyndrome. Außerdem berichten wir Daten zur beruflichen Teilhabe bei Patient:innen im erwerbsfähigen Alter. Für ausgewählte Diagnosen werden zeitliche Trends von 2010 bis 2023 zur Krankheitsaktivität und zu den Therapien dargestellt.
Methodik
Die Kerndokumentation ist eine seit 1993 durchgeführte bundesweite prospektive Langzeitdokumentation. Patient:innen aus der rheumatologischen Routineversorgung werden 1‑mal im Jahr hinsichtlich ihres Krankheitsverlaufes dokumentiert [1]. In die Kerndokumentation können Patient:innen mit allen rheumatischen Erkrankungen eingeschlossen werden. Die Daten aus diesem Bericht beziehen sich auf das Auswertungsjahr 2023 und für die zeitlichen Trends auf die Jahre 2010 bis 2023. Für die Darstellung von Patientencharakteristika, Therapien und patientenberichteten Outcomes (PROs) sind nur Patient:innen mit einer gesicherten Diagnose berücksichtigt. Für folgende Diagnosen werden Daten ausgegeben: rheumatoide Arthritis (RA), Psoriasisarthritis (PsA), axiale Spondyloarthritis (axSpA), systemischer Lupus erythematodes (SLE), systemische Sklerose (SSc), Sjögren-Syndrom (SjS), idiopathische inflammatorische Myositiden (IIM), Polymyalgia rheumatica (PMR), Riesenzellarteriitis (RZA), ANCA-assoziierte Vaskulitiden (AAV), Morbus Behçet (BD), AOSD und AIE.
Die ärztlich eingeschätzte Krankheitsaktivität wird bei allen Krankheitsentitäten mit einer numerischen Ratingskala (NRS) von 0 bis 10 erfasst, wobei 0 keiner und 10 der höchsten Aktivität entspricht. Bei RA wird der Disease Activity Score (DAS28) bzw. der Clinical oder Simple Disease Activity Index (CDAI oder SDAI) erhoben, bei axSpA der Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) und der Axial Spondyloarthritis Disease Activity Score (ASDAS). Bei SLE werden in einigen Einrichtungen der European Consensus Lupus Activity Measurement (ECLAM) und der Systemic Lupus Disease Activity Index (SLEDAI) erhoben.
Als medikamentöse Therapien werden erfasst: Glukokortikoide (GC), alle konventionell synthetischen (cs), biologischen (b) und zielgerichteten (englisch „targeted synthetic“ [ts]) immunmodulierenden Medikamente (englisch „disease-modifying antirheumatic drugs“ [DMARDs]), nichtsteroidale Antirheumatika (NSAR), nicht opioidhaltige Analgetika und Opioide. Die Abfrage nichtmedikamentöser Therapien umfasst Physiotherapie, Ergotherapie, Rheumafunktionstraining und Patientenschulung.
Patientenberichtete Outcomes (PRO) beinhalten u. a. den allgemeinen Gesundheitszustand, Krankheitsaktivität, Schmerzen, Erschöpfung/Müdigkeit, Schlafstörungen, Schwierigkeiten bei körperlichen Tätigkeiten sowie psychisches und körperliches Wohlbefinden, jeweils bezogen auf die letzte Woche. Diese werden mit einer NRS, adaptiert vom Rheumatoid Arthritis Impact of Disease (RAID) [2] erfasst. Für die Funktionsfähigkeit wird bei RA der Funktionsfragebogen Hannover (FFbH) und bei axSpA der Bath Ankylosing Spondylitis Functional Index (BASFI) erhoben.
Bezüglich der beruflichen Teilhabe dokumentieren die Patient:innen, ob sie erwerbstätig (in Voll- oder Teilzeit, arbeitslos/in Ausbildung/Umschulung) sind, ob mindestens eine Arbeitsunfähigkeit in den letzten 12 Monaten aufgrund der rheumatischen Erkrankung bestand und, falls ja, Anzahl der Tage sowie Erwerbs- oder Berufsunfähigkeit aufgrund der rheumatischen Erkrankung.
Ergebnisse
Im Jahr 2023 erhoben 14 rheumatologische Einrichtungen (7 Praxen, 1 Krankenhaus und 6 Universitätskliniken) Daten für die Kerndokumentation. Dokumentiert wurden insgesamt 13.884 ambulant versorgte Patient:innen. Die häufigsten Krankheitsentitäten waren RA (n = 5734), PsA (n = 1741), axSpA (n = 1494) und SLE (n = 937), s. Tab. 1. Über die Hälfte der Patient:innen (62 %) wurde über die ambulante spezialfachärztliche Versorgung (ASV), 30 % über die Regelversorgung und 8 % über eine Hochschul‑/Ermächtigungsambulanz abgerechnet.
Tab. 1.
Patientencharakteristika von 2023
| RA | PsA | axSpA | SLE | SSc | SjS | IIM | MCTD | PMR | RZA | AAV | BD | AOSD | AIE | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N | 5734 | 1741 | 1494 | 937 | 343 | 224 | 108 | 147 | 446 | 390 | 305 | 159 | 85 | 87 |
| Weiblich (%) | 73 % | 56 % | 38 % | 88 % | 76 % | 92 % | 64 % | 85 % | 59 % | 72 % | 56 % | 43 % | 66 % | 58 % |
| BMI, MW (SD) |
27 (6) |
28 (6) |
27 (5) |
25 (5) |
25 (5) |
25 (6) |
27 (6) |
26 (6) |
27 (5) |
26 (4) |
26 (6) |
26 (4) |
26 (6) |
27 (6) |
| BMI ≥ 30 kg/m2 (%) | 24 % | 33 % | 27 % | 17 % | 12 % | 15 % | 21 % | 19 % | 20 % | 15 % | 21 % | 15 % | 23 % | 25 % |
| Alter in 2023 in Jahren, MW (SD) |
62 (14) |
56 (14) |
50 (14) |
49 (15) |
58 (14) |
55 (14) |
56 (16) |
53 (15) |
71 (9) |
73 (9) |
61 (14) |
45 (11) |
48 (14) |
38 (14) |
| Erkrankungsalter in Jahren, MW (SD) |
48 (16) |
42 (15) |
31 (13) |
31 (14) |
45 (14) |
42 (14) |
45 (16) |
37 (17) |
66 (10) |
67 (9) |
49 (15) |
28 (10) |
36 (15) |
17 (14) |
| Krankheitsdauer in 2023 in Jahren, MW (SD) |
14 (11) |
14 (11) |
18 (13) |
17 (11) |
12 (9) |
13 (9) |
11 (8) |
16 (10) |
5 (7) |
6 (5) |
11 (8) |
17 (10) |
12 (10) |
21 (12) |
| Krankheitsdauer, Median | 11 | 11 | 16 | 16 | 11 | 12 | 9 | 16 | 3 | 4 | 9 | 16 | 9 | 20 |
| Krankheitsdauer < 2 Jahre (%) | 8 % | 7 % | 4 % | 6 % | 6 % | 5 % | 14 % | 7 % | 37 % | 21 % | 7 % | 3 % | 7 % | 0 % |
RA rheumatoide Arthritis, PsA Psoriasisarthritis, axSpA axiale Spondyloarthritis, SLE systemischer Lupus erythematodes, SSc systemische Sklerose, SjS primäres Sjögren-Syndrom, IIM idiopathische Inflammatorische Myositiden, MCTD „mixed connective tissue diseases“, PMR Polymyalgia rheumatica, RZA Riesenzellarteriitis, AAV ANCA-assoziierte Vaskulitiden, BD Morbus Behçet, AOSD „adult-onset Still’s disease“, AIE autoinflammatorische Erkrankungen. MW Mittelwert, SD Standardabweichung, BMI Body Mass Index
Patientencharakteristika
Das mittlere Alter der Patient:innen variierte von 45 Jahren (BD) bis 73 Jahre (RZA). Die Krankheitsdauer lag im Median zwischen 3 Jahren bei PMR und 16 Jahren bei axSpA. Das mittlere Alter bei Erkrankung lag zwischen 28 Jahren bei BD und 67 Jahren bei RZA. Drei Prozent (BD) bis 37 % (PMR) hatten eine Krankheitsdauer unter 2 Jahren. Der Anteil an Frauen war mit 92 % bei primärem Sjögren-Syndrom (SjS) am höchsten und mit 38 % bei axSpA am niedrigsten.
Krankheitsaktivität und Remission
Die auf der NRS angegebene ärztlich dokumentierte Krankheitsaktivität lag krankheitsübergreifend im niedrigen Bereich: Der Mittelwert war am niedrigsten bei BD (0,9 ± 1,3) und am höchsten bei axSpA (1,8 ± 1,8). Bei 6 (BD) bis 15 % (axSpA) stuften die Rheumatolog:innen die Aktivität als moderat bis hoch (> 4) ein, s. Tab. 2.
Tab. 2.
Krankheitsaktivität nach ärztlicher Einschätzung
| RA | PsA | axSpA | SLE | SSc | SjS | IIM | MCTD | PMR | RZA | AAV | BD | AOSD | AIE | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Krankheitsaktivität, ärztliche Einschätzung, NRS 0–10, MW (SD) |
1,5 (1,7) |
1,7 (1,8) |
1,8 (1,8) |
1,3 (1,4) |
1,8 (1,5) |
1,7 (1,6) |
1,5 (1,6) |
1,3 (1,2) |
1,1 (1,4) |
1,1 (1,4) |
1,3 (1,5) |
0,9 (1,3) |
1,3 (1,8) | 1,3 (1,7) |
| Moderat bis hoch (4–10), % | 13 | 14 | 15 | 8 | 13 | 12 | 12 | 6 | 9 | 7 | 9 | 6 | 10 | 11 |
RA rheumatoide Arthritis, PsA Psoriasisarthritis, axSpA axiale Spondyloarthritis, SLE systemischer Lupus erythematodes, SSc systemische Sklerose, SjS primäres Sjögren-Syndrom, IIM idiopathische inflammatorische Myositiden, MCTD „mixed connective tissue diseases“, PMR Polymyalgia rheumatica, RZA Riesenzellarteriitis, AAV ANCA-assoziierte Vaskulitiden, BD Morbus Behçet, AOSD „adult-onset Still’s disease“, AIE autoinflammatorische Erkrankungen, MW Mittelwert, SD Standardabweichung, NRS numerische Ratingskala, 0 entspricht inaktiver und 10 hochaktiver Erkrankung
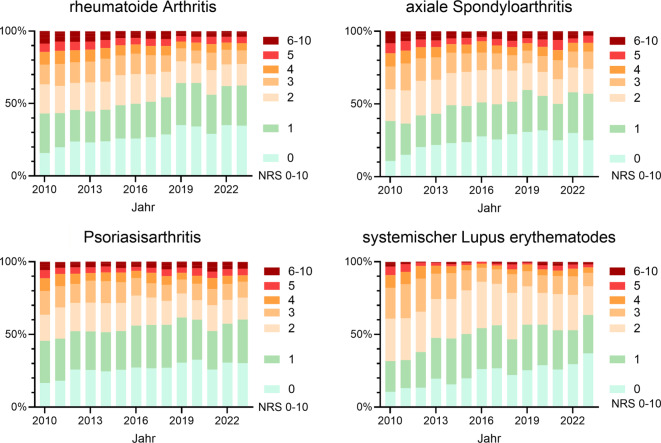
Seit 2010 ist die Zahl der Patient:innen in Remission bzw. mit sehr niedriger Krankheitsaktivität (NRS 0 oder 1) diagnoseübergreifend gestiegen (Abb. 1).
Abb. 1.
Ärztlich eingeschätzte Krankheitsaktivität auf numerischer Ratingskala von 0 (keine) bis 10 (sehr hohe Aktivität). Dargestellt ist der prozentuale Anteil an Patient:innen mit der jeweiligen Einschätzung in den Jahren 2010 bis 2023
Von den RA-Patient:innen befanden sich 47 % in DAS28-BSG-Remission (< 2,6), 19 % hatten eine niedrige (2,6–3,2), 29 % eine mittlere (> 3,2–5,1) und 5 % (> 5,1) eine hohe Krankheitsaktivität. Nach dem CDAI waren 25 % in Remission (≤ 2,8), 51 % hatten eine niedrige (2,8–10), 19 % eine moderate (11–22) und 5 % eine hohe (> 22) Krankheitsaktivität. Von den axSpA-Patient:innen hatten 22 % gemäß dem ASDAS-CRP eine inaktive Erkrankung (< 1,3), 28 % eine moderate (1,3 bis < 2,1), 43 % eine hohe (2,1–3,5) und 8 % eine sehr hohe (> 3,5) Krankheitsaktivität. Nach dem BASDAI hatten 30 % eine niedrige (0–2), 30 % eine mittlere (< 2–4) und 40 % eine hohe Krankheitsaktivität (> 4).
Der ECLAM wurde bei 96 SLE-Patientinnen erfasst. Nach dem ECLAM-Score (0–10, 0 entsprechend einer inaktiven Erkrankung) betrug der Score bei 14 % 0, bei 26 % 1, bei 50 % 2, bei 6 % 3, bei 2 % 4 und bei 2 % 5. Am häufigsten waren Fieber/Fatigue (31 %) und eine hämatologische Beteiligung (19 %).
Glukokortikoide, NSAR und Schmerzmedikation
Im Jahr 2023 wurden 27 % der Patient:innen mit RA, 44 % mit SLE und 54 % mit AAV mit Glukokortikoiden (GC) behandelt, die Prozentzahlen für die weiteren Diagnosen sind in Tab. 3 angeführt. Davon hatten etwa 80 % eine niedrige Dosis von bis zu 5 mg Prednisolonäquivalent pro Tag. AOSD-Patient:innen hatten zu 39 % und PMR-Patient:innen zu 35 % > 5 mg pro Tag. NSAR wurden v. a. bei axSpA (64 %), PsA (43 %) und RA (41 %) eingesetzt. Sechs bis 22 % der Patient:innen erhielten nicht opioidhaltige Analgetika und 3 % (BD) bis 8 % (AOSD) nahmen ein Opioid ein.
Tab. 3.
Konventionelle medikamentöse Therapien
| RA | PsA | axSpA | SLE | SSc | SjS | IIM | MCTD | PMR | RZA | AAV | BD | AOSD | AIE | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Glukokortikoide | 27 | 9 | 5 | 44 | 17 | 27 | 43 | 35 | 57 | 45 | 54 | 35 | 27 | 7 |
| Davon ≤ 5 mg/Tag | 79 | 72 | 74 | 81 | 71 | 83 | 78 | 88 | 65 | 73 | 84 | 80 | 61 | 83 |
| NSAR | 41 | 43 | 64 | 23 | 14 | 26 | 15 | 23 | 24 | 12 | 11 | 18 | 27 | 26 |
| Analgetikaa | 17 | 14 | 16 | 17 | 11 | 17 | 18 | 19 | 18 | 22 | 17 | 13 | 13 | 6 |
| Opioide | 6,8 | 7,6 | 7,7 | 5,2 | 3,0 | 5,9 | 4,7 | 6,2 | 5,4 | 5,9 | 5,3 | 3,2 | 8,4 | 3,4 |
| Basistherapie (cs/b/tsDMARD) | 90 | 86 | 73 | 91 | 61 | 71 | 80 | 78 | 38 | 64 | 80 | 62 | 76 | 56 |
| csDMARD | 65 | 42 | 12 | 88 | 58 | 67 | 75 | 71 | 36 | 26 | 53 | 34 | 29 | 5 |
| Azathioprin | 0,2 | 0,1 | 0,4 | 17 | 4,3 | 6,3 | 19 | 10 | 0,5 | 1,6 | 23 | 23 | 0 | 1,2 |
| Ciclosporin A | 0 | 0,1 | 0 | 1,2 | 0 | 0,9 | 1,9 | 0 | 0 | 0 | 0 | 1,9 | 2,4 | 0 |
| Cyclophosphamid | 0 | 0 | 0 | 0,5 | 0,9 | 0 | 0 | 0 | 0 | 0 | 1,0 | 0 | 0 | 0 |
| Hydroxychloroquin | 5,6 | 0,4 | 0,1 | 76 | 9,0 | 54 | 6,5 | 50 | 0,7 | 0 | 0 | 0,6 | 2,4 | 1,2 |
| Leflunomid | 6,5 | 2,7 | 0,4 | 0,2 | 0,6 | 0,9 | 1,9 | 2,8 | 3,0 | 0,3 | 2,0 | 0 | 0 | 1,2 |
| Methotrexat | 53 | 37 | 7,3 | 9,5 | 25 | 10 | 42 | 17 | 32 | 25 | 27 | 8,9 | 25 | 2,3 |
| Mycophenolat | 0 | 0,1 | 0,1 | 16 | 21 | 1,8 | 12 | 4,1 | 0 | 0 | 2,6 | 0 | 0 | 0 |
| Sulfasalazin | 3,5 | 2,1 | 3,5 | 0,1 | 0 | 0 | 0 | 0 | 0,5 | 0 | 0 | 0,6 | 0 | 0 |
Alle Angaben sind Prozentwerte
RA rheumatoide Arthritis, PsA Psoriasisarthritis, axSpA axiale Spondyloarthritis, SLE systemischer Lupus erythematodes, SSc systemische Sklerose, SjS primäres Sjögren-Syndrom, IIM idiopathische inflammatorische Myositiden, MCTD „mixed connective tissue diseases“, NSAR nichtsteroidale Antirheumatika, PMR Polymyalgia rheumatica, RZA Riesenzellarteriitis, AAV ANCA-assoziierte Vaskulitiden, BD Morbus Behçet, AOSD „adult-onset Still’s disease“, AIE autoinflammatorische Erkrankungen
aNicht opioidhaltig
csDMARDs
Eine Therapie mit einem csDMARD, bDMARD oder tsDMARD hatten 62 % (BD) bis 91 % (SLE) der Patient:innen. Methotrexat (MTX) war das am häufigsten verwendete csDMARD (s. Tab. 3). MTX wurde v. a. bei RA (53 %), IIM (42 %) und PsA (37 %) verwendet. Azathioprin kam am häufigsten bei AAV und BD (je 23 %) zum Einsatz. Bei SLE (76 %), SjS (54 %) und MCTD (50 %) war Hydroxychloroquin (HCQ) das häufigste csDMARD. Mycophenolat-Mofetil spielte am ehesten bei SSc (21 %) und bei SLE (16 %) eine Rolle. Leflunomid (6,5 % bei RA, 2,7 % PsA), Sulfasalazin, Ciclosporin A und Cyclophosphamid waren nur bei wenigen Patient:innen Bestandteil der Therapie.
bDMARDs
Biologische (b)DMARDs wurden am häufigsten bei axSpA (65 %), AOSD (58 %), PsA (53 %) und AIE (52 %) verordnet (s. Tab. 4). Auch bei RZA (41 %), RA (33 %), AAV (34 %) und BD (31 %) erhielt jeder dritte Patient ein bDMARD. Die am häufigsten eingesetzte bDMARD-Gruppe waren TNF-Inhibitoren (TNFi), v. a. bei axSpA (53 %), BD (30 %), PsA (28 %) und RA (21 %). Bei PsA waren auch IL-17-Inhibitoren (17 %) und IL-12/23-Inhibitoren (7 %) relevant. Patient:innen mit AOSD und AIE wurden mit den IL-1-Inhibitoren Anakinra und Canakinumab behandelt.
Tab. 4.
Biologische DMARDs
| RA | PsA | axSpA | SLE | SSc | SjS | IIM | MCTD | PMR | RZA | AAV | BD | AOSD | AIE | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| bDMARD (any) | 33 | 53 | 65 | 18 | 5,6 | 8,1 | 13 | 10 | 2,7 | 41 | 34 | 31 | 58 | 52 |
| TNFi | 21 | 28 | 53 | 0,4 | 0,6 | 0 | 0 | 1,4 | 0,9 | 1,1 | 0,7 | 30 | 3,6 | 2,3 |
| – Adalimumab | 8,6 | 15 | 25 | 0,3 | 0,6 | 0 | 0 | 0,7 | 0 | 0 | 0,7 | 7,0 | 2,4 | 1,2 |
| – Certolizumab | 2,7 | 2,9 | 4,3 | 0 | 0 | 0 | 0 | 0,7 | 0 | 0 | 0 | 0 | 0 | 0 |
| – Etanercept | 8,6 | 5,4 | 9,8 | 0 | 0 | 0 | 0 | 0 | 0,9 | 0,8 | 0 | 0 | 0 | 0 |
| – Golimumab | 1,3 | 2,7 | 7,8 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1,3 | 0 | 1,2 |
| – Infliximab | 0,6 | 1,4 | 6,8 | 0 | 0 | 0 | 0 | 0 | 0 | 0,3 | 0 | 13 | 1,2 | 0 |
| T‑Zell-Kostimulation‑i Abatacept | 3,0 | 0,5 | 0 | 0,4 | 0,3 | 0,9 | 0,9 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| BLySi Belimumab | 0 | 0 | 0 | 14 | 0 | 0,5 | 0 | 1,4 | 0 | 0 | 0 | 0 | 0 | 0 |
| IFNαRi Anifrolumab | 0 | 0 | 0 | 0,5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B‑Zell-Depletion Rituximab | 3,4 | 0,1 | 0 | 1,5 | 1,9 | 6,3 | 11 | 4,8 | 0 | 0 | 29 | 0,6 | 0 | 0 |
| IL-1i: Anakinra | 0,2 | 0 | 0 | 0,3 | 0 | 0 | 0,9 | 0 | 0,2 | 0,5 | 0,3 | 0 | 38 | 15 |
| – Canakinumab | 0 | 0 | 0 | 0,1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 13 | 35 |
| IL-5i: Mepolizumab | 0,1a | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3,9 | 0 | 0 | 0 |
| IL-6Ri | 4,6 | 0,2 | 0,1 | 0 | 2,8 | 0,5 | 0 | 2,8 | 1,6 | 39 | 0,3 | 0 | 3,6 | 0 |
| – Tocilizumab | 3,6 | 0,2 | 0,1 | 0 | 2,8 | 0,5 | 0 | 2,8 | 1,6 | 39 | 0,3 | 0 | 1,2 | 0 |
| – Sarilumab | 0,9 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2,4 | 0 |
| IL-23i und IL-12/23i | 0,2 | 7,2 | 1,2 | 0,2 | 0 | 0 | 0 | 0 | 0 | 0 | 0,3 | 0 | 0 | 0 |
| IL-23i Guselkumab | 0,1a | 4,0 | 0,5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Risankizumab | 0 | 0,8 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| IL-12/23i Ustekinumab | 0,1a | 2,4 | 0,7 | 0,2 | 0 | 0 | 0 | 0 | 0 | 0 | 0,3 | 0 | 0 | 0 |
| IL-17i | 0,1 | 17 | 9,4 | 0 | 0 | 0 | 0 | 0,7 | 0 | 0,5 | 0 | 0 | 0 | 0 |
| – Ixekizumab | 0,1a | 5,5 | 1,7 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| – Secukinumab | 0 | 11 | 7,3 | 0 | 0 | 0 | 0 | 0,7 | 0 | 0,5 | 0 | 0 | 0 | 0 |
| – Bimekizumab | 0 | 0,5 | 0,3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
Alle Angaben sind Prozentwerte
RA rheumatoide Arthritis, PsA Psoriasisarthritis, axSpA axiale Spondyloarthritis, SLE systemischer Lupus erythematodes, SSc systemische Sklerose, SjS primäres Sjögren-Syndrom, IIM idiopathische inflammatorische Myositiden, MCTD „mixed connective tissue diseases“, PMR Polymyalgia rheumatica, RZA Riesenzellarteriitis, AAV ANCA-assoziierte Vaskulitiden, BD Morbus Behçet, AOSD „adult-onset Still’s disease“, AIE autoinflammatorische Erkrankungen. IL Interleukin, TNFi Tumornekrosefaktorinhibitoren, bDMARD „biologic DMARD“
aWeitere Diagnosen vorliegend
Tocilizumab wurde häufig bei RZA (39 %) eingesetzt, dazu kamen IL-6Ri auch bei 5 % der RA-Patient:innen zum Einsatz. Rituximab war die häufigste bDMARD-Therapie bei AAV (29 %), wurde aber auch bei RA und „off label“ bei Kollagenosen eingesetzt. SLE-Patient:innen erhielten zu 14 % Belimumab und – neu – zu 0,5 % Anifrolumab. Mepolizumab wurde bei 12 von 53 (23 %) der Patient:innen mit einer eosinophilen Granulomatose mit Polyangiitis (EGPA) verordnet.
tsDMARDs
Januskinaseinhibitoren (JAKi) kamen v. a. bei der RA (11 %) zum Einsatz (s. Tab. 5). Es wurden mehrheitlich Baricitinib (4,1 %) und Upadacitinib (4,4 %), seltener Filgotinib (2,0 %) und Tofacitinib (0,8 %) verordnet.
Tab. 5.
Zielgerichtete („targeted-synthetic“) DMARDs
| RA | PsA | axSpA | SLE | SSc | SjS | IIM | MCTD | PMR | RZA | AAV | BD | AOSD | AIE | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| tsDMARD | 11 | 6,4 | 3,2 | 0,9 | 0 | 0,5 | 0,9 | 3,4 | 0,5 | 0,5 | 0,3 | 7,6 | 0 | 0 |
| JAKi | 11 | 4,4 | 3,1 | 0,9 | 0 | 0,5 | 0,9 | 3,4 | 0,5 | 0,5 | 0,3 | 0,6 | 0 | 0 |
| – Baricitinib | 4,1 | 0 | 0,1 | 0,3 | 0 | 0 | 0 | 0,7 | 0 | 0 | 0,3 | 0 | 0 | 0 |
| – Filgotinib | 2,0 | 0 | 0 | 0,2 | 0 | 0 | 0 | 1,4 | 0 | 0 | 0 | 0 | 0 | 0 |
| – Tofacitinib | 0,8 | 0,7 | 0,4 | 0,1 | 0 | 0 | 0,9 | 0 | 0 | 0 | 0 | 0,6 | 0 | 0 |
| – Upadacitinib | 4,4 | 3,6 | 2,6 | 0,2 | 0 | 0,5 | 0 | 1,4 | 0,5 | 0,5 | 0 | 0 | 0 | 0 |
| Apremilast | 0 | 2,0 | 0,1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 7,0 | 0 | 0 |
Alle Angaben sind Prozentwerte
RA rheumatoide Arthritis, PsA Psoriasisarthritis, axSpA axiale Spondyloarthritis, SLE systemischer Lupus erythematodes, SSc systemische Sklerose, SjS primäres Sjögren-Syndrom, IIM idiopathische inflammatorische Myositiden, MCTD „mixed connective tissue diseases“, PMR Polymyalgia rheumatica, RZA Riesenzellarteriitis, AAV ANCA-assoziierte Vaskulitiden, BD Morbus Behçet, AOSD „adult-onset Still’s disease“, AIE autoinflammatorische Erkrankungen. JAKi Januskinaseinhibitoren, tsDMARD „targeted synthetic DMARD“
Apremilast kam bei BD (7 %) und bei PsA (2 %) zum Einsatz.
Im zeitlichen Verlauf zeigen sich seit 2010 diagnoseübergreifend ein Anstieg an b/tsDMARD-Therapien und ein Rückgang im Einsatz von Glukokortikoiden (s. Abb. 2).
Abb. 2.
Medikamentöse Therapien in den Jahren 2010 bis 2023. Dargestellt ist der prozentuale Anteil an Patient:innen mit der jeweiligen Therapie. cs „conventionel synthetic“, ts „targeted synthetic“, b „biologic“, DMARD „disease-modifying antirheumatic drugs“, IL Interleukin, NSAR nichtsteroidale Antirheumatika
Ergänzende nichtmedikamentöse Therapiemaßnahmen
In den letzten 12 Monaten erhielten 31 % (RA), 37 % (PsA), 50 % (axSpA) und 20 % (SLE) Physiotherapie. Bei schweren Funktionseinschränkungen gemäß FFbH (< 50) lag der Anteil bei 50 % (RA) bzw. gemäß BASFI (> 4) bei 63 % (axSpA). Ergotherapie erhielten 6 % (SLE) bis 8 % (RA).
Patientenberichtete Outcomes
Die patientenberichtete Krankheitsaktivität lag krankheitsübergreifend im mittleren Bereich (s. Tab. 6). Der Mittelwert nach der NRS lag bei Werten von 2,7 ± 2,4 (AOSD) bis 4,1 ± 2,4 (SSc). Im Vergleich zur ärztlichen Einschätzung gaben die Betroffenen im Mittel jeweils eine um etwa 2 Einheiten (auf der 0‑ bis 10er-Skala) höhere Krankheitsaktivität an. Schmerzen wurden am stärksten bei axSpA bewertet (4,0 ± 2,3). Der MW von Fatigue war auch bei axSpA, bei SSc, IIM und AIE am höchsten (alle ≥ 4,5). Patient:innen mit IIM und SjS dokumentierten die stärksten Einschränkungen bei Schlafstörungen, psychischem und körperlichem Wohlbefinden.
Tab. 6.
Patientenberichtete Outcomes nach NRS (0–10), MW (SD)
| RA | PsA | axSpA | SLE | SSc | SjS | IIM | MCTD | PMR | RZA | AAV | BD | AOSD | AIE | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Krankheitsaktivität |
3,5 (2,4) |
3,5 (2,4) |
3,7 (2,5) |
3,0 (2,4) |
4,1 (2,3) |
3,9 (2,4) |
3,6 (2,5) |
3,4 (2,4) |
3,5 (2,4) |
3,5 (2,7) |
2,9 (2,5) |
3,1 (2,4) |
2,7 (2,4) | 2,8 (2,5) |
| Gesundheitszustand |
4,1 (2,2) |
4,1 (2,3) |
4,1 (2,2) |
3,8 (2,3) |
4,5 (2,2) |
4,3 (2,2) |
4,2 (2,1) |
3,9 (2,2) |
4,2 (2,2) |
4,0 (2,2) |
3,9 (2,3) |
3,9 (2,3) |
3,6 (2,2) | 3,4 (2,5) |
| Schmerzen |
3,7 (2,5) |
3,9 (2,6) |
4,0 (2,5) |
3,1 (2,7) |
3,9 (2,7) |
3,7 (2,5) |
3,1 (2,7) |
3,6 (2,7) |
3,4 (2,5) |
3,1 (2,6) |
2,7 (2,6) |
3,0 (2,8) |
2,9 (2,4) | 2,9 (3,1) |
| Fatigue |
4,2 (2,9) |
4,4 (3,0) |
4,4 (2,9) |
4,3 (3,0) |
4,6 (3,0) |
4,6 (3,0) |
4,7 (2,9) |
4,4 (3,0) |
3,7 (2,8) |
3,8 (2,9) |
3,6 (3,0) |
3,9 (3,1) |
4,0 (3,2) | 4,5 (3,1) |
| Körperliche Schwierigkeiten |
3,6 (2,7) |
3,7 (2,8) |
3,8 (2,7) |
3,0 (2,7) |
3,9 (2,8) |
3,3 (2,7) |
3,7 (3,1) |
3,4 (2,8) |
3,3 (2,6) |
3,2 (2,8) |
2,8 (2,8) |
2,8 (2,8) |
2,6 (2,6) |
2,8 (3,1) |
| Schlafstörungen |
4,0 (3,1) |
4,2 (3,2) |
4,1 (3,1) |
4,3 (3,3) |
4,3 (3,2) |
4,4 (3,3) |
4,4 (3,3) |
4,1 (3,2) |
4,0 (3,1) |
3,8 (3,1) |
3,3 (3,1) |
4,1 (3,3) |
3,5 (3,1) | 3,9 (3,8) |
| Psychisches Wohlbefinden |
3,7 (2,6) |
3,7 (2,8) |
3,7 (2,7) |
3,6 (2,7) |
3,9 (2,8) |
3,9 (2,7) |
4,2 (2,8) |
3,4 (2,6) |
3,6 (2,6) |
3,4 (2,6) |
3,1 (2,6) |
3,7 (2,9) |
3,3 (2,8) | 3,8 (3,0) |
| Körperliches Wohlbefinden |
4,1 (2,5) |
4,3 (2,5) |
4,2 (2,4) |
3,8 (2,5) |
4,5 (2,5) |
4,3 (2,5) |
4,4 (2,5) |
4,0 (2,6) |
3,9 (2,4) |
3,8 (2,4) |
3,5 (2,5) |
3,5 (2,6) |
3,9 (2,9) | 4,2 (2,6) |
Alle Angaben werden auf numerischen Ratingskalen von 0–10 erfasst, 0 ist jeweils der beste Wert und entspricht keiner Einschränkung. Angegeben sind jeweils Mittelwert und Standardabweichung
RA rheumatoide Arthritis, PsA Psoriasisarthritis, axSpA axiale Spondyloarthritis, SLE systemischer Lupus erythematodes, SSc systemische Sklerose, SjS primäres Sjögren-Syndrom, IIM idiopathische inflammatorische Myositiden, MCTD „mixed connective tissue diseases“, PMR Polymyalgia rheumatica, RZA Riesenzellarteriitis, AAV ANCA-assoziierte Vaskulitiden, BD Behçet Disease, AOSD „adult-onset Still’s disease“, AIE autoinflammatorische Erkrankungen
Berufliche Teilhabe
Von den Patient:innen im erwerbsfähigen Alter (< 65 Jahre) waren 58 % (SSc) bis 77 % (axSpA) erwerbstätig. Bei allen Diagnosen bis auf IIM waren Männer häufiger erwerbstätig als Frauen, insbesondere der Anteil an Vollzeittätigkeit lag bei Männern deutlich höher. Innerhalb der letzten 12 Monate waren 19 % (PsA) bis 38 % (PMR) arbeitsunfähig mit 14 bis 28 Fehltagen im Median. Eine Erwerbsminderungsrente wegen der rheumatischen Erkrankung hatten 3 % (PMR) bis 18 % (AAV) der unter 65-Jährigen (Tab. 7).
Tab. 7.
Berufliche Teilhabe bei Patienten unter 65 Jahren
| RA | PsA | axSpA | SLE | SSc | SjS | IIM | MCTD | PMR | RZA | AAV | BD | AOSD | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Gesamt, N | 2549 | 983 | 1018 | 654 | 171 | 122 | 59 | 88 | 96 | 60 | 130 | 111 | 61 |
| Erwerbstätig (%) | 68 | 71 | 77 | 64 | 58 | 60 | 68 | 63 | 73 | 60 | 64 | 67 | 72 |
| – In Vollzeit (%) | 45 | 53 | 62 | 37 | 32 | 31 | 39 | 33 | 53 | 32 | 40 | 52 | 43 |
| – In Teilzeit (%) | 23 | 18 | 15 | 27 | 26 | 30 | 29 | 30 | 20 | 28 | 24 | 15 | 30 |
| AU im letzten Jahr (%) | 20 | 19 | 20 | 20 | 24 | 22 | 32 | 31 | 38 | b | 29 | 21 | 30 |
| Tage, median | 14 | 18 | 14 | 14 | 17 | 14 | 17 | 14 | 15 | b | 20 | 21 | 28 |
| Berentung Rheumaa (%) | 9 | 7 | 6 | 14 | 16 | 9 | 15 | 17 | 3 | 10 | 18 | 8 | 5 |
| Frauen, N | 1868 | 543 | 386 | 583 | 122 | 113 | 36 | 77 | 48 | 46 | 75 | 51 | 42 |
| Erwerbstätig (%) | 67 | 66 | 72 | 64 | 56 | 61 | 72 | 65 | 65 | 59 | 58 | 60 | 74 |
| – In Vollzeit (%) | 38 | 37 | 44 | 34 | 24 | 32 | 33 | 32 | 25 | 22 | 25 | 35 | 33 |
| – In Teilzeit (%) | 29 | 29 | 29 | 30 | 33 | 31 | 39 | 33 | 40 | 37 | 33 | 25 | 40 |
| Männer, N | 681 | 440 | 632 | 71 | 49 | 9 | 23 | 11 | 48 | 14 | 55 | 60 | 19 |
| Erwerbstätig (%) | 71 | 78 | 80 | 65 | 64 | b | 61 | b | 81 | b | 73 | 73 | b |
| – In Vollzeit (%) | 65 | 73 | 74 | 58 | 54 | b | 48 | b | 81 | b | 62 | 67 | b |
| – In Teilzeit (%) | 6 | 5 | 7 | 7 | 10 | b | 13 | b | 0 | b | 11 | 7 | b |
aBerentung aufgrund der rheumatischen Erkrankung
bBei kleinen Fallzahlen keine Angabe
Diskussion
Die Kerndokumentation liefert seit 30 Jahren aktuelle Daten zur Versorgung von Patient:innen mit entzündlich rheumatischen Erkrankungen, die sich in fachärztlicher rheumatologischer ambulanter Behandlung befinden.
Hinsichtlich der medikamentösen Therapie zeigt sich die kontinuierliche Erweiterung des rheumatologischen Therapiespektrums v. a. im Bereich der Interleukininhibitoren: IL-1i und IL-1Ri werden bei AOSD und AIE, IL-5i bei EGPA, IL-6Ri bei RZA und RA, IL-12/23i und IL-23i bei PsA und IL-17i bei PsA und axSpA eingesetzt. Dazu kommen neben den TNFi noch die Inhibition von BLyS, die TypI-IFNR-Blockade sowie Kostimulationsblockade und B‑Zell-Depletion. Der Einsatz von GC ist seit 2010 diagnoseübergreifend deutlich rückläufig, während spezifische Therapien mit Biologika und tsDMARDs zunehmend eingesetzt werden. Weitere Trends können über die Versorgungstrends der Kerndokumentation verfolgt werden [3].
Bei den patientenberichteten Outcomes gibt es diagnosespezifische Unterschiede im Schweregrad der Angaben. Insgesamt zeichnet sich im Vergleich mit früheren Jahren kaum eine Verbesserung der Parameter ab, selbst bei den Diagnosen wie RA und axSpA, die heute gut medikamentös behandelt werden können. Bei der Interpretation muss aber berücksichtigt werden, dass die Kerndokumentation ein Kollektiv langjährig erkrankter Patient:innen abbildet (die mediane Krankheitsdauer liegt für die meisten Diagnosen bei über 10 Jahren) und derzeit nur wenige Neuerkrankte dokumentiert werden. Ob eine frühe intensive Therapie auch die PROs nachhaltig verbessern kann, lässt sich anhand dieser Daten nicht beantworten.
Die berufliche Teilhabe bei Patient:innen mit Vaskulitiden und Kollagenosen ist mit insgesamt etwa 64 % noch geringer als bei den Arthritiden mit 68–77 %, was die noch nicht ausreichende Verfügbarkeit von effektiven biologischen bzw. zielgerichteten Therapien bei diesen Diagnosen widerspiegelt. Eine ausführliche Analyse der Erwerbstätigkeit im Vergleich zu Bevölkerungsdaten wurde kürzlich publiziert [4].
Limitationen und Stärken
Die Kerndokumentation umfasst mit knapp 14.000 Patient:innen etwas weniger als 1 % der geschätzten Zahl an Menschen mit einer entzündlich rheumatischen Erkrankung in Deutschland. Alle Patient:innen aus der Kerndokumentation kommen aus Rheumazentren mit hoher Expertise und bilden daher eine fachärztliche Versorgung auf sehr hohem Niveau ab. Durch die bundesweite Teilnahme von Einzelpraxen, MVZ, Krankenhäusern und Universitätsambulanzen bildet die Kerndokumentation unterschiedliche Versorgungssektoren und verschiedene Regionen mit Großstädten bis zu ländlichen Regionen ab. Die Versorgung von Betroffenen, die nicht rheumatologisch betreut werden, kann jedoch nicht abgebildet werden. Aus Abrechnungsdaten der gesetzlichen Krankenversicherung ist bekannt, dass ohne Rheumatologenkontakt z. B. die Verordnungshäufigkeit von DMARDs deutlich niedriger ist [5].
Fazit
Der Jahresbericht 2025 aus der Kerndokumentation zeigt die Vielfältigkeit der rheumatischen Diagnosen und das kontinuierlich wachsende Therapiespektrum, welches wir einsetzen können. Die gleichzeitige Erfassung ärztlicher und patientenberichteter Daten gibt einen umfassenden aktuellen Einblick in die rheumatologische Versorgungsqualität unserer Patient:innen.
Acknowledgments
Danksagung
Wir bedanken uns bei allen Patient:innen, die ihre Daten der Kerndokumentation zur Verfügung stellen und durch ihre sorgfältige Dokumentation der Fragebögen eine umfangreiche Datenauswertung ermöglichen. Unser Dank geht weiterhin an alle Mitarbeitenden in den beteiligten Einrichtungen.
Förderung
Die Kerndokumentation wird durch die Arbeitsgemeinschaft der Regionalen Kooperativen Rheumazentren, die Deutsche Gesellschaft für Rheumatologie e. V. und die folgenden im Arbeitskreis korporativer Mitglieder der Deutschen Gesellschaft für Rheumatologie vertretenen Firmen: AbbVie (seit 2007*), AstraZeneca (seit 2021), GALAPAGOS (seit 2020**), GSK (seit 2011), Medac (seit 2007), Pfizer (seit 2007), UCB (seit 2010) über eine gemeinsame Zuwendung an die Rheumatologische Fortbildungs-Akademie unterstützt. Die Studienleitung besitzt die volle akademische Freiheit. *bis 2014 Abbott, **bis 2021 Gilead. (Stand 09.01.2025)
Funding
Open Access funding enabled and organized by Projekt DEAL.
Einhaltung ethischer Richtlinien
Interessenkonflikt
J. Callhoff erhielt Referentenhonorare von Janssen, Pfizer und Idorsia. Tobias Alexander erhielt in den letzten 3 Jahren Honorare für Advisory Boards und/oder Vorträge von AbbVie, Amgen, AstraZeneca, GSK und Lilly. Martin Aringer erhielt Honorare für Advisory Boards und/oder Vorträge von AbbVie, AstraZeneca, BMS, Chugai, Galapagos, GSK, Lilly, MSD, Novartis, Roche, Sanofi und UCB. J. Detert erhielt Advisory Board- und Vortragshonorare von AbbVie, Amgen, BMS, Eli Lilly, Galapagos, Gilead, Janssen, Novartis, Pfizer und UCB. Martin Feuchtenberger erhielt Honorare für Advisory Boards und/oder Vorträge von AbbVie, Lilly, MSD, Novartis, Pfizer, Celltrion und UCB. J. Henes erhielt Vortragshonorare für AbbVie, AstraZeneca, Boehringer Ingelheim, BMS, Janssen, Lilly, Novartis, Pfizer, Roche, SOBI, Otsuka, EUSA und UCB. K. Karberg erhielt Vortragshonorare von AbbVie, UCB, Novartis und der Rheumaakademie. U. Kiltz erhielt Vortrags‑/Beratungshonorare von AbbVie, Amgen, Biocad, Biogen, Chugai, Eli Lilly, Fresenius, Gilead, Grünenthal, GSK, Janssen, MSD, Novartis, Pfizer, Roche und UCB. B. Köhler erhielt Vortragshonorare von AbbVie, Lilly und Novartis, Beratungshonorare von AbbVie, Amgen, Lilly, Pfizer, UCB und Unterstützung für Kongressreisen/-teilnahme von UCB, Pfizer, Lilly und AbbVie. Susanna Späthling-Mestekemper erhielt Vortrags‑/Beraterhonorare von AbbVie, AstraZeneca, BMS, Gilead, Grünenthal, GSK, Janssen, Lilly, MSD, Novartis, Pfizer, UCB. M. Steinmüller erhielt Vortrags‑/Beratungshonorare von AbbVie, Amgen, Berlin Chemie, BMS, Galapagos, Gilead, GSK, Janssen, Lilly, Medac, MSD, Mylan, Novartis, Pfizer und ViiV. A. Strangfeld erhielt Referentenhonorare von AbbVie, Biogen, Galapagos, Janssen, Lilly, Pfizer und Takeda. K. Albrecht, T. Eidner, A. Krause, J. Richter und K. Thiele geben an, dass bzgl. der Kerndokumentation keine Interessenkonflikte bestehen.
Für die Studie liegt ein positives Ethikvotum von der Charité-Universitätsmedizin Berlin vor (EA1/196/06 und EA1/093/24). Alle Patient:innen haben bei Teilnahme an der Kerndokumentation ihr schriftliches Einverständnis gegeben.
Footnotes

QR-Code scannen & Beitrag online lesen
Hinweis des Verlags
Der Verlag bleibt in Hinblick auf geografische Zuordnungen und Gebietsbezeichnungen in veröffentlichten Karten und Institutsadressen neutral.
Literatur
- 1.Albrecht K, Callhoff J, Zink A (2019) Langzeittrends in der rheumatologischen Versorgung : Erfolge und Defizite im Spiegel von 25 Jahren rheumatologischer Kerndokumentation. (Long-term trends in rheumatology care : Achievements and deficits in 25 years of the German national rheumatology database). Z Rheumatol 78(8):703–712. 10.1007/s00393-019-0660-5 [DOI] [PubMed] [Google Scholar]
- 2.Thiele K, Albrecht K, Zink A, Aringer M, Karberg K, Spathling-Mestekemper S, von Hinuber U, Callhoff J (2022) Is the Rheumatoid Arthritis Impact of Disease (RAID) score a meaningful instrument for other inflammatory rheumatic diseases? A cross-sectional analysis of data from the German National Database. RMD Open. 10.1136/rmdopen-2022-002342 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Thiele K, Albrecht K, Alexander T, Aringer M, Detert J, Eidner T, Feuchtenberger M, Henes J, Karberg K, Kiltz U, Köhler B, Krause A, Richter JG, Späthling-Mestekemper S, Steinmüller M, Zinke S, Callhoff J (2025) Kerndokumentation der regionalen kooperativen Rheumazentren. Versorgungstrends 2025. 10.17169/refubium-46216
- 4.Veltri C, Albrecht K, Kiltz U, Meyer-Olson D, Spathling S, Strangfeld A, Thiele K, Callhoff J (2025) Trends in work participation among patients with inflammatory rheumatic musculoskeletal diseases (iRMDs): Data from the German National Database (2010–2022). Rmd Open. 10.1136/rmdopen-2024-004980 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Steffen A, Holstiege J, Klimke K, Akmatov MK, Batzing J (2018) Patterns of the initiation of disease-modifying antirheumatic drugs in incident rheumatoid arthritis: a German perspective based on nationwide ambulatory drug prescription data. Rheumatol Int 38(11):2111–2120. 10.1007/s00296-018-4161-7 [DOI] [PMC free article] [PubMed] [Google Scholar]