RÉSUMÉ
OBJECTIF
Analyser et adapter des indicateurs de qualité pour l’évaluation et la prise en charge des personnes avec atteinte des fonctions cognitives, dont la prévalence est très élevée dans les unités d’évaluation gériatrique au Québec.
DEVIS
Une méthode de type Delphi-modifiée.
CONTEXTE
Province de Québec.
PARTICIPANTS
Sept praticiens de milieux hospitaliers affiliés à 3 universités du Québec choisis pour leur compétence reconnue en démence et soins gériatriques.
MÉTHODE
Parmi les indicateurs développés en 2001 par la méthode RAND, 22 items sélectionnés pour leur pertinence au cours du processus d’évaluation et de prise en charge d’une atteinte des fonctions cognitives ont été adaptés aux conditions de pratique du milieu hospitalier québécois. Les indicateurs, accompagnés d’évidences de la littérature, ont été soumis, par la poste, à un panel d’experts. Chaque expert a coté, sur une échelle de 1 à 9, son degré d’accord à des affirmations concernant la validité, la qualité et la nécessité d’être inscrit dans le dossier médical. Pour qu’un indicateur soit retenu, il devait faire consensus selon les valeurs médianes, être situé dans le tertile supérieur et recevoir l’agrément des experts. Les indicateurs incertains étaient modifiés en fonction des commentaires des experts, puis soumis au même panel pour un second tour.
RÉSULTATS
Des 22 indicateurs soumis au premier tour, 21 ont été validés. Ils prenaient en compte le dépistage, l’investigation, l’évaluation, le traitement et le suivi. L’indicateur considéré comme incertain a été modifié puis accepté lors du second tour.
CONCLUSION
Cette étude a identifié 22 indicateurs pertinents pour l’évaluation et la prise en charge de l’atteinte des fonctions cognitives dans une unité d’évaluation gériatrique. Ils serviront de base à l’appréciation de la problématique de la démence, dans une étude ayant cours sur la qualité des soins dans l’ensemble des unités de courte durée gériatriques des hôpitaux généraux duQuébec.
Abstract
OBJECTIVE
To analyze and adapt a set of quality indicators for assessment and management of patients with cognitive disorders, which are seen very frequently in geriatric assessment units in Quebec.
DESIGN
Modified Delphi technique.
SETTING
Province of Quebec.
PARTICIPANTS
Seven clinicians from 3 different medical faculties in Quebecwere selected for their expertise in dementia and geriatric care.
METHOD
From among the indicators developed in 2001 using the RAND method, 22 items selected for their relevance to evaluation and management of cognitive disorders were adapted to clinical practice in the Quebec hospital system. These indicators, along with evidence from the literature, were submitted by mail to a panel of experts. The experts were asked to rate, on a scale of 1 to 9, their level of agreement with the indicators in terms of their validity and quality and the need for them to be recorded in patients’ medical charts. For an indicator to be retained, it had to be accepted according to itsmedian value, to be rated in the upper third of the scale, and to be approved by the panelists. Indicators not accepted at first were modified according to experts’ comments and then resubmitted to the same panel for a second round.
RESULTS
Of 22 indicators submitted in the first round, 21 were validated. They covered assessment, investigation, evaluation, treatment, and follow-up. The indicator found questionable was modified and then accepted during the second round.
CONCLUSION
This study identified 22 indicators relevant to assessment and management of patients with cognitive disorders in geriatric assessment units. These indicators will serve as a basis for evaluation of dementia in a larger study of the quality of care in all short-term geriatric assessment units in Quebec.
Les aînés occupent, dans la société, une place démographique et économique de plus en plus importante. Etant donné la prévalence croissante de la démence toute cause confondue dans la population canadienne1, la gestion des atteintes cognitives chez les personnes âgées de plus de 65 ans représente un défi considérable pour l’organisation du réseau des soins de la santé.
Un tiers des lits d’un service médical de soins aigus serait occupé par des personnes âgées ayant une atteinte significative des fonctions cognitives2. Dans les unités d’évaluation gériatrique, milieu optimal pour la prise en charge des personnes âgées fragiles, plus de 50% des patients hospitalisés auraient un diagnostic identifiant des troubles cognitifs3.
Dans certaines conditions comme la démence, l’incontinence ou les chutes, les soins dispensés aux aînés sont fréquemment sous optimaux4. Toutefois, malgré une conscientisation à l’importance de l’atteinte des fonctions cognitives dans une population de plus en plus âgée et des traitements disponibles, leur détection et leur prise en charge en milieu hospitalier semblent toujours être insuffisantes5–7.
Dans un contexte de rareté des ressources, l’efficience et l’amélioration de la qualité des soins sont devenues des préoccupations majeures des gestionnaires et professionnels du réseau de la santé. Des indicateurs de qualité ont donc été développés afin de pouvoir mesurer de façon objective la qualité des soins. Comme le démontrent certaines études8–11, l’utilisation de ces indicateurs améliore l’adhérence aux recommandations édictées pour certaines conditions ainsi que la qualité des soins dispensés12. Toutefois, le bénéfice de leur application clinique reste encore à valider dans de nombreux domaines.
Afin d’harmoniser et améliorer les interventions cliniques, nous avons voulu, dans un premier temps, identifier des indicateurs de qualité spécifiques à l’évaluation et la prise en charge de l’atteinte des fonctions cognitives chez la personne âgée hospitalisée. Ces indicateurs seront utilisés par la suite pour mesurer la qualité des processus de soins dans une étude ayant cours dans l’ensemble des unités d’évaluation gériatrique du Québec13.
MÉTHODE
En vue d’obtenir un consensus sur la validité et la faisabilité des indicateurs de qualité, une méthode de type Delphi-modifiée (consultation itérative d’experts sur un sujet donné), inspirée par l’approche RAND, a été utilisée14.
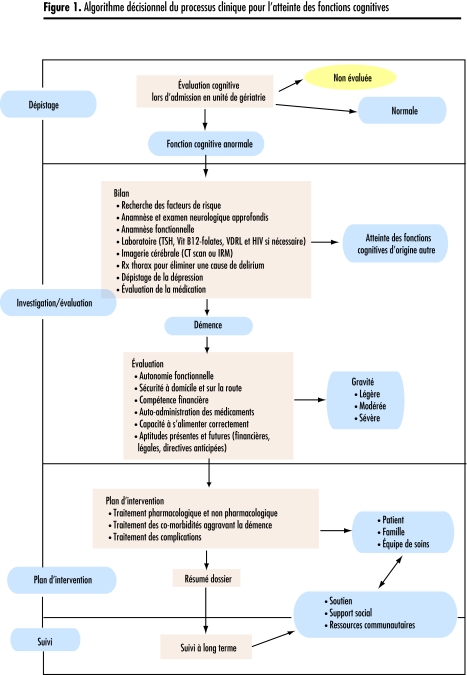
Dans un premier temps, à l’aide des informations contenues dans la littérature scientifique, nous avons développé un algorithme (Figure 1) pour identifier chaque étape nécessaire au processus d’évaluation et de prise en charge de l’atteinte cognitive. Pour nous aider dans notre analyse de la pertinence des différentes étapes du processus de soins, nous avons appuyé nos recherches sur des recommandations édictées par des sociétés médicales concernées, que nous avons jugées proches de la pratique clinique au Québec15–21, ainsi que sur un certain nombre d’articles pertinents (Tableau 117,20,22–26). Puis, avec l’aide de 3 médecins gériatres associés au programme de recherche sur la qualité des soins en unité d’évaluation gériatrique et suivant l’algorithme, nous avons sélectionné, parmi les indicateurs ACOVE (Assessing Care Of Vulnerable Elders)27–29 22 indicateurs qui nous semblaient essentiels à une prise en charge optimale de l’atteinte des fonctions cognitives, lors de l’hospitalisation d’une personne âgée dans une unité d’évaluation gériatrique (Tableau 2).
Figure 1.
Algorithme décisionnel du processus clinique pour l’atteinte des fonctions cognitives
Tableau 1.
Synthèse de la recension des écrits scientifiques pertinents à la prise en charge de l’atteinte des fonctions cognitives
| Dépistage |
| Compte tenu de leur prévalence, de leurs répercussions et des possibilités d’intervention, il est recommandé de procéder à un dépistage de l’atteinte des fonctions cognitives dans les populations à risque, notamment des individus qui présentent des plaintes subjectives et ceux appartenant à un groupe d’âge où la prévalence est élevée (>80 ans)17,20. |
| Investigation |
| Si le dépistage suggère une atteinte des fonctions cognitives, une évaluation et une prise en charge s’imposent22. L’évaluation requiert une histoire clinique et un examen physique complet, plus particulièrement du système neurologique. En outre, il faut effectuer une évaluation complète de l’autonomie fonctionnelle, soit des activités de la vie quotidienne et domestique, puisque un déclin des performances dans ce domaine constitue un critère diagnostique majeur de la démence23. Des épreuves de laboratoire systématiques de base sont indiquées dans certaines circonstances, ainsi que de la neuroimagerie structurale, surtout dans le but d’éliminer une cause secondaire ou contributive à la démence22. |
| Évaluation |
| Une fois l’évaluation complétée, le diagnostic est annoncé, discuté et expliqué au patient ainsi qu’à ses proches et aidants naturels24. Plusieurs considérations d’ordre non pharmacologique doivent être abordées suite à l’annonce du diagnostic17: l’évaluation de l’aptitude, de la conduite automobile, des directives anticipées (décisions en rapport avec les soins de fin de vie, gestion des biens, etc.) et les services d’aide. |
| Traitement |
| Sur le plan pharmacologique, la prévention et le traitement agressif des facteurs de risque cardiovasculaire, ainsi que l’introduction d’un inhibiteur de l’acétylcholinestérase constituent les bases du traitement de la maladie d’Alzheimer25. |
| Suivi |
| Le diagnostic ainsi que la prise en charge de la démence nécessitent une approche multidimensionnelle26. L’information concernant les épreuves diagnostiques et les interventions face à la démence doivent être systématiquement transmises au médecin de famille du patient et au réseau communautaire de première ligne pour assurer une continuité des soins au moment du congé. |
Tableau 2.
Description des indicateurs de qualité selon leur dimension clinique
| DIMENSION CLINIQUE | INDICATEURS DE QUALITÉ | VALEUR MÉDIANE | IPRAS/IPR* |
|---|---|---|---|
| Dépistage | 1. Si une personne âgée vulnérable est hospitalisée dans un service de gériatrie (unité de courte durée gériatrique (UCDG), ALORS une évaluation gériatrique globale, incluant les capacités cognitives et le statut fonctionnel doit être effectuée. | 8 | 6.8/0.07 |
| Investigation | 2. Si une personne âgée vulnérable admise en UCDG est évaluée pour une atteinte cognitive, ALORS le taux de vitamine B12 et celui de la thyréostimuline (TSH, thyroid-stimulating hormone) doivent être déterminés. | 7 | 5.35/2 |
| Investigation | 3. Pour toute personne âgée vulnérable admise en UCDG qui présente une atteinte cognitive n’ayant jamais été investiguée et des symptômes cliniques suggérant un processus intracrânien, un test de neuroimagerie tel un CT cérébral doit être réalisé. | 7.5 | 6.85/2 |
| Investigation | 4. Si une personne âgée vulnérable admise en UCDG présente des symptômes d’atteinte cognitive, ALORS le médecin doit revoir la liste des médicaments du patient afin de détecter si l’initiation d’un traitement pharmacologique ne coïncide pas avec le début des symptômes et le cesser si la condition clinique le permet. | 9 | 8.35/0 |
| Investigation | 5. Si une personne âgée vulnérable admise en UCDG est atteinte de troubles cognitifs, ALORS elle doit bénéficier du dépistage d’une éventuelle dépression durant l’évaluation initiale et un traitement doit être débuté si cela est nécessaire. | 8 | 7.17/0.43 |
| Investigation | 6. Si une personne âgée vulnérable atteinte de démence est admise en UCDG, ALORS un diagnostic de delirium surajouté doit être recherché et s’il est confirmé, les facteurs précipitants doivent être évalués et traités. | 8 | 6.42/1.43 |
| Évaluation | 7. Si une personne âgée vulnérable souffrant de démence est soutenue par un proche aidant, ALORS le médecin ou un professionnel compétent doit avoir une discussion avec le patient si c’est possible ou avec son aidant à propos de la sécurité, de ses besoins en services de soutien, des ressources disponibles en communauté pour les personnes atteintes de démence et des stratégies de résolution de conflits liés à la progression de la maladie. | 8 | 7.6/1 |
| Évaluation | 8. Si une personne âgée vulnérable admise en UCDG a été nouvellement diagnostiquée avec une démence et qu’elle dispose d’un permis de conduire valide, ALORS le médecin ayant établi le diagnostic doit procéder avec son équipe à une évaluation de son aptitude à conduire de façon sécuritaire et, le cas échéant, en aviser la Société d’assurance automobile du Québec. | 8.5 | 7.28/1.43 |
| Évaluation | 9. Si une personne âgée vulnérable atteinte de démence est hospitalisée, ALORS le dossier médical doit contenir le nom de la personne identifiée comme étant le proche aidant significatif ou le représentant légal à qui pouvoir se référer en toutes circonstances ou indiquer qu’il n’y en a pas. | 7 | 6.1/1 |
| Évaluation | 10. Si une personne âgée vulnérable portant un diagnostic de démence avancée est hospitalisée en UCDG, ALORS le niveau d’intervention doit être déterminé avec le curateur, le mandataire ou un proche en respectant les directives anticipées du patient. | 8 | 6.42/1.43 |
| Évaluation | 11. Si une personne âgée vulnérable atteinte de démence doit être opérée de façon élective, ALORS le dossier médical doit documenter la capacité du patient à comprendre les risques, les bénéfices et les conséquences de l’intervention proposée avant que le formulaire de consentement ne soit présenté pour signature ou si le patient n’est pas capable de comprendre les risques, les bénéfices et les conséquences de l’acte chirurgical, ceux-ci doivent être expliqués au représentant légal s’il en existe un ou à un proche. | 9 | 7.6/1 |
| Évaluation | 12. Toute personne âgée vulnérable atteinte de démence et hospitalisée en UCDG doit être pesée et son poids doit être inscrit dans le dossier médical. | 8 | 7.17/0.43 |
| Intervention | 13. Si une personne âgée vulnérable atteinte de démence admise en UCDG a une perte de poids involontaire documentée, alors une cause potentiellement réversible à cette perte de poids doit être recherchée. | 8 | 7.6/1 |
| Traitement | 14. Si une personne âgée vulnérable admise en UCDG souffre d’une démence de type Alzheimer, vasculaire, mixte ou à corps de Lewy de gravité légère à modérée, ALORS le médecin traitant doit discuter avec le patient ou son aidant d’un traitement aux inhibiteurs de l’acétylcholinestérase. | 7 | 6.85/2 |
| Traitement | 15. Si une personne vulnérable atteinte de démence et admise en UCDG souffre d’une maladie vasculaire cérébrale concomitante, ALORS elle doit bénéficier de mesures appropriées de prévention secondaire. | 8 | 5.35/2 |
| Traitement | 16. Une personne âgée vulnérable avec une atteinte des fonctions cognitives admise en UCDG ne devrait pas recevoir de médication ayant d’importants effets anticholinergiques. | 8 | 7.6/1 |
| Traitement | 17. Une personne souffrant de démence et admise en UCDG ne devrait pas recevoir de médicaments ayant des propriétés sédatives (hypnotiques, anxiolytiques) à longue durée d’action, à moins que cette médication ne soit justifiée explicitement dans le dossier médical. | 8 | 7.6/1 |
| Traitement | 18. Si une personne âgée vulnérable présentant une atteinte cognitive doit être mise sous contention physique dans une UCDG, ALORS dans les 48 heures les éléments (troubles de comportement ou problèmes de sécurité) qui justifient l’utilisation des contentions doivent être exposés au patient (s’il est capable de comprendre) ou à son représentant légal et être consignés au dossier et la durée d’application doit être limitée au temps minimal indispensable. | 8 | 7.6/1 |
| Intervention | 19. Si une personne âgée vulnérable atteinte de démence est admise en UCDG, ALORS la planification du congé avec l’organisation des soins à domicile appropriés devrait commencer aussitôt que sa situation de santé est stabilisée. | 8 | 5.78/1.43 |
| Suivi | 20. Le personnel de l’UCDG doit s’assurer que la personne âgée vulnérable présentant une atteinte cognitive ou son aidant soit en mesure d’identifier un médecin traitant régulier ou un gestionnaire de cas pour assurer son suivi. | 7 | 6.1/1 |
| Suivi | 21. Si une personne âgée vulnérable reçoit son congé de l’UCDG pour retourner à domicile ou dans un centre de soins de longue durée ou tout autre établissement de santé, ALORS un résumé d’hospitalisation doit être transmis au médecin traitant ou au médecin responsable dans un délai d’au plus 2 semaines. | 7 | 6.1/1 |
| Suivi | 22: Si une personne âgée vulnérable présentant une atteinte cognitive reçoit son congé de l’UCDG et qu’un plan de service lui a été proposé, alors il faut s’assurer qu’elle ou son aidant ait été informé de ce plan (description des services offerts, objectifs et résultats escomptés, raison de leur inclusion dans le plan) et y souscrive. | 7.5 | 6.1/1 |
Si IPRAS (Interpercentile Range Adjusted for Symmetry)/IPR (InterPercentile Range) <1: désagrément entre experts.
Dans un second temps, les indicateurs ont été soumis à un panel d’experts pour être validés. Les panélistes ont été choisis, à la fois en fonction de leur compétence clinique reconnue dans les troubles cognitifs et de leur expérience professionnelle auprès de la clientèle gériatrique hospitalisée. Sept médecins, dont 4 gériatres, 2 neurologues et un omnipraticien, chargés plus particulièrement de l’enseignement en soins aux personnes âgées et en démence et en poste dans des hôpitaux universitaires de 3 facultés de médecine du Québec ont participé au processus de validation des indicateurs.
Dans ce processus de validation, les indicateurs, accompagnés de preuves de la littérature ont été soumis, par envoi postal, au panel d’experts. Ils ont été présentés sous forme de fiches, accompagnés d’une documentation justificative. Dans tous les cas, la documentation était étayée par 3 lignes directrices sur l’évaluation et la prise en charge de la démence15,16,18.21.
Pour chaque indicateur, l’expert devait coter, sur une échelle de réponse de type Likert à 9 points (1—entièrement en désaccord; 9—entièrement en accord) son degré d’accord à des affirmations concernant la validité, la qualité et la nécessité d’être inscrit dans le dossier médical de chaque indicateur.
Chaque indicateur était jugé en fonction de 4 critères. Un indicateur était considéré comme valide si:
des évidences scientifiques ou un consensus professionnel démontraient un lien entre le processus spécifié par l’indicateur et un bénéfice de santé pour le patient;
l’indicateur était pertinent pour mesurer la qualité des soins aux personnes âgées vulnérables;
il était établi que les dispensateurs qui adhéraient fortement à cet indicateur fournissaient des soins et services de meilleure qualité; et
il était essentiel que l’information sur cet indicateur soit présente au dossier du patient.
Les analyses ont été basées sur la RAND/UCLA Appropriateness Method14, une méthode de mesures statistiques fréquemment employée et adaptée à toutes les tailles de panel. Pour qu’un indicateur soit retenu, il devait faire consensus selon les valeurs médianes, être situé dans le tertile supérieur (7 à 9) et recevoir l’agrément des experts. Les scores ont été enregistrés et les commentaires analysés. L’agrément entre expert a été déterminé par le taux d’accord ou désaccord défini par le calcul de l’IPR (InterPercentile Range, une mesure statistique de la dispersion d’une distribution) sur l’IPRAS (Interpercentile Range Adjusted for Symmetry) en utilisant comme borne inférieure et supérieure, le 33e et le 67e percentile respectivement. Si l’IPR était plus élevé que l’IPRAS, l’indicateur était côté comme étant en désaccord. Les indicateurs qui rencontraient un score moyen de moins de 3 ou un désaccord entre experts étaient éliminés d’emblée. Ceux qui avaient un score de 7 ou plus avec un accord entre experts étaient acceptés tels quels. Les indicateurs qui obtenaient un score intermédiaire étaient modifiés en fonction des commentaires apportés par les experts puis soumis au même panel pour un second tour.
RÉSULTATS
Sur les 22 indicateurs de qualité soumis à l’appréciation du panel d’experts, 21 (95%) ont été acceptés au premier tour comme valides pour l’évaluation et la prise en charge de l’atteinte des fonctions cognitives. Tous ont obtenu un score médian de 7 et plus, ainsi qu’un agrément entre experts. Un seul indicateur a obtenu un score médian de 5. Il a été modifié en fonction des commentaires puis soumis à nouveau au panel d’experts, qui l’a finalement accepté. Le Tableau 2 décrit les indicateurs de qualité en détail et selon leur appartenance à chaque étape du processus de soins.
L’indicateur rejeté lors du premier tour portait sur l’importance de communiquer avec le proche aidant du patient atteint de démence et de consigner le résultat de la discussion au dossier médical au plus tard 48 heures après l’admission. La majorité des experts a jugé qu’il n’y avait pas assez d’évidences scientifiques pour faire un lien entre le résultat spécifié par l’indicateur et l’obtention d’un bénéfice pour le patient, que l’indicateur n’était pas assez pertinent comme mesure de la qualité des soins et qu’il n’y avait pas de preuve que les dispensateurs qui adhéraient à cet indicateur fournissaient de meilleurs soins. Plus de la moitié des panélistes estimaient qu’il n’était pas nécessaire de consigner ces informations au dossier hospitalier et que le délai de 48 heures imparti était trop court. Cet indicateur a été modifié selon les commentaires du panel et accepté.
DISCUSSION
Le pourcentage élevé d’accord peut être expliqué par la sélection minutieuse des indicateurs faite avant la soumission aux experts. En effet, les indicateurs ont été majoritairement inspirés du projet américain ACOVE27 pour les personnes âgées vulnérables souffrant de démence, vivant dans la communauté ou hospitalisées. Ils étaient déjà passés par un processus de sélection quant à leur pertinence dans la prise en charge des atteintes des fonctions cognitives avant d’être retenus par notre équipe de recherche.
Comme le démontrent plusieurs études, il existe des avantages certains à utiliser des indicateurs de qualité ayant déjà été soumis à un processus de validation pour une condition donnée30–32. Toutefois cette démarche demande une certaine adaptation contextuelle des indicateurs, en fonction du pays ou du milieu étudié. Les indicateurs de qualité ont été modifiés pour être ajustés aux conditions de pratique hospitalière québécoises, avec l’appui d’une littérature ciblée sur une population vulnérable, dont les caractéristiques sociodémographiques et cliniques ont été publiées antérieurement par notre équipe de recherche33. En plus de cette revue de littérature adaptée à chaque indicateur, ce dernier était soutenu par 3 lignes directrices, dont 2 étaient parfaitement pertinentes pour le système de santé étudié (financement publique, accès à des soins universels), puisque l’une était canadienne et l’autre australienne15,16.
Les experts ont été sélectionnés pour leur compétence reconnue en gériatrie, troubles de la cognition et expérience clinique en unité d’évaluation gériatrique. Ils reflétaient les spécialités qui prennent en charge ce type de clientèle. Ceci pourrait expliquer l’acceptation de certains indicateurs sur lesquels la littérature restait vague (comme assurer un suivi après le congé) ou conflictuelle (comme effectuer systématiquement une imagerie cérébrale ou un dosage de cyanocobalamine).
Il est à noter que la méthode RAND préconise un panel qui compte entre 7 et 15 experts au minimum14. Le nombre de spécialistes composant notre panel était relativement restreint. Toutefois, comme l’a démontré Akins et al34, même un nombre peu élevé de panélistes, s’ils possèdent une expertise relativement homogène dans un domaine requis, peut contribuer à développer des critères de qualité. Le sujet du Delphi étant l’évaluation et la prise en charge de l’atteinte des fonctions cognitives en milieu hospitalier, qui incombent, initialement, essentiellement aux médecins, seule cette profession a été représentée parmi les experts.
Les indicateurs avaient l’avantage de couvrir toutes les étapes du processus de soins, depuis le dépistage d’une atteinte des fonctions cognitives jusqu’à l’organisation d’un suivi à domicile après le congé de l’hôpital, domaine, en général, peu considéré dans les lignes directrices. Ils mettaient donc l’accent sur des aspects moins explorés par les médecins lors de l’évaluation de troubles cognitifs, comme l’importance de documenter la capacité à comprendre les risques des traitements proposés ou d’identifier une personne capable d’assurer le suivi médical dès le congé au domicile. Les indicateurs soulignaient aussi des aspects reliés à l’entourage et aux proches aidants. Ils évaluaient l’aspect des directives anticipées ou la possibilité de se référer à une personne significative identifiée par le patient lui-même en cas de nécessité.
Il faut mentionner que la prise en charge de personnes âgées, souvent très malades, requiert une adaptation en fonction de l’individu et du contexte clinique. Il est parfois difficile d’effectuer une évaluation complète des fonctions cognitives, lors d’une hospitalisation en unité d’évaluation gériatrique malgré le temps et les professionnels disponibles, en raison du nombre élevé de co-morbidités, parfois décompensées, et de la présence souvent associée d’un delirium. Un certain nombre d’interventions doivent être différées après stabilisation de l’état du patient et faites en ambulatoire ou après le transfert dans une unité de réadaptation.
Le fait de demander aux experts de coter les indicateurs non seulement en fonction des évidences de la littérature mais aussi de leur propre expérience clinique a permis d’obtenir des précisions sur des points litigieux que l’on retrouvait dans les recommandations internationales, ainsi que sur les habitudes de pratique, notamment en ce qui concerne l’usage des inhibiteurs de l’acétylcholinestérase, dans les cas de démence à contribution vasculaire. Il faut noter toutefois que les lignes directrices auxquelles nous avons fait référence datent de 1999, 2001 et 2003 et que de nouvelles recommandations, dont des recommandations canadiennes, vont paraître prochainement. Il est probable que les pratiques concernant cette médication dans les démences avec une contribution vasculaire seront révisées en fonction de données plus récentes35–37.
Associés à d’autres approches, les indicateurs serviront à l’évaluation de la qualité des processus de soins dans une étude ayant cours dans l’ensemble des unités d’évaluation gériatrique de courte durée des hôpitaux de soins généraux du Québec13.
EDITOR’S KEY POINTS
This study identifies quality indicators for assessment and management of cognitive impairment in elderly patients in hospital geriatric assessment units.
These indicators will be used to assess the quality of care in all short-term geriatric care units in Quebec and might help improve the care given to vulnerable elderly patients.
POINTS DE REPÈRE DU RÉDACTEUR
Cette étude identifie des indicateurs de qualité pour l’évaluation et la prise en charge des atteintes des fonctions cognitives chez des personnes âgées hospitalisées aux unités d’évaluation gériatrique.
Ces indicateurs serviront à l’évaluation de la qualité des processus de soins dans l’ensemble des unités de courte durée gériatriques du Québec et pourront contribuer à améliorer les soins aux personnes âgées vulnérables.
Footnotes
Contributions des auteurs
Drs Payot, Latour, Massoud et Kergoat ont contribué à l’élaboration du protocole de recherche, au traitement et à l’analyse des données et à la rédaction du présent article.
Intérêts concurrents
Rien déclaré
Cet article a fait l’objet d’une révision par des pairs.
Références
- 1.The Canadian study of health and aging: risk factors for Alzheimer’s disease in Canada. Neurology. 1994;44(11):2073–80. doi: 10.1212/wnl.44.11.2073. [DOI] [PubMed] [Google Scholar]
- 2.Hickey A, Clinch D, Groarke EP. Prevalence of cognitive impairment in the hospitalized elderly. Int J Geriatr Psychiatry. 1997;12(1):27–33. doi: 10.1002/(sici)1099-1166(199701)12:1<27::aid-gps446>3.0.co;2-f. [DOI] [PubMed] [Google Scholar]
- 3.Gouvernement du Québec, Ministère de la santé et des services sociaux. Fichier provincial sur les hospitalisations au Québec, 2002–2003. Québec, Qué: MedEcho; 2004. [Google Scholar]
- 4.Wenger NS, Solomon DH, Roth CP, MacLean CH, Saliba D, Kamberg CJ, et al. The quality of medical care provided to vulnerable community-dwelling older patients. Ann Intern Med. 2003;139(9):740–7. doi: 10.7326/0003-4819-139-9-200311040-00008. [DOI] [PubMed] [Google Scholar]
- 5.Hustey FM, Meldon SW. The prevalence and documentation of impaired mental status in elderly emergency department patients. Ann Emerg Med. 2002;39(3):248–53. doi: 10.1067/mem.2002.122057. [DOI] [PubMed] [Google Scholar]
- 6.Chodosh J, Petitti DB, Elliott M, Hays RD, Crooks VC, Reuben DB, et al. Physician recognition of cognitive impairment: evaluating the need for improvement. J Am Geriatr Soc. 2004;52(7):1051–9. doi: 10.1111/j.1532-5415.2004.52301.x. [DOI] [PubMed] [Google Scholar]
- 7.Laurila JV, Pitkala KH, Strandberg TE, Tilvis RS. Detection and documentation of dementia and delirium in acute geriatric wards. Gen Hosp Psychiatry. 2004;26(1):31–5. doi: 10.1016/j.genhosppsych.2003.08.003. [DOI] [PubMed] [Google Scholar]
- 8.Caminiti C, Scoditti U, Diodati F, Passalacqua R. How to promote, improve and test adherence to scientific evidence in clinical practice. BMC Health Serv Res. 2005;5:62. doi: 10.1186/1472-6963-5-62. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Miller DC, Litwin MS, Sanda MG, Montie JE, Dunn RL, Resh J, et al. Use of quality indicators to evaluate the care of patients with localized prostate carcinoma. Cancer. 2003;97:1428–35. doi: 10.1002/cncr.11216. [DOI] [PubMed] [Google Scholar]
- 10.Ornstein S, Jenkins RG, Nietert PJ, Feifer C, Roylance LF, Nemeth L, et al. A multimethod quality improvement intervention to improve preventive cardiovascular care. Ann Intern Med. 2004;141:523–32. doi: 10.7326/0003-4819-141-7-200410050-00008. [DOI] [PubMed] [Google Scholar]
- 11.Asch SM, McGlynn EA, Hogan MM, Hayward RA, Shekelle P, Rubenstein L, et al. Comparison of quality of care for patients in the Veterans Health Administration and patients in a national sample. Ann Intern Med. 2004;141:938–46. doi: 10.7326/0003-4819-141-12-200412210-00010. [DOI] [PubMed] [Google Scholar]
- 12.Vickrey BG, Mittman BS, Connor KI, Pearson ML, Della Penna RD, Ganiats TG, et al. The effect of a disease management intervention on quality and outcomes of dementia care. Ann Intern Med. 2006;145:713–26. doi: 10.7326/0003-4819-145-10-200611210-00004. [DOI] [PubMed] [Google Scholar]
- 13.Kergoat M-J, Latour J, Lebel P, Leduc N, Berg K. Étude de la qualité des soins et des services gériatriques hospitaliers par le cas traceur des chutes (Study protocol, 2002–2005) Ottawa, Ont: Instituts de recherche en santé du Canada; 2003. [Google Scholar]
- 14.Fitch K, Bernstein SJ, Aguilar MS, Burnand B, LaCalle JR, Lazaro P, et al. The RAND/UCLA Appropriateness Method user’s manual (Report No. MR-1269-DG-XII/RE) Santa Monica, Calif: RAND; 2001. [Google Scholar]
- 15.Bridges-Webbs C, Wolk J rédacteurs. Care of patients with dementia in general practice. Guidelines. South Melbourne, Aust: Royal Australian College of General Practitioners; 2003. [Accédé le 14 novembre 2005]. Accessible à: www.health.nsw.gov.au/pubs/c/pdf/care_dementia_guide.pdf. [Google Scholar]
- 16.Patterson C, Gauthier S, Bergman H, Cohen C, Feightner JW, Feldman H, et al. The recognition, assessment and management of dementing disorders: conclusions from the Canadian Consensus Conference on Dementia. Can J Neurol Sci. 2001;28(Suppl 1):S3–16. doi: 10.1017/s0317167100001165. [DOI] [PubMed] [Google Scholar]
- 17.Patterson CJ, Gass DA. Screening for cognitive impairment and dementia in the elderly. Can J Neurol Sci. 2001;28(Suppl 1):S42–51. doi: 10.1017/s0317167100001190. [DOI] [PubMed] [Google Scholar]
- 18.Foley D, Masaki K, White L, Ross GW, Eberhard J. Practice parameter: risk of driving and Alzheimer’s disease [abstract] Neurology. 2001;56(5):695. doi: 10.1212/wnl.56.5.695. [DOI] [PubMed] [Google Scholar]
- 19.Knopman DS, DeKosky ST, Cummings JL, Chui H, Corey-Bloom J, Relkin N, et al. Practice parameter: diagnosis of dementia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2001;56(9):1143–53. doi: 10.1212/wnl.56.9.1143. [DOI] [PubMed] [Google Scholar]
- 20.Petersen RC, Stevens JC, Ganguli M, Tangalos EG, Cummings JL, DeKosky ST. Practice parameter: early detection of dementia: mild cognitive impairment (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2001;56(9):1133–42. doi: 10.1212/wnl.56.9.1133. [DOI] [PubMed] [Google Scholar]
- 21.Doody RS, Stevens JC, Beck C, Dubinsky RM, Kaye JA, Gwyther L, et al. Practice parameter: management of dementia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology . Neurology. 2001;56(9):1154–66. doi: 10.1212/wnl.56.9.1154. [DOI] [PubMed] [Google Scholar]
- 22.Chertkow H, Bergman H, Schipper HM, Gauthier S, Bouchard R, Fontaine S, et al. Assessment of suspected dementia. Can J Neurol Sci. 2001;28(Suppl 1):S28–41. doi: 10.1017/s0317167100001189. [DOI] [PubMed] [Google Scholar]
- 23.Gauthier S, Bodick N, Erzigkeit E, Feldman H, Geldmacher DS, Huff J, et al. Activities of daily living as an outcome measure in clinical trials of dementia drugs. Alzheimer Dis Assoc Disord; Position paper from the International Working Group on Harmonization of Dementia Drug Guidelines; 1997. pp. 6–7. [PubMed] [Google Scholar]
- 24.Smith AP, Beattie BL. Disclosing a diagnosis of Alzheimer’s disease: patient and family experiences. Can J Neurol Sci. 2001;28(Suppl 1):S67–71. doi: 10.1017/s0317167100001220. [DOI] [PubMed] [Google Scholar]
- 25.Cummings JL. Alzheimer’s disease. N Engl J Med. 2004;351(1):56–67. doi: 10.1056/NEJMra040223. [DOI] [PubMed] [Google Scholar]
- 26.Crooks EA, Geldmacher DS. Interdisciplinary approaches to Alzheimer’s disease management. Clin Geriatr Med. 2004;20(1):121–39. doi: 10.1016/j.cger.2003.11.004. [DOI] [PubMed] [Google Scholar]
- 27.Shekelle PG, MacLean CH, Morton SC, Wenger NS. ACOVE quality indicators. Ann Intern Med. 2001;135(8 Pt 2):653–67. doi: 10.7326/0003-4819-135-8_part_2-200110161-00004. [DOI] [PubMed] [Google Scholar]
- 28.Shekelle PG, MacLean CH, Morton SC, Wenger NS. Assessing care of vulnerable elders: methods for developing quality indicators. Ann Intern Med. 2001;135(8 Pt 2):647–52. doi: 10.7326/0003-4819-135-8_part_2-200110161-00003. [DOI] [PubMed] [Google Scholar]
- 29.Chow TW, MacLean CH. Quality indicators for dementia in vulnerable community-dwelling and hospitalized elders. Ann Intern Med. 2001;135(8 Pt 2):668–76. doi: 10.7326/0003-4819-135-8_part_2-200110161-00005. [DOI] [PubMed] [Google Scholar]
- 30.Marshall MN, Shekelle PG, McGlynn EA, Campbell S, Brook RH, Roland MO. Can health care quality indicators be transferred between countries? Qual Saf Health Care. 2003;12(1):8–12. doi: 10.1136/qhc.12.1.8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Steel N, Melzer D, Shekelle PG, Wenger NS, Forsyth D, McWilliams BC. Developing quality indicators for older adults: transfer from the USA to the UK is feasible. Qual Saf Health Care. 2004;13(4):260–4. doi: 10.1136/qshc.2004.010280. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Shield T, Campbell S, Rogers A, Worrall A, Chew-Graham C, Gask L. Quality indicators for primary care mental health services. Qual Saf Health Care. 2003;12(2):100–6. doi: 10.1136/qhc.12.2.100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Kergoat M-J, Latour J, Giroux F. rédacteurs. Geriatrics assessment units: the Quebec model in an urban setting. In: Guez D, Vellas B, Rubenstein LZ, Albarede JL, Garry PJ, editors. Home care: facts research and intervention in gerontology. Paris, Fr: Serdi-New York Springer; 1996. pp. 223–48. [Google Scholar]
- 34.Akins RB, Tolson H, Cole BR. Stability of response characteristics of a Delphi panel: application of bootstrap data expansion [abstract] BMC Med Res Methodol. 2005;5:37. doi: 10.1186/1471-2288-5-37. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Small G, Erkinjuntti T, Kurz A, Lilienfeld S. Galantamine in the treatment of cognitive decline in patients with vascular dementia or Alzheimer’s disease with cerebrovascular disease. CNS Drugs. 2003;17(12):905–14. doi: 10.2165/00023210-200317120-00004. [DOI] [PubMed] [Google Scholar]
- 36.Schindler RJ. Dementia with cerebrovascular disease: the benefits of early treatment. Eur J Neurol. 2005;12(Suppl 3):17–21. doi: 10.1111/j.1468-1331.2005.01323.x. [DOI] [PubMed] [Google Scholar]
- 37.Erkinjuntti T, Roman G, Gauthier S. Treatment of vascular dementia—evidence from clinical trials with cholinesterase inhibitors. J Neurol Sci. 2004;226(1–2):63–6. doi: 10.1016/j.jns.2004.09.018. [DOI] [PubMed] [Google Scholar]