Resumen
Introducción
La impulsividad es un rasgo de personalidad multidimensional relacionado con el control del comportamiento y las emociones. Está presente de manera diversa en los trastornos de la conducta alimentaria, particularmente, en la bulimia nerviosa (BN). Aunque la relación entre la impulsividad y BN ha sido objeto de numerosas investigaciones, en la actualidad se desconocen los sustratos neurobiológicos de esta relación.
Objetivos
Discutir críticamente la evidencia que sugiere que las alteraciones en los sistemas neuronales relacio-nados con las funciones ejecutivas, con la formación de preferencias y con la regulación de los estados emocionales sirven como base para el rasgo de personalidad impulsiva, así como su estado en subgrupos de pacientes con BN.
Métodos
Búsqueda selectiva de la literatura relevante.
Resultados y conclusiones
Esta discusión ilustra la complejidad de la relación entre la impulsividad y BN, donde la impulsividad actúa como un factor de vulnerabilidad que puede sensibilizar al sujeto con BN a estados emocionales negativos, durante los cuales modifica el impacto de estímulos internos y externos sobre el comportamiento y su regulación, favoreciendo así patrones de comportamiento maladaptativos e inflexibles.
Keywords: Palabras clave: Personalidad, bulimia nerviosa, neurobiología, factor liberador de corticotropina, trastornos de la conducta alimentaria
Keywords: Personality, bulimia nervosa, neurobiology, corticotropin releasing factor, eating disorders
Abstract
Introduction
Impulsivity is a complex personality trait related to the control of behavior and emotions and it is present in a wide variety of psychiatric diseases, including eating disorders and particularly in bulimia nervosa (BN). Yet, the relationship between impulsivity and bulimia nervosa, as well as the neurobiological substrates of these disorders, are difficult to discern.
Objectives
The present manuscript reviews the neural substrates for impulsivity, including executive function, preference formation and emotional regulation, and the function of these circuits in individuals with BN.
Methods
A selective review of the literature related to the subject was performed.
Results and Conclusions
The discussion illustrates the complex relationship between impulsivity and BN, where impulsivity may serve as a vulnerability factor that sensitizes the subjects with BN to negative emotional states that bias the impact of environmental and internal stimuli over behavioral regulation processes, favoring maladaptive and inflexible behavioral patterns.
Introducción
La impulsividad es un complejo rasgo de la personalidad, relacionado con el control del comportamiento y de las emociones (1). Esta se encuentra presente en grados patológicos en algunos subgrupos de pacientes con patologías psiquiátricas prevalentes, que incluyen los trastornos de la conducta alimentaria, particularmente bulimia nerviosa (BN) y anorexia purgativa (2). Aunque la relación entre la impulsividad y los trastornos de la conducta alimentaria (TCA) ha sido objeto de numerosas investigaciones recientes (3–5), se desconocen parcialmente los sustratos neurobiológicos que subyacen a este rasgo de personalidad y su relación con los TCA.
Este manuscrito tiene como objetivo principal hacer una revisión crítica (no sistemática) de los sistemas neuronales relacionados con el rasgo impulsividad y su estado en subgrupos de pacientes con TCA. De manera específica, se alude a los hallazgos en pacientes con BN, dada la fuerte asociación entre la impulsividad y algunos comportamientos prevalentes en subgrupos de pacientes con esta condición (6). Para una revisión del vínculo existente entre impulsividad y anorexia nerviosa o trastorno por atracones se sugiere consultar los trabajos de Steiger y Bruce (7) y Grillo (8).
Primero se mencionan algunos conceptos generales acerca del rasgo de personalidad impulsiva y su caracterización experimental. Enseguida se discuten los hallazgos que sustentan un rol para tres sistemas neuronales en la mediación de la impulsividad en roedores y humanos. Luego se realiza un paralelo entre el estado de estos sistemas neuronales y los hallazgos en algunos individuos con BN, con el fin de ilustrar la complejidad de la relación entre la impulsividad y este tipo de trastorno psiquiátrico. Finalmente, se discuten las direcciones futuras de las investigaciones en este campo, a la luz de la discusión previa.
Métodos
Se realizaron búsquedas de literatura médica en las bases de datos PubMed y ISI Web of Science utilizando como palabras clave: anorexia, impulsivity, impulsiveness, bulimia, neurobiology, human experimentation, rats, mice, serotonin, norepinephrine, dopamine, corticotropin releasing factor, salience, prefrontal, eating disorders, neuropeptides, receptors, amygdale, striatum, executive function, emotion, motivation, circuits y behavior
La búsqueda de literatura se restringió a artículos originales y de revisión, en inglés o en español, publicados en revistas indexadas entre 1965 y la actualidad. Las publicaciones fueron seleccionadas por los autores tomando en cuenta el impacto de sus contribuciones al campo de estudio, su relevancia y accesibilidad (24 artículos de revisión, 29 reportes de investigación original, 6 capítulos de libros, libros y un póster).
Adicionalmente, se tomaron en cuenta datos de experimentación no publicados y conversaciones personales con el profesor Ernest Barratt, en el Departamento de Psiquiatría de la Universidad de Texas Rama Médica, antes de su deceso, y entre sus coautores, así como comunicaciones personales con expertos en este campo del conocimiento.
Impulsividad
La impulsividad es un rasgo de personalidad complejo, relacionado con el control del comportamiento y las emociones (1). Desde el punto de vista clínico-práctico la impulsividad puede ser definida como: “Una predis-posición a realizar acciones rápidas y no planeadas en respuesta a estímulos internos o externos a pesar de las consecuencias negativas que puedan tener tanto para el sujetos impulsivo, como para los demás” (9).
Como constructo, la impulsividad no es un monolito (10,11). Existen múltiples tipos y dimensiones. La complejidad de este rasgo de personalidad es evidente en el análisis de los componentes principales de instrumentos de autollenado, ampliamente utilizados en el estudio de este rasgo, como la Escala de Impulsividad de Barratt (12,13), que distingue tres factores o subdimensiones principales del rasgo.
Primero una dimensión motora, caracterizada con elementos como: “Hago las cosas en el momento en el que se me ocurren”. Un segundo factor denominado atencional, que se relaciona con elementos como: “Me siento inquieto en clases o conferencias”. Por último, un factor o dimensión denominado de no planeación, que incluye elementos como: “Vivo para el momento”.
Es importante mencionar que estas subdimensiones parecen y pueden coexistir en diferentes grados, tanto en un rango normal como patológico. Según Hollander y Stein (10), los grados de impulsividad se consideran patológicos cuando es imposible resistir el impulso y se produce un acto impulsivo.
Además de ser un componente esencial de los trastornos de des-control de impulsos (TDI) per se y de los TDI no especificados en otros apartes, la impulsividad está asociada, por lo menos, a subgrupos de pacientes con las siguientes condiciones psiquiátricas: trastorno afectivo bipolar (TAB), trastorno por hiperactividad, BN y anorexia nerviosa purgativa, abuso o dependencia a sustancias y trastornos de la personalidad del grupo B (2).
Dada la complejidad del rasgo impulsividad, Barratt y otros grupos (1,14) han propuesto que su caracterización debe incluir instrumentos y medidas de varias dimensiones, como son cognoscitiva, biológica, ambiental/social y comportamental. Una aproximación multidimensional de la impulsividad permite construir matrices de caracterización del rasgo que sirven para explorar los sustratos neurobiológicos de sus diferentes subdimensiones (14,15). Ejemplos de esta matriz se han publicado, por ejemplo en Barrat y cols. (14).
Adicionalmente, permite ubicar la impulsividad a largo de un espectro de la personalidad junto con el rasgo compulsividad, en relación con la percepción del riesgo de los estímulos ambientales y las motivaciones que originan los actos. En general, es aceptado que los individuos impulsivos suelen involucrarse en comportamientos riesgosos con el fi n de buscar gratificación y aumentar su grado de alertamiento. No obstante, el autor y otros han llamado la atención acerca de las diferencias entre los individuos buscadores de sensaciones y los individuos impulsivos, ya que los primeros suelen tener habilidades de planeación intactas, mientras que los segundos no (14).
Circuitos neuronales asociados al rasgo de personalidad impulsividad
La revisión de los datos recolectados en relación con los sustratos neurobiológicos de la impulsividad ha permitido identificar alteraciones en, por lo menos, tres sistemas funcionales neuronales en estos individuos. El primero, y tal vez el más evidente, es la disfunción del sistema que subyace a la función ejecutiva. Los individuos impulsivos presentan importantes déficits en el procesamiento de la información presentada de manera secuencial. Este déficit se acentúa cuando se aumenta la carga de información, la presión de tiempo (300 ms para realizar una respuesta) y la carga emocional negativa a las respuestas, en tareas de desempeño continuo (14).
El segundo, el défi cit atencional, consistente en una importante difi cultad para sostener la atención en una tarea determinada, y que se ha documentado de forma amplia en estos individuos (16,17). Por último, los grados de impulsividad, relacionados con una pobre inhibición de respuestas aprendidas y procesos de programación motora insuficiente (18,19). Las alteraciones mencionadas ocasionan que estos individuos manifiesten con frecuencia comportamientos inflexibles y perseverativos.
También se encuentra que la preferencia que exhiben los individuos y animales impulsivos por recompensas pequeñas e inmediatas sobre recompensas tardías y de mayor magnitud (20) sugiere que la impulsividad se relaciona con alteraciones que afectan el sistema de formación de preferencias o circuito de recompensa. De manera específica, la impulsividad se relaciona con alteraciones en la atribución del valor emocional y motivacional a estímulos internos o externos-ambientales (21).
Sin embargo, el efecto de los estímulos sobre el comportamiento puede no ser constante, sino episódico. Recientes estudios en humanos sugieren que el efecto de los estímulos sobre el comportamiento está modulado por el estado emocional de los individuos (22). Por ejemplo, es bien conocido que los estados afectivos negativos aumentan el impacto de los estímulos en el comportamiento de los individuos impulsivos (23), probablemente porque aumentan el estado de tensión que precede y que sirve de gatillo a los actos impulsivos (2).
Lo anterior sugiere que los individuos impulsivos son hipersensibles a las emociones negativas, lo que facilita un patrón de respuesta impulsiva. De igual manera, sugiere que existen alteraciones en los sistemas neuronales que median la generación y la regulación de los emociones en estos individuos. Sin duda alguna, este sistema no se ha analizado profundamente en el estudio de la impulsividad.
Por lo tanto, para estudiar la impulsividad es importante reconocer la existencia de una alteración en la regulación emocional frente a los estímulos. La gran mayoría de la literatura en este campo de estudio se refi ere a défi cits en la inhibición motora (9,21) y alteraciones en la monitorización del comportamiento (24,25), como los principales causantes de la impulsividad. No obstante, se ha sugerido que el estado emocional de los individuos se relaciona con estados funcionales del sistema nervioso, que imprimen un importante sesgo al procesamiento de la información (26).
En este contexto, los estados emocionales negativos pueden sesgar el procesamiento de información en individuos impulsivos y aumentar su tendencia a realizar actos impulsivos. Esto explicaría la naturaleza episódica de los actos de este tipo, a pesar de constituir un rasgo de personalidad.
En la Figura 1 se encuentran esquematizados los sistemas neuronales asociados con diversos aspectos del rasgo impulsividad. Incluyen estructuras neuronales, como el complejo amigdalino, la corteza prefrontal, las cortezas polimodales relacionadas con la imagen corporal, el estriado ventral, los núcleos de tallo productores de las principales aminas biógenas, los circuitos páli-do-tálamo-corticales y las estructuras auxiliares (núcleo subtalámico), la corteza motora suplementaria y la corteza motora primaria.
Figura 1. Sistemas neuronales asociados a diversos aspectos del rasgo de personalidad impulsividad.
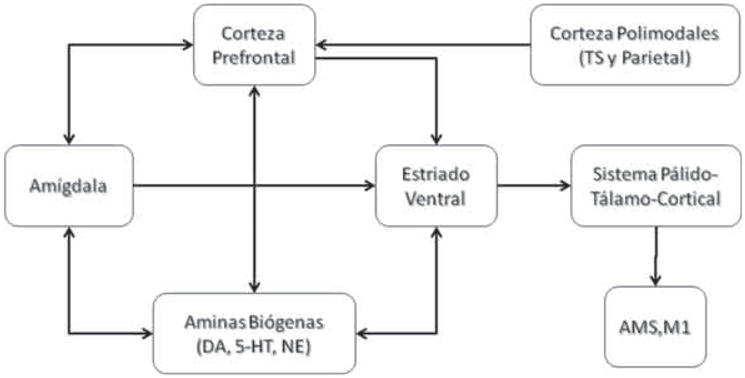
TS: corteza temporal superior; AMS: área motora suplementaria; DA: dopamina; 5-HT: serotonina; NE: norepinefrina; M1: corteza motora primaria.
Una revisión exhaustiva de las propiedades de estos circuitos escapa a los objetivos del presente manuscrito. Para este fin se remite al lector revisiones previas del tema (27). No obstante, es importante resaltar algunas características de estos circuitos. Las estructuras enunciadas conforman los circuitos de regulación del comportamiento intencional y de las emociones, según McFarland y Kalivas (28). Como se aprecia en la Figura 1, estas estructuras están íntimamente relacionadas con la corteza prefrontal y, por lo tanto, constituyen los principales circuitos córtico-límbicos y córtico-estriatales descritos por Alexander y cols. (29). En consecuencia, su adecuado funcionamiento depende más de la integridad funcional de los circuitos que de la integridad estructural de una región anatómica particular (30).
Por ello resulta lógico considerar especialmente los estudios sobre cambios en la microestructura de la sustancia blanca que sirve de sustrato a estos circuitos y sobre el estado funcional de sus principales neurotransmisores moduladores (i.e., dopamina, norepinefrina y serotonina), para identificar los sustratos neurobiológicos del rasgo de personalidad impulsividad.
Con respecto a la integridad microestructural de la sustancia blanca, se ha encontrado recientemente que existen alteraciones en la integridad del cuerpo calloso anterior y de la corteza prefrontal de individuos con una mínima inhibición comportamental y pobre discriminación de estímulos (31). De manera similar, Hazlett y cols. (32) han reportado anormalidades microestructurales en las sustancias blanca y gris en la corteza prefrontal y en el cíngulo anterior en pacientes con trastorno de personalidad límite.
Sin embargo, las lesiones del cíngulo anterior y de la corteza prefrontal, de manera exclusiva, no se correlacionan con un patrón de respuesta impulsivo en animales, medido con una prueba de preferencias (33). No obstante, en este mismo estudio, alteraciones de los circuitos relacionados con la amígdala basolateral y el núcleo accumbens sí se relacionaron con la impulsividad.
Así mismo, Grant y cols. (34) han encontrado que la impulsividad motora y la autoagresión se asocian con alteraciones en la microestructura de los circuitos orbitofrontales. Estas observaciones sugieren que las alteraciones en las vías que median el procesamiento de la información en estos circuitos prefrontales median los efectos de la impulsividad en la regulación del comportamiento y las emociones. Adicionalmente, apuntan a la comunicación interhemisférica como un sustrato importante en la producción de un patrón de comportamiento impulsivo.
Invariablemente, la impulsividad se ha asociado con alteraciones en la neurotransmisión serotoninérgica en los circuitos prefrontales. De manera específica, la impulsividad motora se relaciona con un decremento de la neurotrasmisión, mediada por este modulador, que involucra la merma de la liberación de serotonina de las terminales presinápticas, alteraciones de los receptores 5-HT1B y 5-HT2A y alteraciones en los trasportadores para serotonina (35–39).
Así mismo, se han reportado alteraciones en la función de los receptores para la norepinefrina, relacionados con la impulsividad motora. Específicamente, una disminución de la función de los receptores α2A o un aumento de la función de los receptores α1 se asocia con impulsividad motora (40).
Finalmente, se han controvertido los hallazgos en favor de las alteraciones de la neurotransmisión dopaminérgica en impulsividad. En primer lugar, se ha demostrado que las alteraciones en la disponibilidad de la dopamina presináptica no parecen relacionarse con la impulsividad (41). No obstante, estudios en animales han demostrado contundentemente que una disminución de la disponibilidad de receptores D2/3 en el estriado ventral se asocia con impulsividad motora y con la transición a un patrón de comportamiento compulsivo y maladaptativo (42).
Un importante regulador de la actividad dopaminérgica en los circuitos frontolímbicos es el factor liberador de corticotropina (CRF) (43,44). Este es un neuropéptido de 41 aminoácidos que sirve de integrador de las respuestas al estrés en mamíferos, al actuar como un modulador cognoscitivo de los estímulos ambientales potencialmente amenazantes (26).
Su función como modulador cognoscitivo está mediada por receptores afines y péptidos relacionados en la órbita extrahipotalámica. En estas estructuras neuronales el CRF y sus receptores afi nes tienen un efecto modulador sobre la transmisión excitatoria e inhibitoria mediada por el glutamato y el ácido gamma-aminobutírico (GABA), respectivamente. Para una revisión comprehensiva de la fisiología sináptica del CRF, véase el estudio de Gallagher y cols. (44).
La elevación de las concentraciones de CRF en el núcleo accumbens aumenta el valor motivacional de estímulos ambientales y es responsable del estado disfórico característico de la abstinencia a sustancias de abuso (45,46). Luego es posible que alteraciones en el sistema extrahipotalámico del CRF, que afecten la modulación de la neurotrasmisión dopaminérgica en los circuitos prefrontales, estén relacionadas con el rasgo impulsividad, más que alteraciones dopaminérgicas, por sí solas.
En resumen, la impulsividad es un rasgo de personalidad complejo, relacionado con el control del comportamiento y las emociones, al igual que con una disfunción de los circuitos córtico-límbicos y córtico-estriatales. La disfunción de los circuitos está mediada por alteraciones microestructurales en las sustancias blanca y gris, que limitan el procesamiento de información en los circuitos; así como por alteraciones de los neurotransmisores modulares principales (i. e. serotonina, norepinefrina y dopamina) y en sus reguladores (i. e. CRF).
Estas alteraciones pueden contribuir de manera significativa a modificar el efecto de los estímulos en la regulación del comportamiento, por medio de la formación anormal de estados emocionales o de un aumento de la sensibilidad a los estados emocionales negativos. Estas conclusiones son consistentes con los hallazgos neurobiológicos en subgrupos de pacientes con BN, lo que sustenta un rol para la impulsividad en este tipo de TCA.
Hallazgos neurobiológicos en bulimia nerviosa
Invariablemente, la BN se asocia con una disminución en el tono de la neurotransmisión serotoninérgica en el sistema nervioso central. Así como en la impulsividad, estas alteraciones involucran tanto la liberación de serotonina como una modifi cación en la función de sus receptores, en particular el receptor 5-HT1A y sus transportadores. Por ello no es sorprendente que la hipofunción serotoninérgica sea más marcada en pacientes con BN y altos grados de impulsividad, comparados con los no impulsivos.
Sin embargo, a diferencia de otras alteraciones neurobiológicas en BN, la hipofunción serotoninérgica persiste, a pesar de la recuperación sintomática, lo cual sugiere que es un factor de vulnerabilidad o de rasgo asociado al desarrollo de una patrón de comportamiento impulsivo en estos pacientes (6,47), al modificar el equilibrio entre neurotransmisión excitatoria e inhibitoriaen los circuitos córtico-límbicos y córtico-estriatales (48,49).
Menos contundentes son los hallazgos relacionados con la disfunción prefrontal en BN, dada la heterogeneidad de los paradigmas comportamentales empleados y las diferencias en el estado de la enfermedad de los sujetos participantes. No obstante, algunos estudios coinciden en alteraciones de la perfusión frontal inferior derecha, temporal derecha y parietal derecha en pacientes con BN y un patrón de comportamiento impulsivo (i. e. purgas) (50).
Un hallazgo prevalente en estudios de imagenología funcional es una pérdida de la asimetría hemisférica en el patrón de distribución de las sustancias radiotrazadoras en individuos con BN sintomáticos (51,52). Lo anterior está de acuerdo con el hallazgo Moeller y cols. (31), sobre alteraciones en la microestructura del cuerpo calloso anterior en individuos impulsivos, que sugieren la pérdida de la integridad de la comunicación interhemisférica con altos grados de impulsividad. Sin embargo, los pocos hallazgos consistentes que sugieren disfunción prefrontal parecen ser específi cos de un estado activo de enfermedad, ya que se normalizan luego de la recuperación sintomática (53).
Relación entre el rasgo de personalidad impulsividad y la bulimia nerviosa
La dificultad para caracterizar hallazgos neurobiológicos específicos en individuos con BN permite apreciar la complejidad de la relación entre el rasgo de personalidad impulsividad y BN. Si bien numerosos estudios han demostrado que, en general, los individuos con BN presentan altos grados de impulsividad, medidos a través de pruebas de autollenado, como la Escala de Impulsividad de Barratt (12) y el Cuestionario de Impulsividad de Eysenck (54–56), y un mayor número de errores de coomisión en pruebas de desempeño continuo, comparados con controles (individuos con BN y uso de laxantes) (57), no todos los individuos con BN presentan los mismos grados o el mismo tipo de impulsividad.
Específicamente, Rosval y cols. (58) demostraron en fecha reciente que, en general, los individuos con TCA presentan alteraciones atencionales, medidas por pruebas comportamentales e instrumentos de autollenado. En este mismo estudio, los individuos con BN y anorexia nerviosa purgativa presentaron déficits específicos en la inhibición motora. Sin embargo, en BN existían de manera específica altos grados de impulsividad del tipo de la no planeación.
Los resultados de este estudio sugieren que sólo algunas de las dimensiones de la impulsividad, particularmente la dimensión de no planeación, se encuentran específicamente en algunos individuos con BN. Estudios de este tipo son necesarios para comprender la importante relación entre el rasgo de personalidad impulsividad y los TCA.
En resumen, los hallazgos sugieren que la impulsividad está presente en grados elevados y de manera diferencial en un subgrupo de pacientes con BN. En estos, la impulsividad se asocia con un decremento de la neurotransmisión serotoninérgica, que puede alterar el equilibrio entre excitación e inhibición en los circuitos córtico-límbicos y córtico-estriatales. La hipofunción serotoninérgica es un factor de vulnerabilidad constante o un rasgo que se puede relacionarse con disfunción prefronta y alteraciones en la regulación afectiva en estos sujetos.
Direcciones futuras
La complejidad de la relación entre el rasgo de personalidad impulsiva y los TCA, particularmente BN, hace necesario el desarrollo de instrumentos y medidas que permitan un enfoque multidimensional de las características de estos pacientes. Sólo así se podrán validar los endofenotipos que permitan la identificación de sistemas neurales específicos, asociados con los diversos patrones de comportamiento presentes en los pacientes con el espectro de patologías de la conducta alimentaria.
Un enfoque de este tipo ya ha mostrado sus frutos en la validación de la unión a receptores plaquetarios de serotonina por parte de la paroxetina (3H), como indicador del rasgo de impulsividad en individuos con BN asintomáticos (59). Finalmente, los endofenotipos auxiliarán en la identifi cación de los mediadores moleculares de la BN sobre los sistemas neurales que sirvan de blancos terapéuticos para el desarrollo de estrategias de tratamiento a estos pacientes.
Acknowledgments
Al financiamiento del Fondo Semilla, Universidad de los Andes, Bogotá, Colombia; a LFOC, y al U. S. National Institute on Drug Abuse. Agradecemos a las dras. Maritza Rodríguez y Juanita Gempeler y al dr. Ricardo de La Espriella, por sus sugerencias y retroalimentación a este manuscrito. Así mismo, deseamos agradecer al señor Juan Romero, por su valiosa asistencia en la preparación de este manuscrito.
Footnotes
El contenido de este manuscrito fue presentado de manera parcial por Luis Felipe Oroz-co-Cabal como ponencia en el Curso de Actualización de Trastornos de la Conducta Alimentaria, entre el 7 y el 9 de febrero de 2008, Facultad de Medicina, Universidad de los Andes, Bogotá, Colombia.
Referencias
- 1.Orozco-Cabal LF, Barratt ES. Implicaciones para el estudio de la neurobiología de la experiencia consciente. El acto impulsivo. Rev Latinoam Psicol. 2007;39(1):109–26. [Google Scholar]
- 2.American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 4. Washington: American Psychiatric Publishing; 2000. [Google Scholar]
- 3.Dawe S, Loxton NJ. The role of impulsivity in the development of substance use and eating disorders. Neurosci Biobehav Rev. 2004;28(3):343–51. doi: 10.1016/j.neubiorev.2004.03.007. [DOI] [PubMed] [Google Scholar]
- 4.Fernández-Aranda F, Jiménez-Murcia S, Álvarez-Moya EM, Granero R, Vallejo J, et al. Impulse control disorders in eating disorders: clinical and therapeutics implications. Comp Psychiatry. 2006;47(6):482–88. doi: 10.1016/j.comppsych.2006.03.002. [DOI] [PubMed] [Google Scholar]
- 5.Steiger H, Israël M, Gauvin L, Ng Ying Kin NM, Young SN. Implications of compulsive and impulsive traits for serotonin status in women with bulimia nervosa. Psychiatry Res. 2003;120(3):119–29. doi: 10.1016/s0165-1781(03)00195-1. [DOI] [PubMed] [Google Scholar]
- 6.Steiger H, Bruce KR. Phenothypes, endophenotypes, and genotypes in bulimia spectrum eating disorders. Can J Psychiatry. 2007;52(4):220–27. doi: 10.1177/070674370705200403. [DOI] [PubMed] [Google Scholar]
- 7.Steiger H, Bruce KR. Personality traits and disorders in anorexia nervosa, bulimia nervosa and hinge eating disorder. In: Brewerton TD, editor. Clinical handbook of eating disorders: an integrated approach. New York: Marcel Dekker; 2004. pp. 207–28. [Google Scholar]
- 8.Grilo CM. Recent research of relationships among eating disorders and personality disorders. Curr Psychiatry Rep. 2002;4(1):18–24. doi: 10.1007/s11920-002-0007-8. [DOI] [PubMed] [Google Scholar]
- 9.Moeller FG, Barratt ES, Dougherty DM, Swann AC. Psychiatric aspects of impulsivity. Am J Psychiatry. 2001;158(11):1783–93. doi: 10.1176/appi.ajp.158.11.1783. [DOI] [PubMed] [Google Scholar]
- 10.Hollander E, Stein DJ, editors. Clinical Manual of Impulsive Control Disorders. Arlington: American Psychiatric Publishing; 2006. [Google Scholar]
- 11.Evenden JL. Varieties of impulsivity. Psychopharmacology. 1999;146(4):348–61. doi: 10.1007/pl00005481. [DOI] [PubMed] [Google Scholar]
- 12.Patton JH, Stanford MS, Barratt ES. Factor structure of the Barratt impulsiveness scale. J Clin Psychol. 1995;51(6):768–74. doi: 10.1002/1097-4679(199511)51:6<768::aid-jclp2270510607>3.0.co;2-1. [DOI] [PubMed] [Google Scholar]
- 13.Spinella M. Normative data and a short form of the Barratt impulsiveness scale. Int J Neurosci. 2007;117(3):359–68. doi: 10.1080/00207450600588881. [DOI] [PubMed] [Google Scholar]
- 14.Barratt E, Orozco-Cabal LF, Moeller FG. Impulsivity and sensation seeking: a historical perspective on current challenges. In: Stelmack RM, editor. On the psychobiology of personality. Boston: Elsevier Science; 2004. pp. 3–15. [Google Scholar]
- 15.Barratt ES. Impulsiveness subtracts: arousal and information processing. In: Spence JT, Izard CE, editors. Motivation, emotion and personality. North Holland: Elsevier Science; 1985. pp. 137–46. [Google Scholar]
- 16.Dougherty DM, Moeller FG, Steinberg JL, Marsh DM, Hines SE, Bjork JM. Alcohol increases commission error rates for a continuous performance test. Alcohol Clin Exp Res. 1999;23(8):1342–51. [PubMed] [Google Scholar]
- 17.Halperin JM, Sharma V, Greenblatt E, Schwartz ST. Assessment of the continuous performance test: reliability and validity in a nonreferred sample. Psychol Assess. 1991;3(4):603–08. [Google Scholar]
- 18.Dougherty DM, Bjork JM, Huckabee HC, Moeller FG, Swann AC. Laboratory measures of aggression and impulsivity in women with borderline personality disorder. Psychiatry Res. 1999;85(3):315–26. doi: 10.1016/s0165-1781(99)00011-6. [DOI] [PubMed] [Google Scholar]
- 19.Barratt ES, Mishalanie J, Matthews S, Moeller FG. Lateralized readiness potential and impulsivity. San Francisco: Cognitive Neuroscience Society Meeting; 2002. [Google Scholar]
- 20.Ainslie G. Specious reward: a behavioral theory of impulsiveness and impulse control. Pshychol Bull. 1975;82(4):463–96. doi: 10.1037/h0076860. [DOI] [PubMed] [Google Scholar]
- 21.Jentsch JD, Taylor JR. Impulsivity resulting from frontostriatal dysfunction in drug abuse: implications for the control of behavior by reward-related stimuli. Psychopharmacology. 1999;146(4):371–90. doi: 10.1007/pl00005483. [DOI] [PubMed] [Google Scholar]
- 22.Uslaner JM, Robinson TE. Subthalamic nucleus lesions increase impulsive action and decrease impulsive choice - mediation by enhanced incentive motivation? Eur J Neurosci. 2006;24(8):2345–54. doi: 10.1111/j.1460-9568.2006.05117.x. [DOI] [PubMed] [Google Scholar]
- 23.Hinshaw SP. Impulsivity, emotion regulation, and developmental psychopatology: especificity versus generality of linkages. Ann NY Acad Sci. 2003;1008:149–59. doi: 10.1196/annals.1301.016. [DOI] [PubMed] [Google Scholar]
- 24.Pailing PE, Segalowitz SJ, Dywan J, Davies PL. Error negativity and response control. Psychophysiology. 2002;39(2):198–206. doi: 10.1017/S0048577202010247. [DOI] [PubMed] [Google Scholar]
- 25.Pailing PE, Segalowitz SJ. The error-related negativity as a state and trait measure: Motivation, personality, and ERPs in response to errors. Psychophysiology. 2004;41(4):84–95. doi: 10.1111/1469-8986.00124. [DOI] [PubMed] [Google Scholar]
- 26.Orozco-Cabal L, Pollandt S, Liu J, Shinnick-Gallagher P, Gallagher JP. Regulation of synaptic transmission by CRF receptors. J Neurosci. 2006;17(3):279–307. doi: 10.1515/revneuro.2006.17.3.279. [DOI] [PubMed] [Google Scholar]
- 27.Lichter DG, Cummings JL, editors. frontal-subcortical circuits in psychiatric and neurological disorders. New York: Guilford Press; 2001. [Google Scholar]
- 28.McFarland K, Kalivas PW. The circuitry mediating cocaine-induced reinstatement of drug-seeking behavior. J Neurosci. 2001;21(21):8655–63. doi: 10.1523/JNEUROSCI.21-21-08655.2001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Alexander GE, DeLong MR, Strick PL. Parallel organization of functionally segregated circuits linking basal ganglia and cortex. Annu Rev Neurosci. 1986;9:357–81. doi: 10.1146/annurev.ne.09.030186.002041. [DOI] [PubMed] [Google Scholar]
- 30.Fuster JM. Cortex and mind. Oxford: Oxford University Press; 2003. [Google Scholar]
- 31.Moeller FG, Hasan KM, Steinberg JL, Kramer LA, Dougherty DM, Santos RM, et al. Reduced anterior corpus callosum white matter integrity is related to increased Impulsivity and reduced discriminability in cocaine-dependent subjects: diffusion tensor imaging. Neuropsychopharmacology. 2005;30:610–17. doi: 10.1038/sj.npp.1300617. [DOI] [PubMed] [Google Scholar]
- 32.Hazlett EA, New AS, Newmark R, Haznedar MM, Lo JN, Speiser LJ, et al. Reduced anterior and posterior cingulate gray matter in borderline personality disorder. Biol Psychiatry. 2005;58(8):614–23. doi: 10.1016/j.biopsych.2005.04.029. [DOI] [PubMed] [Google Scholar]
- 33.Cardinal RN, Winstanley CA, Robbins TW, Everitt BJ. Limbic corticostriatal systems and delayed reinforcement. Ann N Y Acad Sci. 2004;1021:33–50. doi: 10.1196/annals.1308.004. [DOI] [PubMed] [Google Scholar]
- 34.Grant JE, Correia S, Brennan-Krohn T, Malloy PF, Laidlaw DH, Schulz SC. Frontal white matter integrity in borderline personality disorder with self-injurious behavior. J Neuropsychiatry Clin Neurosci. 2007;19(4):383–90. doi: 10.1176/jnp.2007.19.4.383. [DOI] [PubMed] [Google Scholar]
- 35.Soubrie P. Serotonergic neurons and behavior. J Pharmacol. 1986;17(2):107–12. [PubMed] [Google Scholar]
- 36.Evenden JL. The pharmacology of impulsive behavior in rats II: the effects of amphetamine, haloperidol, imipramine, chlordiazepoxide, and other drugs on fixed consecutive number schedules (FCN 8 and FCN 32) Psychopharmacology. 1998;138(3–4):283–94. doi: 10.1007/s002130050673. [DOI] [PubMed] [Google Scholar]
- 37.Evenden JL. The pharmacology of impulsive behavior in rats VII: the effects on serotonergic agonists and antagonists on responding under a discrimination task using unreliable visual stimuli. Psychopharmacology (Berl) 1999;146(4):422–31. doi: 10.1007/pl00005487. [DOI] [PubMed] [Google Scholar]
- 38.Nishiguchi N, Matsushita S, Suzuki K, Murayama M, Shirakawa O, Higuchi S. Association between 5HT2A receptor gene promoter region polymorphism and eating disorders in Japanese patients. Biol Psychiatry. 2001;50(2):123–28. doi: 10.1016/s0006-3223(00)01107-0. [DOI] [PubMed] [Google Scholar]
- 39.Preuss UW, Koller G, Bondy B, Bahlmann M, Soyka M. Impulsive traits and 5-HT2A receptor promoter polymorphism in alcohol dependents: possible association but no influence of personality disorders. Neuropsychobiology. 2001;43(3):186–91. doi: 10.1159/000054888. [DOI] [PubMed] [Google Scholar]
- 40.Koskinen T, Haapalinna A, Sirvio J. Alpha-adrenoceptor-mediated modulation of 5-HT2 receptor agonist induced impulsive responding in a 5-choice serial reaction time task. Pharmacol Toxicol. 2003;92(5):214–25. doi: 10.1034/j.1600-0773.2003.920504.x. [DOI] [PubMed] [Google Scholar]
- 41.Dalley JW, Mara AC, Economidou D, Robbins TW. Neurobehavioral mechanisms of impulsivity: fronto-striatal systems and functional neurochemistry. Pharmacol Biochem Behav. 2007 doi: 10.1016/j.pbb.2007.12.021. [avance en línea] [DOI] [PubMed] [Google Scholar]
- 42.Dalley JW, Fryer TD, Brichard L, Robinson ES, Theobald DE, Lääne K, et al. Nucleus accumbens D2/3 receptors predict trait impulsivity and cocaine reinforcement. Science. 2007;315(5816):1267–70. doi: 10.1126/science.1137073. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Orozco-Cabal L, Liu J, Pollandt S, Robinson ES, Theobald DE, Lääne K, et al. Dopamine and corticotropin-releasing factor synergistically alter basolateral amygdala-to-medial prefrontal cortex synaptic transmission: functional switch after chronic cocaine administration. J Neurosci. 2008;28(2):529–42. doi: 10.1523/JNEUROSCI.2666-07.2008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Gallagher JP, Orozco-Cabal LF, Liu J, Shinnick-Gallagher P. Synaptic physiology of central CRH system. Eur J Pharmacol. 2008;583(2–3):515–25. doi: 10.1016/j.ejphar.2007.11.075. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Peciña S, Schulkin J, Berridge KC. Nucleus accumbens corticotropin-releasing factor increases cue-triggered motivation for sucrose reward: paradoxical positive incentive effects in stress? BMC Biol. 2006;13:4–8. doi: 10.1186/1741-7007-4-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Land BB, Bruchas MR, Lemos JC, Xu M, Melief EJ, Chavkin C. The dysphoric component of stress is encoded by activation of the dynorphin kappa-opioid system. J Neurosci. 2008;8(2):407–14. doi: 10.1523/JNEUROSCI.4458-07.2008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Kaye WH, Bulik CM, Thornton L, Bar-barich N, Masters K. Comorbidity of anxiety disorders with anorexia and bulimia nervosa. Am J Psychiatry. 2004;161(12):2215–21. doi: 10.1176/appi.ajp.161.12.2215. [DOI] [PubMed] [Google Scholar]
- 48.Kaye WH, Frank GK, Henry SE. Neurobiology of anorexia nervosa: clinical implications of alterations of the function of serotonin and other neuronal systems. Int J Eat Disord. 2005;37(Suppl):S15–9. doi: 10.1002/eat.20109. [DOI] [PubMed] [Google Scholar]
- 49.Tan H, Zhong P, Yan Z. Corticotropin-releasing factor and acute stress prolongs serotonergic regulation of GABA transmission in prefrontal cortical pyramidal neurons. J Neurosci. 2004;24(21):5000–8. doi: 10.1523/JNEUROSCI.0143-04.2004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Poblete-García VM, García-Vicente A, Soriano-Castrejon A, Beato Fernández L, García-Vilches I, Rodríguez-Cano T. Assessment of cortical brain blood flood by brain perfusion SPECT in patients with a diagnosis of eating behavior disorders. Rev Esp Med Nucl. 2007;26(1):11–18. [PubMed] [Google Scholar]
- 51.Hirano H, Tomura N, Okane K, Watarai J, Tashiro T. Changes in cerebral blood flow in bulimia nervosa. J Comput Assist Tomogr. 1999;23(2):280–82. doi: 10.1097/00004728-199903000-00019. [DOI] [PubMed] [Google Scholar]
- 52.Wu JC, Hagman J, Buchsbaum MS, Blinder B, Derrfler M, Tai WY, et al. Greater left cerebral hemispheric metabolism in bulimia assessed by positron emission tomography. Am J Psychiatry. 1990;147(3):309–12. doi: 10.1176/ajp.147.3.309. [DOI] [PubMed] [Google Scholar]
- 53.Frank GK, Bailer UF, Meltzer CC, Price JC, Mathis CA, Wagner A, et al. Regional cerebral blood flow after recovery from anorexia nervosa or bulimia nervosa. Int J Eat Disord. 2007;40(6):488–92. doi: 10.1002/eat.20395. [DOI] [PubMed] [Google Scholar]
- 54.Newton JR, Freeman CP, Munro J. Impulsivity and dyscontrol in bulimia nervosa: is impulsivity an independent phenomenon or a marker of severity? Acta Psychiatr Scand. 1993;87(6):389–94. doi: 10.1111/j.1600-0447.1993.tb03393.x. [DOI] [PubMed] [Google Scholar]
- 55.Fahy T, Eisler I. Impulsivity and eating disorders. Br J Psychiatry. 1990;162:193–7. doi: 10.1192/bjp.162.2.193. [DOI] [PubMed] [Google Scholar]
- 56.Wolfe BE, Jimerson DC, Levine JM. Impulsivity ratings in bulimia nervosa: relationship to binge eating behaviors. Int J Eat Disord. 1994;15(3):289–92. doi: 10.1002/1098-108x(199404)15:3<289::aid-eat2260150314>3.0.co;2-u. [DOI] [PubMed] [Google Scholar]
- 57.Bruce KR, Koerner NM, Steiger H. Laxative misuse and behavioral disinhibition in bulimia nervosa. Int J Eat Disord. 2003;33(1):92–7. doi: 10.1002/eat.10116. [DOI] [PubMed] [Google Scholar]
- 58.Rosval L, Steiger H, Bruce K. Impulsivity in women with eating disorders: problem of response inhibition, planning, or attention? Int J Eat Disord. 2006;39(7):590–3. doi: 10.1002/eat.20296. [DOI] [PubMed] [Google Scholar]
- 59.Steiger H, Rchardson J, Israel M. Reduced density of platelet-binding sales 3H-panoxetine in remitted bulimic women. Neuropsychopharmacology. 2005;30(5):1028–32. doi: 10.1038/sj.npp.1300693. [DOI] [PubMed] [Google Scholar]


