Abstract
L’alcool est un tératogène physique et comportemental. Le syndrome d’alcoolisme foetal (SAF) est un trouble courant mais encore sous-diagnostiqué découlant de la consommation d’alcool par la mère pendant la grossesse. Bien qu’il puisse être prévenu, le SAF est également invalidant.
Même si le SAF est présent dans tous les groupes socioéconomiques du Canada, sa prévalence est élevée dans certaines communautés inuites et des Premières nations du Canada. Le présent énoncé porte sur la prévention, le diagnostic, le dépistage précoce et la prise en charge du SAF par les professionnels de la santé.
La prévention du SAF doit s’effectuer à deux échelons. La prévention primaire consiste à éliminer le SAF par une formation en classe ou dans la collectivité et à inciter les femmes à éviter de consommer de l’alcool avant la conception et pendant la grossesse. La prévention secondaire consiste à repérer les femmes qui boivent pendant leur grossesse et à réduire leur consommation. Le présent énoncé décrit plusieurs stratégies de dépistage, dont la stratégie T-ACE (tolérance-agacement, réduction, éveil). Les dispensateurs de soins devraient recommander l’abstinence dès la première visite prénatale. Un envoi rapide en consultation en vue de traiter l’alcoolisme est recommandé pour les femmes enceintes incapables d’arrêter de boire.
Le présent énoncé décrit le diagnostic de SAF, de SAF partiel ou atypique, d’anomalies congénitales et de troubles neurodéveloppementaux reliés à l’alcool. En cas d’exposition à l’alcool in utero, un diagnostic de SAF devrait être envisagé en présence d’un retard de croissance courant ou antérieur, de certaines anomalies faciales touchant la lèvre supérieure et les yeux et d’anomalies neurodéveloppementales. Ces caractéristiques sont mieux quantifiées au moyen d’une méthode diagnostique à quatre chiffres.
Des stratégies de dépistage précoce des anomalies pouvant être reliées à l’alcool sont soulignées.
L’intervention est axée sur l’optimisation du développement, la prise en charge des troubles de comportement et la prestation d’un programme scolaire convenable. Il est capital d’intervenir le plus tôt possible pour prévenir les incapacités secondaires susceptibles de découler d’un délai causé par l’attente d’un diagnostic définitif de SAF.
Ce n’est que depuis 1973, lorsque Jones et Smith (1) ont donné des descriptions classiques des malformations reliées à l’exposition du foetus à l’alcool, qu’on a compris toute l’étendue de la dévastation provoquée par la consommation d’alcool pendant la grossesse. Un diagnostic de syndrome d’alcoolisme foetal (SAF) dépend d’un historique de consommation prénatale d’alcool par la mère, combiné à un ensemble de caractéristiques chez le nourrisson : croissance médiocre, traits caractéristiques du visage et anomalies neurodéveloppementales. À l’origine, l’effet de l’alcool sur le foetus (SAF atypique) était décrit comme une exposition à l’alcool accompagnée d’un schéma incomplet de manifestations physiques et psychologiques non spécifiques. Cette nomenclature a largement été remplacée par un système de classification qui précise si les effets sont physiques (anomalies congénitales reliées à l’alcool [ACRA]) ou reliés au développement du système nerveux ou du cerveau (anomalies neurodéveloppementales reliées à l’alcool [ANRA]) (2). Bien que les ACRA et les ANRA n’accompagnent pas nécessairement le SAF complet, leurs effets peuvent être tout aussi graves (3). Récemment, Astley et Clarren (4) ont suggéré de limiter la nomenclature aux termes SAF et SAF atypique.
LA PRÉVALENCE
On ne connaît pas la prévalence exacte de SAF et de SAF atypique. Abel (5) estime que l’incidence globale de SAF s’élève à 0,97 naissance vivante sur 1 000 (0,097 %) et à 43 sur 1 000 (4,3 %) chez les bébés de grosses buveuses. Récemment, d’après trois études démographiques, Sampson et coll. (6) ont estimé que l’incidence de SAF se situait entre 2,8 et 4,8 naissances vivantes sur 1 000, et que celle d’une combinaison de SAF et d’ANRA correspondait à au moins 9,1 naissances vivantes sur 1 000. Bien que toutes les races soient susceptibles au SAF, le nombre de cas de SAF est démesuré chez les enfants amérindiens (7).
On est de plus en plus sensibilisé à l’importance du SAF et du SAF atypique dans les communautés autochtones du Canada (8), et surtout au lien de ce trouble avec un retard de développement et des troubles d’apprentissage (9,10). Les quelques études existantes laissent supposer une incidence très élevée au sein des communautés autochtones canadiennes. Robinson et coll. (11) ont répertorié 22 (16 %) enfants sur 116 atteints du SAF dans une communauté autochtone de Colombie-Britannique. Un compte rendu deMacDonald (12), présenté en 1991, témoigne d’un taux de SAF de 3,3 enfants sur 1 000 en Colombie-Britannique et d’un taux de SAF atypique susceptible d’être cinq fois plus élevé si on inclut les enfants plus vieux atteints du syndrome. D’après un nombre de 42 909 naissances dénombrées par année en 1998 (13), ce taux laisse supposer que chaque année en Colombie-Britannique, au moins 142 enfants naissent atteints du SAF et 710, du SAF partiel. Au nord du Manitoba, d’après les observations physiques à la naissance, Williams et coll. (14) ont estimé l’incidence de SAF à 7,2 enfants sur 1 000, mais ils pensent qu’un certain nombre d’enfants n’ont pas été dépistés. Chez les nouveau-nés, le SAF tend à être sous-diagnostiqué (15).
L’ÉTIOLOGIE
L’alcool est à la fois un tératogène physique et comportemental. C’est l’une des principales causes de déficience mentale de par le monde. Les autopsies et les études d’imagerie par résonance magnétique démontrent une microcéphalie, accompagnée de signes de perte tissulaire, de dysgénésie cérébrale et d’anomalies de la migration névroglique et neuronale (16). L’holotélencéphalie est caractéristique du SAF. C’est une pathologie associée à l’omission par le cerveau de se séparer en deux hémisphères, laquelle est généralement reliée à des anomalies neurodéveloppementales et faciales. Des anomalies connexes du corps calleux (p. ex., agénésie, hypoplasie), du tronc cérébral et du cervelet, en particulier la portion antérieure du vermis, s’observent également. Les autres constatations peuvent inclure l’absence de lobes olfactifs, une hypoplasie de l’hippocampe, des noyaux gris centraux anormaux ou inexistants ou des noyaux caudés fréquemment hypoplasiques ou inexistants. Les tomographies par émission de positrons démontrent des anomalies du métabolisme du glucose, surtout dans le noyau caudé antérieur et dans le vermis du cervelet, même en l’absence d’anomalies structurelles apparentes. Des études sont en cours afin de relier les anomalies cérébrales aux issues neurocomportementales.
On pense que la variabilité des lésions cérébrales résulte de différences dans la quantité d’alcool consommé, le cycle et le moment de la consommation ou la capacité génétique de la mère à métaboliser l’alcool.
LES FACTEURS MATERNELS
L’âge de la mère et la quantité d’alcool consommé étaient directement reliés aux incapacités cognitives d’un groupe de nourrissons exposés à l’alcool (17). On ne remarquait aucun lien entre la consommation d’alcool par la mère et l’issue neurodéveloppementale lorsque le seuil de consommation était inférieur à 14,8 mL d’alcool par jour, mais audessus de ce niveau, les nourrissons de mères de plus de 30 ans risquaient de deux à cinq fois plus de présenter une incapacité fonctionnelle que ceux de mères plus jeunes. On remarquait des incapacités fonctionnelles importantes, surtout chez les nourrissons dont la mère avait bu plus de cinq boissons à la fois, en moyenne au moins une fois par semaine. Cependant, même chez les femmes qu’on sait intoxiquées à l’alcool, le SAF continue d’être sousdiagnostiqué (15).
Les marqueurs biochimiques chez la mère peuvent contribuer à évaluer la quantité d’alcool consommé. Stoler et coll. (18) ont mesuré quatre marqueurs sanguins pendant la grossesse : la transférine déficiente en hydrates de carbone, la transpeptidase gamma-glutamyl, le volume moyen de globules rouges et l’acétylaldéhyde associé au sang entier. Toutes les mères qui buvaient au moins 29,6 mL d’alcool par jour présentaient au moins un marqueur. Celles dotées de deux marqueurs ou plus avaient des nourrissons dont la taille, le poids et la circonférence crânienne étaient inférieurs à ceux des bébés normaux.
LES MANIFESTATIONS CLINIQUES
Les effets de l’exposition prénatale à l’alcool oscillent entre le décès et le SAF à une extrémité du spectre et une normalité relative à l’autre extrémité. Le diagnostic de SAF se fonde sur une triade de caractéristiques chez un individu exposé à l’alcool in utero : retard de croissance prénatal et postnatal, modèle caractéristique d’anomalies faciales et dysfonction du système nerveux central.
Les traits anormaux du visage incluent de courtes fissures palpébrales, un espace intercanthal accru, un visage aplati et un nez court, un sillon naso-labial inexistant ou hypoplasique et une bouche en arceau avec une lèvre supérieure mince. Les normes de ces traits ont été établies (4).
Les séquelles les plus dévastatrices de l’exposition du foetus à l’alcool sont d’ordre neurodéveloppemental, associées à l’effet de l’alcool sur le système nerveux central (16). En plus d’une microcéphalie, la dysfonction du système nerveux central peut influer sur l’intelligence, l’activité et l’attention, l’apprentissage et la mémoire, le langage et les aptitudes motrices, et le comportement (tableau 1).
TABLEAU 1.
Critères diagnostiques reliés à l’âge pour le syndrome d’alcoolisme fœtal ou le syndrome d’alcoolisme foetal atypique
| Nourrissons |
| Antécédents d’exposition prénatale à l’alcool |
| Anomalies faciales |
| Retard de croissance (taille, poids, circonférence crânienne) |
| Hypotonie, irritabilité accrue |
| Agitation, tremblements, succion faible |
| Difficulté à s’habituer aux stimuli |
| Âge préscolaire |
| Antécédents d’exposition à l’alcool, retard de croissance, anomalies faciales |
| Attitule amicale, bavarde et vive |
| Accès de colère et difficulté avec les transitions |
| Hyperactivité, hypersensibitilié possible au toucher ou à la surstimulation |
| Déficits de l’attention, retards de développement (troubles du langage et de la motricité fine) |
| Les aptitudes apparentes peuvent sembler supérieures au taux de capacité testé. |
| Milieu de l’enfance |
| Antécédents d’exposition à l’alcool, retard de croissance, anomalies faciales |
| Hyperactivité, déficit de l’attention, impulsivité |
| Pensée abstraite déficiente |
| Incapacité de prévoir les conséquences de ses gestes |
| Manque d’organisation et de séquencement |
| Incapacité à faire des choix |
| Absence d’aptitudes organisationnelles |
| Comportement inadapté |
| Trop affectueux, ne distingue pas la famille des étrangers |
| Manque d’inhibition |
| Troubles de la communication |
| Absence d’aptitudes sociales à se faire des amis et à les conserver |
| Insensibilité aux indices sociaux |
| Utilisation du comportement comme mode de communication |
| Difficulté avec les transitions |
| Troubles scolaires (en lecture et en mathématiques) |
| Troubles du comportement (prolongation du comportement d’un tout-petit) |
| Adolescence et âge adulte |
| Antécédents d’exposition à l’alcool, retard de croissance, anomalies faciales |
| Quotient intellectuel : Retard mental léger à modéré dans une gamme étendue, troubles scolaires constants |
| Difficulté avec les aptitudes adaptatives et de vie |
| Déficits de l’attention, manque de jugement, impulsivité menant à des troubles à conserver un emploi, à mener une vie stable et à des démêlés avec la justice |
| Graves troubles d’ajustement à la vie (dépression, alcoolisme, crime, grossesse et suicide) |
LE NOUVEAU-NÉ
Les caractéristiques décrites ci-dessus ne sont pas toujours apparentes à la naissance parce que de nombreuses manifestations de l’exposition du foetus à l’alcool font leur apparition plus tard (tableau 1). La constatation physique la plus courante chez les nouveau-nés atteints du SAF, à part les traits caractéristiques du visage qui peuvent être difficiles à reconnaître, demeure le retard de croissance, et surtout une petite circonférence crânienne (19,20). Une augmentation de l’activité motrice et des altérations du tonus moteur et de l’orientation s’observent également (21–24) et ont tendance à être relativement peu spécifiques. Les troubles de l’audition (25), les anomalies oculaires (26) et des anomalies congénitales assorties peuvent également être notées.
LA PETITE ENFANCE
Tout au long de la petite enfance, d’autres manifestations comportementales deviennent évidentes, comme un retard du développement moteur et du langage (27,28) et une réduction des aptitudes cognitives (29,30), les anomalies les plus graves s’observant chez les enfants dont la mère était une grosse buveuse pendant la grossesse (8,11,19,31,32). Des difficultés dans les aptitudes aux relations interpersonnelles (33) sont caractéristiques. Des déficits de l’attention, une hyperactivité et des comportements impulsifs semblables à ceux observés chez les enfants atteints d’un trouble déficitaire de l’attention avec hyperactivité (TDAH) sont également documentés chez les enfants atteints du SAF ou du SAF atypique (10,33). À mesure que les enfants vieillissent, des anomalies d’apprentissage précises reliées au langage et au traitement des nombres peuvent devenir apparentes (10,34,35). On peut aussi remarquer des anomalies de l’audition et de la parole (25,36), ainsi que des troubles olfactifs.
Bien qu’une grande consommation d’alcool, et surtout une consommation frénétique occasionnelle, semble influer sur la cognition, le comportement et le développement, plusieurs études indiquent que les anomalies comportementales et les déficits du langage peuvent varier énormément. Greene et coll. (37) ont suivi, jusqu’à l’âge de trois ans, une cohorte de nourrissons exposés à l’alcool pendant la période prénatale, et n’ont découvert aucun lien significatif entre l’exposition à l’alcool et les troubles du langage, sauf en présence d’effets crâniofaciaux du SAF. De même, Russell et coll. (38) n’ont découvert aucune différence appréciable dans le développement intellectuel ou le traitement auditif des enfants de buveuses modérées ou « sociales » qui ne présentaient aucun stigmate du SAF ou SAF atypique. Abel (3) a présenté des arguments convaincants selon lesquels une faible consommation d’alcool est peu susceptible de causer le SAF, que les effets dépendent d’un taux d’alcool sanguin élevé et que le nombre de boissons consommées en une seule fois revêt plus d’importance que la consommation d’alcool « moyenne ». De même, Godel et coll. (20) ont découvert qu’une consommation modérée (moins de cinq verres, moins d’une fois par semaine) n’avait aucun effet mesurable sur la taille du nouveau-né par rapport à une consommation fréquente ou frénétique occasionnelle, qui s’associe surtout à la microcéphalie.
La dysfonction du système nerveux central atteint surtout l’intelligence, l’activité et l’attention, l’apprentissage et la mémoire, le langage et les aptitudes motrices.
Les effets sur l’activité et l’attention incluent les tremblements, l’hyperactivité, l’irritabilité (signes cardinaux), les déficits de l’attention (augmentation de l’état de nonvigilance) et l’impulsivité. Contrairement aux enfants souffrant de TDAH, qui peuvent afficher un spectre d’activités similaire, les enfants atteints de SAF ou de SAF atypique obtenaient des résultats qui ressemblaient davantage à ceux des témoins normaux aux tests de vigilance et au temps de réaction. L’ingestion d’alcool d’un « buveur social », soit 13,3 mL d’alcool absolu par jour, s’associait à une réduction de la durée d’attention, même en cas de contrôle pour la parité, le tabagisme, le milieu de vie et le sexe de l’enfant. Dans ces cas, l’hyperactivité n’était pas en cause.
Le quotient intellectuel (QI) des enfants atteints du SAF est extrêmement variable, oscillant entre 50 et 115. Chez les enfants de six ans de mères dont la consommation d’alcool était problématique pendant la grossesse, on a découvert une diminution moyenne de 7 points de QI (38,39). Streissguth et coll. (40) ont remarqué une diminution similaire du QI chez les enfants de six ans exposés à une consommation d’alcool frénétique occasionnelle (plus de cinq boissons à la fois) in utero. Dans une étude de LaDue et coll. (41), on a constaté que le fonctionnement intellectuel des adolescents et des adultes atteints du SAF se situait dans la plage d’une déficience légère à modérée, le QI de 46 % d’entre eux étant inférieur à 69. On remarquait un écart marqué entre un QI verbal moyen de 65 et un QI performance de 79, comportant des déficits précis considérables de la fonction scolaire et adaptatrice.
Même en présence d’un QI normal, l’apprentissage tendait à être compromis chez les enfants exposés à l’alcool. Les caractéristiques incluaient une mauvaise mémoire à court terme accompagnée d’une mémoire intacte à long terme, de la difficulté à établir des routines chez les nourrissons (échelle de Brazelton) (42), un rendement scolaire inférieur, surtout en cas de consommation frénétique occasionnelle, des troubles de mémoire verbale (rappel d’une liste de mots) (43) et des anomalies de la mémoire spatiale, accompagnées d’une mauvaise rétention des tâches acquises. Parmi les anomalies repérées grâce aux tests, soulignons les incapacités de reproduire des formes de mémoire (dessin d’horloge) ainsi que de se rappeler les détails et de les copier. Les troubles de lecture et en mathématiques sont courants (10).
Le retard et les anomalies du langage, comme des difficultés dans la compréhension des mots, la capacité de nommer, l’articulation, les aptitudes de langage expressives et réceptives et les troubles de l’articulation sont également classiques.
Les aptitudes interpersonnelles tendent à être entravées (34), et les troubles de comportement sont courants (tableau 2). Ces troubles incluent l’incapacité de se faire des amis et de les conserver. Les enfants atteints de SAF ou de SAF atypique sont démesurément amicaux, même face aux étrangers, et sont incapables de distinguer les amis des membres de la famille et des étrangers.
TABLEAU 2.
Profil cognitif et comportemental des enfants atteints du syndrome d’alcoolisme foetal ou du syndrome d’alcoolisme foetal atypique
| Manque d’organisation |
| Séquencement |
| Incapacité de faire des choix |
| Pensée abstraite déficiente |
| Incapacité de prévoir les conséquences |
| Impulsivité |
| Comportement inconvenant |
| Attitude démesurément amicale |
| Manque d’inhibitions |
| Incapacité d’apprendre de ses expériences passées |
| Troubles de la communication |
| Insensibilité aux indices sociaux |
| Incapacité de se faire des amis et de les conserver |
| Utilisation du comportement comme mode de communication |
| Difficulté avec les aptitudes adaptatives à la vie |
Les troubles cognitifs sont également fréquents chez les enfants atteints de SAF. L’attention, la mémoire à court terme, la flexibilité et la planification, la mémoire auditive (la mémoire des rythmes et des séquences de chiffres) et la visualisation spatiale peuvent toutes être touchées (24). Ces enfants peuvent aussi présenter des troubles moteurs, y compris un retard du développement moteur, une détérioration de la motricité fine et des troubles de l’équilibre (25). Les tests peuvent révéler des troubles comme un retard du développement moteur et de la motricité fine, des schèmes moteurs non coordonnés, une ataxie, une hémiplégie, des anomalies de la vitesse motrice, de la précision, de la vitesse à taper du doigt et de la force de préhension (10).
Les individus exposés à l’alcool in utero peuvent souffrir de séquelles à long terme qui exigent des soins et une attention la vie durant. La Due et coll. (41), Olson et coll. (44) et Stressguth et coll. (45) ont établi un profil des manifestations psychologiques et comportementales du SAF et du SAF atypique qui ne s’atténuent pas avec l’âge. Un manque de jugement et l’incapacité d’évaluer les conséquences possibles d’une action sont monnaie courante. Si ces caractéristiques sont combinées à la frustration causée par de mauvais résultats scolaires ou à une tendance à l’impulsivité, une conduite favorisant les conflits avec la société peut en résulter. De plus, une familiarité et une attitude démesurément amicale, même face aux étrangers, combinées à une absence d’inhibitions, peuvent favoriser l’exploitation et les mauvais traitements.
D’autres problèmes ayant des répercussions à long terme, comme un manque de sociabilité (31), de la difficulté à s’organiser et de la difficulté à reconnaître et à établir des limites, rendent la vie quotidienne difficile et dangereuse (46). Ces anomalies persistantes distinguent les individus exposés à l’alcool pendant la phase foetale de ceux souffrant de déficits de l’attention et de troubles d’apprentissage non reliés à une exposition à l’alcool. Des données indiquent qu’une intervention convenable et précoce peut réduire au minimum les effets des comportements liés au SAF ou au SAF atypique (28,30). Ainsi, un dépistage rapide des enfants atteints de SAF ou de SAF atypique s’impose.
LE DIAGNOSTIC ET LA PRISE EN CHARGE
La prise en charge du SAF doit être proactive.
Le premier objectif demeure la prévention : Changer les attitudes vis-à-vis de la consommation d’alcool chez les jeunes d’âge scolaire.
Le deuxième objectif consiste à repérer les buveuses à risque avant la grossesse, dans la mesure du possible, afin de permettre une intervention précoce sur les habitudes de consommation d’alcool.
Le troisième objectif consiste à repérer les nourrissons à risque, que ce soit à la naissance ou dans la première enfance.
Le quatrième objectif consiste à amorcer une intervention le plus tôt possible pour prévenir les troubles secondaires.
Le dernier objectif vise à poser un diagnostic plus exact et plus définitif, que ce soit de SAF ou de troubles comorbides qui exigent un traitement, afin de pouvoir accéder à des services précis et de soigner des troubles précis.
Le dépistage de la buveuse à risque
Dans la société autochtone traditionnelle, la mère et le bébé sont considérés comme des parties d’un cercle plus grand qui inclut les partenaires, les familles et les communautés (47). Le dépistage de la femme à risque devrait être effectué dans ce contexte, afin de mobiliser facilement un soutien et un traitement compatissants.
Toutes les femmes vues par un médecin de premier recours, une sage-femme ou une infirmière clinicienne devraient être interrogées au sujet de leurs habitudes de consommation d’alcool, qu’elles soient enceintes ou non. Cette série de questions doit être faite avec respect pendant l’anamnèse, dans le contexte d’une démarche traditionnelle tenant compte de la culture. L’importance de la consommation peut se caractériser comme suit :
Abstinente : Ne consomme pas d’alcool.
Buveuse à faible risque : Boit une ou deux consommations standards par jour, pas plus de trois fois par semaine. L’alcool n’a aucun effet sur sa santé. Elle ne prend pas d’alcool lorsqu’elle conduit, pendant sa grossesse ou lorsqu’elle allaite ou prend certains médicaments.
Buveuse à risque : Boit de sept à 21 consommations standards par semaine. Boit plus de trois à quatre consommations normales par occasion ou boit dans des situations à risque élevé.
Buveuse à problème : Boit plus de 21 consommations standards par semaine et peut souffrir des conséquences néfastes (comportementales, familiales, médicales, de santé mentale, d’emploi, juridiques, etc.) de ce comportement.
Il existe plusieurs moyens d’aborder le sujet de la consommation d’alcool. Les questions devraient s’intégrer à une anamnèse complète qui inclut l’apport alimentaire, les moeurs tabagiques et l’importance de la consommation d’alcool. Le questionneur doit se montrer coopératif et non conflictuel, parce que le simple fait de poser des questions reliées à la consommation d’alcool peut susciter une réaction défensive. Néanmoins, il est important que toutes les femmes, qu’elles ne soient pas enceintes (annexe A) ou qu’elles le soient (annexe B) soient interrogées au sujet de leur consommation d’alcool.
Les réponses à ces questions peuvent contribuer à évaluer l’importance de la consommation problématique d’alcool et peuvent donner lieu à l’une des quatre conclusions possibles suivantes :
la patiente est une buveuse à risque,
la patiente est une buveuse à problème,
la patiente peut être alcoolodépendante,
la patiente n’est pas à risque (48).
Il existe une autre démarche pour évaluer le risque, le T-ACE (tolérance-agacement, réduction, éveil).
Combien d’alcool buvez-vous avant d’en ressentir les effets? (tolérance)
Vous a-t-on déjà agacé en disant que vous devriez réduire votre consommation d’alcool?
Avez-vous déjà pensé que vous devriez réduire votre consommation?
Avez-vous déjà pris une consommation pour démarrer votre journée? (éveil)
Si la femme répond au moins deux consommations à la question sur la tolérance, le pointage est 2. Une réponse positive à chacune des questions suivantes donne un point par question. Un total d’au moins deux indique un comportement « à risque » (49).
Les buveuses à risque qui ne sont pas enceintes devraient être invitées à réduire leur consommation d’alcool ou à éviter de boire. Les buveuses dépendantes devraient être invitées à arrêter de boire et être envoyées en consultation auprès d’un spécialiste des troubles de l’alcool. Une femme enceinte devrait chercher à respecter une abstinence totale. Il faut donner des conseils avec l’appui du conjoint, de la famille et des amis les plus près de la personne à risque. Il faut viser à en faire des alliés pour qu’ils soutiennent le changement de comportement (47). Les stratégies d’intervention sont soulignées dans la brochure A Guide for Primary-Care Providers (48). Un suivi étroit et un soutien compatissant sont essentiels.
Le dépistage précoce de l’enfant à risque
L’importance d’un dépistage précoce :
Plus le SAF et les troubles connexes sont dépistés rapidement, plus une prise en charge efficace pourra être entreprise tôt. Le médecin ou la sage-femme est souvent le premier à être confronté à un bébé susceptible d’être atteint, et il a un rôle important à jouer dans le diagnostic et la prise en charge. En cas de diagnostic précoce, il est possible d’offrir des conseils préventifs et un soutien à la mère. Il peut être très difficile de s’occuper des enfants touchés par l’alcool, et il existe un risque de mauvais traitements. Il est également important d’éviter que le nourrisson continue à être exposé à l’alcool par l’al-laitement (50). Des programmes d’évaluation et d’intervention précoces devraient être mobilisés rapidement pour que des projets soient mis en place relativement aux futurs besoins d’éducation de l’enfant. Des données indiquent qu’une intervention précoce peut contribuer à prévenir et à réduire au minimum les effets du SAF ou du SAF atypique sur le comportement.
Le dépistage du nouveau-né à risque
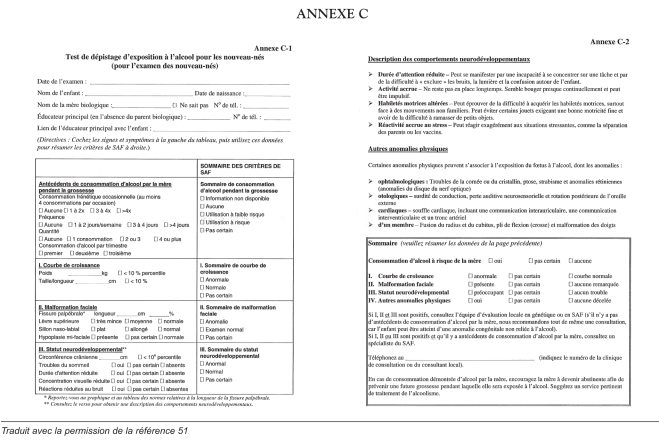
L’annexe C représente une grille utile pour aider le praticien de premier recours à repérer le nouveau-né à risque de SAF (51). La présomption de SAF se fonde sur les signes physiques, le retard de croissance, surtout de la tête (4,20), les traits caractéristiques du visage (1,2,52) et des signes de dysfonction du système nerveux central. Les nouveau-nés atteints sont difficiles à alimenter et ont tendance à dormir mal, à être irritables, à être hypersensibles au toucher, à la lumière et au bruit et à éprouver de la difficulté à établir des routines.
La prise en charge précoce :
Les nourrissons à risque repérés devraient être orientés sans délai vers des programmes d’intervention de la petite enfance, afin de prévenir l’apparition éventuelle de comportements dommageables et de traiter les troubles du développement. La mère devrait recevoir de l’appui et de l’aide pour s’occuper d’un nourrisson difficile. Souvent, la mère souffre ellemême de SAF et peut éprouver de la difficulté à affronter un enfant difficile.
Le dépistage de la possibilité de SAF chez le tout-petit ou l’enfant d’âge préscolaire
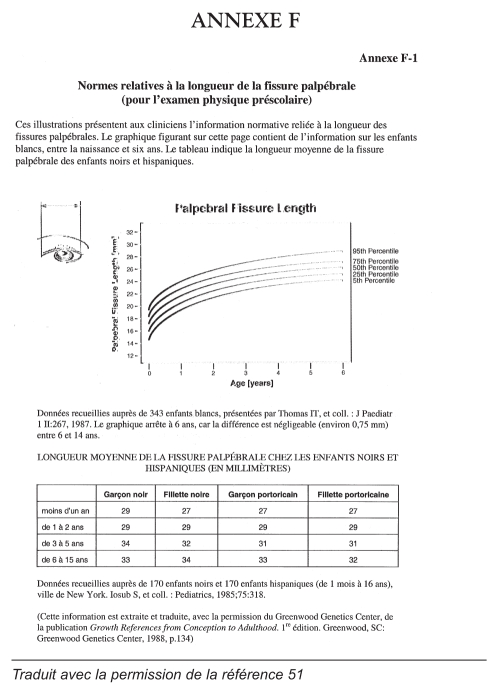
L’enfant à risque plus âgé présente souvent des signes plus manifestes et plus précis que le nouveau-né : retard de développement, et surtout du langage, retard de croissance et anomalies comportementales. Les manifestations comportementales caractéristiques du SAF, comme l’hyperactivité, un manque de jugement, l’incapacité d’apprécier les conséquences de ses gestes, une attitude démesurément amicale, des troubles du séquencement, une mauvaise mémoire à court terme et des troubles d’apprentissage, peuvent devenir apparents pendant cette phase. Le dépistage de l’enfant de 18 à 24 mois (annexe D) et de l’enfant de quatre à cinq ans (annexe E) peut aider le pédiatre, le médecin ou l’infirmière-hygiéniste à diagnostiquer et à prendre en charge le SAF (51). L’annexe F procure des normes pour mesurer la fissure palpébrale. Aucune norme n’a été établie pour les autochtones canadiens.
La prise en charge précoce :
Si des troubles de comportement, physiques ou d’apprentissage types du SAF sont repérés, l’enfant devrait non seulement être envoyé en consultation afin de subir une bilan diagnostique plus approfondi par une équipe de SAF, mais également pour l’aider à gérer ses comportements. Cependant, il importe d’entreprendre l’intervention même en l’absence d’un diagnostic définitif.
Le dépistage du SAF chez l’enfant d’âge scolaire
L’enfant d’âge scolaire, s’il n’a pas encore été dépisté, sera généralement envoyé en consultation pour subir un bilan diagnostique en raison de troubles d’apprentissage (surtout en ce qui a trait à la lecture et aux mathématiques) ou d’anomalies du comportement. Le spectre entier d’anomalies du comportement (tableaux 1 et 2) peut être évident, ainsi que les manifestation comportementales secondaires, généralement négatives. Cet enfant devrait subir un bilan complet, qui exige la collaboration de l’enseignant, des parents, du psychologue scolaire et du médecin.
Un diagnostic définitif
Il est difficile de poser un diagnostic définitif de SAF parce qu’il n’existe aucun marqueur biochimique et que les manifestations de cette pathologie sont très variables. Le diagnostic dépend du dépistage d’un spectre de caractéristiques cliniques statiques, non imputables à des facteurs postnatals. La participation d’une équipe de médecins et de psychologues expérimentés peut être nécessaire pour effectuer l’examen physique détaillé, l’évaluation développementale et les tests cognitifs, de même que pour administrer les questionnaires aux parents et aux enseignants sur le comportement scolaire en vue de parvenir à la précision nécessaire au diagnostic.
Le code diagnostique à quatre chiffres (4) représente une méthode objective, uniforme, précise et reproductible de diagnostic du SAF. Quatre critères sont évalués, quantifiés et associés à une note de 1 à 4 par critère, selon l’importance de l’anormalité :
anomalies de croissance,
anomalies faciales (52),
anomalies de la fonction cérébrale,
degré de consommation d’alcool par la mère.
Des critères précis d’évaluation de la consommation d’alcool par la mère, des caractéristiques de croissance et des traits du visage sont fournis avec le guide diagnostique (4). Bien que la dysfonction cérébrale représente la principale incapacité provoquée par l’exposition prénatale à l’alcool, c’est également la plus difficile à évaluer parce qu’elle comporte des paramètres, comme le QI, la cognition et les anomalies neurologiques et comportementales, qui varient énormément d’une personne à l’autre. La dysfonction est évaluée sur une échelle de 1 à 4, selon la gravité.
Une note de 4 (dysfonction cérébrale manifeste) définit une encéphalopathie statique et dépend des observations précises de dommages cérébraux (microcéphalie, anomalies de l’imagerie cérébrale, observations neurologiques persistantes d’origine prénatale ou QI de 60 ou moins).
À l’autre extrémité de l’échelle, une note de 1 (absence) est attribuée lorsque aucun trouble cérébral n’est démontré.
Une note de 3 (dysfonction cérébrale probable), également caractérisée par une encéphalopathie statique, se fonde sur des anomalies dans trois des quatre secteurs de la fonction cérébrale influant sur la cognition, les succès, l’adaptation, les signes neurologiques « flous » et le langage.
Une note de 2 (dysfonction cérébrale possible), ou trouble neurocomportemental, dépend d’observations personnelles et d’une anamnèse au sujet du comportement, laissant supposer la présence de dommages cérébraux.
La définition de ces anomalies peut dépendre d’observations prolongées, de listes de vérification et de tests. L’échelle de comportement de l’alcoolisme foetal, précise et facile à administrer, a été élaborée et normalisée par Streissguth et coll. (43), et peut être utile pour quantifier les comportements. Elle se fonde sur de simples réponses oui ou non à 36 affirmations, et les résultats sont valables quel que soit l’âge, la race, le sexe ou le QI de l’individu.
Dans le tableau 3 figurent plusieurs tests qui peuvent également contribuer à quantifier les comportements et les anomalies cognitives et neurodéveloppementales, mais ils peuvent nécessiter les services d’un psychologue (42,43,53,54).
TABLEAU 3.
Tests disponibles pour délimiter les troubles neurodéveloppementaux
| Les tests pour mesurer l’intelligence peuvent inclure : |
| Échelles Bayley du développement moteur et intellectuel du nourrisson (Bayley) donnant lieu à un indice de développement intellectuel |
| Stanford Binet – Quotient intellectuel (QI) |
Échelles de Wechsler – QI
|
| Les tests pour mesurer l’attention et l’hyperactivité incluent : |
| Test d’annulation de Taland Letter |
| Test de mémoire de chiffres WISC-R |
| Test de classification catégorielle de carte de Wisconsin (WCST) (indique un glissement de l’attention) |
| Échelle ADD-H d’évaluation complète de l’enseignant (ACTeRS) (54) |
| Les tests de l’apprentissage et de la mémoire incluent : |
| Échelle de Brazelton : Difficulté à s’habituer aux stimuli (42) |
| Examen pédiatrique élémentaire précoce (PEEX) (60) |
| Examen pédiatrique de l’état de préparation éducative (PEER) (61) |
| Brigance (53, 62) |
| Les tests du langage incluent : |
| Test de dépistage développemental de Denver (DDST) |
| Test de mémoire des mots |
| Nomenclature |
| Compréhension des mots |
| Maîtrise de la lecture de Woodstock |
| Les tests d’aptitudes motrices incluent : |
| DDST |
| WISC-R |
| PEEX (60) |
| PEER (61) |
| Les tests d’aptitudes sociales et de comportement incluent : |
| Échelles de comportement adaptatif de Vineland (VABS) (31) |
| Échelle de comportement à l’alcoolisme foetal (FABS) (43) |
| Échelle de SAF et de SAF atypique (10) |
| ACTeRS (54) |
| Les tests de troubles visuels et spatiaux incluent : |
| Test de développement de Beery sur l’intégration de la motricité visuelle |
| Test de développement de Frostig sur la perception visuelle |
| PEEX (60) |
| PERR (61) |
Les notes obtenues dans les quatre catégories sont ensuite insérées dans un code diagnostique à quatre chiffres. Les codes varient de 1111 (normal) à 4444 (SAF indubitable) (4). Le regroupement donne lieu à des combinaisons de 22 codes, qui donnent toutes des possibilités diagnostiques différentes. Seules trois possibilités désignent le SAF (SAF-exposition à l’alcool, SAF-exposition à l’alcool inconnue, et SAF atypique-exposition à l’alcool). Ce système comporte les avantages de la précision et de la reproductibilité, de l’uniformité du diagnostic et de l’ouverture sur d’autres diagnostics possibles. Les désavantages incluent la possibilité de faux négatifs. Par exemple, si des antécédents manifestes d’exposition à l’alcool et de comportements propres au SAF sont observés (tableau 2), mais que le retard de croissance et que les traits du visage caractéristiques du SAF sont absents, les notes en résultant (1134 ou 1143) correspondraient à une encéphalopathie statique et non à un SAF, même si l’exposition du foetus à l’alcool en est la cause probable. Cette différence d’étiquetage peut être importante parce que le financement des services d’intervention peut dépendre d’un diagnostic établi de SAF.
L’utilisation de l’échelle diagnostique à quatre chiffres est recommandée pour poser un diagnostic de SAF. Cette échelle est relativement simple et directe et peut être utilisée par un médecin bien formé à l’aide d’un nombre minimal de tests perfectionnés. Des tests exécutés par un psychologue peuvent contribuer à mieux définir les incapacités et à planifier l’intervention.
L’INTERVENTION
L’intervention devrait dépendre des besoins et ne devrait pas être reportée en raison de longues listes d’attente ou d’un délai pour accéder aux services diagnostiques définitifs. Les conséquences d’un délai de traitement peuvent être graves pour les enfants atteints du SAF. Les enfants atteints de ce syndrome qui affichent une attitude démesurément amicale peuvent risquer des mauvais traitements, et ceux qui sont incapables de comprendre les conséquences de leurs gestes peuvent avoir des démêlés avec la justice. En fait, un pourcentage élevé de jeunes intégrés au système judiciaire criminel ont été dépistés comme atteints de SAF ou de SAF atypique (55). À cette étape, un délai à affronter les troubles comportementaux et cognitifs peut également provoquer des incapacités secondaires (56) et des problèmes comme des échecs scolaires, une perte de l’estime de soi, une frustration et un passage à l’acte. Bien que les anomalies reliées au SAF soient permanentes et durent toute la vie, certaines peuvent être modifiées grâce à une intervention précoce. En effet, la documentation sur le SAF fourmille de comptes rendus de réussites associées à une intervention précoce.
Si le dépistage néonatal ou du nourrisson permet de déceler des anomalies comportementales ou neurodéveloppementales, le traitement devrait être entrepris au plus tôt. Les dispensateurs de soins ne devraient pas attendre un diagnostic plus définitif, mais commencer à travailler sur les comportements interpersonnels et sur l’apprentissage de l’enfant de manière à promouvoir la confiance en soi et l’estime de soi. Ce type de traitement signifie qu’il faut repérer les points forts de l’enfant et y prendre appui.
Il est important d’envoyer l’enfant en consultation pour obtenir un diagnostic plus précis et établir l’étiologie. Comme les enfants atteints du SAF ou du SAF atypique ne présentent pas tous le même spectre d’anomalies, le dépistage permet de planifier un programme d’intervention mieux adapté à l’enfant.
Il est très difficile de s’occuper des nourrissons atteints du SAF ou du SAF atypique et, pour cette raison, ces enfants risquent d’être maltraités par les personnes qui s’occupent d’eux. Ces personnes doivent recevoir de l’information sur les réactions du nourrisson et être orientées quant aux moyens d’affronter ces comportements. Elles peuvent avoir besoin de services de répit.
Les parents et les éducateurs peuvent apprendre à comprendre les indices donnés par le bébé. Les nourrissons devraient être tenus et flattés doucement, câlinés fréquemment et profiter de contacts oculaires fréquents ainsi que de mots tendres et apaisants. Il faut éviter les mouvements soudains et les tressautements. Les nourrissons et les enfants atteints du SAF ou du SAF atypique éprouvent de la difficulté avec les transitions. Il est donc important d’établir une routine stricte.
Les objectifs à long terme de l’intervention et de l’éducation pendant la première enfance comprennent :
l’établissement et le maintien d’un sentiment de confiance en soi,
l’établissement d’un comportement interpersonnel acceptable,
la promotion de l’indépendance,
l’apprentissage à prendre des décisions acceptables.
Dans le cadre d’un programme d’intervention de la première enfance, ces enfants peuvent apprendre à fonctionner selon leurs limites, à faire des choix convenables, à développer des aptitudes interpersonnelles acceptables, à maîtriser la dynamique fondamentale de la vie et, par-dessus tout, à maintenir leur estime de soi. Ce type d’intervention signifie souvent de diminuer les attentes scolaires et d’accentuer la formation visant à assurer l’autosuffisance plus tard. La programmation pour le succès peut améliorer l’apprentissage et l’image de soi, ce qui, à son tour, peut réduire les comportements de passages à l’acte.
À mesure que les enfants grandissent, leurs comportements difficiles peuvent être reliés à une mémoire à court terme limitée, à des troubles du séquencement, à des difficultés à faire des choix et à un manque d’appréciation des conséquences de leurs gestes. Par conséquent, ils éprouvent de la difficulté à se souvenir de routines ou de directives simples. Il est important de maintenir les tâches simples, de donner des exemples concrets et de transmettre une directive à la fois. Les enfants peuvent avoir de la difficulté à reconnaître des situations dangereuses ou à y réagir et peuvent donc avoir besoin d’être protégés en tout temps. Les consignes doivent être simples et constantes, et les explications doivent être données calmement. Les accès de colère peuvent constituer des tentatives de communiquer. Il faut y réagir en imposant de courtes périodes de réflexion aux enfants atteints. Il faut apprendre aux enfants atteints du SAF ou du SAF atypique à utiliser des moyens efficaces pour faire connaître leurs désirs.
Les stratégies pour faire face à des comportements difficiles incluent :
maintenir les tâches simples,
utiliser des exemples concrets,
maintenir les directives simples et les transmettre une à la fois,
se concentrer sur la dynamique de vie.
Les stratégies plus précises dépendent des troubles découverts. Hinde (61) a souligné des méthodes face à des comportements précis chez l’enfant de un à trois ans atteint du SAF ou du SAF atypique.
Une communication et une collaboration étroites s’imposent entre les parents et les professionnels. Les parents devraient apprendre à analyser la tâche en repérant le résultat souhaité, puis en divisant la tâche en petites étapes. Il est possible de mettre au point des mesures précises pour contribuer à modifier les troubles d’attention et d’hyperactivité. Le fait d’apprendre à l’enfant à distinguer entre la famille et les amis et les étrangers peut enrayer le problème de l’attitude démesurément amicale. Le mauvais séquencement peut être abordé par la mise au point de routines et par l’utilisation d’images pour les renforcer. On vise ainsi à aider les enfants à acquérir des aptitudes qui le guideront vers une vie autonome.
Des stratégies similaires peuvent s’appliquer aux enfants d’âge préscolaire et d’âge scolaire (59). Les enseignants ont besoin d’apprendre des techniques efficaces et de travailler en collaboration avec les parents et les psychologues scolaires.
Il est important de former des spécialistes capables de s’occuper des anomalies comportementales dans le cadre de programmes d’intervention de la première enfance. Les interventions effectuées par des spécialistes communautaires qui travaillent directement avec les parents ou les parents d’accueil devraient tenir compte de la famille et de la collectivité. Puisque les spécialistes de l’éducation de la petite enfance se font rares, leurs services pourraient être complétés par ceux de bénévoles bien formés qui pourraient faire des visites à domicile et offrir un soutien familial. La formation pourrait être donnée dans la collectivité, selon le modèle de la formation des bénévoles des lignes d’écoute téléphonique.
Dans la mesure du possible, les enfants atteints devraient demeurer avec leur famille biologique. Des cours sur l’art d’être parent devraient être offerts, et les parents devraient être incités à y participer. Cependant, si la mère est atteinte de SAF, si elle est incapable de faire face à la situation ou si la situation familiale menace le bien-être de l’enfant, un placement en famille d’accueil peut s’imposer. Les familles d’accueil devraient posséder une formation précise ou avoir l’expérience des enfants souffrant du SAF. Le taux de frustration est souvent très élevé, et les personnes qui s’occupent de tels enfants ont besoin de répit. Il faut éviter le passage dans de multiples foyers d’accueil, qui nuit au lien affectif et à l’estime de soi de l’enfant. Certaines personnes atteintes du SAF peuvent être incapables de développer les aptitudes nécessaires pour mener une vie indépendante et devoir, à long terme, être placées dans des foyers collectifs.
Des recherches constantes sont souhaitables pour vérifier si les mesures prises sont efficaces; elles devraient se fonder sur des critères. L’utilisation du code diagnostique à quatre chiffres assure l’uniformité des critères diagnostiques. Elle permet également de comparer la prévalence, les issues et l’efficacité des mesures préventives et d’intervention.
LE FINANCEMENT
Les enfants canadiens n’ont pas tous un accès équivalent aux services diagnostiques et d’intervention. Par exemple, les Indiens inscrits du nord de la Saskatchewan sont couverts, tandis que les Métis ne le sont pas, même s’ils affichent la même fourchette de problèmes. L’ensemble de la formation de spécialistes de l’éducation en petite enfance, de psychologues scolaires, d’ergothérapeutes et de physiothérapeutes devrait également être couvert.
Le financement ne devrait pas dépendre d’un diagnostic officiel de SAF. En raison des listes d’attente et de l’absence de diagnostic définitif, on rate souvent la « lucarne de possibilités » permettant d’affronter les anomalies comportementales et de prévenir les incapacités secondaires. Pour l’instant, seuls les enfants étiquetés comme « handicapés » ont droit au financement. Le SAF et les troubles développementaux et physiques connexes devraient être perçus comme des invalidités admissibles à une aide financière.
Le financement du SAF doit être global, chaque territoire contribuant à une « cagnotte » dont tous les enfants peuvent profiter. Pour ce faire, il faudrait une collaboration sans précédent entre le gouvernement fédéral, les gouvernements provinciaux, les services sociaux, les bandes autochtones et les ministères de l’éducation.
LES RECOMMANDATIONS
La Société canadienne de pédiatrie recommande que les mesures suivantes soient adoptées pour prévenir, diagnostiquer et prendre en charge le SAF.
La prévention primaire du SAF devrait inclure des programmes d’éducation en milieu scolaire, un dépistage précoce, le traitement des femmes à risque et des programmes respectueux de la culture parrainés par la communauté. Les dispensateurs de soins devraient demander aux femmes quelles sont leurs habitudes de consommation d’alcool, qu’elles soient enceintes ou non.
Les dispensateurs de soins jouent un rôle important pour repérer les bébés ou les enfants atteints du SAF. Ils devraient connaître les outils de dépistage disponibles pour diagnostiquer ce trouble chez des enfants d’âges variés.
Si des anomalies comportementales ou physiques sont repérées qui étayent le SAF, l’intervention devrait commencer sans délai, même avant qu’un diagnostic définitif soit posé.
Les programmes d’intervention devraient faire participer la famille et la collectivité de l’enfant.
Le diagnostic et les services de traitement du SAF exigent une démarche multidisciplinaire, avec la participation de médecins, de psychologues, d’éducateurs de la petite enfance, d’enseignants, de professionnels des services sociaux, de thérapeutes familiaux, d’infirmières et de cercles d’entraide communautaire.
Les services de diagnostic et de traitement devraient être subventionnés par l’État et offerts à tous les Canadiens, quel que soit leur ethnie, leur statut (p. ex., autochtones inscrits ou non inscrits), leur lieu de résidence et leurs revenus.
Les interventions devraient continuer à être évaluées d’après leur efficacité.
Pour s’assurer que tous les enfants ont accès à des services et à un soutien convenables, la collaboration s’impose à divers échelons et entre divers secteurs : le gouvernement fédéral, les ministères de la Santé provinciaux, les services sociaux, le milieu de l’éducation et les groupes communautaires locaux.
Les particuliers et les groupes qui offrent des services de diagnostic et de traitement devraient adopter une méthode globale respectueuse de la culture.
ANNEXE A
ANNEXE B
ANNEXE C
ANNEXE D
ANNEXE E
ANNEXE F
Footnotes
COMITÉ DE SANTÉ DES INDIENS ET INUITS
Membres : Docteurs Garth Bruce (administrateur responsable), Royal University Hospital, Saskatoon (Saskatchewan); Jim Carson (président), université du Manitoba, Winnipeg (Manitoba); James Irvine, La Ronge (Saskatchewan); Keith Menard, clinique médicale Stanton, Yellowknife (Territoires du Nord-Ouest); Kent Saylor, Kahnawake (Québec); Leigh Wincott, Thompson General Hospital, Thompson (Manitoba)
Conseillers : Docteur Fred Baker, Calgary (Alberta); monsieur Keith Conn, Direction générale de la santé des Premières nations et des Inuits, Services de la santé, Santé Canada, Ottawa (Ontario); docteurs John Godel, Heriot Bay (Colombie-Britannique); Michael Moffatt, Winnipeg Children’s Hospital, Winnipeg (Manitoba); Gary Pekeles, Hôpital de Montréal pour enfants, Montréal (Québec)
Représentants : Mesdames Claudette Dumont-Smith, Ottawa (Ontario) (Association des infirmières et infirmiers autochtones du Canada); Reepa Evic-Carleton, Ottawa (Ontario) (Inuit Women’s Association); Melanie Morningstar, Ottawa (Ontario) (Assemblée des Premières nations); Margaret Horn, Kahnawake (Québec) (Organisation nationale des représentants indiens et inuit en santé communautaire); docteurs David Grossman, Harborview Injury Prevention and Research Center, université de Washington, Seattle (Washington), É.-U. (comité de la santé des enfants autocthones américains, American Academy of Pediatrics); Vincent Tookenay, Ottawa (Ontario) (Association des médecins autochtones du Canada)
Auteur principal : Docteur John Godel, Heriot Bay (Colombie-Britannique)
Les recommandations du présent énoncé ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes.
Les adresses dans Internet sont à jour au moment de la publication.
RÉFÉRENCES
- 1.Jones KL, Smith DW. Recognition of the fetal alcohol syndrome in early pregnancy. Lancet. 1973;ii:999–1001. doi: 10.1016/s0140-6736(73)91092-1. [DOI] [PubMed] [Google Scholar]
- 2.Stratton K, Howe C, Battaglia FC, editors. Fetal Alcohol Syndrome: Diagnosis, Epidemiology, Prevention and Treatment. Washington: National Academy Press; 1996. [Google Scholar]
- 3.Abel EL. What really causes FAS? Teratology. 1999;59:4–6. doi: 10.1002/(SICI)1096-9926(199901)59:1<4::AID-TERA3>3.0.CO;2-C. [DOI] [PubMed] [Google Scholar]
- 4.Astley SJ, Clarren SK.Diagnostic Guide for Fetal Alcohol Syndrome and Related Conditions: The 4-Digit Diagnostic Code Seattle: University of Washington, FAS Diagnostic and Prevention Network; 1999. <http://depts.washington.edu/fasdpn> (version à jour au 12 février 2002). [Google Scholar]
- 5.Abel EL. An update on Incidence of FAS: FAS is not an equal opportunity birth defect. Neurotoxicol Teratol. 1995;17:437–43. doi: 10.1016/0892-0362(95)00005-c. [DOI] [PubMed] [Google Scholar]
- 6.Sampson PD, Streissguth AP, Bookstein FL, et al. Incidence of fetal alcohol syndrome and prevalence of alcohol-related neurodevelopmental disorder. Teratology. 1997;56:317–26. doi: 10.1002/(SICI)1096-9926(199711)56:5<317::AID-TERA5>3.0.CO;2-U. [DOI] [PubMed] [Google Scholar]
- 7.Aase JM. The fetal alcohol syndrome in American Indians: A high risk group. Neurobehav Toxicol Teratol. 1981;3:153–6. [PubMed] [Google Scholar]
- 8.Carney LJ, Chermak GD. Performance of American Indian children with fetal alcohol syndrome on the test of language development. J Commun Disord. 1991;24:123–34. doi: 10.1016/0021-9924(91)90016-c. [DOI] [PubMed] [Google Scholar]
- 9.Asante KO, Nelms-Matzke J. Report on the survey of children with chronic handicaps and fetal alcohol syndrome in the Yukon and Northwest British Columbia. Terrance: Mills Memorial Hospital; 1985. [Google Scholar]
- 10.Godel JC, Lee BE, McCallum DE, et al. Exposure to alcohol in utero: Influence on cognitive function and learning in a northern elementary population. Paediatr Child Health. 2000;5:93–100. doi: 10.1093/pch/5.2.93. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Robinson GC, Conry JL, Conry RF. Clinical profile and prevalence of fetal alcohol syndrome in an isolated community in British Columbia. CMAJ. 1987;137:203–7. [PMC free article] [PubMed] [Google Scholar]
- 12.MacDonald . A Report to Communications and Education Branch BC Ministry of Health and Minister Responsible for Seniors. Vancouver: Ministry of Health; 1991. [Google Scholar]
- 13.BC Vital Statistics Annual Report. Victoria: Crown Publishers; 1998. [Google Scholar]
- 14.Williams RJ, Odaibo FS, McGee JM. Incidence of fetal alcohol syndrome in northeastern Manitoba. Can J Public Health. 1999;90:192–4. doi: 10.1007/BF03404505. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Stoler JM, Holmes LB. Under-recognition of prenatal alcohol effects in infants of known alcohol abusing women. J Pediatr. 1999;135:430–6. doi: 10.1016/s0022-3476(99)70164-2. [DOI] [PubMed] [Google Scholar]
- 16.Roebuck TM, Mattson SN, Riley EP. A review of the neuroanatomical findings in children with Fetal Alcohol Syndrome or prenatal exposure to alcohol. Alcohol Clin Exp Res. 1998;22:339–44. doi: 10.1111/j.1530-0277.1998.tb03658.x. [DOI] [PubMed] [Google Scholar]
- 17.Jacobson JL, Jacobson SW, Sokol RJ, Ager JW., Jr Relationship of maternal age and pattern of drinking to functionally significant cognitive deficit in infancy. Alcohol Clin Exp Res. 1998;22:345–51. doi: 10.1111/j.1530-0277.1998.tb03659.x. [DOI] [PubMed] [Google Scholar]
- 18.Stoler JM, Huntington KS, Peterson CM, et al. The prenatal detection of significant alcohol exposure with maternal blood markers. J Pediatr. 1998;133:346–52. doi: 10.1016/s0022-3476(98)70267-7. [DOI] [PubMed] [Google Scholar]
- 19.Russell M, Skinner JB. Early measures of maternal alcohol misuse as predictors of adverse pregnancy outcomes. Alcohol Clin Exp Res. 1988;12:824–30. doi: 10.1111/j.1530-0277.1988.tb01354.x. [DOI] [PubMed] [Google Scholar]
- 20.Godel JC, Pabst HF, Hodges PE, Johnson KE, Froese GJ, Joffres MR. Smoking and caffeine and alcohol intake during pregnancy in a northern population: Effect on fetal growth. CMAJ. 1992;147:181–8. [PMC free article] [PubMed] [Google Scholar]
- 21.Walpole I, Zubrick S, Ponte J, Lawrence C. Low to moderate maternal alcohol use before and during pregnancy, and neurobehavioural outcome in the newborn Infant. Dev Med Child Neurol. 1991;33:875–83. doi: 10.1111/j.1469-8749.1991.tb14796.x. [DOI] [PubMed] [Google Scholar]
- 22.Coles CD, Smith I, Fernhoff PM, Falek A. Neonatal neurobehavioural characteristics as correlates of maternal alcohol use during gestation. Alcohol Clin Exp Res. 1985;9:454–60. doi: 10.1111/j.1530-0277.1985.tb05582.x. [DOI] [PubMed] [Google Scholar]
- 23.Roebuck TM, Simmons RW, Richardson C, Mattson SN, Riley EP. Neuromuscular responses to disturbances of balance in children with prenatal exposure to alcohol. Alcohol Clin Exp Res. 1998;22:1992–7. [PubMed] [Google Scholar]
- 24.Olson HC, Feldman JJ, Streissguth AP, Sampson PD, Bookstein FL. Neuropsychologic deficits in adolescents with fetal alcohol syndrome: Clinical findings. Alcohol Clin Exp Res. 1998;22:1998–2012. [PubMed] [Google Scholar]
- 25.Church MW, Kaltenbach JA. Hearing, speech, language, and vestibular disorders and the fetal alcohol syndrome. Alcohol Clin Exp Res. 1997;21:495–512. doi: 10.1111/j.1530-0277.1997.tb03796.x. [DOI] [PubMed] [Google Scholar]
- 26.Hellstrom A, Chen Y, Stromland K. Fundus morphology assessed by digital image analysis in children with fetal alcohol syndrome. J Pediatr Ophthalmol Strabismus. 1997;34:17–24. doi: 10.3928/0191-3913-19970101-05. [DOI] [PubMed] [Google Scholar]
- 27.Roebuck TM, Simmons RW, Mattson SN, Riley EP. Prenatal exposure to alcohol affects the ability to maintain postural balance. Alcohol Clin Exp Res. 1998;22:252–8. [PubMed] [Google Scholar]
- 28.Nagahara AH, Handa RJ. Fetal alcohol exposure produces delaydependent memory deficits in juvenile and adult rats. Alcohol Clin Exp Res. 1997;21:710–5. [PubMed] [Google Scholar]
- 29.Kerns KA, Don A, Mateer CA, Streissguth AP. Cognitive defects in nonretarded adults with fetal alcohol syndrome. J Learn Disabil. 1997;30:685–93. doi: 10.1177/002221949703000612. [DOI] [PubMed] [Google Scholar]
- 30.Uecker A, Nadel L. Spatial but not object memory impairments in children with fetal alcohol syndrome. J Am Mental Retard. 1998;103:12–8. doi: 10.1352/0895-8017(1998)103<0012:SBNOMI>2.0.CO;2. [DOI] [PubMed] [Google Scholar]
- 31.Conry J. Neuropsychological deficits in fetal alcohol syndrome and fetal alcohol effects. Alcohol Clin Exp Res. 1990;14:650–5. doi: 10.1111/j.1530-0277.1990.tb01222.x. [DOI] [PubMed] [Google Scholar]
- 32.Becker M, Warr-Leeper GA, Leeper HA. Fetal alcohol syndrome: A description of oral motor, articulatory, short-term memory, grammatical, and semantic abilities. J Commun Disord. 1990;23:97–124. doi: 10.1016/0021-9924(90)90016-r. [DOI] [PubMed] [Google Scholar]
- 33.Nanson JL, Hiscock M. Attention deficits in children exposed to alcohol prenatally. Alcohol Clin Exp Res. 1990;14:656–61. doi: 10.1111/j.1530-0277.1990.tb01223.x. [DOI] [PubMed] [Google Scholar]
- 34.Thomas SE, Kelly SJ, Mattson SN, Riley EP. Comparison of social abilities of children with fetal alcohol syndrome to those of children with similar IQ scores and normal controls. Alcohol Clin Exp Res. 1998;22:528–33. [PubMed] [Google Scholar]
- 35.Kopera-Frye K, Dehaene S, Streissguth AP. Impairments of number processing induced by fetal alcohol exposure. Neuropsychologia. 1996;34:1187–96. doi: 10.1016/0028-3932(96)00043-7. [DOI] [PubMed] [Google Scholar]
- 36.Church MW, Eldis F, Blakley BW, Bawle EV. Hearing, language speech, vestibular, and dentofacial disorders in fetal alcohol syndrome. Alcohol Clin Exp Res. 1997;21:227–37. [PubMed] [Google Scholar]
- 37.Greene T, Ernhart CB, Martler S, Sokol R, Ager J. Prenatal alcohol exposure and language development. Alcohol Clin Exp Res. 1990;14:937–45. doi: 10.1111/j.1530-0277.1990.tb01842.x. [DOI] [PubMed] [Google Scholar]
- 38.Russell M, Czarnecki DM, Cowan R, MePherson E, Mudar PJ. Measures of maternal alcohol use as predictors of development in early childhood. Alcohol Clin Exp Res. 1991;14:991–1000. doi: 10.1111/j.1530-0277.1991.tb05200.x. [DOI] [PubMed] [Google Scholar]
- 39.Larroque B, Kaminski M. Prenatal alcohol exposure and development at preschool age. Alcohol Clin Exp Res. 1998;22:295–30. doi: 10.1111/j.1530-0277.1998.tb03652.x. [DOI] [PubMed] [Google Scholar]
- 40.Streissguth AP, Barr HM, Sampson PD. Moderate prenatal alcohol exposure: Effects on child IQ and learning problems at age 7 1/2 years. Alcohol Clin Exp Res. 1990;14:662–9. doi: 10.1111/j.1530-0277.1990.tb01224.x. [DOI] [PubMed] [Google Scholar]
- 41.Ladue RA, Streissguth AP, Randels SP. Clinical considerations pertaining to adolescents and adults with fetal alcohol syndrome. In: Sonderegger TB, editor. Perinatal Substance Abuse: Research Findings and Clinical Implications. Baltimore: The Johns Hopkins University Press; 1993. pp. 104–31. [Google Scholar]
- 42.Streissguth AP, Barr HM, Martin DC. Maternal alcohol use and neonatal habituation assessed with the Brazelton Scale. Child Dev. 1983;54:1109–18. [PubMed] [Google Scholar]
- 43.Streissguth AP, Bookstein HM, Barr HM, Sherman P. A fetal alcohol behaviour scale. Alcohol Clin Exp Res. 1998;22:325–33. doi: 10.1111/j.1530-0277.1998.tb03656.x. [DOI] [PubMed] [Google Scholar]
- 44.Olson HC, Burgess DM, Streissguth AP. Vol. 13. Arlington: ZERO TO THREE/National Center for Clinical Infant Programs; 1992. Fetal alcohol syndrome (FAS) and fetal alcohol effects (ATYPICAL FAS): A life span view with implications for early Intervention; pp. 24–9. [Google Scholar]
- 45.Streissguth AP, Aasfe JM, Claren SK, Randels SP, LaDue RA, Smith DF. Fetal alcohol syndrome in adolescents and adults. JAMA. 1991;265:1961–7. [PubMed] [Google Scholar]
- 46.Burgess DM, Streissguth AP. Fetal alcohol syndrome and fetal alcohol effects: Principles for educators. Phi Delta Kappan. 1992;74:24–9. [Google Scholar]
- 47.Van Bibber M, editor. Aboriginal Nurses Association of Canada; 1997. It takes a community. A Resource Manual for Community-based Prevention of Fetal Alcohol Syndrome and Fetal Alcohol Effects; pp. 33–5. [Google Scholar]
- 48.Identification of At-Risk Drinking and Intervention with Women of Childbearing Age: A Guide for Primary Care Providers NIH Publication No. 99-4368 <www.niaaa.nih.gov/publications/FASguides.htm> (version à jour au 18 février 2002). [Google Scholar]
- 49.Alcohol and Child/Family Health conference proceedings. British Columbia: FAS Resource Society; 1988. [Google Scholar]
- 50.Ito S. Drug therapy for breastfeeding women. N Engl J Med. 2000;343:118. doi: 10.1056/NEJM200007133430208. [DOI] [PubMed] [Google Scholar]
- 51.Identification and Care of Fetal Alcohol Exposed Children: A Guide for Primary Care Providers, NIH Publication No. 99-4370 <www.niaaa.nih.gov/publications/FASguides.htm> (version à jour au 18 février 2002).
- 52.Stromland K, Chen Y, Norberg T, Wennerstrom K, Michael G. Reference values of facial features in Scandinavian children measured with a range-camera technique. Scand J Plast Reconstr Surg Hand Surg. 1999;33:59–65. doi: 10.1080/02844319950159631. [DOI] [PubMed] [Google Scholar]
- 53.Brigance AH. Comprehensive Inventory of Basic Skills. North Billerica: Curriculum Associates Inc; 1983. [Google Scholar]
- 54.Ullmann RK, Sleator EK, Sprague RL. ACTeRs. Champaign: MetriTech Inc; 1991. [Google Scholar]
- 55.Fast DK, Conry J, Loock CA. Identifying fetal alcohol syndrome among youth in the criminal justice system. J Dev Behav Pediatr. 1999;20:370–2. doi: 10.1097/00004703-199910000-00012. [DOI] [PubMed] [Google Scholar]
- 56.Streissguth AP, Barr HM, Kogan J, Bookstein FL. Understanding the occurrence of secondary disabilities in clients with Fetal Alcohol Syndrome (FAS) and Fetal Alcohol Effects Final report. Seattle: Fetal Alcohol and drug Unit; 1996. [Google Scholar]
- 57.Kleifeld J, Westcott S, editors. Fantastic Antone Succeeds. Fairbanks: University of Alaska Press; 1993. [Google Scholar]
- 58.Hinde J. Early intervention of alcohol affected children. In: Kleifeld J, Wescott S, editors. Fantastic Antone Succeeds. Fairbanks: University of Alaska Press; 1993. pp. 131–47. [Google Scholar]
- 59.Kvigne V, Struck J, Engelhart E, West T. Educational techniques for children with FAS/FAE FAS. In: Kleifeld J, Wetcott S, editors. Fantastic Antone Succeeds. Fairbanks: University of Alaska Press; 1993. pp. 323–39. [Google Scholar]
- 60.Levine MD. The Pediatric Early Elementary Examination (PEEX) Cambridge: Educators Publishing Service Inc; 1992. [Google Scholar]
- 61.Levine MD, Schneider EA. Pediatric Examination of Educational Readiness (PEER) Cambridge: Educators Publishing Service Inc; 1982. [Google Scholar]
- 62.Linkous LW. A reliability study of the Brigance CIBS; Annual Meeting of the Council for Exceptional Children; New Orleans. March 31 to April 4; 1986. [Google Scholar]