> Le conduit gastro-intestinal contient un grand nombre de micro-organismes résidants. Chez l’homme, ces bactéries dites commensales surpassent en nombre les cellules de l’organisme, et représentent plus de mille espèces. On sait depuis longtemps que l’anatomie, la physiologie et les fonctions normales de l’intestin dépendent de la présence et de l’activité des bactéries commensales. La colonisation par ce microbiote intestinal induit notamment la maturation du système immunitaire des muqueuses, et plus particulièrement le développement des structures lymphoïdes organisées, le recrutement des lymphocytes B et T dans la lamina propria et la sécrétion d’immu-noglobulines A (IgA) et de peptides anti-microbiens dans la lumière de l’intestin. Les agents commensaux fournissent une protection additionnelle en privant les pathogènes potentiels de nutriments et d’accès à la muqueuse. Cependant, la capacité des différentes espèces de bactéries intestinales à réguler individuellement les mécanismes immunitaires reste mal connue.
Propriétés des lymphocytes Th17
Les lymphocytes Th17 représentent un des sous-types majeurs des cellules T auxiliaires CD4+ [18, 19]. Ils produisent plusieurs cytokines pro- inflammatoires, dont l’IL(interleukine)-17, l’IL-21, l’IL-22 et l’IL-26 (cette dernière est absente chez les souris) et peuvent contribuer aux effets délétères qui caractérisent des maladies inflammatoires auto-immunes comme la sclérose en plaques, la polyarthrite rhumatoïde et les maladies inflammatoires de l’intestin [20]. En conditions normales, les cellules Th17 confèrent une protection contre les pathogènes extracellulaires, et agissent plus spécifiquement au niveau des surfaces mucosales. Le processus moléculaire de différenciation des cellules Th17 a été très étudié chez l’homme [1–3] et la souris [4, 5–10]. Le facteur de transcription RORγT est nécessaire et suffisant pour cette différenciation [11] et plusieurs autres facteurs de transcription contribuent au façonnage du phénotype Th17 [12]. De plus, ces cellules partagent certaines voies de développement et de différenciation avec les lymphocytes T auxiliaires régulateurs (Treg) qui expriment le facteur de transcription FoxP3 [13]. In vivo, en conditions normales, les cellules Th17 sont presque exclusivement localisées dans les tissus gastro-intestinaux comme la lamina propria de l’intestin grêle. Dans ce tissu, les cellules Th17 et Treg représentent plus de la moitié des lymphocytes T CD4+ et se trouvent à un état d’équilibre considéré comme déterminant pour la nature et l’intensité des réponses immunitaires mucosales.
Induction des cellules Th17 de l’intestin par un élément de la flore intestinale
Parce que les cellules Th17 sont principalement présentes dans la lamina propria de souris non immunisées, nous avons émis l’hypothèse que l’intestin contient des signaux uniques pour la différenciation de ces cellules. La présence du microbiote commensal est une des propriétés fondamentales de l’intestin et nous avons donc décidé d’examiner le rôle des bactéries intestinales dans cette localisation préférentielle des Th17. Nous avons tout d’abord examiné la distribution des cellules Th17 dans l’intestin au cours de l’ontogénie. Les cellules Th17 n’étaient pas présentes dans la lamina propria de l’intestin grêle de souriceaux nouveaunés et apparaissaient environ trois semaines après la naissance. Ce temps coïncide avec le sevrage des souriceaux, l’introduction dans leur alimentation de matière solide et la colonisation par le microbiote commensal de type adulte. Ainsi, l’apparition des cellules Th17 dans l’intestin est contemporaine de la colonisation de cet organe par des bactéries résidentes. De plus, ces cellules sont absentes de l’intestin des souris axéniques (germ-free) dépourvues de micro-organismes détectables. Cela n’est pas dû à un défaut de développement, car l’apparition des cellules Th17 peut être rapidement induite chez ces souris si l’on introduit dans leur intestin des bactéries provenant d’animaux élevés de manière conventionnelle. Nous avons également observé que les bactéries intestinales influaient de manière inverse sur le nombre de cellules Treg : elles sont en excès chez les souris axéniques et diminuent en réponse à la colonisation bactérienne. Ces expériences démontrent donc que les bactéries commensales sont nécessaires à la différenciation des cellules Th17 dans l’intestin et contrôlent la balance entre les cellules Th17 et les Treg.
Nous avons ensuite examiné la possibilité qu’un élément spécifique du microbiote puisse être responsable de l’induction des cellules Th17. Pour déterminer l’espèce en cause, nous avons testé une sélection d’antibiotiques et déterminé lesquels inhibaient cette induction des cellules Th17. Seuls certains antibiotiques, dont la vancomycine, avaient cette capacité, impliquant une sous-population de bactéries intestinales et non pas le microbiote intestinal dans son ensemble. Nous avons également examiné le nombre de Th17 chez des souris élevées dans différentes conditions et découvert que les souris C57BL/6 (B6) du Jackson Laboratory (Jackson) avaient un nombre faible de cellules Th17 dans l’intestin en comparaison de souris de la même lignée obtenues chez Taconic Farms (Taconic), bien qu’une flore intestinale soit présente dans les deux cas. Les cellules Th17 peuvent toutefois être induites chez les souris Jackson en réponse à l’introduction, par co-élevage ou gavage oral, de la flore présente chez les souris provenant de Taconic. De plus, les bactéries intestinales des souris de Taconic ont pour effet inverse de réduire le nombre de cellules Treg. Ces résultats constituent donc la première démonstration que certaines bactéries du microbiote, alors inconnues, modulent l’équilibre entre les populations de cellules T effectrices dans l’intestin [14].
Les bactéries filamenteuses segmentées induisent les lymphocytes Th17
Afin d’identifier les éléments du microbiote spécifiquement responsables de l’induction des cellules Th17, nous avons comparé la composition en bactéries de l’iléon terminal des souris B6 Jackson et Taconic en utilisant la détection des rRNA16S par la technique de Phylochip. Nous avons observé que les deux taxons de bactéries les plus enrichis dans le microbiote des souris Taconic et indétectables chez les souris Jackson correspondaient aux séquences de Lactobacillus murinus et Candidatus arthromitus. Nous avons écarté Lactobacillus murinus, car la colonisation des souris Jackson par la flore altérée dite de Schaedler, une flore standardisée qui contient notamment Lacto-bacillus murinus, n’avait aucun effet sur la différenciation des cellules Th17. Candidatus arthromitus est le nom d’un genre de bactéries filamenteuses segmentées (BFS) groupées dans la classification phylogénétique avec la famille des Clostridiaceae. Les BFS sont gram positives, anaérobiques, forment des spores et sont connues pour résider spécifiquement dans l’iléon terminal de nombreuses espèces où elles adhèrent fermement aux cellules épithéliales. On sait également que les BFS colonisent l’intestin au moment du sevrage et ont des fonctions immunomodulatrices, parmi lesquelles le recrutement des lymphocytes intra-épithéliaux et la sécrétion d’IgA.
Nous avons confirmé la présence de BFS dans les souris Taconic par l’analyse de la séquence d’ADN codant pour l’ARN 16S et par microscopie électronique (Figure 1). Chez les souris Jackson, l’ADN des BFS n’est pas détectable (Tableau I). Le transfert du microbiote des souris Taconic aux souris Jackson entraîne la colonisation de ces dernières par les BFS et l’induction des cellules Th17. De même, des cellules Th17 sont détectées chez des souris axéniques lorsque celles-ci sont colonisées avec les seules BFS, et l’introduction d’homogénats fécaux de souris colonisées uniquement par les BFS dans des souris Jackson provoque l’induction de cellules Th17.
Figure 1.
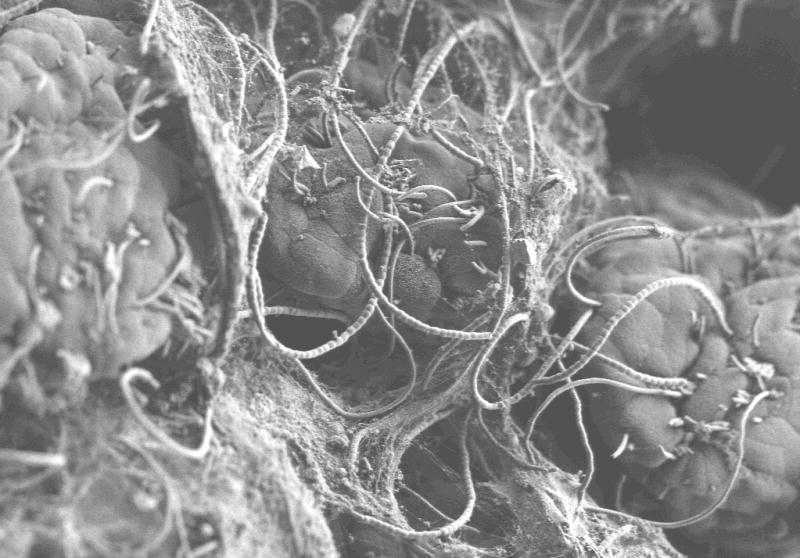
Observation de bactéries filamenteuses segmentées à la surface de la muqueuse intestinale par microscopie électronique à transmission (© Alice Liang et Eric Roth, NYU).
Tableau I.
La présence des cellules Th17 dans l’intestin corrèle avec la colonisation par les bactéries filamenteuses segmentées. O = oui ; N = non. BFS : bactéries filamenteuses segmentées.
| Souris | Détection de microbiote intestinal (hors BFS) | Détection de l’ADN de BFS dans l’intestin | Observation de BFS dans l’intestin par microscopie électronique | Présence de cellules Th17 dans la lamina propria |
|---|---|---|---|---|
| Axénique | N | N | N | N |
| Axénique mono-colonisée par les BFS | N | O | O | O |
| C57/B6 « Jackson » | O | N | N | N |
| C57/B6 « Taconic » | O | O | O | O |
Restait à comprendre le lien entre BFS et cellules Th17. Pour ce faire, nous avons déterminé les gènes du tissu intestinal dont l’expression changeait en réponse à l’introduction de ces BFS. Une fraction importante de ces gènes est impliquée dans les réponses immunitaires, inflammatoires et de défense. En particulier, un des groupes de gènes code notamment pour des peptides antimicrobiens produits par les cellules épithéliales tels que RegIIIg. RegIIIg est une lectine de type C qui est induite par les bactéries commensales et par l’IL-22 et qui protège contre les infections dans la lumière intestinale. Nous avons alors émis l’hypothèse que la colonisation par les BFS pouvait augmenter la protection mucosale via l’induction de cellules Th17, d’IL-22 et de peptides antimicrobiens. Pour tester cette hypothèse, nous avons infecté des souris colonisées par les BFS et des souris contrôles par Citrobacter rodentium, un pathogène intestinal dont l’éradication nécessite des molécules liées aux cellules Th17 comme l’IL-23, l’IL-22 et RegIIIg. Nous avons observé que l’épaisseur de la muqueuse du côlon, un indicateur de l’infection par Citrobacter rodentium, est réduite chez les souris colonisées par les BFS et que le titre des bactéries Citrobacter rodentium récoltées à la surface du côlon est également réduit. La présence de BFS confère donc une protection contre l’infection, confirmant ainsi notre hypothèse.
Microbiote intestinal : une future arme thérapeutique ?
Ces résultats constituent la première preuve qu’une bactérie commensale spécifique peut induire une sous-population spécifique de cellules T CD4+ effectrices dans la muqueuse gastro-intestinale [15], et ils ont été confirmés par d’autres laboratoires [16, 17]. Ainsi la composition du microbiote intestinal peut moduler, ou prédéter-miner, la nature de la réponse immunitaire de l’hôte et donc influencer la protection immunitaire face à une infection. La connaissance du mécanisme moléculaire qu’utilisent les BFS pour induire la présence de cellules Th17 dans l’intestin est encore imparfaite. Il sera essentiel de déterminer si les BFS induisent une différenciation de novo des cellules Th17 ou leur recrutement à partir de sites plus lointains. De même, le mécanisme moléculaire responsable de la détection des BFS par l’hôte n’est pas connu. Étant donné le rôle protecteur des BFS à la muqueuse intestinale, il serait important de déterminer si les BFS influencent les cellules Th17 dans des sites extra-intestinaux, par exemple dans des modèles d’encéphalite auto-immune expérimentale. La colonisation éventuelle de l’homme par les BFS devra être analysée en détails, cependant il est tentant de spéculer que chez l’homme également, l’introduction de BFS sera capable de moduler les réponses immunitaires. Il serait fascinant de généraliser cette approche : si la contribution respective de chaque bactérie commensale dans l’expression des fonctions immunitaires était décryptée, on pourrait envisager de manipuler la composition du microbiote mucosal chez l’homme afin d’induire une immunité protectrice, locale et à distance.
Footnotes
Induction of gut mucosal Th17 cells by segmented filamentous bacteria
CONFLIT D’INTÉRÊTS
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
Contributor Information
Ivaylo I. Ivanov, The Kimmel Center for Biology and Medicine of the Skirball Institute, New York University School of Medicine, New York, NY 10016, États-Unis
Nicolas Manel, Email: nicolas.manel@nyumc.org, The Kimmel Center for Biology and Medicine of the Skirball Institute, New York University School of Medicine, New York, NY 10016, États-Unis. Institut de génétique moléculaire de Montpellier, Centre national de la recherche scientifique et Université Montpellier I et II, Unité mixte de recherche 5535, Montpellier, France.
RÉFÉRENCES
- 1.Acosta-Rodriguez EV, Rivino L, Geginat J, et al. Surface phenotype and antigenic specificity of human interleukin 17-producing T helper memory cells. Nat Immunol. 2007;8 :639–46. doi: 10.1038/ni1467. [DOI] [PubMed] [Google Scholar]
- 2.Manel N, Unutmaz D, Littman DR. The differentiation of human T(H)-17 cells requires transforming growth factor-beta and induction of the nuclear receptor RORgammat. Nat Immunol. 2008;9 :641–9. doi: 10.1038/ni.1610. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Volpe E, Servant N, Zollinger R, et al. A critical function for transforming growth factor-beta, interleukin 23 and proinflammatory cytokines in driving and modulating human T(H)-17 responses. Nat Immunol. 2008;9 :650–7. doi: 10.1038/ni.1613. [DOI] [PubMed] [Google Scholar]
- 4.Korn T, Bettelli E, Gao W, et al. IL-21 initiates an alternative pathway to induce proinflammatory T(H)17 cells. Nature. 2007;448 :484–7. doi: 10.1038/nature05970. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Veldhoen M, Hocking RJ, Atkins CJ, et al. TGFbeta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells. Immunity. 2006;24 :179–89. doi: 10.1016/j.immuni.2006.01.001. [DOI] [PubMed] [Google Scholar]
- 6.Bettelli E, Carrier Y, Gao W, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 2006;441 :235–8. doi: 10.1038/nature04753. [DOI] [PubMed] [Google Scholar]
- 7.Langrish CL, Chen Y, Blumenschein WM, et al. IL-23 drives a pathogenic T cell population that induces autoimmune inflammation. J Exp Med. 2005;201 :233–40. doi: 10.1084/jem.20041257. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Mangan PR, Harrington LE, O’Quinn DB, et al. Transforming growth factor-beta induces development of the T(H)17 lineage. Nature. 2006;441 :231–4. doi: 10.1038/nature04754. [DOI] [PubMed] [Google Scholar]
- 9.Nurieva R, Yang XO, Martinez G, et al. Essential autocrine regulation by IL-21 in the generation of inflammatory T cells. Nature. 2007;448 :480–3. doi: 10.1038/nature05969. [DOI] [PubMed] [Google Scholar]
- 10.Zhou L, Ivanov, Spolski R, et al. IL-6 programs T(H)-17 cell differentiation by promoting sequential engagement of the IL-21 and IL-23 pathways. Nat Immunol. 2007;8 :967–74. doi: 10.1038/ni1488. [DOI] [PubMed] [Google Scholar]
- 11.Ivanov, McKenzie BS, Zhou L, et al. The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells. Cell. 2006;126 :1121–33. doi: 10.1016/j.cell.2006.07.035. [DOI] [PubMed] [Google Scholar]
- 12.Ivanov, Zhou L, Littman DR. Transcriptional regulation of Th17 cell differentiation. Semin Immunol. 2007;19 :409–17. doi: 10.1016/j.smim.2007.10.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Zhou L, Lopes JE, Chong MM, et al. TGF-beta-induced Foxp3 inhibits T(H)17 cell differentiation by antagonizing RORgammat function. Nature. 2008;453 :236–40. doi: 10.1038/nature06878. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Ivanov, Frutos Rde L, Manel N, et al. Specific microbiota direct the differentiation of IL-17-producing T-helper cells in the mucosa of the small intestine. Cell Host Microbe. 2008;4 :337–49. doi: 10.1016/j.chom.2008.09.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Ivanov, Atarashi K, Manel N, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 2009;139 :485–98. doi: 10.1016/j.cell.2009.09.033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Salzman NH, Hung K, Haribhai D, et al. Enteric defensins are essential regulators of intestinal microbial ecology. Nat Immunol. 2009 doi: 10.1038/ni.1825. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Gaboriau-Routhiau V, Rakotobe S, Lecuyer E, et al. The key role of segmented filamentous bacteria in the coordinated maturation of gut helper T cell responses. Immunity. 2009;31 :677–89. doi: 10.1016/j.immuni.2009.08.020. [DOI] [PubMed] [Google Scholar]
- 18.Leung-Theung-Long S, Guerder S. Les cellules Th17 : Une nouvelle population de cellules T CD4 effectrices pro-inflammatoires. Med Sci (Paris) 2008;24 :972–6. doi: 10.1051/medsci/20082411972. [DOI] [PubMed] [Google Scholar]
- 19.Soumelis V, Volpe E. Différenciation des lymphocytes TH17: Des souris et des hommes. Med Sci (Paris) 2008;24 :925–7. doi: 10.1051/medsci/20082411925. [DOI] [PubMed] [Google Scholar]
- 20.Sendid B, Jouault T, Vitse A, et al. Glycanes pariétaux de levures et anticorps spécifiques : biomarqueurs et outils d’analyse physiopathologique des candidoses et de la maladie de Crohn. Med Sci (Paris) 2009;25 :473–81. doi: 10.1051/medsci/2009255473. [DOI] [PubMed] [Google Scholar]


