Abstract
Cette étude prospective compare les effets de la xylazine et de la romifidine sur la qualité du réveil de chevaux anesthésiés. Vingt-huit chevaux sains présentés pour des arthroscopies étaient aléatoirement distribués entre 2 groupes. Le protocole anesthésique intraveineux du groupe xylazine comprenait : butorphanol (0,02 mg/kg) et xylazine (0,5–0,7 mg/kg) en prémédication, diazépam (0,1 mg/kg), kétamine (2,2 mg/kg) et isoflurane comme agents anesthésiques, et xylazine (0,1 mg/kg) comme sédatif au réveil. La xylazine était remplacée par la romifidine 0,05–0,08 mg/kg (prémédication) et 0,01 mg/kg (réveil) dans le groupe romifidine. La qualité du réveil était évaluée à l’aveugle au moyen d’une grille d’évaluation. Le test de la somme des rangs de Wilcoxon (P < 0,05) a été utilisé pour l’analyse statistique. Les notes de la qualité du réveil n’étaient pas statiquement différentes entre les deux groupes. Dans cette étude, la romifidine et la xylazine influençaient de façon similaire la qualité du réveil.
Abstract
Comparison of the effects of xylazine and romifidine administered perioperatively on the recovery of anesthetized horses. The present study was designed to compare recoveries from anesthesia following the use of romifidine or xylazine in horses. In a prospective blind randomized clinical trial, 28 horses, undergoing elective arthroscopy, were randomly allocated into 2 groups. The intravenous anesthesia protocol used in the xylazine group was: butorphanol [0.02 mg/kg body weight (BW)] and xylazine (0.5 to 0.7 mg/kg BW) for premedication, diazepam (0.1 mg/kg BW) and ketamine (2.2 mg/kg BW) for induction, isoflurane in oxygen for maintenance and xylazine (0.1 mg/kg BW) in recovery. The xylazine was replaced with romifidine 0.05 to 0.08 mg/kg BW (premedication) and 0.01 mg/kg BW (recovery) in the romifidine group. The quality of recovery was evaluated with a modified scoring system and the duration recorded. Wilcoxon Ranked Sum test (P < 0.05) was used for statistical analysis. The recovery quality scores and the durations of recovery were not statistically different between the 2 groups. In this study, romifidine and xylazine were equal in their effects on recovery qualities.
(Translated by the authors)
Introduction
Le taux de mortalité associé à l’anesthésie générale en médecine équine est jusqu’à 10 et 100 fois plus important que celui rapporté en médecine des petits animaux et en médecine humaine respectivement (1–7). Dans l’étude multicentrique à plus grande échelle publiée jusqu’à présent, Johnston et al (2) rapportent que 1,9 % des anesthésies se terminent par la mort du cheval dans les 7 jours suivant l’anesthésie (2). Si l’on exclut les anesthésies réalisées lors de chirurgies de colique, l’incidence de mortalité diminue à 0,9 %, dont 33 % seraient dus à une défaillance cardiovasculaire, 23 % à des fractures au réveil et 7 % à des myopathies (2). Il apparaît donc que le réveil est une phase critique lors d’anesthésie équine.
Les agonistes adrénergique alpha–2 (α2) sont couramment utilisés en médecine équine. La sédation qu’ils engendrent fut démontrée pour la première fois en 1969 en utilisant la xylazine et est particulièrement intéressante en période péri-opératoire (8). En prémédication, ils réduisent la sécrétion de catécholamines de manière directe par un effet orthosym-patholytique central et de manière indirecte en réduisant le stress de l’animal, ce qui favorise une induction et un entretien de l’anesthésie générale avec des agents anesthétiques en plus faible quantité. Au réveil, ils permettent de limiter l’apparition de la phase d’hyperexcitabilité (stade II) couramment observée lors d’anesthésie avec les agents halogénés (9). Ainsi, il a été démontré que leur utilisation en fin d’anesthésie à l’isoflurane engendre un réveil plus long et améliore de manière substantielle la qualité du réveil (9). La sédation qu’ils engendrent est rapide et fiable mais leur administration n’est pas dépourvue d’effets secondaires avec entre autres : dépression cardio-vasculaire et respiratoire, ataxie et réduction de la motilité intestinale (10–13). Cependant, aux doses utilisées au réveil, ils ne semblent pas avoir d’effets cardiovasculaires significatifs et à dose sédative équivalente, l’ataxie observée après l’administration de romifidine était moins marquée qu’après l’administration de xylazine (9, 12). Aussi, il semble qu’il existerait une phase de sédation résiduelle avec la romifidine.
La présente étude a pour objectifs principaux de déterminer lequel des agonistes α2, entre la xylazine et la romifidine, permet la meilleure qualité de réveil et de quantifier leur répercussion relative sur la durée du réveil suite à une anesthésie générale à l’isoflurane. En second lieu, l’association des 2 molécules à l’incidence de troubles digestifs en période postopératoire a été étudiée. Notre hypothèse de départ était que comparativement à la xylazine, la romifidine induirait un réveil plus long et de meilleure qualité avec possiblement des effets sur le transit digestif plus importants.
Matériels et méthodes
Choix des sujets expérimentaux
Les chevaux étaient présentés entre les mois de novembre 2005 et février 2006 au Centre hospitalier universitaire vétérinaire (CHUV) pour arthroscopie élective de 2 articulations au maximum (boulet et/ou jarret). Les chevaux étaient intégrés dans l’étude s’ils étaient déclarés sains après un examen général et une analyse hémato-biochimique dans les normes. Il n’y avait pas de restriction quant à la race, le sexe, l’âge et la masse corporelle des animaux En revanche, la durée de l’anesthésie générale ne devait pas dépasser 4 heures.
Protocole expérimental
Dès l’arrivée au CHUV, chaque cheval se voyait attribuer aléatoirement un groupe (xylazine ou romifidine). Cette distribution se faisait en suivant l’ordre d’une liste de chiffres pairs (xylazine) et impairs (romifidine) produite de manière aléatoire à l’aide de la fonction RAND du logiciel Excel (Microsoft Office 2004). Cette classification permettait au cheval de recevoir un seul type d’agent agoniste α2 tout au long de son séjour aussi bien lors de son examen pré-opératoire (si nécessaire), que lors de la prise de radiographies ou que lors de l’anesthésie générale.
Les protocoles utilisés dans cette étude sont identiques à ceux utilisés en clinique et afin de respecter le bien-être du patient lors de son hospitalisation, les cliniciens en charge du cas avaient toute la latitude pour modifier le protocole établi, en conséquence de quoi l’animal était exclu de l’étude. Aucune autorisation n’a été demandée au comité d’éthique de l’université pour la réalisation de cette étude clinique. En effet, elle n’imposait aucune procédure invasive ou changement au protocole utilisé en clinique.
Protocole anesthésique
Un cathéter de diamètre 14G (Angiocath; Becton Dickinson, Sandy, Utah, USA) était placé de manière aseptique dans la veine jugulaire droite ou gauche. La médication prophylaxique consistait en l’administration intraveineuse (IV) (15 à 45 minutes avant l’induction) de pénicilline sodique (22 000 UI/kg) (Penicillin G sodium; Novopharm, Toronto, Ontario) et de phénylbutazone (2,2 mg/kg) (Phenylbutazone; Univet Pharmaceutical, Milton, Ontario). Le cheval était ensuite transféré dans le box d’induction. La température rectale pré-anesthésique (T1) était mesurée avant la prémédication. Lors de cette prémédication, chaque cheval recevait par voie IV de la xylazine (0,5 à 0,7 mg/kg) (Anased®; xylazine injection 100 mg/mL, Novopharm santé animale, Toronto, Ontario) ou de la romifidine (50 à 80 μg/kg) (Sedivet®; romifidine injection 10 mg/mL, Boehringer Ingelheim, Burlington, Ontario) dépendamment du groupe, et du butorphanol (0,02 mg/kg) (Torbugesic®; butorphanol injection 10 mg/mL, Wyeth Animal Health, Guelph, Ontario). Alors que le cheval montrait les premiers signes de sédation (tête abaissée, diminution de réponse aux stimuli environnementaux) il était placé entre un mur et une porte battante. Une auscultation cardiaque et une prise de pouls étaient réalisées. Une fois l’animal bien tranquillisé, l’induction de l’anesthésie était réalisée avec diazépam (0,1 mg/kg) (diazépam injection 5 mg/mL, Sabex, Boucherville, Québec) IV et kétamine (2,2 mg/kg) (Vetalar®; ketamine injection 100 mg/mL, Bioniche Animal Health Canada Inc., Belleville, Ontario) IV. Le cheval était intubé avec un tube endotrachéal (24 ou 26 mm de diamètre interne, Bivona Inc, Gary, Indiana, USA) puis transféré dans la salle de chirurgie où il était placé en décubitus dorsal. Durant la phase de transfert et si le cheval montrait des signes de réveil (nystagmus, mouvement spontané) de la kétamine était administré à effet. La durée d’anesthésie (DA) était définie comme étant le temps écoulé entre l’induction de l’anesthésie et l’arrêt de l’anesthésie volatile. Le maintien de l’anesthésie se poursuivait avec de l’isoflurane (AErrane®; Baxter Corporation, Mississauga, Ontario), dans 100 % d’oxygène, administré à effet au moyen d’un vaporisateur hors du circuit dans un système circulaire (Rachel Model 2800 Large Animal Anesthesia Ventilator; Mallard, Redding, California, USA). Le support cardiovasculaire consistait en une fluidothérapie (Lactate Ringer; Baxter Corporation, Mississauga, Ontario) IV et une perfusion de dobutamine (Dobutrex, Novopharm Limited) jusqu’à 2 μg/kg/min IV si la pression artérielle moyenne était inférieure à 70 mmHg. De la kétamine IV était administrée en cas de profondeur anesthésique insuffisante lors de la transition entre l’anesthésie intraveineuse et l’anesthésie gazeuse et lors de mouvement du cheval sur la table d’opération. L’analgésie intra-opératoire était procurée par l’anti-inflammatoire non-stéroïdien administré en période pré-opératoire et par l’administration systématique de butorphanol (0,04 mg/kg) IV toutes les heures. Le cheval était mécaniquement ventilé avec un volume courant de 10 à 15 mL/kg et une fréquence respiratoire permettant le maintien d’une pression partielle de CO2 en fin d’expiration (PetCO2) entre 35 et 50 mmHg (Datascope Multinex 4000 multiparameter gas monitor, Datascope Corp., Mahwah, New Jersey, USA). À la fin de la chirurgie, une mesure de la température rectale en fin d’anesthésie (T2) ainsi qu’une injection intra-articulaire de bupivacaïne (Marcaine, bupivacaïne injection 5 mg/mL; Abbott Laboratories, St-Laurent, Québec) 10 mL par boulet et 15 mL par jarret, et de morphine (morphine HP 25, 25 mg/mL, preservative-free, Sabex) 1 ml par articulation, étaient réalisées. L’administration de l’agoniste α2 post-opératoire se faisait systématiquement dès le retour au box de réveil. Le cheval y était placé en décubitus latéral (membre opéré dessus) et recevait de la xylazine (0,1 mg/kg IV) ou de la romifidine (10 μg/kg IV), suivant son groupe de départ, et de la phényléphrine intra-nasale (10 mL par narine d’une solution diluée à 0,15 %) (Neo-synephrine, Hospira Healthcare Corporation, Montréal, Québec). De l’oxygène était administré par une valve de demande jusqu’au retour de la ventilation spontanée, puis par une insufflation continue (15 L/min dans le tube endotrachéal jusqu’au lever. Lors du réveil, la stimulation manuelle et sonore était réduite au minimum. La lumière était éteinte dans le box de réveil jusqu’au passage en décubitus sternal.
Outils de surveillance du patient durant l’anesthésie
L’électrocardiogramme (dérivation 1), la fréquence cardiaque, les pressions artérielles systolique, moyenne et diastolique (cathéter 20G inséré dans l’artère faciale transverse, transducteur au niveau de la pointe de l’épaule) et la température œsophagienne étaient continuellement surveillés sur un moniteur multiparamétrique (Datascope 2000; Datascope Corp., Mahwah, New Jersey, USA). La saturation en oxygène de l’hémoglobine artérielle et PetCO2 étaient mesurées respectivement par oxymétrie de pouls (Vet/Ox 4404; Heska Corp., Waukesha, Wisconsin, USA) et capnométrie (Datascope Multinex 4000 multiparameter gas monitor, Datascope Corp., Mahwah, New Jersey, USA). L’oxygénation et la ventilation étaient aussi évaluées par l’analyse périodique des gaz sanguins.
Description des paramètres évalués
Pour toutes les échelles utilisées dans cette étude, une notation faible reflétait une évaluation favorable. Une évaluation de la réponse de l’animal à la prémédication (note sédation : 0 = profonde, 1 = modérée, 2 = légère, 3 = aucune) et de la résistance à l’induction (note induction : 0 = aucune, 1 = légère, 2 = modérée, 3 = profonde) était réalisée dans le but de s’assurer que la réponse des chevaux aux agents anesthétiques IV était équivalente dans les 2 groupes. Afin d’évaluer la qualité de l’anesthésie durant la phase de transition entre l’induction IV et l’entretien par l’anesthésie volatile, la dose totale de kétamine administrée (dose kétamine) lors des 20 premières minutes suivant l’induction était comptabilisée. La durée du réveil (DR) était chronométrée dès l’arrêt de l’anesthésie volatile jusqu’au lever définitif du cheval. La qualité du réveil de chacun des chevaux était appréciée par deux évaluateurs indépendants grâce à une échelle comportementale modifiée (utilisée après autorisation de l’auteur) qui associait une note à chacune des étapes du lever (tableau 1) (14). La première évaluation était réalisée de manière non aveugle et en direct par le clinicien en charge du cas (note réveil clinicien). La deuxième évaluation était réalisée à l’aveugle par l’investigateur principal (IP) à partir d’enregistrements vidéo (note réveil IP). À partir de ces évaluations, une analyse des étapes du lever associées à des risques de traumatisme était réalisée (tableau 1) et une nouvelle note était attribuée par chacun des 2 évaluateurs (note trauma clinicien et note trauma IP).
Tableau 1.
Grille d’évaluation de la qualité du réveil [modifiée, tirée de Donaldson et al (14)]. Cette échelle d’évaluation comportementale a été modifiée de manière à incorporer le lever aux câbles. La note trauma ne reprend que les notes associées aux étapes dactylographiées en italique
| Etat à évaluer | Caractéristique de l’état | Note |
|---|---|---|
| Attitude générale | Calme | 1 |
| Calme/déterminé | 3 | |
| Anxieux | 5 | |
| Vertige/Ataxie | 7 | |
| Énervé | 8 | |
| Frénétique | 10 | |
| Attitude couchée | Calme, s’étirant occasionnellement, levant la tête | 1 |
| Tendu, prêt à exploser | 3 | |
| S’agite dans tous les sens | 5 | |
| Passage en décubitus sternal | Calmement, posément | 1 |
| Difficilement mais sans rechute brutale | 5 | |
| Nbre de tentatives pour passer en décubitus sternal | La note est égale au nombre de tentatives (Max de 5) | |
| Décubitus sternal | Calme, organisé, avec une pause | 1 |
| N’existe pas | 3 | |
| Prolongé | 6 | |
| Multiples reprises | 7 | |
| Continue de lutter | 10 | |
| Lever du cheval | Méthodique | 1 |
| Lever difficile sans heurt | 3 | |
| Prend appui sur les murs | 6 | |
| Se cogne sur les murs | 10 | |
| Assisté aux câbles | 10 | |
| Force du cheval au lever | A presque toutes ses forces | 1 |
| Vacillant | 3 | |
| En chien assis avant de se lever | 6 | |
| Tentatives multiples par manque d’énergie | 10 | |
| Assisté aux câbles après le lever | 10 | |
| Nombre de tentatives au lever | La note est égal au nombre de tentatives (Max de 5) | |
| Si lever aux câbles | 5 | |
| Station debout et coordination | Solide sur ces pattes | 1 |
| Vacillant modérément | 3 | |
| Se maintient grâce à ses réflexes | 5 | |
| En équilibre très instable | 8 | |
| Retombe | 10 | |
| Est maintenu debout par les câbles | 10 | |
| Bouleture | Aucune | 1 |
| Modérée sur membres postérieurs | 2 | |
| Marquée sur membres postérieurs | 3 | |
| Modérée sur les quatre membres | 4 | |
| Excessive et prolongée | 5 |
Note réveil (ensemble des étapes).
Note trauma (étapes en italique).
L’existence de différences significatives entre les deux groupes de traitements en ce qui concerne la dose de kétamine, l’écart de température (Δ T) entre T1 et T2, DA, la note réveil clinicien, la note réveil IP, la note trauma clinicien et la note trauma IP a été testée. L’existence d’une différence significative entre la note réveil clinicien et la note réveil IP pour un même cheval a été évaluée. Afin de tester l’influence de T2 sur la note réveil IP, l’ensemble des chevaux a été réparti entre 3 groupes (groupe T2a : T2 ≤ 36,4 °C; T2b: 36,4 °C < T2 < 37°C, T2c : T2 ≥ 37 °C dont les notes réveil IP ont été comparées. De la même manière, dans le but de tester l’influence de DA sur la note réveil, l’ensemble des chevaux a été reparti entre 3 groupes (groupe DAa: DA ≤125 min, DAb: 125 min < DA < 155 min, DAc ≥ 155 min) dont les notes réveil IP ont été comparées. L’existence d’une influence de T2 sur DR, de DA sur DR et de DA sur T2 a aussi été testée.
Enfin, dans le but de déterminer si l’un des agonistes α2 utilisés avait des effets néfastes probant sur le tube digestif, les signes de colique postopératoire, la quantité (normal, faible ou absent) et la qualité (normal, sec, pâteux, diarrhée) du fumier étaient notées durant les trois jours suivant l’anesthésie. L’évaluation du fumier était réalisée chaque matin par le personnel préposé au soin des animaux.
Analyse statistique
Pour évaluer l’existence, entre les 2 groupes de traitements, d’une différence significative relative à certains paramètres cliniques, le test de la somme des rangs de Wilcoxon a été utilisé. Pour évaluer l’existence d’une association statistique significative entre certains paramètres cliniques, le test de Friedman a été utilisé. L’analyse statistique permettant de cibler, entre 3 groupes de chevaux, une différence significative relative à certains paramètres cliniques a été réalisée à l’aide du test de Kruskal-Wallis. L’existence d’une différence significative entre la note réveil clinicien et la note réveil IP pour un même cheval a été évaluée en deux étapes : test de corrélation de Spearman pour montrer la présence d’une corrélation entre les 2 notes et test de la somme des rangs de Wilcoxon pour comparer les médianes des 2 notes. Le seuil de signification a était fixé à 0,05. Les analyses statistiques ont été réalisées à l’aide du logiciel Number Cruncher Statistical System (NCSS) 2001, Kaysville, Utah, USA.
Résultats
Trente-quatre chevaux ont été initialement inclus dans l’étude, mais 6 (3 de chaque groupe) ont été exclus pour non-respect du protocole expérimental. Des 28 chevaux retenus, il y avait 23 standardbred, 2 croisés, 1 cheval de selle, 1 Hanovrien et 1 thoroughbred, d’un âge moyen (± écart type) de 30 mois (± 11,8) et pesant en moyenne 451 kg (± 53). Quatorze d’entre eux étaient des femelles, 99 des mâles entiers et 5 des hongres. Il n’y avait pas de différence intergroupe significative quant à l’âge, la masse, le sexe et la race. Aucune différence significative n’a pu être mise en évidence quant à la qualité de la sédation et la résistance à l’induction (tableau 2). Dose kétamine, DA, DR et ΔT étaient similaires dans les deux groupes (tableau 2). Aucune des notes réveil ou trauma n’a montré de différence significative, aussi bien dans l’évaluation effectuée de manière non aveugle que lors de l’évaluation à l’aveugle (tableau 2).
Tableau 2.
Comparaison de certains paramètres cliniques, des notes sédation et des notes trauma entre les 2 groupes : dose kétamine, dose totale de kétamine reçue par le patient durant les 20 premières minutes suivant l’induction; T2, température rectale en fin d’anesthésie; ΔT, défini comme température préopératoire — T2; DA, durée de l’anesthésie; DR, durée du réveil; IP, investigateur principal; NS, pas de différence statistiquement significative entre les deux groupes
| Groupes
|
||||||
|---|---|---|---|---|---|---|
| Romifidine
|
Xylazine
|
Contraste statistique (5 %)
|
||||
| Paramètres | n | Moyenne | n | Moyenne | Test | |
| Dose kétamine (mg) | 14 | 83 | 14 | 61 | NS | Test de la somme des rangs de Wilcoxon |
| T2 (°C) | 14 | 36,7 | 14 | 36,6 | NS | Test de la somme des rangs de Wilcoxon |
| ΔT (°C) | 14 | 1 | 14 | 0,9 | NS | Test de la somme des rangs de Wilcoxon |
| DA (min) | 14 | 130 | 14 | 147 | NS | Test de la somme des rangs de Wilcoxon |
| DR (min) | 14 | 38 | 14 | 37 | NS | Test de la somme des rangs de Wilcoxon |
| Romifidine
|
Xylazine
|
|||||
|---|---|---|---|---|---|---|
| Paramètres | n | Médiane | n | Médiane | Test | |
| Note sédation | 14 | 1 | 14 | 1 | NS | Test de la somme des rangs de Wilcoxon |
| Note induction | 14 | 0 | 14 | 0 | NS | Test de la somme des rangs de Wilcoxon |
| Note réveil clinicien | 14 | 24,5 | 14 | 35,5 | NS | Test de la somme des rangs de Wilcoxon |
| Note réveil IP | 14 | 25,5 | 14 | 35,5 | NS | Test de la somme des rangs de Wilcoxon |
| Note trauma clinicien | 14 | 14,5 | 14 | 20 | NS | Test de la somme des rangs de Wilcoxon |
| Note trauma IP | 14 | 16 | 14 | 26 | NS | Test de la somme des rangs de Wilcoxon |
Une association significative entre les 2 notes réveil clinicien et réveil IP fut ciblée (P < 0,001). De plus, les médianes de ces 2 notes [27,5 note réveil clinicien et 26,5 note réveil IP; (n = 28) données appariées], n’ont pas différé statistiquement (P = 0,419). En d’autres termes, pour un même cheval il n’y a pas eu de différence significative entre les notes données par les 2 évaluateurs.
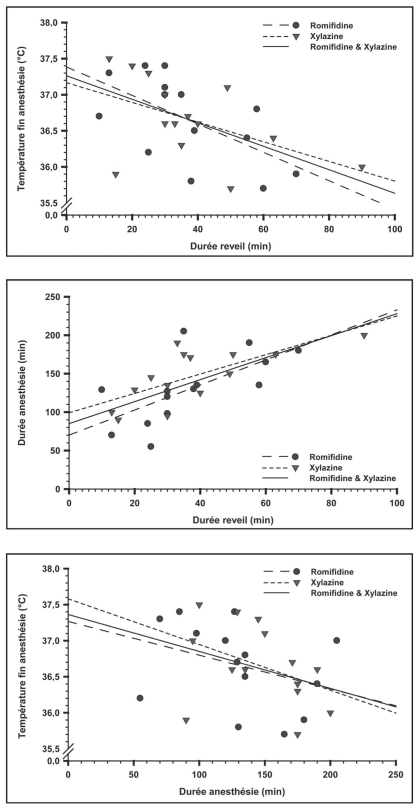
T2 était corrélée (négativement) avec DR globalement et au sein du groupe romifidine (figure 1). Une corrélation (positive) a aussi été observée entre DA et DR globalement et dans chacun des groupes, et une corrélation négative entre T2 et DA globalement (figure 1). Aucune influence de T2 et de la durée d’anesthésie (P = 0,619 et P = 0,155 respectivement; n = 28) sur la note réveil IP n’a pu être mise en évidence.
Figure 1.
Association entre la température en fin d’anesthésie et la durée du réveil, entre la durée d’anesthésie et la durée du réveil et entre la température en fin d’anesthésie et la durée d’anesthésie.
Lors de l’évaluation des effets sur le système digestif, aucune impaction, diarrhée ou tout autre signe de trouble digestif n’a été observé chez aucun des chevaux.
Commentaires
Avec la taille des groupes présentés dans cette étude, il n’a pas été possible de détecter d’effets statistiquement significatifs entre les deux groupes. La différence qui est statistiquement non significative entre les deux groupes pourrait toutefois avoir un sens clinique et d’autres travaux sont nécessaires pour déterminer un seuil d’équivalence entre les valeurs des deux tests.
Des 28 chevaux inclus dans l’étude, une vaste majorité (23) était constituée de standardbreds. Comparativement aux chevaux thoroughbreds, les standardbreds ont un tempérament plus docile et il est donc difficile d’extrapoler les résultats de la présente étude à l’ensemble des races quand certains auteurs rapportent que le tempérament du cheval peut influencer la qualité du réveil (15, 16). Ainsi, il est possible que la différence de qualité de réveil (statistiquement non significative), observée entre les deux groupes dans cette étude, se révèle plus importante dans une population équine composée de chevaux thoroughbreds.
Les chevaux avec une note ASA élevée sont plus à risque de développer durant l’anesthésie des complications qui peuvent avoir des répercussions sur la qualité du réveil (2). En conséquence, les chevaux ayant une note ASA supérieure à 2 n’étaient pas inclus dans l’étude. Des six chevaux exclus, 3 avaient des évaluations de la qualité du réveil incomplètes et 3 avaient reçu un protocole anesthésique non conforme (perfusion de lidocaïne durant la chirurgie ou butorphanol au réveil).
La prémédication permet une anesthésie générale plus sûre (2). L’utilisation des agonistes α2 en prémédication engendre une relaxation musculaire, une baisse de l’anxiété et donc une diminution de la sécrétion de catécholamines. Elle permet alors d’améliorer l’induction et l’entretien de l’anesthésie, ainsi que de baisser la concentration alvéolaire minimale des agents anesthésiques volatils (17). Pour ces raisons, aucun groupe témoin non prémédicamenté n’a été inclus dans l’étude. Une étude pilote a permis de déterminer que les doses de romifidine (0,05–0,07 mg/kg) et de xylazine (0,5–0,7 mg/kg) avaient des effets sédatifs équivalents lors de co-administration avec du butorphanol (0,02 mg/kg). Le butorphanol a été montré comme ayant des effets synergiques avec les agonistes α2 sans en aggraver les effets cardiovasculaires (17). Une autre étude a confirmé que la romifidine (0,08 mg/kg) et la xylazine (1 mg/kg) produisaient des effets sédatifs équivalents avec un ratio romifidine/xylazine de 8/100, proche de celui utilisé dans la présente étude (10/100) (12). Aussi dans cette même étude, les effets sédatifs de la romifidine avaient une durée d’action plus longue.
Les chevaux étaient placés peu de temps après la prémédication entre une porte battante et un mur dans le box d’induction. Par conséquent, il a été difficile d’évaluer en détail le comportement des chevaux en raison de l’entrave à leurs mouvements et à l’inspection visuelle causée par la porte battante. Ainsi, l’ataxie décrite comme plus importante lors de sédation à la xylazine comparativement à la romifidine (12) n’a pu être mise en évidence. Cependant, toutes les sédations étaient adéquates et aucune prémédication n’a nécessité l’administration supplémentaire de sédatifs. Par la suite, l’analyse de la qualité de la transition entre l’induction et l’entretien de l’anesthésie n’a pas montré de différence entre les deux groupes, suggérant un degré de sédation et une réduction de concentration alvéolaire minimale similaires entre les deux molécules.
La grille d’évaluation de la qualité du réveil utilisée dans cette étude a déjà été utilisée par plusieurs chercheurs (14, 18). Nous avons modifié cette échelle d’évaluation comportementale de manière à incorporer le lever aux câbles. Cette technique, consistant à aider le cheval à l’aide de 2 câbles (un à la queue, l’autre au licol), est couramment utilisée à la Faculté de médecine vétérinaire de l’Université de Montréal lors de réveil jugé difficile par le clinicien en charge du cas. Au moment de la réalisation de cette étude, cette technique de lever n’était utilisée qu’en seconde intention et était associée à un score maximum. Parce que toutes les étapes reprises dans la grille d’évaluation du réveil ne sont pas directement associées à un risque de blessure grave au réveil (ex. attitude couchée, nombre de passages en décubitus sternal), une seconde note ne reprenant que les étapes les plus à risque (lever du cheval, force du cheval au lever, nombre de tentatives au lever, station debout et coordination et bouleture) ont été reprises pour l’attribution de la note trauma. Les notes réveil clinicien et IP ainsi que les notes trauma clinicien et IP ont montré la même tendance, à savoir une meilleure qualité de lever avec la romifidine, sans pour autant révéler une différence statistiquement significative. Cette même tendance a aussi été observée dans une autre étude utilisant un protocole anesthésique similaire (19). Dans cette étude, le groupe recevant de la romifidine 0,02 mg/kg au réveil a montré les meilleurs réveils avec un nombre de tentatives au lever plus faible et une meilleure coordination. Dans notre étude, les résultats obtenus par le chercheur principal tendent à montrer une qualité de lever inférieure. Cette différence peut être due à la possibilité de visionner les réveils à plusieurs reprises, de mieux déterminer les différentes phases du réveil et de mieux évaluer les détails comme les signes de bouleture. Cependant, les résultats comparables entre le chercheur principal et les cliniciens soulignent l’objectivité de l’évaluation réalisée de manière non aveugle par ces derniers et encourage l’utilisation de cette grille en clinique en prévision d’études rétrospectives.
Une étude réalisée sur des chevaux recevant 80 μg/kg de romifidine par voie IV a déterminé que la note sédation était significativement différente du niveau de référence pour une durée de 120 min (20). En comparaison, les effets sédatifs de la xylazine administrée à la dose de 1,1 mg/kg IV ont une durée d’action de seulement 15 à 60 min (10). Ces données sont en faveur d’une sédation plus longue et possiblement d’un réveil prolongé suivant l’administration de romifidine. Ainsi, la durée d’anesthésie (16 min) obtenue grâce à l’administration de xylazine/diazépam/kétamine (1,1/0,04/2,2 mg/kg) est inférieure à celle obtenue (20 min) grâce à l’administration de romifidine/diazépam/kétamine (0,1/0,04/2,2 mg/kg) (21). Cependant, aucune différence significative n’a pu être mise en évidence quant à DR entre les deux groupes dans notre étude. De plus, DR n’était pas corrélée avec la qualité du réveil, contrairement à ce qu’ont suggéré différents auteurs (22). Enfin, DA et T2 étaient corrélées avec DR. Cette corrélation a déjà été décrite dans une étude comprenant 381 chevaux anesthésiés avec xylazine, kétamine, diazépam et isoflurane (23).
Aucun cheval n’a montré de signe de colique. La qualité et la quantité du fumier étaient adéquates pour tous les animaux. Ceci suggère que dans le cadre de la présente étude, quel que soit l’agoniste α2 utilisé, les effets sur le transit intestinal n’ont eu aucune conséquence néfaste pour l’animal.
Dans les conditions de la présente étude, la romifidine et la xylazine administrées en période péri-opératoire ont procuré la même durée et la même qualité de réveil chez des chevaux anesthésiés avec diazépam, kétamine et isoflurane
Remerciements
Aux Drs Geneviève Bussières et Daniel Pang pour leur contribution à la collecte des données, à Maxime Moreau et à Guy Beauchamp pour leur contribution à l’analyse statistique des données, au Dr M. Paula Larenza pour la revue du texte final et au Dr Lydia Donaldson et ses co-auteurs pour nous avoir auto-risés à utiliser leur grille d’évaluation de la qualité du réveil. CVJ
Footnotes
Une partie de cet article a été présentée comme communication brève au congrès de l’«Association of Veterinary Anaesthetists» au printemps 2006, Paris, France. Aussi, les auteurs n’autoriseront pas la réimpression.
Bibliographie
- 1.JOHNSTON GM, TAYLOR PM, HOLMES MA, WOOD JL. Confidential enquiry of perioperative equine fatalities (CEPEF–1): preliminary results. Equine Vet J. 1995;27:193–200. doi: 10.1111/j.2042-3306.1995.tb03062.x. [DOI] [PubMed] [Google Scholar]
- 2.JOHNSTON GM, EASTMENT JK, WOOD JLN, TAYLOR PM. The confidential enquiry into perioperative equine fatalities (CEPEF): mortality results of Phases 1 and 2. Vet Anaesth Analg. 2002;29:159–170. doi: 10.1046/j.1467-2995.2002.00106.x. [DOI] [PubMed] [Google Scholar]
- 3.BIDWELL LA, BRAMLAGE LR, ROOD WA. Equine peri-operative fatalities associated with general anaesthesia at a private practice — a retrospective case series. Vet Anaesth Analg. 2007;34:23–30. doi: 10.1111/j.1467-2995.2005.00283.x. [DOI] [PubMed] [Google Scholar]
- 4.CLARKE KW, HALL LW. A survey of anaesthesia in small animal practice: AVA/BSAVA report. J Vet Anaes. 1990;17:4–16. [Google Scholar]
- 5.BRODBELT D. Perioperative mortality in small animal anaesthesia. Vet J. 2009;182:152–61. doi: 10.1016/j.tvjl.2008.06.011. [DOI] [PubMed] [Google Scholar]
- 6.WARDEN JC, BORTON CL, HORAN BF. Mortality associated with anaesthesia in New South Wales, 1984–1990. Med J Aust. 1994;161:585–593. doi: 10.5694/j.1326-5377.1994.tb127636.x. [DOI] [PubMed] [Google Scholar]
- 7.IRITA K, KAWASHIMA Y, IWAO Y, SEO N, TSUZAKI K, MORITA K, OBARA H. Annual mortality and morbidity in operating rooms during 2002 and summary of morbidity and mortality between 1999 and 2002 in Japan: a brief review. Masui. 2004;53:320–335. [PubMed] [Google Scholar]
- 8.CLARKE KW, HALL LW. “Xylazine” — a new sedative for horses and cattle. Vet Rec. 1969;85:512–517. doi: 10.1136/vr.85.19.512. [DOI] [PubMed] [Google Scholar]
- 9.SANTOS M, FUENTE M, GARCIA_ITURRALDE R, HERRAN R, LOPEZ_SANROMAN J, TENDILLO FJ. Effects of alpha-2 adrenoceptor agonists during recovery from isoflurane anaesthesia in horses. Equine Vet J. 2003;35:170–175. doi: 10.2746/042516403776114117. [DOI] [PubMed] [Google Scholar]
- 10.TRONICKE R, VOCKE G. Contributions to the use of the preparation Rompun as a sedative and for anaesthetic premedication in the horse. Veterinary Medical Reviews. 1970;6:247–54. [Google Scholar]
- 11.CLARKE KW, PATON BS. Combined use of detomidine with opiates in the horse. Equine Vet J. 1988;20:331–334. doi: 10.1111/j.2042-3306.1988.tb01540.x. [DOI] [PubMed] [Google Scholar]
- 12.ENGLAND GC, CLARKE KW, GOOSSENS L. A comparison of the sedative effects of three alpha 2-adrenoceptor agonists (romifidine, detomidine and xylazine) in the horse. J Vet Pharmacol Ther. 1992;15:194–201. doi: 10.1111/j.1365-2885.1992.tb01007.x. [DOI] [PubMed] [Google Scholar]
- 13.HAMM D, TURCHI P, JÖCHLE W. Sedative and analgesic effects of detomidine and romifidine in horses. Vet Rec. 1995;136:324–327. doi: 10.1136/vr.136.13.324. [DOI] [PubMed] [Google Scholar]
- 14.DONALDSON LL, DUNLOP GS, HOLLAND MS, BURTON BA. The recovery of horses from inhalant anesthesia: a comparison of halothane and isoflurane. Vet Surg. 2000;29:92–101. doi: 10.1111/j.1532-950x.2000.00092.x. [DOI] [PubMed] [Google Scholar]
- 15.MATTHEWS NS, HARTSFIELD SM, MERCER D, BELEAU MH, MACKENTHUN A. Recovery from sevoflurane anesthesia in horses: comparison to isoflurane and effect of postmedication with xylazine. Vet Surg. 1998;27:480–485. doi: 10.1111/j.1532-950x.1998.tb00160.x. [DOI] [PubMed] [Google Scholar]
- 16.WHITEHAIR KJ, STEFFEY EP, WILLITS NH, WOLINER MJ. Recovery of horses from inhalation anesthesia. Am J Vet Res. 1993;54:1693–702. [PubMed] [Google Scholar]
- 17.ENGLAND GC, CLARKE KW. Alpha 2 adrenoceptor agonists in the horse — a review. Br Vet J. 1996;152:641–657. doi: 10.1016/s0007-1935(96)80118-7. [DOI] [PubMed] [Google Scholar]
- 18.VALVERDE A, GUNKELT C, DOHERTY TJ, GIGUÈRE S, POLLAK AS. Effect of a constant rate infusion of lidocaine on the quality of recovery from sevoflurane or isoflurane general anaesthesia in horses. Equine Vet J. 2005;37:559–564. doi: 10.2746/042516405775314772. [DOI] [PubMed] [Google Scholar]
- 19.BIENERT A, BARTMANN CP, VON OPPEN T, POPPE C, SCHIEMANN V, DEEGEN E. Standing behavior in horses after inhalation anesthesia with isoflurane (Isoflo) and postanesthetic sedation with romifidine (Sedivet) or xylazine (Rompun) Dtsch Tierarztl Wochenschr. 2003;110:244–248. [PubMed] [Google Scholar]
- 20.WOJTASIAK_WYPART M, SOMA LR, RUDY JA, UBOH CE, BOSTON RC, DRIESSEN B. Pharmacokinetics and pharmaco-dynamics of romifidine hydrochloride in the horse. Vet Anaesth Analg; Abstracts of the American College of Veterinary Anesthesiologists’ (ACVA) Annual Meeting; Phoenix, AZ. September 18–19, 2008; 2009. pp. 1–19. [Google Scholar]
- 21.KERR CL, MCDONELL WN, YOUNG SS. A comparison of romifidine and xylazine when used with diazepam/ketamine for short duration anesthesia in the horse. Can Vet J. 1996;37:601–609. [PMC free article] [PubMed] [Google Scholar]
- 22.AUER JA, GARNER HE, AMEND JF, HUTCHESON DP, SALEM CA. Recovery from anaesthesia in ponies: a comparative study of the effects of isoflurane, enflurane, methoxyflurane and halothane. Equine Vet J. 1978;10:18–23. doi: 10.1111/j.2042-3306.1978.tb02207.x. [DOI] [PubMed] [Google Scholar]
- 23.VOULGARIS DA, HOFMEISTER EH. Multivariate analysis of factors associated with post-anesthetic times to standing in isoflurane-anesthetized horses: 381 cases. Vet Anaesth Analg. 2009;36:414–420. doi: 10.1111/j.1467-2995.2009.00472.x. [DOI] [PubMed] [Google Scholar]