Abstract
Introduction
Décrire les différents aspects échographiques de carcinome hépatocellulaire (CHC) et préciser l’apport de l’échographie dans le diagnostic des CHC dans le contexte burkinabè.
Méthodes
U+00C9tude prospective descriptive de 12 mois, réalisée dans les services de médecine interne et d’imagerie médicale du CHU Souro Sanou de Bobo Dioulasso, portant sur 58 patients ayant un CHC. Tous les patients ont bénéficié d’une exploration échographique abdominale et dans certains cas d’un dosage du taux d’alpha-foetoprotéine et d’un examen histologique hépatique. Les caractères échographiques des tumeurs et les signes extra tumoraux associés ont été notés.
Résultats
Cinquante huit patients d’âge moyen de 45,6 ±12,5 ans (extrêmes 22-77 ans), avec une nette prédominance masculine (n=44) étaient inclus dans l’étude. Le retard diagnostic était de plus de 3 mois dans 50,7%. L’échographie décrivait des grosses tumeurs (69% des cas), multinodulaires (67,2%), à majorité hyperéchogènes (70,7%). Cinq formes pseudo suppuratives étaient notées (8,7%). L’ascite (60,3% des cas) et la thrombose portale (56,8%) étaient les signes extra-tumoraux les plus fréquents. La thrombose cave inférieure (n=1) était rare. L’alpha-foetoprotéine était significativement élevée chez 10 patients (43,5%). L’examen histologique (n=20) décrivait un CHC chez 18 patients (90%).
Conclusion
Au Burkina Faso, le CHC est multinodulaire, hyperéchogène et de grosse taille avec une forme particulière pseudo abcédée. L’imagerie échographique est un examen complémentaire indispensable décrivant des aspects presque pathognomoniques du CHC. Toutefois, son association à l’histologie est plus utile que le dosage de l’alpha-foetoprotéine dans le diagnostic des CHC.
Key words: Carcinome hépatocellulaire, échographie, Alpha-foetoprotéine, Burkina
Introduction
Le carcinome hépatocellulaire (CHC) est la tumeur primitive du foie la plus fréquente dans le monde. La population à risque est constituée des sujets atteints d’hépatopathie chronique au stade de fibrose extensive ou de cirrhose. L’incidence est globalement de 11 sur 100 000 hommes et de 1,5 sur 100000 femmes [1]. Cette tumeur est de distribution géographique inhomogène. En effet 80% des patients porteurs de CHC sont originaires de pays en voie de développement. Son incidence est de plus de 20 cas sur 100.000 habitants en Asie du Sud et en Afrique subsaharienne qui sont des zones endémiques de l'infection par le virus de l’hépatite B [1,2]. L’étiologie du CHC est dominée par les virus des hépatites B et C, la consommation massive d’alcool et la stéatohépatite non alcoolique [1].
Dans les pays du nord, le CHC est habituellement de découverte précoce dans le cadre du suivi d’une cirrhose et touche principalement les sujets âgés [1]. Par contre, en Afrique noire, le CHC reste encore une affection de découverte tardive au stade de développement tumoral massif. Au Burkina Faso, le problème posé par le CHC est connu depuis de longues années et en 1974, sa fréquence était de 1,73% de l’ensemble des hospitalisés en zone rurale [3].
En Afrique, la majorité des études se sont intéressées aux aspects épidémio-cliniques, thérapeutiques ou évolutifs [4,5]. Par contre, peu d'études ont décrit les aspects échographiques des CHC [6]. En effet, l'application de l'imagerie diagnostique est d'une importance fondamentale dans le dépistage, le diagnostic et le traitement du CHC. Parmi les options d'imagerie diagnostique, l'échographie a un rôle de premier plan. De part ses caractères intrinsèques, elle permet une imagerie en temps réel d’une approche diagnostique précoce du CHC [7].
Le but de cette étude était de décrire les aspects échographiques de CHC et de préciser l’apport de l’échographie dans le diagnostic des CHC dans le contexte burkinabè.
Méthodes
Il s’agit d’une étude prospective descriptive de janvier 2008 à décembre 2009, réalisée dans les services de médecine interne et d’imagerie médicale du CHU Sourô Sanou de Bobo Dioulasso, portant sur 58 cas de CHC.
Ont été inclus les patients de plus de 18 ans suspects de tumeur hépatique et ayant bénéficié d’une exploration échographique, d’un dosage du taux d’alphafoetoprotéine, d’une recherche sérologique de hépatite B (AgHBs) et C (Ac antiVHC), et d’un examen histologique hépatique. Le diagnostic était basé sur un taux élevé de l'alphafoetoprotéine (>500 ng/ml), sur les caractères échographiques des tumeurs et/ou sur la preuve histologique de CHC.
L’examen échographique a été réalisé à l’aide d’un échographe Logic 200 de marque General Electric muni d’une sonde de 3,5 MHZ et de 7,5 MHz. Il a consisté en une analyse abdomino-pelvienne par voie antérieure après un jeûn d’au moins 12 heures. L'analyse échographique a recherché les caractères des tumeurs notamment leur nombre, leur forme, leur taille [8]. Il s’agissait d’une petite tumeur, si son plus grand diamètre était inférieur à 5 cm et d’une grosse tumeur si le diamètre était supérieur ou égal à 5 cm. Lorsque les nodules étaient multiples, le diamètre considéré était celui du plus gros nodule. Les formes diffuses ou infiltrantes à limites imprécises ont été considérées d'emblée comme de grosses tumeurs. L'échogénicité des tumeurs se définissait en hyperéchogène, isoéchogène, hypoéchogène, liquidienne ou mixte. L'exploration échographique a également noté les lésions extra-tumorales associées.
La ponction hépatique était effectuée à l’aiguille fine sous guidage échographique en l’absence de contre-indications. Après la ponction, un contrôle échographique était effectué à la recherche de signes d’hémorragie patente.
Résultats
Caractéristiques épidémiologiques des patients
L’âge moyen des patients était de 45,6±12,5 ans avec des extrêmes de 22 ans et 77 ans. Une nette prédominance masculine a été notée avec 75,7% d’hommes et 24,3% de femmes.
Antécédents et motifs de consultation
Les antécédents les plus fréquents étaient: l’ictère (36,1%), l’alcool (31,9%), et l’hémorragie digestive dans 26,4% des cas. Les douleurs abdominales (83,8%), l’altération de l’état général (79,7%), l’augmentation du volume de l’abdomen (74,3%) et la perception d’une masse abdominale (67,1%) étaient les principaux motifs de consultation.
Données cliniques
Le début de la maladie pour la plupart des patients se situait entre un et trois mois avec 38,3% et pour 32,9%, il se situait au-delà de 6 mois. L’hépatomégalie était le principal signe retrouvé chez 86,5% des malades suivie de l’ascite (51,4%). Le liquide péritonéal était hémorragique dans 34% des cas et d’aspect citrin dans 66% des cas. Les autres signes étaient surtout l’ictère (35,1%) et les oedèmes des membres inférieurs (28,8%).
Données biologiques et cytologiques
Le dosage de l’AFP a été effectué chez 23 patients. L’AFP était supérieure à 500ng/ml, significativement élevé chez 10 patients soit 43,5%. La recherche de l’AgHBs était positive dans 75,5% des cas. Les anticorps anti VHC étaient présents dans 13,6% des cas. La ponction échoguidée hépatique réalisée à l’aiguille fine (n=20) était contributive dans 18 cas (90%) et constituée uniquement de CHC.
Imagerie échographique
L’échographie abdominale était effectuée chez 74 patients et une anomalie suspecte de néoplasie hépatique était décrite chez 58 d’entre eux, soit 78,3% des cas. On distingue: les anomalies hépatiques (tableau 1) et les anomalies extra-hépatiques (tableau 2).
Tableau 1: Différents aspects hépatiques observés à l’échographie.
| Paramètres hépatiques | Nombre de cas | Pourcentage |
|---|---|---|
| Taille | ||
| Normale | 4 | 6,9 |
| Hépatomégalie | 54 | 93,1 |
| Contours | ||
| Réguliers | 6 | 10,3 |
| Irréguliers | 52 | 89,7 |
| Parenchyme | ||
| Homogène | 4 | 6,9 |
| Hétérogène | 54 | 93,1 |
| Nombre de tumeur | ||
| Unique | 16 | 27,6 |
| Multiple | 39 | 67,2 |
| Diffuse | 3 | 5,2 |
| Taille de la tumeur | ||
| Petite | 18 | 31 |
| Grande | 40 | 69 |
| Echogénicité de la tumeur | ||
| Hyperéchogène | 41 | 70,7 |
| Hypoéchogène | 6 | 10,3 |
| Mixte | 6 | 10,3 |
| Pseudo suppurative | 5 | 8,7 |
| Cirrhose | 4 | 6,8 |
Tableau 2: Différentes anomalies extra-tumorales observées à l’échographie.
| Anomalies extra- tumorales | Nombre de cas | Pourcentage |
|---|---|---|
| Ascite | 35 | 60,3 |
| Thrombose ou thrombus | ||
| portale | 35 | 56,8 |
| cave inférieure | 1 | 1,7 |
| Adénopathies | 11 | 18,9 |
| Splénomégalie | 6 | 10,3 |
| Lithiase vésiculaire | 5 | 8,7 |
| Bile (sludge, boue) | 13 | 22,4 |
| Dilatation des voies biliaires | 5 | 8,7 |
| Carcinose péritonéale | 2 | 3,4 |
La figure 1 décrit une image échographique de CHC de forme macro-nodulaire hyperéchogène. La figure 2 décrit une image de CHC de forme pseudo-suppurative et la figure 3 celle d’une forme abcédée.
Figure 1:
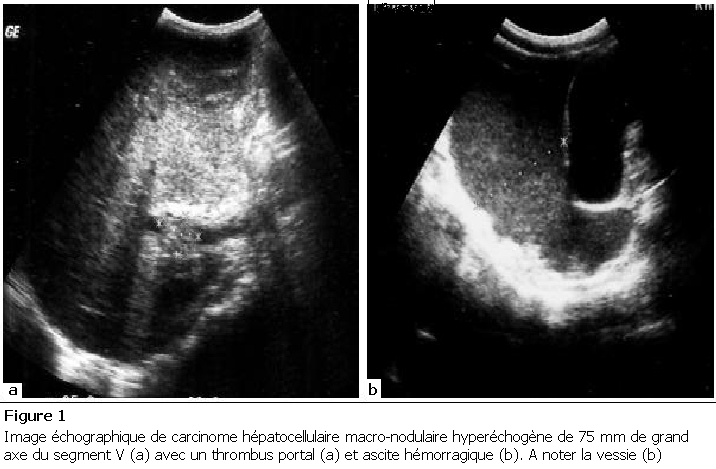
Image échographique de carcinome hépatocellulaire macro-nodulaire hyperéchogène de 75 mm de grand axe du segment V (a) avec un thrombus portal (a) et ascite hémorragique (b). A noter la vessie (b)
Figure 2:
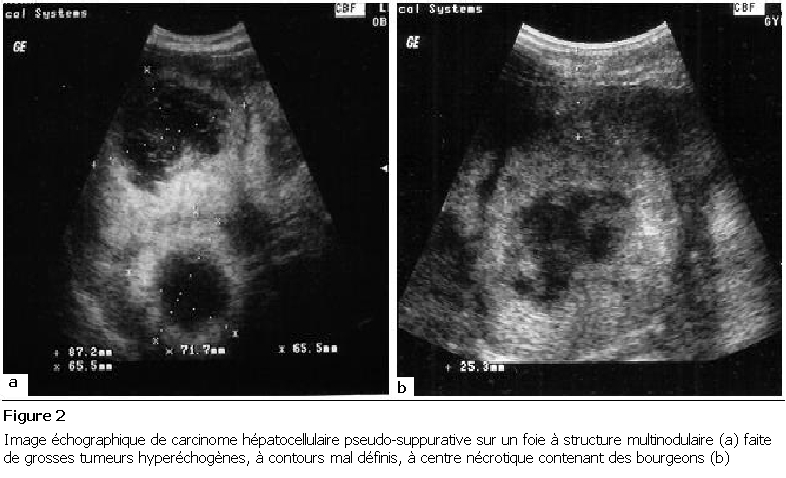
Image échographique de carcinome hépatocellulaire pseudo-suppurative sur un foie à structure multinodulaire (a) faite de grosses tumeurs hyperéchogènes, à contours mal définis, à centre nécrotique contenant des bourgeons (b)
Figure 3:
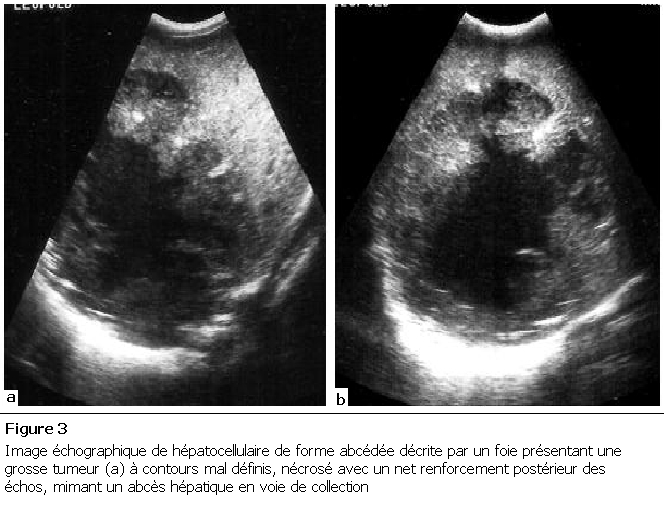
Image échographique de carcinome hépatocellulaire de forme abcédée décrite sur un foie présentant une grosse tumeur (a) à contours mal définis, nécrosée avec un net renforcement postérieur des échos, mimant un abcès hépatique en voie de collection
Discussion
L’exploration échographique a permis une approche diagnostique des différents stades évolutifs des CHC dans notre contexte burkinabè. En effet, notre étude retrouve des tumeurs surtout nodulaires, hyperéchogènes, multiples et à majorité de grande taille, caractères conformes à ceux retrouvés par N’Gbesso en Côte d’Ivoire [6]. Au contraire dans les séries occidentales, les CHC sont de petites lésions nodulaires de moins de 3 cm, isolées qui augmentent progressivement de taille et plus fréquemment hypoéchogènes et homogènes [1,9,10]. L'un des arguments pour expliquer cette différence, est la détection précoce et la petite taille des CHC observés dans ces pays de haute technicité des moyens d’imagerie médicale, en particulier dans la population à risque des cirrhotiques. Les CHC de petite taille sont surtout hypoéchogènes dans 55,5% des cas et les gros CHC surtout hyperéchogènes [9,10]. Il semblerait que beaucoup de petits CHC hypoéchogènes au début, deviennent secondairement de gros CHC Page number not for citation purposes 4 hyperéchogènes (36% des cas), et les rares petits CHC hyperéchogènes gardent généralement leur aspect en devenant de grosses tumeurs dans 4% des cas [9]. Ces auteurs concluent que l’échogénicité des petits carcinomes hépatocellulaires augmente avec la croissance de la tumeur, et reste inchangée quand ils n'augmentent pas de taille [9,10].
Du fait de l'absence de suivi évolutif et la découverte tardive de la maladie, la majorité de nos CHC étaient de grosses tumeurs hyperéchogènes et constituent une particularité du sujet noir africain. Cependant, Cottone dans une étude italienne rapporte des aspects échographiques de CHC superposables aux nôtres. Dans son étude, les patients porteurs de CHC étaient à 80% AgHbs positifs et à 17% alcooliques [9]. Ce contexte épidémiologique est donc superposable à celui de notre étude oU+00F9 nous avons noté 75,5% patients AgHbs positifs et 23 patients (31,9%) alcooliques avérés. Dans ce contexte épidémiologique, l'âge jeune de nos patients de 45,6 ans et la prédominance masculine sont superposables aux données de la littérature africaine [4-6]. Ces résultats tendent à conférer au CHC le statut de pathologie masculine. Cela pour plusieurs raisons. La consommation d’alcool et la prévalence des hépatites virales chroniques B et C plus élevées chez l’homme que chez la femme seraient incriminées.
Dans notre étude, une forme particulière de CHC est à souligner de même que dans la série de N’Gbesso [6]. C’est la forme suppurative ou à type d’abcès non collecté notée chez cinq de nos patients et qui était étiquetée d’abcès amibien du foie. Elle n’est pas signalée dans la plupart des séries occidentales [1,9,10]. Mais l’absence d’évolutivité clinique et échographique orientent vers un caractère suspect et imposent la réalisation d’explorations complémentaires tel le dosage de l'AFP, l’histologie ou la cytologie après ponction écho-guidée. La technique est reconnue par tous les auteurs, sans danger et fiable lorsqu'elle est réalisée par un opérateur expérimenté et à l'aiguille fine [11]. Renard n'a observé aucune différence significative entre les résultats obtenus par l'analyse cytologique et ceux obtenus par l'analyse histologique [12]. Toutefois, l'histologie n'est requise que lorsque la nature de la lésion hépatique est douteuse [11].
Maringhini qui étudiait la précision de l'échographie par rapport à l'AFP dans le diagnostic du carcinome hépatocellulaire avec une suspicion clinique de CHC a trouvé pour l’échographie une sensibilité de 90% et une spécificité de 93,3% [13]. Pour un taux sérique d’AFP Z à 500 ng/ml, ou exagérément élevé, la spécificité était de 100% et signe le diagnostic de CHC [13,14]. Mais aucune relation entre l’échographie et les concentrations sériques d’AFP n’a été démontrée. L’utilisation de l’AFP comme test de dépistage pour le CHC précoce est remise en question en raison de sa faible sensibilité (39% à 64%) et la valeur prédictive positive (9% à 32%) malgré sa spécificité (76% à 91%) [15]. De plus on peut observer des taux élevés d'AFP sans qu’il existe un CHC dans les situations suivantes : la grossesse, la mucoviscidose, une hépatite aiguëu ou chronique active ou une cirrhose et, plus rarement dans certains cancers (gastrique, pancréatique, biliaire, testiculaire non séminomateux) [1].
L'examen du foie cirrhotique chez quatre de nos patients était difficile, concernant la reconnaissance des nodules de régénération et de petits carcinomes hépatocellulaires. Ceci est également décrit dans une étude de Jakab [7]. Cette différenciation est d’autant plus délicate qu’un nodule tumoral peut apparaîe au sein d’un nodule de régénération [1].
Dans une étude récente visant à évaluer la valeur diagnostique de l'échographie de contraste (EDC) rapport par à échographie Doppler et l'AFP dans le diagnostic des lésions focales hépatiques de la cirrhose, D'Onofrio a démontré que l’EDC permettait de caractériser de faU+00E7on précise ces lésions dans 96,6% des cas. Cette valeur était supérieure à celles notées pour l’échographie (72,0%), l’écho-Doppler (70,0%), le taux de l'AFP (65,7%), la combinaison de l’échographie et de l’'AFP (90,3%) [16]. La différence entre l’échographie et l’EDC était statistiquement significative. L’EDC devrait donc être utilisée pour caractériser les lésions hépatiques focales détectées pendant la surveillance des patients cirrhotiques. L’échographie de contraste est une technique prometteuse, mais ses conditions de mise en oeuvre sont lourdes dans notre milieu burkinabè.
Dans notre étude, la thrombose portale était décrite dans 56,9% des cas. Ces chiffres sont très proches de ceux trouvés par Llovet [17] qui rapportait une thrombose portale dans la moitié des cas. Elle témoigne du stade avancé de la maladie dans notre série. L’incidence de l’invasion portale est parallèle à la taille et le nombre des tumeurs. Cette invasion serait de 60 à 90% pour les nodules supérieurs à 5 cm et de 47% pur les tumeurs multiples [1,18].
Conclusion
Au Burkina Faso, le CHC est de préférence nodulaire, hyperéchogène et de taille variable, souvent grosse, avec une forme particulière pseudo abcédée. Parmi les options d'imagerie diagnostique, l'échographie a un rôle de premier plan. De par ses caractères intrinsèques, elle est d'une grande contribution dans le diagnostic des CHC, et constitue parfois la seule approche diagnostique d’autant plus que les examens anatomopathologiques sont souvent inaccessibles. L’échographie peut en outre aider à améliorer le diagnostic des CHC par le développement de la pratique des ponctions biopsiques avec examens cytologiques et/ou histologiques qui sont plus fiables que le dosage de l'AFP.
Conflits d’intérêt
Les auteurs ne déclarent aucun conflit d’intérêts.
Contribution des auteurs
Exploration échographique: Nikièma Z, Prise en charge médicale des patients: Sawadogo A et Kyelem CG, Rédaction du manuscrit: Nikièma Z et Kyelem CG.
Patient consent
Written informed consent was obtained from the patient for publication of this case report and a copy of it is available for review by the Editor-in-Chief of this journal.
Competing interests
No competing interests are involved in this case report
References
- 1.Fartoux L, Desbois-Mouton C, Rosmorduc O. Carcinome hépatocellulaire : épidémiologie, physiopathologie et diagnostic. EMCHépatologie. 2009;7-038-A-18 [Google Scholar]
- 2.Nordenstedt H, White DL, El-Serag HB. The changing pattern of epidemiology in hepatocellular carcinoma. Dig Liver Dis. 2010 Jul;43(Suppl 3):S20623–14. doi: 10.1016/S1590-8658(10)60507-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Gendron Y, Josserand O. Le cancer primitif du foie dans un hôpital rural en Haute-Volta: A propos de 61 cas en 3 ans. Médecine tropicale. 1974;34:92–93. [Google Scholar]
- 4.Diarra M, Konaté A, Dembélé M, Koné B, Wandji MJ, Maiga MY. et al. Carcinome hépatocellulaire : Aspects épidémiologiques, cliniques et évolutifs. Médecine d'Afrique Noire. 2006;1(53):23–28. [Google Scholar]
- 5.Ibara JR, Ossendza RA, Okouo M, Deby Gassaye, Ngoma Ph. Les cancers primitifs du foie au Congo : étude hospitalière de 558 cas. Médecine d'Afrique Noire. 1999;46((8/9)):394–397. [Google Scholar]
- 6.N'Gbesso RD, Attia A, Mahassadi A, Kanga N, Yoman TN, Kéita AK, Manlan KL. Cancer hépatocellaires (CHC) observés à Abidjan : aspects et place de l’échographie. Journal de Radiologie. 1998;79(5):409–414. [PubMed] [Google Scholar]
- 7.Jakab Z. Diagnostic imaging for the screening of hepatocellular carcinoma. Orv Hetil. 2010 Jul 4;151(27):1083–90. doi: 10.1556/OH.2010.28912. [DOI] [PubMed] [Google Scholar]
- 8.Llovet JM, Bru C, Bruix J. Prognosis of hépatocellular carcinoma: the BCLC stating classification. Semin Liver Dis. 1999;19:329–338. doi: 10.1055/s-2007-1007122. [DOI] [PubMed] [Google Scholar]
- 9.Cottone M, MarcenU+00F2 MP, Maringhini A, Rinaldi F, Russo G, Sciarrino E, Turri M, Pagliaro L. Ultrasound in the diagnosis of hepatocellular carcinoma associated with cirrhosis. Radiology. 1983;147(2):517–519. doi: 10.1148/radiology.147.2.6300963. [DOI] [PubMed] [Google Scholar]
- 10.Mazzola G, Virdone R, Orlando A, Tuni M, Caltagirone M, Fusco G, Parisi P, Cottone M. Evolution of the echographic picture in primary liver tumor associated with cirrhosis. Radiol Med. 1989;77(5):488–492. [PubMed] [Google Scholar]
- 11.Assy N, Nasser G, Djibre A, Beniashvili Z, Zidan J. Characteristics of common solid liver lesions and recommendations for diagnostic workup. World J Gastroenterol. 2009;15(26):3217–3227. doi: 10.3748/wjg.15.3217. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Renard P, Minault S, Aucouturier JP, Pluot M, Faroux MJ, Zeitoun P. Ponctions échoguidées des masses hépatiques : la cytologie n'estelle pas suffisante ?. Gastroenterol Clin Biol. 1992;16:473–474. [PubMed] [Google Scholar]
- 13.Maringhini A, cottone M, Sciarrino E, Marcenó MP, La Seta F, Fusco G, Rinaldi F, Pagliaro L. Ultrasonography and alpha-fetoprotein in diagnosis of hepatocellular carcinoma in cirrhosis. Dig Dis Sci. 1988;33(1):47–51. doi: 10.1007/BF01536630. [DOI] [PubMed] [Google Scholar]
- 14.Johnson JP, Leung N, Cheng P, Welby C, Leung WT, Lau WY, Yu S, Ho S. ‘Hepatoma-specific’ alphafetoprotein may permit preclinical diagnosis of malignant change in patients with chronic liver disease. British Journal of Cancer. 1997;75(2):236–240. doi: 10.1038/bjc.1997.39. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Sherman M. Surveillance for hepatocellular carcinoma. Semin Oncol. 2001;28:450–459. doi: 10.1016/s0093-7754(01)90138-1. [DOI] [PubMed] [Google Scholar]
- 16.D'Onofrio M, Faccioli N, Zamboni G, MalagU+00F2 R, Caffarri S, Fattovich G, Mucelli RP. Focal liver lesions in cirrhosis: value of contrastenhanced ultrasonography compared with Doppler ultrasound and alpha-fetoprotein levels. Radiol Med. 2008 Oct;113(7):978–91. doi: 10.1007/s11547-008-0316-z. [DOI] [PubMed] [Google Scholar]
- 17.Llovet JM, Beaugrand M. Hepatocellular carcinoma: present status, and future prospects. Journal of hepatology. 2003;38:136–149. doi: 10.1016/s0168-8278(02)00432-4. [DOI] [PubMed] [Google Scholar]
- 18.Kim BK, Han KH, Park YN, Park MS, Kim KS, Choi JS, Moon BS, Chon CY, Moon YM, Ahn SH. Prediction of microvascular invasion before curative resection of hepatocellular carcinoma. J Surg Oncol. 2008 Mar 1;97(3):246–52. doi: 10.1002/jso.20953. [DOI] [PubMed] [Google Scholar]


