Résumé
Objectif
Présenter aux médecins de famille un résumé clinique pratique des lignes directrices canadiennes sur l’utilisation sécuritaire et efficace des opioïdes pour la douleur chronique non cancéreuse, produites par le National Opioid Use Guideline Group.
Qualité des données
Pour produire les lignes directrices, les chercheurs ont effectué une synthèse critique de la littérature médicale sur l’efficacité et l’innocuité des opioïdes pour la douleur chronique non cancéreuse et ont rédigé une série de recommandations. Un panel de 49 cliniciens experts de toutes les régions du Canada ont passé en revue l’ébauche et ont atteint un consensus sur 24 recommandations.
Message principal
Il est recommandé de faire un dépistage du risque de dépendance avant de prescrire des opioïdes. On recommande des opioïdes faibles (codéine et tramadol) pour une douleur de légère à modérée qui n’a pas répondu aux traitements de première intention. On peut essayer l’oxycodone, l’hydromorphone et la morphine chez les patients qui n’ont pas eu de soulagement avec des opioïdes plus faibles. Une faible dose initiale et une lente hausse du titrage sont recommandées, ainsi qu’une étroite surveillance du patient qu’on a d’abord renseigné. Les médecins doivent surveiller l’apparition de complications comme l’apnée du sommeil. La dose optimale est celle qui améliore le fonctionnement ou atténue les cotes d’évaluation de la douleur d’au moins 30 %. Pour la grande majorité des patients, la dose optimale sera bien en deçà de l’équivalent de 200 mg de morphine par jour. On recommande le sevrage progressif pour les patients qui n’ont pas répondu à un essai d’opioïdes adéquat.
Conclusion
Les opioïdes jouent un rôle important dans la prise en charge de la douleur chronique non cancéreuse, mais il faut en prescrire avec prudence pour limiter les dommages potentiels. Les nouvelles lignes directrices canadiennes offrent des conseils dont les médecins avaient grand besoin pour les aider à en arriver à un juste équilibre entre le contrôle optimal de la douleur et la sécurité.
Les ordonnances d’opioïdes ont connu une hausse dramatique au cours des dernières années. Par exemple, les prescriptions d’oxycodone aux bénéficiaires de l’assurance-médicaments en Ontario ont augmenté de 850 % de 1991 à 2007, passant de 23 prescriptions par 1 000 personnes par année à 197 prescriptions par 1 000 personnes par année1. La quantité moyenne par prescription est passée de 1 830 mg à 2 280 mg. Les prescriptions d’autres opioïdes, en particulier le fentanyl, ont aussi augmenté. Ces hausses se sont accompagnées d’une augmentation des problèmes liés aux opioïdes comme la dépendance et la surdose2.
Élaboration des lignes directrices
En 2008, un groupe de recherche dont les membres ont été choisis par la Fédération des ordres des médecins du Canada a effectué une révision systématique de la littérature médicale sur l’efficacité et les effets indésirables des opioïdes3. Les chercheurs ont produit une ébauche initiale de recommandations qui a été examinée par le Panel consultatif national, un groupe de 49 experts en médecine familiale, en physiatrie, en médecine de la toxicomanie et d’autres disciplines. À la suite de 4 rondes de révisions, le Panel consultatif national a atteint un consensus sur 24 recommandations.
Qualité des données
Le groupe de recherche s’est basé sur une mise à jour d’une méta-analyse réalisée en 2006 d’études contrôlées sur l’efficacité analgésique des opioïdes pour la douleur chronique non cancéreuse (DCNC)4. De plus, plusieurs recherches documentaires ciblées ont cerné des études sur l’efficacité à long terme des opioïdes, les complications médicales, l’usage problématique des opioïdes et l’utilisation des opioïdes dans des populations spécifiques. Les révisions ciblées incluaient des études de différents types sur les patients adultes qui prenaient des opioïdes d’ordonnance pour la DCNC. Au total, on a identifié 10 798 études dans les ouvrages spécialisés et 183 répondaient aux critères d’inclusion. Les recommandations finales ont été cotées selon le niveau des données probantes.
Message principal
Cet article présente un bref résumé clinique des lignes directrices nationales5, y compris des recommandations concernant les indications du recours aux opioïdes, la sélection, le titrage, les précautions et la surveillance. Le document ne porte pas sur d’autres éléments importants du traitement de la DCNC, comme les médicaments autres que les opioïdes, les traitements physiques ou psychothérapeutiques. Un document complémentaire (page e419) résume les recommandations des lignes directrices portant sur des populations particulières6. Le texte intégral des lignes directrices se trouve à www.nationalpaincentre.mcmaster.ca5.
Indications
On devrait réserver l’utilisation des opioïdes aux patients qui n’ont pas bien répondu aux traitements avec des agents non opioïdes, lorsqu’il est démontré que les opioïdes sont efficaces pour leurs problèmes somatiques ou neuropathiques spécifiques. Les données scientifiques qui justifient l’utilisation des opioïdes pour des douleurs courantes comme la fibromyalgie ou les maux au bas du dos sont limitées (Tableau 1)5. Si le tramadol (considéré par plusieurs comme un opioïde faible) apporte des bienfaits modestes pour la fibromyalgie7,8, des opioïdes forts comme l’oxycodone ou la morphine n’ont pas fait l’objet d’études pour ce problème et ne sont pas recommandés9. Des synthèses critiques ont conclu que les opioïdes ne devraient pas être utilisés systématiquement pour les douleurs au bas du dos ou d’autres problèmes arthritiques en raison de l’incertitude entourant leur efficacité à long terme10, du risque d’abus11 et de leurs effets secondaires considérables12,13. On recommande plutôt pour les douleurs chroniques au bas du dos de l’acétaminophène, des anti-inflammatoires non stéroïdiens, l’éducation des patients, des exercices pour le dos et la thérapie comportementale14.
Tableau 1.
Données probantes à l’appui de l’efficacité des opioïdes
|
EXEMPLES DE PROBLÈMES DE DCNC POUR LESQUELS L’EFFICACITÉ DES OPIOÏDES A ÉTÉ DÉMONTRÉE DANS DES ÉTUDES CONTRÔLÉES CONTRE PLACEBO* |
EXEMPLES DE PROBLÈMES DE DCNC QUI N’ONT PAS ÉTÉ ÉTUDIÉS DANS DES ÉTUDES CONTRÔLÉES CONTRE PLACEBO SUR LES OPIOÏDES | |
|---|---|---|
| TRAMADOL SEULEMENT | OPIOÏDE FAIBLE OU PUISSANT | |
|
|
|
DCNC—douleur chronique non cancéreuse
Ces études étaient limitées par la courte durée de la thérapie aux opioïdes (maximum de 3 mois).
Reproduction de National Opioid Use Guideline Group5
Évaluation repère
Le médecin doit déterminer la cause et le type de douleur (neuropathique, nociceptive ou mixte) en procédant à un bilan rigoureux de la douleur, à un examen physique et à des investigations appropriées (Encadré 1)5. Le médecin doit s’enquérir de l’intensité de la douleur (sur une échelle de 11 points selon laquelle 0 représente aucune douleur et 10 la pire douleur possible), des facteurs qui aggravent ou soulagent la douleur et des effets de la douleur sur les activités quotidiennes. De brefs questionnaires, comme la version abrégée du Questionnaire McGill sur la douleur15 ou le Brief Pain Inventory (accessible en ligne à www.algosresearch.org/PracticeTools/DxTestForms/index.html)16, peuvent être utiles pour surveiller les progrès. On devrait questionner les patients sur les antécédents personnels ou familiaux d’usage problématique de substances et au sujet de la consommation actuelle d’alcool, de cannabis, d’opioïdes, de benzodiazépines, de produits sédatifs en vente libre et de drogues illicites. Des questionnaires ou des tests d’urine de dépistage peuvent aussi aider à identifier les patients à risque élevé; on donne des sources d’information et des renseignements additionnels à ce sujet dans l’article complémentaire à la page e4196. Les médecins devraient aussi s’informer de l’humeur et du soutien social du patient, facteurs qui peuvent influencer la perception de la douleur.
Encadré 1. Évaluation repère de la douleur chronique non cancéreuse chez le patient.
|
Reproduction de National Opioid Use Guideline Group5
Amorce d’une thérapie aux opioïdes
Les médecins doivent passer en revue avec le patient les objectifs de la thérapie aux opioïdes et les effets secondaires courants avant d’amorcer le traitement (Encadré 2)5. Les médecins devraient insister sur le fait que l’élimination de la douleur est improbable; un but réaliste d’une thérapie aux opioïdes est d’améliorer le fonctionnement ou de réduire la douleur de 30 % ou plus. On doit aussi revoir les complications médicales potentielles, y compris la dysfonction sexuelle17,18, l’hyperalgésie induite par les opioïdes17,19 et l’apnée du sommeil20–22. Il faut avertir les patients d’éviter l’alcool et les sédatifs (en particulier durant le titrage) et de demander une assistance médicale urgente s’ils ressentent des signes précoces de surdose comme «cogner des clous» ou des troubles de l’élocution. Les patients devraient toujours garder leurs opioïdes dans un endroit sécuritaire, hors de portée des amis ou de la famille. Il n’y a que de faibles données probantes23 qui appuient le recours à des ententes sur les traitements aux opioïdes (Encadré 3)24, mais elles peuvent être envisagées avec des patients que le médecin ne connaît pas bien ou qui sont à risque plus élevé d’usage abusif.
Encadré 2. Renseignements sur les opioïdes pour les patients: Ces messages peuvent servir à produire du matériel d’information à l’intention des patients.
Les opioïdes forment un groupe de médicaments semblables qui sont utilisés pour soulager la douleur. Il existe plusieurs types d’opioïdes qui portent des noms différents (par exemple, Percocet, OxyContin, Tylenol No 2 et Tramacet).
|
Reproduction de National Opioid Use Guideline Group5
Encadré 3. Modèle d’entente sur le traitement aux opioïdes.
Je comprends que j’obtiens une prescription d’opioïdes du Dr _______________ pour traiter la douleur. J’accepte ce qui suit :
Je comprends que si je ne respecte pas ces conditions, le Dr _______________ peut décider de ne plus me prescrire d’opioïdes. |
Reproduction de Kahan et collab.24
Benzodiazépines: Les benzodiazépines sont souvent impliquées dans les décès par surdose d’opioïdes25 et ils baissent considérablement la dose létale des opioïdes26. Par conséquent, il y a lieu de titrer plus lentement les opioïdes, avec des augmentations plus petites de la dose, chez les patients qui prennent aussi des benzodiazépines. On devrait envisager un sevrage progressif des benzodiazépines avant de commencer une thérapie aux opioïdes (Encadré 4)5,27, en particulier pour les patients qui prennent des doses quotidiennes de modérées à élevées (p. ex. 20 mg de diazépam ou 4 mg de lorazépam ou de clonazépam)5. On peut très bien réussir un sevrage des benzodiazépines en milieu de soins primaires28–31; les symptômes psychiatriques et le sommeil s’améliorent ou restent stable avec le sevrage30,32–34. Des précautions semblables devraient être prises pour d’autres médicaments sédatifs.
Encadré 4. Sevrage progressif de la benzodiazépine.
|
Reproduction de National Opioid Use Guideline Group5
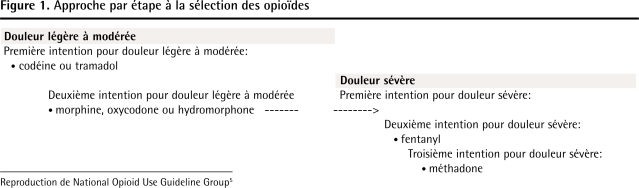
Opioïdes de première intention: Si le médecin décide de commencer une thérapie aux opioïdes, la codéine ou le tramadol sont suggérés comme options de première intention pour la DCNC de légère à modérée, car ils ont des taux moins élevés de surdose, d’usage abusif et de dépendance que les opioïdes plus puissants1,35–37 et des études contrôlées4 ont démontré leur efficacité pour la DCNC (Figure 1)5.
Figure 1.
Approche par étape à la sélection des opioïdes
Reproduction de National Opioid Use Guideline Group5
Opioïdes de deuxième intention: Si un essai adéquat de codéine ou de tramadol ne réussit pas à soulager considérablement la douleur ou produit des effets secondaires substantiels, on recommande alors la morphine, l’oxycodone ou l’hydromorphone comme traitement de deuxième intention. Il faut utiliser avec prudence la morphine avec les patients qui ont une insuffisance rénale38 (Tableau 2)5. Il faut faire attention avec l’oxycodone et l’hydromorphone chez les patients à risque élevé d’usage abusif et de dépendance (voir l’article complémentaire page e419)6. La dose initiale de fentanyl transdermique (25 μg/h) peut causer une surdose chez les patients qui n’ont pas de tolérance complète aux opioïdes. Par conséquent, il ne faut utiliser le fentanyl qu’avec les patients qui ont pris des doses d’opioïdes correspondant à des doses équivalentes de morphine (DEM) de 60 à 100 mg par jour pendant au moins 2 semaines. Il ne faut pas passer directement de la codéine au fentanyl, parce que jusqu’à hauteur de 10 % des patients blancs ne produisent pas l’enzyme P450 2D6 (CYP 2D6) qui convertit la codéine en morphine et, par conséquent, ils peuvent ne pas avoir acquis de tolérance aux opioïdes39–41. La méthadone présente un risque élevé de surdose en raison de sa longue demivie42,43; elle ne peut être prescrite pour la douleur que si le médecin a reçu une exemption spéciale de Santé Canada. La mépéridine n’a pas de rôle dans la prise en charge de la DCNC; elle a une mauvaise biodisponibilité orale et son administration par voie parentérale peut causer une crise d’épilepsie ou d’autres incidents neurologiques44.
Tableau 2.
Questions de sécurité à prendre en compte dans le choix des opioïdes
| AGENT | QUESTIONS DE SÉCURITÉ* |
|---|---|
| Codéine | Ne pas prescrire pendant plus de 4 jours aux femmes qui allaitent: certaines femmes convertissent rapidement la codéine en morphine pouvant causer une toxicité néonatale. Risque général plus faible de surdose et de dépendance qu’avec des opioïdes plus forts. |
| Tramadol | Associé à des crises d’épilepsie chez les patients à risque élevé d’épilepsie ou quand il est combiné à des médicaments qui augmentent les niveaux de sérotonine (p. ex. ISRS). Plus faible risque de surdose et de dépendance qu’avec des opioïdes plus forts. |
| Morphine | Un métabolite de la morphine peut s’accumuler jusqu’à des niveaux toxiques chez les patients ayant une insuffisance rénale. |
| Oxycodone, hydromorphone | Utiliser avec précaution avec les patients à risque plus élevé d’usage abusif et de dépendance aux opioïdes. |
| Fentanyl | Avant de prescrire du fentanyl, questionner le patient à propos de son usage d’opioïdes durant les 2 semaines précédentes; pour assurer une tolérance complète, le patient devrait prendre une DEM quotidienne d’au moins 60 à 90 mg à heures fixes pendant au moins 2 semaines, au moins 2 fois par jour pour les opioïdes à LC et au moins 4 fois par jour pour les opioïdes à LI. Ne pas passer de la codéine au fentanyl, quelle que soit la dose de codéine; certains patients n’ont qu’une faible ou aucune tolérance aux opioïdes même s’ils prennent régulièrement de la codéine. Maintenir la dose initiale pendant au moins 6 jours; prendre des précautions additionnelles avec les patients à risque élevé de surdose (p. ex. les patients plus âgés, ceux qui prennent des benzodiazépines). Donner au patient les conseils suivants:
|
| Méthadone | Ne prescrire de la méthadone que si vous détenez une exemption par écrit de Santé Canada. Le titrage présente un danger en raison de sa très longue demi-vie qui entraîne une bioaccumulation. |
| Mépéridine | Non recommandé pour la DCNC:
|
| Combinaisons d’acétaminophène et d’opioïdes | Utiliser avec prudence pour éviter une toxicité de l’acétaminophène; pas plus de 3,2 g d’acétaminophène pour adultes, ce qui équivaut à 10 comprimés par jour pour les combinaisons codéine-acétaminophène ou oxycodoneacétaminophène; pas plus de 8 comprimés par jour pour les combinaisons tramadol-acétaminophène. Avertir les buveurs excessifs de ne pas combiner l’alcool avec l’acétaminophène. |
| Formules à LC | Procéder prudemment au titrage; les comprimés à LC contiennent des doses plus élevées d’opioïdes que les formules à LI et peuvent aisément être convertis en LI en croquant ou en écrasant le comprimé. |
| Opioïdes par voie parentérale | Non recommandé pour la DCNC:
|
DCNC—douleur chronique non cancéreuse, LC—libération contrôlée, LI—libération immédiate, DEM—dose équivalente de morphine, ISRS—inhibiteur sélectif du recaptage de la sérotonine.
Consulter la monographie de chaque médicament pour des renseignements complets sur la sécurité27.
Adaptation de National Opioid Use Guideline Group5
Opioïdes à libération immédiate (LI): On utilise les opioïdes à libération immédiate pour le titrage initial et l’accès douloureux transitoire. On peut aussi les substituer aux opioïdes à libération contrôlée (LC) pour la douleur récurrente qui ne dure que quelques heures ou moins ou pour la douleur liée à l’activité.
Les opioïdes à libération contrôlée: Pour les patients qui éprouvent de la douleur toute la journée, les opioïdes à LC peuvent offrir un soulagement plus constant de la douleur que les opioïdes à LI. Il faut être prudent avec les comprimés à LC parce qu’ils contiennent des doses bien plus grandes d’opioïdes que les combinaisons d’acétaminophène et d’opioïdes (p. ex. 1 comprimé de 80 mg d’OxyContin est l’équivalent de 16 comprimés de Percocet). L’euphorie, la sédation et la surdose sont fonction de la dose d’opioides45–47.
Titrage initial: Il faut procéder lentement au titrage des opioïdes chez les patients souffrant de DCNC pour minimiser le risque de toxicité aiguë (Tableau 3)5. On suggère une dose initiale ne dépassant pas une DEM de 5 à 10 mg 4 fois par jour et des augmentations de la dose d’au plus 5 à 10 mg par semaine. Le titrage doit être plus lent chez les personnes âgées que chez les plus jeunes patients, parce qu’ils sont à risque plus élevé de toxicité aiguë (voir l’article complémentaire page e419)6.
Tableau 3.
Dose et titrage initiaux d’opioïdes par voie orale suggérés pour la DCNC
| OPIOÏDE | DOSE INITIALE | INTERVALLE DE TEMPS RECOMMANDÉ AVANT UNE HAUSSE | HAUSSE DE LA DOSE SUGGÉRÉE | DOSE MINIMALE QUOTIDIENNE AVANT DE PASSER DE LA LI À LA LC |
|---|---|---|---|---|
| Codéine | 15 à 30 mg aux 6 h | 7 j | 15 à 30 mg/j jusqu’à 600 mg/j | 100 mg |
| Codéine à LC | 50 mg aux 12 h | 2 j | 50 mg/j jusqu’à un maximum de 300 mg aux 12 h | SO |
| Tramadol-acétaminophène |
|
7 j | 1 comprimé aux 4 à 6 h jusqu’à 8 comprimés/j | 3 comprimés |
| Tramadol à LC | ||||
| • Zytram | 150 mg aux 24 h | 7 j | 400 mg/j au maximum | SO |
| • Tridural | 100 mg aux 24 h | 2 j | 300 mg/j au maximum | SO |
| • Ralivia | 100 mg aux 24 h | 5 j | 300 mg/j au maximum | SO |
| Morphine à LI | • 5 à 10 mg aux 4 à 6 h | 7 j | 5 à 10 mg/j | 20 à 30 mg |
| • maximum de 40 mg/j | ||||
| Morphine à LC | • 10 à 20 mg: 1, 2 ou 3 fois par jour | 14 j | 5 à 10 mg/j | SO |
| • maximum de 40 mg/j | ||||
| Oxycodone à LI | • 5 mg aux 4 à 6 h | 7 j | 5 mg/j | 20 mg |
| • maximum de 30 mg/j | ||||
| Oxycodone à LC | • 10 mg 2 à 3 fois par jour | 14 j | 10 mg/j | SO |
| • maximum de 30 mg/j | ||||
| Hydromorphone à LI | • 1 à 2 mg aux 4 à 6 h | 7 j | 1 à 2 mg/ | 6 mg |
| • maximum de 8 mg/j | ||||
| Hydromorphone à LC (Hydromorph Contin) | • 3 mg 2 à 3 fois par jour | 14 j | 2 à 4 mg/ | SO |
| • maximum de 9 mg/j |
DCNC—douleur chronique non cancéreuse, LC—libération contrôlée, LI—libération immédiate, SO—sans objet.
Adaptation de National Opioid Use Guideline Group
Doses pour accès douloureux transitoires: Dans la plupart des cas, la dose quotidienne pour les accès douloureux transitoires ne devrait pas dépasser 10 % à 20 % de la dose quotidienne totale. L’opioïde à LC peut être augmenté si le patient utilise constamment des doses pour accès douloureux transitoire à maintes reprises durant la journée. Des doses quotidiennes multiples pour accès douloureux transitoire ne sont habituellement pas nécessaires à moins que le patient souffre de douleur neuropathique sévère ayant des exacerbations imprévisibles. De plus, des opioïde à LI peuvent être utilisés juste avant des activités dont on sait qu’elles causent de graves exacerbations de la douleur; on devrait aussi avoir recours à la modification et à la gradation des activités.
Visites au cabinet: À chaque visite au cabinet durant le titrage, il faut évaluer l’intensité de la douleur à l’aide de l’échelle numérique à 11 points (de 0 à 10). Les opioïdes ont une puissance analgésique graduelle, alors si la douleur répond aux opioïdes, le patient éprouvera une petite réduction de l’intensité de la douleur à chaque augmentation de la dose. Pour la douleur nociceptive, l’intensité de la douleur devrait être mesurée au repos et en activité. Le médecin devrait aussi s’enquérir à chaque visite des effets secondaires, de la conformité à la prescription et des changements sur le plan de l’humeur et des activités quotidiennes. L’outil Brief Pain Inventory peut aider à faire cette évaluation16.
Dose optimale: On atteint la dose optimale quand le patient voit une amélioration de son fonctionnement ou une réduction de sa douleur d’au moins 30 % (environ 2 points sur l’échelle de 11 points), avec un bienfait analgésique minimal après 1 ou 2 augmentations additionnelles de la dose sans effets secondaires ou complications graves48. Pour la très grande majorité des patients ayant une DCNC, le dosage optimal se situe bien en deçà d’une DEM de 200 mg par jour (Tableau 4)5,27,49.
Tableau 4.
Table de conversion analgésique des opioïdes oraux en fonction de la dose par voie orale pour la douleur chronique non cancéreuse: A) Équivalence de 30 mg de morphine par voie orale; B) Équivalence entre la morphine par voie orale et le fentanyl par voie transcutanée
| A) | |||
|---|---|---|---|
| OPIOÏDE | ÉQUIVALENCE DE 30 MG DE MORPHINE PAR VOIE ORALE | POUR CONVERTIR À L’ÉQUIVALENT DE MORPHINE PAR VOIE ORALE, MULTIPLIER PAR | POUR CONVERTIR DE LA MORPHINE PAR VOIE ORALE, MULTIPLIER PAR |
| Morphine | 30 mg | 1 | 1 |
| Codéine | 200 mg | 0.15 | 6,67 |
| Oxycodone | 20 mg | 1.5 | 0,667 |
| Hydromorphone | 6 mg | 5 | 0,2 |
| Mépéridine | 300 mg | 0.1 | 10 |
| Méthadone et tramadol | Équivalence en dose de morphine non établie de manière fiable | ||
| B) FENTANYL PAR VOIE TRANSDERMIQUE* | MORPHINE |
|---|---|
| 25 μg/h | 60 à 134 mg |
| 37 μg/h | 135 à 179 mg |
| 50 μg/h | 180 à 224 mg |
| 62 μg/h | 225 à 269 mg |
| 75 μg/h | 270 à 314 mg |
| 87 μg/h | 315 à 359 mg |
| 100 μg/h | 360 à 404 mg |
Parmi les formulations disponibles, il y a des timbres de 12, 25, 50, 75 et 100-μg/h, mais le timbre de 12 μg/h est généralement utilisé pour ajuster la dose plutôt que pour initier un traitement au fentanyl. Adaptation de National Opioid Use Guideline Group5. Données du Compendium des produits et spécialités pharmaceutiques et de Pereira et collab.49 Les ouvrages spécialisés font état de grandes variations. Ces équivalences désignent la puissance analgésique des opioïdes oraux et non pas les effets psychoactifs ou l’efficacité dans le soulagement des symptômes de sevrage.
Doses supérieures à une DEM de 200 mg: Les lignes directrices conseillent de faire une réévaluation rigoureuse si la dose approche une DEM de 200 mg (la dose «à surveiller»). Le médecin doit revoir le diagnostic sous-jacent, la nécessité d’investigations additionnelles ou d’une demande de consultation, la réponse du patient aux opioïdes et les complications médicales liées à la dose. Le seuil de 200 mg en DEM a été choisi parce que la plupart des patients ont besoin d’une dose considérablement moindre que celle-ci; la dose moyenne d’opioïdes utilisée dans les études contrôlées 4 était de 66 mg pour l’oxycodone et de 57 mg pour la morphine dans le cas de la douleur nociceptive et de 81 mg pour l’oxycodone et de 92 mg pour la morphine dans le cas de douleur neuropathique (Tableau 5)5. De plus, selon des données scientifiques, il existe des relations entre la réponse à la dose et les complications médicales d’une thérapie aux opioïdes, y compris la dysfonction sexuelle50, l’apnée du sommeil51–53, l’hyperalgésie induite par les opioïdes 54 et les chutes et fractures55,56. Selon de récentes données probantes, il y a un lien étroit entre la dose prescrite et le risque de surdoses fatales ou non fatales47. Parmi les bénéficiaires de l’assurance-médicaments publique de l’Ontario entre 2003 et 2008, les taux de mortalité reliée aux opioïdes sur 2 ans étaient respectivement de 1,6, 7,9 et 9,9 par 1 000 personnes chez ceux à qui on a prescrit une DEM de moins de 200 mg, une DEM de 200 à 400 mg et une DEM de plus de 400 mg57.
Tableau 5.
Équivalents en morphine d’opioïdes puissants utilisés dans des études randomisées
| MÉDICAMENT | TYPE DE DOULEUR | EQM MINIMUM | EQM MOYEN | EQM MAXIMUM | NOMBRE D’ÉTUDES |
|---|---|---|---|---|---|
| Oxycodone à LC | Nociceptive | 20 mg | 65,7 mg | 146,7 mg | 6 |
| Neuropathique | 40 mg | 81,3 mg | 173,3 mg | 3 | |
| Morphine à LC | Nociceptive | 25 mg | 56,8 mg | 120 mg | 2 |
| Neuropathique | 28,75 mg | 91,7 mg | 202,5 mg | 5 |
LC—libération contrôlée, MEQ—équivalent en morphine.
Adaptation de National Opioid Use Guideline Group5
En outre, des études observationnelles à long terme ont fait valoir que les patients qui prenaient des doses élevées d’opioïdes avaient tendance à avoir plus d’incapacités et des cotes de douleur plus élevées que ceux qui prenaient des doses moins fortes, même après avoir contrôlé la gravité du problème de douleur sous-jacent58,59. Les ouvrages spécialisés récents laissent aussi entendre que les médecins prescrivent des doses d’opioïdes plus élevées aux patients qui souffrent d’une plus grande détresse psychologique60,61. Ces études soulèvent des inquiétudes à propos de la sécurité et de l’efficacité d’une thérapie à long terme à fortes doses d’opioïdes.
Changer d’opioïde: Les patients qui n’ont pas eu de soulagement avec un opioïde ou qui ont eu des effets secondaires bénéficient parfois de changer d’opioïde62. En raison d’une tolérance croisée imprévisible ou incomplète, la dose initiale du nouvel opioïde ne doit pas dépasser 50 % de la dose antérieure si celle-ci était assez élevée (p. ex. une DEM de plus de 75 mg) ou 60 % à 75 % si la dose de l’opioïde précédent était modérée (p. ex. une DEM de moins de 75 mg). Aucune donnée probante n’appuie la pratique de combiner différents genres d’opioïdes.
Sevrage graduel
On devrait diminuer la dose graduellement puis cesser l’administration d’opioïdes chez les patients dont la douleur n’a pas été soulagée par un essai adéquat de plusieurs opioïdes différents. Des études observationnelles ont démontré que les patients ayant des douleurs sévères en dépit de doses élevées d’opioïdes éprouvent moins de douleur et ont une meilleure humeur avec la diminution graduelle des opioïdes63–68. On ne sait pas pourquoi le sevrage graduel peut améliorer la perception de la douleur. La diminution graduelle fonctionne peut-être en soulageant l’hyperalgésie et les symptômes de sevrage (les symptômes du sevrage à la fin d’un intervalle de dosage sont plus graves avec des doses élevées qu’avec des doses plus faibles). Cette diminution améliore peut-être aussi l’humeur en réduisant la sédation et la dysphorie induites par les opioïdes61. De plus, certains des bienfaits du sevrage graduel pourraient être causés par des interventions psychologiques concomitantes qui ont accompagné le sevrage durant ces études. Le médecin et le patient devraient aborder le sevrage graduel avec des attentes positives parce qu’il est associé à une meilleure humeur et à moins de douleur. Le sevrage graduel est aussi indiqué chez les patients qui ont des effets secondaires ou des complications médicales associées à la dose. L’Encadré 5 explique le protocole du sevrage graduel.
Encadré 5. Sevrage progressif des opioïdes.
|
Adaptation de National Opioid Use Guideline Group5
Consultation auprès de spécialistes
Quoique les données scientifiques ne soient pas convaincantes, les patients qui ont des douleurs sévères et une incapacité reliée à la douleur semblent obtenir de meilleurs résultats quand ils sont pris en charge par des cliniques multidisciplinaires de la douleur65. L’accès à des programmes multidisciplinaires de contrôle de la douleur est limité dans la plupart des régions au Canada69. La philosophie et l’approche thérapeutique dans les cliniques de la douleur varient considérablement et les médecins de famille devraient choisir avec soin les cliniques et les praticiens à qui ils demandent une consultation pour leurs patients. Les médecins de famille devraient toujours avertir les consultants de leurs préoccupations à propos de l’utilisation d’opioïdes par leurs patients. Ils ne sont pas obligés de prescrire des opioïdes en fonction des recommandations faites par les consultants. Ils ne doivent le faire que si, selon leur jugement clinique, les recommandations du consultant sont sécuritaires, probablement bénéfiques pour les patients en cause et conformes aux lignes directrices.
Patients prenant des opioïdes transférés d’une autre clinique
Les médecins de famille devraient expliquer clairement leurs politiques en matière d’ordonnance d’opioïdes aux patients atteints de DCNC qui sont nouveaux dans leur pratique, mais qui suivent déjà une thérapie à long terme aux opioïdes prescrite par leur ancien médecin. Les patients qui prennent des doses inappropriées devraient être encouragés à réduire graduellement leurs doses dans un avenir rapproché. On devrait suggérer aux patients qui ne veulent pas se conformer au sevrage graduel de chercher ailleurs des soins médicaux. À l’heure actuelle, les pratiques d’ordonnance varient selon le médecin de famille ou le spécialiste de la douleur. Par conséquent, les médecins doivent prescrire des opioïdes en se servant de leur meilleur jugement, même si cela va à l’encontre des désirs des patients, des recommandations du consultant ou des pratiques des médecins antérieurs de ces patients.
Milieux de soins aigus
Les médecins qui pratiquent en milieu de soins aigus comme les cliniques sans rendez-vous ou l’urgence devraient en arriver à un consensus sur les politiques de prescription d’opioïdes pour les patients ayant des DCNC. Une option est de simplement refuser d’en prescrire dans de tels milieux; les patients ont la responsabilité de voir à ce qu’ils ne manquent pas de médicament et il n’est pas prudent de prescrire des opioïdes sans connaître les antécédents médicaux complets du patient. Une autre option est de ne prescrire qu’une quantité suffisante pour durer jusqu’à ce que le médecin de famille du patient soit accessible. Si la deuxième option est choisie, la clinique devrait instaurer des précautions telles que celles expliquées à l’Encadré 6.
Encadré 6. Précautions à prendre dans la prescription d’opioïdes en milieu de soins aigus à des patients ayant une DCNC.
Rappelez-vous des précautions suivantes quand vous prescrivez des opioïdes pour la DCNC à l’urgence ou dans une clinique sans rendez-vous:
|
DCNC—douleur chronique non cancéreuse.
Conclusion
Les opioïdes jouent un rôle important dans la prise en charge de la DCNC, mais il faut les prescrire avec prudence pour limiter les préjudices potentiels. On devrait réserver la thérapie aux opioïdes pour les douleurs qui n’ont pas été soulagées avec des traitements sans opioïdes et pour lesquelles il a été démontré que les opioïdes étaient efficaces. Il faudrait combiner les opioïdes avec d’autres traitements pharmacologiques et non pharmacologiques. Le titrage de la dose doit se faire lentement et s’accompagner d’une étroite surveillance, en particulier pour les patients à risque élevé de surdose ou d’usage abusif. La dose optimale est celle qui améliore le fonctionnement ou réduit les cotes de la douleur d’au moins 30 %. Dans la très grande majorité des cas, cette dose sera bien en deçà d’une DEM de 200 mg. On recommande le sevrage progressif des patients qui n’ont pas répondu à un essai adéquat d’opioïdes.
POINTS DE REPÈRE
Les ordonnances d’opioïdes ont augmenté au Canada et, avec cette hausse, il s’est produit une augmentation des dommages liés aux opioïdes, comme la surdose et la dépendance. Jusqu’à présent, les médecins canadiens n’avaient pas suffisamment de lignes directrices fondées sur des données probantes sur la prescription des opioïdes pour les aider à réduire ces problèmes. Cette révision présente un bref résumé clinique des lignes directrices récemment publiées concernant la population générale. Un document complémentaire résume les recommandations pour les populations particulières. Les opioïdes jouent un rôle important dans la prise en charge de la douleur chronique non cancéreuse, mais il faut les prescrire avec prudence. On doit réserver la thérapie aux opioïdes pour les douleurs qui n’ont pas répondu aux thérapies sans opioïdes et pour lesquelles les opioïdes se sont révélés efficaces. On devrait combiner les opioïdes à d’autres traitements pharmacologiques et non pharmacologiques.
Footnotes
Cet article a fait l’objet d’une révision par des pairs.
Cet article donne droit à des crédits Mainpro-M1. Pour obtenir des crédits, allez à www.cfp.ca et cliquez sur le lien Mainpro.
This article is also in English on page 1257.
Collaborateurs
Tous les auteurs ont contribué au concept et à la conception de l’étude, à la collecte des données, à leur analyse et à leur interprétation et ont préparé le manuscrit aux fins de soumission.
Intérêts concurrents
Trois des auteurs étaient membres du groupe principal de recherche sur les lignes directrices. Par contre, toutes les affirmations dans cet article relèvent uniquement de la responsabilité des auteurs et le résumé n’a pas fait l’objet d’une révision par le National Opioid Use Guideline Group.
Références
- 1.Dhalla IA, Mamdani MM, Sivilotti ML, Kopp A, Qureshi O, Juurlink DN. Prescribing of opioid analgesics and related mortality before and after the introduction of long-acting oxycodone. CMAJ. 2009;181(12):891–6. doi: 10.1503/cmaj.090784. Cyberpub. du 7 décembre 2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Kuehn BM. Opioid prescriptions soar: increase in legitimate use as well as abuse. JAMA. 2007;297(3):249–51. doi: 10.1001/jama.297.3.249. [DOI] [PubMed] [Google Scholar]
- 3.Furlan AD, Reardon R, Weppler C. Opioids for chronic noncancer pain: a new Canadian practice guideline. CMAJ. 2010;182(9):923–30. doi: 10.1503/cmaj.100187. Cyberpub. du 3 mai 2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Furlan AD, Sandoval JA, Mailis-Gagnon A, Tunks E. Opioids for chronic noncancer pain: a meta-analysis of effectiveness and side effects. CMAJ. 2006;174(11):1589–94. doi: 10.1503/cmaj.051528. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.National Opioid Use Guideline Group . Canadian guideline for safe and effective use of opioids for chronic non-cancer pain. Hamilton, ON: McMaster University; 2010. Acessible à: http://nationalpaincentre.mcmaster.ca/opioid/cgop_a00_executive_summary.html. Accédé le 20 septembre 2011. [Google Scholar]
- 6.Kahan M, Wilson L, Mailis-Gagnon A, Srivastava A. Canadian guideline for safe and effective use of opioids for chronic noncancer pain. Clinical summary for family physicians. Part 2: special populations. Can Fam Physician. 2011;57:1269–76. e419–28. (ang), (fr). [PMC free article] [PubMed] [Google Scholar]
- 7.Russell IJ, Kamin M, Bennett RM, Schnitzer TJ, Green JA, Katz WA. Efficacy of tramadol in treatment of pain in fibromyalgia. J Clin Rheumatol. 2000;6(5):250–7. doi: 10.1097/00124743-200010000-00004. [DOI] [PubMed] [Google Scholar]
- 8.Bennett RM, Kamin M, Karim R, Rosenthal N. Tramadol and acetaminophen combination tablets in the treatment of fibromyalgia pain: a double-blind, randomized, placebo-controlled study. Am J Med. 2003;114(7):537–45. doi: 10.1016/s0002-9343(03)00116-5. [DOI] [PubMed] [Google Scholar]
- 9.Carville SF, Arendt-Nielsen S, Bliddal H, Blotman F, Branco JC, Buskila D, et al. EULAR evidence-based recommendations for the management of fibromyalgia syndrome. Ann Rheum Dis. 2008;67(4):536–41. doi: 10.1136/ard.2007.071522. Cyberpub. du 20 juillet 2007. [DOI] [PubMed] [Google Scholar]
- 10.Deshpande A, Furlan A, Mailis-Gagnon A, Atlas S, Turk D. Opioids for chronic low-back pain. Cochrane Database Syst Rev. 2007;(3):CD004959. doi: 10.1002/14651858.CD004959.pub3. [DOI] [PubMed] [Google Scholar]
- 11.Chou R. Pharmacological management of low back pain. Drugs. 2010;70(4):387–402. doi: 10.2165/11318690-000000000-00000. [DOI] [PubMed] [Google Scholar]
- 12.Wang H, Weinsheimer N, Akbar M, Schiltenwolf M. [Altered pain thresholds during and after opioid withdrawal in patients with chronic low back pain.] Article en allemand. Schmerz. 2010;24(3):257–61. doi: 10.1007/s00482-010-0912-4. [DOI] [PubMed] [Google Scholar]
- 13.Nuesch E, Rutjes AW, Husni E, Welch V, Juni P. Oral or transdermal opioids for osteoarthritis of the knee or hip. Cochrane Database Syst Rev. 2009;(4):CD003115. doi: 10.1002/14651858.CD003115.pub3. [DOI] [PubMed] [Google Scholar]
- 14.Dagenais S, Tricco AC, Haldeman S. Synthesis of recommendations for the assessment and management of low back pain from recent clinical practice guidelines. Spine J. 2010;10(6):514–29. doi: 10.1016/j.spinee.2010.03.032. [DOI] [PubMed] [Google Scholar]
- 15.Strand LI, Ljunggren AE, Bogen B, Ask T, Johnsen TB. The Short-Form McGill Pain Questionnaire as an outcome measure: test-retest reliability and responsiveness to change. Eur J Pain. 2008;12(7):917–25. doi: 10.1016/j.ejpain.2007.12.013. [DOI] [PubMed] [Google Scholar]
- 16.McCaffery M, Pasero C. Pain. Clinical manual. 2 éd. St Louis, MO: Mosby Inc; 1999. [Google Scholar]
- 17.Ballantyne JC, Mao J. Opioid therapy for chronic pain. N Engl J Med. 2003;349(20):1943–53. doi: 10.1056/NEJMra025411. [DOI] [PubMed] [Google Scholar]
- 18.Daniell HW. DHEAS deficiency during consumption of sustained-action prescribed opioids: evidence for opioid-induced inhibition of adrenal androgen production. J Pain. 2006;7(12):901–7. doi: 10.1016/j.jpain.2006.04.011. [DOI] [PubMed] [Google Scholar]
- 19.Chu LF, Clark DJ, Angst MS. Opioid tolerance and hyperalgesia in chronic pain patients after one month of oral morphine therapy: a preliminary prospective study. J Pain. 2006;7(1):43–8. doi: 10.1016/j.jpain.2005.08.001. [DOI] [PubMed] [Google Scholar]
- 20.Zgierska A, Brown RT, Zuelsdorff M, Brown D, Zhang Z, Fleming MF. Sleep and daytime sleepiness problems among patients with chronic noncancerous pain receiving long-term opioid therapy: a cross-sectional study. J Opioid Manag. 2007;3(6):317–27. doi: 10.5055/jom.2007.0020. [DOI] [PubMed] [Google Scholar]
- 21.Mogri M, Khan MI, Grant BJ, Mador MJ. Central sleep apnea induced by acute ingestion of opioids. Chest. 2008;133(6):1484–8. doi: 10.1378/chest.07-1891. [DOI] [PubMed] [Google Scholar]
- 22.Farney RJ, Walker JM, Cloward TV, Rhondeau S. Sleep-disordered breathing associated with long-term opioid therapy. Chest. 2003;123(2):632–9. doi: 10.1378/chest.123.2.632. [DOI] [PubMed] [Google Scholar]
- 23.Starrels JL, Becker WC, Alford DP, Kapoor A, Williams AR, Turner BJ. Systematic review: treatment agreements and urine drug testing to reduce opioid misuse in patients with chronic pain. Ann Intern Med. 2010;152(11):712–20. doi: 10.7326/0003-4819-152-11-201006010-00004. [DOI] [PubMed] [Google Scholar]
- 24.Kahan M, Srivastava A, Wilson L, Mailis-Gagnon A, Midmer D. Opioids for managing chronic non-malignant pain: safe and effective prescribing. Can Fam Physician. 2006;52(9):1091–6. [PMC free article] [PubMed] [Google Scholar]
- 25.Mirakbari SM, Innes GD, Christenson J, Tilley J, Wong H. Do co-intoxicants increase adverse event rates in the first 24 hours in patients resuscitated from acute opioid overdose? J Toxicol Clin Toxicol. 2003;41(7):947–53. doi: 10.1081/clt-120026516. [DOI] [PubMed] [Google Scholar]
- 26.Cone EJ, Fant RV, Rohay JM, Caplan YH, Ballina M, Reder RF, et al. Oxycodone involvement in drug abuse deaths: a DAWN-based classification scheme applied to an oxycodone postmortem database containing over 1000 cases. J Anal Toxicol. 2003;27(2):57–67. doi: 10.1093/jat/27.2.57. [DOI] [PubMed] [Google Scholar]
- 27.Repchinsky C rédacteur en chef, editor. Compendium of pharmaceuticals and specialties. The Canadian drug reference for health professionals. Ottawa, ON: Association des pharmaciens du Canada; 2008. [Google Scholar]
- 28.Schreiber S, Peles E, Adelson M. Association between improvement in depression, reduced benzodiazepine (BDZ) abuse, and increased psychotropic medication use in methadone maintenance treatment (MMT) patients. Drug Alcohol Depend. 2008;92(1–3):79–85. doi: 10.1016/j.drugalcdep.2007.06.016. Cyberpub. du 13 août 2007. [DOI] [PubMed] [Google Scholar]
- 29.Baillargeon L, Landreville P, Verreault R, Beauchemin JP, Grégoire JP, Morin CM. Discontinuation of benzodiazepines among older insomniac adults treated with cognitive-behavioural therapy combined with gradual tapering: a randomized trial. CMAJ. 2003;169(10):1015–20. [PMC free article] [PubMed] [Google Scholar]
- 30.Gosselin P, Ladouceur R, Morin CM, Dugas MJ, Baillargeon L. Benzodiazepine discontinuation among adults with GAD: a randomized trial of cognitive-behavioral therapy. J Consult Clin Psychol. 2006;74(5):908–19. doi: 10.1037/0022-006X.74.5.908. [DOI] [PubMed] [Google Scholar]
- 31.Vicens C, Fiol F, Llobera J, Campoamor F, Mateu C, Alegret S, et al. Withdrawal from long-term benzodiazepine use: randomised trial in family practice. Br J Gen Pract. 2006;56(533):958–63. [PMC free article] [PubMed] [Google Scholar]
- 32.Moroz G, Rosenbaum JF. Efficacy, safety, and gradual discontinuation of clonazepam in panic disorder: a placebo-controlled, multicenter study using optimized dosages. J Clin Psychiatry. 1999;60(9):604–12. doi: 10.4088/jcp.v60n0907. [DOI] [PubMed] [Google Scholar]
- 33.Cook JM, Biyanova T, Thompson R, Coyne JC. Older primary care patients’ willingness to consider discontinuation of chronic benzodiazepines. Gen Hosp Psychiatry. 2007;29(5):396–401. doi: 10.1016/j.genhosppsych.2007.07.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Morin CM, Bastien C, Guay B, Radouco-Thomas M, Leblanc J, Vallieres A. Randomized clinical trial of supervised tapering and cognitive behavior therapy to facilitate benzodiazepine discontinuation in older adults with chronic insomnia. Am J Psychiatry. 2004;161(2):332–42. doi: 10.1176/appi.ajp.161.2.332. [DOI] [PubMed] [Google Scholar]
- 35.Dasgupta N, Kramer ED, Zalman MA, Carino S, Jr, Smith MY, Haddox JD, et al. Association between non-medical and prescriptive usage of opioids. Drug Alcohol Depend. 2006;82(2):135–42. doi: 10.1016/j.drugalcdep.2005.08.019. Cyberpub. du 19 octobre 2005. [DOI] [PubMed] [Google Scholar]
- 36.Preston KL, Jasinski DR, Testa M. Abuse potential and pharmacological comparison of tramadol and morphine. Drug Alcohol Depend. 1991;27(1):7–17. doi: 10.1016/0376-8716(91)90081-9. [DOI] [PubMed] [Google Scholar]
- 37.Cicero TJ, Inciardi JA, Adams EH, Geller A, Senay EC, Woody GE, et al. Rates of abuse of tramadol remain unchanged with the introduction of new branded and generic products: results of an abuse monitoring system, 1994–2004. Pharmacoepidemiol Drug Saf. 2005;14(12):851–9. doi: 10.1002/pds.1113. [DOI] [PubMed] [Google Scholar]
- 38.Peterson GM, Randall CT, Paterson J. Plasma levels of morphine and morphine glucuronides in the treatment of cancer pain: relationship to renal function and route of administration. Eur J Clin Pharmacol. 1990;38(2):121–4. doi: 10.1007/BF00265969. [DOI] [PubMed] [Google Scholar]
- 39.Tyndale RF, Droll KP, Sellers EM. Genetically deficient CYP2D6 metabolism provides protection against oral opiate dependence. Pharmacogenetics. 1997;7(5):375–9. doi: 10.1097/00008571-199710000-00006. [DOI] [PubMed] [Google Scholar]
- 40.Romach MK, Otton SV, Somer G, Tyndale RF, Sellers EM. Cytochrome P450 2D6 and treatment of codeine dependence. J Clin Psychopharmacol. 2000;20(1):43–5. doi: 10.1097/00004714-200002000-00008. [DOI] [PubMed] [Google Scholar]
- 41.Howard LA, Sellers EM, Tyndale RF. The role of pharmacogenetically-variable cytochrome P450 enzymes in. Pharmacogenomics. 2002;3(2):185–99. doi: 10.1517/14622416.3.2.185. [DOI] [PubMed] [Google Scholar]
- 42.Shields LB, Hunsaker JC, 3rd, Corey TS, Ward MK, Stewart D. Methadone toxicity fatalities: a review of medical examiner cases in a large metropolitan area. J Forensic Sci. 2007;52(6):1389–95. doi: 10.1111/j.1556-4029.2007.00565.x. [DOI] [PubMed] [Google Scholar]
- 43.Sims SA, Snow LA, Porucznik CA. Surveillance of methadone-related adverse drug events using multiple public health data sources. J Biomed Inform. 2007;40(4):382–9. doi: 10.1016/j.jbi.2006.10.004. Epub 2006 Nov 1. [DOI] [PubMed] [Google Scholar]
- 44.Seifert CF, Kennedy S. Meperidine is alive and well in the new millennium: evaluation of meperidine usage patterns and frequency of adverse drug reactions. Pharmacotherapy. 2004;24(6):776–83. doi: 10.1592/phco.24.8.776.36066. [DOI] [PubMed] [Google Scholar]
- 45.Zacny JP, Lichtor SA. Within-subject comparison of the psychopharmacological profiles of oral oxycodone and oral morphine in non-drug-abusing volunteers. Psychopharmacology (Berl) 2008;196(1):105–16. doi: 10.1007/s00213-007-0937-2. Cyberpub. du 27 septembre 2007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Lamas X, Farré M, Moreno V, Camí J. Effects of morphine in post addict humans: a meta-analysis. Drug Alcohol Depend. 1994;36(2):147–52. doi: 10.1016/0376-8716(94)90097-3. [DOI] [PubMed] [Google Scholar]
- 47.Dunn KM, Saunders KW, Rutter CM, Banta-Green CJ, Merrill JO, Sullivan MD, et al. Opioid prescriptions for chronic pain and overdose: a cohort study. Ann Intern Med. 2010;152(2):85–92. doi: 10.1059/0003-4819-152-2-201001190-00006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Farrar JT, Young JP, Jr, LaMoreaux L, Werth JL, Poole RM. Clinical importance of changes in chronic pain intensity measured on an 11-point numerical pain rating scale. Pain. 2001;94(2):149–58. doi: 10.1016/S0304-3959(01)00349-9. [DOI] [PubMed] [Google Scholar]
- 49.Pereira J, Lawlor P, Vigano A, Dorgan M, Bruera E. Equianalgesic dose ratios for opioids. A critical review and proposals for long-term dosing. J Pain Symptom Manage. 2001;22(2):672–87. doi: 10.1016/s0885-3924(01)00294-9. [DOI] [PubMed] [Google Scholar]
- 50.Rajagopal A, Vassilopoulou-Sellin R, Palmer JL, Kaur G, Bruera E. Hypogonadism and sexual dysfunction in male cancer survivors receiving chronic opioid therapy. J Pain Symptom Manage. 2003;26(5):1055–61. doi: 10.1016/s0885-3924(03)00331-2. [DOI] [PubMed] [Google Scholar]
- 51.Walker JM, Farney RJ, Rhondeau SM, Boyle KM, Valentine K, Cloward TV, et al. Chronic opioid use is a risk factor for the development of central sleep apnea and ataxic breathing. J Clin Sleep Med. 2007;3(5):455–61. Erratum dans: J Clin Sleep Med 2007;3(6):table of contents. [PMC free article] [PubMed] [Google Scholar]
- 52.Webster LR, Choi Y, Desai H, Webster L, Grant BJ. Sleep-disordered breathing and chronic opioid therapy. Pain Med. 2008;9(4):425–32. doi: 10.1111/j.1526-4637.2007.00343.x. [DOI] [PubMed] [Google Scholar]
- 53.Alattar MA, Scharf SM. Opioid-associated central sleep apnea: a case series. Sleep Breath. 2009;13(2):201–6. doi: 10.1007/s11325-008-0221-7. Cyberpub. du 20 septembre 2008. [DOI] [PubMed] [Google Scholar]
- 54.Cohen SP, Christo PJ, Wang S, Chen L, Stojanovic MP, Shields CH, et al. The effect of opioid dose and treatment duration on the perception of a painful standardized clinical stimulus. Reg Anesth Pain Med. 2008;33(3):199–206. doi: 10.1016/j.rapm.2007.10.009. [DOI] [PubMed] [Google Scholar]
- 55.Vestergaard P, Rejnmark L, Mosekilde L. Fracture risk associated with the use of morphine and opiates. J Intern Med. 2006;260(1):76–87. doi: 10.1111/j.1365-2796.2006.01667.x. [DOI] [PubMed] [Google Scholar]
- 56.Hass B, Lungershausen J, Hertel N, Poulsen Nautrup B, Kotowa W, Liedgens H. Cost-effectiveness of strong opioids focussing on the long-term effects of opioid-related fractures: a model approach. Eur J Health Econ. 2009;10(3):309–21. doi: 10.1007/s10198-008-0134-1. Cyberpub. du 21 décembre 2008. [DOI] [PubMed] [Google Scholar]
- 57.Gomes T, Juurlink D, Dhalla I, Mailis-Gagnon A, Paterson M, Mamdani M. Trends in opioid use and dosing among the socioeconomically disadvantaged. Open Med. 2011;5(1):e13. [PMC free article] [PubMed] [Google Scholar]
- 58.Rome JD, Townsend CO, Bruce BK, Sletten CD, Luedtke CA, Hodgson JE. Chronic noncancer pain rehabilitation with opioid withdrawal: comparison of treatment outcomes based on opioid use status at admission. Mayo Clin Proc. 2004;79(6):759–68. doi: 10.4065/79.6.759. [DOI] [PubMed] [Google Scholar]
- 59.Franklin GM, Stover BD, Turner JA, Fulton-Kehoe D, Wickizer TM, Disability Risk Identification Study Cohort Early opioid prescription and subsequent disability among workers with back injuries: the Disability Risk Identification Study Cohort. Spine. 2008;33(2):199–204. doi: 10.1097/BRS.0b013e318160455c. [DOI] [PubMed] [Google Scholar]
- 60.Breckenridge J, Clark JD. Patient characteristics associated with opioid versus nonsteroidal anti-inflammatory drug management of chronic low back pain. J Pain. 2003;4(6):344–50. doi: 10.1016/s1526-5900(03)00638-2. [DOI] [PubMed] [Google Scholar]
- 61.Braden JB, Sullivan MD, Ray GT, Saunders K, Merrill J, Silverberg MJ, et al. Trends in long-term opioid therapy for noncancer pain among persons with a history of depression. Gen Hosp Psychiatry. 2009;31(6):564–70. doi: 10.1016/j.genhosppsych.2009.07.003. Cyberpub. du 27 août 2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Quigley C. Opioid switching to improve pain relief and drug tolerability. Cochrane Database Syst Rev. 2004;(3):CD004847. doi: 10.1002/14651858.CD004847. [DOI] [PubMed] [Google Scholar]
- 63.Baron MJ, McDonald PW. Significant pain reduction in chronic pain patients after detoxification from high-dose opioids. J Opioid Manag. 2006;2(5):277–82. doi: 10.5055/jom.2006.0041. [DOI] [PubMed] [Google Scholar]
- 64.Becker N, Sjøgren P, Bech P, Olsen AK, Eriksen J. Treatment outcome of chronic non-malignant pain patients managed in a Danish multidisciplinary pain centre compared to general practice: a randomised controlled trial. Pain. 2000;84(2–3):203–11. doi: 10.1016/s0304-3959(99)00209-2. [DOI] [PubMed] [Google Scholar]
- 65.Miller NS, Swiney T, Barkin RL. Effects of opioid prescription medication dependence and detoxification on pain perceptions and self-reports. Am J Ther. 2006;13(5):436–44. doi: 10.1097/01.mjt.0000212894.35705.90. [DOI] [PubMed] [Google Scholar]
- 66.Ralphs JA, Williams AC, Richardson PH, Pither CE, Nicholas MK. Opiate reduction in chronic pain patients: a comparison of patient-controlled reduction and staff controlled cocktail methods. Pain. 1994;56(3):279–88. doi: 10.1016/0304-3959(94)90166-X. [DOI] [PubMed] [Google Scholar]
- 67.Crisostomo RA, Schmidt JE, Hooten WM, Kerkvliet JL, Townsend CO, Bruce BK. Withdrawal of analgesic medication for chronic low-back pain patients: improvement in outcomes of multidisciplinary rehabilitation regardless of surgical history. Am J Phys Med Rehabil. 2008;87(7):527–36. doi: 10.1097/PHM.0b013e31817c124f. [DOI] [PubMed] [Google Scholar]
- 68.Hooten WM, Townsend CO, Sletten CD, Bruce BK, Rome JD. Treatment outcomes after multidisciplinary pain rehabilitation with analgesic medication withdrawal for patients with fibromyalgia. Pain Med. 2007;8(1):8–16. doi: 10.1111/j.1526-4637.2007.00253.x. [DOI] [PubMed] [Google Scholar]
- 69.Peng P, Choiniere M, Dion D, Intrater H, Lefort S, Lynch M, et al. Challenges in accessing multidisciplinary pain treatment facilities in Canada. Can J Anaesth. 2007;54(12):977–84. doi: 10.1007/BF03016631. [DOI] [PubMed] [Google Scholar]