Résumé
Objectif
Étudier entre 1996 et 2006, l’évolution des schémas thérapeutiques et du profil clinique et immunologique des patients infectés par le VIH au début du traitement antirétroviral (TARV) en Afrique de l’Ouest.
Cadre et méthode
Les données issues de 12 centres cliniques adultes (IeDEA West Africa réseau collaboratif de prise en charge de l’infection à VIH) de cinq pays (Bénin, Cote d’Ivoire, Sénégal, Gambie, Mali) ont été mises en commun et analysées. Les patients âgés de 16 ans et plus dont le sexe, la date de naissance et la date d’initiation du TARV étaient connus ont été inclus dans cette étude.
Résultats
Quatorze mille quatre-cent-quatre-vingt-seize patients avaient débuté un TARV entre 1996–2006 avec 55 % des patients l’ayant débuté entre 2005–2006. La proportion de femmes était de 46 % en 1996–2000 et de 63 % en 2005–2006. L’âge médian à la mise sous traitement était constant: 35 ans chez les femmes et 40 ans chez les hommes. La proportion de patients qui ont débuté le TARV avec un taux de CD4 inférieur à 200 cellules/µl était de 54 % en 1996–2000 et de 64 % en 2005–2006. Les combinaisons thérapeutiques les plus prescrites étaient: AZT/3TC (ou d4T/DDI)/IDV (27 %) en 1996–2000; d4T (ou AZT)/3TC/EFV (59 %) en 2003–2004; et d4T/3TC/NVP (49 %) en 2005–2006. Les traitements de première ligne recommandés par l’OMS étaient débutés dans 83 % de cas en 2005–2006.
Conclusion
De nouvelles approches pour débuter un TARV plus précocement doivent être développées pour améliorer la survie des patients sous TARV.
Mots clés: VIH, Afrique de l’Ouest, Antirétroviral
Keywords: HIV, Antiretroviral therapy, West Africa
Abstract
Objective
We studied the evolution of drug combinations used, as well as the clinical and immunological profile of patients at initiation of highly active antiretroviral therapy (HAART) between 1996 and 2006 in West Africa.
Settings and method
IeDEA West Africa is a network of HIV care programs established in 2006. We analyzed data from 12 clinical centers treating adults in five countries: Benin, Cote d’Ivoire, Senegal, Gambia, and Mali. Patients 16 years of age or over were included in the study and the following was documented: sex, date of birth and date of initiation of HAART.
Results
We included 14,496 adult patients having started HAART, among these 55 % had started HAART between 2005–2006. The proportion of HIV-infected women increased from 46 % in 1996–2000 to 63 % in 2005–2006. The median age at HAART initiation remained constant: 35 years for women and 40 years for men. The proportion of patients having started HAART with a CD4 count < 200 cells/µl was 54 % in 1996–2000, and 64 % in 2005–2006. The most frequently prescribed HAART was: AZT/3TC (or d4T/DDI)/IDV (27 %) in 1996–2000; d4T (or AZT)/3TC/EFV (49 %) in 2003–2004, and d4T/3TC/NVP (49 %) in 2005–2006.
Conclusion
The first line HAART regimen recommended by WHO was initiated in 83 % of cases in 2005–2006. New approaches to an earlier initiation of ART should be explored to reduce mortality in HIV-infected patients on HAART.
1. Introduction
Àla fin de décembre 2007, grâce à l’appui sans cesse croissant des bailleurs de fonds (Fonds mondial, PEPFAR, Banque mondiale) et des initiatives comme l’initiative 3 × 5 de l’Organisation mondiale de la santé (OMS), trois millions de patients infectés par le VIH avaient reçu un traitement antirétroviral (TARV) dans le monde [1], soit seulement 31 % des patients infectés par le VIH et ayant besoin d’un TARV. Malgré cette couverture insuffisante, on note en Afrique sub-saharienne, une nette progression au cours des trois dernières années passant de 100 000 patients sous TARV à la fin 2003 à près de 2 120 000 patients en décembre 2007 [2].
Un autre défi chez les patients infectés par le VIH est d’améliorer les conditions de leur prise en charge en débutant le TARV le plus tôt possible. En effet, une étude observation-nelle réalisée au sein de la collaboration ART-LINC a montré que dans les pays à ressources limitées les patients débutaient le TARV avec des CD4 à 104 cellules/mm3 en médiane contre 234 cellules/mm3 pour les pays développés [3]. Cette prise en charge tardive se traduit par une mortalité initiale élevée observée surtout dans les six premiers mois suivant la mise sous TARV [3–5].
Dans le souci de permettre le passage à l’échelle, avec la mise à disposition des antirétroviraux pour tous les patients infectés par le VIH, l’OMS recommandait des régimes de première ligne moins coûteux. Presque tous les programmes nationaux ont ainsi adopté les recommandations proposées par l’OMS en 2004 et révisées en 2006, c’est-à-dire un régime de première ligne avec deux inhibiteurs nucléosidiques de la reverse transcriptase (INRTI) et un inhibiteur non nucléosidique de la reverse transcriptase (INNRTI) [6–8].
Notre étude se propose comme objectif d’étudier l’évolution des schémas thérapeutiques, le profil clinique et immunologique des patients au moment de l’initiation du TARV sur une période de des dix ans (1996–2006) en Afrique de l’Ouest.
2. Matériel et méthodes
2.1. Description de la population d’étude
The International epidemiological Database to Evaluate AIDS (IeDEA) est une collaboration internationale regroupant des centres cliniques de prise en charge des patients infectés par le VIH. Cette collaboration existe dans sept régions dans le monde http://www.iedea-hiv.org/. En Afrique de l’Ouest, cette collaboration dénommée IeDEA West Africa (http://www.iedeawestafrica.org/) a été initiée en juillet 2006. Elle s’est concentrée initialement sur cinq pays (Sénégal, Mali, Gambie, Cote d’Ivoire, Bénin) et regroupait au 30 juin 2008, 12 centres cliniques adultes (Tableau 1) et neuf centres cliniques pédiatriques. Le Burkina-Faso et le Nigeria viennent d’intégrer la collaboration en juillet 2008, mais leurs données ne sont pas encore disponibles.
Tableau 1.
Nombre de patients par centre et année d’initiation du traitement TARV (n = 14 496).
Number of patients per center and year of HAART initiation, (n = 14,496).
| Nom des centres | Pays | Effectif | Date début ART | Type de centre |
|---|---|---|---|---|
| CIRBA | Abidjan, Cote d’Ivoire | 1877 | 1996 | Semi-public |
| CNTS | Abidjan, Cote d’Ivoire | 493 | 2005 | Public (ONG) |
| CePReF | Abidjan, Cote d’Ivoire | 2729 | 2004 | Public (ONG) |
| MTCT-Plus | Abidjan, Cote d’Ivoire | 389 | 2003 | Public (ONG) |
| SMIT | Abidjan, Cote d’Ivoire | 3786 | 1998 | CHU/Public |
| USAC | Abidjan, Cote d’Ivoire | 2330 | 1998 | Public |
| Gabriel Touré | Bamako, Mali | 963 | 2001 | CHU/Public |
| Point G | Bamako, Mali | 278 | 2001 | CHU/Public |
| FAJARA | Banjul, Gambie | 146 | 2004 | Public |
| CNHU | Cotonou, Bénin | 794 | 2002 | CHU/Public |
| ANRS 1215 | Dakar, Sénégal | 404 | 1998 | Centre de recherche |
| SMIT | Dakar, Sénégal | 307 | 2001 | CHU/Public |
ONG: organisme non gouvernemental; CHU: centre hospitalier universitaire.
L’objectif de la collaboration est, d’une part, de renforcer les capacités existantes des systèmes d’information pour un meilleur suivi des patients infectés par le VIH sous TARV et, d’autre part, de mieux décrire l’épidémiologie du VIH en Afrique de l’Ouest en répondant à des questions de recherche sur l’infection à VIH et sur le TARV dans ces pays.
2.2. Principe de la collaboration
Un accord de sous adjudication est signé chaque année entre le centre coordonnateur (Institut de santé publique d’epidémiologie et de développement [ISPED] à l’université Victor Segalen de Bordeaux 2 et les centres cliniques volontaires pour mettre en pratique les principes suivants de la collaboration: mise à disposition des données une fois par an par chaque équipe clinique, a purement des données et exploitation commune de la base de données centralisée selon les objectifs scientifiques approuvés par l’ensemble du réseau.
2.2.1. Population d’étude
La population d’étude est constituée de tous les patients adultes âgés d’au moins 16 ans, dont la date de mise sous traitement antirétroviral est connue, et ayant démarré leur TARV entre 1996 et 2006.
2.2.2. Variables recueillies
Les données démographiques (âge, sexe), cliniques (stade OMS ou CDC de l’infection à VIH), l’indice de masse corporelle (poids/taille2), les principales variables biologiques (taux de lymphocytes CD4) et thérapeutiques (combinaison antirétrovirale, date de mise sous TARV) ont été recueillies à l’initiation du TARV.
Les données individuelles recueillies dans chaque centre sont envoyées une fois par an au Bureau régional de la collaboration IeDEA West Africa localisé à Abidjan. Ces données sont fusionnées afin d’obtenir une base de données unique. Un descriptif des données de la base est renvoyé à chaque centre clinique pour compléter les incohérences et les données manquantes avant les analyses statistiques.
2.2.3. Aspects éthiques
Tous les centres cliniques participant à cette collaboration ont soumis et obtenu du comité national ou local d’éthique un avis favorable pour le transfert, l’exploitation et l’analyse statistique des données. Ces comités d’éthiques sont enregistrés dans la base des données américaines de l’Office for Human Research Protections (OHRP, http://www.dhhs.gov/ohrp/assurances/index.html) pour l’obtention d’un numéro d’identification. De plus, tous les coordonnateurs des centres cliniques ont suivi et validé un enseignement à distance sur l’éthique et la recherche clinique (http://ohsr.od.nih.gov/cbt/cbt.html.).
2.2.4. Analyses statistiques
Les résultats sont exprimés sous forme de médiane et d’espace interquatile (IQR) pour les variables quantitatives et de proportion pour les variables qualitatives.
Tous les résultats ont été stratifiés sur la période calendaire et les analyses statistiques ont été réalisées avec le logiciel SAS version 9.1.
3. Résultats
Au 30 juin 2008, la base de données de la collaboration IeDEA West Africa (Tableau 1) était constituée des données issues de 12 centres cliniques de cinq pays de l’Afrique de l’Ouest, soit un total de 17291 patients sous TARV. Nous avons exclu de cette analyse les patients dont le sexe ou la date de naissance n’était pas connu (n = 36, 0,2 %), dont la date d’initiation du TARV n’était pas mentionnée (n = 54, 0,3 %) et les patients ayant débuté le TARV en dehors de la période 1996–2006 (n = 2705, 15,6 %).
3.1. Description des sites cliniques
Au total 12 centres cliniques, tous situés en milieu urbain participent à la collaboration IeDEA West Africa. On note:
à Dakar, au Sénégal, la participation d’un centre clinique de recherche (la cohorte ANRS 1215), qui est une cohorte fermée et du service des maladies infectieuses et tropicales (SMIT) du CHU de Fann;
à Banjul en Gambie, la participation d’un centre public soutenu par le Medical Research Center (MRC);
à Cotonou au Bénin, la participation du service de médecine interne situé au sein du CHU de Cotonou;
à Bamako au Mali, la participation de deux services hospitaliers situés au CHU du point G et au CHU Gabriel Touré;
à Abidjan en Cote d’Ivoire, six centres cliniques participent à cette collaboration dont un service hospitalo-universitaire.
Le Tableau 1 présente un descriptif des centres participants à la collaboration IeDEA West Africa.
3.2. Mise à disposition des traitements antirétroviraux à grande échelle
Le nombre de patients sous TARV a augmenté considérablement au cours des deux dernières années (2005–2006) durant lesquelles 54,8 %des patients recensés (7940/14496) ont été mis sous TARV, 3,0 % en 1996–2000, 6,3 % en 2001–2002, 35,9 % en 2003–2004.
3.3. Caractéristiques sociodémographiques à la mise sous traitement antirétroviral
L’âge médian à la mise sous TARV est resté constant au cours de cette décennie. Il était de 37,3 ans pour la période 1996–2000 et de 37,0 ans pour la période 2005–2006.
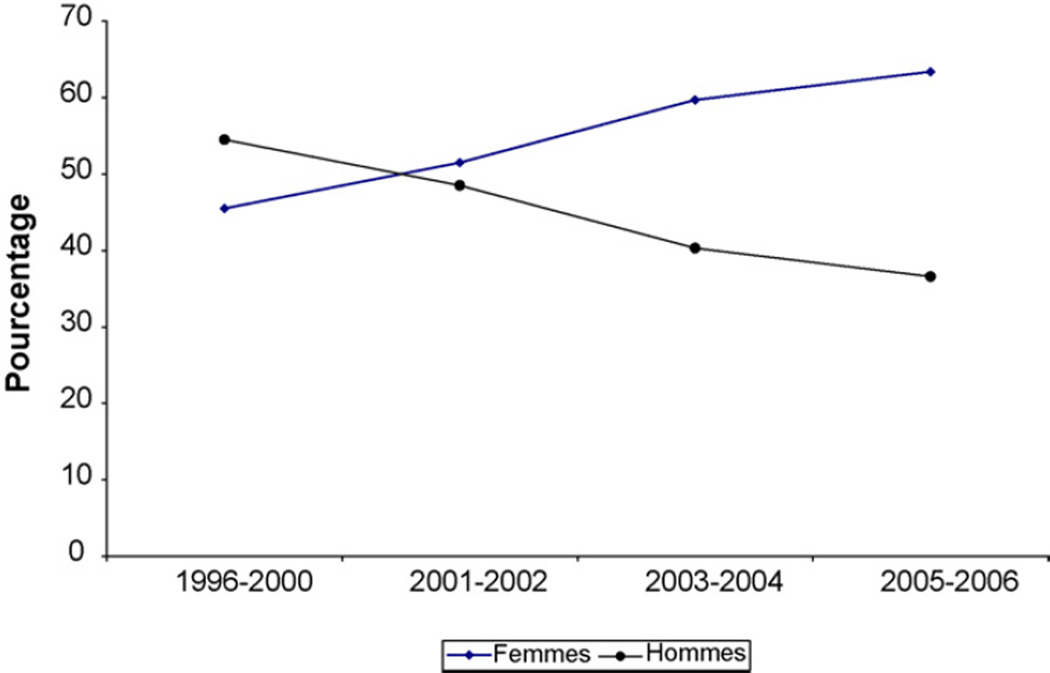
Il y a eu peu de variation de l’âge au cours du temps en fonction du sexe. En 2005 et 2006, les femmes mises sous TARV étaient plus jeunes (âge médian 34,6 ans [29,5–41,1]) que les hommes (âge médian de 40,8 ans [IQR 35,4–47,1]). Entre 1996 et 2000, on notait une prédominance masculine avec 54,5 % d’hommes parmi les nouveaux patients mis sous TARV. Cette tendance s’est inversée au cours du temps avec 63,4 % de femmes parmi les nouveaux patients débutant une TARV en 2005–2006 (Fig. 1).
Fig. 1.
Pourcentage d’hommes et de femmes par année de mise sous traitement antirétroviral.
Percentage of male and female patients according to year of HAART initiation.
3.4. Caractéristiques cliniques et biologiques à la mise sous traitement
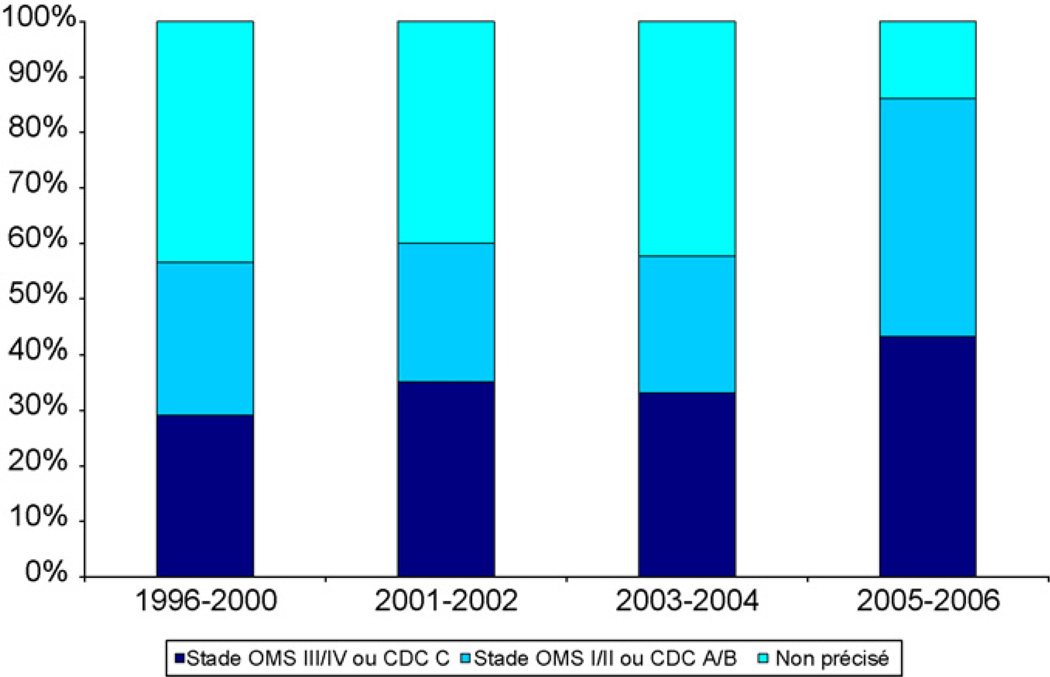
La notification du stade clinique des patients s’est améliorée au cours des années: 43,4 % des données étaient manquantes entre 1996 et 2000 pour seulement 13,9 % en 2005–2006. Quatre équipes utilisent la classification OMS, trois utilisent la classification CDC, quatre autres utilisent les deux classifications et une clinique ne recueille pas les données sur les stades cliniques. La proportion de patients au stade SIDA (classification CDC) ou aux stades OMS III/IV est passée de 29,1 % en 1996–2000 à 33,1 % en 2003–2004 et à 43,2 % en 2005–2006) grâce à une meilleure notification du stade clinique des patients à la mise sous TARV (Fig. 2).
Fig. 2.
Classification OMS ou CDC à l’initiation du traitement antirétroviral par année.
Baseline WHO or CDC clinical stage at initiation of HAART per year.
L’indice de masse corporelle médian (IMC) était de 21,0 kg/m2 entre 1996 et 2000. Il est resté constant au cours des années avec un IMC médian de 20,4 kg/m2 pour les patients ayant débuté un TARV entre 2005–2006. Cependant les données nécessaires pour le calcul d’IMC sont peu colligées avec 6319 données manquantes (43,5 %). En 2005–2006, sur 7940 patients qui ont débuté un TARV, les données de l’IMC étaient disponibles pour 4925 patients (62 %) contre 46 % entre 2003 et 2004 témoignant de l’amélioration des données recueillies par les cliniques au cours du temps.
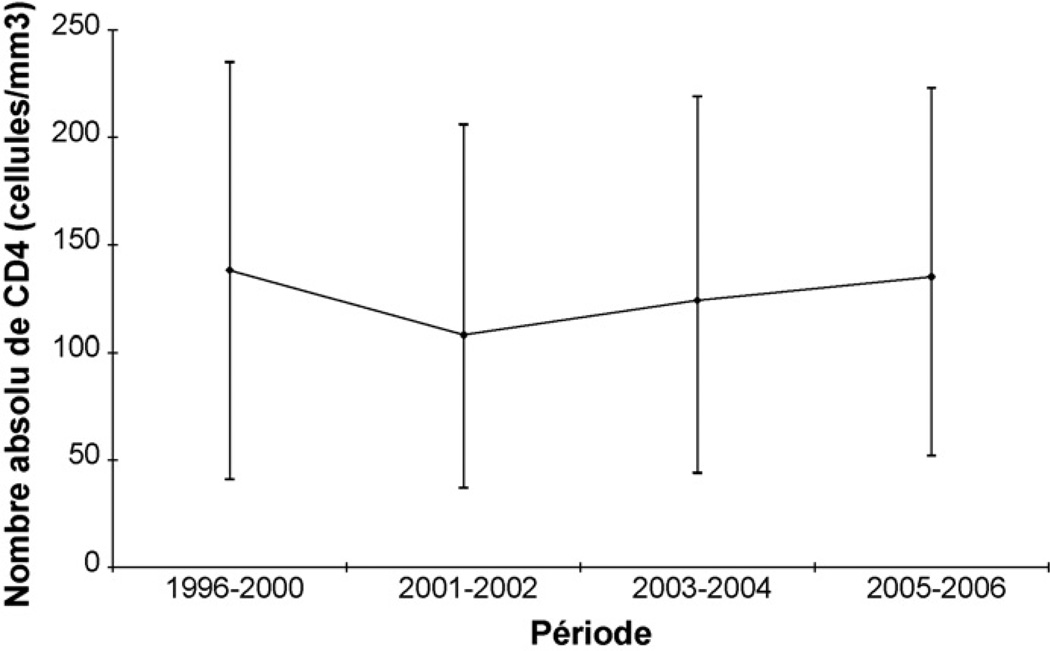
La médiane du nombre absolu de CD4 à la mise sous TARV était de 130 cellules/µl [IQR = 48–221] et est resté constamment en dessous de 140 cellules/µl quelle que soit la période d’initiation du TARV (Fig. 3). La proportion de patients qui ont initié le TARV avec un taux de CD4 inférieur à 200 cellules/µl était ainsi de 54,0 % en 1996–2000 et de 63,5 % en 2005–2006. Cependant, les données de CD4 étaient manquantes à la mise sous traitement chez 1979 (14 %) des patients.
Fig. 3.
Médiane et étendue interquartile range (EIQ) du nombre absolu de lymphocytes CD4 à l’initiation du traitement antirétroviral.
Median and interquartile range of absolute CD4 count at baseline.
3.5. Caractéristiques thérapeutiques
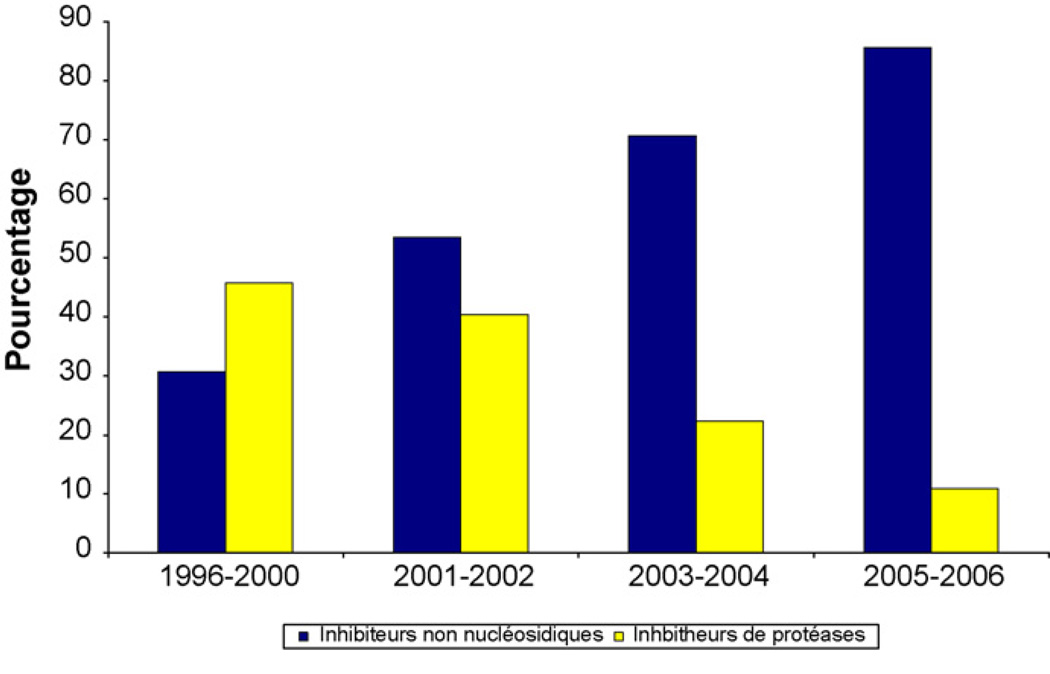
La combinaison thérapeutique la plus prescrite au cours des années 1996 à 2000 associait deux INRT et un IP dans 45,7 % des cas; et les régimes les plus prescrits étaient AZT/3TC/IDV 13,6 % et d4T/DD/IDV dans 13,6 % des cas. En 2001–2002, l’association d4T (ou AZT)/3TC/EFV était le régime le plus utilisé dans 36,9 %de cas et les régimes incluant un INNRT prescrit dans 53,6 % des cas. La combinaison d4T (ou AZT)/3TC/EFV était initiée chez 46,8 % des nouveaux patients en 2003–2004. Enfin en 2005–2006, l’association d4T/3TC/NVP a été prescrite chez 48,6 % des nouveaux patients. L’utilisation des régimes recommandés par l’OMS depuis 2006 comprenant deux INRTI et un INNRTI a augmenté progressivement passant de 30,7 % des patients en 1996–2000 et à 85,6 % en 2005–2006 (Fig. 4).
Fig. 4.
Régimes thérapeutiques à l’initiation du traitement.
Type of HAART regimen used at initiation.
4. Discussion
Cette description des données disponibles dans la base de données informatisée de la collaboration IeDEA West Africa porte sur l’évolution des caractéristiques cliniques et démographiques à la mise sous TARV en Afrique de l’Ouest.
La proportion de patients mis sous traitement a été croissante au cours du temps avec plus de 50 %des patients qui ont initié le TARV entre 2003 et 2006. Ce qui coïncide bien avec le début des initiatives de l’OMS 3 × 5 et qui a estimé qu’en décembre 2007, trois millions de personnes vivant avec le VIH avaient initié un TARV en Afrique sub-saharienne [1]. L’appui de partenaires extérieurs a été déterminant dans la mise sous TARV. Mais des efforts énormes restent à faire puisque selon le dernier rapport de l’OMS, seulement 31 % des patients infectés ayant besoin d’un TARV l’avaient effectivement débuté [1].
La tendance à la féminisation de l’épidémie à partir de 2000 se confirme aussi en Afrique de l’Ouest comme dans les autres régions africaines [2,9,10]. Elle est quasi identique dans les cinq pays participant à cette collaboration. Ainsi les femmes représentent plus de 60 % des patients mis sous TARV. Cette féminisation s’explique par plusieurs changements. Le lien entre les centres de prévention de la transmission mère–enfant du VIH (PTME) et les centres de prise en charge thérapeutique s’est resserré [11] et les recommandations OMS de la PTME ont changé avec l’initiation de la multithérapie antirétrovirale chez les femmes enceintes qui sont éligibles au TARV [12]. Aussi des facteurs culturels tels l’acceptation de la maladie par la femme, la stigmatisation du VIH surtout le fait des hommes et la plus faible prévalence du VIH chez les hommes par rapport aux femmes contribuent à la féminisation de la pandémie et donc à celle de la prise en charge en Afrique de l’Ouest [2,9,10]. Des programmes spécifiques de prise en charge de l’infection à VIH chez les femmes ont ainsi été multipliés ces dernières années tels les programmes de prise en charge familiale avec la femme comme porte d’entrée [11].
Seulement 30 % des partenaires des femmes infectées par le VIH prises en charge ont pu être identifiés et ont accepté de faire leur test VIH dans ce programme [11]. Il importe donc de renforcer les conditions et accès au traitement en initiant le dépistage et la prise en charge dans les deux sexes.
Des études ont montré que le taux de lymphocytes T4 à la mise sous TARV est le plus important facteur prédictif de la progression de la maladie, notamment des complications infectieuses et de la survie des patients après la mise sous TARV [3–5]. Dans notre étude, le taux de CD4 initial, reste toujours faible (< 200 cellules/µl) quelle que soit la période. En 2005–2006 le taux médian de CD4 à la mise sous TARV était de 139 cellules/µl et on note que plus de 60 %des patients mis sous TARV à cette période l’avaient initié avec des CD4 inférieur à 200 cellules/mm3 et cette proportion ne s’est pas améliorée au cours du temps. Cela pose le problème du diagnostic et de la prise en charge tardifs des patients expliquant la mortalité initiale très élevée à la mise sous TARV [3]. Des barrières culturelles et le manque d’information des patients d’une part, le manque de personnel, d’infrastructure et notamment de laboratoire de référence capable de réaliser en temps réel et de donner des résultats de comptage de CD4 d’autre part, et surtout la stigmatisation des patients VIH pourraient expliquer cette prise en charge tardive. La question d’initier le TARV plus tôt c’est-à-dire le plus proche possible des seuils actuellement recommandés par l’OMS [6,7] est un réel enjeu pour les programmes de prise en charge en Afrique sub-saharienne comparativement aux pays industrialisés, où on note une bien faible proportion de patients VIH qui initie le traitement tardivement.
De manière similaire, la proportion de patients fortement immunodéprimés (stades III et IV) ou au stade C CDC, est restée relativement constante au cours du temps. Entre 2005 et 2006, près de 40 % des patients ont été mis sous traitement à un stade avancé de la maladie alors que les directives OMS préconisent que la prise en charge des patients infectés par le VIH doit commencer si possible avant le stade SIDA [6,7].
Les régimes thérapeutiques ont évolué en fonction des approches individuelles puis de santé publique des recommandations OMS, ainsi que du coût et de la disponibilité des médicaments. La disponibilité des formes combinées comme la Triomune® 30 ou 40 a fait disparaître progressivement les régimes contenant des inhibiteurs de protéase en Afrique de l’Ouest. Ainsi en 2005–2006, près de 86 %des patients ont initié un régime thérapeutique conforme aux recommandations OMS c’est-à-dire l’association de deux INRT et d’un INNRTI. Le fait que les centres IeDEA soient en général des centres de référence pour la prise en charge de l’infection à VIH dans leur pays et le fait que coexistent en Afrique de l’Ouest le VIH-1 et le VIH-2 fait qu’environ 10 % des patients initient comme traitement de première intention un régime contenant un inhibiteur de la protéase.
Nous reconnaissons que les centres de la collaboration IeDEA ne sont pas nécessairement représentatifs de tous les centres de prise en charge en Afrique sub-saharienne, mais les données de plus de 14000 patients ayant débuté un TARV sur une durée d’au moins dix ans permettent d’avoir une idée de l’évolution des caractéristiques individuelles des patients et cliniques à la mise sous TARV. Une des limites de notre étude est que les données importantes comme les CD4 et surtout l’IMC sont parfois manquantes. Ces données ne sont pas toujours disponibles dans les dossiers cliniques des patients posant le problème de la bonne tenue des dossiers cliniques et notamment de la mise à disposition des informations lors du transfert des patients vers des centres spécialisés.
En conclusion, la mise à disposition du TARV est devenue une réalité en Afrique de l’Ouest et les centres cliniques participant à notre collaboration en sont la preuve. On doit cependant faire le constat que cette prise en charge est encore tardive avec une importante perte de chance pour les patients. Enfin le monitorage tant individuel qu’au niveau des files actives des centres cliniques n’est pas sans poser de problèmes. Des études sociocomportementales doivent être initiées pour comprendre pourquoi malgré la disponibilité des antirétroviraux, et les multiples campagnes de sensibilisation, plus de trois quarts des patients infectés par le VIH débutant un TARV le font tardivement et pourquoi une majorité des patients éligibles n’accèdent pas encore au traitement. Ces analyses montrent que des efforts encore substantiels doivent être faits pour une prise en charge précoce de l’infection à VIH.
Remerciements
La collaboration IeDEA West Africa est soutenue par le National Institute of Allergy and Infectious Diseases (NIAID). (Subvention U01 AI069919).
Nous remercions tout particulièrement à l’ISPED de Bordeaux: Rodolphe Thiebaut et Charlotte Lewden pour leur contribution à la rédaction de cet article ainsi que Caroline Williams et Rosemary McKaig (NIAID) pour leur soutien dans la mise ne place de cette collaboration.
La collaboration IeDEA West Africa est ainsi constituée:
investigateur principal: Pr François Dabis (Inserm U897, ISPED, Bordeaux, France);
coordonnateurs des centres clinique (par ordre alphabétique): Clarisse Amani-Bosse, Franck Olivier Ba-Gomis Emmanuel Bissagnene, Eric Delaporte, Constace Kanga-Koffi, Moussa Maiga, Eugène Messou, Albert Minga, Kevin Peterson, Papa Salif Sow, Hamar Traoré, Marcel D Zannou;
autres membres de la collaboration par (ordre alphabétique): Gérard Allou, Xavier Anglaret, Alain Azondékon, Eric Balestre, Jules Bashi, Joseph Drabo, Ye-Diarra, Antoine Jacquet, Didier K Ekouévi, Jean-François Eytard, Alain Kouakoussui, Valériane Leroy, Charlotte Lewden, Karen Malateste, Lorna Renner, Annnie Sasco, Haby Signaté Sy, Rodolphe Thiebault, Marguerite Timité-Konan, Hapsatou Touré;
- centres cliniques adultes:
-
◦médecine interne et tropicale (SMIT), CHU de Treichville, Abidjan, Cote d’Ivoire,
-
◦unité de soins ambulatoires et de conseil (USAC), Abidjan, Cote d’Ivoire,
-
◦centre médical de suivi de donneurs de Sang/CNTS, Abidjan, Cote d’Ivoire,
-
◦ACONDA-MTCT+ adultes, Abidjan, Cote d’Ivoire,
-
◦ACONDA-CePReF, adultes, Abidjan Cote d’Ivoire,
-
◦centre intégré de recherche bioclinique d’Abidjan (CIRBA), Abidjan, Cote d’Ivoire,
-
◦service des maladies infectieuses, CHU de FANN/ISAARV, Dakar, Sénégal,
-
◦projet ANRS 1215 Cohort, Dakar, Sénégal,
-
◦service d’hépato-gastro-entérologie, hôpital Gabriel Touré, Bamako, Mali,
-
◦centre de prise en charge des personnes vivant avec le VIH, hôpital du point G, Bamako, Mali,
-
◦centre de prise en charge des personnes vivant avec le VIH, CHNU, Cotonou, Bénin,
-
◦Fajara Medical Research Council, Banjul, Gambie;
-
◦
- centre de coordination:
-
◦programme PAC-CI, CHU de Treichville, Abidjan, Cote d’Ivoire,
-
◦ISPED, université Victor Segalen Bordeaux 2, France.
-
◦
Références
- 1.WHO/UNAIDS/UNICEF. Vers un accès universel. [Accessed 06 January 2009];Étendre les interventions prioritaires liées au VIH/sida dans le secteur de la santé. Rapport de situation 2008. 2008 Available from: http://www.who.int/hiv/pub/towards_universal_access_report_2008_fr.pdf.
- 2.UNAIDS. [Accessed 06 January 2009];2008 Report on the global AIDS Epidemic. 2008 [cited 200ç 08 November 2008]; Available from: http://www.unaids.org/en/KnowledgeCentre/HIVData/GlobalReport/2008/2008_Global_report.asp.
- 3.Braitstein P, Brinkhof MW, Dabis F, Schechter M, Boulle A, Miotti P, et al. Mortality of HIV-1-infected patients in the first year of antiretroviral therapy: comparison between low-income and high-income countries. Lancet. 2006;367(9513):817–824. doi: 10.1016/S0140-6736(06)68337-2. [DOI] [PubMed] [Google Scholar]
- 4.Stringer JS, Zulu I, Levy J, Stringer EM, Mwango A, Chi BH, et al. Rapid scale-up of antiretroviral therapy at primary care sites in Zambia: feasibility and early outcomes. J Am Med Assoc. 2006;296(7):782–793. doi: 10.1001/jama.296.7.782. [DOI] [PubMed] [Google Scholar]
- 5.Calmy A, Pinoges L, Szumilin E, Zachariah R, Ford N, Ferradini L. Generic fixed-dose combination antiretroviral treatment in resource-poor settings: multicentric observational cohort. AIDS. 2006;20(8):1163–1169. doi: 10.1097/01.aids.0000226957.79847.d6. [DOI] [PubMed] [Google Scholar]
- 6.OMS et ONUSIDA. Élargissement de l’accès au traitement antirétroviral dans le monde: rapport sur l’initiative « 3 millions d’ici 2005 » et au-delà. [Accessed 06 January 2009];Genève, mars 2006. Organisation mondiale de la Santé. 2006 Available from: http://www.who.int/hiv/progreport2006_fr.pdf.
- 7.OMS, ONUSIDA et UNICEF. Vers un accès universel: étendre les interventions prioritaires liées au VIH/sida dans le secteur de la santé. [Accessed 06 January 2009];Rapport de situation, avril 2007. Genève, Organisation mondiale de la Santé. 2007 Available from: http://www.who.int/mediacentre/news/releases/2007/.
- 8.Gilks CF, Crowley S, Ekpini R, Gove S, Perriens J, Souteyrand Y, et al. The WHO public-health approach to antiretroviral treatment against HIV in resource-limited settings. Lancet. 2006;368(9534):505–510. doi: 10.1016/S0140-6736(06)69158-7. [DOI] [PubMed] [Google Scholar]
- 9.Keiser O, Anastos K, Schechter M, Balestre E, Myer L, Boulle A, et al. Antiretroviral therapy in resource-limited settings 1996 to 2006: patient characteristics, treatment regimens and monitoring in sub-Saharan Africa, Asia and Latin America. Trop Med Int Health. 2008;13(7):870–879. doi: 10.1111/j.1365-3156.2008.02078.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Braitstein P, Boulle A, Nash D, Brinkhof MW, Dabis F, Laurent C, et al. Gender and the use of antiretroviral treatment in resource-constrained settings: findings from a multicenter collaboration. J Womens Health. 2008;17(1):47–55. doi: 10.1089/jwh.2007.0353. [DOI] [PubMed] [Google Scholar]
- 11.Tonwe-Gold B, Ekouevi DK, Amani-Bosse C, Toure S, Kone M, Becquet R, et al. Implementing family-focused HIV care and treatment: The first two years’ experience of the MTCT-Plus program in Abidjan, Cote d’Ivoire. Trop Med Int Health. 2009;14(2):204–212. doi: 10.1111/j.1365-3156.2008.02182.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.WHO. Antiretroviral drugs for treating pregnant women and preventing HIV infection in infants in resource-limited settings: towards universal access. [Accessed 06 January 2009];Recommendations for a public health approach. 2006 Available from: http://www.who.int/hiv/pub/guidelines/pmtct/en/index.html.