Abstract
There are presented the most important sources of pluripotent stem cells for potential application in the regenerative medicine. This review summarizes also advantages and disadvantages for potential application of these cells in clinical medicine.
Keywords: Regenerative medicine, Pluripotent stem cells, Embryonic stem cells, Induced pluripotent stem cells, VSELs
Wstęp
Dzięki postępom nauki człowiek sięgnął u progu trzeciego tysiąclecia po technologie, które do tej pory były przypisywane istotom najwyższym. Rozwój fizyki doprowadził do zgłębienia tajników energii jądrowej, rozwój nauk biologicznych i genetyki przybliżył z kolei tajemnice powstawania organizmów i ich regeneracji, wprowadzając tym samym ludzkość w fascynujący świat komórek macierzystych [1, 2]. Komórkom macierzystym poświęca się coraz więcej uwagi i uważa się, że technologie prowadzące do optymalizacji ich klinicznego wykorzystania staną się kluczem do długowieczności w rozwijającej się jako nowa dyscyplina kliniczna medycynie regeneracyjnej [3].
Założeniem medycyny regeneracyjnej jest wykorzystanie komórek macierzystych w terapii uszkodzonych narządów i tkanek. Biorąc pod uwagę ogromny potencjał komórek macierzystych i uwzględniając, jak ważną rolę odgrywają one w codziennej regeneracji szeregu tkanek (m.in. tkanki krwiotwórczej, naskórka czy nabłonka jelitowego), nie można się dziwić, że komórki te stały się przedmiotem żywego zainteresowania klinicystów. Słusznie upatruje się w nich klucz do poprawienia jakości oraz przedłużenia życia ludzkiego [1].
Uważa się, że przeszczepianie całych narządów będzie w przyszłości coraz częściej zastępowane przeszczepami zawiesiny komórek macierzystych, ukierunkowanych dla danego narządu, które będą miały za zadanie regenerację/odbudowę uszkodzonych organów [4, 5]. Szczególne nadzieje na wykorzystanie terapeutyczne komórek macierzystych wiąże się z takimi schorzeniami, jak zawał mięśnia sercowego, udar mózgu, parkinsonizm, cukrzyca, dystrofie mięśniowe, toksyczne uszkodzenia wątroby i nerek. Komórkami macierzystymi interesuje się coraz bardziej nowoczesna gastroenterologia. Wydaje się, że człowiek faktycznie zaczyna sięgać coraz bardziej po upragniony klucz do długowieczności.
Komórki macierzyste – definicja, hierarchia i różnorodność
Mianem komórki macierzystej, jak wspomniano, określa się komórkę mająca zdolność do samoodnawiania oraz różnicowania się w komórki potomne [2]. Definicja ta jest jednak zbyt uproszczona. Wyróżniamy bowiem wiele rodzajów komórek macierzystych, różniących się pomiędzy sobą potencjałem proliferacyjnym oraz zdolnością do różnicowania. W rzeczywistości komórki macierzyste są bardzo różnorodne i trudno je jednoznacznie opisać jedną wspólną definicją. Pula komórek macierzystych utrzymuje w równowadze liczbę komórek somatycznych w organizmie, a tym samym jest odpowiedzialna za odnawianie zużywających się z czasem komórek somatycznych oraz za regenerację narządów i tkanek [3].
Najbardziej charakterystyczną cechą komórki macierzystej jest jej zdolność do samoodnawiania i różnicowania się w coraz to bardziej ukierunkowane narządowo komórki potomne [6]. Stąd też w przedziale komórek macierzystych istnieje duży stopień hierarchii i zróżnicowania od tych najbardziej prymitywnych rozwojowo do bardziej już ukierunkowanych tkankowo/narządowo (Tab. I). Dorosły ssak rozwija się z najwcześniejszej komórki macierzystej, jaką jest zapłodniona komórka jajowa (zygota). Zygota jest komórką macierzystą totipotencjalną (KMT). Komórka taka zgodnie z definicją daje początek zarówno komórkom łożyska, jak i zarodka. Zygota jako KMT po implantacji w macicy może więc dać początek nowemu osobnikowi. KMT na pierwszych etapach rozwoju embrionalnego różnicuje się natychmiast w komórki macierzyste pluripotencjalne (PKM), które występują m.in. w moruli (stadium zarodka składające się z ~30 komórek) oraz następnie w węźle zarodkowym blastocysty (blastocysta składa się z ~250 komórek) [2]. PKM nie mogą odtworzyć łożyska, ale dają początek komórkom wszystkich trzech listków zarodkowych (ektodermy, mezodermy i endodermy) i mogą różnicować się w tzw. ukierunkowane tkankowo komórki macierzyste (UTKM). UTKM ze względu już na ograniczoną możliwość różnicowania do jednego rodzaju tkanki zwane też są komórkami macierzystymi monopotencjalnymi.
Tabela I.
Hierarchia komórek macierzystych (KM) Developmental hierarchy of stem cell compartment
| Totipotencjalne KM(KMT) | Dają początek zarówno ciału zarodka, jak i tkankom łożyska. W warunkach naturalnych totipotencjalnymi komórkami są zapłodniony oocyt (zygota) oraz pierwsze blastomery.W warunkach sztucznych totipotencję zachowuje odpowiednik zygoty – tzw. klonota, powstała na skutek transferu jądra komórki somatycznej do oocytu (nuclear transfer). |
| Pluripotencjalne KM(PKM) | Dają początek komórkom wszystkich trzech listków zarodkowych po przeszczepieniu do rozwijającej się blastocysty. Pluripotencjalnymi są komórki wewnętrznej masy blastocysty oraz epiblastu. |
| Multipotencjalne KM(MKM) | Dają początek komórkom dwóchlistków zarodkowych lub jednego listka zarodkowego. |
| Monopotencjalne KM lub ukierunkowane tkankowo komórki macierzyste (UTKM) | Obejmują tzw. komórki ukierunkowane tkankowo, dające początek komórkom tylko jednej linii. Należą tu m.in. KM nabłonka jelit, krwiotwórcze KM, KM naskórka, KM nerwowe, KM wątroby oraz KM mięśni szkieletowych. |
Obliczono, że z zapłodnionej zygoty (KMT) po około 47 podziałach powstaje podczas rozwoju embrionalnego łącznie ~10 × 105 komórek należących do 200 różnych rodzajów tworzących tkanki i organy ciała człowieka. Komórki macierzyste „pracują” ciężko przez całe życie osobnicze i w wyniku zsynchronizowanych procesów samoodnawiania i różnicowania komórek macierzystych rozwija się i funkcjonuje przez wiele lat dorosły, ciągle regenerujący się organizm. Wiadomo bowiem, że nabłonek jelitowy wymienia się co 48 godzin, naskórek co 14 dni, granulocyty co 1– 5 dni, a erytrocyty mają okres półtrwania 100– 150 dni [7, 8]. W innych narządach i tkankach wymiana zużywanych komórek jest wolniejsza, niemniej istnieją dzisiaj dowody, że nawet takie narządy, jak serce czy mózg, wykazują powolną odnowę biologiczną. Trudno sobie bowiem wyobrazić, aby pojedyncza komórka w narządzie mogła żyć przez 80 lat.
Potencjalne źródła komórek macierzystych do regeneracji tkankowo/narządowej
Koncepcja wykorzystania klinicznego komórek macierzystych pojawiła sie najpierw w hematologii. Od około 45 lat wykorzystuje się bowiem krwiotwórcze komórki macierzyste (KKM), które zgodnie z podaną powyżej definicją należą do przedziału UTKM dla krwiotworzenia, w leczeniu szeregu chorób układu krwiotwórczego [9, 6]. Coraz częściej stosuje się również UTKM naskórka w leczeniu oparzeń skóry lub dla usprawnienia procesu gojenia się owrzodzeń troficznych kończyn. Zaawansowana jest również technologia pozyskiwania fibroblastów szpiku kostnego – tzw. macierzystych komórek mezenchymalnych, które można uważać za UTKM dla tkanki łącznej, w leczeniu ubytków kostnych [7, 10, 11]. Wspólną cechą komórek macierzystych krwiotwórczych, naskórka czy mezenchymalnych jest stosunkowo duża łatwość ich pozyskiwania. Przeciwnie, ze zrozumiałych względów etycznych i technicznych, znacznie trudniej jest uzyskać od zdrowych dawców komórki macierzyste innych tkanek i narządów, jak np. mięśni szkieletowych, mięśnia sercowego, wątroby, wysepek trzustki lub ośrodkowego układu nerwowego, w ilościach pozwalających na ich potencjalne wykorzystanie terapeutyczne.
W związku z powyższym, w ostatnich latach pojawiły się koncepcje wykorzystania bardziej prymitywnych pluripotencjalnych komórek macierzystych (PKM), które jak wspomniano powyżej mają zdolność różnicowania się we wszystkie komórki zarodka – będąc tym samym źródłem UTKM. Wykorzystanie PKM w medycynie klinicznej wzbudziło na świecie spore nadzieje na rozwój nowych metod leczniczych, ale jednocześnie spowodowało szereg dyskusji i emocji natury religijno-etycznej. Problem wykorzystania tych komórek jest różnie postrzegany przez różne religie, gdyż dotyka problemu początku życia człowieka, który jest różnie interpretowany przez różne główne religie świata [1, 12, 13]. Próbując otrzymać wczesno rozwojowe PKM, zbliżamy się bowiem bardzo blisko do TKM, a więc do komórki macierzystej, która może rozwinąć się w dorosłego osobnika. W ten sposób nauka dotyka dogmatów, na jakim etapie embriogenezy zaczyna się życie.
Embrionale i nieembrionalne źródła komórek macierzystych
PKM mogą być potencjalnie pozyskiwane z czterech różnych źródeł, które wymieniono w tabeli II. Każde z tych potencjalnych źródeł ma swoje zalety jak i ograniczenia, które zostaną pokrótce przedstawione poniżej. Omówimy zarówno kontrowersyjne źródła PKM pochodzących z zarodków, jak i PKM otrzymywane z dorosłych tkanek [7, 11]. Takie szersze przedstawienie problemu może być pomocne w zrozumieniu zjawisk, na temat których często wypowiadają się osoby, którym brak jest wiedzy biologicznej, niewiedzący, co kryje się pod konkretnymi pojęciami. Dlatego też nie będziemy unikać trudnych i drażliwych tematów, wierząc, że każdy musi sam dokonać wyboru zgodnie z własnym sumieniem i osobistym światopoglądem, jakie są potencjalne granice wykorzystania różnych źródeł komórek macierzystych w medycynie.
Tabela II.
Różne potencjalne źródła pluripotencjalnych komórek macierzystych (PKM) Various potential sources of pluripotent stem cells
| izolowane z bankowanychzarodków otrzymanych drogą zapłodnienia | izolowane z zarodków otrzymanych poprzez utworzenie klonoty (klonowanie terapeutyczne) | uzyskane w wyniku transformacji komórek somatycznych (indukowane PKM) | |
|---|---|---|---|
| Ryzyko powstania guzow potworniaków | + | + | + |
| Problem niezgodności tkankowej | + | – | +/– |
| Wymagany dawca komórki jajowej | + | + | – |
| Zastrzeżenia natury etycznej | tak | tak/nie* | nie |
Problem różnie postrzegany przez różne główne religie światowe. Szereg religii potencjalnie akceptuje klonowanie terapeutyczne (np. islam, buddyzm, judaizm), ale zdecydowana większość odrzuca klonowanie reprodukcyjne
Pluripotencjalne komórki macierzyste izolowane z zarodków (embrionalne)
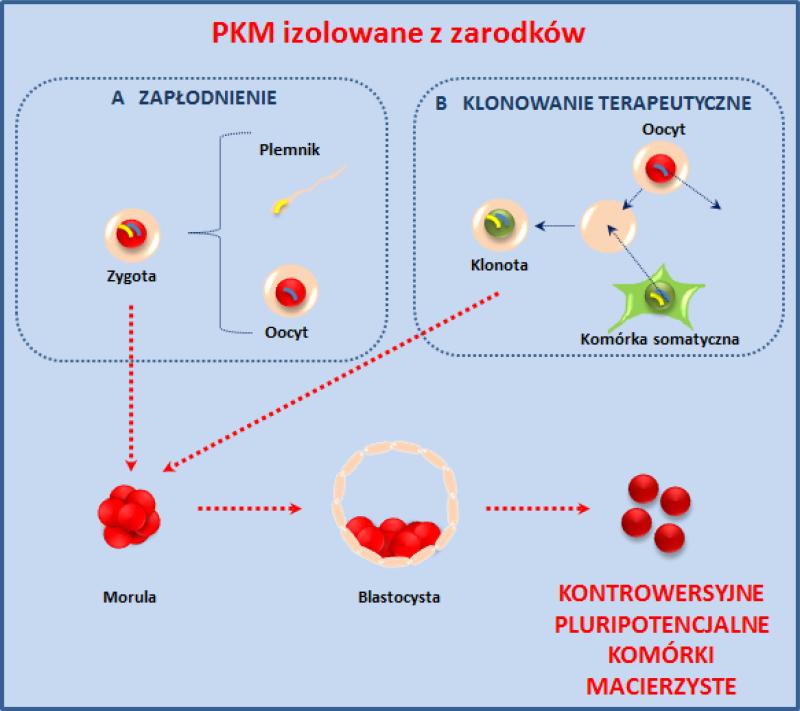
Wiadomo, że tkanki zarodkowe są potencjalnym źródłem PKM. Komórki takie można pozyskać z rozwijającej się moruli lub blastocysty (Ryc. 1), wykorzystując np. zamrożone wczesne „nadliczbowe” morule przechowywane w klinikach, gdzie wykonuje się zapłodnienia in vitro. Wykorzystując takie zarodki, uzyskano pierwsze ustalone ludzkie linie komórek embrionalnych [11, 14]. Zgodnie z dekretem prezydenta Georga Busha, jeśli były one otrzymane przed 9 sierpnia 2001 roku, mogły być legalnie wykorzystane do badań finansowanych z funduszy federalnych. Jeśli otrzymane były „minutę” po północy z 9 na 10 sierpnia 2001 roku, takiego prawa już się nie stosowało. Była to oczywiście sztucznie ustalona granica, która nie rozwiązywała całego problemu. Szybko jednak okazało się, że wiele z około 60 ludzkich linii, na których zezwolono badania jest mało przydatnych. Linie te bowiem szybko zmieniały właściwości w hodowlach in vitro, co spowolniło, a często zatrzymało prowadzone badania.
Rycina 1. PKM obtained from embryos.
PKM pozyskiwane z zarodków. Panel A – PKM obdarzone właściwościami różnicowania się w komórki wszystkich trzech listków zarodkowych pozyskuje się poprzez ekspansję PKM izolowanych z węzła zarodkowego blastocysty. Blastocystę można otrzymać in vitro z moruli, która powstaje z zygoty drogą zapłodnienia komórki jajowej przez plemnik in vitro. Panel B – PKM można również pozyskać na drodze tzw. klonowania terapeutycznego, podczas którego zamiast zapłodnienia komórki jajowej przez plemnik wprowadza się do cytoplazmy enukleowanej uprzednio komórki jajowej jądro dojrzałej komórki somatycznej (np. fibroblastu). W wyniku tego procesu zwanego jako „przeniesienie jądra” (nuclear transfer) powstaje klonota, która podobnie jak zygota może dać początek moruli, a potem blastocyście. Warto nadmienić, że zarówno zygota jak i klonota, jeśli zostaną umieszczone w macicy, utworzą dojrzałego osobnika. Jeśli osobnik taki powstaje z klonoty, mówimy o tzw. klonowaniu reprodukcyjnym. Zastosowanie tego typu strategii w wypadku człowieka budzi szereg zastrzeżeń natury etycznej.
Źródło PKM z zarodków pochodzących od dawców do potencjalnych terapii budzi jednak również sporo zastrzeżeń natury naukowej. Zarodki takie, jak wiadomo, są tkankowo odmienne od potencjalnego biorcy komórek. W związku z powyższym, ustalone linie komórek embrionalnych będą różnicowały się w komórki, które będą miały inny zestaw antygenów układu zgodności tkankowej niż potencjalny biorca. Będą więc rozpoznawane przez układ immunologiczny biorcy jako całkowicie obce, gdyż zarodek pochodził od niezgodnego w układzie HLA dawcy [15]. Ponadto trudno sobie wyobrazić, biorąc pod uwagę względy etyczne i techniczne (dostęp do komórek rozrodczych rodziców), że otrzymywałoby się takie zarodki dla konkretnego pacjenta „na zamówienie” od biologicznych rodziców. Badania u zwierząt doświadczalnych wykazały ponadto, że podanie komórek ustalonych linii embrionalnych powoduje u nich powstawanie potworniaków [16, 17]. Dlatego też pozyskiwanie PKM dla celów klinicznych z normalnych ludzkich zarodków zostało słusznie zarzucone. Pozostał niemniej jednak trudny dylemat, co zrobić z zamrożonymi w bankach na świecie zarodkami. Trzymać je w nieskończoność w stanie hibernacji, rozmrozić i zniszczyć czy też wykorzystać do badań podstawowych.
Pluripotencjalne komórki macierzyste uzyskiwane w wyniku klonowania terapeutycznego
Biorąc pod uwagę aspekty natury etycznej i problemy techniczne w pozyskiwaniu normalnych ludzkich zarodków oraz świadomość, że PKM otrzymywane z takich zarodków będą różnicowały się w niezgodne tkankowo z biorcą tkanki, opracowano strategię pozyskiwania PKM z wczesnych zarodków tworzonych w laboratorium w wyniku tzw. klonowania terapeutycznego (Tab. II).
Strategia klonowania terapeutycznego polega na utworzeniu in vitro komórki, która jest równa pod względem potencjału rozwojowego zygocie [18, 19]. Komórka taka zwana jest „klonotą” (Ryc.1). Podczas tworzenia klonoty wykorzystuje się „jako inkubator biochemiczny” cytoplazmę komórki jajowej, z której uprzednio usuwa sie jądro mające połowę (haploidalną liczbę) chromosomów. Do pozbawionej jądra komórki jajowej wprowadza się następnie jądro dojrzałej komórki somatycznej (np. jądro fibroblastu lub limfocytu), która ma pełen diploidalny garnitur chromosomalny. Proces ten różni się od zapłodnienia tym, że w przeciwieństwie do zapłodnienia nie występuje tutaj połączenie haploidalnej liczby chromosomów matki i haploidalnej liczby chromosomów ojca w unikatowy diploidalny zestaw genów, przeciwnie – wszystkie chromosomy (zestaw diplioidalny) w tym i geny zgodności tkankowej pochodzą z komórki dawcy jądra [20].
Po przeniesieniu jądra somatycznego do cytoplazmy komórki jajowej wprowadzone chromosomy ulegają „odróżnicowaniu”. Jak wspomniano, cytoplazma komórki jajowej jest unikatowym inkubatorem biochemicznym zawierającym szereg enzymów mogących modyfikować DNA. Ogólnie ujmując, proces ten polega na procesach demetylacji DNA oraz odpowiedniej rearanżacji i ustaleniu odpowiedniego wzoru metylacji i acetylacji białek histonowych. Wszystko to prowadzi do rozluźnienia struktury chromatyny i powrotu zróżnicowanego już rozwojowo DNA z komórki somatycznej dawcy do stanu, jaki miało ono w zapłodnionej komórce jajowej. Umożliwia to ekspresję wczesnych rozwojowo genów.
Powstaje tym samym klonota będąca sztucznie stworzonym rodzajem KMT, która w odróżnieniu od zygoty posiada zestaw chromosomów – tym samym geny kodujące układ zgodności tkankowej, zgodny z komórką, od której pochodziło jądro. Strategia ta znana jako przeniesienie jądra komórkowego do komórki jajowej (nuclear transfer), jest ciągle jeszcze jednak w stadium eksperymentalnym w modelach zwierzęcych u ssaków. Jak wiadomo, ostatni głośny skandal w Korei wykazał, że wbrew wcześniejszym doniesieniom nie udało sie otrzymać ludzkiej klonoty. Niemniej jednak ostatnio grupa z Uniwersytetu w Oregonie, USA wykazała, że jest to technicznie możliwe. Dyskusja nad wykorzystaniem ludzkich zarodkow otrzymanych techniką transferu jądrowego rozpocznie się zatem na nowo [21].
Należy nadmienić, że szereg emocji natury etycznej budzi potencjał rozwojowy klonoty [21]. Jak wspominano, klonota podobnie jak zapłodniona komórka jajowa jest komórką totipotecjalną (TKM). W hodowlach in vitro może dać początek moruli i blastuli, z których można pozyskać PKM, podobnie jak to próbowano czynić z zarodków rozwijających się w wyniku fizjologicznego zapłodnienia. Strategia pozyskiwania takich komórek z zarodków tworzonych przez klonotę, znana jest pod nazwą tzw. klonowania terapeutycznego. Z drugiej jednak strony, jeżeli klonotę umieści się w macicy, może ona podobnie jak zygota dać początek nowemu osobnikowi. Powoduje to duże opory natury etycznej, gdyż stwarza podstawy tzw. klonowania reprodukcyjnego. W ten sposób otrzymano np. słynną owcę Dolly [22]. Możliwość klonowania terapeutycznego jako drogi pozyskania komórek zgodnych z dawcą jądra komórkowego jest dopuszczana przez niektóre kręgi religijno-kulturowe. Jak jednak wspomniano, należy się cieszyć, że nie udało się do tej pory uzyskać ludzkiej klonoty i pochodzących z niej ludzkich PKM [23].
Mimo to teoretyczna możliwość uzyskania ludzkich PKM na drodze klonowania terapeutycznego spowodowała ostrą krytykę ze strony kręgów kulturowo-religijnych. Postawiono bowiem słuszny zarzut, że zarodek otrzymany z klonoty powinien być traktowany jako istota żywa. W odpowiedzi na te zarzuty zaproponowano szereg modyfikacji pozyskiwania PKM z zarodków. Zgodnie z powyższym, PKM zaczęto pozyskiwać z zarodków uzyskanych w wyniku partenogenezy (omijając proces fizjologicznego zapłodnienia), drogą mikrobiopsji rozwijającej się moruli uzyskując pojedyncze blastomery będące materiałem wyjściowym do namnażania PKM czy też tworząc niezdolne rozwojowo zarodki poprzez wprowadzenie tzw. „genu samobójczego” który uniemożliwia ukończenie pełnej emrbiogenezy [24].
Oprócz oporów natury etyczno-religijnej główną przeszkodą szerszego wykorzystania klonowania terapeutycznego okazała się potrzeba dostępu do ludzkich komórek jajowych (oocytów) oraz obserwacje, że PKM otrzymane z zwierzęcych klonot tworzą również, podobnie jak komórki embrionalne, u zwierząt doświadczalnych potworniaki.
Komórki macierzyste pozyskiwane z dorosłych tkanek
Niejako równolegle z pierwszymi doniesieniami, że możliwe jest pozyskanie ludzkich linii komórek embrionalnych, zaczęto poszukiwać alternatywnych źródeł PKM. Pozyskanie takich komórek było oczekiwane szczególnie z zainteresowaniem przez oponentów stosowania komórek embrionalnych w medycynie regeneracyjnej. Nie będzie przesadą stwierdzenie, że niejako „oczekiwano” pojawienia się takich potencjalnych źródeł. Z tego więc powodu kilka lat temu zaproponowano teorię tzw. „plastyczności komórek macierzystych” lub ich zdolności do „transróżnicowania”. Zgodnie z tą teorią, UTKM np. KKM pozyskane ze szpiku kostnego, skąd stosunkowo łatwo je wyizolować, byłyby zdolne do odróżnicowania się w komórki macierzyste swoiste dla innych narządów, np. mięśnia sercowego, ośrodkowego układu nerwowego lub wątroby [25, 26]. Ogromne nadzieje pokładano w potencjalnym zastosowaniu KKM izolowanych ze szpiku kostnego, mobilizowanej krwi obwodowej oraz krwi pępowinowej w terapiach regeneracyjnych uszkodzonych narządów i tkanek. Szereg artykułów naukowych, opublikowanych w najlepszych pismach naukowych, sugerowało teorię plastyczności KKM, demonstrując pozytywne wyniki wykorzystania tych komórek w zwierzęcych modelach regeneracyjnych w zawale serca [27], udarze mózgu [28], mechanicznym uszkodzeniu rdzenia kręgowego [29] oraz toksycznym uszkodzeniu wątroby [30].
Pomimo przytoczonych powyżej obiecujących wyników rola szpiku kostnego oraz zawartych w nim KKM w regeneracji uszkodzonych narządów budziła jednak od początku kontrowersje [31, 32]. Seria badań z zastosowaniem fenotypowo zdefiniowanych i oczyszczonych subpopulacji macierzystych komórek hematopoetycznych przyniosła bowiem rozczarowanie, ukazując negatywne wyniki w modelach regeneracji mięśnia sercowego [33] oraz mózgu [34]. Te nieoczekiwane obserwacje podważyły koncepcje plastyczności KKM. Część uzyskanych poprzednio pozytywnych wyników zaczęto tłumaczyć poprzez fenomen fuzji komórkowej [35]. Według tej teorii, przeszczepiane KKM mogłyby ulegać fuzji (stopieniu) z komórkami uszkodzonych narządów. Tak więc komórki w uszkodzonych narządach, leczonych przeszczepionymi KKM, były wtedy heterokarionami powstałymi na skutek fuzji przeszczepionych KKM oraz komórek należących do uszkodzonego narządu. Warto nadmienić, że fuzja komórkowa należy jednak do bardzo rzadkich, przypadkowych zjawisk i nie może w pełni tłumaczyć opublikowanych pozytywnych wyników badań wskazujących udział komórek izolowanych z dorosłych tkanek w regeneracji. Zaczęto więc poszukiwać innego wytłumaczenia „zjawiska plastyczności” komórek macierzystych.
Ostatnie doniesienia wskazały m.in. na możliwość modyfikacji fenotypu komórek znajdujących się w tkankach poprzez przeniesienie receptorów komórkowych, białek cytoplazmatycznych oraz mRNA z sąsiednich komórek, za pomocą wymiany mikrofragmentów komórkowych (microvesicles). Mikrofragmenty komórkowe są kulistymi strukturami, w których fragment cytoplazmy komórkowej jest otoczony błoną komórkową [36, 37]. Złuszczanie mikrofragmentów z powierzchni błony komórkowej opisane zostało jako zjawisko fizjologiczne towarzyszące wzrostowi komórek oraz ich aktywacji w procesach, takich jak np. niedotlenienie tkanek czy ich uszkodzenie [37]. W związku z tym, wspomniane przeniesienie receptorów powierzchniowych, białek oraz informacji genetycznej, jaką jest mRNA, pomiędzy wszczepionymi KKM szpiku kostnego a komórkami gospodarza za pomocą mikrofragmentów błonowych mogłoby przejściowo prowadzić do zmiany fenotypu komórek uszkodzonego organu.
Wydaje się to jednak najbardziej logicznym wytłumaczeniem wyjaśniającym pozytywne wyniki wykazujące „plastyczność” KKM oraz udział komórek szpikowych w regeneracji uszkodzonych narządów. Od początku badań nad plastycznością nie wzięto poważnie pod uwagę możliwości, że szpik kostny zawiera heterogenną populację komórek macierzystych [38, 39]. To oraz brak odpowiednich kontroli w prowadzonych badaniach nad regeneracją tkanek niehematopoetycznych z udziałem przeszczepionych komórek szpiku kostnego oraz krwi pępowinowej doprowadziło do wielu nieścisłości i niewłaściwych interpretacji omawianych zjawisk. Zgodnie z powyższym, najlepszym wyjaśnieniem zjawiska plastyczności KKM wydaje się obecność w szpiku kostnym, mobilizowanej krwi obwodowej oraz krwi pępowinowej heterogennej populacji komórek macierzystych, których udział w regeneracji uszkodzonych tkanek może tłumaczyć opisywane zjawiska „plastyczności i transróżnicowania” KKM [39]. Występowania wczesnych rozwojowo niehematopoetycznych komórek macierzystych w szpiku kostnym, krwi obwodowej lub pępowinowej może zatem wyjaśnić bardziej wiarygodnie niż transróżnicowanie KKM pozytywne wyniki „plastyczności” [39].
Rozpoczęto więc poszukiwania takich komórek w szpiku kostnym, krwi pępowinowej i mobilizowanej krwi obwodowej. Planem tych poszukiwań było zidentyfikowanie m.in. populacji tzw. małych komórek embrionalnopodobnych komórek macierzystych (very small embryonic-like stem cells; VSELs). Wykazano, że komórki te są zdeponowane w tkankach podczas rozwoju embrionalnego jako populacja PKM i źródło dla bardziej zróżnicowanych UTKM. Stanowią one jednak bardzo rzadką populację komórek, np. w dorosłym szpiku kostnym ok. 1 komórka VSEL przypada na 104– 105 komórek jednojądrowych [40, 41]. Wykazano również, że szpik kostny jak inne tkanki młodych osobników zawiera więcej komórek o fenotypie VSELs i liczba tych komórek maleje z wiekiem [42]. Wiadomo, że komórki te pojawiają się w krwi obwodowej w stanach uszkodzeń narządowych, uwidaczniając niejako naturalny mechanizm organizmu polegający na mobilizacji tych komórek, aby brały udział w próbie regeneracji uszkodzonych tkanek [43, 44]. Z myślą o wykorzystaniu tych komórek do potencjalnych celów terapeutycznych niezbędne staje się szybkie opracowanie skutecznej metody ekspansji tych komórek ex vivo.
Indukowane PKM (ind-PKM)
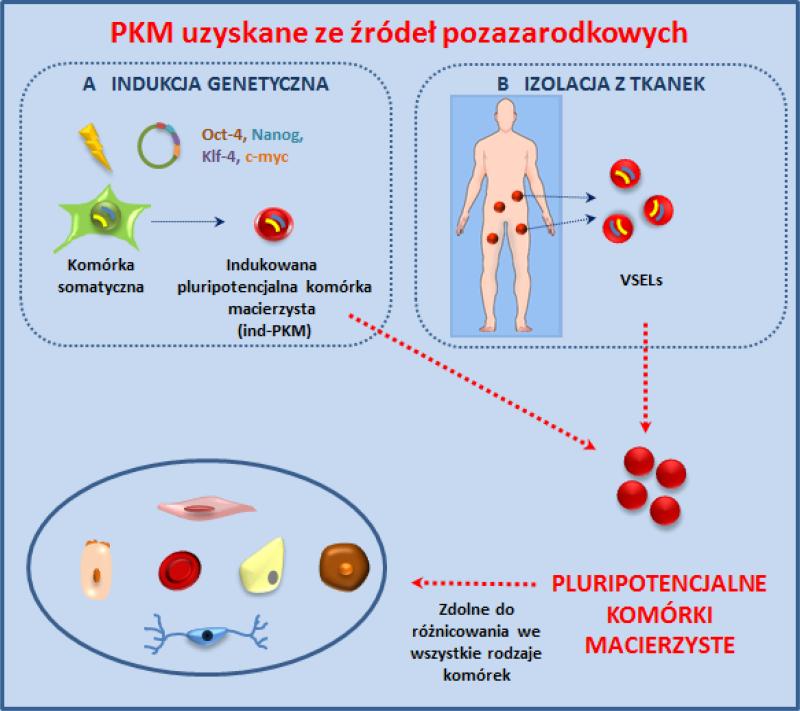
Innym rodzajem PKM, które zaproponowano ostatnio jako alternatywę dla komórek izolowanych z zarodków, są tzw. indukowane PKM (ind-PKM) (Ryc. 2). Komórki te są uzyskiwane w wyniku transformacji hodowlanych in vitro dorosłych komórek somatycznych za pomocą genów kodujących czynniki transkrypcyjne kluczowe dla rozwoju komórek embrionalnych (Oct-4, Nanog, Klf4, c-myc). Geny te wprowadzane są do komórki somatycznej (np. komórki fibroblastu) za pomocą wektorów retrowirusowych [45]. W wyniku powyższej strategii można uzyskać transformowaną komórkę, która ma szereg właściwości PKM (m.in. różnicuje się w komórki pochodzące ze wszystkich trzech listków zarodkowych).
Rycina 2. PKM obtained from sources extraembryonic.
PKM pozyskiwane ze źródeł pozazarodkowych. Panel A – PKM można pozyskać, transformując komórki somatyczne izolowane z tkanek dorosłych osobników (np. fibroblasty) za pomocą genów kodujących embrionalne czynniki transkrypcyjne (np. Oct-4, Nanog, Klf-4, c-myc). Powstające w wyniku transformacji tzw. ind-PKM mają wiele cech podobnych do PKM pozyskiwanych drogą klonowania terapeutycznego, m.in. zgodny z dawcą komórki układ antygenów zgodności tkankowej. Panel B – PKM mogą również być izolowane z tkanek dojrzałych osobników. Takimi komórkami są np. VSELs, wykazujące szereg cech komórek embrionalnych. Jak przypuszczamy, komórki te pochodzą z epiblastu i zostają zdeponowane w rozwijających się podczas embriogenezy narządach, gdzie następnie przebywają w stanie „uśpienia”. Obecnie prowadzone są intensywne prace nad „wybudzeniem” tych komórek, tak aby je w pełni wykorzystać w medycynie regeneracyjnej.
Transformacja taka jest jednak stosunkowo rzadka, średnio jedna komórka na kilka tysięcy poddanych powyższej manipulacji genetycznej ulega transformacji (indukcji do stanu embrionalnego) i zaczyna proliferować, tworząc klon składający się z ind-PKM [45, 46]. Jest to jednak trudny do kontrolowania proces, a komórki uzyskane w wyniku powyższej strategii, podobnie jak komórki embrionalne izolowane z zarodków, tworzą potworniaki w modelach doświadczalnych u zwierząt laboratoryjnych. Wprowadzanie do komórek somatycznych genów indukujących powstanie ind-PKM zaburza ponadto strukturę i organizację DNA, co może potencjalnie prowadzić do indukowania mutacji i powstania komórek nowotworowych.
Obecnie próbuje się uzyskać ind-PKM, ograniczając liczbę wprowadzonych genów (np. transformując komórki tylko za pomocą pojedynczego genu Oct-4) oraz próbując zastąpić wprowadzane geny pewnymi niskocząsteczkowymi molekułami, które bezpośrednio mogą „odróżnicowywać” DNA w komórkach somatycznych [47]. Wydaje się, że jest to bardziej obiecująca strategia pozyskiwania ind-PKM w porównaniu z transformacją komórek za pomocą wprowadzanych genów w niekontrolowany sposób do chromosomów.
Przyjmuje się, że ind-PKM są alternatywą komórek pozyskiwanych z zarodków m.in. również tych otrzymywanych na drodze klonowania terapeutycznego. Otrzymanie ind-PKM nie wymaga dostępu do ludzkich komórek jajowych, a co najważniejsze, komórki powstające z ind-PKM, podobnie jak te otrzymywane drogą klonowania terapeutycznego, będą miały te same geny kodujące układ zgodności tkankowej jak potencjalny biorca. Mogłyby być wykorzystane w klinice bez ryzyka odrzucenia powstających z nich tkanek. Co najważniejsze, o ile strategia klonowania terapeutycznego nie powiodła się jak do tej pory w przypadku komórek człowieka, otrzymano już szereg ludzkich linii komórek ind-PKM.
Należy jednak nadmienić, że ind-PKM niestety rownież powodują powstawanie potworniaków i są odrzucane przez organizm biorcy w modelach zwierzęcych [45, 47]. Problemem jest rownież duża niestabilność genetyczna tch komórek i występowanie w nich licznych aberracji chromosomalnych [48].
Komórki pluripotencjalne izolowane z dorosłych tkanek
Szereg grup doświadczalnych opisało występowanie w dorosłych tkankach komórek o charakterze PKM i MKM. Komórki takie mają różne nazwy (Tab. III). Najprawdopodobniej, stosując odmienne techniki izolacji i hodowli, zidentyfikowano komórki o podobnych lub zbliżonych właściwościach. W odpowiednich modelach doświadczalnych komórki te mogą się różnicować w komórki trzech, dwóch lub jednego listka zarodkowego.
Tabela III.
Najważniejsze różne potencjalne źródła pluripotencjalnych komórek macierzystych (PKM) oraz multipotencjalnych komórek macierzystych (MKM)izolowanych z doroslych tkanek The most important sources of pluripotent and multipotent stem cells isolated form the adult tissues
| Nazwa proponowana przez odkrywców | Procedura izolacji i identyfikacji komórki | Referenecje |
|---|---|---|
| Komórki ELH | Izolowane podczas elutriacji (E), usunięcia komórek liniowo pozytywnych(L) oraz po homingu do szpiku kostnego (H). Dają początek komórkom epitelium. | [60–62] |
| Spore-likestemcells | Małe komórki o średnicy ~5 μm izolowane z różnych mysich tkanek, Oct-4+, różnicujące się w komórki różnych tkanek. | [63] |
| VSELs | Małe komórki Sca-1+Lin-CD45- u myszy oraz CD133+Lin-CD45- u człowieka. Mają ekspresję markerów typowych dla pluripotencjalnych komórek epiblastu, uczestniczą prawdopodobnie w formowaniu listków zarodkowych i dają początek różnym liniom komórkowym. | [40, 64] |
| Komórki o charakterze embrionalnym z ludzkiej krwi pępowinowej | Małe komorki CD45-, CD33-, CD7-, CD235a-mające ekspresję Oct4 and Sox2, mogące różnicować się w neurony. | [65] |
| Omnicyty | Małe Oct-4+ KM biorące udział w tworzeniu chimeryzmu matczyno-płodowego. | [66] |
| Multipotencjalne KM izolowane z dorosłych tkanek (MASC) | Komórki izolowane z dorosłych tkanek poddające się ekspansji w komórki poszczególnych narządów. | [67] |
Ciekawą populacją wczesnych rozwojowo komórek zdeponowanych w rozwijających się tkankach są m.in. tzw. małe komórki przypominające komórki embrionalne (very small embryonic like stem cells; VSELs) [49]. Cechą charakterystyczną komórek VSELs jest ekspresja markerów typowych dla pluripotencjalnych komórek epiblastu, które to we wczesnych etapach embriogenezy podczas gastrulacji uczestniczą w formowaniu listków zarodkowych i dają początek różnym liniom komórkowym. Badacze uważają, że komórki VSELs deponowane stopniowo w rozwijających się tkankach odgrywają ważną rolę w utrzymywaniu puli tkankowo specyficznych komórek macierzystych. Stanowią one pierwotne źródło wszystkich komórek rozwijającego się organizmu podczas ontogenezy, przeżywają w dojrzałych tkankach i tym samym pozostają źródłem ukierunkowanych tkankowo komórek macierzystych. W odpowiedzi na uszkodzenie tkanek i narządów (np. w zawale mięśnia sercowego, udarze mózgu) VSELs mogą być mobilizowane i krążyć we krwi obwodowej [44, 50-53]. Ponadto, jak wykazano, modyfikacja metylacji niektórych genów wykazujących piętno genomowe chroni VSELs przed niekontrolowaną proliferacją i tworzeniem potworniaków. Z naszych badań wynika również, że aby VSELs mogły w pełni wykazać swój potencjał regeneracyjny, muszą być również w pełni funkcjonalne. Nie można wykluczyć możliwości, że VSELs rezydujące w szpiku kostnym są funkcjonalnie „zablokowane”, pozostając w stadium swoistego „uśpienia”, wymagając odpowiednich sygnałów aktywacyjnych, których na razie jeszcze w pełni nie znamy [5, 40].
Potencjalnym ograniczeniem ich wykorzystania obecnie dla celów terapeutycznych jest stosunkowo niska liczba tych komórek w dorosłym szpiku kostnym (1 komórka VSEL na 104– 105 komórek jednojądrowych szpiku kostnego). Dlatego tak ważne jest opracowanie protokołów służących do skutecznej ekspansji tych komórek. Co więcej, z naszych obserwacji wynika, że liczba VSELs jest wyższa u młodych osobników i maleje wraz z wiekiem [40].
Wyniki otrzymane w naszym laboratorium [54-55] oraz w innych niezależnych laboratoriach [56-59] wskazują jednak, że VSELs mogą stanowić realną alternatywę dla komórek pozyskiwanych np. drogą tzw. klonowania terapeutycznego czy ind-PKM. W czasie kiedy trwa etyczno-religijna debata nad zastosowaniem komórek embrionalnych w klinice, istnieje uzasadniona potrzeba zbadania potencjału terapeutycznego VSELs jako alternatywnego źródła komórek do terapii. Musimy więc jak najszybciej znaleźć odpowiedź na pytanie, czy izolowane z tkanek dorosłych osobników VSELs mogą być efektywnie zastosowane w klinice. Nadchodzące lata z pewnością przyniosą ważne odpowiedzi na postawione pytania.
Acknowledgments
Finansowanie/Financial support
Nie występuje.
Footnotes
Publisher's Disclaimer: This is a PDF file of an unedited manuscript that has been accepted for publication. As a service to our customers we are providing this early version of the manuscript. The manuscript will undergo copyediting, typesetting, and review of the resulting proof before it is published in its final citable form. Please note that during the production process errors may be discovered which could affect the content, and all legal disclaimers that apply to the journal pertain.
Wkład autorów /Authors’ contributions
Według kolejności.
Konflikt interesu/ Conflict of interest
Nie występuje.
Etyka/Ethics
Treści przedstawione w artykule są zgodne z zasadami Deklaracji Helsińskiej, dyrektywami EU oraz ujednoliconymi wymaganiami dla czasopism biomedycznych.
Piśmiennictwo
- 1.Popiela T. Medycyna kliniczna na progu trzeciego millenium - refleksje osobiste. Adv Clin Exp Med. 2003;12:405–408. [Google Scholar]
- 2.O'Farrell PH, Stumpff J, Su TT. Embryonic cleavage cycles: how is a mouse like a fly? Curr Biol. 2004;14:35–45. doi: 10.1016/j.cub.2003.12.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Moore KA, Lemischka IR. Stem cells and their niches. Science. 2006;311:1880–1884. doi: 10.1126/science.1110542. [DOI] [PubMed] [Google Scholar]
- 4.Alison MR, Islam S. Attributes of adult stem cells. J Pathol. 2009;217:144–160. doi: 10.1002/path.2498. [DOI] [PubMed] [Google Scholar]
- 5.Kucia M, Ratajczak J, Ratajczak MZ. Are bone marrow stem cells plastic or heterogenous – that is the question. Exp Hematol. 2005;33:613–623. doi: 10.1016/j.exphem.2005.01.016. [DOI] [PubMed] [Google Scholar]
- 6.Ratajczak MZ. Phenotypic and functional characterization of hematopoietic stem cells. Current Opinion Hematol. 2008;15:293–300. doi: 10.1097/MOH.0b013e328302c7ca. [DOI] [PubMed] [Google Scholar]
- 7.Hipp J, Atala A. Sources of stem cells for regenerative medicine. Stem Cell Rev. 2008;4:3–11. doi: 10.1007/s12015-008-9010-8. [DOI] [PubMed] [Google Scholar]
- 8.Leedham SJ, Brittan M, McDonald SAC, Wright NA. Intestinal stem cells. J Cell Mol. 2005;9:11–24. doi: 10.1111/j.1582-4934.2005.tb00333.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Lo Celso C, Scadden D. Isolation and transplantation of hematopoietic stem cells (HSCs). J Vis Exp. 2007;4:157–162. doi: 10.3791/157. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues. Science. 1997;276:71–74. doi: 10.1126/science.276.5309.71. [DOI] [PubMed] [Google Scholar]
- 11.Stocum DL, Zupanc GK. Stretching the limits: stem cells in regeneration science. Dev Dyn. 2008;237:3648–3671. doi: 10.1002/dvdy.21774. [DOI] [PubMed] [Google Scholar]
- 12.Lo B, Kriegstein A, Grady D. Clinical trials in stem cell transplantation: guidelines for scientific and ethical review. Clin Trials. 2008;5:517–522. doi: 10.1177/1740774508096705. [DOI] [PubMed] [Google Scholar]
- 13.Lo B, Zettler P, Cedars MI, et al. A new era in the ethics of human embryonic stem cell research. Stem Cells. 2005;23:1454–1459. doi: 10.1634/stemcells.2005-ed.4. [DOI] [PubMed] [Google Scholar]
- 14.Zhu WZ, Hauch KD, Xu C, Laflamme MA. Human embryonic stem cells and cardiac repair. Transplant Rev. 2009;23:53–68. doi: 10.1016/j.trre.2008.05.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Cabrera CM, Cobo F, Nieto A, Concha A. Strategies for preventing immunologic rejection of transplanted human embryonic stem cells. Cytotherapy. 2006;8:517–518. doi: 10.1080/14653240600944287. [DOI] [PubMed] [Google Scholar]
- 16.Blum B, Benvenisty N. The tumorigenicity of human embryonic stem cells. Adv Cancer Res. 2008;100:133–158. doi: 10.1016/S0065-230X(08)00005-5. [DOI] [PubMed] [Google Scholar]
- 17.Andrews PW, Matin MM, Bahrami AR, et al. Embryonic stem (ES) cells and embryonal carcinoma (EC) cells: opposite sides of the same coin. Biochem Soc Trans. 2005;33:1526–1530. doi: 10.1042/BST0331526. [DOI] [PubMed] [Google Scholar]
- 18.Hwang WS, Lee BC, Lee CK, Kang SK. Cloned human embryonic stem cells for tissue repair and transplantation. Stem Cell Rev. 2005;1:99–109. doi: 10.1385/SCR:1:2:099. [DOI] [PubMed] [Google Scholar]
- 19.Yang X, Smith SL, Tian XC, et al. Nuclear reprogramming of cloned embryos and its implications for therapeutic cloning. Nat Genet. 2007;39:295–302. doi: 10.1038/ng1973. [DOI] [PubMed] [Google Scholar]
- 20.McHugh PR. Zygote and “clonote” ... the ethical use of embryonic stem cells. N Engl J Med. 2004;351:209–211. doi: 10.1056/NEJMp048147. [DOI] [PubMed] [Google Scholar]
- 21.Tachibana M, Amato P, Sparman M, et al. Human embryonic stem cells derived by somatic cell nuclear transfer. Cell. May 15 doi. 2013:10. doi: 10.1016/j.cell.2013.05.006. 1016/j.cell.2013.05.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Green RM. Can we develop ethically universal embryonic stem-cell lines? Nat Rev Genet. 2007;8:480–485. doi: 10.1038/nrg2066. [DOI] [PubMed] [Google Scholar]
- 23.Tsunoda Y, Kato Y. Recent progress and problems in animal cloning. Differentiation. 2002;69:158–161. doi: 10.1046/j.1432-0436.2002.690405.x. [DOI] [PubMed] [Google Scholar]
- 24.Brevini TA, Gandolfi F. Parthenotes as a source of embryonic stem cells. Cell Prolif. 2008;41:20–30. doi: 10.1111/j.1365-2184.2008.00485.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Mezey E, Chandross KJ, Harta G, et al. Turning blood into brain: cells bearing neuronal antigens generated in vivo from bone marrow. Science. 2000;290:1779–1782. doi: 10.1126/science.290.5497.1779. [DOI] [PubMed] [Google Scholar]
- 26.Quesenberry PJ, Abedi M, Aliotta J, et al. Stem cell plasticity: an overview. Blood Cells Mol Dis. 2004;32:1–4. doi: 10.1016/j.bcmd.2003.09.007. [DOI] [PubMed] [Google Scholar]
- 27.Orlic D, Kajstura J, Chimenti S, et al. Bone marrow cells regenerate infarcted myocardium. Nature. 2001;410:701–705. doi: 10.1038/35070587. [DOI] [PubMed] [Google Scholar]
- 28.Hess DC, Abe T, Hill WD, et al. Hematopoietic origin of microglial and perivascular cells in brain. Exp Neurol. 2004;186:134–144. doi: 10.1016/j.expneurol.2003.11.005. [DOI] [PubMed] [Google Scholar]
- 29.Corti S, Locatelli F, Donadoni C, et al. Neuroectodermal and microglial differentiation of bone marrow cells in the mouse spinal cord and sensory ganglia. J Neurosci Res. 2002;70:721–733. doi: 10.1002/jnr.10455. [DOI] [PubMed] [Google Scholar]
- 30.Petersen BE, Bowen WC, Patrene KD, et al. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168–1170. doi: 10.1126/science.284.5417.1168. [DOI] [PubMed] [Google Scholar]
- 31.Orkin SH, Zon LI. Hematopoiesis and stem cells: plasticity versus developmental heterogeneity. Nat Immunol. 2002;3:323–328. doi: 10.1038/ni0402-323. [DOI] [PubMed] [Google Scholar]
- 32.Wagers AJ, Sherwood RI, Christensen JL, Weissman IL. Little evidence for developmental plasticity of adult hematopoietic stem cells. Science. 2002;297:2256–2259. doi: 10.1126/science.1074807. [DOI] [PubMed] [Google Scholar]
- 33.Murry CE, Soonpaa MH, Reinecke H, et al. Haematopoietic stem cells do not transdifferentiate into cardiac myocytes in myocardial infarcts. Nature. 2004;428:664–668. doi: 10.1038/nature02446. [DOI] [PubMed] [Google Scholar]
- 34.Castro RF, Jackson KA, Goodell MA, et al. Failure of bone marrow cells to transdifferentiate into neural cells in vivo. Science. 2002;297:1299. doi: 10.1126/science.297.5585.1299. [DOI] [PubMed] [Google Scholar]
- 35.Lucas JJ, Terada N. Cell fusion and plasticity. Cytotechnology. 2003;41:103–109. doi: 10.1023/A:1024870605447. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Janowska-Wieczorek A, Majka M, Kijowski J, et al. Platelet-derived microparticles bind to hematopoietic stem/progenitor cells and enhance their engraftment. Blood. 2001;98:3143–3149. doi: 10.1182/blood.v98.10.3143. [DOI] [PubMed] [Google Scholar]
- 37.Ratajczak J, Wysoczynski M, Hayek F, et al. Membrane-derived microvesicles: important and underappreciated mediators of cell-to-cell communication. Leukemia. 2006;20:1487–1495. doi: 10.1038/sj.leu.2404296. [DOI] [PubMed] [Google Scholar]
- 38.Kucia M, Ratajczak J, Ratajczak MZ. Are bone marrow stem cells plastic or heterogenous-that is the question. Exp Hematol. 2005;33:613–623. doi: 10.1016/j.exphem.2005.01.016. [DOI] [PubMed] [Google Scholar]
- 39.Ratajczak MZ, Kucia M, Reca R, et al. Stem cell plasticity revisited: CXCR4-positive cells expressing mRNA for early muscle, liver and neural cells ‘hide out’ in the bone marrow. Leukemia. 2004;18:29–40. doi: 10.1038/sj.leu.2403184. [DOI] [PubMed] [Google Scholar]
- 40.Kucia M, Reca R, Campbell FR, et al. A population of very small embryonic-like (VSEL) CXCR4(+)SSEA-1(+)Oct-4+ stem cells identified in adult bone marrow. Leukemia. 2006;20:857–869. doi: 10.1038/sj.leu.2404171. [DOI] [PubMed] [Google Scholar]
- 41.Zuba-Surma EK, Kucia M, Abdel-Latif A, et al. Morphological characterization of Very Small Embryonic-Like stem cells (VSELs) by ImageStream system analysis. J Cell Mol Med. 2008;12:292–303. doi: 10.1111/j.1582-4934.2007.00154.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Zuba-Surma EK, Wu W, Ratajczak J, et al. Very small embryonic-like stem cells in adult tissues-Potential implications for aging. Mech Ageing Dev. 2009;130:58–66. doi: 10.1016/j.mad.2008.02.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Kucia M, Wysoczynski M, Wu W, et al. Evidence that Very Small Embryonic Like (VSEL) Stem Cells are Mobilized into Peripheral Blood. Stem Cells. 2008;26:2083–2092. doi: 10.1634/stemcells.2007-0922. [DOI] [PubMed] [Google Scholar]
- 44.Zuba-Surma EK, Kucia M, Dawn B, et al. Bone marrow-derived pluripotent very small embryonic-like stem cells (VSELs) are mobilized after acute myocardial infarction. J Mol Cell Cardiol. 2008;44:865–873. doi: 10.1016/j.yjmcc.2008.02.279. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006;126:663–676. doi: 10.1016/j.cell.2006.07.024. [DOI] [PubMed] [Google Scholar]
- 46.Kim JB, Sebastiano V, Wu G, et al. Oct4-induced pluripotency in adult neural stem cells. Cell. 2009;136:411–419. doi: 10.1016/j.cell.2009.01.023. [DOI] [PubMed] [Google Scholar]
- 47.Okita K, Nakagawa M, Hyenjong H, et al. Generation of mouse induced pluripotent stem cells without viral vectors. Science. 2008;322:949–953. doi: 10.1126/science.1164270. [DOI] [PubMed] [Google Scholar]
- 48.Ronen D, Benvenisty N. Genomic stability in reprogramming. Curr Opin Genet Dev. 2012;22:444–449. doi: 10.1016/j.gde.2012.09.003. [DOI] [PubMed] [Google Scholar]
- 49.Ratajczak MZ, Zuba-Surma EK, Machalinski B, et al. Very small embryonic-like (VSEL) stem cells: purification from adult organs, characterization, and biological significance. Stem Cell Rev. 2008;4:89–99. doi: 10.1007/s12015-008-9018-0. [DOI] [PubMed] [Google Scholar]
- 50.Wojakowski W, Ratajczak MZ, Tendera M. Mobilization of very small embryonic-like stem cells in acute coronary syndromes and stroke. Herz. 2010;35:467–472. doi: 10.1007/s00059-010-3389-0. [DOI] [PubMed] [Google Scholar]
- 51.Paczkowska E, Kucia M, Koziarska D, et al. Clinical evidence that very small embryonic-like stem cells are mobilized into peripheral blood in patients after stroke. Stroke. 2009;40:1237–1244. doi: 10.1161/STROKEAHA.108.535062. [DOI] [PubMed] [Google Scholar]
- 52.Abdel-Latif A, Zuba-Surma EK, Ziada KM, et al. Evidence of mobilization of pluripotent stem cells into peripheral blood of patients with myocardial ischemia. Exp Hematol. 2010;38:1131–1142. doi: 10.1016/j.exphem.2010.08.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Drukała J, Paczkowska E, Kucia M, et al. Stem cells, including a population of very small embryonic-like stem cells, are mobilized into peripheral blood in patients after skin burn injury. Stem Cell Rev. 2012;8:184–194. doi: 10.1007/s12015-011-9272-4. [DOI] [PubMed] [Google Scholar]
- 54.Wojakowski W, Tendera M, Kucia M, et al. Cardiomyocyte differentiation of bone marrow-derived Oct-4+CXCR4+SSEA-1+ very small embryonic-like stem cells. Int J Oncol. 2010;37:237–247. doi: 10.3892/ijo_00000671. [DOI] [PubMed] [Google Scholar]
- 55.Ratajczak J, Wysoczynski M, Zuba-Surma E, et al. Adult murine bone marrow-derived very small embryonic-like stem cells differentiate into the hematopoietic lineage after coculture over OP9 stromal cells. Exp Hematol. 2011;39:225–237. doi: 10.1016/j.exphem.2010.10.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Zuba-Surma EK, Guo Y, Taher H, et al. Transplantation of expanded bone marrow-derived very small embryonic-like stem cells (VSEL-SCs) improves left ventricular function and remodelling after myocardial infarction. J Cell Mol Med. 2011;15:1319–1328. doi: 10.1111/j.1582-4934.2010.01126.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Taichman RS, Wang Z, Shiozawa Y, et al. Prospective identification and skeletal localization of cells capable of multilineage differentiation in vivo. Stem Cells Dev. 2010;19:1557–1570. doi: 10.1089/scd.2009.0445. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Havens AM, Shiozawa Y, Jung Y, et al. Human very small embryonic-like cells generate skeletal structures, in vivo. Stem Cells Dev. 2013;22:622–360. doi: 10.1089/scd.2012.0327. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Kassmer SH, Jin H, Zhang PX, et al. Very Small Embryonic-Like Stem Cells from the murine bone marrow differentiate into epithelial cells of the lung. Stem Cells. 2013 May 16; doi: 10.1002/stem.1413. doi: 10.1002/stem.1413. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Jones RJ, Collector MI, Barber JP, et al. Characterization of mouse lymphohematopoietic stem cells lacking spleen colony-forming activity. Blood. 1996;88:487–491. [PubMed] [Google Scholar]
- 61.Jones RJ, Wagner JE, Celano P, Zicha MS, Sharkis SJ. Separation of pluripotent haematopoietic stem cells from spleen colony-forming cells. Nature. 1990;347:188–189. doi: 10.1038/347188a0. [DOI] [PubMed] [Google Scholar]
- 62.Krause DS. Bone marrow-derived cells and stem cells in lung repair. Proc AmThorac Soc. 2008;5:323–327. doi: 10.1513/pats.200712-169DR. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Vacanti MP, Roy A, Cortiella J, et al. Identification and initial characterization of spore-like cells in adult mammals. J Cell Biochem. 2001;80:455–460. [PubMed] [Google Scholar]
- 64.Kucia M, Halasa M, Wysoczynski M, et al. Morphological and molecular characterization of novel population of CXCR4+ SSEA-4+ Oct-4+ very small embryonic-like cells purified from human cord blood: preliminary report. Leukemia. 2007;21:297–303. doi: 10.1038/sj.leu.2404470. [DOI] [PubMed] [Google Scholar]
- 65.McGuckin C, Jurga M, Ali H, Strbad M, Forraz N. Culture of embryonic-like stem cells from human umbilical cord blood and onward differentiation to neural cells in vitro. Nat Protoc. 2008;6:1046–1055. doi: 10.1038/nprot.2008.69. [DOI] [PubMed] [Google Scholar]
- 66.Mikhail MA, M'Hamdi H, Welsh J, et al. High frequency of fetal cells within a primitive stem cell population in maternal blood. HumReprod. 2008;23:928–933. doi: 10.1093/humrep/dem417. [DOI] [PubMed] [Google Scholar]
- 67.Beltrami AP, Cesselli D, Bergamin N, et al. Multipotent cells can be generated in vitro from several adult human organs (heart, liver and bone marrow). Blood. 2007;110:3438–3446. doi: 10.1182/blood-2006-11-055566. [DOI] [PubMed] [Google Scholar]