Abstract
The initial evaluation of patients with interstitial lung disease (ILD) primarily involves a comprehensive, active search for the cause. Autoantibody assays, which can suggest the presence of a rheumatic disease, are routinely performed at various referral centers. When interstitial lung involvement is the condition that allows the definitive diagnosis of connective tissue disease and the classical criteria are met, there is little debate. However, there is still debate regarding the significance, relevance, specificity, and pathophysiological role of autoimmunity in patients with predominant pulmonary involvement and only mild symptoms or formes frustes of connective tissue disease. The purpose of this article was to review the current knowledge of autoantibody positivity and to discuss its possible interpretations in patients with ILD and without clear etiologic associations, as well as to enhance the understanding of the natural history of an allegedly new disease and to describe the possible prognostic implications. We also discuss the proposition of a new term to be used in the classification of ILDs: lung-dominant connective tissue disease.
Keywords: Idiopathic interstitial pneumonias; Autoantibodies; Connective tissue diseases; Autoimmune diseases; Diagnosis, differential
Introduction
Interstitial lung diseases (ILDs) are heterogeneous diseases that affect the lung parenchyma in a diffuse and multicompartmental manner, being characterized by different combinations of inflammation and fibrosis; the understanding of ILDs has increased dramatically in recent years.(1) On the basis of histological and CT patterns, ILDs can be subdivided into categories, as follows: granulomatous diseases; lymphoid diseases; miscellaneous; idiopathic diseases; and diseases of known cause, which include connective tissue diseases (CTDs).(1,2) There is considerable radiological, functional, and histological overlap among the abovementioned categories, especially between the last two.
Among ILDs, CTDs are of great importance, and pulmonary involvement causes significant functional limitation, which is the leading cause of death in such patients.(3) However, other factors determining ILD can be observed in patients with rheumatic diseases, and these factors should be taken into consideration in the differential diagnosis: i) a reasonable proportion of such patients were smokers at some point; ii) various drugs that are potentially toxic to the lungs are used in the treatment of CTDs; and iii) there is an increased susceptibility to infections.(1,4) In addition, the ILD patterns that are most commonly identified in this population can be quite similar to idiopathic forms.(2-10)
In the initial evaluation of patients with clinical and CT signs of ILD, serum autoantibody positivity is not uncommon.(1,11-14) In addition, routine ANF and serum autoantibody testing for the detection of occult CTD is recommended in several consensus guidelines for ILDs.(1,10-13,15)
Since 1994, when Katzenstein and Fiorelli first described the histological pattern of nonspecific interstitial pneumonia (NSIP), the understanding of idiopathic interstitial pneumonias (IIPs) and the role of CTDs in their etiology has changed. (5,16,17) It is well established that CTD-associated ILD has a better prognosis than does IIP.(7,8) However, many questions remain unanswered, including those regarding patients with ILD and positive ANF or serum autoantibodies.(12,13) Do such patients have formes frustes of CTD, which initially or exclusively manifest as ILD?(10,17,18) Will such patients present with well-defined CTD in the follow-up period?(12,19) Are there prognostic or therapeutic peculiarities?(17)
The purpose of this article was to review the current knowledge of autoantibody positivity and to discuss its possible interpretations in patients with ILD without etiologic associations, as well as to standardize recognition of these diseases, enhance the understanding of their natural history, and describe the prognostic implications. We also discuss the proposition of a new term to be used in the classification of ILDs: lung-dominant CTD (LDCTD).
CTD-associated ILD and undifferentiated CTD
The challenge of answering the question of whether IIP is actually a pulmonary manifestation of occult CTD increases when the criteria for defining CTDs are taken into consideration.(20,21) In the context of CTD-associated ILD, two scenarios are possible: one in which a patient with CTD subsequently develops respiratory symptoms due to new interstitial involvement; and one in which ILD-related respiratory symptoms precede or coincide with clinical and laboratory findings of autoimmune diseases.(19,21)
In the first scenario, when there is no doubt about the association between ILD and CTD, the causal relationship must be confirmed,(1,9,11) and it is essential to exclude potential causes of ILD, such as drug use, smoking, and infection. (22-25) In addition, the functional consequences of lung involvement and the need for treatment modification in the presence of ILD must be evaluated.(1) Lung biopsy is rarely indicated in this scenario, being reserved for cases having atypical presentations or for those in which there is the possibility of another cause for ILD.(4,18,23,26)
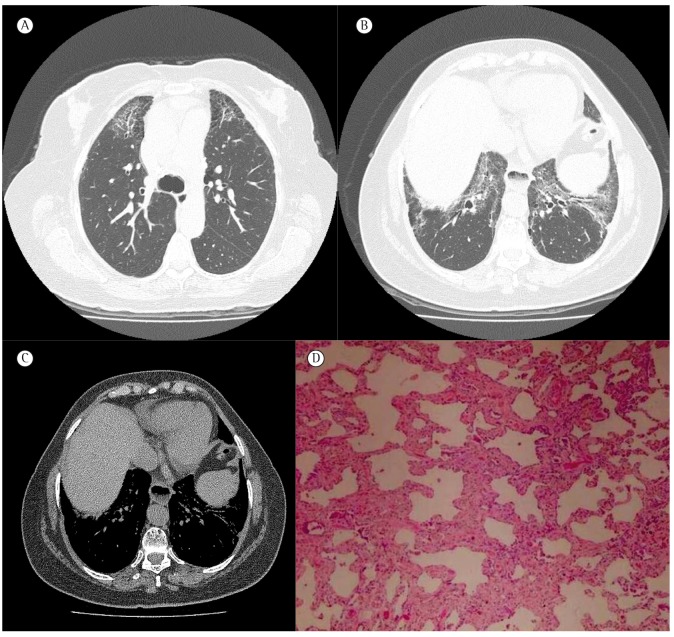
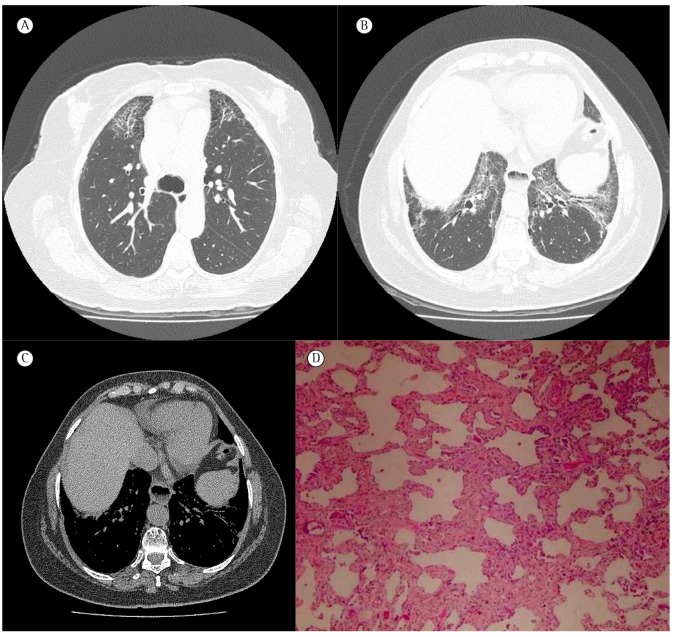
In the second scenario, in which pulmonary involvement predominates and there is no definite CTD, the difficulties increase significantly, which is mainly due to the fact that definitive rheumatologic criteria have yet to be established.(12,19,21) Historically, although the lung interstitium is a major target of CTD-associated autoimmunity, the lung is traditionally overlooked in the diagnostic criteria for these diseases.(10,12) As an example, there is the case of a 56-year-old female patient who presented with dyspnea, dry cough, moderate restrictive lung disease, Raynaud's phenomenon, telangiectases of the hands, a pattern of NSIP (as determined by HRCT), esophageal dilation with an air-fluid level (as determined by HRCT), homogeneous ANF (titer, 1:1,280), and positive anti-Ro antibodies (Figure 1). Although the patient showed clear signs of autoimmune disease, they were not sufficient to establish a specific rheumatologic diagnosis, such as progressive systemic sclerosis (PSS).(14) If the patient had presented with a history of large joint arthritis for at least three years, the rheumatology team might have considered a diagnosis of undifferentiated CTD (UCTD).(27 ) Therefore, various rheumatologists seem to believe that predominant pulmonary involvement is not enough to recognize an autoimmune etiology.
Figure 1. Lung-dominant connective tissue disease. In A, HRCT scan showing reticular opacities, permeated by areas of ground-glass attenuation, and paracicatricial emphysema in the upper lobes. In B, HRCT scan showing peribronchovascular reticular opacities, ground-glass opacities, and traction bronchiectasis in the lower lobes. In C, mediastinal CT scan showing esophageal dilation with an air-fluid level. In D, histological examination of an open lung biopsy specimen showing inflammatory infiltrate in the alveolar septa, consistent with a nonspecific interstitial pneumonia pattern.
The term UCTD is used in order to define patients with unclassifiable CTD, and the criteria presented in Chart 1 are currently used for the diagnosis of UCTD.(27)
Chart 1. Diagnostic criteria for undifferentiated connective tissue disease.a.

The main characteristics of patients with UCTD are as follows: being female; being younger than 50 years of age; testing positive for ANF (approximately 80% of cases); and testing positive for various autoantibodies, especially anti-Ro (SSA) autoantibodies.(28-31) Patients with UCTD have predominant joint involvement that is mild to moderate in intensity and that resolves spontaneously or responds quite well to prednisone.(32) Commonly reported symptoms include Raynaud's phenomenon, xerophthalmia, xerostomia, joint pain, and morning stiffness. It is possible that up to one third of patients will meet the diagnostic criteria for a specific CTD (in particular, systemic lupus erythematosus) up to 2 years after the onset of symptoms; thereafter, this possibility is reduced, and most patients will persist with mild impairment (as observed at the onset of the disease), without meeting the diagnostic criteria for a specific CTD.(30-32)
In patients with UCTD, extra-articular involvement (including respiratory involvement) is rare.(29-31) These findings stand in contrast to the finding of severe pulmonary involvement habitually seen in patients with ILD and unclassifiable CTD.(13,15,33-35) In the practice of pulmonology, autoantibody-positive ILD patients who do not meet the diagnostic criteria for any established CTD present with pulmonary involvement whose intensity is markedly different from that of pulmonary involvement in relevant cohorts of patients with UCTD. This is the main reason why some authors avoid using the term UCTD to refer to cases of ILD and autoantibody positivity. In 2010, Fischer et al. proposed that the term LDCTD be used in order to characterize patients with any known pattern of ILD (usual interstitial pneumonia-UIP-NSIP, lymphocytic interstitial pneumonia, organizing pneumonia, desquamative interstitial pneumonia, etc.) associated with the presence of at least one CTD-specific autoantibody, two histological findings classically associated with pulmonary involvement secondary to CTD, or both, these findings, however, not characterizing a well-established rheumatic disease or an alternative etiology for ILD (Chart 2).(12) These stricter criteria, which include clinical, laboratory, CT, and histological findings, are intended for use in studies aimed at understanding the natural history, prognosis, and therapeutic response of this allegedly new form of ILD.
Chart 2 . Provisional criteria for lung-dominant connective tissue disease.a.
Importance of autoantibody positivity in the evaluation of patients with ILD
In patients with ILD and suspected occult CTD, specific laboratory tests are needed in order to determine the presence or absence of a systemic disease. Although most tests are not highly specific or sensitive for the diagnosis of CTD, a positive result in conjunction with clinical changes can indicate the presence of a CTD with a high degree of confidence.(3,14,36)
Homma et al. were the first to show the possibility of ILD as the sole presentation of occult CTD, having followed (for up to 11 years) 68 patients in whom the initial evaluation showed no clinical or serological evidence of CTD.(37) Of the 68 patients, 13 (19%) developed a definite CTD after an average of 25 months of follow-up: rheumatoid arthritis, in 5; polymyositis/dermatomyositis, in 5; systemic lupus erythematosus, in 1; Sjögren's syndrome (SS), in 1; and mixed CTD, in 1. In comparison with the remaining patients, those who met diagnostic criteria for a given CTD were younger, most being female. Creatine phosphokinase and ESR were the biochemical markers that distinguished between the two groups of patients, together with discoid atelectasis in the lower lung fields on chest X-rays.(37,38) At a time when autoantibody assays were not available in clinical practice, those results shed light on the possibility of predominant pulmonary manifestation of occult CTD or even the currently recognized LDCTD.
In a recent study aimed at evaluating the prevalence of occult CTD in all ILD patients presenting exclusively with respiratory symptoms, careful multidisciplinary evaluation and a comprehensive autoimmune panel showed that 34 (29%) of the 114 patients with confirmed ILD met diagnostic criteria for CTD.(39) Of those 34 patients, half had met diagnostic criteria for CTD in the initial evaluation and the other half were diagnosed during the follow-up period, the incidence of CTD in the cohort being 15%. The most common autoantibodies were ANF, in 56%, rheumatoid factor (RF), in 31%, and anti-Ro, in 15%. Inflammatory myopathies were present in 50% of cases, and the histological pattern most commonly associated with CTD was NSIP. An independent analysis of the data from that study shows that, of the 80 patients who showed no association with CTD at the end of the study period, 34 (42.5%) tested positive for ANF (7 of whom had ANF titer greater than or equal to 1:640) and 11 (16.3%) had a nucleolar pattern, which is highly specific for PSS.(14,40) These findings strongly suggest the presence of occult CTD. Although the diagnoses of those 80 patients were not reported, the serological evidence of autoimmunity in those patients is curious, given that idiopathic pulmonary fibrosis (IPF) is the most prevalent ILD. Although autoantibody positivity in the absence of clinical evidence of CTD should be interpreted with great caution, screening for autoantibodies in patients with diffuse parenchymal lung disease (as recommended by national and international guidelines) is justified.(1,11) It is of note that a rigorous evaluation is required in order to diagnose inflammatory myopathies. (38,41) Given that these conditions are commonly accompanied by interstitial lung involvement, recognition of occult manifestations requires a high degree of suspicion, an active search for desquamative lesions on the hands and increased serum muscle enzymes being therefore justified.
Autoantibodies and IPF
A specific form of chronic interstitial pneumonia, IPF is a disease of unknown etiology that is limited to the lungs and that occurs primarily in adults in their sixth decade of life, being associated with the histological and CT patterns of UIP.(1,42) The most widely accepted theory for the pathogenesis of IPF involves an interaction between alveolar epithelial injury and apoptosis, followed by abnormal mesenchymal repair.(43) The damaged epithelial cells adopt a mesenchymal behavior during the tissue repair process, producing fibrogenic cytokines.(1,44) Because IPF is a disease that is limited to the lungs, there is much debate about the presence of autoantibodies and clinical manifestations of occult CTD in patients with IPF. According to the recently published Brazilian Thoracic Association Guidelines for ILDs, up to 25% of patients have low-titer ANF and RF. However, this is considered to have no clinical relevance if CTD is excluded, determination of anti-cyclic citrullinated peptide (anti-CCP) antibodies being recommended in order to confirm rheumatoid arthritis in RF-positive patients.(1) It remains unknown whether the association between IPF and serum markers of immunity is only fortuitous or whether the identification of autoantibodies in such patients has any pathophysiological relevance.
Of all known rheumatic diseases, PSS is the disease in which fibrotic involvement is most pronounced.(45) The classic cutaneous manifestations of PSS (sclerodactyly, scleroderma facies, and morphea) cause significant thickening and tightening of the skin, which are markers of multisystem fibrotic involvement.(3) Interstitial lung injury is more closely related to the limited form of systemic sclerosis, which is known as CREST syndrome (CREST being an acronym for Calcinosis, Raynaud's phenomenon, Esophageal dysfunction, Sclerodactyly, and Telangiectasia). Although NSIP is the pattern that is most commonly associated with PSS, UIP is quite common.(46) Because of the difficulty in excluding occult CTD in patients with ILD, Fischer et al. reported the serological findings in patients with a clinical diagnosis of IPF.(40) Of the 285 patients who were tested for ANF, 25 had titers greater than 1:40 and a nucleolar-staining pattern. Among the various antinuclear antibodies found in patients with PSS, antinucleolar antibodies are found in 10-15%. Antinucleolar antibodies constitute a group of heterogeneous autoantibodies that cause ANF to have an antinucleolar pattern of immunofluorescence, being highly specific markers of PSS. Of the 25 IPF patients who had a positive ANF, 13 tested positive for anti-Th/To antibody-an antinucleolar antibody that is strongly related to systemic sclerosis-associated ILD-PSS being therefore confirmed. This underscores the need for comprehensive serological testing for the identification of occult CTD in patients with IPF, with therapeutic and prognostic implications.
The results of a recently published study investigating the prevalence and clinical significance of circulating autoantibodies in 67 patients with IPF(47) add weight to the abovementioned conclusion. Autoantibody positivity was found in 22% of the patients with IPF and in 21% of the healthy controls. There were no differences between the IPF patients with circulating antibodies and those without in terms of clinical characteristics, CT findings, histological features, or treatment response. However, the subgroup of patients with circulating autoantibodies had a longer transplant-free survival time. The authors also compared the group of IPF patients who tested positive for circulating autoantibodies (n = 15) with a group of patients with UCTD (n = 22) and found that the latter were younger and had higher titers of ANF.
Therefore, the significance of positive autoantibodies in patients with IPF depends on the presence of systemic signs of rheumatic disease and on the specificity of the technique used for screening, as well as on autoantibody titers and patterns. In the presence of these factors, an alternative diagnosis of CTD (rather than IPF) is possible. However, studies have recognized the role of autoimmunity in the pathogenesis of IPF, the identification of circulating autoantibodies and the direct association of circulating autoantibodies with lung epithelial injury suggesting the presence of autoimmunity. Takahashi et al. assessed autoantibody positivity in 22 patients with IPF and compared those patients with 37 healthy individuals.(48) Through techniques of immunohistochemistry and immunoprecipitation of epithelial lung cells, the authors identified in the sera from IPF patients an antibody that precipitated in the cytoplasm of those cells but not in that of cells of mesenchymal origin (ovary). Spectrophotometry of the precipitated immunocomplex allowed the isolation of the antigen, which was a protein consistent with alanyl-tRNA synthetase (also known as PL-12) in 50% of the patients with IPF. This antibody is associated with inflammatory myopathies that affect the pulmonary interstitium (such as antisynthetase syndrome), although it is present in only a small proportion of such patients.(38) Despite a potential systematic error in the diagnosis of IPF in that study, the presence of that autoantibody in half of the sample adds validity to the findings and shows that autoimmunity plays a relevant role in the pathogenesis of IPF (in some patients, at least). In addition, ensuring the distinction between IPF and CTD, the antigen described was present in less than 5% of the patients with CTD-associated ILD in whom the techniques described above were performed.
There is a tendency in the literature to interpret the presence of nonspecific autoantibodies or low-titer ANF in patients with IPF as positivity that is similar to that in the general population (20-30%) and that generally has no clinical consequences.(1,35,39,40,42,47,48) However, in a subgroup of patients, the presence of associated autoimmunity can have an impact on prognosis and response to treatment. In the case of diseases for which there is currently insufficient scientific evidence to endorse most of the treatments that are currently available, identifying patients with stigmata of autoimmunity can stimulate pharmacological innovations. In addition, formes frustes of rheumatic diseases and occult forms of CTD should not be forgotten.
Autoantibodies and idiopathic NSIP
Early in the last decade, an international panel of experts in ILDs met, with the support of the American Thoracic Society, in order to gain a better understanding of idiopathic NSIP in light of the scientific knowledge available at the time.(17) Researchers who had previously reported cases of idiopathic NSIP were invited to submit cases for review. Patients who, at the onset of pulmonary symptoms, met diagnostic criteria for CTD (or other diseases) were excluded from the analysis. The selected cases were considered idiopathic after a detailed evaluation performed by the multidisciplinary expert panel (including clinicians, radiologists, and pathologists), who subsequently studied the epidemiological, histological, and CT features. Of the 67 cases that were considered idiopathic, 43% had positive ANF and 23% had increased RF; Raynaud's phenomenon and arthritis had been reported in 8% and 3%, respectively. The authors considered and confirmed the possibility of interstitial lung involvement as the initial or sole manifestation of CTD, or as a manifestation of LDCTD. In a report published in 2006, the expert panel concluded that NSIP is a distinct form of ILD; however, because of a possible association between NSIP and other forms, especially hypersensitivity pneumonitis and CTD, a comprehensive multidisciplinary approach is required in order to establish a diagnosis of idiopathic NSIP.(17)
LDCTD
On the basis of the abovementioned report from the American Thoracic Society, various authors attempted to characterize patients presenting with histological features of NSIP and meeting the previously discussed diagnostic criteria for UCTD. Kinder et al. sought to determine whether idiopathic NSIP was actually the pulmonary manifestation of a systemic autoimmune disease and, consequently, the pulmonary manifestation of UCTD.(13) By applying their own criteria (which were considered permissive for including findings that have low specificity for autoimmunity, such as gastroesophageal reflux and ESR), which combined CTD symptoms with evidence of systemic inflammation (autoantibodies, inflammatory activity, or both), the authors identified, in a population of 285 patients with ILD, 28 cases without any other apparent cause. Most were female, were younger than 50 years of age, and complained of arthralgia, joint swelling, Raynaud's phenomenon, and dysphagia more often than did patients who met no diagnostic criteria for UCTD. With the exception of digital clubbing, which was more prevalent in those with the idiopathic form (26% vs. 7%), there were no differences between the groups in terms of physical examination findings. Regarding CT findings, ground-glass opacities and consolidations were more common in the UCTD group, whereas honeycombing was more common in the IIP group (being more consistent with the UIP pattern). In the histological analysis, most of the patients with UCTD were found to have the NSIP pattern, which was rarely found in the IIP group. The UIP pattern (as determined by pathological examination) was positively associated with IIP (OR = 111) and negatively associated UCTD (OR = 0.009). The authors concluded that the NSIP pattern is strongly associated with patients with CTD symptoms, especially Raynaud's phenomenon, arthralgia, and gastrointestinal manifestations, when associated with positive serum autoantibodies. In addition, the authors suggested that meeting diagnostic criteria for UCTD in this context constitutes a predictor of NSIP, which is actually a pulmonary manifestation of systemic autoimmunity.(13) Suda et al.(49) evaluated 47 patients with idiopathic NSIP and, by applying the same criteria as those applied by Kinder et al.,(13) identified 22 cases of UCTD (47%), which were compared with those of patients who did not meet those criteria. In addition to having found clinical and laboratory features that were quite similar to those found in the previous study, the authors demonstrated that cases considered idiopathic showed a higher mortality rate than did those with UCTD, as well as showing a lower 5-year survival rate (58% vs. 100%). For the first time, it was suggested that the prognosis of such patients follows the pattern of that of other patients with CTD-associated ILD, progression being more favorable.
In contrast, in another recent study, in which stricter diagnostic criteria were applied, 63 (32%) of 200 patients with ILD met diagnostic criteria for autoimmunity, and 58 (29%) met diagnostic criteria for IPF.(35) In the autoimmunity group, the UIP pattern was the most common CT finding (62%), correlating well with histological findings. There were no differences in survival between the autoimmunity and IPF groups, and both had worse survival than did those with known CTD. In yet another study, stringent criteria (CTD-specific symptoms and autoantibodies) were applied, and their accuracy in predicting NSIP was evaluated.(34) Of 100 patients with NSIP or UIP (as determined by surgical biopsy), 21 had LDCTD, which accounted for 31% of all cases of PINE and only 13% of all cases of UIP. Therefore, those strict criteria were three times more likely to be associated with NSIP histology, their sensitivity being 31% and their specificity being 88%. A poor accuracy in predicting this pattern is probably due to the fact that LDCTD can be associated with any known pattern of ILD.
The two studies cited above(34,35) seem to characterize a population that is different from those in the studies by Kinder et al.(13) and Suda et al.(49) Can this difference be explained solely by differences among the study populations? Do these patients actually have UCTD and will rheumatologic criteria apply in this context of predominant ILD?(35,50) When this association was first recognized, NSIP was the most prevalent pattern. However, relevant data suggest that, if there are cases in which ILD is a pulmonary manifestation of systemic autoimmunity, the patterns of response to epithelial injury do vary. This constitutes an obstacle to the use of classifications or terms that originate from other specialties (such as UCTD), if not because such classifications and terms are well established then at least because of the clinical and epidemiological distinction described herein. In this context, we propose that the term LDCTD be used in order to aid in distinguishing such patients from those with UCTD and predominant joint involvement, as well as to aid in standardizing criteria that will allow pulmonologists to characterize such patients more precisely. Chart 2 presents stringent criteria for the diagnosis of LDCTD. The proposed criteria give weight to autoantibodies that are more specific to CTD and to higher titers of highly sensitive markers of autoimmunity. In addition, other causes for ILD or even well-established CTD should be ruled out. However, the major difference between these and other criteria is that they recognize the possibility of classic patterns other than NSIP and allow the inclusion of histological findings suggestive of pulmonary involvement secondary to CTD. Figure 1 shows CT and histological findings in a female patient with LDCTD after a 6-year follow-up period, during which she met no diagnostic criteria for CTD.
Occult CTD
It is clearly difficult to distinguish between CTD-associated ILD and formes frustes of CTD. Rheumatic diseases are classified in accordance with clinical criteria established by leading rheumatology societies worldwide, chief among which is the American College of Rheumatology. The primary criticism directed toward the use of these criteria is that they do not reflect the clinical reality.(19) Chief among formes frustes of CTD are PSS sine scleroderma and amyopathic dermatomyositis, which are characterized by the absence of clinical findings that primarily characterize the diseases to which they are related.(36,38,51,52) The different criteria used in the LDCTD studies reviewed above do not escape this criticism, and LDCTD can often be characterized as occult CTD.
Next, we discuss the major rheumatic diseases that can present as formes frustes and mimic ILD, and that can be mistaken for LDCTD in the absence of a high degree of clinical suspicion. Fischer et al. evaluated 37 patients with clinical features of antisynthetase syndrome, negative ANF, and negative anti-Jo-1 antibodies. In order to test the hypothesis that antisynthetase syndrome is an unrecognized cause of ILD, those patients were screened for other anti-tRNA synthetase antibodies, and 9 (24%) tested positive for anti-PL-7 or anti-PL-12 antibodies.(41) In the presence of a high degree of clinical suspicion, a provisional diagnosis of antisynthetase syndrome can be established in those with Raynaud's phenomenon, desquamation on the sides of the fingers (mechanic's hands), arthritis, Gottron's papules, and pulmonary fibrosis, even if they have tested negative for ANF and anti-Jo-1 antibodies. Therefore, screening for other anti-tRNA synthetase antibodies, basically anti-PL-7 and anti- PL-12 antibodies, increases the chance of a diagnosis of occult CTD.(39,53)
In another study, 38 patients with ILD and sicca syndrome (keratoconjunctivitis sicca or xerostomia) or abnormal levels of SS-associated autoantibodies (anti-Ro and anti-La) underwent labial salivary gland biopsy.(54) When biopsy was requested, none of the patients had a definable CTD. Thirteen patients (34%) had chronic sialadenitis, which, together with sicca syndrome, is diagnostic of SS.(55) Of those 13 patients, 3 tested negative for ANF, RF, anti-Ro antibodies, and anti-La antibodies, a finding that increases the possibility of CTD even in the absence of autoantibodies.
The difficulty in and importance of identifying patients with CTD-associated ILD are therefore clear. All ILD patients should be screened for occult or early CTD in order to decrease the diagnosis of IIP, with prognostic and therapeutic implications. A multidisciplinary approach, involving pulmonologists, radiologists, pathologists, and rheumatologists, is recommended in order to overcome the limitations of current diagnostic criteria and the unavailability of autoantibody assays.
How should patients with ILD be evaluated in terms of the presence of features of rheumatic disease? Chart 3 presents the main clinical, laboratory, radiological, and histological findings for an active search for patients with CTD-associated ILD. The presence of positive ANF titers ≥ 320 strongly suggests an association with rheumatic disease; however, as is the case with any other autoantibody, a positive ANF alone loses specificity unless certain highly specific immunofluorescence patterns (including a nucleolar pattern, a centromere pattern, and a cytoplasmic pattern) are found.(56) The hands should be routinely examined for changes suggestive of rheumatic disease. Mechanic's hands and Gottron's papules are associated with inflammatory myopathies and antisynthetase syndrome.(3) The presence of sclerodactyly, Raynaud's phenomenon, digital pitting scars, and fingertip ulcers is suggestive of PSS, whereas the presence of Raynaud's phenomenon, digital pitting scars, and fingertip ulcers without sclerodactyly is suggestive of PSS sine scleroderma.(3,51,52) Nailfold capillaroscopy is a technique that is used in order to evaluate microvascular involvement (which is quite common in patients with PSS), polymyositis/dermatomyositis, and mixed CTD.(36)
Chart 3 . Findings suggestive of connective tissue disease as the cause of interstitial lung disease.
What is the importance of this discussion? What is the advantage of identifying rheumatic features in patients with ILD?
There are various reasons why patients with ILD should be screened for features of CTD.(12) Initially, the identification of a CTD allows patients to gain a better understanding of their health problems and allows health professionals to seek lesions in organs that can also be affected by systemic autoimmunity.(12) Standardization of criteria allows researchers to conduct epidemiological studies that are more reproducible, allowing a better understanding of the natural history and prognosis of the disease in question. Regarding the treatment of ILDs, robust data regarding the efficacy or inefficacy of certain drugs have only recently been obtained. (19,42) In patients with PSS-associated ILD, the use of cyclophosphamide for 12 months, followed by maintenance therapy with azathioprine or mycophenolate, slows functional deterioration.(57,58) The therapeutic response in patients with LDCTD remains unclear. It remains unknown whether it is similar to the refractoriness in those with IPF or to the stability in those with PSS, or whether the possibility of partial or complete resolution exists.
Another important point is patient prognosis. Most of the studies reviewed here showed that the prognosis of patients with CTD-associated ILD is better than is that of those with idiopathic forms. Park et al.(7) showed that survival was better in the group of patients with CTD-associated ILD than in that of those with IIP, the groups of patients with CTD-associated NSIP, idiopathic NSIP, and CTD-associated UIP having a similar prognosis. The group of patients with IPF had the worst prognosis. The authors concluded that patients with CTD-associated ILD (including those with CTD-associated UIP) had a better prognosis, screening for occult CTD or even frustes formes of CTD (such as LDCTD) being therefore justified. Suda et al. demonstrated that patients with NSIP and LDCTD have better 5-year survival than do those with idiopathic NSIP.(49) In another study, in which the diagnostic criteria for LDCTD were adopted, lung histology revealed that the proportion of patients with UIP was much higher than was that of those with NSIP, and, despite the low mortality in the study population, their survival was better than was that of those with IPF.(35) However, these results were not reproduced in another study, in which strict criteria were also adopted.(34)
Therefore, prospective studies should be conducted in order to establish the real prognosis and the best treatment strategy for patients with LDCTD.
Final considerations
The initial evaluation of patients with ILD involves a comprehensive, active search for the cause. Routine screening for autoantibodies allows the diagnosis of rheumatic diseases ranging from UCTD (a fruste forme of CTD) to a definable CTD. However, autoantibody positivity should be interpreted with caution, given that autoantibody assays are laboratory tests whose accuracy is limited in many cases. Autoantibody positivity in the general population, technical difficulties, and analytical errors are typical. Therefore, the diagnosis or suspicion of CTD should be associated with typical signs and symptoms.
The terms LDCTD and UCTD are often treated as synonyms. However, studies investigating patients with UCTD show little joint morbidity and virtually no pulmonary involvement. The criteria used in the studies investigating patients with predominant respiratory disease and using the term UCTD lacked specificity, as well as having differed from study to study. Despite conflicting data, different terminology, varying inclusion criteria, and different views on the same issue, it seems that patients with LDCTD constitute a distinct population of patients with ILD. The hypothesis that the lung is the organ that is predominantly affected by systemic autoimmunity in such cases is now more likely than not. Although this hypothesis emerged from studies of idiopathic NSIP, it is possible that other patterns of ILD are involved. The immune system is highly complex, and very little is known regarding the orchestration of the distinction between self and non-self in innate and acquired immunity. What is the explanation for the finding of anti-PL-12 antibodies in patients with IPF, given that PL-12 is highly specific to rheumatic disease and that IPF is a highly fibrotic and poorly cellular disease? How can patients with well-defined CTD have prognostic features that are different from those of patients with LDCTD?
Many questions remain unanswered, and many others will arise. However, this knowledge must be extrapolated to current daily practice. In approaching ILDs, it is essential to consider the possibility of CTD as the etiologic agent. Patients with ILD should be actively screened for extrapulmonary manifestations, such as Raynaud's phenomenon, arthralgia, sicca symptoms, and gastrointestinal symptoms. In addition, they should be routinely screened for rheumatoid antibodies, such as ANF, anti-Ro, anti-La, anti-RNP, anti-Sm, anti-DNA, anti-Scl-70, RF, anti-CCP, and antisynthetase antibodies (especially anti-Jo-1, given that the tests for the remaining antisynthetase antibodies are available only in the USA). In the presence of negative test results and a high degree of clinical suspicion of CTD, the possibility of repeating the tests should be taken into consideration because of the possibility of formes frustes.(14,56) In the presence of positive test results, the possibility of a false association of indeterminate clinical significance (which is due to the considerable sensitivity of some of these tests) should not be discarded. The clinical context, titers, and patterns, as well as which specific antibody test results were abnormal, are factors that will jointly contribute to the relevance of positive test results.
Finally, in addition to recommending a multidisciplinary approach to patients with LDCTD, we suggest that LDCTD be defined as a distinct phenotype and as a classification of disease so that future studies can examine its prognostic, therapeutic, and biopathological implications.
Footnotes
Study carried out at the Instituto do Coração - InCor, Heart Institute - University of São Paulo School of Medicine Hospital das Clínicas, São Paulo, Brazil.
Financial support: None.
Contributor Information
Daniel Antunes Silva Pereira, Department of Pulmonology, Instituto do Coração - InCor, Heart Institute - University of São Paulo School of Medicine Hospital das Clínicas, São Paulo, Brazil.
Alexandre de Melo Kawassaki, Department of Pulmonology, Instituto do Câncer do Estado de São Paulo - ICESP, São Paulo State Cancer Institute - and Pulmonologist, Hospital Nove de Julho, São Paulo, Brazil.
Bruno Guedes Baldi, Department of Pulmonology, Instituto do Coração - InCor, Heart Institute - University of São Paulo School of Medicine Hospital das Clínicas, São Paulo, Brazil.
References
- 1.Baldi BG, Pereira CA, Rubin AS, Santana AN, Costa AN, Carvalho CR, et al. Highlights of the Brazilian Thoracic Association guidelines for interstitial lung diseases. J Bras Pneumol. 2012;38(3):282–291. doi: 10.1590/s1806-37132012000300002. http://dx.doi.org/10.1590/S1806-37132012000300002 PMid:22782597 [DOI] [PubMed] [Google Scholar]
- 2.Elicker B, Pereira CA, Webb R, Leslie KO. High-resolution computed tomography patterns of diffuse interstitial lung disease with clinical and pathological correlation. J Bras Pneumol. 2008;34(9):715–744. doi: 10.1590/s1806-37132008000900013. http://dx.doi.org/10.1590/S1806-37132008000900013 [DOI] [PubMed] [Google Scholar]
- 3.Tzelepis GE, Toya SP, Moutsopoulos HM. Occult connective tissue diseases mimicking idiopathic interstitial pneumonias. Eur Respir J. 2008;31(1):11–20. doi: 10.1183/09031936.00060107. http://dx.doi.org/10.1183/09031936.00060107 [DOI] [PubMed] [Google Scholar]
- 4.Antoniou KM, Margaritopoulos G, Economidou F, Siafakas NM. Pivotal clinical dilemmas in collagen vascular diseases associated with interstitial lung involvement. Eur Respir J. 2009;33(4):882–896. doi: 10.1183/09031936.00152607. http://dx.doi.org/10.1183/09031936.00152607 [DOI] [PubMed] [Google Scholar]
- 5.Lauretis A de, Veeraraghavan S, Renzoni E. Review series: Aspects of interstitial lung disease: connective tissue disease-associated interstitial lung disease: how does it differ from IPF? How should the clinical approach differ? Chron Respir Dis. 2011;8(1):53–82. doi: 10.1177/1479972310393758. [DOI] [PubMed] [Google Scholar]
- 6.Song JW, Do KH, Kim MY, Jang SJ, Colby TV, Kim DS. Pathologic and radiologic differences between idiopathic and collagen vascular disease-related usual interstitial pneumonia. Chest. 2009;136(1):23–30. doi: 10.1378/chest.08-2572. http://dx.doi.org/10.1378/chest.08-2572 [DOI] [PubMed] [Google Scholar]
- 7.Park JH, Kim DS, Park IN, Jang SJ, Kitaichi M, Nicholson AG, et al. Prognosis of fibrotic interstitial pneumonia: idiopathic versus collagen vascular disease-related subtypes. Am J Respir Crit Care Med. 2007;175(7):705–711. doi: 10.1164/rccm.200607-912OC. http://dx.doi.org/10.1164/rccm.200607-912OC [DOI] [PubMed] [Google Scholar]
- 8.Flaherty KR, Colby TV, Travis WD, Toews GB, Mumford J, Murray S, et al. Fibroblastic foci in usual interstitial pneumonia: idiopathic versus collagen vascular disease. Am J Respir Crit Care Med. 2003;167(10):1410–1415. doi: 10.1164/rccm.200204-373OC. http://dx.doi.org/10.1164/rccm.200204-373OC [DOI] [PubMed] [Google Scholar]
- 9.Lynch DA. Lung disease related to collagen vascular disease. J Thorac Imaging. 2009;24(4):299–309. doi: 10.1097/RTI.0b013e3181c1acec. http://dx.doi.org/10.1097/RTI.0b013e3181c1acec [DOI] [PubMed] [Google Scholar]
- 10.Cottin V. Interstitial lung disease: are we missing formes frustes of connective tissue disease? Eur Respir J. 2006;28(5):893–896. doi: 10.1183/09031936.00101506. http://dx.doi.org/10.1183/09031936.00101506 [DOI] [PubMed] [Google Scholar]
- 11.American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias This joint statement of the American Thoracic Society (ATS), and the European Respiratory Society (ERS) was adopted by the ATS board of directors, June 2001 and by the ERS Executive Committee, June 2001 . Am J Respir Crit Care Med. 2002;165(2):277–304. doi: 10.1164/ajrccm.165.2.ats01. http://dx.doi.org/10.1164/ajrccm.165.2.ats01 Erratum in: Am J Respir Crit Care Med. 2002;166(3):426. [DOI] [PubMed] [Google Scholar]
- 12.Fischer A, West SG, Swigris JJ, Brown KK, Bois RM du. Connective tissue disease-associated interstitial lung disease: a call for clarification. Chest. 2010;138(2):251–256. doi: 10.1378/chest.10-0194. http://dx.doi.org/10.1378/chest.10-0194 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Kinder BW, Collard HR, Koth L, Daikh DI, Wolters PJ, Elicker B, et al. Idiopathic nonspecific interstitial pneumonia: lung manifestation of undifferentiated connective tissue disease? Am J Respir Crit Care Med. 2007;176(7):691–697. doi: 10.1164/rccm.200702-220OC. http://dx.doi.org/10.1164/rccm.200702-220OC [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Papiris SA, Kagouridis K, Bouros D. Serologic evaluation in idiopathic interstitial pneumonias. Curr Opin Pulm Med. 2012;18(5):433–440. doi: 10.1097/MCP.0b013e3283560840. http://dx.doi.org/10.1097/MCP.0b013e3283560840 [DOI] [PubMed] [Google Scholar]
- 15.Romagnoli M, Nannini C, Piciucchi S, Girelli F, Gurioli C, Casoni G, et al. Idiopathic nonspecific interstitial pneumonia: an interstitial lung disease associated with autoimmune disorders? Eur Respir J. 2011;38(2):384–391. doi: 10.1183/09031936.00094910. http://dx.doi.org/10.1183/09031936.00094910 [DOI] [PubMed] [Google Scholar]
- 16.Katzenstein AL, Fiorelli RF. Nonspecific interstitial pneumonia/fibrosis. Histologic features and clinical significance. Am J Surg Pathol. 1994;18(2):136–147. http://dx.doi.org/10.1097/00000478-199402000-00003 [PubMed] [Google Scholar]
- 17.Travis WD, Hunninghake G, King TE, Jr, Lynch DA, Colby TV, Galvin JR, et al. Idiopathic nonspecific interstitial pneumonia: report of an American Thoracic Society project. Am J Respir Crit Care Med. 2008;177(12):1338–1347. doi: 10.1164/rccm.200611-1685OC. http://dx.doi.org/10.1164/rccm.200611-1685OC Erratum in: Am J Respir Crit Care Med.2008;178(2): 211. [DOI] [PubMed] [Google Scholar]
- 18.Leslie KO. My approach to interstitial lung disease using clinical, radiological and histopathological patterns. J Clin Pathol. 2009;62(5):387–401. doi: 10.1136/jcp.2008.059782. http://dx.doi.org/10.1136/jcp.2008.059782 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Fischer A, Bois R du. Interstitial lung disease in connective tissue disorders. Lancet. 2012;380(9842):689–698. doi: 10.1016/S0140-6736(12)61079-4. http://dx.doi.org/10.1016/S0140-6736(12)61079-4 [DOI] [PubMed] [Google Scholar]
- 20.Coletta EN. Padrões histológicos dos processos infiltrativos difusos em colagenoses. J Pneumol. 1997;23(4):197–207. [Google Scholar]
- 21.Fischer A. Interstitial lung disease: a rheumatologist's perspective. J Clin Rheumatol. 2009;15(2):95–99. doi: 10.1097/RHU.0b013e31819b715d. http://dx.doi.org/10.1097/RHU.0b013e31819b715d [DOI] [PubMed] [Google Scholar]
- 22.Rodrigues SC, Rodrigues MM, Colleta EN, Rocha NS, Pereira CA. Respiratory bronchilitis-associated interstitial lung disease. J Bras Pneumol. 2004;30(6):574–580. [Google Scholar]
- 23.Antin-Ozerkis D, Rubinowitz A, Evans J, Homer RJ, Matthay RA. Interstitial lung disease in the connective tissue diseases. Clin Chest Med. 2012;33(1):123–149. doi: 10.1016/j.ccm.2012.01.004. http://dx.doi.org/10.1016/j.ccm.2012.01.004 [DOI] [PubMed] [Google Scholar]
- 24.Reichert J, Reichert A, Bendhack LI, Noronha E. Pneumonite intersticial em paciente sob tratamento com leflunomide: toxicidade da droga? J Pneumol. 2003;29(6):395–400. http://dx.doi.org/10.1590/S0102-35862003000600013 [Google Scholar]
- 25.Dias OM, Pereira DA, Abensur A, Rodrigo K, Ronaldo A, Carvalho CR, et al. Pneumonite intersticial aguda induzida por adalimumabe em paciente com artrite reumatoide: relato de caso. J Bras Pneumol. 2013 [epub ahead of print] [Google Scholar]
- 26.Leslie KO, Trahan S, Gruden J. Pulmonary pathology of the rheumatic diseases. Semin Respir Crit Care Med. 2007;28(4):369–378. doi: 10.1055/s-2007-985609. http://dx.doi.org/10.1055/s-2007-985609 [DOI] [PubMed] [Google Scholar]
- 27.Mosca M, Tani C, Carli L, Bombardieri S. Undifferentiated CTD: a wide spectrum of autoimmune diseases. Best Pract Res Clin Rheumatol. 2012;26(1):73–77. doi: 10.1016/j.berh.2012.01.005. http://dx.doi.org/10.1016/j.berh.2012.01.005 [DOI] [PubMed] [Google Scholar]
- 28.LeRoy EC, Maricq HR, Kahaleh MB. Undifferentiated connective tissue syndromes. Arthritis Rheum. 1980;23(3):341–343. doi: 10.1002/art.1780230312. http://dx.doi.org/10.1002/art.1780230312 [DOI] [PubMed] [Google Scholar]
- 29.Mosca M, Tavoni A, Neri R, Bencivelli W, Bombardieri S. Undifferentiated connective tissue diseases: the clinical and serological profiles of 91 patients followed for at least 1 year. Lupus. 1998;7(2):95–100. doi: 10.1191/096120398678919787. http://dx.doi.org/10.1191/096120398678919787 [DOI] [PubMed] [Google Scholar]
- 30.Vaz CC, Couto M, Medeiros D, Miranda L, Costa J, Nero P, et al. Undifferentiated connective tissue disease: a seven-center cross-sectional study of 184 patients. Clin Rheumatol. 2009;28(8):915–921. doi: 10.1007/s10067-009-1175-2. http://dx.doi.org/10.1007/s10067-009-1175-2 [DOI] [PubMed] [Google Scholar]
- 31.Bodolay E, Csiki Z, Szekanecz Z, Ben T, Kiss E, Zeher M, et al. Five-year follow-up of 665 Hungarian patients with undifferentiated connective tissue disease (UCTD) Clin Exp Rheumatol. 2003;21(3):313–320. [PubMed] [Google Scholar]
- 32.Mosca M, Tani C, Neri C, Baldini C, Bombardieri S. Undifferentiated connective tissue diseases (UCTD) Autoimmun Rev. 2006;6(1):1–4. doi: 10.1016/j.autrev.2006.03.004. http://dx.doi.org/10.1016/j.autrev.2006.03.004 [DOI] [PubMed] [Google Scholar]
- 33.Kinder BW, Shariat C, Collard HR, Koth LL, Wolters PJ, Golden JA, et al. Undifferentiated connective tissue disease-associated interstitial lung disease: changes in lung function. Lung. 2010;188(2):143–149. doi: 10.1007/s00408-009-9226-7. http://dx.doi.org/10.1007/s00408-009-9226-7 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Corte TJ, Copley SJ, Desai SR, Zappala CJ, Hansell DM, Nicholson AG, et al. Significance of connective tissue disease features in idiopathic interstitial pneumonia. Eur Respir J. 2012;39(3):661–668. doi: 10.1183/09031936.00174910. http://dx.doi.org/10.1183/09031936.00174910 [DOI] [PubMed] [Google Scholar]
- 35.Vij R, Noth I, Strek ME. Autoimmune-featured interstitial lung disease: a distinct entity. Chest. 2011;140(5):1292–1299. doi: 10.1378/chest.10-2662. http://dx.doi.org/10.1378/chest.10-2662 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Cutolo M, Sulli A, Secchi ME, Paolino S, Pizzorni C. Nailfold capillaroscopy is useful for the diagnosis and follow-up of autoimmune rheumatic diseases. A future tool for the analysis of microvascular heart involvement? . Rheumatology (Oxford) 2006;45(Suppl 4):iv43–iv46. doi: 10.1093/rheumatology/kel310. http://dx.doi.org/10.1093/rheumatology/kel310 [DOI] [PubMed] [Google Scholar]
- 37.Homma Y, Ohtsuka Y, Tanimura K, Kusaka H, Munakata M, Kawakami Y, et al. Can interstitial pneumonia as the sole presentation of collagen vascular diseases be differentiated from idiopathic interstitial pneumonia? Respiration. 1995;62(5):248–251. doi: 10.1159/000196457. http://dx.doi.org/10.1159/000196457 [DOI] [PubMed] [Google Scholar]
- 38.Solomon J, Swigris JJ, Brown KK. Myositis-related interstitial lung disease and antisynthetase syndrome. J Bras Pneumol. 2011;37(1):100–109. doi: 10.1590/s1806-37132011000100015. http://dx.doi.org/10.1590/S1806-37132011000100015 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Mittoo S, Gelber AC, Christopher-Stine L, Horton MR, Lechtzin N, Danoff SK. Ascertainment of collagen vascular disease in patients presenting with interstitial lung disease. Respir Med. 2009;103(8):1152–1158. doi: 10.1016/j.rmed.2009.02.009. http://dx.doi.org/10.1016/j.rmed.2009.02.009 [DOI] [PubMed] [Google Scholar]
- 40.Fischer A, Pfalzgraf FJ, Feghali-Bostwick CA, Wright TM, Curran-Everett D, West SG, et al. Anti-th/to-positivity in a cohort of patients with idiopathic pulmonary fibrosis. J Rheumatol. 2006;33(8):1600–1605. [PubMed] [Google Scholar]
- 41.Fischer A, Swigris JJ, Bois RM du, Lynch DA, Downey GP, Cosgrove GP, et al. Anti-synthetase syndrome in ANA and anti-Jo-1 negative patients presenting with idiopathic interstitial pneumonia. Respir Med. 2009;103(11):1719–1724. doi: 10.1016/j.rmed.2009.05.001. http://dx.doi.org/10.1016/j.rmed.2009.05.001 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Raghu G, Collard HR, Egan JJ, Martinez FJ, Behr J, Brown KK, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;183(6):788–824. doi: 10.1164/rccm.2009-040GL. http://dx.doi.org/10.1164/rccm.2009-040GL [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Barbas-Filho JV, Ferreira MA, Sesso A, Kairalla RA, Carvalho CR, Capelozzi VL. Evidence of type II pneumocyte apoptosis in the pathogenesis of idiopathic pulmonary fibrosis (IFP)/usual interstitial pneumonia (UIP) J Clin Pathol. 2001;54(2):132–138. doi: 10.1136/jcp.54.2.132. http://dx.doi.org/10.1136/jcp.54.2.132 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Gonçalves JJ, Leão LE, Ferreira RG, Oliveira R, Ota LH, Santos RS dos. Semiquantitative analysis of surgical biopsies of distinct lung lobes of patients with usual interstitial pneumonia/idiopathic pulmonary fibrosis. J Bras Pneumol. 2009;35(7):676–682. doi: 10.1590/s1806-37132009000700009. http://dx.doi.org/10.1590/S1806-37132009000700009 [DOI] [PubMed] [Google Scholar]
- 45.Jezler SF, Santiago MB, Andrade TL, Araujo C, Neto, Braga H, Cruz AA. Interstitial lung disease in patients with progressive systemic sclerosis: a study of 58 cases. J Bras Pneumol. 2005;31(4):300–306. [Google Scholar]
- 46.Parra ER, Otani LH, Carvalho EF de, Ab'Saber A, Capelozzi VL. Systemic sclerosis and idiopathic interstitial pneumonia: histomorphometric differences in lung biopsies. J Bras Pneumol. 2009;35(6):529–540. doi: 10.1590/s1806-37132009000600006. http://dx.doi.org/10.1590/S1806-37132009000600006 [DOI] [PubMed] [Google Scholar]
- 47.Lee JS, Kim EJ, Lynch KL, Elicker B, Ryerson CJ, Katsumoto TR, et al. Prevalence and clinical significance of circulating autoantibodies in idiopathic pulmonary fibrosis. Respir Med. 2013;107(2):249–255. doi: 10.1016/j.rmed.2012.10.018. http://dx.doi.org/10.1016/j.rmed.2012.10.018 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Takahashi T, Wada I, Ohtsuka Y, Munakata M, Homma Y, Kuroki Y. Autoantibody to alanyl-tRNA synthetase in patients with idiopathic pulmonary fibrosis. Respirology. 2007;12(5):642–653. doi: 10.1111/j.1440-1843.2007.01140.x. http://dx.doi.org/10.1111/j.1440-1843.2007.01140.x [DOI] [PubMed] [Google Scholar]
- 49.Suda T, Kono M, Nakamura Y, Enomoto N, Kaida Y, Fujisawa T, et al. Distinct prognosis of idiopathic nonspecific interstitial pneumonia (NSIP) fulfilling criteria for undifferentiated connective tissue disease (UCTD) Respir Med. 2010;104(10):1527–1534. doi: 10.1016/j.rmed.2010.04.022. http://dx.doi.org/10.1016/j.rmed.2010.04.022 [DOI] [PubMed] [Google Scholar]
- 50.Pereira DA, Dias OM, Almeida GE, Araujo MS, Kawano-Dourado L, Kairalla RA, et al. Features of a Brazilian cohort of patients with lung-dominant connective tissue disease (LD-CTD). Progress in Connective Tissue Disease Related to Interstitial Lung Disease; American Thoracic Society International Conference ; 2013 May 1; Philadelphia, USA. 2013. pp. A2928–A2928. [Google Scholar]
- 51.Kairalla RA. Interstitial lung disease in scleroderma. J Bras Pneumol. 2005;31(4):i–iii. doi: 10.36416/1806-3756/e20220293. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Marangoni RG, Rocha LF, Del Rio AP, Yoshinari NH, Marques-Neto JF, Sampaio-Barros PD. Systemic sclerosis sine scleroderma: distinct features in a large Brazilian cohort. Rheumatology (Oxford) 2013;52(8):1520–1524. doi: 10.1093/rheumatology/ket163. http://dx.doi.org/10.1093/rheumatology/ket163 [DOI] [PubMed] [Google Scholar]
- 53.Castelino FV, Goldberg H, Dellaripa PF. The impact of rheumatological evaluation in the management of patients with interstitial lung disease. Rheumatology (Oxford) 2011;50(3):489–493. doi: 10.1093/rheumatology/keq233. http://dx.doi.org/10.1093/rheumatology/keq233 [DOI] [PubMed] [Google Scholar]
- 54.Fischer A, Swigris JJ, Bois RM du, Groshong SD, Cool CD, Sahin H, et al. Minor salivary gland biopsy to detect primary Sjogren syndrome in patients with interstitial lung disease. Chest. 2009;136(4):1072–1078. doi: 10.1378/chest.08-2839. http://dx.doi.org/10.1378/chest.08-2839 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Deheinzelin D, Capelozzi VL, Kairalla RA, Barbas JV, Filho, Saldiva PH, de Carvalho CR. Interstitial lung disease in primary Sjögren's syndrome. Clinical-pathological evaluation and response to treatment. Pt 1Am J Respir Crit Care Med. 1996;154(3):794–799. doi: 10.1164/ajrccm.154.3.8810621. http://dx.doi.org/10.1164/ajrccm.154.3.8810621 [DOI] [PubMed] [Google Scholar]
- 56.Stinton LM, Fritzler MJ. A clinical approach to autoantibody testing in systemic autoimmune rheumatic disorders. Autoimmun Rev. 2007;7(1):77–84. doi: 10.1016/j.autrev.2007.08.003. http://dx.doi.org/10.1016/j.autrev.2007.08.003 [DOI] [PubMed] [Google Scholar]
- 57.Tashkin DP, Elashoff R, Clements PJ, Goldin J, Roth MD, Furst DE, et al. Cyclophosphamide versus placebo in scleroderma lung disease. N Engl J Med. 2006;354(25):2655–2666. doi: 10.1056/NEJMoa055120. http://dx.doi.org/10.1056/NEJMoa055120 [DOI] [PubMed] [Google Scholar]
- 58.Fischer A, Brown KK, Du Bois RM, Frankel SK, Cosgrove GP, Fernandez-Perez ER, et al. Mycophenolate mofetil improves lung function in connective tissue disease-associated interstitial lung disease. J Rheumatol. 2013;40(5):640–646. doi: 10.3899/jrheum.121043. http://dx.doi.org/10.3899/jrheum.121043 [DOI] [PMC free article] [PubMed] [Google Scholar]