Résumé
Objectif
Les présentes lignes directrices visent à aider les médecins de famille et autres généralistes à reconnaître les manifestations cliniques devant éveiller les soupçons quant à la présence d’un cancer du poumon chez les patients.
Composition du comité
Les membres du comité ont été choisis parmi les leaders régionaux en soins primaires du Réseau provincial des soins primaires et de la lutte contre le cancer d’Action Cancer Ontario et parmi les membres du Groupe sur le siège de la maladie, Cancer du poumon d’Action Cancer Ontario.
Méthodes
Les présentes lignes directrices sont le fruit d’une revue systématique des données probantes, d’une synthèse des données et d’un examen externe formel effectué par des intervenants canadiens qui ont validé la pertinence des recommandations.
Rapport
Ces lignes directrices fondées sur des données probantes ont été formulées pour améliorer la prise en charge en contexte canadien des patients qui présentent des manifestations cliniques du cancer du poumon.
Conclusion
Le dépistage et l’aiguillage précoces des patients atteints de cancer du poumon pourraient en fin de compte aider à réduire les morbidités et mortalités liées au cancer. Ces lignes directrices pourraient aussi s’avérer utiles dans la mise sur pied de programmes de diagnostic du cancer du poumon et pour aider les décideurs à veiller à ce que les ressources appropriées soient en place.
Le cancer du poumon est la cause la plus fréquente de décès par cancer au Canada1. Ces cancers sont souvent diagnostiqués à un stade avancé et le pronostic est très sombre1. Au Canada, les chances de survivre à un cancer du poumon sont faibles, le taux de survie à 5 ans se situant à 13 % chez les hommes et à 19 % chez les femmes1. Les retards de diagnostic sont bien connus2–11 et s’expliquent en partie par le fait que les patients et les médecins attribuent souvent les symptômes communs, atypiques et non spécifiques du cancer du poumon à d’autres maladies, bénignes celles-là.
Dans le but d’orienter l’introduction de programmes d’évaluation diagnostique (PED) en Ontario, le Réseau provincial des soins primaires et de la lutte contre le cancer d’Action Cancer Ontario (ACO) est entré en collaboration, en octobre 2009, avec le Programme de soins fondés sur la recherche (PSFR) d’ACO pour former le groupe de travail sur l’aiguillage des patients atteints de cancer du poumon. Le groupe de travail devait émettre des recommandations visant à aider les médecins de famille et autres fournisseurs de soins primaires à reconnaître les patients exempts de diagnostic qui présentent des signes et symptômes de cancer du poumon et à instaurer leur prise en charge. À cette fin, le groupe a tenté de répondre aux questions ci-dessous.
Quels sont les principaux facteurs de risque connus permettant de prédire le cancer du poumon?
Quels sont les signes, symptômes et autres manifestations cliniques prédictifs du cancer du poumon?
Quelle est la précision diagnostique des investigations en cancer du poumon?
Quels sont les facteurs liés au patient et au fournisseur qui retardent l’aiguillage à un spécialiste?
Un retard de la consultation influence-t-il les résultats?
Ces lignes directrices visent à aider les généralistes à reconnaître les manifestations cliniques du cancer du poumon devant éveiller les soupçons et à les prendre en charge, puis à favoriser les aiguillages opportuns et appropriés. Les recommandations ciblent les patients qui consultent en soins primaires. Elles visent également à aider les décideurs à veiller à ce que les ressources, tels les PED, soient en place pour réaliser les temps d’attente ciblés.
Composition du comité
Le groupe de travail était composé de 5 médecins de famille (M.E.D., S.Y., M.A., P.B., C.L.), 1 oncologue médical (A.R.), 1 pneumologue (R.S.), 1 radio-oncologue (Y.U.), 1 chirurgien thoracique (R.Z.) et 1 spécialiste de la méthodologie (E.T.V.). Les membres du comité étaient des leaders régionaux de lutte contre le cancer en soins primaires sélectionnés dans le Réseau provincial des soins primaires et de la lutte contre le cancer, et des membres du Groupe sur le siège de la maladie, Cancer du poumon d’ACO. Les examinateurs internes et externes étaient notamment des médecins de famille, des chirurgiens thoraciques et des radiologistes. Les travaux du PSFR sont appuyés par le ministère de la Santé et des Soins de longue durée de l’Ontario par le biais d’ACO et du point de vue éditorial, le PSFR est indépendant de sa source de financement.
Méthodes
Les méthodes du cycle de développement des lignes directrices de pratique cliniques ont servi à formuler ces lignes directrices, soit une analyse du contexte des lignes directrices existantes, une revue systématique des données probantes, une synthèse des données et les commentaires des examinateurs internes et externes de toutes les régions du Canada12. Les détails des méthodes et des conclusions de la revue systématique ont été publiés13,14.
Le processus d’adaptation des lignes directrices a tenu compte des recommandations du New Zealand Guidelines Group 2009 (NZGG)6, de l’Australian National Health and Medical Research Council 200415, du National Institute for Health and Care Excellence (NICE) 20052, des lignes directrices de pratique clinique de l’American College of Chest Physicians10,16,17 et du Scottish Intercollegiate Guidelines Network 200518. Le processus a aussi tenu compte des données mises à jour tirées des recherches originales. Un grand nombre de recommandations des lignes directrices NZGG 2009 ou NICE 2005 ont été adoptées ou adaptées2,6. Les recommandations ci-dessous sont le fruit de l’intégration des recommandations NZGG 2009 et NICE 2005 aux données issues de revues systématiques de niveau I, d’études de cohortes et cas-témoins de niveau II et d’opinions d’experts de niveau III du groupe de travail sur l’aiguillage des patients atteints de cancer du poumon du PSFR, tel que décrit plus bas2,6.
Les recommandations ont été formulées et approuvées dans le cadre de téléconférences, par un consensus informel au sein du groupe de travail. Chaque recommandation a tenu compte des données probantes issues de la revue systématique. Les temps d’attente recommandés sont fondés sur l’opinion d’experts et le consensus du groupe de travail qui reflétaient t souvent leur caractère réaliste dans le système de santé canadien. Certains membres du groupe de travail faisaient également partie d’une étude canadienne (Lung Cancer Time to Treat Study) qui montrait que le temps d’attente pour une consultation avec un spécialiste chez les patients qui présentent des signes et symptômes de cancer du poumon pouvait passer de 20 à 6 jours avec la mise en place d’un PED5.
Rapport
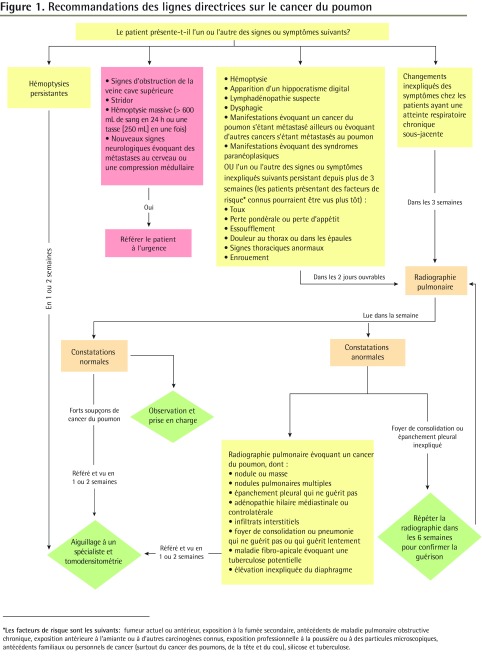
Les recommandations des lignes directrices sur le cancer du poumon sont présentées à la Figure 1 et sont résumées ci-dessous.
Figure 1.
Recommandations des lignes directrices sur le cancer du poumon
*Les facteurs de risque sont les suivants: fumeur actuel ou antérieur, exposition à la fumée secondaire, antécédents de maladie pulmonaire obstructive chronique, exposition antérieure à l’amiante ou à d’autres carcinogènes connus, exposition professionnelle à la poussière ou à des particules microscopiques, antécédents familiaux ou personnels de cancer (surtout du cancer des poumons, de la tête et du cou), silicose et tuberculose.
Facteurs qui élèvent le risque de cancer du poumon
Les facteurs de risque du cancer du poumon présentés dans l’Encadré 1 étaient fondés sur le résumé de la revue de la littérature NICE 2005 fournie par NZGG 20092,6. Notre revue de la littérature actualisée n’a pas fourni de nouvelles données justifiant l’ajout de facteurs de risque associés au cancer du poumon à ceux apparaissant dans les lignes directrices NICE 2005 ou NZGG 2009.
Encadré 1. Facteurs qui élèvent le risque de cancer du poumon.
Les facteurs ci-dessous élèvent le risque de cancer du poumon :
|
Indications et investigation initiale recommandée pour un cancer du poumon soupçonné
Une radiographie pulmonaire d’urgence est recommandée dans les 48 heures pour tout signe et symptôme éveillant des soupçons de cancer du poumon,. Le groupe de travail a adapté les indications des lignes directrices NZGG 2009 en faveur d’une radiographie pulmonaire urgente (Encadré 2)6,10. Cette adaptation comprend notamment l’élimination du délai de 3 semaines pour l’apparition d’un hippocratisme digital, une lymphadénopathie suspecte ou un tableau clinique évoquant des métastases ayant atteint les poumons ou originaires des poumons. La dysphagie a été ajoutée comme indication pour une radiographie pulmonaire, car la revue de NICE 2005 l’a citée comme un symptôme du cancer du poumon et elle s’est révélée être un symptôme clinique principal parmi les patients atteints de cancer du poumon en soins tertiaires2,3. Enfin, les syndromes paranéoplasiques ont été ajoutés en fonction des conclusions d’une revue effectuée en 2007 par Spiro et collab., qui ont observé des syndromes paranéoplasiques chez environ 10 % des patients atteints d’un cancer du poumon10.
Encadré 2. Indications pour les investigations en cancer du poumon soupçonné.
Indications pour une radiographie pulmonaire
Une personne devrait subir une radiographie pulmonaire dans les 2 jours ouvrables si elle présente l’un ou l’autre des symptômes suivants :
Hémoptysie
Apparition d’un hippocratisme digital
Lymphadénopathie suspecte
Dysphagie
Manifestations évoquant des métastases ayant atteint les poumons ou originaires des poumons10
Manifestations évoquant des syndromes paranéoplasiques10
Ou si l’un ou l’autre des signes ou symptômes inexpliqués suivants persistent pendant plus de 3 semaines (les patients qui présentent des facteurs de risque connus [Encadré 1] pourraient être vus plus tôt) :
Toux
Perte pondérale ou perte d’appétit
Essoufflement
Douleur au thorax ou dans les épaules
Signes thoraciques anormaux (p. ex. crépitations or respiration sifflante)
Enrouement
Aussi, tenir compte de ce qui suit :
Les patients ayant une atteinte respiratoire chronique sous-jacente devraient subir une radiographie pulmonaire dans les 3 semaines si les symptômes se modifient de façon inexpliquée
Une personne qui présente un foyer de consolidation ou un épanchement pleural inexpliqué sur une radiographie initiale doit être traitée et la radiographie doit être répétée dans les 6 semaines pour confirmer la guérison complète
La cytologie des expectorations n’est pas recommandée dans le cadre des investigations en cancer du poumon soupçonné
Indications pour une tomodensitométrie des poumons
Une personne doit subir une tomodensitométrie des poumons dans les 2 semaines si elle répond à au moins un des critères suivants :
Anomalies sur la radiographie pulmonaire (p. ex. nodules, infiltrats, foyer de consolidation ou épanchement non guéris malgré un traitement) éveillant les soupçons quant à un cancer du poumon
Radiographie normale, jumelée à de forts soupçons de cancer du poumon en fonction du jugement clinique
Le médecin traitant dépend des ressources et des processus disponibles à l’échelle locale pour obtenir une tomodensitométrie d’urgence
Dans le cas des patients qui ont une atteinte respiratoire chronique sous-jacente, le groupe de travail a sanctionné la recommandation de NICE 2005, selon laquelle une radiographie pulmonaire est nécessaire pour toute modification inexpliquée des symptômes existants qui dure depuis plus de 3 semaines2.
Le groupe de travail a adapté la recommandation pour un suivi de 6 semaines après l’observation d’un foyer de consolidation sur la radiographie pulmonaire en modifiant les lignes directrices d’aiguillage NZGG 20096 pour inclure l’épanchement pleural inexpliqué et tous les patients, peu importe les facteurs de risque de cancer du poumon (Encadré 2)6,10.
Les lignes directrices variaient considérablement au sujet de l’indication de la cytologie des expectorations en cas de cancer du poumon soupçonné6,15,17,18, qui était absente des lignes directrices NICE 2005 et NZGG 20092,6. Puisque notre recherche de la littérature a continué de conclure à une grande spécificité, mais à une sensibilité variable de ce test dans le dépistage du cancer du poumon15,17–20, le groupe de travail a sanctionné la recommandation de NZGG 2009 s’opposant à la cytologie des expectorations6.
Les lignes directrices NICE 2005 et NZGG 2009 n’ont pas fourni d’analyse de la tomodensitométrie des poumons ni n’ont-elles émis de recommandation à ce sujet, chez les patients chez qui on soupçonne un cancer du poumon2,6. La mise à jour de la revue de la littérature a donné lieu à de rares études additionnelles. Le groupe de travail a formulé des indications pour la tomodensitométrie des poumons en fonction des recommandations fournies en 2005 par le Scottish Intercollegiate Guidelines Network et de l’opinion des experts du groupe de travail (Encadré 2)6,10,18. Ces indications incluaient une radiographie pulmonaire anormale ou normale, jumelée à de forts soupçons de cancer du poumon.
Une recommandation pour le suivi des nodules pulmonaires solitaires sur les clichés d’imagerie a été initialement adaptée des lignes directrices de pratique clinique de l’American College of Chest Physicians pour les nodules pulmonaires16. Cependant, après une revue interne, le groupe de travail a opté pour retirer la recommandation, car un patient qui présente un nodule pulmonaire solitaire, peu importe la taille, doit être référé à un spécialiste.
Indications et aiguillage recommandé pour un cancer du poumon soupçonné
Les indications pour l’aiguillage immédiat au service d’urgence (Encadré 3) sont adaptées des lignes directrices NICE 20052. Des hémoptysies massives (définies comme plus de 600 mL de sang sur 24 heures ou plus de 250 mL en une fois) et l’apparition de signes neurologiques évoquant des métastases au cerveau ou une compression médullaire ont été ajoutées d’après l’opinion des experts et le consensus dans le groupe de travail5.
Encadré 3. Indications pour l’aiguillage d’un patient chez qui on soupçonne un cancer du poumon.
|
Indications pour référer le patient à l’urgence Les patients doivent être référés à l’urgence s’ils présentent l’un ou l’autre des symptômes suivants :
Indications pour référer un patient à un spécialiste (pneumologue ou chirurgien thoracique) ou à un PED Les patients doivent être référés à un spécialiste ou à un PED, et s’attendre à une consultation, si ces ressources sont disponibles dans la localité, dans 1 à 2 semaines s’ils présentent l’un ou l’autre des symptômes suivants :
S’il est possible d’accéder rapidement à une tomodensitométrie des poumons, celle-ci peut être demandée simultanément à l’aiguillage pendant qu’on attend la consultation avec le médecin. Tout dépend des ressources disponibles à l’échelle locale. Si la tomodensitométrie est totalement négative, l’aiguillage au spécialiste peut alors être annulé. |
PED-programme d’évaluation diagnostique
Le groupe de travail a adapté des lignes directrices d’aiguillage NZGG 2009 et NICE 2005 les indications pour référer le patient à un spécialiste2,6. L’élévation inexpliquée du diaphragme a été incluse, après qu’un examinateur interne l’ait suggérée. Les anomalies suspectes additionnelles constatées sur la radiographie pulmonaire (Encadré 3) et les conseils pratiques (Encadré 4) pour l’aiguillage à un spécialiste étaient fondés sur l’opinion des experts du groupe de travail, particulièrement tirée de leur expérience avec le programme Time to Treat5.
Encadré 4. Conseils pratiques pour les investigations et aiguillages des patients chez qui on soupçonne un cancer du poumon.
La requête pour une radiographie pulmonaire doit inclure l’anamnèse, y compris les signes et symptômes éveillant les soupçons de cancer du poumon, et l’existence de facteurs de risque (Encadré 1)
Dans la semaine qui suit la demande pour une radiographie, celle-ci doit avoir été effectuée, lue et rapportée par le radiologiste, et le rapport doit avoir été lu par le médecin traitant
Si la radiographie évoque un cancer du poumon, le radiologiste doit utiliser une autre méthode pour informer le médecin traitant (p. ex. appel téléphonique, signalisation)
Pour accélérer le diagnostic et éviter la duplication des examens, fournir au moins l’information suivante au spécialiste :
Anamnèse du patient, y compris tous les facteurs de risque et signes ou symptômes évoquant un cancer du poumon
Tous les résultats d’imagerie préexistants (tous les efforts doivent être faits pour les fournir), y compris radiographies et tomodensitométries des poumons (les clichés et images numériques doivent être disponibles lors de la consultation)
Toutes les autres affections médicales et tous les autres médicaments pris par le patient
Tous les résultats des prélèvements sanguins récents
En raison du taux élevé de faux négatifs liés aux radiographies pulmonaires, les lignes directrices NICE 2005 et NZGG 2009 ont recommandé l’aiguillage à un spécialiste en cas de forts soupçons de cancer du poumon malgré des radiographies pulmonaires normales2,6. Deux revues systématiques relevées dans notre recherche ont aussi rapporté un taux élevé de faux négatifs liés aux radiographies pulmonaires18,21. Ainsi, la recommandation qui pousse les médecins à référer les patients à un spécialiste en cas de forts soupçons de cancer du poumon a été adoptée.
Recommandations visant à réduire les retards de diagnostic
Les recommandations visant à réduire les retards de diagnostic découlent des données probantes des lignes directrices NZGG 2009 et NICE 2005, de même que de la mise à jour de la recherche de la littérature (Encadré 5)2,6,7,9,10. Les facteurs liés au patient ou au médecin de famille qui peuvent retarder l’aiguillage à un spécialiste ou la pose d’un diagnostic de cancer du poumon sont la peur d’un diagnostic de cancer, la non-reconnaissance des signes et symptômes évoquant un cancer du poumon, les comorbidités, les tests consécutifs multiples en soins primaires, la confiance excessive dans les radiographies pulmonaires pour poser un diagnostic de cancer du poumon, l’absence de suivi des résultats d’imagerie et l’aiguillage initial à un médecin non pneumologue2,6,7,9,10.
Encadré 5. Recommandations visant à réduire le délai du diagnostic.
Les facteurs suivants peuvent contribuer à réduire le délai du diagnostic :
|
Conclusion
Les signes et symptômes du cancer du poumon qui justifient des examens plus poussés sont les suivants : obstruction de la veine cave supérieure, stridor, hémoptysie, hippocratisme digital, hypertrophie ganglionnaire, toux persistante et inexpliquée, perte pondérale inexpliquée, dyspnée, douleur au thorax ou dans les épaules, enrouement, dysphagie et anomalies sur la radiographie pulmonaire. Les patients pourraient aussi présenter des signes et symptômes de syndromes paranéoplasiques ou de métastases pulmonaires2,3,10. Les facteurs de risque de cancer du poumon sont le tabagisme actuel ou antérieur, la maladie pulmonaire obstructive chronique, l’exposition antérieure à l’amiante, les antécédents de cancer (surtout les cancers de la tête et du cou), l’exposition professionnelle à la poussière ou aux particules microscopiques (p. ex. poussière de bois, silice), la silicose ou tuberculose, les antécédents familiaux de cancer, l’exposition à des carcinogènes connus (p. ex. radon, chrome, nickel) et l’exposition passive à la fumée du tabac2,6.
Il faut demander une radiographie pulmonaire à titre d’examen préliminaire chez les patients qui présentent de signes et symptômes éveillant les soupçons quant au cancer du poumon. La cytologie des expectorations n’est pas recommandée. Dans les cas où l’on soupçonne fortement un cancer du poumon en fonction des radiographies pulmonaires ou du jugement clinique (malgré des radiographies négatives), une tomodensitométrie des poumons et la référence à un pneumologue ou à un chirurgien thoracique sont recommandées, selon la disponibilité des ressources locales.
En l’absence de données publiées sur les effets des temps d’attente sur la santé des patients, on estime généralement qu’un diagnostic précoce de cancer du poumon améliore probablement le pronostic. Si les médecins demandaient plus souvent une radiographie pulmonaire pour les patients qui présentent de vagues symptômes de cancer du poumon, on pourrait éviter les retards de diagnostic. Si la situation le justifie, il faudrait aussi référer le patient de façon hâtive à un spécialiste ou à un PED pour qu’il reçoive des examens plus poussés. Il faudrait aussi tenter d’éliminer les retards de diagnostic au niveau du patient, du fournisseur ou des politiques.
Les présentes lignes directrices pourraient contribuer à raccourcir le délai avant la pose d’un diagnostic de cancer du poumon en aidant les médecins de famille et autres fournisseurs de soins primaires à reconnaître les manifestations cliniques pouvant éveiller les soupçons quant à la présence d’un cancer du poumon et pouvant leur permettre de référer les patients de manière plus ponctuelle et appropriée. Elles pourraient aussi orienter l’élaboration des PED pour les patients chez qui on soupçonne un cancer du poumon et contribuer à ce que les ressources soient en place pour atteindre les temps d’attente visés.
POINTS DE REPÈRE DU RÉDACTEUR
Les signes et symptômes du cancer du poumon qui justifient des examens plus poussés sont les suivants: obstruction de la veine cave supérieure, stridor, hémoptysie, hippocratisme digital, hypertrophie ganglionnaire, toux persistante et inexpliquée, perte pondérale inexpliquée, dyspnée, douleur au thorax ou dans les épaules, enrouement, dysphagie et anomalies sur la radiographie pulmonaire.
Il faut demander une radiographie pulmonaire à titre d’examen préliminaire chez les patients qui présentent de signes et symptômes éveillant les soupçons quant au cancer du poumon. La cytologie des expectorations n’est pas recommandée. Dans les cas où l’on soupçonne fortement un cancer du poumon en fonction des radiographies pulmonaires ou du jugement clinique (malgré des radiographies négatives), une tomodensitométrie des poumons et l’aiguillage à un pneumologue ou à un chirurgien thoracique sont recommandés, selon la disponibilité des ressources locales.
Footnotes
Cet article donne droit à des crédits Mainpro-M1. Pour obtenir des crédits, allez à www.cfp.ca et cliquez sur le lien vers Mainpro.
Cet article a fait l’objet d’une révision par des pairs.
The English version of this article is available at www.cfp.ca on the table of contents for the August 2014 issue on page 711.
Collaborateurs
Tous les auteurs ont contribué à la revue documentaire et à l’interprétation, ainsi qu’à la rédaction du manuscrit aux fins de soumission.
Intérêts concurrents
Aucun déclaré
Références
- 1.Institut national du cancer du Canada . Canadian cancer statistics 2001. Toronto, ON: Institut national du cancer du Canada; 2001. Accessible à : http://publications.gc.ca/site/eng/398229/publication.html. Réf. du 27 juin 2014. [Google Scholar]
- 2.Referral guidelines for suspected cancer. NICE guidelines CG27. Londres, RU: National Institute for Health and Care Excellence; 2005. National Institute for Health and Care Excellence [site web] Accessible à : www.nice.org.uk/CG027. Réf. du 2 juillet 2014. [Google Scholar]
- 3.Chandra S, Mohan A, Guleria R, Singh V, Yadav P. Delays during the diagnostic evaluation and treatment of lung cancer. Asian Pac J Cancer Prev. 2009;10(3):453–6. [PubMed] [Google Scholar]
- 4.Liedekerken BM, Hoogendam A, Buntinx F, van der Weyden T, de Vet HC. Prolonged cough and lung cancer: the need for more general practice research to inform clinical decision-making. Br J Gen Pract. 1997;47(421):505. [PMC free article] [PubMed] [Google Scholar]
- 5.Lo DS, Zeldin RA, Skrastins R, Fraser IM, Newman H, Monavvari A, et al. Time to treat: a system redesign focusing on decreasing the time from suspicion of lung cancer to diagnosis. J Thorac Oncol. 2007;2(11):1001–6. doi: 10.1097/JTO.0b013e318158d4b6. [DOI] [PubMed] [Google Scholar]
- 6.New Zealand Guidelines Group . Suspected cancer in primary care: guidelines for investigation, referral and reducing ethnic disparities. Wellington, NZ: New Zealand Guidelines Group; 2006. Accessible à : www.midlandcancernet-work.org.nz/file/fileid/17510. Réf. du 27 juin 2014. [Google Scholar]
- 7.Olsson JK, Schultz EM, Gould MK. Timeliness of care in patients with lung cancer: a systematic review. Thorax. 2009;64(9):749–56. doi: 10.1136/thx.2008.109330. [DOI] [PubMed] [Google Scholar]
- 8.Rolke HB, Bakke PS, Gallefoss F. Delays in the diagnostic pathways for primary pulmonary carcinoma in Southern Norway. Respir Med. 2007;101(6):1251–7. doi: 10.1016/j.rmed.2006.10.021. Publication en ligne du 5 déc. 2006. [DOI] [PubMed] [Google Scholar]
- 9.Singh H, Sethi S, Raber M, Petersen LA. Errors in cancer diagnosis: current understanding and future directions. J Clin Oncol. 2007;25(31):5009–18. doi: 10.1200/JCO.2007.13.2142. [DOI] [PubMed] [Google Scholar]
- 10.Spiro SG, Gould MK, Colice GL, American College of Chest Physicians Initial evaluation of the patient with lung cancer: symptoms, signs, laboratory tests, and paraneoplastic syndromes: ACCP evidenced-based clinical practice guidelines (2 édition) Chest. 2007;132(3 Suppl):149S–60S. doi: 10.1378/chest.07-1358. [DOI] [PubMed] [Google Scholar]
- 11.Yilmaz A, Damadoglu E, Salturk C, Okur E, Tuncer LY, Halezeroglu S. Delays in the diagnosis and treatment of primary lung cancer: are longer delays associated with advanced pathological stage? Ups J Med Sci. 2008;113(3):287–96. doi: 10.3109/2000-1967-236. [DOI] [PubMed] [Google Scholar]
- 12.Browman GP, Levine MN, Mohide EA, Hayward RS, Pritchard KI, Gafni A, et al. The practice guidelines development cycle: a conceptual tool for practice guidelines development and implementation. J Clin Oncol. 1995;13(2):502–12. doi: 10.1200/JCO.1995.13.2.502. [DOI] [PubMed] [Google Scholar]
- 13.Del Giudice L, Young S, Vella E, Ash M, Bansal P, Robinson A, et al. Referral of suspected lung cancer by family physicians and other primary care providers. Toronto, ON: Action Cancer Ontario; 2011. Evidence-based series 24-2. Accessible à : www.cancercare.on.ca/common/pages/UserFile.aspx?fileId=155781. Réf. du 27 juin 2014. [Google Scholar]
- 14.Del Giudice ME, Young SM, Vella ET, Ash M, Bansal P, Robinson A, et al. Systematic review of guidelines for the management of suspected lung cancer in primary care. Can Fam Physician. 2014;60:e395–404. [PMC free article] [PubMed] [Google Scholar]
- 15.Cancer Council Australia . Clinical practice guidelines for the prevention, diagnosis and management of lung cancer. Sydney, Aust: National Health and Medical Research Council; 2004. Accessible à : www.nhmrc.gov.au/_files_nhmrc/publications/attachments/cp97.pdf. Réf. du 27 juin 2014. [Google Scholar]
- 16.Gould MK, Fletcher J, Iannettoni MD, Lynch WR, Midthun DE, Naidich DP, et al. Evaluation of patients with pulmonary nodules: when is it lung cancer?: ACCP evidence-based clinical practice guidelines (2 édition) Chest. 2007;132(3 Suppl):108S–30S. doi: 10.1378/chest.07-1353. [DOI] [PubMed] [Google Scholar]
- 17.Rivera MP, Mehta AC, American College of Chest Physicians Initial diagnosis of lung cancer: ACCP evidence-based clinical practice guidelines (2 édition) Chest. 2007;132(3 Suppl):131S–48S. doi: 10.1378/chest.07-1357. [DOI] [PubMed] [Google Scholar]
- 18.Management of patients with lung cancer: a national clinical guideline. Edinburgh, Écosse: Scottish Intercollegiate Guidelines Network; 2005. Scottish Intercollegiate Guidelines Network. Accessible à : www.sign.ac.uk/guidelines/fulltext/80/. Réf. du 27 juin 2014. [Google Scholar]
- 19.Choi YD, Han CW, Kim JH, Oh IJ, Nam JH, Juhng SW, et al. Effectiveness of sputum cytology using ThinPrep method for evaluation of lung cancer. Diagn Cytopathol. 2008;36(3):167–71. doi: 10.1002/dc.20761. [DOI] [PubMed] [Google Scholar]
- 20.Kemp RA, Reinders DM, Turic B. Detection of lung cancer by automated sputum cytometry. J Thorac Oncol. 2007;2(11):993–1000. doi: 10.1097/JTO.0b013e318158d488. [DOI] [PubMed] [Google Scholar]
- 21.Kvale PA. Chronic cough due to lung tumors: ACCP evidence-based clinical practice guidelines. Chest. 2006;129(1 Suppl):147S–53S. doi: 10.1378/chest.129.1_suppl.147S. [DOI] [PubMed] [Google Scholar]