Résumé
Objectif
Ces lignes directrices ont pour but d’aider les médecins de famille et les autres professionnels des soins primaires à reconnaître les caractéristiques qui devraient susciter leurs soupçons quant à la présence d’un cancer colorectal (CCR) chez leurs patients.
Composition du comité
Les membres du comité ont été choisis parmi les dirigeants régionaux des soins primaires au sein du Réseau provincial des soins primaires et de la lutte contre le cancer, les membres du Comité consultatif sur le dépistage du cancer colorectal de l’Ontario et les membres du Groupe sur le siège de la maladie, Cancer gastrointestinal, d’Action Cancer Ontario.
Méthodes
Ces lignes directrices sont le fruit d’une revue systématique et d’une synthèse des données probantes, ainsi que d’un examen formel par des intervenants canadiens pour valider la pertinence des recommandations.
Rapport
Des lignes directrices fondées sur des données probantes ont été élaborées pour améliorer la prise en charge des patients qui présentent des caractéristiques cliniques d’un CCR et ce, dans le contexte canadien.
Conclusion
Un équilibre judicieux entre une suspicion de CCR et le niveau de risque d’un tel cancer devrait favoriser une demande de consultation en temps opportun par les médecins de famille et les professionnels des soins primaires. Ces lignes directrices pourraient aussi orienter les décisions de demander une consultation à des programmes d’évaluation diagnostique du CCR.
Le cancer colorectal (CCR) est l’un des types de cancer les plus fréquents au Canada1. Les patients qui consultent un médecin de famille pour des symptômes de CCR en sont souvent à des stades avancés de la maladie2. Pour essayer d’améliorer le taux de détection précoce du CCR, de nombreuses instances au Canada ont instauré des programmes de dépistage dans la population. Même si les taux de dépistage du CCR augmentent, ils demeurent faibles et, même avec le dépistage, des patients atteints de CCR peuvent ne pas être identifiés2. Par conséquent, il dépendra des médecins de famille et des autres professionnels des soins primaires (PSP) de reconnaître, d’investiguer et de référer les patients qui présentent des signes et symptômes prédicteurs de CCR pour une évaluation plus approfondie et une prise en charge de la maladie3.
Dans le but d’orienter l’instauration de programmes d’évaluation diagnostique (PED) du CCR en Ontario, le Réseau provincial des soins primaires et de la lutte contre le cancer a conclu une entente de collaboration en février 2009 avec le Programme de soins fondés sur la recherche (PSFR) pour former le groupe de travail sur l’aiguillage des patients atteints de cancer colorectal. Le groupe de travail avait pour mandat de déterminer la prise en charge des patients présentant des signes et symptômes de CCR lorsqu’ils se présentent chez un médecin de famille ou d’autres professionnels de la santé. Pour ce faire, le groupe a répondu aux questions suivantes:
Quels signes, symptômes et autres manifestations cliniques en soins primaires sont prédictifs d’un CCR?
Quelle est l’exactitude diagnostique des investigations communément envisagées pour les patients qui présentent des signes et symptômes de CCR?
Quels sont les facteurs de risque connus qui accroissent la probabilité d’un CCR chez les patients qui en présentent les signes et symptômes?
Quels sont les facteurs associés aux patients et aux professionnels qui retardent les demandes de consultation?
Les délais dans le moment de la consultation affectentils les résultats chez le patient?
Les présentes lignes directrices ne portent pas sur le dépistage du CCR ni sur les urgences gastro-intestinales.
Composition de comité
Le groupe de travail était formé de 3 médecins de famille (M.E.D., A.H., C.L.), 2 chirurgiens (M.S., W.H.) et 1 spécialiste de la méthodologie (E.T.V.). On a choisi les membres du comité parmi ceux du Comité consultatif sur le dépistage du cancer colorectal de l’Ontario, du Réseau provincial des soins primaires et de la lutte contre le cancer et du Groupe sur le siège de la maladie, Cancer gastro-intestinal, d’ACO. Les examinateurs internes et externes étaient des médecins de famille, des gastro-entérologues, des radiologistes et des chirurgiens. Les travaux du PSFR sont financés par le ministère de la Santé et des Soins de longue durée de l’Ontario par l’intermédiaire d’ACO et le PSFR est indépendant de sa source de financement sur le plan éditorial.
Méthodes
Le cycle d’élaboration des guides de pratique a servi de méthodologie pour cet exercice4. Les lignes directrices ont été élaborées à la suite d’une revue systématique de la base factuelle, d’une synthèse des données probantes et des conclusions d’une révision formelle interne et externe effectuée par des intervenants canadiens. Les méthodes et les principales constatations sont expliquées ailleurs en détail2,5. Les recommandations se fondent sur des données probantes tirées de revues systématiques et de méta-analyses de niveau I, de cas-témoins et d’études de cohortes de niveau II et des opinions d’experts de niveau III.
De nombreuses instances considèrent que des résultats positifs à une recherche de sang occulte dans les selles (RSOS) au gaïac sont un indicateur de risque accru de CCR. La valeur prédictive positive (VPP) moyenne pour les RSOS combinés dans une revue systématique était de 5,7 %6. Un récent rapport évaluant les RSOS utilisées dans le programme ContrôleCancerColorectal en Ontario faisait valoir une VPP de 5,4 % pour un test unique (une seule fois) chez des patients asymptomatiques7. Une VPP est la probabilité que la maladie est véritablement présente lorsque la caractéristique clinique est présente ou positive. Les VPP estimées des signes et symptômes possibles sont tirées des ouvrages évalués par des pairs. Les caractéristiques cliniques dont les VPP combinées, tirées de nos revues systématiques et des méta-analyses publiées, qui étaient égales ou supérieures à la VPP d’une RSOS positive étaient considérées comme étant une indication d’un risque accru de CCR.
On recommande actuellement une colonoscopie pour les personnes considérées à risque accru de CCR, notamment celles dont les résultats d’une RSOS de dépistage sont positifs et celles qui ont un proche parent au premier degré qui a eu un CCR. Par conséquent, la colonoscopie a aussi été recommandée pour la prise en charge de patients qui présentent des caractéristiques cliniques indicatrices d’un risque accru de CCR. Pour établir les recommandations quant aux délais d’attente, on s’est servi des lignes directrices canadiennes publiées et de l’objectif d’un temps d’attente de 8 semaines pour une colonoscopie après des résultats de RSOS positifs que s’est fixé le programme ContrôleCancerColorectal de l’Ontario7,8.
Rapport
Quels signes, symptômes et autres manifestations cliniques en soins primaires sont prédictifs d’un CCR?
On trouve au Tableau 1 un résumé des signes et symptômes jugés indicateurs d’un risque accru de CCR que l’on observe en soins primaires, ainsi que leurs VPP moyennes respectives dont on a assuré la validité dans notre revue systématique2.
Tableau 1.
Caractéristiques cliniques indicatrices d’un risque accru de CCR
| CARACTÉRISTIQUE CLINIQUE | VPP MOYENNE (VARIATION), % |
|---|---|
| Masse rectale ou abdominale palpable | ND* |
| Saignement rectal combiné à une perte de poids | 13,0 (4,7–23) |
| Anémie ferriprive | 11,0 (7,7–41) |
| Saignement rectal mêlé aux selles | 11,0 (3,0–21) |
| Saignement rectal en l’absence de symptômes périanaux | 10,8 (6,9–18) |
| Saignement rectal combiné à des changements dans les habitudes intestinales | 10,5 (9,2–27) |
| Saignement rectal foncé | 9,7 (7,4–17) |
| Saignement rectal et diarrhée | 9,0 (3,4–19) |
| Saignement rectal et âge > 60 ou > 65 ans | 8,6 (4,6–20) |
| Saignement rectal et âge > 70 ou > 75 ans | 7,9 (4,9–31) |
| Changements dans les habitudes intestinales ou diarrhée | 7,5 (0,94–14) |
| Saignement rectal et sexe masculin | 7,5 (2,4–17) |
| Saignement rectal et âge > 50 or > 55 ans | 5,9 (4–11) |
| Saignement rectal (indéfini) | 5,3 (2,2–16) |
| Saignement rectal et douleur abdominale | 5,1 (1,7–23) |
| Premier épisode de saignement rectal | 5,0 (2,2–14) |
CCR—cancer colorectal, ND—non disponible, VPP—valeur prédictive positive.
Des études individuelles ont signalée des VPP > 15 %.
Quelle est l’exactitude diagnostique des investigations communément envisagées pour les patients qui présentent des signes et symptômes de CCR?
En raison de la rareté des études qui examinent la précision diagnostique des investigations et des manœuvres d’examen physique recommandées pour les patients qui présentent des signes et symptômes de CCR, le groupe de travail a fondé ses recommandations quant à de telles investigations et manœuvres sur un consensus et ce, en fonction de leur facilité d’exécution en soins primaires et de la fourniture potentielle de renseignements utiles menant à une demande de consultation accélérée. Les recommandations concernant une investigation détaillée d’une anémie inexpliquée dépassaient la portée des présentes lignes directrices; au besoin, les médecins de famille et les autres professionnels des soins primaires peuvent consulter les lignes directrices actuellement publiées à ce sujet9,10. Compte tenu des données scientifiques convaincantes établissant une association entre l’anémie ferriprive et le CCR, il faudrait prescrire une analyse de la ferritine en présence d’anémie. L’imagerie de masses abdominales palpables pourrait aider à déterminer si ces masses sont à l’intérieur ou à l’extérieur du côlon et, par conséquent, orienter les investigations et les demandes de consultations spécialisées appropriées. On ne recommande pas la proctoscopie comme standard de soin en raison du manque de données probantes en sa faveur, de son manque d’accessibilité en général et de son faible taux d’utilisation en soins primaires. Toutefois, on en est venu à un consensus qu’elle peut être utilisée à la discrétion du clinicien. On a inclus l’examen rectal digital parce que c’est une manœuvre simple, qu’il peut facilement être effectué en soins primaires et, si une masse rectale suspecte est découverte, cette constatation peut fournir des renseignements utiles menant à une demande de consultation accélérée. Deux études corroborent cette recommandation; elles font valoir que la VPP d’un examen rectal digital en présence d’autres symptômes est supérieure à 5 %11,12. Étant donné l’existence de très peu d’études examinant l’exactitude diagnostique du dosage de l’antigène carcino-embryonnaire, du taux de sédimentation des érythrocytes et d’autres analyses sanguines pour confirmer un CCR chez des patients symptomatiques, ces tests ne sont pas recommandés et ne devraient pas être prescrits.
Quels sont les facteurs de risque connus qui accroissent la probabilité d’un CCR chez les patients qui en présentent les signes et symptômes?
Des données probantes bien reconnues démontrent que les patients qui ont des antécédents personnels de polypes colorectaux ou de maladie intestinale inflammatoire sont à risque accru de CCR13. Des méta-analyses par Jellema et ses collaborateurs et par Olde Bekkink et ses collègues ont constaté une grande spécificité mais une faible sensibilité à l’existence d’antécédents familiaux de CCR à des fins de dépistage chez des patients symptomatiques14,15. Jellema et ses collaborateurs ont signalé que des antécédents familiaux de CCR avaient une VPP combinée de 6 % chez des patients symptomatiques14. Dans certaines études, on désignait par antécédents familiaux le fait qu’un parent au premier degré avait eu un CCR, tandis que dans d’autres, aucune définition n’était donnée.
Recommandations quant à l’aiguillage
Pour assurer que les patients sont classés de manière appropriée en fonction du risque, il faut faire une anamnèse complète, un examen physique et les investigations indiquées à l’Encadré 119,10. Lorsque les manifestations cliniques chez le patient justifient une demande de consultation, le médecin de famille ou le professionnel des soins primaires devrait demander une consultation dans les 24 heures suivant la visite. Le patient devrait être aiguillé vers un PED du CCR, le cas échéant, ou vers un spécialiste qualifié en endoscopie (Encadré 2).
Encadré 1. Recommandations pour la visite clinique.
Il faut faire une anamnèse et un examen physique ciblés si les patients présentent 1 ou plusieurs des signes ou symptômes suivants:
L’anamnèse ciblée devrait recueillir les renseignements suivants:
Pour compléter l’anamnèse, l’examen physique et les investigations doivent inclure ce qui suit:
|
CCR—cancer colorectal, HC—hémogramme complet, MII—maladie intestinale inflammatoire, VCM—volume corpusculaire moyen.
Encadré 2. Recommandations quant à une demande de consultation: Le médecin devrait envoyer dans les 24 heures une demande de consultation auprès d’un spécialiste compétent en endoscopie ou d’un programme d’évaluation diagnostique, là où il y en a.
|
Consultation urgente S’attendre à une consultation dans les 2 semaines et une investigation diagnostique définitive dans les 4 semaines de la demande de consultation si le patient répond à au moins 1 des critères suivants:
Consultation semi-urgente S’attendre à une consultation dans les 4 semaines et une investigation diagnostique définitive dans les 8 semaines de la demande de consultation si le patient répond à au moins 1 des critères suivants:
Le médecin qui présente une demande de consultation doit fournir des renseignements à propos de tout ce qui peut accroître la probabilité d’un CCR:
Patients ne répondant pas aux critères justifiant une demande de consultation Si les signes et symptômes inexpliqués du patient ne répondent pas aux critères justifiant une demande de consultation mais qu’il persiste, selon le jugement clinique, un faible degré de suspicion d’un CCR, les démarches suivantes sont appropriées:
Temps d’attente excessifs Dans les situations où les délais d’attente pour l’exécution d’une colonoscopie sont jugés excessifs, le médecin traitant peut prescrire ce qui suit (si accessible localement):
Si possible, il vaut mieux le faire en coordination avec le spécialiste. Des résultats normaux ou négatifs ne devraient pas justifier l’annulation de la consultation. Des résultats positifs pourraient faciliter une investigation du patient en temps plus opportun. |
CCR—cancer colorectal, CT—tomodensitométrie par ordinateur, LBDC—lavement baryté en double contraste, MII—maladie intestinale inflammatoire, RSOS—recherche de sang occulte dans les selles.
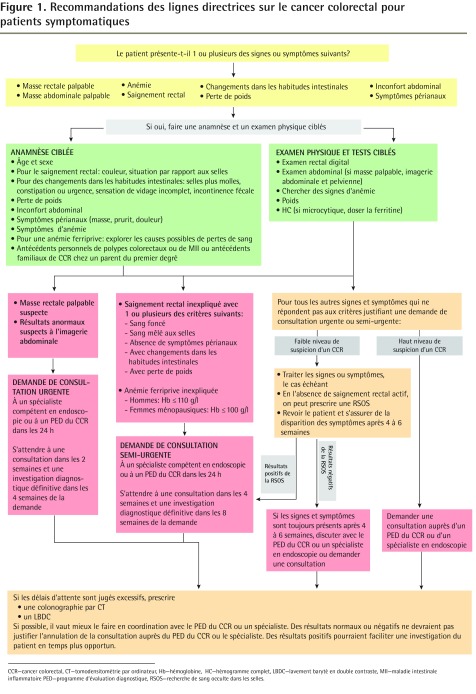
La Figure 1 présente les recommandations quant au triage des patients et au moment opportun des demandes de consultation pour des signes et symptômes faisant soupçonner un CCR.
Figure 1.
Recommandations des lignes directrices sur le cancer colorectal pour patients symptomatiques
CCR—cancer colorectal, CT—tomodensitométrie par ordinateur, Hb—hémoglobine, HC—hémogramme complet, LBDC—lavement baryté en double contraste, MII—maladie intestinale inflammatoire PED—programme d’évaluation diagnostique, RSOS—recherche de sang occulte dans les selles.
Consultations urgentes: Dans notre revue systématique, 3 études estimaient que des masses rectales et abdominales étaient des facteurs de prédiction statistiquement significatifs d’un CCR16–18. Dans 1 étude, la VPP de masses rectales ou abdominales combinées était de 16,7 %16. Deux études ont fait valoir une VPP de 80 %17 et de 22,6 %18 pour les masses rectales et de 41 %17 et de 16,3 %18 pour les masses abdominales. En se fondant sur ces VPP relativement élevées, ainsi que sur l’expérience clinique du groupe de travail, on a jugé que ces signes exigent une consultation urgent. Les temps d’attente visés pour une demande de consultation urgente sont de 2 semaines pour avoir la consultation et une investigation diagnostique définitive dans un délai de 4 semaines.
Consultations semi-urgentes: Pour les autres caractéristiques cliniques indiquant un risque accru, on recommande une demande de consultation semi-urgente. Parmi ces manifestations, on peut mentionner l’anémie ferriprive et des saignements rectaux, en particulier en combinaison avec d’autres caractéristiques cliniques. Les valeurs seuils de l’hémoglobine (≤ 110 g/l pour les hommes ou ≤ 100 g/l pour les femmes sans menstruation et des taux de fer sous la normale) sont tirées de lignes directrices sur les demandes de consultation dans les 2 semaines, produites par le National Institute for Health and Care Excellence en 2005 et endossées par le New Zealand Guidelines Group en 200919,20. Par consensus, le groupe de travail a décidé que pour les patients ayant des antécédents médicaux de maladie intestinale inflammatoire ou des antécédents familiaux de CCR qui participent à un programme de surveillance et qui présentent des signes ou symptômes intérimaires de CCR, une nouvelle demande de consultation rapide peut être envisagée à la discrétion du médecin de famille ou du professionnel des soins primaires pour les patients qui n’ont pas eu d’endoscopie récente.
On fixe les temps d’attente visés pour une demande de consultation semi-urgent à 4 semaines pour la consultation et à 8 semaines pour une investigation diagnostique définitive.
Pour les signes et symptômes dont la VPP est plus faible et qui ne justifient pas de demande de consultation, on recommande de se servir de son jugement clinique pour décider s’il existe un degré élevé ou faible de suspicion d’un CCR. Une demande de consultation semi-urgente est recommandée si le degré de suspicion clinique est élevé.
Faible degré de suspicion d’un CCR
Si le degré de suspicion d’un CCR est faible, il faut traiter les signes et les symptômes, s’il y a lieu, et s’assurer qu’ils sont résolus après 4 à 6 semaines. Cet échéancier a été choisi en fonction de l’expérience clinique du groupe de travail et il est conforme aux lignes directrices du National Institute for Health and Care Excellence et du New Zealand Guidelines Group qui recommandent une demande de consultation seulement si les symptômes persistent pendant au moins 6 semaines19,20. Si les signes et les symptômes ne sont pas disparus en 4 à 6 semaines, il faudrait alors demander une consultation semi-urgente. En l’absence d’un dépistage récent du CCR et s’il n’y a pas de saignement rectal actif, le cli nicien peut envisager à sa discrétion une RSOS sur 3 spécimens. Des résultats positifs concomitants pourraient fournir des renseignements additionnels justifiant une investigation accélérée.
La recommandation d’utiliser la RSOS chez les patients symptomatiques, lorsque le degré de suspicion est faible, se fonde sur une méta-analyse par Jellema et ses collègues qui ont constaté que les tests de RSOS au gaïac et immunologiques avaient un bon rendement diagnostique chez les patients symptomatiques14. Toutefois, la plupart de ces études ont été réalisées dans des milieux de soins secondaires et n’indiquaient pas de signes et symptômes spécifiques pour lesquels on avait utilisé la RSOS.
Recommandations portant sur les retards systémiques dans les consultations
Si le délai pour obtenir une consultation est jugé excessif, le médecin qui a fait la demande peut envisager procéder à des investigations intérimaires. Les sensibilités ou les spécificités étaient plus élevées que 83 % lorsque qu’une colonographie par tomodensitométrie assistée par ordinateur ou un lavement baryté en double contraste chez les patients symptomatiques étaient comparés à une colonoscopie seulement21–33. La sigmoïdoscopie flexible s’est aussi révélée avoir une bonne sensibilité pour détecter un CCR, en particulier en combinaison avec un lavement baryté en double contraste22,25,31,34. Il y avait peu d’études qui examinaient la précision diagnostique d’une tomodensitométrie abdominale par ordinateur ou d’une échographie abdominale ou pelvienne chez des patients symptomatiques; toutefois, de telles études d’imagerie pourraient être utiles pour différencier des masses abdominales ou pelviennes.
Quels sont les facteurs associés aux patients et aux professionnels qui retardent les demandes de consultation? Les délais dans le moment de la consultation affectentils les résultats chez le patient?
Des données probantes tirées d’études prospectives et rétrospectives font valoir que divers facteurs retardent le diagnostic d’un CCR19,20,35–38. Parmi les facteurs associés au patient qui avaient le plus d’influence sur les délais figuraient le fait que les patients ne reconnaissaient pas que leurs symptômes pouvaient être indicateurs de la présence d’un CCR ou la peur des séquelles possibles des tests ou des interventions qui pourraient se produire. Il y avait moins de retard lorsque les patients avaient des symptômes plus graves, d’autres maladies concomitantes ou plus de soutien social. Au nombre des facteurs associés au médecin, on peut mentionner le manque de reconnaissance des symptômes d’un CCR chez les patients, l’absence d’investigation d’une anémie ferriprive ou l’omission de faire un examen rectal. De plus, les demandes de consultation à un spécialiste sans intérêt gastrointestinal ou des résultats de tests insuffisants fournis au spécialiste peuvent entraîner des retards. Quoique la situation socioéconomique n’ait pas de fortes répercussions sur les délais d’attente, une scolarité plus faible, le fait de vivre en milieu rural, d’être célibataire ou divorcé, d’être une femme, d’être de race noire ou sud-asiatique entraînaient des délais plus longs. De plus, bien que les études fas-sent valoir que des délais plus longs dans la demande de consultation n’ont pas d’effet sur la mortalité des patients, les effets sur la morbidité psychologique chez les patients et leur famille devraient justifier une évaluation plus urgente39–45. On trouve à l’Encadré 3 des recommandations pour éviter de tels retards9,10.
Encadré 3. Recommandations pour réduire les retards dans le diagnostic.
Les éléments suivants pourraient contribuer à réduire les retards dans le diagnostic:
|
CCR—cancer colorectal, PSP—professionnel des soins primaires.
Conclusion
On a utilisé une approche systématique pour cerner les caractéristiques cliniques laissant présager un CCR qui devraient inciter les médecins de famille et les autres professionnels des soins primaires à demander une consultation accélérée et une colonoscopie pour leurs patients. Il faudrait demander une consultation de toute urgence pour les patients ayant des masses abdominales ou rectales. Chez les patients ayant une anémie ferriprive ou des saignements rectaux, en particulier en combinaison avec d’autres signes et symptômes, on devrait demander une consultation semi-urgente avec un spécialiste compétent en endoscopie. Les autres symptômes présents devraient être pris en charge et on devrait assurer qu’ils sont disparus dans les 6 semaines qui suivent. Le recours à une RSOS peut être envisagé chez les patients dont les symptômes ne justifient pas une consultation urgente ou semi-urgente et pour ceux dont on ne soupçonne pas fortement la présence d’un CCR. Pour les patients symptomatiques qui doivent attendre longtemps pour obtenir une consultation, on peut envisager des investigations intérimaires. On devrait tenter d’éviter les délais dans le diagnostic, qu’ils soient attribuables au patient, au professionnel ou aux politiques.
Ces lignes directrices pourraient contribuer à réduire les délais dans le diagnostic d’un CCR en aidant les médecins de famille et les autres professionnels des soins primaires à reconnaître les caractéristiques cliniques qui devraient susciter des soupçons au sujet de la présence d’un CCR et les inciter à demander une consultation plus appropriée et en temps plus opportun. Elles pourraient aussi orienter l’élaboration de programmes d’évaluation diagnostique pour les patients qui ont des caractéristiques éveillant des soupçons quant à la présence d’un CCR et aider les décideurs à assurer que les ressources sont en place de manière à ce qu’on puisse atteindre les objectifs des temps d’attente.
POINTS DE REPÈRE DU RÉDACTEUR
Au nombre des caractéristiques cliniques associées à un risque accru de cancer colorectal figurent une masse rectale ou abdominale palpable, un saignement rectal, en particulier en combinaison avec d’autres signes et symptômes, une anémie ferriprive et des changements dans les habitudes intestinales.
Il faut demander de toute urgence une consultation pour les patients qui ont une masse abdominale ou rectale auprès d’un programme d’évaluation diagnostique, s’il est accessible, ou d’un spécialiste compétent en endoscopie. Pour les patients souffrant d’anémie ferriprive ou de saignements rectaux, en particulier en combinaison avec d’autres signes ou symptômes, une demande de consultation semi-urgente devrait être faite. Il faut prendre en charge les autres symptômes présents et assurer qu’ils sont résolus dans un délai de 6 semaines.
Footnotes
Cet article donne droit à des crédits Mainpro-M1. Pour obtenir des crédits, allez à www.cfp.ca et cliquez sur le lien vers Mainpro.
Cet article a fait l’objet d’une révision par des pairs.
The English version of this article is available at www.cfp.ca on the table of contents for the August 2014 issue on page 717.
Collaborateurs
Tous les auteurs ont contribué à la recherche documentaire, à l’interprétation des ouvrages et à la préparation du rapport aux fins de présentation.
Intérêts concurrents
Aucun déclaré
Références
- 1.Société canadienne du cancer [site web] Cancer statistics at a glance. Toronto, ON: Société canadienne du cancer; 2014. Accessible à: www.cancer.ca/en/cancer-information/cancer-101/cancer-statistics-at-a-glance/?region=on. Réf. du 2 juillet 2014. [Google Scholar]
- 2.Action Cancer Ontario [site web] Colorectal cancer. Toronto, ON: Action Cancer Ontario; 2014. Accessible à: www.cancercare.on.ca/common/pages/UserFile.aspx?fileId=124403. Réf. du 10 juillet 2014. [Google Scholar]
- 3.Baranek PM, editor. The patient experience. From symptoms to diagnosis. Summary of the Cancer Quality Council of Ontario 2007 signature event. “Is it cancer? Improving the patient journey to diagnosis.”. Toronto, ON: Action Cancer Ontario; 2007. pp. 12–3. Accessible à: www.cancercare.on.ca/common/pages/UserFile.aspx?fileId=64408. Réf. du 2 juillet 2014. [Google Scholar]
- 4.Browman GP, Levine MN, Mohide EA, Hayward RS, Pritchard KI, Gafni A, et al. The practice guidelines development cycle: a conceptual tool for practice guidelines development and implementation. J Clin Oncol. 1995;13(2):502–12. doi: 10.1200/JCO.1995.13.2.502. [DOI] [PubMed] [Google Scholar]
- 5.Del Giudice EM, Vella ET, Hey A, Simunovic M, Harris W, Levitt C. Systematic review of clinical features of suspected colorectal cancer in primary care. Can Fam Physician. 2014;60:e405–15. [PMC free article] [PubMed] [Google Scholar]
- 6.Rabeneck L, Zwaal C, Goodman JH, Mai V, Zamkanei M. Cancer Care Ontario guaiac fecal occult blood test (FOBT) laboratory standards: evidentiary base and recommendations. Clin Biochem. 2008;41(16–17):1289–305. doi: 10.1016/j.clinbiochem.2008.08.069. Cyberpub. du 29 août 2008. [DOI] [PubMed] [Google Scholar]
- 7.Action Cancer Ontario. ColonCancerCheck. 2010 Program report. Toronto, ON: Action Cancer Ontario; 2012. Accessible à: www.cancercare.on.ca/common/pages/UserFile.aspx?fileId=156747. Réf. du 2 juillet 2014. [Google Scholar]
- 8.Paterson WG, Depew WT, Paré P, Petrunia D, Switzer C, Veldhuyzen van Zanten SJ, et al. Canadian consensus on medically acceptable wait times for digestive health care. Can J Gastroenterol. 2006;;20(6):411–23. doi: 10.1155/2006/343686. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Anemia Review Panel. Anemia guidelines for family medicine. 2 éd. Toronto, ON: Medication Use Management Services Guideline Clearinghouse; 2008. [Google Scholar]
- 10.Goddard AF, James MW, McIntyre AS, Scott BB. Guidelines for the management of iron deficiency anaemia. Londres, RU: British Society of Gastroenterology; 2005. Accessible à: www.bsg.org.uk/images/stories/docs/clinical/guidelines/sbn/iron_def.pdf. Réf. du 3 juillet 2014. [DOI] [PubMed] [Google Scholar]
- 11.Fijten GH, Starmans R, Muris JW, Schouten HJ, Blijham GH, Knottnerus JA. Predictive value of signs and symptoms for colorectal cancer in patients with rectal bleeding in general practice. Fam Pract. 1995;12(3):279–86. doi: 10.1093/fampra/12.3.279. [DOI] [PubMed] [Google Scholar]
- 12.Wauters H, Van Casteren V, Buntinx F. Rectal bleeding and colorectal cancer in general practice: diagnostic study. BMJ. 2000;321(7267):998–9. doi: 10.1136/bmj.321.7267.998. Erratum dans: BMJ 2001;322(7284):488. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Leddin D, Hunt R, Champion M, Cockeram A, Flook N, Gould M, et al. Canadian Association of Gastroenterology and the Canadian Digestive Health Foundation: guidelines on colon cancer screening. Can J Gastroenterol. 2004;18(2):93–9. doi: 10.1155/2004/983459. [DOI] [PubMed] [Google Scholar]
- 14.Jellema P, van der Windt DA, Bruinvels DJ, Mallen CD, van Weyenberg SJ, Mulder CJ, et al. Value of symptoms and additional diagnostic tests for colorectal cancer in primary care: systematic review and meta-analysis. BMJ. 2010;340:c1269. doi: 10.1136/bmj.c1269. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Olde Bekkink M, McCowan C, Falk GA, Teljeur C, Van de Laar FA, Fahey T. Diagnostic accuracy systematic review of rectal bleeding in combination with other symptoms, signs and tests in relation to colorectal cancer. Br J Cancer. 2010;102(1):48–58. doi: 10.1038/sj.bjc.6605426. Cyberpub. du 24 novembre 2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Barwick TW, Scott SB, Ambrose NS. The two week referral for colorectal cancer: a retrospective analysis. Colorectal Dis. 2004;6(2):85–91. doi: 10.1111/j.1463-1318.2004.00589.x. [DOI] [PubMed] [Google Scholar]
- 17.Chohan DP, Goodwin K, Wilkinson S, Miller R, Hall NR. How has the ‘two-week wait’ rule affected the presentation of colorectal cancer? Colorectal Dis. 2005;7(5):450–3. doi: 10.1111/j.1463-1318.2005.00821.x. [DOI] [PubMed] [Google Scholar]
- 18.Flashman K, O’Leary DP, Senapati A, Thompson MR. The department of health’s “two week standard” for bowel cancer: is it working? Gut. 2004;53(3):387–91. doi: 10.1136/gut.2003.020503. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.National Institute for Health and Care Excellence [site web]. Referral guidelines for suspected cancer. NICE guidelines CG27. Londres, RU: National Institute for Health and Care Excellencebook; 2005. Accessible à: www.nice.org.uk/CG027. Réf. du 2 juillet 2014. [Google Scholar]
- 20.New Zealand Guidelines Group . Suspected cancer in primary care: guidelines for investigation, referral and reducing ethnic disparities. Wellington, NZ: New Zealand Guidelines Group; 2009. Accessible à: www.midlandcancernetwork.org.nz/file/fileid/17510. Réf. du 27 juin 2014. [Google Scholar]
- 21.Anderson N, Cook HB, Coates R. Colonoscopically detected colorectal cancer missed on barium enema. Gastrointest Radiol. 1991;16(2):123–7. doi: 10.1007/BF01887325. [DOI] [PubMed] [Google Scholar]
- 22.Brewster NT, Grieve DC, Saunders JH. Double-contrast barium enema and flexible sigmoidoscopy for routine colonic investigation. Br J Surg. 1994;81(3):445–7. doi: 10.1002/bjs.1800810341. [DOI] [PubMed] [Google Scholar]
- 23.Duff SE, Murray D, Rate AJ, Richards DM, Kumar NA. Computed tomographic colonography (CTC) performance: one-year clinical follow-up. Clin Radiol. 2006;61(11):932–6. doi: 10.1016/j.crad.2006.06.004. [DOI] [PubMed] [Google Scholar]
- 24.Helfand M, Marton KI, Zimmer-Gembeck MJ, Sox HC., Jr History of visible rectal bleeding in a primary care population. Initial assessment and 10-year follow-up. JAMA. 1997;277(1):44–8. [PubMed] [Google Scholar]
- 25.Irvine EJ, O’Connor J, Frost RA, Shorvon P, Somers S, Stevenson GW, et al. Prospective comparison of double contrast barium enema plus flexible sigmoidoscopy v colonoscopy in rectal bleeding: barium enema v colonoscopy in rectal bleeding. Gut. 1988;29(9):1188–93. doi: 10.1136/gut.29.9.1188. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Ott DJ, Scharling ES, Chen YM, Wu WC, Gelfand DW. Barium enema examination: sensitivity in detecting colonic polyps and carcinomas. South Med J. 1989;82(2):197–200. [PubMed] [Google Scholar]
- 27.Roberts-Thomson IC, Tucker GR, Hewett PJ, Cheung P, Sebben RA, Khoo EE, et al. Single-center study comparing computed tomography colonography with conventional colonoscopy. World J Gastroenterol. 2008;14(3):469–73. doi: 10.3748/wjg.14.469. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Robinson C, Halligan S, Iinuma G, Topping W, Punwani S, Honeyfield L, et al. CT colonography: computer-assisted detection of colorectal cancer. Br J Radiol. 2011;84(1001):435–40. doi: 10.1259/bjr/17848340. Cyberpub. du 16 novembre 2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Sofic A, Beslic S, Kocijancic I, Sehovic N. CT colonography in detection of colorectal carcinoma. Radiol Oncol. 2010;44(1):19–23. doi: 10.2478/v10019-010-0012-1. Cyberpub. du 18 mars 2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Taylor SA, Halligan S, Saunders BP, Morley S, Riesewyk C, Atkin W, et al. Use of multidetector-row CT colonography for detection of colorectal neoplasia in patients referred via the department of health “2-week-wait” initiative. Clin Radiol. 2003;58(11):855–61. doi: 10.1016/s0009-9260(03)00273-3. [DOI] [PubMed] [Google Scholar]
- 31.Thompson MR, Flashman KG, Wooldrage K, Rogers PA, Senapati A, O’Leary DP, et al. Flexible sigmoidoscopy and whole colonic imaging in the diagnosis of cancer in patients with colorectal symptoms. Br J Surg. 2008;95(9):1140–6. doi: 10.1002/bjs.6234. [DOI] [PubMed] [Google Scholar]
- 32.Tolan DJ, Armstrong EM, Chapman AH. Replacing barium enema with CT colonography in patients older than 70 years: the importance of detecting extracolonic abnormalities. AJR Am J Roentgenol. 2007;189(5):1104–11. doi: 10.2214/AJR.07.2026. [DOI] [PubMed] [Google Scholar]
- 33.White TJ, Avery GR, Kennan N, Syed AM, Hartley JE, Monson JR. Virtual colonoscopy vs conventional colonoscopy in patients at high risk of colorectal cancer—a prospective trial of 150 patients. Colorectal Dis. 2009;11(2):138–45. doi: 10.1111/j.1463-1318.2008.01554.x. Cyberpub. du 3 mai 2008. [DOI] [PubMed] [Google Scholar]
- 34.Rex DK, Weddle RA, Lehman GA, Pound DC, O’Connor KW, Hawes RH, et al. Flexible sigmoidoscopy plus air contrast barium enema versus colonoscopy for suspected lower gastrointestinal bleeding. Gastroenterology. 1990;98(4):855–61. doi: 10.1016/0016-5085(90)90007-n. [DOI] [PubMed] [Google Scholar]
- 35.Korsgaard M, Pedersen L, Laurberg S. Delay of diagnosis and treatment of colorectal cancer—a population-based Danish study. Cancer Detect Prev. 2008;32(1):45–51. doi: 10.1016/j.cdp.2008.01.001. Cyberpub. du 10 avril 2008. [DOI] [PubMed] [Google Scholar]
- 36.Mitchell E, Macdonald S, Campbell NC, Weller D, Macleod U. Influences on pre-hospital delay in the diagnosis of colorectal cancer: a systematic review. Br J Cancer. 2008;98(1):60–70. doi: 10.1038/sj.bjc.6604096. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Neal RD, Allgar VL. Sociodemographic factors and delays in the diagnosis of six cancers: analysis of data from the “National Survey of NHS Patients: Cancer”. Br J Cancer. 2005;92(11):1971–5. doi: 10.1038/sj.bjc.6602623. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Singh H, Daci K, Petersen LA, Collins C, Petersen NJ, Shethia A, et al. Missed opportunities to initiate endoscopic evaluation for colorectal cancer diagnosis. Am J Gastroenterol. 2009;104(10):2543–54. doi: 10.1038/ajg.2009.324. Cyberpub. du 23 juin 2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Ramos M, Esteva M, Cabeza E, Campillo C, Llobera J, Aguiló A. Relationship of diagnostic and therapeutic delay with survival in colorectal cancer: a review. Eur J Cancer. 2007;43(17):2467–78. doi: 10.1016/j.ejca.2007.08.023. Cyberpub. du 10 octobre 2007. [DOI] [PubMed] [Google Scholar]
- 40.Ramos M, Esteva M, Cabeza E, Llobera J, Ruiz A. Lack of association between diagnostic and therapeutic delay and stage of colorectal cancer. Eur J Cancer. 2008;44(4):510–21. doi: 10.1016/j.ejca.2008.01.011. Cyberpub. du 12 février 2008. [DOI] [PubMed] [Google Scholar]
- 41.Wattacheril J, Kramer JR, Richardson P, Havemann BD, Green LK, Le A, et al. Lagtimes in diagnosis and treatment of colorectal cancer: determinants and association with cancer stage and survival. Aliment Pharmacol Ther. 2008;28(9):1166–74. doi: 10.1111/j.1365-2036.2008.03826.x. Cyberpub. du 8 août 2008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Terhaar sive Droste JS, Oort FA, van der Hulst RW, Coupé VM, Craanen ME, Meijer GA, et al. Does delay in diagnosing colorectal cancer in symptomatic patients affect tumor stage and survival? A population-based observational study. BMC Cancer. 2010;10:332. doi: 10.1186/1471-2407-10-332. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Rupassara KS, Ponnusamy S, Withanage N, Milewski PJ. A paradox explained? Patients with delayed diagnosis of symptomatic colorectal cancer have good prognosis. Colorectal Dis. 2006;8(5):423–9. doi: 10.1111/j.1463-1318.2006.00958.x. [DOI] [PubMed] [Google Scholar]
- 44.Comber H, Cronin DP, Deady S, Lorcain PO, Riordan P. Delays in treatment in the cancer services: impact on cancer stage and survival. Ir Med J. 2005;98(8):238–9. [PubMed] [Google Scholar]
- 45.Tørring ML, Frydenberg M, Hansen RP, Olesen F, Hamilton W, Vedsted P. Time to diagnosis and mortality in colorectal cancer: a cohort study in primary care. Br J Cancer. 2011;104(6):934–40. doi: 10.1038/bjc.2011.60. Cyberpub. du 1e mars 2011. [DOI] [PMC free article] [PubMed] [Google Scholar]