Abstract
Das Werner-Syndrom ist eine segmental progeroide Erkrankung mit Beginn in der Adoleszenz oder im frühen Erwachsenenalter. Typische Symptome, die zum vorgealterten Phänotyp beitragen, sind ein post-pubertär auftretender Kleinwuchs, Katarakte, eine vorzeitige Ergrauung/Ausdünnung des Haupthaars, sklerodermieähnliche Hautveränderungen und eine regionale Atrophie des subkutanen Fettgewebes. Darüber hinaus kommt es früh und gehäuft zu „Alterserkrankungen“ wie z. B. einem Diabetes mellitus Typ 2, einer Osteoporose, einer Atherosklerose sowie verschiedenen malignen Tumoren. Das Werner-Syndrom wird autosomal- rezessiv vererbt und ist durch Mutationen im Werner-Gen (WRN) bedingt. Es wurden bis heute mehr als 70 über das gesamte Gen verteilte Mutationen identifiziert, die typischerweise zu einem Verlust der Genfunktion führen. WRN kodiert für eine RecQ-Typ- Helikase, die u. a. an der DNA-Reparatur und der Aufrechterhaltung der DNA-Integrität beteiligt ist, was sich in einer erhöhten genetischen Instabilität in Patientenzellen wider-spiegelt. Trotz der relativen Seltenheit ist die Analyse des Werner-Syndroms von allgemeiner Bedeutung, um die Rolle der DNA-Stabilität und Integrität für das Altern sowie die Entwicklung altersassoziierter Erkrankungen besser zu verstehen.
Keywords: Werner-Syndrom, Progerie, RecQ-Helikase, DNA-Reparatur, Genomische Instabilität
Abstract
Werner syndrome is a segmental progeroid disorder with onset in adolescence or early adulthood. Typical symptoms contributing to patients’ prematurely aged appearance include postpubertal development of short stature, cataracts, premature greying/thinning of scalp hair, scleroderma-like skin changes and regional atrophy of subcutaneous fat tissue. In addition, an increased rate and early onset of typical age-related diseases such as type 2 diabetes mellitus, osteoporosis, atherosclerosis, and various malignancies is observed. Werner syndrome is autosomal recessively inherited and caused by mutations in the Werner gene (WRN). To date, more than 70 WRN mutations have been identified. These are spread over the entire gene and typically represent loss of function mutations. WRN encodes a RecQ type helicase involved in DNA repair and the maintenance of DNA integrity, which is reflected by an increased genetic instability in patient cells. Despite the relative rarity of Werner syndrome, its analysis provides important general insights into the roles of DNA stability and integrity for the ageing process and the development of age-associated diseases.
Keywords: Werner syndrome, Progeria, RecQ helicase, DNA repair, Genomic instability
Obwohl das Werner-Syndrom mit einer geschätzten Prävalenz im Bereich von 1:200.000 zu den sehr seltenen Erkrankungen gehört, können dieses und andere segmentale Progeriesyndrome aufgrund ihrer typischen Symptomkonstellationen als monogene Paradigmen für die Erforschung von Altersvorgängen und altersassoziierten Erkrankungen betrachtet werden. Vor dem Hintergrund der aktuellen demographischen Veränderungen ist somit ersichtlich, dass das verbesserte Verständnis der genetischen und molekularen Grundlagen des Werner-Syndroms und verwandter Progeriesyndrome u. U. weitgehende medizinische Implikationen mit sich bringen kann.
Betrachtet man primär die Anzahl von unterschiedlichen Geweben, die typischerweise von einer progeroiden Erkrankung betroffen sind, können zwei verschiedene Krankheitsgruppen unterschieden werden [13].
Zum einen gibt es die unimodalen Progeriesyndrome, die lediglich ein Organsystem betreffen und zu denen z. B. monogen vererbte und früh manifeste Formen der Alzheimer- und Parkinson-Erkrankung oder auch monogene Subtypen des Darmkrebses gehören.
Zum anderen gibt es die segmentalen Progerien, die charakteristische vorzeitige Krankheitssymptome in mehr als einem Gewebe aufweisen und somit eher einen „physiologischen“ Alterungsprozess des Gesamtorganismus vorwegzunehmen scheinen.
Es besteht eine Vielzahl dieser segmentalen Progerieformen mit Beteiligung der unterschiedlichsten Organsysteme, wobei oftmals 2 Syndrome als prototypische Formen der segmentalen Progerie hervorgehoben werden [2, 11]. Hierbei handelt es sich um das Hutchinson-Gilford-Syndrom (OMIM #176670) mit Erkrankungsbeginn in der frühen Kindheit und das hier beschriebene Werner-Syndrom (OMIM #277700), das auch als „adulte“ Form der Progerie bezeichnet wird und einen typischen Krankheitsbeginn in der Adoleszenz oder im frühen Erwachsenenalter hat.
Klinische Symptomatik und Diagnosekriterien
Das Werner-Syndrom (WS) wurde erstmals 1904 vom deutschen Arzt C. W. Otto Werner (1879–1936) im Rahmen seiner Medizinischen Dissertation (Titel: „Über Katarakt in Verbindung mit Sklerodermie“) an der Universität Kiel als eigenständige Krankheitsentität beschrieben. Das WS wird autosomal-rezessiv vererbt und es gibt zzt. keine überzeugenden Hinweise darauf, dass heterozygote Anlageträger ein gegenüber der Allgemeinbevölkerung eindeutig erhöhtes Risiko für einzelne Symptome des WS oder eine vorzeitige Alterung besitzen. Die Prävalenz in den meisten Populationen wird auf etwa 1:200.000 geschätzt [14], wobei sie in einigen Regionen wie z. B. Japan (1:20.000– 1:40.000) und Sardinien (1:50.000) wahrscheinlich aufgrund von lokalen Founder-Effekten deutlich höher ist [15, 23]. Bereits vor der Aufklärung der genetischen Ursache war bekannt, dass somatische Zellen von Patienten mit WS eine reduzierte replikative Kapazität, eine erhöhte Sensibilität gegenüber verschiedenen genotoxischen Substanzen und insbesondere eine erhöhte chromosomale Instabilität aufweisen [13, 22], was bereits auf ein zugrunde liegendes funktionelles Defizit der DNA-Reparatur hinwies.
Der charakteristische klinische Phänotyp des WS sowie der Krankheitsverlauf wurden sowohl vor als auch nach der Genidentifizierung im Detail beschrieben (z. B. [4, 17, 18, 24]), wobei die durchschnittliche Lebenserwartung aufgrund der allgemeinen Verbesserung der medizinischen Versorgung, aber auch spezifischer Vorsorgeempfehlungen beim WS, deutlich angestiegen ist. So wurde z. B. in Japan in einem Beobachtungszeitraum von 1966–2004 eine Steigerung der durchschnittlichen Lebenserwartung von etwa 38 auf 53 Jahre beschrieben [6].
Patienten mit klassischem WS zeigen i. d. R. bis zur Pubertät keine Symptome, und erst das Ausbleiben des Wachstumsschubes in der Pubertät mit nachfolgender Entwicklung eines Kleinwuchses gibt – meist retrospektiv – erste Hinweise auf das Vorliegen einer systemischen Erkrankung. Zusätzliche Symptome treten dann in aller Regel nach dem 20. Lebensjahr auf, wobei hier im Wesentlichen eine vorzeitige Ergrauung bzw. der Verlust des Haupthaars, charakteristische Stimmveränderungen und sklerodermieähnliche Hautveränderungen zu nennen sind (Abb. 2). Nachfolgend treten ab dem 30. Lebensjahr gehäuft bilaterale Katarakte (medianes Erkrankungsalter mit etwa 31 Jahren), ein Diabetes mellitus Typ 2, ein Hypogonadismus, Hautulzerationen, die z. T. therapierefraktär sind, und eine Osteoporose hinzu. Charakteristisch sind besonders das Auftreten von Ulzerationen im Bereich der Fußknöchel sowie die Verkalkung der Achillessehne [24]. Des Weiteren bildet sich nachfolgend auch die typische Fazies („bird-like“) mit gebogener Nase und tiefliegenden Augen aus (Abb. 1).
Abb. 2.
Charakteristische Symptome und Diagnosekriterien des Werner-Syndroms. Gegenübergestellt sind die Kriterien des International Registry of Werner Syndrome (links) und eines japanischen Patientenregisters (rechts), das auf einer aktuellen (2009–2011) epidemiologischen Studie zum Werner-Syndrom in Japan beruht und Daten von etwa 200 neu diagnostizierten Fällen beinhaltet [24]. In beiden Fällen werden „Kardinalsymptome“ von „sonstigen/zusätzlichen Symptomen“ unterschieden
Abb. 1.

Zunehmend progeroides Erscheinungsbild bei einer Patientin mit klinisch und molekulargenetisch gesichertem Werner-Syndrom. Die Patientin ist homozygot für eine Deletion im Bereich der Helikase-Domäne des WRN-Proteins, die zu einem vorzeitigen Stop-Kodon führt (c.2089–2825del; p.M696fsX705). (Mod. nach [8], mit freundl. Genehmigung der Familie der Patientin und der American Association for the Advancement of Science, AAAS)
Zusätzliche Symptome sind ein deutlich erhöhtes Risiko für diverse Formen der Arteriosklerose, wobei insbesondere die Atherosklerose der Koronargefäße mit erhöhtem Infarktrisiko zu nennen ist, welche zusammen mit den malignen Erkrankungen auch die häufigste Todesursache beim WS darstellt. Das Tumorrisiko ist erhöht, wobei dies insbesondere für sonst eher seltene Karzinome und Sarkome gilt [7], obwohl durchaus auch häufige Tumoren auftreten. Die häufigsten Tumoren bei Patienten mit WS in Japan stellen Weichteilsarkome, Osteosarkome, Melanome und Schilddrüsenkarzinome dar. Anhand der genannten Symptome sind mehr oder weniger unabhängige Diagnosekriterien für das WS formuliert worden (Abb. 2), wobei die bilateralen Katarakte, die Auffälligkeiten der Haut und des Haupthaars sowie die charakteristische Fazies übereinstimmend als Kardinalsymptome gewertet werden.
Wenngleich somit beim WS eine charakteristische Häufung von Erkrankungen und Symptomen vorliegt, die normalerweise erst im höheren Alter gehäuft auftreten, handelt es sich bei dieser segmentalen Progerie dennoch nicht um eine einfache Phänokopie des „normalen“ Alterns mit seinen begleitenden Erkrankungen. Auch dies hat dazu geführt, dass das WS als eine „Karikatur“ des Alterns beschrieben worden ist [3]. Wesentliche Unterschiede zum „physiologischen“ Altern sind dabei z. B. das Auftreten sonst eher seltener (oftmals mesenchymaler) Tumorerkrankungen und einer Osteoporose mit besonderer Beteiligung der langen Röhrenknochen (im Gegensatz zur bevorzugten Beteiligung der Wirbelsäule bei der „normalen“ Osteoporose). Dennoch gibt es eine Vielzahl von klinischen Parallelen zwischen dem WS und dem „physiologischen“ Altern, zudem konnte gezeigt werden, dass das Genexpressionsprofil in Zellen von Patienten mit WS und älteren Menschen der Allgemeinbevölkerung sehr ähnlich ist [12]. Da betroffene zelluläre Signalwege wie die DNA-Reparatur oder die Aufrechterhaltung der Telomerstruktur auch für das „physiologische“ Altern und verschiedene altersassoziierte Erkrankungen (insbesondere maligne Erkrankungen) von er heblicher Bedeutung sind, gelten das WS und andere segmentale Progerien somit trotz der phänotypischen Unterschiede als wertvolle Modelle für das Altern per se [2, 11, 13].
Aufgrund der pleiotropen Effekte von WRN-Mutationen stellt die medizinische Versorgung von Patienten mit WS eine anspruchsvolle und multidisziplinäre Aufgabe dar, die sowohl die initiale klinische Evaluation, die Behandlung vorhandener Krankheitsmanifestationen als auch die regelmäßige Vorsorge und die Vermeidung von sekundären Komplikationen beinhaltet [18]. Von Bedeutung sind hierbei u. a. klinische Untersuchungen und ggf. die medikamentöse Behandlung bezüglich Diabetes mellitus und Lipidstoffwechselstörungen, die augenärztliche Betreuung bezüglich einer Katarakterkrankung sowie die intensive dermatologische Betreuung mit dem Ziel, Ulzerationen zu vermeiden und Melanome frühzeitig zu diagnostizieren und therapieren. Aufgrund der großen Bedeutung kardiovaskulärer und maligner Erkrankungen ist darüber hinaus eine besonders engmaschige und intensive internistischkardiologische und onkologische Mitbetreuung indiziert. Letztlich ist neben der ausführlichen humangenetischen Beratung auch eine psychologische Mitbetreuung und aufgrund des Hypogonadismus ggf. eine gezielte endokrinologische/reproduktionsmedizinische Beratung zu empfehlen.
Genetische und molekulare Grundlagen
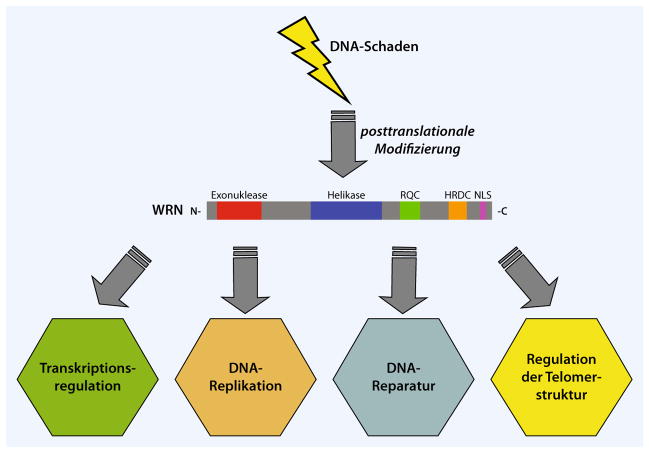
Durch positionelle Klonierung gelang es bereits 1996, das ursächliche Krankheitsgen für das WS zu identifizieren [25]. Das verantwortliche Gen, WRN, ist auf dem kurzen Arm von Chromosom 8 lokalisiert (8p12) und erstreckt sich über einen genomischen Lokus von etwa 140 kb. Es besteht aus 35 Exons, wobei das erste Exon nicht kodierend ist. WRN kodiert für ein evolutionär konserviertes Protein von 1432 Aminosäuren mit einem Molekulargewicht von etwa 162 kDa, das mehrere funktionelle Domänen umfasst (Abb. 3). Es gehört zur Proteinfamilie der RecQ-Helikasen, die beim Menschen aus 5 Mitgliedern besteht [16] und zu denen u. a. auch BLM und RecQL4 zählen, die bei den beiden segmentalen Progerieformen Bloom-Syndrom und Rothmund- Thomson-Syndrom mutiert sind. WRN ist das einzige Mitglied der RecQFamilie mit einer Exonuklease-Domäne und nachgewiesener 3′-5′-Exonuklease- Funktion [16]. Funktionell scheint WRN eine Vielzahl unterschiedlicher Funktionen im Bereich der DNA-Reparatur, -Rekombination, -Replikation, der Transkription und der Regulation der Telomerintegrität zu haben (Abb. 3) und somit zentral an der Aufrechterhaltung der genomischen Stabilität beteiligt zu sein [11, 19, 20].
Abb. 3.
Domänenstruktur des WRN-Proteins und Positionierung von WRN an der Schnittstelle verschiedener DNA-Signalwege. Die bekannten funktionellen Domänen sind farbig markiert; die Exonuklease- Domäne (rot), die Helikase-Domäne (blau), die RecQ-Helikase-konservierte Region (RQC, grün), die Helikase-RNaseD-C-terminal-konservierte Region (HRDC, orange) und das nukleäre Lokalisations-signal (NLS, pink). Das Werner-Protein wird u. a. durch DNA-Schäden posttranslational modifiziert (z. B. phosphoryliert und azetyliert) und ist gemeinsam mit verschiedenen Bindungspartnern und funktionell interagierenden Proteinen (nicht gezeigt) z. B. an der Regulation der Telomerstruktur und der Transkription sowie an der DNA-Replikation sowie verschiedenen Mechanismen der DNA-Reparatur beteiligt
Bis heute wurden mehr als 70 ursächlich verantwortliche Mutationen in WRN identifiziert [5, 9, 18], die sich über das gesamte Gen verteilen. Beim überwiegenden Teil der Mutationen handelt es sich um Stop-Mutationen, Insertionen/Deletionen mit konsekutivem Frameshift und Splice-site-Mutationen, die i. d. R. zum Exon-Skipping führen. Bei all diesen Mutationen handelt es sich offensichtlich um Veränderungen, die zum Verlust der Proteinfunktion/-stabilität und der Kernlokalisierung führen. Darüber hinaus sind jedoch auch größere genomische Alterationen [5] und in seltenen Fällen Missense-Mutationen und kausale Veränderungen außerhalb der kodierenden Bereiche identifiziert worden. Auch bei diesen Mutationen wird davon ausgegangen, dass sie primär die Stabilität des Proteins stören und somit sekundär ebenfalls als Loss-of-Function- Allele wirken. Mit der Mutation c.1105 C > T gibt es eine Veränderung, die bei 20–25% der Fälle aus Europa und Japan nachgewiesen worden ist, zusätzlich sind auch einige populationsspezifische Founder-Mutationen beschrieben worden [5, 15, 23]. Da wahrscheinlich alle Mutationen über einen ähnlichen zellulären Mechanismus wirken, ist es nicht weiter erstaunlich, dass bis jetzt keine eindeutigen Genotyp-Phänotyp-Korrelationen nachgewiesen wurden.
Die genetische Diagnostik des WS besteht im Wesentlichen aus der Sequenzierung aller kodierenden WRN-Exons, wodurch bei klinisch sehr wahrscheinlicher Diagnose etwa 90% der Fälle aufgeklärt werden können. Eine solche Diagnostik wird z. B. durch das International Registry of Werner Syndrome oder das Labor der Autoren durchgeführt. Eine routinemäßige Analyse in Bezug auf größere Deletionen/Insertionen am WRN-Lokus z. B. durch MLPA ist zzt. nicht verfügbar, allerdings konnten im Rahmen von Forschungsansätzen durchaus genomische Alterationen durch den Einsatz von hoch auflösenden Array-CGH-Untersuchungen (CGH: „comparative genomic hybridization“) identifiziert werden [5]. Unter Umständen kann die DNA-basierte Diagnostik durch eine Proteinanalyse aus Blutzellen bzw. Fibroblasten ergänzt werden, die bei fehlendem Nachweis von WRN-Protein im Western Blot zusammen mit der klinischen Symptomatik ggf. einen Hinweis auf eine ursächliche Mutation, z. B. im nicht kodierenden Bereich, geben kann. Bei Nachweis der kausalen Mutation ist eine entsprechende Analyse weiterer Familienangehöriger i. d. R. einfach möglich. Eine pränatale Diagnostik ist bei Mutationsnachweis zwar prinzipiell möglich, aufgrund der späten Manifestation der Erkrankung aber de facto nicht von Belang.
Atypische Formen
Ungefähr 10–20% der Patienten, die an das International Registry of Werner Syndrome (Infobox 1) überwiesen werden und bei denen eine unklare progeroide Erkrankung als „mögliches WS“ klassifiziert worden ist (Abb. 2), haben keine ursächlichen Mutationen in WRN, und auch im Western Blot zeigt sich ein normales WRN-Protein. Diese Patienten werden zzt. operational als „atypisches“ WS klassifiziert. Bei einem kleineren Teil dieser Patienten wurden heterozygote Mutationen im Lamin-A/C-Gen (LMNA) gefunden [1, 10, 21], welches auch im Hutchinson-Gilford-Syndrom mutiert ist. Typischerweise weisen diese Patienten im Vergleich zum klassischen WS einen vergleichsweise früheren Krankheitsbeginn oder schnelleren Verlauf auf. Zudem bestehen bei ihnen charakteristischerweise keine Katarakte, die als nahezu obligates Symptom für das klassische WS gewertet werden können. Zukünftig offerieren gerade die Patienten mit atypischem WS ohne bekannte Mutationen im WRN und LMNA die Möglichkeit, neue Krankheitsgene für segmentale Progerieformen zu identifizieren und somit neue Einblicke in die zum Großteil immer noch unverstandene Pathophysiologie der vorzeitigen Alterung zu gewinnen. Da es sich dabei in den meisten Fällen um einzelne Patienten in der Familie handelt, ist es offensichtlich, dass die erfolgreiche Krankheitsgenidentifizierung erst durch die neuen Hochdurchsatztechnologien im Bereich der Sequenzierung und quantitativen Genomanalyse möglich geworden ist. Tatsächlich ist es durch den systematischen Einsatz dieser Methoden bereits gelungen, zwei neue Gene für das atypische WS zu identifizieren, die neue zelluläre Signalwege des humanen Alterns aufzeigen (Lessel, Oshima & Kubisch, unpubliziert).
Infobox 1. Weitere Informationen.
Homepage des International Registry of Werner Syndrome an der University of Washington, Seattle/WA, USA: http://www.wernersyndrome.org/registry/registry.html
http://www.progeriaresearch.org/Homepage der „Progeria Research Foundation“:
Aktualisierte Version des GeneReviews™ über das Werner-Syndrom: http://www.ncbi.nlm.nih.gov/books/NBK1514/
Fazit für die Praxis.
Das Werner-Syndrom (WS) gehört zu den seltenen Erkrankungen mit autosomal- rezessiver Vererbung, das jedoch aufgrund seiner typischen Symptomatik auch Einblicke in die molekulare Pathophysiologie des Alterns und verschiedener altersassoziierter Erkrankungen erlaubt.
Bei klinischem Verdacht auf WS kann die Bestätigung durch eine direkte molekulargenetische Analyse z. B. über das International Registry of Werner Syndrome erfolgen. Hierdurch wird eine gezielte humangene-tische Beratung möglich.
Zudem wird hierdurch eine spezifische medizinische Vor- bzw. Nachsorge bezüglich der verschiedenen beim WS betroffenen Gewebe/Körperfunktionen ermöglicht, die in der Vergangenheit bereits zu einer Verbesserung der Lebenserwartung und -qualität geführt hat.
Die wissenschaftliche Untersuchung von Patienten mit atypischem WS oder ähnlichen Progerieformen verspricht, neue Ursachen und Mechanismen der vorzeitigen Alterung zu identifizieren, was zukünftig hoffentlich zu einer besseren medizinischen Versorgung der betroffenen, aber auch anderer Patienten mit altersassoziierten Erkrankungen führen wird.
Footnotes
Interessenkonflikt. Der korrespondierende Autor gibt für sich und seine Koautoren an, dass kein Interessenkonflikt besteht.
Literatur
- 1.Chen L, Lee L, Kudlow BA, et al. LMNA mutations in atypical Werner’s syndrome. Lancet. 2003;362:440–445. doi: 10.1016/S0140-6736(03)14069-X. [DOI] [PubMed] [Google Scholar]
- 2.Dreesen O, Stewart CL. Accelerated aging syndromes, are they relevant to normal human aging? Aging (Albany NY) 2011;3:889–895. doi: 10.18632/aging.100383. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Epstein CJ, Martin GM, Motulsky AG. Werner’s syndrome; caricature of aging. A genetic model for the study of degenerative diseases. Trans Assoc Am Physicians. 1965;78:73–81. [PubMed] [Google Scholar]
- 4.Epstein CJ, Martin GM, Schultz AL, Motulsky AG. Werner’s syndrome a review of its symptomatology, natural history, pathologic features, genetics and relationship to the natural aging process. Medicine (Baltimore) 1966;45:177–221. doi: 10.1097/00005792-196605000-00001. [DOI] [PubMed] [Google Scholar]
- 5.Friedrich K, Lee L, Leistritz DF, et al. WRN mutations in Werner syndrome patients: genomic rearrangements, unusual intronic mutations and ethnic-specific alterations. Hum Genet. 2010;128:103–111. doi: 10.1007/s00439-010-0832-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Goto M, Matsuura M. Secular trends towards delayed onsets of pathologies and prolonged longevities in Japanese patients with Werner syndrome. Biosci Trends. 2008;2:81–87. [PubMed] [Google Scholar]
- 7.Goto M, Miller RW, Ishikawa Y, Sugano H. Excess of rare cancers in Werner syndrome (adult progeria) Cancer Epidemiol Biomarkers Prev. 1996;5:239–246. [PubMed] [Google Scholar]
- 8.Hisama FM, Bohr VA, Oshima J. WRN’s tenth anniversary. Sci Aging Knowledge Environ. 2006;10:pe18. doi: 10.1126/sageke.2006.10.pe18. [DOI] [PubMed] [Google Scholar]
- 9.Hisama FM, Kubisch C, Martin GM, Oshima J. Clinical utility gene card for: Werner syndrome. Eur J Hum Genet. 2012;20(5) doi: 10.1038/ejhg.2011.265. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Hisama FM, Lessel D, Leistritz D, et al. Coronary artery disease in a Werner syndrome-like form of progeria characterized by low levels of progerin, a splice variant of lamin A. Am J Med Genet. 2011;155A:3002–3006. doi: 10.1002/ajmg.a.34336. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Kudlow BA, Kennedy BK, Monnat RJ., Jr Werner and Hutchinson-Gilford progeria syndromes: mechanistic basis of human progeroid diseases. Nat Rev Mol Cell Biol. 2007;8:394–404. doi: 10.1038/nrm2161. [DOI] [PubMed] [Google Scholar]
- 12.Kyng KJ, May A, Kølvraa S, Bohr VA. Gene expression profiling in Werner syndrome closely resembles that of normal aging. Proc Natl Acad Sci U S A. 2003;100:12259–12264. doi: 10.1073/pnas.2130723100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Martin GM. Genetic modulation of senescent phenotypes in Homo sapiens. Cell. 2005;120:523–532. doi: 10.1016/j.cell.2005.01.031. [DOI] [PubMed] [Google Scholar]
- 14.Martin GM, Oshima J, Gray MD, Poot M. What geriatricians should know about the Werner syndrome. J Am Geriatr Soc. 1999;47:1136–1144. doi: 10.1111/j.1532-5415.1999.tb05240.x. [DOI] [PubMed] [Google Scholar]
- 15.Masala MV, Scapaticci S, Olivieri C, et al. Epidemiology and clinical aspects of Werner’s syndrome in North Sardinia: description of a cluster. Eur J Dermatol. 2007;17:213–216. doi: 10.1684/ejd.2007.0155. [DOI] [PubMed] [Google Scholar]
- 16.Monnat RJ., Jr Human RECQ helicases: roles in DNA metabolism, mutagenesis and cancer biology. Semin Cancer Biol. 2010;20:329–339. doi: 10.1016/j.semcancer.2010.10.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Muftuoglu M, Oshima J, von Kobbe C, et al. The clinical characteristics of Werner syndrome: molecular and biochemical diagnosis. Hum Genet. 2008;124:369–377. doi: 10.1007/s00439-008-0562-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Oshima J, Martin GM, Hisama FM. Werner Syndrome. In: Pagon RA, Bird TD, Dolan CR, et al., editors. (Hrsg) GeneReviews™ [Internet] Seattle (WA): University of Washington, Seattle; 2012. pp. 1993–2012. (updated 2012 Feb 09) [PubMed] [Google Scholar]
- 19.Pichierri P, Ammazzalorso F, Bignami M, Franchitto A. The Werner syndrome protein: linking the replication checkpoint response to genome stability. Aging (Albany NY) 2011;3:311–318. doi: 10.18632/aging.100293. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Rossi ML, Ghosh AK, Bohr VA. Roles of Werner syndrome protein in protection of genome integrity. DNA Repair (Amst) 2010;9:331–344. doi: 10.1016/j.dnarep.2009.12.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Saha B, Lessel D, Hisama FM, et al. A novel LMNA mutation causes altered nuclear morphology and symptoms of familial partial lipodystrophy (Dunnigan Variety) with progeroid features. Mol Syndromol. 2010;1(3):127–132. doi: 10.1159/000320166. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Salk D, Au K, Hoehn H, Martin GM. Cytogenetic aspects of Werner syndrome. Adv Exp Med Biol. 1985;190:541–546. doi: 10.1007/978-1-4684-7853-2_27. [DOI] [PubMed] [Google Scholar]
- 23.Satoh M, Imai M, Sugimoto M, et al. Prevalence of Werner’s syndrome heterozygotes in Japan. Lancet. 1999;353:1766. doi: 10.1016/S0140-6736(98)05869-3. [DOI] [PubMed] [Google Scholar]
- 24.Takemoto M, Mori S, Kuzuya M, et al. Diagnostic criteria for Werner syndrome based on Japanese nationwide epidemiological survey. Geriatr Gerontol Int. 2012 doi: 10.1111/j.1447-0594.2012.00913.x. [Epub ahead of print] [DOI] [PubMed] [Google Scholar]
- 25.Yu CE, Oshima J, Fu YH, et al. Positional cloning of the Werner’s syndrome gene. Science. 1996;272:258–262. doi: 10.1126/science.272.5259.258. [DOI] [PubMed] [Google Scholar]