Abstract
Introducción
El tejido adiposo blanco (TAB) subcutáneo (Sc) humano podría variar dependiendo de su localización anatómica, con diferencias en su perfil proteómico.
Pacientes y métodos
Se obtuvieron aspirados de TAB-Sc de seis mujeres con IMC >25 kg/m2, sometidas a liposucción. Dicho TAB-Sc se obtuvo de seis localizaciones anatómicas: abdominal superior e inferior, muslo, dorsal, flanco y cadera, analizándose su perfil proteómico mediante electroforesis bidimensional. En muslo y abdomen superior se compararon, además, las muestras obtenidas de las dos capas del TAB-Sc (profunda y superficial).
Resultados
Se detectaron 21 proteínas que mostraban una intensidad de expresión diferente entre las seis localizaciones anatómicas y 14 entre las capas superficial y profunda de una misma región. Entre las proteínas identificadas se incluyen: vimentina (proteína estructural); proteínas “heat-shock” (HSPs), superóxido-dismutasa, (estrés/chaperoninas); proteína fijadora de ácidos grasos 4 (FABP-4) y alfa-enolasa (metabolismo lipídico y de los hidratos de carbono, respectivamente) y ATP-sintetasa (producción de energía). Entre las regiones estudiadas, el TAB-Sc dorsal mostraba un perfil proteómico particular, con menor expresión de proteínas implicadas en la producción de energía y metabolismo (ATP-sintetasa, alfa-enolasa, HSPs y FABP-4) que el resto de regiones.
Conclusiones
Los niveles de expresión de diversas proteínas en el TAB-Sc humano no son homogéneos, difiriendo entre localizaciones anatómicas. Esto sugiere la existencia de diferencias funcionales en el TAB-Sc de acuerdo con su localización anatómica, lo que debe considerarse antes de asumir la extrapolación de los datos derivados del TAB-Sc de una determinada localización al de otras partes de la anatomía.
Keywords: Electroforesis bidimensional, perfil proteómico, tejido adiposo blanco subcutáneo, liposucción
Keywords: Two dimensional electrophoresis, proteomic profile, subcutaneous white adipose tissue, liposuction
Abstract
Background
Human subcutaneous (SQ) white adipose tissue (WAT) can vary according to its anatomical location, with subsequent differences in its proteomic profile.
Patients and methods
SQ-WAT aspirates were obtained from six overweight (BMI >25 kg/m2) women who underwent extensive liposuction. SQ-WAT was removed from six different locations (upper abdominal, lower abdominal, thigh, back, flank, and hip), and the protein profiles were determined by two-dimensional gel electrophoresis. In addition, the proteomic profiles of upper abdominal and hip SQ-WAT were subjected to further analysis, comparing samples obtained from two layers of WAT (deep and superficial).
Results
Twenty one protein spots showed differential intensities among the six defined anatomical locations, and 14 between the superficial and the deep layer. Among the proteins identified were, vimentin (structural protein), heat-shock proteins (HSPs), superoxide-dismutase (stress-resistance/chaperones), fatty-acid-binding protein (FABP) 4, and alpha-enolase (lipid and carbohydrate metabolism), and ATP-synthase (energy production). Among the WAT samples analyzed, the back sub-depot showed significant differences in the levels of selected proteins when compared to the other locations, with lower level of expression of several proteins involved in energy production and metabolism (ATP-synthase, alpha-enolase, HSPs and FABP-4).
Conclusions
The levels of several proteins in human SQ-WAT are not homogeneous between different WAT depots. These changes suggest the existence of inherent functional differences in subcutaneous fat depending upon its anatomical location. Thus, caution must be used when extrapolating data from one subcutaneous WAT region to other depots.
Introducción
El tejido adiposo blanco (TAB) es complejo, existiendo diferencias fisiológicas entre sus distintos depósitos [1–2]. Entre ellos, el subcutáneo (Sc) es fisiológicamente transcendental, por ser el mayor, cuantitativamente, [3] y por su secreción de adipoquinas, cuyo perfil varía influido por su ubicación [1].
Se han comunicado diferencias estructurales y funcionales en el TAB. de acuerdo con su localización, en composición celular, vascularización y drenaje linfático, con repercusión funcional sobre aquél [4–6]. La mayor parte de los estudios se centran en las diferencias existentes entre el TAB visceral (Vis) y el TAB-Sc, con información limitada respecto a las eventuales diferencias entre distintos “sub-depósitos” del TAB-Sc según su localización anatómica. Además, se distinguen dos capas en el TAB-Sc, superficial (TAB-Sc-S) y profunda (TAB-Sc-P), con características estructurales y funcionales diferentes [2, 9] y, la última, con similitudes en su perfil de expresión proteómico con el TAB-Vis en el hombre [10] y con una tasa lipolítica menor que la del TAB-Sc-S [2]. La estructura y consistencia del sistema fascial superficial, que separa ambas capas, también varía entre las distintas partes del cuerpo [11].
Debido a la evidencia de diferencias estructurales y funcionales regionales en el TAB-Sc, se podría hipotetizar sobre la existencia de variaciones en los niveles de expresión de proteínas en el TAB-Sc humano de acuerdo con su localización anatómica y disposición en profundidad. En este estudio descriptivo empleamos la electroforesis bidimensional (2DE), previamente usada para el aislamiento e identificación de un gran número de proteínas, así como de las distintas isoformas de las mismas [12–17], para evaluar comparativamente el proteoma de distintos “sub-depósitos” de TAB-Sc humano. Dicho proteoma fue esencialmente similar entre “sub-depósitos”, pero se observaron diferencias significativas en los niveles de expresión de determinadas proteínas, cuya investigación podría contribuir a la explicación de las diferencias fisiológicas existentes entre los “sub-depósitos” de TAB-Sc.
Pacientes y métodos
Pacientes y muestras
Tras obtener consentimiento informado escrito, se extrajeron, bajo anestesia general, muestras de aspirado de TAB-Sc de seis mujeres (IMC >25 kg/m2) sin patología conocida, sometidas a liposucción el en Hospital Mount Carmel East (Columbus, Ohio) por el mismo cirujano (DWB). Dichas muestras provenían de seis localizaciones anatómicas diferentes (abdominal superior [A-S], abdominal inferior [A-I], muslo [M], dorsal [D], flanco [F] y cadera [C]; Figura 1), en adelante “sub-depósitos”, y se diferenciaron según proviniesen de la capa profunda o superficial (excepto en el muslo, donde esta diferenciación no fue posible).
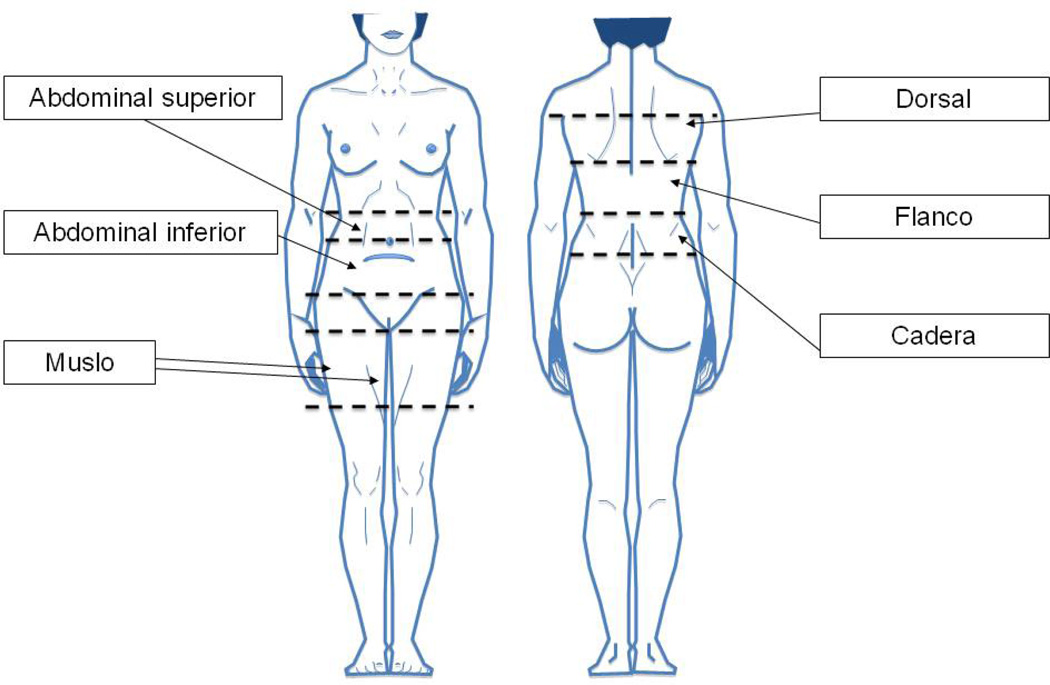
Figura 1.
Localizaciones anatómicas definidas para la obtención de muestras: Abdominal superior (entre la línea umbilical y la costilla inferior), abdominal inferior (entre la línea umbilical y el pliegue abdominal), muslo, cadera (entre la cresta ilíaca y la costilla inferior), flanco (entre la Costilla inferior y la línea escapular) y dorsal (por encima de la línea escapular).
Tras la incisión cutánea y la instilación de solución tumescente (suero salino + mezcla de lidocaína y adrenalina al 0,01%), se diseccionó mecánicamente el TAB-Sc, aspirándose mediante cánula (invariable entre depósitos). Dichos aspirados se centrifugaron inmediatamente en tubos cónicos a durante 10 minutos a 3400 g; separando la capa celular/tisular y congelándola en hielo seco (protocolo aprobado por el Comité Ético del Hospital Mount Carmel East y por el Ohio University Institutional Review Board).
Comparaciones establecidas
Las comparaciones establecidas fueron:
-
-
Capas superficial vs. profunda del TAB-Sc Tanto en una localización “central” (abdominal superior) como en una “periférica” (cadera).
-
-
Comparación entre “sub-depósitos” Se emplearon las muestras de la capa superficial de los 6 “sub-depósitos” de TAB-Sc definidos, con la excepción del muslo (sin diferenciación entre capas).
Preparación de la muestra
Las muestras fueron homogeneizadas, diluidas en una cantidad fija de tampón, sonicadas, incubadas y centrifugadas según descrito previamente [13–17], ajustando a una concentración proteica fija de 150 µg de proteína en un volumen total de 350 µl.
Electroforesis bidimensional (2DE)
Todos los procedimientos de 2DE, procesamiento y análisis de imágenes, espectrometría de masas (MS) y MS secuencial (MS/MS), así como su proceso de análisis (MALDI-TOF) están detallados en anteriores publicaciones de nuestro grupo tanto para muestras humanas como murinas [13–17]. Las identificaciones proteicas mediante MS y MS/MS se obtuvieron mediante la contrastación de los datos generados con las bases de datos disponibles en red mediante el software Mascot (www.matrixscience.com) según descrito previamente [15–17].
Análisis estadístico
Todos los datos de intensidad fueron transformados logarítmicamente. En la comparación entre TAB-Sc-S y TAB-Sc-P, se empleó el test de la T de Student, para aquellos datos con distribución normal (p > 0,05 en el test de Shapiro-Wilk) e igualdad de varianzas, empleándose el test de rangos de Wilcoxon para el resto. Para la comparación entre “sub-depósitos”, en caso de distribución normal se empleó un test de ANOVA, con corrección de Greenhouse-Geisser para los datos sin esfericidad (p < 0,05 en el test de Mauchly), seguido del test post-Hoc de Tukey en los casos con diferencias significativas. Los datos restantes se analizaron mediante el test de Friedman seguido del de Bonferroni-Dunn, si se hallaban diferencias significativas. El nivel de significación se estableció en p < 0,05. El software empleado fue SPSS v. 14.0. (MapInfo Corporation, Troy, NY, USA).
Resultados
Comparación entre las capas superficial y profunda del TAB-Sc
Se diferenciaron un total de 228 potenciales proteínas, comparándose su intensidad entre las capas superficial y profunda tanto en el “sub-depósito” abdominal superior como en la cadera.
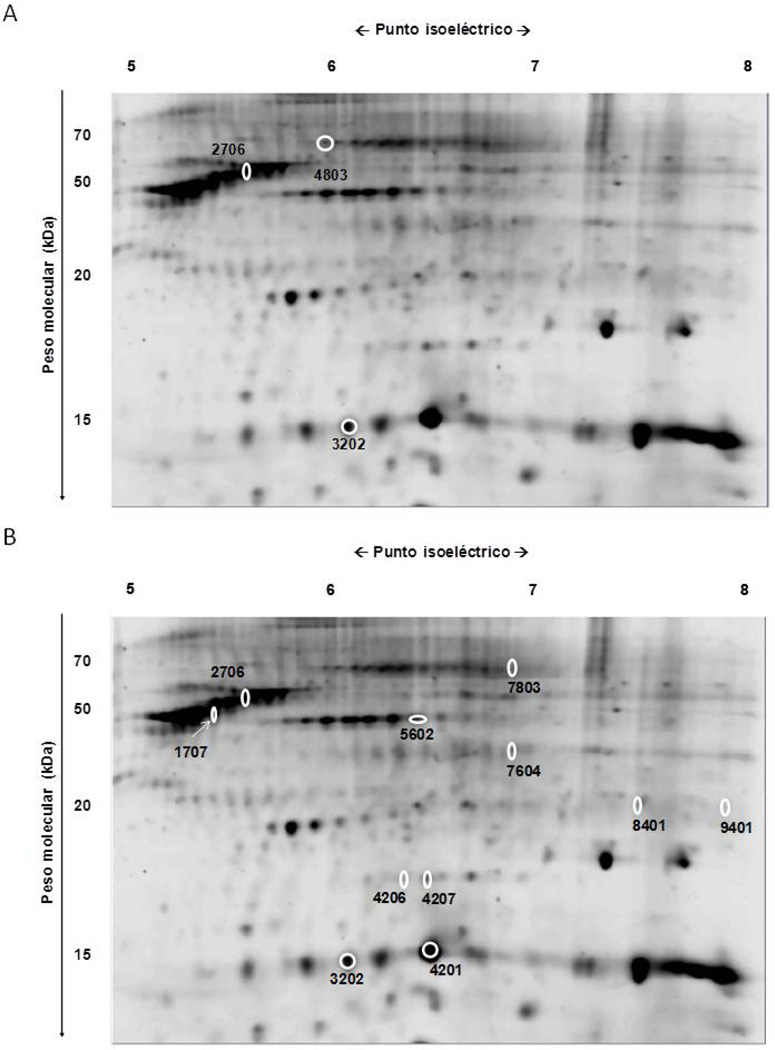
En el “sub-depósito” abdominal superior, tres de ellas mostraban mayor intensidad en la capa superficial (Figura 2A, Tabla 1). Se identificaron como vimentina (2706), proteína fijadora de ácidos grasos (FABP) 4 (3202) y proteína “heat shock “(HSP) 8 (4803).
Figura 2.
Muestra de geles de electroforesis bidimensional. Se resaltan las potenciales proteínas que exhibían diferente intensidad en la comparación entre las capas superficial y profunda del TAB-Sc en los “sub-depósitos” abdominal superior (A) y cadera (B).
Tabla 1. Comparación del proteoma entre las capas superficial y profunda del tejido adiposo blanco subcutáneo.
Intensidades relativas (media ± DE) de las potenciales proteínas que mostraron diferencias significativas entre las capas superficial y profunda en la región abdominal superior y en la cadera, respectivamente.
| Región anatómica | Número | PM/pI | Capa superficial vs. capa profunda | Identidad proteica |
|---|---|---|---|---|
| Abdominal superior | 2706 | ∼50kDa / ∼5.5 | 11049 ± 2775 vs. 1799 ± 1098 | Vimentina |
| 3202 | ∼15kDa / ∼6.1 | 9680 ± 3086 vs. 7504 ± 2017 | FABP-4 | |
| 4803 | ∼70kDa / ∼5.9 | 14880 ± 14160 vs. 1519 ± 817 | Proteína “Heat Shock” 8 | |
| Cadera | 1707 | ∼48kDa / ∼5.3 | 12377 ± 11734 vs. 6104 ± 5257 | No identificada |
| 2706 | ∼50kDa / ∼5.5 | 8173 ± 2598 vs. 2067 ± 979 | Vimentina | |
| 3202 | ∼15kDa / ∼6.1 | 7039 ± 1904 vs. 10304 ± 2823 | FABP-4 | |
| 4201 | ∼15kDa / ∼6.5 | 4451 ± 1415 vs. 8700 ± 4520 | No identificada | |
| 4206 | ∼17kDa / ∼6.3 | 504 ± 54 vs. 341 ± 116 | No identificada | |
| 4207 | ∼17kDa / ∼6.5 | 1983 ± 497 vs. 1042 ± 391 | Proteína “Heat Shock” β6 | |
| 5602 | ∼50kDa / ∼6.4 | 7059 ± 2316 vs. 4181 ± 898 | No identificada | |
| 7604 | ∼30kDa / ∼6.9 | 1346 ± 221 vs. 1833 ± 349 | No identificada | |
| 7803 | ∼70kDa / ∼6.9 | 21401 ± 25580 vs. 5434 ± 5560 | Albúmina | |
| 8401 | ∼20kDa / ∼7.5 | 2161 ± 676 vs. 4519 ± 1338 | No identificada | |
| 9401 | ∼19kDa / ∼7.8 | 1376 ± 796 vs. 4055 ± 2092 | No identificada |
Abreviaturas: FABP-4: Proteína fijadora de ácidos grasos número 4; PM: Peso molecular; pI: Punto isoeléctrico.
En la cadera, seis potenciales proteínas mostraban mayor intensidad en la capa superficial: vimentina (2706), HSP-β6 (4207), albúmina (7803) y tres no identificadas (1707, 4206, 5602). Por el contrario, cinco mostraron una intensidad superior en la capa profunda: FABP-4 (3202), β-hemoglobina (8401) y tres no identificadas (4201; 7604, 9401) (Figura 2B, Tabla 1).
Los datos de MS y MS/MS de las proteínas caracterizadas se muestran en la Tabla 2. Varias potenciales proteínas recibieron la misma caracterización de acuerdo con sus datos de MS y MS/MS. Sus diferencias en peso y carga se deben, probablemente, a modificaciones post-transduccionales, refiriéndose como distintas isoformas de una misma proteína.
Tabla 2. Caracterización de las proteínas mediante MS y MS-MS.
Especificación de los datos de espectrometría de masas (MS) y de MS secuencial (MS-MS) de las proteínas identificadas entre las que mostraban diferencias significativas de intensidad en la comparación entre las capas superficial y profunda y entre las distintas localizaciones anatómicas (A y B, respectivamente).
| Número | MS Puntuación / Corte |
MS Fragmentos emparejados |
MS Cobertura de secuencia |
MS -MS Puntuación / Corte |
MS-MS Fragmentos emparejados |
Identidad proteica |
|---|---|---|---|---|---|---|
| A) Proteínas identificadas en la comparación entre capas superficial y profunda | ||||||
| 2706 | 105 / 66 | 20 | 50 % | 300 / 41 | 10 | Vimentina |
| 3202 | 74 / 66 | 6 | 51 % | 583 / 41 | 6 | FABP-4 |
| 4207 | 69 / 66 | 8 | 60 % | 221 / 41 | 7 |
Proteína “Heat Shock” β6 |
| 4803 | 66 / 64 | 12 | 24 % | 47 / 41 | 4 |
Proteína “Heat Shock” 8 (70kDa) |
| 7803 | 80 / 66 | 9 | 26 % | 82 / 41 | 5 | Albúmina |
| 8401 | 136 / 66 | 17 | 95 % | 664 / 41 | 9 | Hemoglobina |
| B) Proteínas identificadas en la comparación entre las localizaciones anatómicas estudiadas | ||||||
| 1706 | 126 / 66 | 17 | 51 % | 258 / 39 | 10 | Vimentina |
| 2603 | 68 / 66 | 7 | 23 % | 114 / 70 | 23 |
Subunidad B de la ATP sintetasa |
| 2705 | 98 / 66 | 13 | 44 % | 155 / 41 | 7 | Vimentina |
| 3801 | 50 / 66 | 6 | 14 % | 223 / 70 | 7 |
Proteína “Heat Shock” 60 kDa |
| 4201 | 86 / 66 | 7 | 67 % | 267 / 70 | 2 | FABP-4 |
| 4607 | 70 / 66 | 8 | 23 % | 70 / 70 | 6 | Albumin |
| 4707 | 124 / 66 | 14 | 26 % | 133 / 41 | 8 | Albúmina |
| 4805 | 85 / 70 | 7 | 10% | 93 / 70 | 4 | Hemopexina |
| 6101 | 68 / 66 | 12 | 81 % | 358 / 41 | 6 | Hemoglobina |
| 6102 | 83 / 66 | 11 | 81 % | 369 / 41 | 6 | Hemoglobina |
| 7706 | 100% (CI) | 9 | 23 % | 100% (CI) | 4 | Alfa enolasa |
| 8202 | 144 /41 | 4 | 25% | 144 / 41 | 4 | Superóxido dismutasa |
| 8401 | 136 / 66 | 17 | 95 % | 664 / 41 | 9 | Hemoglobina |
| 8402 | 111 / 66 | 8 | 84 % | 215 / 41 | 5 | Hemoglobina |
Abreviatura: FABP4: Proteína fijadora de ácidos grasos número 4.
Comparación entre las distintas áreas anatómicas del TAB-Sc
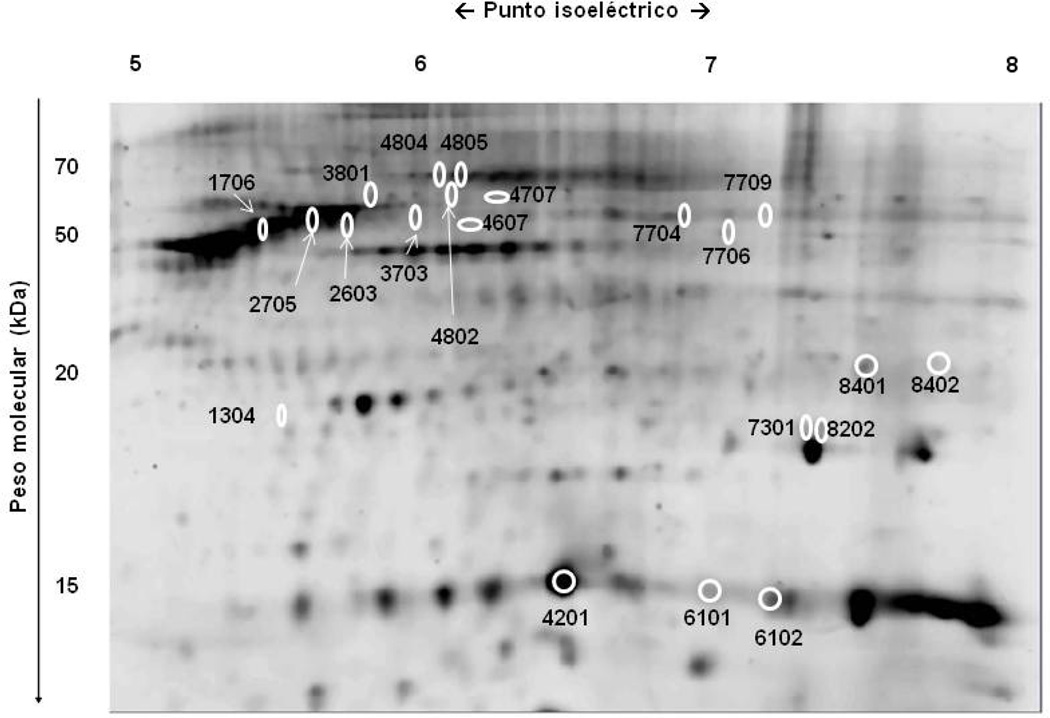
Se encontraron diferencias significativas en el nivel de expresión de 21 potenciales proteínas al comparar el proteoma de los distintos “sub-depósitos” definidos de acuerdo con su localización anatómica (Figuras 3 y 4). Se pudo establecer la identidad de 14 de ellas (Tabla 2), sin alcanzarse a identificar las 7 restantes (1304, 3703, 4802, 4804, 7301, 7704 y 7709).
Figura 3.
Muestra de gel de electroforesis bidimensional. Se resaltan las potenciales proteínas que exhibían diferente intensidad en la comparación entre los distintos “sub-depósitos” definidos de acuerdo con su localización anatómica.
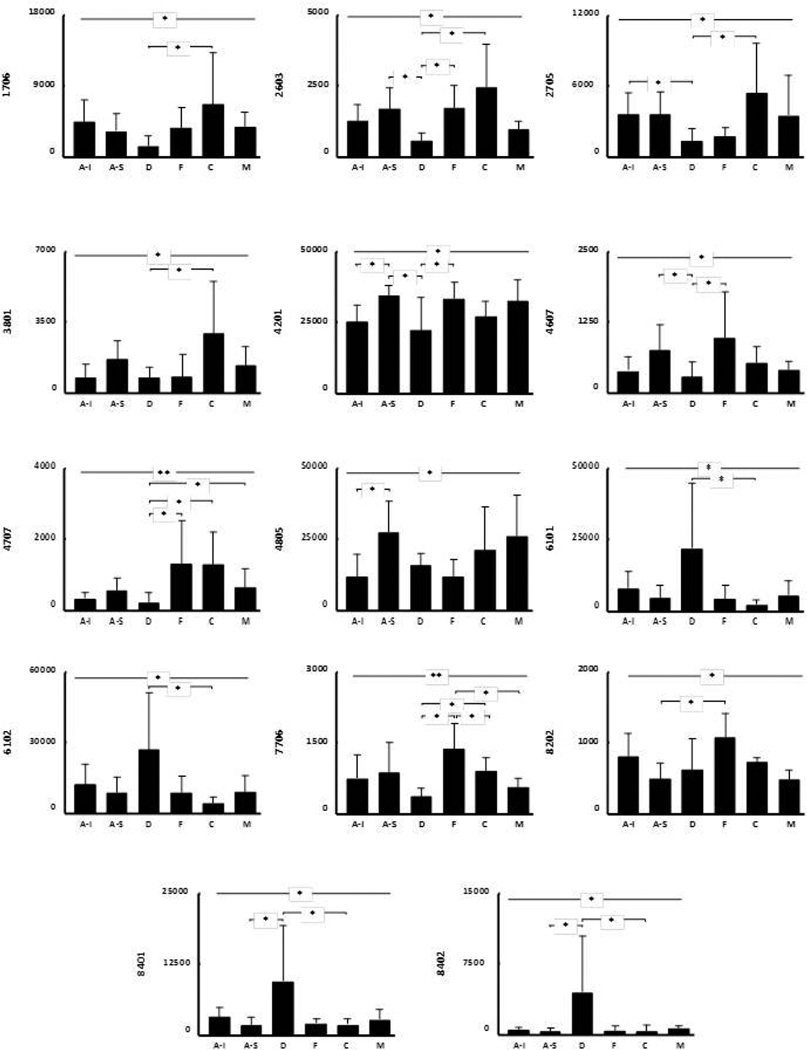
Figura 4.
Los diagramas representan el nivel de expresión (media ± DE) de las proteínas identificadas en cada uno de los “sub-depósitos” de tejido adiposo blanco subcutáneo definidos. Los asteriscos en la línea superior reflejan el nivel de significación de la comparación entre todos los depósitos. Las líneas inferiores con asteriscos muestran los resultados de los análisis “post-hoc”, entre parejas de “sub-depósitos”. *: p<0,05; ** p<0,01. Abreviaturas: A-I: abdominal inferior; A-S: abdominal superior; C: cadera; D: dorsal; F: flanco; M: muslo.
Entre las proteínas identificadas, se incluían múltiples isoformas de hemoglobina, albúmina y vimentina, además de la subunidad beta de la ATP-sintetasa (2603), la proteína mitocondrial HSP-60kDa (3801), FABP-4 (4201), hemopexina (4805), alfa-enolasa (7706) y superóxido dismutasa (SOD) (8202).
Varias proteínas mostraban una localización preferente en alguna de las regiones anatómicas. Por ejemplo, el “sub-depósito” dorsal mostró niveles elevados de hemoglobina, pero reducidos de albúmina y de otras 5 proteínas: vimentina (1706, 2705), ATP-sintetasa (β) (2603), HSP-60kDa (3801), FABP-4 (4201) y alfa-enolasa (7706) (Figura 4). También, en el TAB-Sc del flanco se observó un incremento de la expresión de alfa-enolasa (7706) y SOD (8202); mientras que en la cadera existía una sobreexpresión de vimentina (1706, 2705) y de HSP-60kDa (3801) (Figura 4). Finalmente, encontramos diferencias también entre los dos “sub-depósitos” abdominales, con el inferior mostrando una menor expresión de FABP-4 (4201) y hemopexina (4805) respecto al superior (Figura 4).
Discusión
Nuestros resultados muestran que los perfiles proteómicos del TAB-Sc son similares, pero no idénticos en toda la economía corporal. La profundidad de la capa de tejido adiposo y la localización anatómica del mismo determinan importantes diferencias en su expresión proteica. Es de destacar que la mayor parte de estudios comparan el TAB-Vis con una única localización de TAB-Sc. Sin embargo, sobre la base de nuestros hallazgos, consideramos que es importante distinguir entre las distintas capas y ubicaciones de este TAB-Sc al realizar dichas comparaciones [5,6].
Las escasas diferencias en el perfil proteómico entre las capas superficial y profunda del TAB-Sc al estudiar una localización “central” (abdominal superior), mayores en la localización “periférica” (cadera) podrían indicar que la diferenciación neta entre ambas capas depende de la localización anatómica [9, 18]. La existencia de mayores cantidades de hemoglobina en la capa profunda del TAB-Sc de la cadera podrían ser consecuencia del sangrado más profuso, observado durante el procedimiento quirúrgico, debido a una mayor proximidad de los vasos sanguíneos (lo que se observó también en el “sub-depósito” dorsal respecto al resto [19]. Resulta interesante que los niveles de expresión de albúmina mostraron un perfil exactamente opuesto al de la hemoglobina, con mayor intensidad en la capa superficial de la cadera (comparada con la profunda) y en el depósito dorsal (comparado con el resto). Estas diferencias podrían estar influidas por el papel de la albúmina en el control de la presión osmótica intersticial y a una mayor proximidad de los vasos sanguíneos en estas localizaciones [10, 20].
La vimentina es un miembro de la familia de proteínas de los filamentos intermedios, que se encuentra, fundamentalmente, en el tejido conectivo. Las diferencias observadas en los niveles de vimentina, con mayor expresión en la cadera que en otras localizaciones y también en la capa superficial de cadera y abdomen, respecto a la profunda, resultan interesantes. El incremento observado en las capas superficiales podría ser consecuencia de la estructura fibrosa y densa propia de esta capa del TAB-Sc, en contraste con la capa profunda, con un estroma conectivo menos organizado [9]. Asimismo, se ha descrito cómo la vimentina participa en la lipolisis mediante interacción directa con la lipasa sensible a hormonas [21], por lo que nuestra observación podría indicar la existencia de una tasa lipolítica superior en la capa superficial respecto a la profunda [2]. Además, la vimentina es un componente mayor del citoesqueleto y su síntesis, tanto en fibroblastos como en células epiteliales, se ha relacionado con la expansión celular [22]. Todas las pacientes estudiadas fueron mujeres con sobrepeso en las que, habitualmente, la cadera es el sitio de depósito graso preferente [23]. Por lo tanto, el hallazgo de niveles elevados de expresión de vimentina en la cadera podría estar reflejando esos cambios expansivos del tejido adiposo, más intensos en esta localización y particularmente en la capa superficial; mientras que su menor expresión en el “sub-depósito” dorsal mostraría la situación opuesta. Esto concuerda con la menor tendencia de las mujeres al depósito de TAB-Sc en localizaciones dorsales tras ganancia ponderal, en comparación con los hombres [24]. Finalmente, la vimentina es necesaria para la traslocación de los gránulos que contienen el transportador de glucosa GLUT-4 [25]. Así, estas diferencias observadas en la expresión de vimentina entre distintas capas y localizaciones anatómicas del TAB-Sc podrían tener una implicación funcional en la utilización de glucosa y no reflejar, exclusivamente, diferencias estructurales.
El patrón de cambios en la expresión de diferentes HSPs curiosamente mostró una distribución similar a la descrita para vimentina. Es decir, incremento en las capas superficiales respecto a las profundas (HSP-8 y HSP-β6 en abdomen y cadera, respectivamente), con expresión de la HSP mitocondrial de 60kDa -HSP incrementada en la cadera y particularmente disminuida en el “sub-depósito” dorsal. Se han descrito múltiples funciones de las HSPs, incluyendo la inmunomodulación [26], la contribución a la configuración morfológica de otras proteínas [27] o la senescencia celular [28]. La HSP-β6 pertenece a las llamadas HSP pequeñas (20kDa) HSP, con actividad chaperonina e influencia sobre las interacciones del citoesqueleto y el transporte de glucosa e insulina [29]. La HSP-8 pertenece a la familia de las HSP de 70 kDa y sus niveles de expresión en el hipocampo se han visto influidos por la realización de ejercicio físico [30]. La HSP-60 kDa es una proteína asociada a la matriz mitocondrial que pertenece a la familia de las chaperoninas y cuyos niveles de expresión se ha comprobado que se reducen tras la ingesta de grasa tanto en el tejido adiposo murino [31] como humano [32]. En conjunto, las HSPs están relacionadas con la respuesta al estrés, al tiempo que el estrés oxidativo se ha propuesto como vínculo entre obesidad, resistencia a insulina e inflamación [33]. Por lo tanto, los cambios anatómicos observados en su expresión podrían suponer un vínculo entre la acumulación local de tejido adiposo y sus comorbilidades mediadas por estrés oxidativo [34].
Las proteínas fijadoras de ácidos grasos (FABPs) son proteínas pequeñas localizadas en el citoplasma, fundamentalmente en adipocitos y macrófagos [35]. Pueden unirse reversiblemente con gran afinidad a moléculas hidrofóbicas, incrementando la solubilidad de los ácidos grasos libres (AGL) y su transporte a compartimentos celulares específicos regulando, así, su biodisponibilidad [35]. Por tanto, las FABPs están relacionadas con la regulación del acúmulo lipídico y de la expresión génica mediada por lípidos [36], siendo esenciales para el proceso de lipolisis [37]. Sobre la base de estas acciones, las FABPs de los adipocitos y de los macrófagos se han implicado en el desarrollo de arteriosclerosis y síndrome metabólico [38]. Así, el contraste entre el incremento de expresión de FABP-4 en la capa superficial del TAB-Sc abdominal y sudisminución en la de la cadera podría indicar que su distribución y función en el TAB-Sc varía entre las distintas partes del cuerpo. Las diferencias observadas en la comparación de los niveles de expresión de FABP-4 entre los distintos “sub-depósitos” anatómicos fueron particularmente interesantes; mostrando niveles significativamente menores en el dorsal frente al flanco y en el depósito abdominal inferior frente al superior. Esto podría indicar diferencias específicas entre “sub-depósitos” en la captación de ácidos grasos y en lipolisis que podrías, al menos parcialmente, explicar por qué nuestros hallazgos no son exactamente comparables a estudios previos que no encontraron diferencias entre las distintas capas del TAB-Sc [2, 10].
De forma adicional, el hecho de que las diferencias halladas en los perfiles proteómicos de las dos localizaciones abdominales estudiadas no se limitaban a FABP-4, sino que se hace extensivo a la expresión de hemopexina, apoya esta hipótesis. La hemopexina tiene capacidad para tamponar los grupos hemo derivados del metabolismo de hemoglobina y mioglobina, para la modulación de la inflamación y para la inhibición de la adhesión celular [39]. La reducción en la expresión de hemopexina en la región abdominal inferior, en comparación con la superior, podría reflejar un menor potencial expansivo (inhibición de la adhesión celular) de la misma.
Por otra parte, los “sub-depósitos” del flanco y dorsal también mostraron diferencias entre sí pese a su proximidad anatómica, con mayor nivel de expresión de alfa-enolasa en el flanco. Esta proteína está implicada en la glicolisis y se encuentra en menor cantidad en los adipocitos de localización ectópica (intramuscular) que en los localizados en el TAB [40], por lo que este hallazgo podría orientar también hacia la existencia de diferencias funcionales del TAB-Sc respecto al metabolismo de los hidratos de carbono dependiendo de su localización.
El análisis del proteoma del “sub-depósito” dorsal mostró el mayor número de diferencias respecto al resto de “sub-depósitos”. Observamos menor expresión de HSP-60 kDa HSP (estrés oxidativo), FABP-4 (metabolismo lipídico), alfa-enolasa (metabolismo de los hidratos de carbono) y subunidad beta de la ATP-sintetasa (metabolismo energético). Juntos, estos hallazgos sugieren que el TAB-Sc de localización dorsal muestra una actividad metabólica menor que el de otras áreas anatómicas.
Nuestros resultados demuestran que los perfiles proteómicos de las capas superficial y profunda del TAB-Sc no son completamente superponibles y que existen diferencias entre los proteomas del TAB-Sc de distintas localizaciones anatómicas. Encontramos cambios tanto en proteínas estructurales como funcionales entre las distintas regiones anatómicas estudiadas, así como dependiendo de la profundidad de localización de dicho tejido adiposo. Estos resultados don críticos a la hora de interpretar los datos derivados de cualquier comparación entre TAB-Vis y TAB-Sc, ya que el depósito de TAB-Sc seleccionado para la comparación puede diferir significativamente dependiendo de su localización. Hasta la fecha y en nuestro conocimiento, este es el primer estudio que muestra la existencia de diferencias en los perfiles proteómicos de distintos “sub-depósitos” de TAB-Sc.
Responsabilidades éticas
Protección de personas y animales
Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos
Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado
Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Acknowledgments
Financiación
Gabriel A. Martos-Moreno recibió un “Contrato Rio Hortega” del Instituto de Salud Carlos III (FIS CM05/00100). Este trabajo fue financiado en parte por el Programa Eminent Scholar del estado de Ohio, que incluye una donación de Milton & Lawrence Goll, por los proyectos del NIH DK075436-01, AG019899-06, y por la Diabetes Research Initiative y el BioMolecular Innovation and Technology Partnership de la Universidad de Ohio; por el CIBER Fisiopatología de la Obesidad y Nutrición (CIBERobn), del Instituto de Salud Carlos III, por el Fondo de Investigación Sanitaria (FIS, PI09/91060 y PI10/00747), por la Fundación Endocrinología y Nutrición y por Mutua Madrileña (AP2561/2008).
Footnotes
Publisher's Disclaimer: This is a PDF file of an unedited manuscript that has been accepted for publication. As a service to our customers we are providing this early version of the manuscript. The manuscript will undergo copyediting, typesetting, and review of the resulting proof before it is published in its final citable form. Please note that during the production process errors may be discovered which could affect the content, and all legal disclaimers that apply to the journal pertain.
Bibliografía
- 1.Wajchenberg BL. Subcutaneous and visceral adipose tissue: their relation to the metabolic syndrome. Endocr Rev. 2000;21:697–738. doi: 10.1210/edrv.21.6.0415. [DOI] [PubMed] [Google Scholar]
- 2.Enevoldsen LH, Simonsen L, Stallknecht B, Galbo H, Bulow J. In vivo human lipolytic activity in preperitoneal and subdivisions of subcutaneous abdominal adipose tissue. Am J Physiol Endocrinol Metab. 2001;281:E1110–E1114. doi: 10.1152/ajpendo.2001.281.5.E1110. [DOI] [PubMed] [Google Scholar]
- 3.Garg A, Agarwal AK. Lipodystrophies: disorders of adipose tissue biology. Biochim Biophys Acta. 2009;1791:507–513. doi: 10.1016/j.bbalip.2008.12.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Tsuchida A, Yamauchi T, Kadowaki T. Nuclear receptors as targets for drug development: molecular mechanisms for regulation of obesity and insulin resistance by peroxisome proliferator-activated receptor gamma, CREB-binding protein, and adiponectin. J Pharmacol Sci. 2005;97:164–170. doi: 10.1254/jphs.fmj04008x2. [DOI] [PubMed] [Google Scholar]
- 5.Peinado JR, Jiménez-Gómez Y, Pulido MR, Ortega-Bellido M, Díaz-López C, Padillo FJ, et al. The stromal-vascular fraction of adipose tissue contributes to major differences between subcutaneous and visceral fat depots. Proteomics. 2010;10:3356–3366. doi: 10.1002/pmic.201000350. [DOI] [PubMed] [Google Scholar]
- 6.Kheterpal I, Ku G, Coleman L, Yu G, Ptitsin AA, Floyd ZE, et al. Proteome of human subcutaneous adipose tissue stromal vascular fraction cells versus mature adipocytes based on DIGE. J Proteome Res. 2011;10:1519–1527. doi: 10.1021/pr100887r. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Cinti S. The adipose organ. Prostaglandins Leukot Essent Fatty Acids. 2005;73:9–15. doi: 10.1016/j.plefa.2005.04.010. [DOI] [PubMed] [Google Scholar]
- 8.Trujillo ME, Scherer PE. Adipose tissue-derived factors: impact on health and disease. Endocr Rev. 2006;27:762–678. doi: 10.1210/er.2006-0033. [DOI] [PubMed] [Google Scholar]
- 9.Rohrich RJ, Beran SJ, Kendel JM. Ultrasound-Assisted liposuction. Pp. QMP Inc. ED. St. Louis (MO), USA: ISBN; 1998. pp. 122–146. 1-57626-081-X. [Google Scholar]
- 10.Walker GE, Verti B, Marzullo P, Savia G, Mencarelli M, Zurleni F, et al. Deep subcutaneous adipose tissue: a distinct abdominal adipose depot. Obesity (Silver Spring) 2007;15:1933–1943. doi: 10.1038/oby.2007.231. [DOI] [PubMed] [Google Scholar]
- 11.Lockwood TE. Superficial fascial system (SFS) of the trunk and extremities: a new concept. Plast Reconstr Surg. 1991;87:1009–1018. doi: 10.1097/00006534-199106000-00001. [DOI] [PubMed] [Google Scholar]
- 12.Pérez-Pérez R, Ortega-Delgado FJ, García-Santos E, López JA, Camafeita E, Ricart W, et al. Differential proteomics of omental and subcutaneous adipose tissue reflects their unalike biochemical and metabolic properties. J Proteome Res. 2009;8:1682–1693. doi: 10.1021/pr800942k. [DOI] [PubMed] [Google Scholar]
- 13.Sackmann-Sala L, Berryman DE, Lubbers ER, Vesel CB, Troike KM, List EO, et al. Decreased insulin sensitivity and increased oxidative damage in wasting adipose tissue depots of wild-type mice. Age (Dordr) 2011 Sep 29; doi: 10.1007/s11357-011-9304-7. [Epub ahead of print]. PMID: 21953241. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Sackmann-Sala L, Berryman DE, Munn RD, Lubbers ER, Kopchick JJ. Heterogeneity Among White Adipose Tissue Depots in Male C57BL/6J Mice. Obesity (Silver Spring) 2012;20:101–111. doi: 10.1038/oby.2011.235. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Ding J, Okada S, Jørgensen JO, Kopchick JJ. Novel serum protein biomarkers indicative of growth hormone doping in healthy human subjects. Proteomics. 2011;11:3565–3571. doi: 10.1002/pmic.201100077. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Cruz-Topete D, Jorgensen JO, Christensen B, Sackmann-Sala L, Krusenstjerna-Hafstrom T, Jara A, et al. Identification of new biomarkers of low-dose GH replacement therapy in GH-deficient patients. J Clin Endocrinol Metab. 2011;96:2089–2097. doi: 10.1210/jc.2011-0197. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Christensen B, Lundby C, Jessen N, Nielsen TS, Vestergaard PF, Moller N, et al. Evaluation of functional erythropoietin receptor status in skeletal muscle in vivo: acute and prolonged studies in healthy human subjects. PLoS One. 2012;7:e31857. doi: 10.1371/journal.pone.0031857. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Gasperoni C, Salgarello M. Rationale of subdermal superficial liposuction related to the anatomy of subcutaneous fat and the superficial fascial system. Aesthetic Plast Surg. 1995;19:13–20. doi: 10.1007/BF00209305. [DOI] [PubMed] [Google Scholar]
- 19.Avram AS, Avram MM, James WD. Subcutaneous fat in normal and diseased states: 2 Anatomy and physiology of white and brown adipose tissue. J Am Acad Dermatol. 2005;53:671–683. doi: 10.1016/j.jaad.2005.05.015. [DOI] [PubMed] [Google Scholar]
- 20.Bert JL, Pearce RH, Mathieson JM. Concentration of plasma albumin in its accessible space in postmortem human dermis. Microvasc Res. 1986;32:211–223. doi: 10.1016/0026-2862(86)90055-5. [DOI] [PubMed] [Google Scholar]
- 21.Shen WJ, Patel S, Eriksson JE, Kraemer FB. Vimentin is a functional partner of hormone sensitive lipase and facilitates lipolysis. J Proteome Res. 2010;9:1786–1794. doi: 10.1021/pr900909t. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Ben-Ze’ev A. Application of two-dimensional gel electrophoresis in the study of cytoskeletal protein regulation during growth activation and differentiation. Electrophoresis. 1990;11:191–200. doi: 10.1002/elps.1150110302. [DOI] [PubMed] [Google Scholar]
- 23.Kagawa M, Binns CB, Hills AP. Body composition and anthropometry in Japanese and Australian Caucasian males and Japanese females. Asia Pac J Clin Nutr. 2007;16(Suppl 1):31–36. [PubMed] [Google Scholar]
- 24.Eisner BH, Zargooshi J, Berger AD, Cooperberg MR, Doyle SM, Sheth S, et al. Gender differences in subcutaneous and perirenal fat distribution. Surg Radiol Anat. 2010;32:879–882. doi: 10.1007/s00276-010-0692-7. [DOI] [PubMed] [Google Scholar]
- 25.Ahmed M, Neville MJ, Edelmann MJ, Kessler BM, Karpe F. Proteomic analysis of human adipose tissue after rosiglitazone treatment shows coordinated changes to promote glucose uptake. Obesity (Silver Spring) 2010;18:27–34. doi: 10.1038/oby.2009.208. [DOI] [PubMed] [Google Scholar]
- 26.Yokota S, Fujii N. Immunomodulatory activity of extracellular heat shock proteins and their autoantibodies. Microbiol Immunol. 2010;54:299–307. doi: 10.1111/j.1348-0421.2010.00214.x. [DOI] [PubMed] [Google Scholar]
- 27.Swindell WR, Masternak MM, Kopchick JJ, Conover CA, Bartke A, Miller RA. Endocrine regulation of heat shock protein mRNA levels in long-lived dwarf mice. Mech Ageing Dev. 2009;130:393–400. doi: 10.1016/j.mad.2009.03.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Sherman N. Major heat shock protein Hsp72 controls oncogene-induced senescence. Ann N Y Acad Sci. 2010;1197:152–157. doi: 10.1111/j.1749-6632.2010.05196.x. [DOI] [PubMed] [Google Scholar]
- 29.Gusev NB, Bukach OV, Marston SB. Structure, properties, and probable physiological role of small heat shock protein with molecular mass 20 kD (Hsp20, HspB6) Biochemistry (Mosc) 2005;70:629–637. doi: 10.1007/s10541-005-0162-8. [DOI] [PubMed] [Google Scholar]
- 30.Ding Q, Vaynman S, Souda P, Whitelegge JP, Gomez-Pinilla F. Exercise affects energy metabolism and neural plasticity-related proteins in the hippocampus as revealed by proteomic analysis. Eur J Neurosci. 2006;24:1265–1276. doi: 10.1111/j.1460-9568.2006.05026.x. [DOI] [PubMed] [Google Scholar]
- 31.Rong JX, Qiu Y, Hansen MK, Zhu L, Zhang V, Xie M, et al. Adipose mitochondrial biogenesis is suppressed in db/db and high-fat diet-fed mice and improved by rosiglitazone. Diabetes. 2007;56:1751–1760. doi: 10.2337/db06-1135. [DOI] [PubMed] [Google Scholar]
- 32.Sutherland LN, Capozzi LC, Turchinsky NJ, Bell RC, Wright DC. Time course of high-fat diet-induced reductions in adipose tissue mitochondrial proteins: potential mechanisms and the relationship to glucose intolerance. Am J Physiol Endocrinol Metab. 2008;295:E1076–E1083. doi: 10.1152/ajpendo.90408.2008. [DOI] [PubMed] [Google Scholar]
- 33.Boden G, Duan X, Homko C, Molina EJ, Song W, Pérez O, et al. Increase in endoplasmic reticulum stress-related proteins and genes in adipose tissue of obese, insulin-resistant individuals. Diabetes. 2008;57:2438–2444. doi: 10.2337/db08-0604. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Dorjgochoo T, Gao YT, Chow WH, Shu XO, Yang G, Cai Q, et al. Obesity, Age, and Oxidative Stress in Middle-Aged and Older Women. Antioxid Redox Signal. 2011;14:2453–2460. doi: 10.1089/ars.2010.3337. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Chmurzyńska A. The multigene family of fatty acid-binding proteins (FABPs): function, structure and polymorphism. J Appl Genet. 2006;47:39–48. doi: 10.1007/BF03194597. [DOI] [PubMed] [Google Scholar]
- 36.Storch J, Thumser AE. Tissue-specific functions in the fatty acid-binding protein family. J Biol Chem. 2010;285:32679–32683. doi: 10.1074/jbc.R110.135210. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Hertzel AV, Smith LA, Berg AH, Cline GW, Shulman GI, Scherer PE, et al. Lipid metabolism and adipokine levels in fatty acid-binding protein null and transgenic mice. Am J Physiol Endocrinol Metab. 2006;290:E814–E823. doi: 10.1152/ajpendo.00465.2005. [DOI] [PubMed] [Google Scholar]
- 38.Krusinová E, Pelikánová T. Fatty acid binding proteins in adipose tissue: a promising link between metabolic syndrome and atherosclerosis? Diabetes Res Clin Pract. 2008;82(Suppl 2):S127–S134. doi: 10.1016/j.diabres.2008.09.023. [DOI] [PubMed] [Google Scholar]
- 39.Mauk MR, Smith A, Mauk AG. An alternative view of the proposed alternative activities of hemopexin. Protein Sci. 2011;20:791–805. doi: 10.1002/pro.616. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Gondret F, Guitton N, Guillerm-Regost C, Louveau I. Regional differences in porcine adipocytes isolated from skeletal muscle and adipose tissues as identified by a proteomic approach. J Anim Sci. 2008;86:2115–2125. doi: 10.2527/jas.2007-0750. [DOI] [PubMed] [Google Scholar]