Abstract
Las infecciones constituyen una de las principales causas de muerte en el periodo neonatal. El diagnóstico de sepsis neonatal representa un gran desafío ya que los recién nacidos presentan signos clínicos muy inespecíficos y los exámenes auxiliares tienen una baja sensibilidad. Con el objetivo de mejorar el diagnóstico correcto de esta patología proponemos un algoritmo de vigilancia diagnóstica para sepsis neonatal tardía en el Perú y países de la región. El algoritmo permite clasificar a los episodios como sepsis confirmada, probable o posible, y sobretodo busca identificar aquellos episodios que no corresponden a sepsis, evitando calificar otras patologías como “sepsis”. Un mejor diagnóstico permitiría tener tasas más reales de sepsis neonatal, mejorar el uso de antibióticos y evitar sus efectos negativos en el recién nacido, así como una visión más exacta de su impacto en la salud pública.
Palabras claves: Sepsis neonatal, algoritmo, diagnóstico, mortalidad neonatal, vigilancia diagnóstica
Abstract
Infections are one of the main causes of death in the neonatal period. The diagnosis of neonatal sepsis is a great challenge since neonates have non-specific clinical signs, and laboratory tests have low sensitivity. In order to improve the diagnosis of this disease we propose a surveillance diagnostic’ algorithm for late-onset-sepsis in neonates in Peru and other countries of the region. This algorithm classifies a sepsis episode as a culture-proven, probable or possible sepsis, and essentially seeks those episodes that do not correspond to sepsis, preventing a wrong diagnosis of this pathology. A better diagnosis of sepsis will allow us to have a more accurate vision of it impact in public health, improve rational use of antibiotics and avoid adverse events in neonates.
Impacto de la sepsis neonatal en la salud pública
El cuarto Objetivo de Desarrollo del Milenio busca reducir en dos terceras partes la mortalidad en niños menores de 5 años entre 1990 y el 2015(1). Al año mueren 7.6 millones de niños menores de 5 años en todo el mundo, el 40.3% de estos (3.1 millones) son neonatos (2). Si bien se ha logrado un gran progreso en reducir la mortalidad en el periodo postnatal, la reducción en muertes neonatales ha sido más lenta. Por lo tanto, es crucial acelerar la disminución de la mortalidad neonatal, ya que si las tendencias actuales persisten, no se podrá cumplir con los nuevos objetivos al 2028 (3).
El 98% de las muertes neonatales ocurren en países en desarrollo (4). La prematuridad, las complicaciones asociadas al parto y las infecciones son las principales causas de mortalidad neonatal. En conjunto, estas tres causas representan el 71% de todas las muertes en el periodo neonatal y 28.7% de todas las muertes en menores de 5 años (2). En estos países las infecciones son responsables entre el 8% y 80% de todas las causas de muerte neonatal y hasta del 42% de las causas de muerte en la primera semana de vida (5). La incidencia de sepsis neonatal en países en desarrollo varía entre 49–170 por cada 1000 nacimientos vivos (5).
En América Latina y el Caribe las muertes neonatales representan más de la mitad (52%) de todas las muertes en menores de 5 años (4). En el Perú, 64% de las muertes infantiles ocurren en el primer mes de vida (4); siendo las infecciones la segunda causa más frecuente de mortalidad neonatal en el país (6).
A pesar de que el uso de antibióticos y manejo avanzado en las Unidades de Cuidados Intensivos Neonatales (UCI) ha disminuido de manera significativa la mortalidad por sepsis neonatal, se ha observado que los niños que tienen esta patología presentan mayor retraso del desarrollo motor y cognitivo(7). Por ello, es importante establecer adecuados protocolos de diagnóstico y tratamiento, con el fin de disminuir las consecuencias a largo plazo de esta patología.
Obstáculos en el diagnóstico de sepsis neonatal
Uno de los mayores retos del manejo de la sepsis neonatal es hacer un diagnóstico correcto. A diferencia de pacientes mayores, los recién nacidos presentan signos clínicos de infección inespecíficos. Muchas de las complicaciones de la prematuridad como el síndrome de dificultad respiratoria o las malformaciones cardiacas congénitas pueden presentarse de forma similar a la sepsis neonatal y en ocasiones son indiferenciables clínicamente (7).
La utilidad de pruebas de laboratorio como el hemograma y la proteína C reactiva (PCR) también es limitada. Si bien algunos parámetros como la neutropenia o un alto índice de neutrófilos inmaduros/totales aumentan la posibilidad de infección, la sensibilidad de estas pruebas es baja (8). La PCR ha demostrado tener un alto valor predictivo negativo, por lo que su uso ha sido propuesto en el manejo de sepsis para limitar el tiempo de duración de cobertura antibiótica (9, 10). Sin embargo, esta prueba varía dependiendo de factores como ruptura prematura de membranas, uso de esteroides antenatales y edad gestacional, limitando su uso (8). Por esto, en el diagnóstico de sepsis neonatal se sugiere utilizar una combinación de pruebas auxiliares en lugar de un solo parámetro. Igualmente, por la baja sensibilidad de las pruebas clásicas, se ha propuesto el uso de nuevos marcadores inflamatorios como procalcitonina, perfiles de citoquinas, citometría de flujo o angiopoyetina para hacer el diagnóstico (8) (11). Lamentablemente, muchos de estas pruebas no se encuentran disponibles en nuestro medio o son muy costosas.
El hemocultivo es el “estándar de oro” en el diagnóstico de sepsis neonatal, dado que confirma la presencia de patógenos en la sangre. Sin embargo, la tasa de positividad de esta prueba es baja. El volumen recomendado de sangre para un hemocultivo en neonatos es de 1 ml. Usando este volumen la sensibilidad de esta prueba es de solo 30–40%. Si se usan 3 ml la sensibilidad sube hasta 70–80% (12). Lamentablemente, en la práctica el volumen inoculado promedio es menor a 0.5 ml (13), dado que es difícil tomar mayores volúmenes por el tamaño/peso del recién nacido y por la inestabilidad hemodinámica que pueden presentar como complicación del episodio de sepsis. Utilizar hemocultivos seriados tampoco parece solucionar completamente el problema(14), aunque es recomendable.
Recientemente, se ha evaluado el uso de la reacción en cadena de polimerasa para mejorar el diagnóstico de sepsis neonatal. La ventaja de este método es el poco volumen sanguíneo que requiere (15), además de la posibilidad de identificar al patógeno aun después de haber recibido antibióticos el paciente. Sin embargo, el beneficio de esta prueba aún se encuentra en estudio. Localmente no es una prueba disponible en los laboratorios clínicos.
Todo esto crea una gran incertidumbre en los médicos tratantes. En ocasiones, por temor a un deterioro del paciente, se decide clasificar de “sepsis” a un episodio e iniciar antibióticos sin tener un diagnóstico claro. Si bien esto es aceptable inicialmente por la alta vulnerabilidad de estos pacientes “inmunodeficientes”, cada sospecha de sepsis debe ser evaluada para definir qué tan sólido es el diagnóstico y decidir por la continuación o suspensión de los antibióticos administrados. El uso de antibióticos de amplio espectro y el tratamiento prologando se ha visto asociado a mayor resistencia antibiótica en las UCI neonatales(16). Adicionalmente, se ha encontrado asociación entre el uso indiscriminado de antibióticos y efectos adversos en el neonato como candidiasis invasiva, enterocolitis necrotizante y muerte (17)(18)(19).
Vigilancia epidemiológica de infecciones neonatales
Es imperativo conocer las tasas reales de infección en las UCI neonatales e identificar los factores de riesgo de infección, para diseñar adecuados programas de intervención y evaluar el impacto de estos programas en sepsis neonatal. Los sistemas de vigilancia epidemiológica son clave para la disminución de las infecciones neonatales y los costos asociados. Estos sistemas permiten comparar los datos obtenidos a los largo de los años y en distintas regiones o instituciones de manera que se puedan identificar aquellos con mayores deficiencias y priorizar recursos (5) (20).
Una de las principales barreras para la implementación de un sistema de vigilancia epidemiológica adecuado en infecciones neonatales es la dificultad del diagnóstico. Estos sistemas deben ser consistentes, esto quiere decir que las definiciones de sepsis deben ser reproducibles (20). Actualmente esto no sucede en Perú y en muchos otros países de la región. Al no existir un consenso en el diagnóstico de sepsis neonatal la definición de esta patología varía considerablemente entre instituciones e inclusive entre médicos de la misma institución. Esto evita que se tengan datos confiables, reales y comparables de la incidencia de sepsis neonatal en el país.
Otros factores importantes para el éxito de la vigilancia epidemiológica son la simplicidad y aceptabilidad del sistema, de manera que se minimice la carga de trabajo y favorezca la participación del equipo (20). Se requiere de un método sencillo que pueda ser implementado fácilmente en el ámbito local. Se debe tomar en cuentas las características específicas de los medios donde será aplicado.
Criterios para el diagnóstico de sepsis neonatal
Con el objetivo de lograr un diagnóstico preciso de sepsis neonatal se han publicado diversos criterios diagnósticos. Inicialmente los criterios se basaron en las definiciones de sepsis en el adulto de Bone et al, quien definió sepsis como la presencia del síndrome de respuesta inflamatoria sistémica (SRIS) más un foco infeccioso (21). Esta definición ha sido adaptada a la población pediátrica y neonatal por diversos autores (22)(23). Sin embargo, la utilidad de estas definiciones ha sido cuestionada (24).
En el recién nacido la sepsis neonatal se divide en dos grupos según la edad de presentación. Sepsis neonatal temprana ocurre dentro de las primeras 72 horas de vida y es causada por transmisión vertical, siendo el Streptococcus del grupo B, Escherichia coli, Klebsiella y Listeria los microorganismos principalmente involucrados. La sepsis neonatal tardía ocurre luego de las 72 horas de vida y se debe principalmente a patógenos adquiridos en el periodo post-natal, principalmente cocos Gram positivos y Klebsiella (8). Algunos autores han considerado otros puntos de corte para el inicio de sepsis tardía, tales como las 48 horas o 1 semana de vida. Sin embargo, la mayoría de estudios epidemiológicos y ensayos clínicos recientes alrededor del mundo la definen como aquella infección que ocurre a partir de las 72 horas de vida.(7,25,26) En países en vías de desarrollo, es infrecuente encontrar Streptococcus del grupo B como causa de sepsis neonatal; en estos países predominan las infecciones por Gram negativos.
Debido a la dificultad de aislar un patógeno en neonatos Haque et al han propuesto definiciones de sepsis neonatal tardía basándose en variables clínicas y de laboratorio (Tabla 1)(27). Los criterios para definir los grados de certeza de sepsis neonatal fueron creados en un consenso internacional por expertos. Su objetivo es homogenizar los criterios para definir sepsis, pero a su vez aceptan la dificultad del diagnóstico por lo que permiten diferentes grados de certeza. Los episodios en los que hay signos clínicos de infección y un hemocultivo positivo son catalogados como sepsis confirmada. Aquellos casos en los que no se logra aislar un patógeno pero existe una sepsis clínica son clasificados de acuerdo a las variables de laboratorio. Si el paciente tiene al menos 2 resultados de laboratorio alterados se considera una sepsis probable, indicando una alta sospecha de sepsis y que posiblemente la falta de aislamiento del germen se debe la baja sensibilidad del hemocultivo. Si el paciente no cumple los criterios anteriores pero tiene un resultado de proteína C reactiva (PCR) mayor a 10mg/dl se clasifica como una sepsis posible, indicando un menor grado de certeza, es decir que hay una incertidumbre en el diagnóstico, sin embargo este tampoco puede ser descartado. Cualquier episodio que no cumpla estos criterios es considerado como sepsis descartada (27).
Tabla 1.
Variables clínicas y de laboratorio usadas para el diagnóstico de sepsis en recién nacidos*
| Variable clínica | Inestabilidad de temperatura |
| Frecuencia cardíaca > 1DS por encima de lo normal para la edad (≥180 latidos/min, ≤100 latidos/min) | |
| Frecuencia respiratoria (>60 respiraciones/min) más quejido o desaturación | |
| Letargia o alteración del estado mental | |
| Intolerancia a la glucosa (glucosa en sangre > 10mmol/L) | |
| Intolerancia alimentaria | |
|
| |
| Variable hemodinámica | Presión arterial 2DS por debajo de lo normal para la edad |
| Presión sistólica < 50mm Hg (recién nacido día 1) | |
| Presión sistólica < 65mm Hg (infantes ≤ 1 mes) | |
|
| |
| Variable de perfusión tisular | Llenado capilar > 3 segundos |
| Lactato en plasma > 3 mmol/L | |
|
| |
| Variable inflamatoria | Leucocitosis (Leucocitos > 34,000 × 109/L) |
| Leucopenia (Leucocitos < 5,000 × 109/L) | |
| Neutrófilos inmaduros > 10% ** | |
| Tasa de neutrófilos inmaduros/totales > 0.2 † | |
| Trombocitopenia < 100,000 × 109/L | |
| Proteína C-reactiva (PCR) >10 mg/dL o >2DS por encima del valor normal‡ | |
| Procalcitonina > 8.1 mg/dL o 2DS por encima del valor normal | |
Modificado de Haque KN, 2005 (23);
neutrófilos inmaduros: Metamielocitos, mielocitos y abastonados;
neutrófilos inmaduros/totales: (Metamielocitos, mielocitos y abastonados)/Neutrófilos totales;
Notar que las unidades están en mg/dL, no mg/L, se debe hacer la conversión; DS: desviación estándar.
La sepsis probable y la sepsis posible han sido agrupadas bajo el nombre de “sepsis definida clínicamente” o “sepsis presuntiva”. Sin embargo, consideramos que mantener ambas definiciones (probable y posible) permite tener una definición final más real, con gradientes de certeza, y por tanto, una mejor vigilancia epidemiológica.
Los Staphylococcus Coagulasa Negativo (CoNS) o Staphylococcus no-aureus son la principal causa de sepsis neonatal tardía (7)(8). Sin embargo, estos patógenos pertenecen a la flora normal de la piel y son un contaminante frecuente de los hemocultivos. Diferenciar una verdadera infección de una contaminación puede ser difícil, sobretodo en este grupo etáreo; por lo que se han publicado diversos criterios para definir sepsis en caso de aislar este patógeno en el hemocultivo (28)(29). Para considerar un episodio como sepsis confirmada es necesario aislar el mismo CoNS en dos hemocultivos; o en un hemocultivo y un cultivo de un sitio normalmente estéril (líquido cefaloraquídeo, líquido articular, líquido pleural, etc.); o en un hemocultivo y adicionalmente tener una PCR elevada. En caso de no cumplirse estos criterios, si el paciente recibió terapia antiestafilococica por más de 5 días se considera una sepsis probable. Esto último basado en las definiciones y recomendaciones de la red de investigación neonatal del Instituto Nacional de Salud de los Estados Unidos (NICHD Neonatal Research Network) (14).
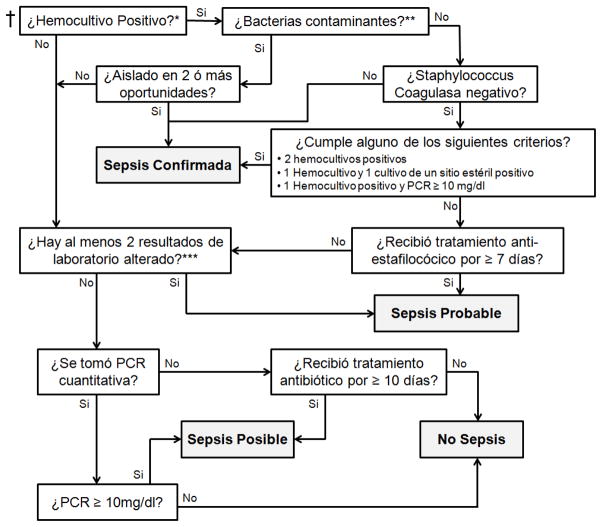
Propuesta de un algoritmo de vigilancia diagnóstica
Con el objetivo de facilitar el diagnóstico final de esta patología y homogenizar su definición proponemos un algoritmo diagnóstico para sepsis neonatal tardía en el Perú y países de la región (Figura 1). En la elaboración de este algoritmo se buscó especialmente que sirva para identificar aquellos episodios que no corresponden a sepsis de manera que el diagnóstico sea más específico, evitando calificar otras patologías como “sepsis”. El formato de algoritmo permite que su uso sea rápido y sencillo, simplificando su implementación. Cabe mencionar que el objetivo de este algoritmo es que sea una herramienta de utilidad para consideraciones estadísticas y de vigilancia, no es un algoritmo de manejo del paciente con sospecha de sepsis.
Figura 1. Algoritmo para definición de sepsis neonatal.
†Inicio del Algoritmo: se inicia luego de identificada una sospecha de sepsis, por presentación clínica o hallazgos de laboratorio.
* En caso no se tomó hemocultivo, se considerará como hemocultivo negativo y se proseguirá con el algoritmo para terminar si se trata de un episodio de sepsis probable o posible.
** Se consideran bacterias contaminantes: Corynebacterium, Propionibacterium, Penicillium o Diphtheroides
***Para este criterio se considera cualquiera de los siguientes resultados: Lactato en plasma > 3 mmol/L, Leucocitos > 34,000 × 109/L, Leucocitos < 5,000 × 109/L, Neutrófilos inmaduros > 10%, Relación de neutrófilos inmaduros/totales > 0.2, Trombocitopenia < 100,000 × 109/L, Proteína C-reactiva (PCR) >10 mg/dL y Procalcitonina > 8.1 mg/dL o 2 DS por encima del valor normal.
El algoritmo está diseñado para ser utilizado de forma retrospectiva luego de cada sospecha de sepsis. Estas sospechas se refieren a episodios en los que el neonato presenta signos clínicos de sepsis, o en ocasiones alteraciones de laboratorio sugerentes de sepsis, y en los que generalmente se decide iniciar antibióticos. Se inicia evaluando los signos clínicos compatibles con sepsis. Se procede con la revisión del resultado del hemocultivo buscando definir los episodios de sepsis confirmada. Si no cumple criterios para esto, se analizan los resultados de laboratorio y se evalúa el tiempo de terapia antibiótica recibida para definir el grado de certeza del diagnóstico y clasificarlo como sepsis probable o posible. Finalmente, los episodios que no cumplen criterios para estas categorías son considerados sepsis descartadas.
Este algoritmo se elaboró en base a los criterios de Haque (27) y los criterios para definir sepsis en caso de aislar un Staphylococcus Coagulasa Negativo(14,15). Además, se hicieron algunas modificaciones para adaptarlas a nuestro medio. La PCR cuantitativa es muy importante en las definiciones de Haque (8), sin embargo muchas de las UCI neonatales en Perú no tienen acceso a esta prueba, sólo cuentan con PCR cualitativa o los pacientes no tienen los recursos para pagarla. Si esta prueba no se encuentra disponible hemos considerado el uso de antibióticos sistémicos por más de 10 días (tiempo mínimo sugerido para el tratamiento de sepsis neonatal) como un criterio de sepsis posible ya que indica una alta sospecha por parte del equipo tratante. Otra modificación fue aumentar a 7 días (en lugar de 5) (29)el tiempo de terapia antiestafilococica requerido para clasificar como sepsis probable a una infección por Staphylococcus Coagulasa Negativo. Esto fue debido al elevado uso de antibióticos y por tiempos más prolongados en las UCI neonatales en nuestro país. Si bien el tiempo de cobertura antibiótica podría ser considerado un criterio arbitrario, su importancia radica en la falta de disponibilidad de pruebas de laboratorio indispensables para la definición final de esta patología y la demora en suspender antibióticos en nuestro medio cuando la sospecha no corresponde a un caso de sepsis. Este algoritmo no busca reemplazar el criterio del neonatólogo sino servir como una herramienta para homogenizar criterios. Si existe otro diagnóstico que explique mejor el cuadro que presenta el paciente, se puede modificar el diagnóstico final del algortimo.
Este algoritmo ha sido utilizado a la fecha en más de 150 sospechas de sepsis como parte de un ensayo clínico que se está llevando a cabo en recién nacido prematuros en tres UCI neonatales de Lima. Cada caso fue discutido con el equipo de médicos tratantes y hemos observado que su aplicación es sencilla, habiendo permitido homogenizar las definiciones de sepsis neonatal en las tres sedes. De todas las sospechas evaluadas, se encontró que 56% no correspondían a un episodio de sepsis neonatal. De los episodios que fueron clasificados como sepsis, 36% resultaron sepsis confirmada, 54% sepsis probable y 10% sepsis posible. Llama la atención que más de la mitad de los episodios inicialmente calificados como “sepsis” no hayan cumplido criterios luego de la evaluación retrospectiva. Sin embargo, esto es similar a lo que ha ocurrido en otros países al implementar protocolos de diagnóstico en sepsis neonatal (30).
Conclusiones
Dado que la sensibilidad del hemocultivo es baja para confirmar los casos de sospecha de sepsis neonatal proponemos el uso de este algoritmo diagnóstico. Su uso permitirá facilitar la clasificación de los casos de sepsis neonatal, diferenciarlos de patologías con presentaciones clínicas similares y homogenizar el diagnóstico de sepsis entre diferentes instituciones. Sin embargo, cabe recalcar que este es un algoritmo de evaluación retrospectiva de los casos y no busca reemplazar el criterio clínico del médico tratante, por lo que cada caso debe ser individualizado.
El uso de este algoritmo diagnóstico permitirá tener tasas más reales de sepsis neonatal y por lo tanto una visión más exacta del impacto de esta patología en nuestro medio y otros países de la región. Esto permitirá evaluar los factores que puedan estar favoreciendo el desarrollo de sepsis en las diferentes instituciones (uso inapropiado de antibióticos, falta de personal, personal poco capacitado, falta de cumplimiento de las medidas de bioseguridad, realización inadecuada de procedimientos invasivos, etc.) y plantear estrategias para corregir estas deficiencias y mejorar la calidad de atención a nuestros pacientes.
Acknowledgments
Fuentes de financiamiento
National Institute of Child Health & Human Development (5R01HD067694), USA
Footnotes
Conflicto de interés
Los autores de este manuscrito declaran no tener ninguna relación económica o institucional relevante a los resultados de este estudio.
Bibliografía
- 1.United Nations. The Millennium Development Goals Report 2013. New York, USA: 2013. Disponible en: www.un.org/millenniumgoals/pdf/report-2013/mdg-report-2013-english.pdf. [Google Scholar]
- 2.Liu L, Johnson HL, Cousens S, Perin J, Scott S, Lawn JE, et al. Global, regional, and national causes of child mortality: an updated systematic analysis for 2010 with time trends since 2000. The Lancet. 2012;379(9832):2151–61. doi: 10.1016/S0140-6736(12)60560-1. [DOI] [PubMed] [Google Scholar]
- 3.United Nations Children’s Fund (UNICEF) Committing to Child Survival: A Promise Renewed – Progress Report 2013. New York, USA: 2013. Disponible en: http://www.unicef.org/publications/index_70354.html. [Google Scholar]
- 4.World Health Organization (WHO) Levels and trends in child mortality Report 2013. Geneva, Suiza: 2013. Disponible en: http://www.who.int/maternal_child_adolescent/documents/levels_trends_child_mortality_2013/en/ [Google Scholar]
- 5.Thaver D, Zaidi AKM. Burden of neonatal infections in developing countries: a review of evidence from community-based studies. Pediatr Infect Dis J. 2009;28(1):S3–9. doi: 10.1097/INF.0b013e3181958755. [DOI] [PubMed] [Google Scholar]
- 6.Ministerio de Salud (MINSA) Boletin Epidemiologico N° 16. Lima, Perú: 2013. Disponible en: http://www.dge.gob.pe/boletines/2013/16.pdf. [Google Scholar]
- 7.Shane AL, Stoll BJ. Neonatal sepsis: Progress towards improved outcomes. J Infect. 2013;68(1):S24–32. doi: 10.1016/j.jinf.2013.09.011. [DOI] [PubMed] [Google Scholar]
- 8.Camacho-Gonzalez A, Spearman PW, Stoll BJ. Neonatal Infectious Diseases. Pediatr Clin North Am. 2013;60(2):367–89. doi: 10.1016/j.pcl.2012.12.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Benitz WE, Han MY, Madan A, Ramachandra P. Serial serum C-reactive protein levels in the diagnosis of neonatal infection. Pediatrics. 1998;102(4):E41. doi: 10.1542/peds.102.4.e41. [DOI] [PubMed] [Google Scholar]
- 10.Hengst JM. The role of C-reactive protein in the evaluation and management of infants with suspected sepsis. Adv Neonatal Care. 2003;3(1):3–13. doi: 10.1053/adnc.2003.50010. [DOI] [PubMed] [Google Scholar]
- 11.Mussap M, Cibecchini F, Noto A, Fanos V. In search of biomarkers for diagnosing and managing neonatal sepsis: the role of angiopoietins. J Matern Fetal Neonatal Med. 2013;26(S2):24–6. doi: 10.3109/14767058.2013.830411. [DOI] [PubMed] [Google Scholar]
- 12.Fischer JE, Bachmann LM, Jaeschke R. A readers’ guide to the interpretation of diagnostic test properties: clinical example of sepsis. Intensive Care Med. 2003;29(7):1043–51. doi: 10.1007/s00134-003-1761-8. [DOI] [PubMed] [Google Scholar]
- 13.Brown DR, Kutler D, Rai B, Chan T, Cohen M. Bacterial concentration and blood volume required for a positive blood culture. J Perinatol Off J Calif Perinat Assoc. 1995;15(2):157–9. [PubMed] [Google Scholar]
- 14.Wiswell TE, Hachey WE. Multiple site blood cultures in the initial evaluation for neonatal sepsis during the first week of life. Pediatr Infect Dis J. 1991;10(5):365–9. doi: 10.1097/00006454-199105000-00004. [DOI] [PubMed] [Google Scholar]
- 15.Kasper DC, Altiok I, Mechtler TP, Böhm J, Straub J, Langgartner M, et al. Molecular Detection of Late-Onset Neonatal Sepsis in Premature Infants Using Small Blood Volumes: Proof-of-Concept. Neonatology. 2013;103(4):268–73. doi: 10.1159/000346365. [DOI] [PubMed] [Google Scholar]
- 16.Tripathi N, Cotten CM, Smith PB. Antibiotic use and misuse in the neonatal intensive care unit. Clin Perinatol. 2012;39(1):61–8. doi: 10.1016/j.clp.2011.12.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Alexander VN, Northrup V, Bizzarro MJ. Antibiotic exposure in the newborn intensive care unit and the risk of necrotizing enterocolitis. J Pediatr. 2011;159(3):392–7. doi: 10.1016/j.jpeds.2011.02.035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Cotten CM, Taylor S, Stoll B, Goldberg RN, Hansen NI, Sánchez PJ, et al. Prolonged duration of initial empirical antibiotic treatment is associated with increased rates of necrotizing enterocolitis and death for extremely low birth weight infants. Pediatrics. 2009;123(1):58–66. doi: 10.1542/peds.2007-3423. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Cotten CM, McDonald S, Stoll B, Goldberg RN, Poole K, Benjamin DK, Jr, et al. The association of third-generation cephalosporin use and invasive candidiasis in extremely low birth-weight infants. Pediatrics. 2006;118(2):717–22. doi: 10.1542/peds.2005-2677. [DOI] [PubMed] [Google Scholar]
- 20.Gray JW. Surveillance of infection in neonatal intensive care units. Early Hum Dev. 2007;83(3):157–63. doi: 10.1016/j.earlhumdev.2007.01.006. [DOI] [PubMed] [Google Scholar]
- 21.Bone RC. Toward an epidemiology and natural history of SIRS (systemic inflammatory response syndrome) JAMA J Am Med Assoc. 1992;268(24):3452–5. [PubMed] [Google Scholar]
- 22.Hayden WR. Sepsis terminology in pediatrics. J Pediatr. 1994;124(4):657–8. doi: 10.1016/s0022-3476(05)83159-2. [DOI] [PubMed] [Google Scholar]
- 23.Goldstein B, Giroir B, Randolph A International Consensus Conference on Pediatric Sepsis. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med J Soc Crit Care Med World Fed Pediatr Intensive Crit Care Soc. 2005;6(1):2–8. doi: 10.1097/01.PCC.0000149131.72248.E6. [DOI] [PubMed] [Google Scholar]
- 24.Hofer N, Zacharias E, Müller W, Resch B. Performance of the definitions of the systemic inflammatory response syndrome and sepsis in neonates. J Perinat Med. 2012;40(5):587–90. doi: 10.1515/jpm-2011-0308. [DOI] [PubMed] [Google Scholar]
- 25.Ramasamy S, Biswal N, Bethou A, Mathai B. Comparison of two empiric antibiotic regimen in late onset neonatal sepsis--a randomized controlled trial. J Trop Pediatr. 2014;60(1):83–86. doi: 10.1093/tropej/fmt080. [DOI] [PubMed] [Google Scholar]
- 26.Tsai MH, Chu SM, Lee CW, Hsu JF, Huang HR, Chiang MC, et al. Recurrent late-onset sepsis in the neonatal intensive care unit: incidence, clinical characteristics and risk factors. Clin Microbiol Infect. 2014 doi: 10.1111/1469-0691.12661. [DOI] [PubMed] [Google Scholar]
- 27.Haque KN. Definitions of bloodstream infection in the newborn. Pediatr Crit Care Med J Soc Crit Care Med World Fed Pediatr Intensive Crit Care Soc. 2005;6(3):S45–49. doi: 10.1097/01.PCC.0000161946.73305.0A. [DOI] [PubMed] [Google Scholar]
- 28.Marchant EA, Boyce GK, Sadarangani M, Lavoie PM. Neonatal Sepsis due to Coagulase-Negative Staphylococci. Clin Dev Immunol. 2013;2013:1–10. doi: 10.1155/2013/586076. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Stoll BJ, Hansen N, Fanaroff AA, Wright LL, Carlo WA, Ehrenkranz RA, et al. Late-onset sepsis in very low birth weight neonates: the experience of the NICHD Neonatal Research Network. Pediatrics. 2002;110(2 Pt 1):285–91. doi: 10.1542/peds.110.2.285. [DOI] [PubMed] [Google Scholar]
- 30.Guedes Pinto MCF, Bueno AC, Vieira AA. Implementation of a protocol proposed by the Brazilian National Health Surveillance Agency for antibiotic use in very low birth weight infants. J Pediatr (Rio J) 2013;89(5):450–5. doi: 10.1016/j.jped.2013.01.009. [DOI] [PubMed] [Google Scholar]