Abstract
OBJECTIVE:
To assess possible factors associated with the loss of antibodies to hepatitis A 7 years after the primary immunization in children of HIV-infected mothers and the response to revaccination in patients seronegative for hepatitis A.
METHODS:
Quantification of HAV antibodies by electrochemiluminescence was performed in 39 adolescents followed up at the Pediatric Aids Clinic of Federal University of São Paulo (Unifesp): 29 HIV-infected (HIV group) (median age: 12.8 years) and 10 HIV-exposed but non-infected (ENI group) (median age: 13.4 years). All of them received two doses of HAV vaccine (Havrix(r)) in 2002.
RESULTS:
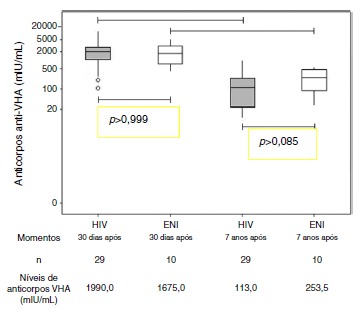
The median age at primary immunization (PI) was 5.4 years for HIV group and 6.5 years for ENI group. All children, from both groups, had antibodies to HAV >20 mIU/mL after PI. Seven years later, the ENI group showed a median concentration of antibodies = 253.5 mIU/mL, while the HIV group = 113.0 mIU/mL (Mann-Whitney test, p=0.085). All ENI group and 23/29 (79.3%) from HIV group mantained HAV antibodies 7 years after PI. The levels of hepatitis A antibodies in the primary vaccination were the only factor independently associated with maintaining these antibodies for 7 years. The group that lost HAV seropositivity was revaccinated and 83.3% (5/6) responded with antibodies >20 mUI/mL.
CONCLUSIONS:
The antibodies levels acquired in the primary vaccination in the HIV group were the main factor associated with antibodies loss after HAV immunization.
Keywords: HIV, Adolescent and children, Hepatitis A vaccine, Immunossupression
Introduction
In recent years, advances in the diagnosis, treatment, and clinical and laboratory monitoring of the infection by the human immunodeficiency virus (HIV) in children have allowed longer survival and better quality of life for this population.1 , 2 In this sense, it is important to vaccinate HIV-infected children who will reach adulthood and monitor the maintenance of antibodies after vaccination.
To monitor and revaccinate HIV-infected patients when necessary can prevent vaccine-preventable disease outbreaks in this population.3 To protect adolescents infected with HIV against infection by the hepatitis A virus (HAV) is need, considering that the HIV/HAV coinfection can influence the clinical course of hepatitis A4 and be associated with an increase in HIV replication.5 , 6 Additionally, during adolescence, these individuals are more prone to liver disorders when exposed to sexually-transmitted diseases (STDs), prolonged use of antiretroviral drugs and opportunistic conditions.
A previous study carried out in the Service Center of the Division of Pediatric Infectious Diseases of Universidade Federal de São Paulo (CEADIPe/UNIFESP)7 showed that two doses of vaccine against hepatitis A, in addition to being well tolerated, resulted in an antibody titer >20 mUI/mL in children with perinatal HIV exposure, both infected ones and those exposed and non-infected (ENI).
The objective of this study was to analyze the persistence of antibodies against HAV seven years after the primary immunization and possible associated factors, as well as the response to revaccination of children and adolescents with perinatal exposure to HIV.
Method
This is a prospective cohort study with intervention, carried out between December 2009 and January 2011 in the Service Center of the Discipline of Pediatric Infectious Diseases (CEADIPe) of Universidade Federal de São Paulo (UNIFESP) and approved by the Institutional Review Board of Hospital São Paulo/Universidade Federal de São Paulo (UNIFESP). The free and informed consent form was signed by parents or guardians of all adolescents included in the study (CEP 1710/06).
A previous study on seroprevalence carried out at the Service identified children and adolescents who were seronegative for hepatitis A,8 who received two doses of the hepatitis A vaccine (Havrix; Glaxo SmithKline Beecham, Rixensart, Belgium) between 2002 and 2003, with a six months interval between doses.7 At the time of primary immunization,7 only those infected with HIV through vertical transmission were included; and the following were excluded from the study: patients who had serological evidence of previous infection with hepatitis viruses A, B or C, the ones who had received immunoglobulin in the previous six months, those who were using immunosuppressive drugs, or HIV-infected children who belonged to the clinical category C and immunological category 3.
Of the 32 HIV-infected patients who received primary immunization,7 two were not currently undergoing regular monitoring at the service, and one received an additional dose of hepatitis A vaccine. Thus, a total of 29 patients infected with HIV (HIV Group) were included in this study. Of the 27 patients exposed to HIV who were non-infected and received primary immunization,7 only 10 (ENI Group) are being followed at the service and were included in the present study. Hence, 39 of these subjects who were regularly followed at the service were included.
Clinical data of patients were obtained from the review of medical records: clinical and immunological category for HIV infection (CDC 1994)9; weight and height measurements used to calculate the Z-score for body mass index (BMI z-score) and z-scores for height/age (H/A z-scores) according to the reference standards and recommendations by the World Health Organization10; clinical events; hospitalizations, and age at start of antiretroviral therapy prescribed to the HIV Group.
As part of the routine clinical follow-up, patients in the HIV group underwent assessment of CD4+ T lymphocyte count and viral load (VL) of HIV every four months. CD4+ T cells were assessed by flow cytometry (FACS Calibur, BD Biosciences, Franklin Lakes, USA). The HIV viral load quantification was performed through RT-PCR (Cobas Amplicor) HIV-1 Monitor kit (Roche Diagnostics System, Basel, Switzerland) and Bayer Versant human immunodeficiency virus type 1 (HIV-1) RNA 3.0 (B-DNA) (Bayer, Tarrytown, New York). The following data were collected: CD4 + T lymphocyte count and HIV viral load quantification 30 days after primary vaccination and seven years later.
Quantification of total antibodies against HAV was performed using electrochemiluminescence by means of a commercial Elecsys Anti-HAV kit (Roche Diagnostics, Indianapolis, USA) seven years after the primary immunization. Plasma samples with antibody concentrations ≥20mIU/mL were considered positive, and those <20 mIU/mL were considered negative. A new measurement of hepatitis A antibodies was performed by electrochemiluminescence in stored samples related to 30 days after the primary vaccination (seven years before).
All patients with antibody concentration <20 mIU/mL for HAV received two doses of the same vaccine used in the primary vaccination seven years before (Havrix), administered intramuscularly with an interval of six months between doses.
The statistical analysis for categorical variables was performed using the chi-square test, and the Mann-Whitney test was used for the quantitative ones. Factors associated with maintenance of hepatitis A antibodies >20 IU/mL were analyzed using uniand multivariate logistic regression. Thus, in search of possible factors that could differentiate patients from the HIV Group who lost their HAV seropositivity (anti-HAV antibodies <20 mIU/mL) during the period, from the ones who kept the seropositivity, some clinical, virological, and immunological events were assessed. The calculation of the odds ratio was performed using logarithmic transformation for the variables CD4+ T lymphocyte count, HIV viral load and quantification of HAV antibodies. Considering the sample size (n=29), the multivariate model could have a maximum of two explanatory variables, in addition to the adjustment constant of the model. Thus, to verify which variables were independently associated to the response, we adjusted the models containing a maximum of two of the following variables: CD4+ T lymphocyte count in the primary vaccination (CD4 PV), CD4+ T lymphocyte count seven years after the primary vaccination (CD4 7 years after PV), viral load seven years after the primary vaccination (VL 7 years after PV), episode of herpes zoster, and hepatitis A antibodies after the primary vaccination (HAV AB after PV). The variables VL seven years after the PV and HAV AB after PV were included in the adjustment as numerical variables, since in the univariate analysis, VL seven years after PV produced no adjustment in the Odds Ratio when categorized, and HAV AB after PV showed wide confidence interval when categorized. The level of statistical significance was set at p<0.05. Statistical analysis was performed using the Statistical Package for Social Sciences 16.0 (SPSS Inc. Chicago, IL, USA).
Results
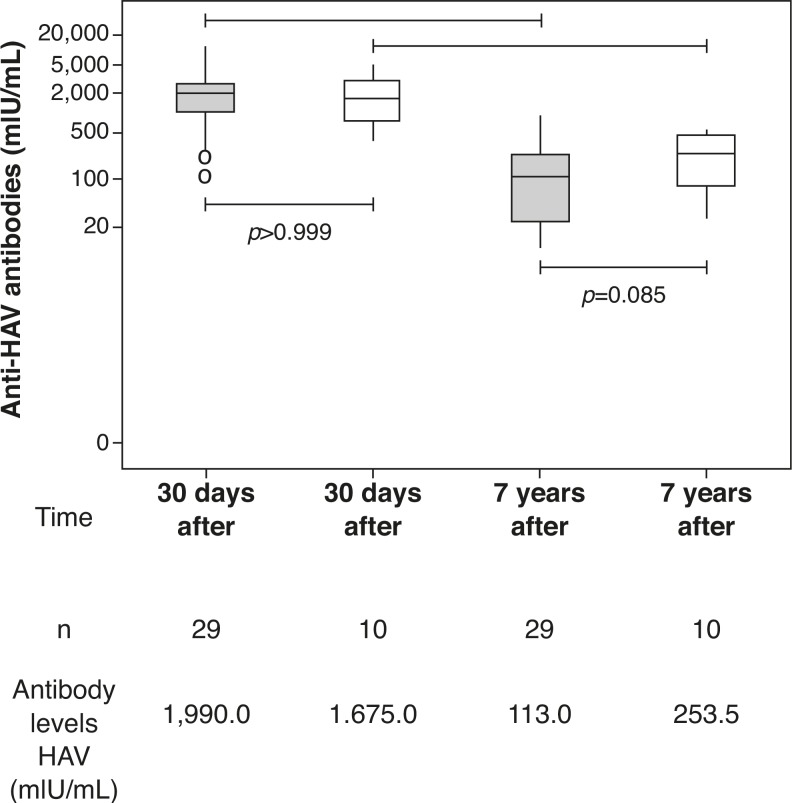
Both groups were similar regarding age, H/A z-score, and BMI z-score (Table 1). All individuals in the ENI group, and 23/29 of individuals from the HIV group were seropositive for hepatitis A (HAV antibodies ≥20 mIU/mL) (Table 1). The levels of HAV antibodies showed no statistically significant differences between the two groups seven years after the primary immunization (HIV Group: 113.0 mIU/mL and ENI Group: 253.5mIU/mL; Mann-Whitney test, p=0.08). Both groups (HIV and ENI) showed significant decrease in the levels of HAV antibodies seven years after the primary vaccination (Fig. 1).
Table 1. Characterization of the study population.
| Characterization of Patients | HIV Group (n=29) | ENI Group (n=10) | p |
|---|---|---|---|
| Age in years [median (min; max)] | 12.8 (9.7; 16.8) | 13.4 (10.9; 16.9) | 0.64 |
| Female gender (%) | 48 | 30 | 0.31 |
| E/I Z-score [median (min; max)] | –0.47 (–2.21; +1.44) | +0.12 (–1.60; +1.28) | 0.08 |
| BMI Z-score [median (min; max)] | –0.10 (–2.64; +1.70) | –0.29 (–1.31; +1.64) | >0.99 |
| Immune patients 7 years after PV (%) | 79 | 100 | 0.17 |
PV, primary vaccination.
Figure 1. Hepatitis A Antibodies in HIV Group and ENI Group 30 days and 7 years after primary immunization.
The following events showed a statistically significant difference between the groups in the univariate analysis: number of patients with herpes zoster, antibody levels 30 days after the primary vaccination, CD4 + T lymphocytes at the primary vaccination and after seven years (Table 2). In the multivariate model, the only variable that was independently associated with the maintenance of hepatitis A antibodies >20 mIU/mL was the level of hepatitis A antibodies assessed 30 days after the primary vaccination, whether the assessment was quantitative or categorized (antibodies > or <1,000 mUI/mL).
Table 2. Univariate analysis of the HIV group according to maintenance of HAV antibodies 7 years after primary vaccination (HAV seropositive) and loss of HAV antibodies 7 years after primary vaccination (HAV seronegative).
| HIV Group | Odds Ratio | 95%CI | p-value | |||
|---|---|---|---|---|---|---|
| Seropositive | Seronegative | |||||
| VHA (n=23) | VHA (n=6) | |||||
| Age at PV | 0.924 | |||||
| ≤5.5 years | 12 (52.2%) | 3 (50.0%) | 1.09 | 0.18-6.58 | ||
| >5.5 years | 11 (47.8%) | 3 (50.0%) | 1.00 | |||
| Age at PV (years) | 0.655 | |||||
| Median (Min-Max) | 5.1 (1.9-9.3) | 6.0 (3.2-9.0) | 0.88 | 0.56-1.39 | ||
| CD4 PV | 0.049 | |||||
| ≤1,000 | 5 (21.7%) | 4 (66.7%) | 1.00 | |||
| >1,000 | 18 (78.3%) | 2 (33.3%) | 7.20 | 1.01-51.39 | ||
| CD4 PV | 0.023 | |||||
| Median (Min-Max) | 1,488 (629-2,717) | 689 (572-1,501) | 21.69 | 1.53-308.25 | ||
| CD4 7 years after PV | 0.026 | |||||
| ≤500 | 6 (26.1%) | 5 (83.3%) | 1.00 | |||
| >500 | 17 (73.9%) | 1 (16.7%) | 14.17 | 1.37-147.07 | ||
| CD4 7 years after PV | 0.018 | |||||
| Median (Min-Max) | 634 (188-1,295) | 200 (9-737) | 13.09 | 1.57-109.39 | ||
| VL PV | 0.137 | |||||
| ≤400 | 9 (39.1%) | 0 (0.0%) | NE | NE | ||
| >400 | 14 (60.9%) | 6 (100.0%) | ||||
| VL PV | 0.244 | |||||
| Median (Min-Max) | 700 (200-84,000) | 1500 (760-24,000) | 0.78 | 0.51-1.19 | ||
| VL 7 years after PV | 0.295 | |||||
| ≤50 | 6 (27.1%) | 0 (0.0%) | NE | NE | ||
| >50 | 17 (73.9%) | 6 (100.0%) | ||||
| VL 7 years after PV | 0.095 | |||||
| Median (Min-Max) | 1,277 (25-94,250) | 14,004 (147-58,078) | 0.68 | 0.43-1.07 | ||
| Clinical Cat. PV | 0.497 | |||||
| N or A | 15 (65.2%) | 3 (50.0%) | 1.88 | 0.31-11.52 | ||
| B | 8 (34.8%) | 3 (50.0%) | 1.00 | |||
| Clinical Cat. after 7 years | 0.655 | |||||
| N or A | 10 (43.5%) | 2 (33.3%) | 1.54 | 0.23-10.15 | ||
| B or C | 13 (56.5%) | 4 (66.7%) | 1.00 | |||
| Imunol Cat. PV | 0.509 | |||||
| 1 | 7 (30.4%) | 1 (16.7%) | 2.19 | 0.21-22.34 | ||
| 2 or 3 | 16 (69.6%) | 5 (83.3%) | 1.00 | |||
| Imunol Cat. after 7 years | 0.634 | |||||
| 1 | 6 (26.1%) | 1 (16.7%) | 1.77 | 0.17-18.32 | ||
| 2 or 3 | 17 (73.9%) | 5 (83.3%) | 1.00 | |||
| Zoster | 0.005 | |||||
| Absent | 22 (95.7%) | 2 (33.3%) | 44.00 | 3.18-608.16 | ||
| Present | 1 (4.3%) | 4 (66.7%) | 1.00 | |||
| Age at ART start | 0.193 | |||||
| Median (Min-Max) | 1.7 (0.1-5.6) | 3.2 (1.7-4.3) | 0.67 | 0.36-1.23 | ||
| HAV AB after PV | 0.008 | |||||
| Median (Min-Max) | 2,070 (269-10,260) | 296 (103-1,175) | 9.04 | 1.77-46.21 | ||
| HAV AB after PV | 0.003 | |||||
| <1000 | 2 (8.7%) | 5 (83.3%) | 1.00 | |||
| ≥1000 | 21 (91.3%) | 1 (16.7%) | 52.50 | 3.93-700.53 | ||
NE, not estimable; PV, Primary vaccination for A hepatitis; VL, viral load; CD4, TCD4+ Lymphocytes; AB, Antibodies; Cat, category; Imunol, immunological; ART, antiretroviral therapy and HAV-Hepatitis A virus.
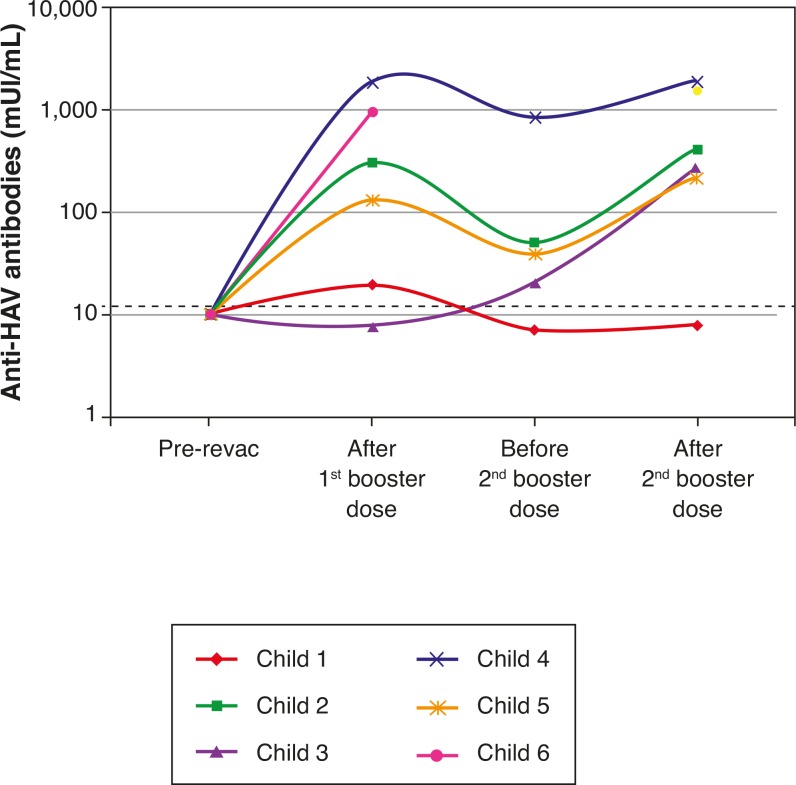
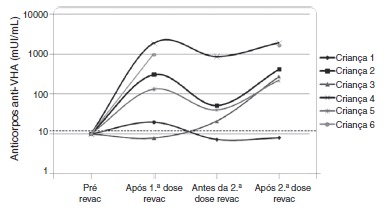
The six patients who lost their seropositivity for HAV were revaccinated with two doses of vaccine against hepatitis A (Havrix), and five responded with antibody concentrations >20 mUI/mL. HAV-antibody levels are shown in Figure 2 at the following times: one month after the 1st booster dose, immediately before the 2nd booster dose, and one month after the 2nd booster dose.
Figure 2. Dynamics of plasma levels of hepatitis A antibodies after revaccination in 6 patients from the HIV group without protective antibody levels seven years after primary immunization. Note: the sample from child #6 immediately before the 2nd booster dose was lost.
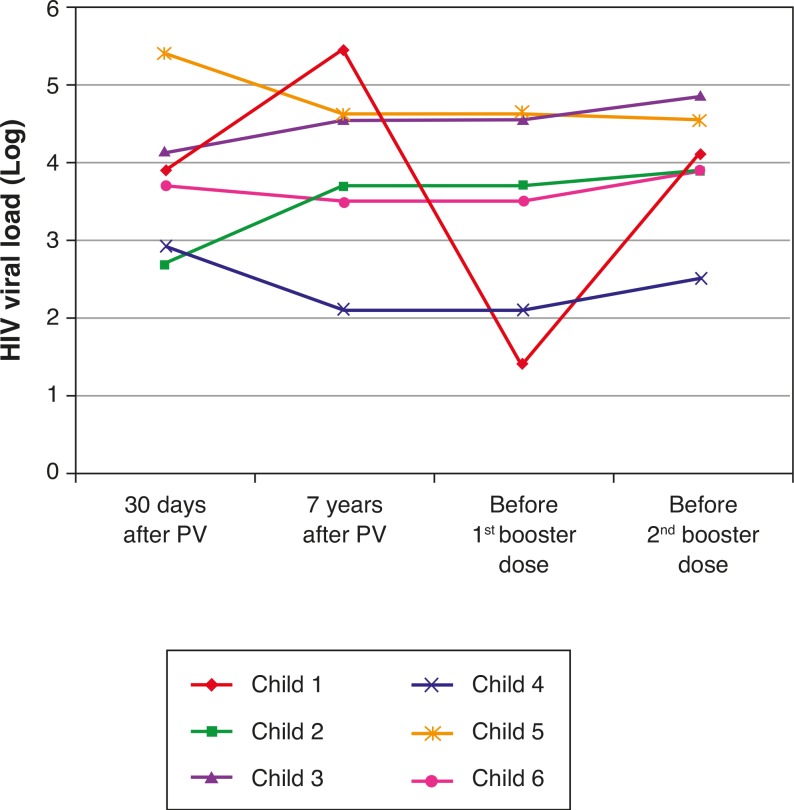
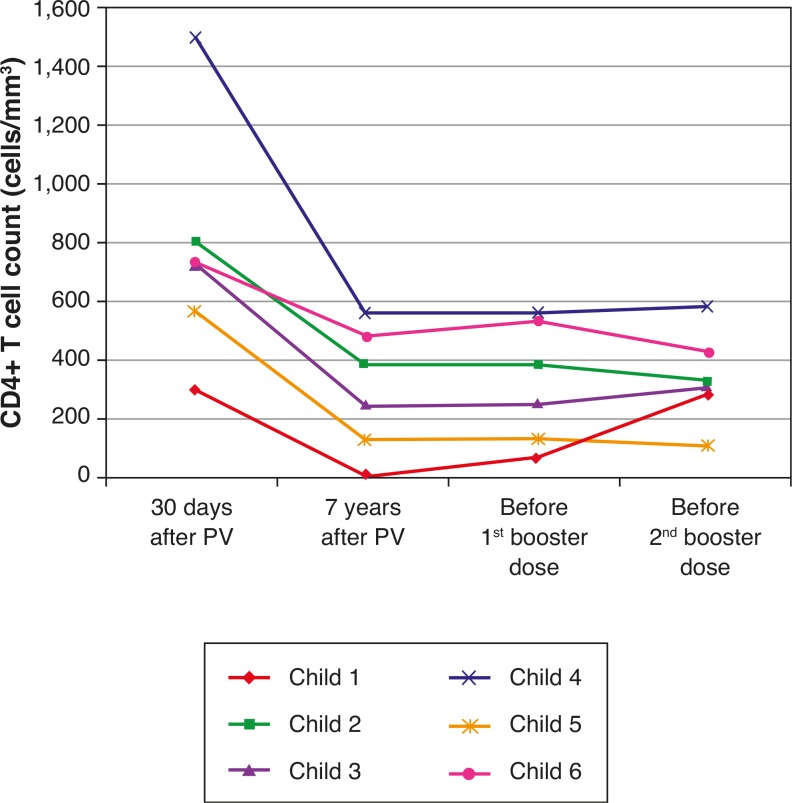
Table 3 and Figures 3 and 4 show clinical, virological, and immunological features of patients who lost seropositivity for hepatitis A during this follow-up period of seven years.
Table 3. Clinical manifestations shown by children who did not maintain protective levels of hepatitis A antibodies seven years after vaccination. Patients Hospital.
| Patients | Hospital admissions | Pneumonia | Herpes Zoster | Upper respiratory tract infections | Chronic Otitis Media | Neurotoxoplasmosis | Others |
|---|---|---|---|---|---|---|---|
| 1 | 4 | 2 | 1 | >10 episodes | 2 | ||
| 2 | 2 | 1 | 1 | ||||
| 3 | 2 | 1 | |||||
| 4 | 1 | 0 | 1 | Parotitis/Gastritis | |||
| 5 | 1 | 1 | 1 | Diarrhea | |||
| 6 | 1 | Fractures |
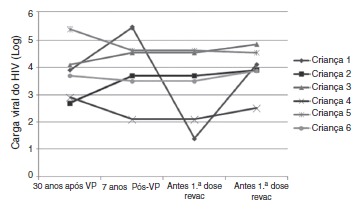
Figure 3. Evolution of viral load at four different moments: 30 days after primary vaccination (PV), seven years after PV, immediately before the 1st and 2nd booster dose (REVAC) in 6 patients from the HIV group who did not respond to revaccination.
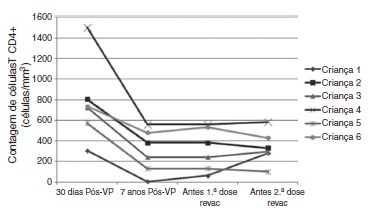
Figure 4. CD4+ T cell count evolution at four different time: 30 days after primary vaccination (PV), 7 years after PV, immediately before the 1st and 2nd booster doses (REVAC) in 6 patients from the HIV group who did not respond to revaccination.
Discussion
The HAV vaccine is known to be highly immunogenic in healthy individuals.11 , 12 Additionally, serum antibody levels remain for long periods after vaccination. Bian et al., in 2010, in China, assessed 110 healthy children vaccinated against HAV and obtained a geometric mean of 61.6 mIU/mL of antibodies, with antibody persistence in 99.1% of individuals 10 years after the immunization schedule.13
This study showed that 79% of adolescents and children infected with HIV through vertical transmission maintained the seropositivity against HAV seven years after the primary immunization schedule, with two vaccine doses. These results were similar, from a statistical point of view, when compared to the group of ten adolescents exposed to, but not infected by, HIV, where 100% maintained HAV seropositivity (Chi-square, p=0.174) (Table 1). Moreover, there was no statistical difference between the median antibody levels of the two groups seven years after the primary vaccination (Fig. 1). The impossibility of assessing all children immunized in the previous study7 may have been responsible for the lack of statistical significance between the two groups (type II error or b error).
However, it is worth mentioning that, for the final model (the one that showed only HAV AB after PV), the power obtained with α set at 5% was 98.6%, indicating that this model had high probability of detecting an actual difference between the groups.
Other groups have assessed the persistence of HAV antibodies for shorter periods than the one analyzed in the present study and included patients with severe immunosuppression. Rigaud et al.,14 in 2008, observed 72% of seroconversion four weeks after vaccination, with a decrease to 66% at week 52. Weinberg et al.,15 in 2009, showed a seroconversion of 97% at week 8 after vaccination, which decreased to 90% 18 months later. The group of HIV-infected patients studied here showed a decrease from 100% to 79% in the percentage of individuals with antibody levels ≥20 mIU/mL for HAV in seven years. There is evidence of a decrease in vaccination antibody levels to other antigens in the population of HIV-infected children,3 even when they received antiretroviral therapy and were revaccinated.16 The proportion of immune HIV-infected children decreased from 88% to 85% for measles, 84% to 61% for mumps, and 100% to 79% in the case of rubella, three years after revaccination.16 Choudhury and Matin,17 in 2013, evaluated the persistence of tetanus toxoid antibodies in 24 HIV-infected children and observed levels >0.1 IU/mL in 62% of infected children and 100% of controls. These authors also showed that 71% responded to revaccination with levels >0.16 IU/mL. They noted that HIV-infected children need a tetanus toxoid booster dose before the recommended revaccination time, which is 5-10 years.
Several factors seem to be involved in the response to vaccination and maintenance of antibody seropositivity in HIV-infected individuals. The immunological status18 , 19 and the HIV viral load20 at the time of vaccination are known to be important. Similarly, the clinical, immunological and virological course21 must influence the maintenance of vaccination antibody levels.
The presence of co-infection, such as hepatitis C, as well as male gender was associated with lower response to hepatitis A vaccine in adult HIV-infected patients.22 The maintenance of specific antibodies against vaccine antigens is associated with better maturation and preservation of B cell memory compartment when the combined antiretroviral therapy is started early in children.23 In the current study, children who lost hepatitis A antibodies started antiretroviral therapy at a later period, although this finding was not statistically significant (p=0.19).
Disease progression caused by HIV occurs even in patients receiving antiretroviral therapy and undergoing stringent clinical follow-up. The six patients who lost their seropositivity for HAV were the ones with the most severe clinical and immunological impairment during the period, and only 50% of them received antiretroviral therapy, although all of them had treatment indication. It is worth mentioning that, over the seven-year period, the following data were observed (Fig. 3): a) the viral load increased in patients 1 and 2; b) four patients (1, 3, 5 and 6) had clinical progression of the disease, aggravating their clinical category (CDC-1994); c) four patients (1, 2, 5 and 6) showed a worsening in immunosuppression, aggravating their immunological category (CDC-1994), and d) patients (2, 4 and 6), who had the highest concentrations of HAV antibodies after revaccination were the ones who had a higher CD4+ T cell count at the time of the primary immunization (Fig. 4). The only patient who did not respond to revaccination (patient 1 in Fig. 4) was the one with the highest number of clinical complications, with important nutritional impairment, decreased z-BMI and immunological impairment in the period after vaccination. It is noteworthy that, at the time of the 1st revaccination dose, this adolescent had an undetectable viral load, responding with an antibody concentration of 19.7mIU/mL for HAV. As he started to show evidence of HIV viral replication, the antibody titers for HAV decreased again (Fig. 2), even though he received a 2nd booster dose and showed an increase in CD4+T cell count (from 65 cells/mm3 to 285 cells/mm3 in the period between the 1st and 2nd revaccination doses).
The small number of sample subjects, particularly in the ENI Group, who typically abandon follow-up soon after their uninfected status is verified, and the great variability of data may have impaired the statistical analysis of our findings. Still, it was possible to demonstrate the importance of temporal monitoring of antibody levels after hepatitis A vaccine in HIV-infected patients.
Although all adolescents exposed and not infected with HIV remained seropositive for HAV, 21% of the HIV-infected adolescents lost the seropositivity for hepatitis A seven years after the primary immunization, particularly those with more clinical complications and more severe immunosuppression. However, it is encouraging to verify that revaccination determines antibody production response at levels >20 mIU/mL in most assessed patients. It is noteworthy that no other studies in the literature have shown the association between post-vaccination antibody titers and their persistence in the long term, or the possible association between clinical events and the maintenance of these antibodies.
To maintain protection against hepatitis B, there are national24 and international25 recommendations on the revaccination of immunosuppressed individuals who lost their antibodies. There is no such recommendation regarding hepatitis A, but the data shown here suggest that, for children and adolescents infected with HIV, antibody titer monitoring is necessary, and revaccination is advisable to maintain protective levels of antibodies. It is known that HIV-infected patients should be vaccinated as early as possible, at a time when immunological impairment has not occurred yet. It can be concluded, based on the multivariate analysis shown here, that the level of hepatitis A antibodies in the first vaccination is the only factor independently associated with the maintenance of these antibodies after a period of seven years. This association was also observed by Sharapov et al.26 A less intense response at the primary vaccination suggests an immunological impairment at this moment. Nevertheless, 83.3% of patients seronegative for hepatitis A responded to revaccination, although the duration of these antibodies is something to be studied in the future.
Acknowledgements
To Professor Adriana Sanudo for her help with the statistical analysis.
Funding Statement
Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) – 09/17275-7 - Research Support.
Footnotes
Funding Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) 09/17275-7 Research Support.
References
- 1.Brady MT, Oleske JM, Williams PL, Elgie C, Mofenson LM, Dankner WM, et al. Declines in mortality rates and changes in causes of death in HIV-1-infected children during the HAART era. J Acquir Immune Defic Syndr. 2010;53:86-94. [DOI] [PMC free article] [PubMed]; Brady MT, Oleske JM, Williams PL, Elgie C, Mofenson LM, Dankner WM. Declines in mortality rates and changes in causes of death in HIV-1-infected children during the HAART era. J Acquir Immune Defic Syndr. 2010;53:86–94. doi: 10.1097/QAI.0b013e3181b9869f. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Matida LH, Ramos AN Jr, Heukelbach J, Hearst N, Brazilian Study Group on Survival of Children with Aids. Continuing improvement in survival for children with acquired immunodeficiency syndrome in Brazil. Pediatr Infect Dis J. 2009;28:920-2. [DOI] [PubMed]; Matida LH, Ramos AN, Jr, Heukelbach J, Hearst N, Brazilian Study Group on Survival of Children with Aids Continuing improvement in survival for children with acquired immunodeficiency syndrome in Brazil. Pediatr Infect Dis J. 2009;28:920–922. doi: 10.1097/INF.0b013e3181a81b5d. [DOI] [PubMed] [Google Scholar]
- 3.Sutcliffe CG, Moss WJ. Do children infected with HIV receiving Haart need to be revaccinated? Lancet Infect Dis. 2010;10:630-42. [DOI] [PubMed]; Sutcliffe CG, Moss WJ. Do children infected with HIV receiving Haart need to be revaccinated. Lancet Infect Dis. 2010;10:630–642. doi: 10.1016/S1473-3099(10)70116-X. [DOI] [PubMed] [Google Scholar]
- 4.Costa-Mattioli M, Allavena C, Poirier AS, Billaudel S, Raffi F, Ferré V. Prolonged hepatitis A infection in an HIV-1 seropositive patient. J Med Virol. 2002;68:7-11. [DOI] [PubMed]; Costa-Mattioli M, Allavena C, Poirier AS, Billaudel S, Raffi F, Ferré V. Prolonged hepatitis A infection in an HIV-1 seropositive patient. J Med Virol. 2002;68:7–11. doi: 10.1002/jmv.10163. [DOI] [PubMed] [Google Scholar]
- 5.Ridolfo AL, Rusconi S, Antinori S, Balotta C, Galli M. Persisting HIV-1 replication triggered by acute hepatitis A virus infection. Antivir Ther. 2000;5:15-7. [PubMed]; Ridolfo AL, Rusconi S, Antinori S, Balotta C, Galli M. Persisting HIV-1 replication triggered by acute hepatitis A virus infection. Antivir Ther. 2000;5:15–17. [PubMed] [Google Scholar]
- 6.Gallego M, Robles M, Palacios R, Ruiz J, Nuño E, Márquez M, et al. Impact of acute hepatitis A virus (HAV) infection on HIV Viral Load in HIV-Infected patients and influence of HIV infection on acute HAV infection. J Int Assoc Physicians Aids Care (Chic). 2011;10:40-2. [DOI] [PubMed]; Gallego M, Robles M, Palacios R, Ruiz J, Nuño E, Márquez M. Impact of acute hepatitis A virus (HAV) infection on HIV Viral Load in HIV-Infected patients and influence of HIV infection on acute HAV infection. J Int Assoc Physicians Aids Care (Chic). 2011;10:40–42. doi: 10.1177/1545109710385692. [DOI] [PubMed] [Google Scholar]
- 7.Gouvea AF, De Moraes-Pinto MI, Ono E, Dinelli MI, Machado DM, Weckx LY, et al. Immunogenicity and tolerability of hepatitis A vaccine in HIV-infected children. Clin Infect Dis. 2005;41:544-8. [DOI] [PubMed]; Gouvea AF, De Moraes-Pinto MI, Ono E, Dinelli MI, Machado DM, Weckx LY. Immunogenicity and tolerability of hepatitis A vaccine in HIV-infected children. Clin Infect Dis. 2005;41:544–548. doi: 10.1086/432055. [DOI] [PubMed] [Google Scholar]
- 8.Gouvea AF, Moraes-Pinto MI, Machado DM, Carmo FB, Beltrao SC, Cunegundes KS, et al. The prevalence of hepatitis A antibodies in HIV exposed and/or infected children and adolescents. J Pediatr (Rio J). 2005;81:205-8. [DOI] [PubMed]; Gouvea AF, Moraes-Pinto MI, Machado DM, Carmo FB, Beltrao SC, Cunegundes KS. The prevalence of hepatitis A antibodies in HIV exposed and/or infected children and adolescents. J Pediatr (Rio J) 2005;81:205–208. doi: 10.2223/1337. [DOI] [PubMed] [Google Scholar]
- 9.Centers for Disease Control and Prevention. Revised classification system for human immunodeficiency virus infection in children less than 13 years of age. MMWR. 1994;43:1-10.; Centers for Disease Control and Prevention Revised classification system for human immunodeficiency virus infection in children less than 13 years of age. MMWR. 1994;43:1–10. [Google Scholar]
- 10.World Health Organization. The WHO child growth standards. Growth reference data for 5-19 years. Geneva: WHO; 2007.; World Health Organization . The WHO child growth standards.Growth reference data for 5-19 years. Geneva: WHO; 2007. [Google Scholar]
- 11.Abarca K, Ibánez I, Perret C, Vial P, Zinsou JA. Immunogenicity, safety, and interchangeability of two inactivated hepatitis A vaccines in Chilean children. Int J Infect Dis. 2008;12:270-7. [DOI] [PubMed]; Abarca K, Ibánez I, Perret C, Vial P, Zinsou JA. Immunogenicity, safety, and interchangeability of two inactivated hepatitis A vaccines in Chilean children. Int J Infect Dis. 2008;12:270–277. doi: 10.1016/j.ijid.2007.08.006. [DOI] [PubMed] [Google Scholar]
- 12.Bell BP, Negus S, Fiore AE, Plotnik J, Dhotre KB, Williams J, et al. Immunogenicity of an inactivated hepatitis A vaccine in infants and young children. Pediatr Infect Dis J. 2007;26:116-22. [DOI] [PubMed]; Bell BP, Negus S, Fiore AE, Plotnik J, Dhotre KB, Williams J. Immunogenicity of an inactivated hepatitis A vaccine in infants and young children. Pediatr Infect Dis J. 2007;26:116–122. doi: 10.1097/01.inf.0000253253.85640.cc. [DOI] [PubMed] [Google Scholar]
- 13.Bian GL, Ma R, Dong HJ, Ni HX, Hu FJ, Chen YR, et al. Long-term clinical observation of the immunogenicity of inactivated hepatitis A vaccine in children. Vaccine. 2010;28:4798-801. [DOI] [PubMed]; Bian GL, Ma R, Dong HJ, Ni HX, Hu FJ, Chen YR. Long-term clinical observation of the immunogenicity of inactivated hepatitis A vaccine in children. Vaccine. 2010;28:4798–4801. doi: 10.1016/j.vaccine.2010.04.096. [DOI] [PubMed] [Google Scholar]
- 14.Rigaud M, Borkowsky W, Muresan P, Weinberg A, Larussa P, Fenton T, et al. Impaired immunity to recall antigens and neoantigens in severely immunocompromised children and adolescents during the first year of effective highly active antiretroviral therapy. J Infect Dis. 2008;198:1123-30. [DOI] [PMC free article] [PubMed]; Rigaud M, Borkowsky W, Muresan P, Weinberg A, Larussa P, Fenton T. Impaired immunity to recall antigens and neoantigens in severely immunocompromised children and adolescents during the first year of effective highly active antiretroviral therapy. J Infect Dis. 2008;198:1123–1130. doi: 10.1086/592050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Weinberg A, Huang S, Fenton T, Patterson-Bartlett J, Gona P, Read JS, et al. Virologic and immunologic correlates with the magnitude of antibody responses to the hepatitis A vaccine in HIV-infected children on highly active antiretroviral treatment. J Acquir Immune Defic Syndr. 2009;52:17-24. [DOI] [PMC free article] [PubMed]; Weinberg A, Huang S, Fenton T, Patterson-Bartlett J, Gona P, Read JS. Virologic and immunologic correlates with the magnitude of antibody responses to the hepatitis A vaccine in HIV-infected children on highly active antiretroviral treatment. J Acquir Immune Defic Syndr. 2009;52:17–24. doi: 10.1097/QAI.0b013e3181b011f6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Aurpibul L, Puthanakit T, Sirisanthana T, Sirisanthana V. Persistence of measles, mumps, and rubella protective antibodies 3 years after revaccination in HIV-infected children receiving antiretroviral therapy. Clin Infect Dis. 2010;50:1415-8. [DOI] [PubMed]; Aurpibul L, Puthanakit T, Sirisanthana T, Sirisanthana V. Persistence of measles, mumps, and rubella protective antibodies 3 years after revaccination in HIV-infected children receiving antiretroviral therapy. Clin Infect Dis. 2010;50:1415–1418. doi: 10.1086/652150. [DOI] [PubMed] [Google Scholar]
- 17.Choudhury SA, Matin F. Subnormal and waning immunity to tetanus toxoid in previously vaccinated HIV-infected children and response to booster doses of the vaccine. Int J Infect Dis. 2013;17:e1249-51. [DOI] [PubMed]; Choudhury SA, Matin F. Subnormal and waning immunity to tetanus toxoid in previously vaccinated HIV-infected children and response to booster doses of the vaccine. Int J Infect Dis. 2013;17:e1249–e1251. doi: 10.1016/j.ijid.2013.07.008. [DOI] [PubMed] [Google Scholar]
- 18.Kosalaraksa P, Srirompotong U, Newman RW, Lumbiganon P, Wood JM. Serological response to trivalent inactive influenza vaccine in HIV-infected children with different immunologic status. Vaccine. 2011;29:3055-60. [DOI] [PubMed]; Kosalaraksa P, Srirompotong U, Newman RW, Lumbiganon P, Wood JM. Serological response to trivalent inactive influenza vaccine in HIV-infected children with different immunologic status. Vaccine. 2011;29:3055–3060. doi: 10.1016/j.vaccine.2011.01.091. [DOI] [PubMed] [Google Scholar]
- 19.Kourkounti S, Papaizos V, Leuow K, Kordosis T, Antoniou C, Hepatitis A. Vaccination and immunological parameters in HIV-infected patients. Viral Immunol. 2013;26:357-63. [DOI] [PubMed]; Kourkounti S, Papaizos V, Leuow K, Kordosis T, Antoniou C, Hepatitis A. Vaccination and immunological parameters in HIV-infected patients. Viral Immunol. 2013;26:357–363. doi: 10.1089/vim.2012.0100. [DOI] [PubMed] [Google Scholar]
- 20.Overton ET, Nurutdinova D, Sungkanuparph S, Seyfried W, Groger RK, Powderly WG. Predictors of immunity after hepatitis A vaccination in HIV-infected persons. J Viral Hepat. 2007;14:189-93. [DOI] [PubMed]; Overton ET, Nurutdinova D, Sungkanuparph S, Seyfried W, Groger RK, Powderly WG. Predictors of immunity after hepatitis A vaccination in HIV-infected persons. J Viral Hepat. 2007;14:189–193. doi: 10.1111/j.1365-2893.2006.00822.x. [DOI] [PubMed] [Google Scholar]
- 21.Crum-Cianflone NF, Wilkins K, Lee AW, Grosso A, Landrum ML, Weintrob A, et al. Long-term durability of immune responses after hepatitis A vaccination among HIV-infected adults. J Infect Dis. 2011;203:1815-23. [DOI] [PMC free article] [PubMed]; Crum-Cianflone NF, Wilkins K, Lee AW, Grosso A, Landrum ML, Weintrob A. Long-term durability of immune responses after hepatitis A vaccination among HIV-infected adults. J Infect Dis. 2011;203:1815–1823. doi: 10.1093/infdis/jir180. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Mena G, García-Basteiro AL, Llupià A, Díez C, Costa J, Gatell JM, et al. Factors associated with the immune response to hepatitis A vaccination in HIV-infected patients in the era of highly active antiretroviral therapy. Vaccine. 2013;31:3668-74. [DOI] [PubMed]; Mena G, García-Basteiro AL, Llupià A, Díez C, Costa J, Gatell JM. Factors associated with the immune response to hepatitis A vaccination in HIV-infected patients in the era of highly active antiretroviral therapy. Vaccine. 2013;31:3668–3674. doi: 10.1016/j.vaccine.2013.06.012. [DOI] [PubMed] [Google Scholar]
- 23.Pensieroso S, Cagigi A, Palma P, Nilsson A, Capponi C, Freda E, et al. Timing of Haart defines the integrity of memory B cells and the longevity of humoral responses in HIV-1 vertically-infected children. Proc Natl Acad Sci USA. 2009;106:7939-44. [DOI] [PMC free article] [PubMed]; Pensieroso S, Cagigi A, Palma P, Nilsson A, Capponi C, Freda E. Timing of Haart defines the integrity of memory B cells and the longevity of humoral responses in HIV-1 vertically-infected children. Proc Natl Acad Sci USA. 2009;106:7939–7944. doi: 10.1073/pnas.0901702106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Brasil Ministério da Saúde. Secretaria de Vigilância em Saúde departamento de vigilância epidemiol6gica. Manual dos centros de referencia para imunobiol6gicos especiais. 3rd ed. Brasília: Ministério de Saúde; 2006.; Brasil Ministério da Saúde,Secretaria de Vigilância em Saúde departamento de vigilância epidemiol6gica . Manual dos centros de referencia para imunobiol6gicos especiais. 3. Brasília: Ministério de Saúde; 2006. [Google Scholar]
- 25.American Academy of Pediatrics. Hepatitis B. In: Pickering LK, Backer CJ, Kimbelin DW, Long SS, editors. Red book: report of the committee on infectious disease. Elk Grove Village: American Academy of Pediatrics; 2012. p. 369-90.; American Academy of Pediatrics Pickering LK, Backer CJ, Kimbelin DW, Long SS. Red book: report of the committee on infectious disease. Elk Grove Village: American Academy of Pediatrics; 2012. Hepatitis B; pp. 369–390. [Google Scholar]
- 26.Sharapov UM, Bulkow LR, Negus SE, Spradling PR, Homan C, Drobeniuc J, et al. Persistence of Hepatitis A vaccine induced seropositivity in infants and young children by maternal antibody status: 10-year follow-up. Hepatology. 2012;56:516-22. [DOI] [PubMed]; Sharapov UM, Bulkow LR, Negus SE, Spradling PR, Homan C, Drobeniuc J. Persistence of Hepatitis A vaccine induced seropositivity in infants and young children by maternal antibody status: 10-year follow-up. Hepatology. 2012;56:516–522. doi: 10.1002/hep.25687. [DOI] [PubMed] [Google Scholar]