Abstract
Introducción:
la Aspergilosis Invasiva (AI) del Sistema Nervioso Central (SNC) es infrecuente y ocurre generalmente en pacientes inmunocomprometidos. Puede presentarse con cuadros de meningitis, aneurismas micóticos, infartos o abscesos. Es una infección con pronóstico reservado y puede afectar el SNC de forma primaria o secundaria a partir de un foco que se disemina por vía hematógena. Presentamos el caso de un paciente con AI con invasión primaria a nivel óseo y diseminación posterior al cerebro.
Caso clínico:
Paciente masculino de 25 años con diagnóstico de leucemia linfática aguda en tratamiento quimioterápico que presentó neumonitis por metotrexate por lo que inicia tratamiento con corticoides. Posteriormente agregó cervicalgia y con el diagnóstico de osteomielitis cervical se realiza punción bajo tomografía computada (TC) sin aislarse gérmenes. Se colocó Halo Vest e inició tratamiento antibiótico empírico. Posteriormente presentó afasia de expresión secundaria a lesión frontal izquierda. Se realizó evacuación de absceso cerebral aislando A. fumigatus. El tratamiento antibiótico específico posterior permitió una buena respuesta clínica y radiológica.
Conclusión:
La presencia de lesiones en el SNC de pacientes inmunocomprometidos debe incluir a las micosis como diagnóstico diferencial. La evacuación quirúrgica permite llegar rápidamente al diagnóstico mejorando la respuesta posterior al tratamiento antibiótico. Para evaluar la respuesta terapéutica y posibles recaídas se debe realizar un seguimiento periódico clínico radiológico. Palabras clave: Aspergilosis cerebral; Aspergilosis cervical; Aspergilosis invasiva; Voriconazol.
Keywords: Brain aspergillosis, cervical aspergillosis, invasive aspergillosis, voriconazol, Aspergilosis cerebral, aspergilosis cervical, aspergilosis invasiva, voriconazol
Abstract
Background:
Invasive aspergillosis (IA) of the central nervous system (CNS) is an uncommon condition that usually occurs in immunocompromised patients. This illness can manifest as meningitis, or as a micotic aneurism, stroke or abscess. The infection affects the CNS either primarily or, more often, secondarily via blood dissemination from a distant focus, and has a poor prognosis. We present a patient with IA primarily affecting the cervical bones, with later spread into the brain.
Case Description:
A 25-year old male was receiving chemotherapy for acute lymphocytic leukemia when he developed pneumonitis secondary to methotrexate and was started on corticosteroids. He subsequently developed cervicalgia, prompting a needle biopsy of the fourth vertebrae, after which a diagnosis of osteomyelitis was made. Even though the biopsy culture was negative, empirical antibiotics were initiated. A parietal lobe lesion was treated surgically months later after the patient presented with three episodes of transient aphasia. After A. fumigatus grew in culture, the patient's antibiotic regimen was changed to treat the specific agent with a good response.
Conclusion:
IA must be considered a possibility whenever an immunocompromised patient presents with a new brain lesion. These lesions require surgical evacuation, a procedure that allows for diagnostic confirmation and enhances prognosis. Appropriate anti-fungal therapy must be started as soon as the diagnosis is confirmed. In addition, the patient's neurological exam must be repeated and images obtained periodically to monitor treatment and detect possible recurrences.
INTRODUCCIÓN
La Aspergillosis Invasiva (AI) es una de las infecciones oportunistas más agresivas. Los sitios más frecuentemente afectados son los pulmones y los senos paranasales. El sistema nervioso central (SNC) se compromete en forma primaria o secundaria a partir de un foco que se disemina vía hematógena.
La AI del SNC es un cuadro poco frecuente con una incidencia menor al 5%. Generalmente ocurre en pacientes inmunocomprometidos, aunque hay casos descriptos en pacientes inmunocompetentes.[11,13] Su incidencia se incrementó en los últimos tiempos[18] debido al aumento de pacientes con SIDA y transplantados, de enfermedades autoinmunes y granulomatosas crónicas y del uso de drogas inmunosupresoras y corticoides.
El éxito en el tratamiento de esta patología depende del diagnóstico temprano, un tratamiento agresivo y un seguimiento posterior adecuado.
Nuestro objetivo es la presentación de un paciente con AI con invasión primaria a nivel óseo y diseminación posterior al cerebro.
CASO CLÍNICO
Paciente de sexo masculino de 25 años de edad con antecedentes de leucemia linfática aguda desde 2007. Realizó quimioterapia hasta 2008 con remisión completa (8 ciclos de HyperCVAD). En julio de 2008 inició tratamiento de mantenimiento con metrotexato, vincristina y 6 mercaptopurina intercurriendo con neumonitis interpretada como secundaria a metrotexato. Se suspendió el mismo e inició tratamiento con corticoides (prednisona 4 mg/día). En noviembre de 2008 comenzó con cervicalgia, la resonancia magnética (RM) realizada evidenció lesión compatible con osteomielitis cervical [Figura 1]. Se realizó punción bajo control tomográfico sin obtenerse rescate de microorganismos.
Figura 1.
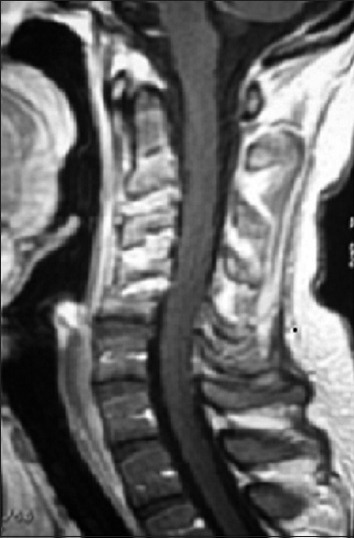
RM columna cervical. Secuencia T1 con gadolinio. Corte sagital. Pérdida parcial de la lordosis cervical e hiperintensidad leve en discos y vértebras C2 - C5. Realce homogéneo de los discos y vértebras de C2 – C5
Se decidió tratamiento conservador con collar de Philadelfia, luego una ortesis cervical (Minerva) y por último HALO VEST, e inició tratamiento empírico con teicoplanina/ciprofloxacina 750 mg cada 12 hs + rifampicina 300 mg cada 12 hs.
A finales de 2008 y comienzos de 2009, presentó 3 episodios compatibles con afasia de expresión de segundos de duración, se realizó una tomografía computada (TC) de cerebro que evidenció la existencia de una lesión a nivel frontal izquierdo.
Se retiró el HALO VEST y se colocó collar de Philadelfia para realizar RM [Figura 2] de cerebro que evidenció lesión cortical con abundante edema vasogénico perilesional con marcado refuerzo posterior al contraste en región parieto temporal posterior. Teniendo en cuenta antecedentes clínicos, sintomatología y hallazgos radiológicos se decidió realizar evacuación quirúrgica guiada con neuronavegación. Posteriormente se medicó con vancomicina 1 gr cada 12 hs + cefepime 2 gr cada 12 hs + metronidazol 500 mg cada 6 hs + aciclovir 750 mg cada 8 hs. Frente a las hifas evidenciadas en el examen histológico inició tratamiento con anfotericina 5 mg/kg/día por 24 hs y luego, con diagnóstico de certeza de Aspergilosis, se rotó el tratamiento a voriconazol 300 mg cada 12 hs. Se efectuaron cada 3 meses controles periódicos de columna cervical y cerebro con RM, con buena respuesta al tratamiento, sin cervicalgia ni trastornos del lenguaje, durante 20 meses de seguimiento [Figuras 3 y 4].
Figura 2.

RM pre operatoria cerebro. Secuencia T1 con gadolinio. Corte axial. Lesión nodular intraxial que capta contraste de forma heterogénea con abundante edema perilesional a nivel parietal izquierdo
Figura 3.
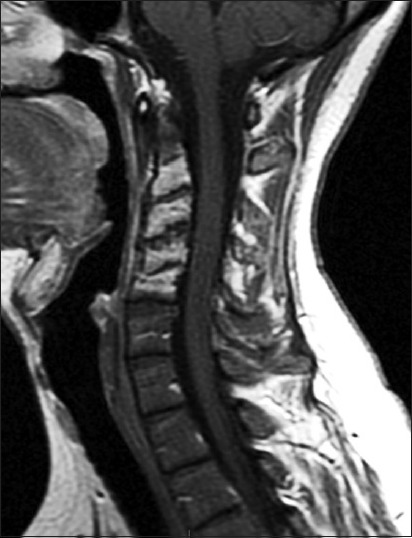
RM columna cervical 20 meses de seguimiento. Secuencia T1 con gadolinio. Corte sagital. Pérdida parcial de la lordosis cervical, no se observa realce en los discos C2 - C5 tras el contraste
Figura 4.
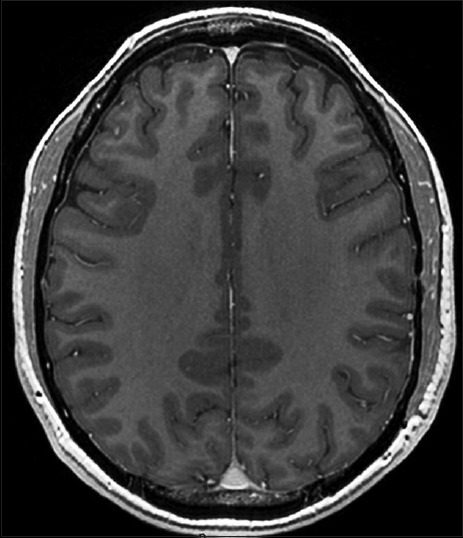
RM de cerebro 20 meses post operatoria. Secuencia T1 con gadolinio. Corte axial. Sin realce a nivel parietal izquierdo en zona de evacuación de lesión abscedada y sin edema
DISCUSIÓN
El Aspergillus es un hongo que se encuentra en la tierra, agua y restos orgánicos y es reconocido como patógeno humano desde 1847.[18] La inhalación de esporas de Aspergillus es sumamente frecuente, sin embargo casi nunca produce enfermedad. La forma infecciosa del hongo son las conidias, las cuales también colonizan el tracto respiratorio y el conducto auditivo externo lo que explica por qué los pulmones y los senos paranasales son los lugares más frecuentemente afectados. De las 19 especies de Aspergillus, el A. fumigatus es el patógeno humano más frecuente, considerado responsable del 90% de los casos.[17] Sin embargo, hay casos descriptos de A. flavus, A. niger y A. oxyzae.[2,4] La incidencia es mayor en climas secos y cálidos, principalmente India y Arabia Saudita.
Un vez producida la primo infección, por vía hematógena o por contigüidad el hongo invade el SNC causando abscesos intraparenquimatosos y epidurales, vasculitis, infartos, granulomas y/o meningitis. La mayor parte de los estudios identifica al Cryptococcus, Aspergillus y la Candida como las especies micóticas más frecuentes en afectar el SNC y reconoce al Aspergillus como la principal especie formadora de granulomas.[21]
Los factores de riesgo más frecuentemente asociados con infección del SNC son el trasplante de médula ósea, los tumores hematológicos, la terapia inmunosupresora y la neutropenia. Otros grupos de riesgo son los pacientes con trasplante de órganos sólidos y los pacientes con SIDA, insuficiencia hepática, síndrome de Cushing, asma y alcoholismo.[10]
La sintomatología que presentan los pacientes con AI es variable y poco específica. En el 25-33% de los casos la AI es asintomática.[5] Déficit neurológico focal, cambios en el estado de conciencia y convulsiones son los síntomas neurológicos más comunes, y se caracterizan por una progresión rápida.
El diagnóstico de AI es establecido mediante la combinación de datos histológicos (visualización de hifas compatibles con las de Aspergillus) y microbiológicos (visualización de hifas en el examen en fresco y aislamiento de Aspergillus en cultivo), dado que ninguno de ellos puede asegurar el diagnóstico por sí solo. Las tinciones histológicas más utilizadas son: La metenamina de plata o tinción de Grocot y la hematoxilina-eosina, aunque esta última no es útil cuando los tejidos están necrosados. La visualización histológica debe ser confirmada con el aislamiento en cultivo, ya que las hifas de Aspergillus son indistinguibles de las de Pseudallescheria boydii o Fusarium spp. El Aspergillus crece bien en casi todos los medios de cultivo. La temperatura óptima de crecimiento es de 37° C y los micelios pueden ser visibles a las 48 horas de incubación.
El diagnóstico es difícil de realizar por pruebas de laboratorio basadas en cultivos sanguíneos y de líquido cefalorraquídeo (LCR).[25] El análisis del LCR generalmente es negativo pero sirve para hacer diagnóstico diferencial con otras patologías que afectan las meninges.[1] Los test serológicos en sangre y en LCR como la contrainmunoelectroforesis, la inmunofluorecencia y la enzimo inmuno ensayo (ELISA) pueden ayudar al diagnóstico. La detección de anticuerpos en sangre para el diagnóstico de la AI resulta útil en el caso de pacientes no inmunosuprimidos, pero es de de muy baja utilidad en pacientes inmunosuprimidos. Si los anticuerpos se encuentran al inicio de la enfermedad suelen estar causados por la exposición al hongo previa a la enfermedad. Si se encuentran al final suelen indicar la recuperación del individuo de su AI, por lo que podemos dar a estos datos un valor pronóstico, pero no diagnóstico.
Debido a la dificultad en el diagnóstico de la AI, la realización de PCR en busca del ADN del hongo causante de la enfermedad constituye una alternativa.[1] La posibilidad de encontrar ADN de Aspergillus en suero es mayor que la de hallar hemocultivos positivos a Aspergillus. Esto se debe a la mayor sensibilidad de PCR o bien a que las hifas que se liberen al torrente sanguíneo estén muertas y por tanto no puedan crecer en medios de cultivos, mientras que sí podemos detectar el ADN. Sin embargo, esta última teoría choca con la demostrada capacidad de diseminación del hongo. La detección de Galactomananos, un carbohidrato componente de la pared del Aspergillus, en orina, suero y LCR ha mejorado el diagnóstico en pacientes inmunodeprimidos. Por lo expuesto, el diagnóstico definitivo se realiza con el estudio anatomopatológico.
Los métodos de imágenes para el diagnóstico son TC, RM y tomografía por emisión de positrones (PET-TC).[8] Las lesiones en TC son hiperdensas con efecto de masa y pueden o no captar contraste; en RM se presentan habitualmente irregulares, hipo o isointensas en T1 e hipointensas en T2, con realce en anillo u homogéneo posterior al gadolineo. Una señal hiperintensa en Difusión puede ser observada debido a células inflamatorias y tejido necrótico rico en proteínas. Las imágenes en T1 son secundarias a necrosis por compromiso vascular y la señal en T2 se debe a la densa cantidad de hifas de Aspergillus pero también puede ser explicada por la presencia de hierro,[16] manganeso y magnesio que presentan las paredes micóticas del Aspergillus o bien por hemorragias que ocurren en el 25% de las lesiones.[23] Un anillo hipointenso circundante está asociado con una mayor frecuencia de hemorragia, y la presencia de una gruesa pared irregular alrededor de la lesión indica mecanismos de defensa del huésped que tienden a encapsular la infección.[15] Las imágenes cambian según la inmunidad del paciente: En pacientes severamente comprometidos se observa poco o nada de refuerzo con contraste en RM, en cambio en pacientes inmunocompetentes o con leve alteración de su inmunidad se observa una gran captación de contraste. Esto sugiere la ausencia de respuesta inflamatoria para el primer paciente y por consiguiente, un peor pronóstico.[14] Todas las imágenes descriptas pueden corresponder a Aspergilosis pero también a otros microorganismos como Criptococos, Nocardia, Toxoplasmosis y Tuberculosis. Por esto resulta difícil realizar el diagnóstico de certeza por medio de las imágenes. Las principales formas de presentación de esta patología en imágenes son: Infartos, infiltración dural o vascular y lesiones ocupantes de espacio intra o extraaxial.[21] Generalmente, los infartos producidos por AI involucran los núcleos de la base mostrando su predilección por arterias perforantes lentículo estriadas. Las lesiones granulomatosas o abscesos, son frecuentes de observar a nivel del lóbulo frontal o temporal en regiones córtico subcorticales. El PET-TC con F-fluordeoxyglucosa (FDG) se usa para diferenciar patología inflamatoria/infecciosa de patología maligna, mostrando captación de FDG en patología inflamatoria. Sin embargo, si la lesión tiene mucho componente necrótico esta captación puede disminuir.[3]
Distintos estudios han probado mayor eficacia y menor toxicidad del voriconazol sobre otros medicamentos, por lo que se ha transformado en la droga de elección para el inicio del tratamiento.[1,3,6,7,22] Se pueden usar otros fármacos como la anfotericina B (su compuesto liposomal), itraconazol, fluconazol y 5 fluorcitocina o una combinación de ellas.[1,9] Las distintas combinaciones continúan siendo estudiadas sin evidencias claras de superioridad de una sobre las otras.[12] Hay reportes de tratamiento de abscesos cerebrales por Aspergilosis con anfotericina intracavitaria de manera continua con buena respuesta. Otros tratamientos experimentales propuestos son el factor estimulante de colonias y el interferón gama recombinante.
En cuanto a la técnica quirúrgica a utilizar no hay recomendaciones, los datos son solo tomados de reportes y series de casos. Lo que sí se puede establecer es que el tratamiento quirúrgico permite un diagnóstico de certeza en aquellos casos que no se llega a diagnóstico con exámenes de laboratorios y de imágenes. Permite, además, una mejor respuesta al tratamiento con antimicóticos y en casos de masas intracraneales de gran tamaño, evita déficits neurológicos y síndrome de hipertensión endocraneana. En una revisión bibliográfica realizada por Kourkoumpetis y col.[12] se analizaron pacientes tratados solo con terapia antibiótica y pacientes que realizaron tratamiento quirúrgico y antibiótico observándose una mortalidad del 67% y 28% respectivamente. Debido a la existencia de múltiples lesiones cerebrales, el tratamiento quirúrgico resectivo no siempre es posible, en ese caso se utiliza la esterotaxia para la toma de biopsia.[24] En lesiones por Aspergilosis en áreas elocuentes, donde la exéresis total provocaría déficit neurológico, la resección parcial y hasta la toma de una biopsia otorgaría mejor pronóstico y mayor respuesta al tratamiento en comparación con casos tratados con antimicóticos solamente. Si la lesión se encuentra en un área no elocuente, la exéresis quirúrgica completa es la meta.
Luego del tratamiento quirúrgico, el paciente debe continuar con un tratamiento antimicótico agresivo. Siddiqui ha planteado una clasificación que pone de manifiesto la evolución clínica con respecto al tipo de invasión producida por el hongo.[19,21]
Tipo 1: Pacientes con aspergilosis intracerebral (peor pronóstico)
Tipo 2: Pacientes con aspergilosis orbital y de base de cráneo (buena respuesta al tratamiento)
Tipo 3: Pacientes con aspergilosis intracranana extradural (pronóstico intermedio).
El pronóstico es distinto según las publicaciones y depende principalmente del estado inmunológico del paciente. En pacientes inmunocomprometidos la mortalidad llega a ser del 95-100%[7,17,18,20] y baja al 40-60% en pacientes inmunocompetentes.[7,18] Pacientes con enfermedad nasosinusal con o sin invasión de órbita o base de cráneo tienen buen pronóstico (mortalidad <20%). Pacientes con lesiones intraparenquimatosas presentan peor pronóstico que aquellos con lesiones extradurales.
CONCLUSIÓN
La AI y más precisamente la afección del SNC es una infección micótica poco frecuente que afecta predominantemente a pacientes inmunodeprimidos. Debido al aumento de su incidencia en los últimos tiempos y al mal pronóstico que acarrea, el diagnóstico rápido es de suma importancia. Los síntomas y signos neurológicos y las imágenes que se pueden observar en pacientes con Aspergilosis cerebral son inespecíficos, por lo que no se puede llegar a un diagnóstico a través de los mismos. Sin embargo, ante un paciente inmunodeprimido que presente sintomatología neurológica y las imágenes muestren lesiones compatibles, es un diagnóstico diferencial a considerar. Ya que es difícil diagnosticar esta patología por medio de técnicas no invasivas (cultivo y análisis de sangre y LCR), se hace necesaria la toma de biopsia para estudios microbiológicos e histológicos. El tratamiento antimicótico de elección es el voriconazol y la segunda opción es la anfotericina liposomal o los tratamientos combinados. Se recomienda un estricto seguimiento clínico – radiológico para evaluar la respuesta al tratamiento y detectar posibles recidivas.
Footnotes
Contributor Information
Guillermo Enrique Vergara, Email: vergaraguien@gmail.com.
Natalia Roura, Email: nroura@fleni.org.ar.
Marcelo del Castillo, Email: mdelcastillo@fleni.org.ar.
Andrea Mora, Email: amora@fleni.org.ar.
Santiago Condomi Alcorta, Email: scondomi@fleni.org.ar.
Rubén Mormandi, Email: rmormandi@fleni.org.ar.
Andrés Cervio, Email: acervio@fleni.org.ar.
Jorge Salvat, Email: jsalvat@fleni.org.arr.
BIBLIOGRAFÍA
- 1.Al-Abdely HM, Alothman AF, Salman JA, Al-Musawi T, Almaslamani M, Butt AA, et al. Clinical practice guidelines for the treatment of invasive Aspergillus infections in adults in the Middle East region: Expert panel recommendations. J Infect Public Health. 2014;7:20–31. doi: 10.1016/j.jiph.2013.08.003. [DOI] [PubMed] [Google Scholar]
- 2.Alapatt JP, Kutty RK, Gopi PP, Challissery J. Middle and posterior fossa aspergilloma. Surg Neurol. 2006:6675–8. doi: 10.1016/j.surneu.2005.11.061. discussion 78-9. [DOI] [PubMed] [Google Scholar]
- 3.Azarpira N, Esfandiari M, Bagheri MH, Rakei S, Salari S. Cerebral Aspergillosis Presenting as a Mass Lesion. Braz J Infect Dis. 2008;12:349–51. doi: 10.1590/s1413-86702008000400019. [DOI] [PubMed] [Google Scholar]
- 4.Chi CY, Fung CP, Liu CY. Aspergillus flavus epidural abscess and osteomyelitis in a diabetic patient. J Microbiol Immunol Infect. 2003;36:145–8. [PubMed] [Google Scholar]
- 5.Dubey A, Patwardhan RV, Sampth S, Santosh V, Kolluri S, Nanda A. Intracranial Fungal Granuloma: Analysis of 40 patients and review of the literature. Surg Neurol. 2005;63:254–60. doi: 10.1016/j.surneu.2004.04.020. [DOI] [PubMed] [Google Scholar]
- 6.Gallien S, Fournier S, Porcher R, Bottero J, Ribaud P, Sulahian A, et al. Therapeutic Outcome and Prognostic Factor of Invasive Aspergilolosis in an Infectious Disease Department: A review of 34 cases. Infection. 2008;36:533–8. doi: 10.1007/s15010-008-7375-x. [DOI] [PubMed] [Google Scholar]
- 7.Herbrecht R, Denning DW, Patterson TF, Bennett JE, Greene RE, Oestmann JW, et al. Voriconazol versus amphotericin B for primary therapy of invasive aspergillosis. N Engl J Med. 2002;347:408–15. doi: 10.1056/NEJMoa020191. [DOI] [PubMed] [Google Scholar]
- 8.Oh IS, Seo JY, Ha KY, Kim YC. Treatment for Multiple Aspergillus Spondylitis Including a Hip Joint. Asian Spine J. 2009;3:106–12. doi: 10.4184/asj.2009.3.2.106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Kirby A, Hassan I, Burnie J. Recommendations for managing Aspergillus osteomyelitis and joint infections based on a review of the literature. J Infect. 2006;52:405–14. doi: 10.1016/j.jinf.2005.08.016. [DOI] [PubMed] [Google Scholar]
- 10.Kleinschmidt-DeMasters BK. Central nervous system aspergilosis: A 20-year retrospective series. Hum Pathol. 2002;33:116–24. doi: 10.1053/hupa.2002.30186. [DOI] [PubMed] [Google Scholar]
- 11.Koshy R, Malhotra P. Treatment of primary aspergilloma of the central nervous system in a diabetic immunocompetent patient with surgical resection and voriconazole: A case report and review of the literature. Turk Neurosurg. 2011;21:641–4. [PubMed] [Google Scholar]
- 12.Kourkoumpetis TK, Desalermos A, Muhammed M, Mylonakis E. Central nervous system aspergillosis: A series of 14 cases from a general hospital and review of 123 cases from the literature. Medicine (Baltimore) 2012;91:328–36. doi: 10.1097/MD.0b013e318274cd77. [DOI] [PubMed] [Google Scholar]
- 13.Lee JC, Lim DJ, Ha SK, Kim SD, Kim SH. Fatal case of cerebral aspergillosis: A case report and literature review. J Korean Neurosurg Soc. 2012;52:420–2. doi: 10.3340/jkns.2012.52.4.420. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Okafuji T, Yabuuchi H, Nagatoshi Y, Hattanda Y, Fukuya T. CT and MR findings of brain aspergillosis. Comput Med Imaging Graph. 2003;27:489–92. doi: 10.1016/s0895-6111(03)00033-8. [DOI] [PubMed] [Google Scholar]
- 15.Phutharak W, Hesselink JR, Wixon C. MR feactures of cerebral aspergillosis in an inmunocompetent patient: Correlation with histology and elemental analysis. AJNR Am J Neuroradiol. 2005;26:835–8. [PMC free article] [PubMed] [Google Scholar]
- 16.Pollack E, Bhaya A, Law M. Differentiating Intracranial Aspergillosis from a High Grade Glioma Using MRI and MR Spectroscopic Imaging. J Neuroimaging. 2007;17:361–6. doi: 10.1111/j.1552-6569.2007.00105.x. [DOI] [PubMed] [Google Scholar]
- 17.Ruhnke M, Kofla G, Otto K, Schwartz S. CNS Aspergillosis. Recognition, Diagnosis and Management. CNS Drugs. 2007;21:659–76. doi: 10.2165/00023210-200721080-00004. [DOI] [PubMed] [Google Scholar]
- 18.Shamim MS, Enam SA, Ali R, Answar S. Cranicerebral Aspergillosis: A review of advances in diagnosis and management. J Pak Med Assoc. 2010;60:573–9. [PubMed] [Google Scholar]
- 19.Siddiqui AA, Bashir SH, Ali Shah A, Sajjad Z, Ahmed N, Jooma R, et al. Diagnostic MR imaging feactures of craniocerebral Aspergillosis of sino-nasal origin in immunocompetent patients. Acta Neurochir (Wien) 2006;148:155–66. doi: 10.1007/s00701-005-0659-3. [DOI] [PubMed] [Google Scholar]
- 20.Son JM, Jee WH, Jung CK, Kim SI, Ha KY. Aspergillus Spondylitis involving the Cervico-Thoraco-Lumbar Spine in an Immunocompromised Patient: A case report. Korean J Radiol. 2007;8:448–51. doi: 10.3348/kjr.2007.8.5.448. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Srinivasan US. Intracranial Aspergilloma in Inmunocompetent Patients Successfully Treatment with Radical Surgical Intervention and Antifungal Therapy - Case Report. Ann Acad Med Singapore. 2008;37:783–7. [PubMed] [Google Scholar]
- 22.Stratov I, Korman TM, Johnson PD. Management of Aspergillus Osteomyelitis: Report of Failure of Liposomal Amphotericin B and Response to Voriconazole in an Immunocompetent Host and Literature Review. Eur J Clin Microbiol Infect Dis. 2003;22:277–83. doi: 10.1007/s10096-003-0909-3. [DOI] [PubMed] [Google Scholar]
- 23.Tempkin AD, Sobonya RE, Seeger JF, Oh ES. Cerebral Aspergillosis: Radiologic and pathologic findings. Radiographics. 2006;26:1239–42. doi: 10.1148/rg.264055152. [DOI] [PubMed] [Google Scholar]
- 24.Turgut M, Ozsunar Y, Oncü S, Akyüz O, Ertuğrul MB, Tekin C, et al. Invasive fungal granuloma of the brain cause by Aspergillus fumigatus: A case report and review of the literature. Surg Neurol. 2008;69:169–74. doi: 10.1016/j.surneu.2006.12.049. [DOI] [PubMed] [Google Scholar]
- 25.Walsh TJ, Hier DB, Caplan LR. Aspergillosis of the Central Nervous System: Clinicopathological Analysis of 17 Patients. Ann Neurol. 1985;18:574–82. doi: 10.1002/ana.410180511. [DOI] [PubMed] [Google Scholar]


