Abstract
Objective:
To evaluate the prevalence of sarcopenia in COPD patients, as well as to determine whether sarcopenia correlates with the severity and prognosis of COPD.
Methods:
A cross-sectional study with COPD patients followed at the pulmonary outpatient clinic of our institution. The patients underwent dual-energy X-ray absorptiometry. The diagnosis of sarcopenia was made on the basis of the skeletal muscle index, defined as appendicular lean mass/height2 only for low-weight subjects and adjusted for fat mass in normal/overweight subjects. Disease severity (COPD stage) was evaluated with the Global Initiative for Chronic Obstructive Lung Disease (GOLD) criteria. The degree of obstruction and prognosis were determined by the Body mass index, airflow Obstruction, Dyspnea, and Exercise capacity (BODE) index.
Results:
We recruited 91 patients (50 females), with a mean age of 67.4 ± 8.7 years and a mean BMI of 25.8 ± 6.1 kg/m2. Sarcopenia was observed in 36 (39.6%) of the patients, with no differences related to gender, age, or smoking status. Sarcopenia was not associated with the GOLD stage or with FEV1 (used as an indicator of the degree of obstruction). The BMI, percentage of body fat, and total lean mass were lower in the patients with sarcopenia than in those without (p < 0.001). Sarcopenia was more prevalent among the patients in BODE quartile 3 or 4 than among those in BODE quartile 1 or 2 (p = 0.009). The multivariate analysis showed that the BODE quartile was significantly associated with sarcopenia, regardless of age, gender, smoking status, and GOLD stage.
Conclusions:
In COPD patients, sarcopenia appears to be associated with unfavorable changes in body composition and with a poor prognosis.
Keywords: Sarcopenia, Body composition, Pulmonary disease, chronic obstructive, Severity of illness index
INTRODUCTION
It is well known that COPD is a highly prevalent disease, affecting up to 10% of adults over the age of 40, with high rates of morbidity and mortality.( 1 ) It is associated with various extrapulmonary disorders, such as cardiovascular disease, osteoporosis, cachexia, and anemia. Previous studies have indicated an association between low BMI and shorter survival in COPD patients. ( 2 , 3 ) However, more recent data demonstrate that specific unfavorable changes in body composition, especially a decrease in lean mass, can be more reliable predictors of mortality than is low BMI alone.( 4 , 5 ) In patients with COPD, such changes have been shown to be related to exercise intolerance, impaired quality of life, and increased mortality.( 6 ) Few studies in the literature have correlated the prevalence of sarcopenia with indices of COPD severity. In addition, to date, there have been no studies correlating sarcopenia with the prognosis of COPD or correcting sarcopenia by the BMI to avoid misdiagnosis in overweight patients.
In COPD patients over 50 years of age, there is a reduction of 1-2% per year in muscle mass.( 4 ) In addition, among those in the 50- to 60-year age group and those over 60 years of age, muscle force has been shown to decline by 1.5% and 3.0% per year, respectively.( 4 ) This phenomenon, known as sarcopenia, is an important indicator of frailty syndrome. Sarcopenia has been shown to occur in approximately 5-13% of all individuals over 65 years of age,( 7 ) as well as in 20-40% of all COPD patients, which might include even the 10-15% of COPD patients who are of normal weight.( 2 )
In patients with COPD, a decrease in exercise capacity is the main factor limiting activities of daily living and is directly related to an increased risk of exacerbations. ( 8 ) It has been suggested that such a decrease is the best predictor of early mortality in COPD.( 3 ) The degree of exercise capacity impairment (exercise intolerance), which results from factors such as impaired pulmonary function, limitation of gas exchange, and skeletal muscle dysfunction, is related to COPD severity. In the presence of dyspnea, such alterations lead to further impairment of physical activity, initiating a vicious cycle, also known as a downward spiral.( 6 , 8 )
The aim of this study was to evaluate the prevalence of sarcopenia in COPD patients. We also attempted to determine whether sarcopenia correlates with indices of COPD severity and with its prognosis.
METHODS
Patients and procedures
This was a cross-sectional study involving 96 consecutive COPD patients, all over 50 years of age, treated at the Pulmonary Outpatient Clinic of the Federal University of Paraná Hospital de Clínicas, in the city of Curitiba, Brazil, between January of 2010 and December of 2011. The diagnosis of COPD was made on the basis of the Global Initiative for Chronic Obstructive Lung Disease (GOLD) criteria( 9 ): persistent progressive airflow limitation; and an increased chronic inflammatory response to noxious particles or gases in the airways and lungs, as evidenced by a post-bronchodilator FEV1/FVC ratio < 0.70 on spirometry. ( 9 ) The inclusion criteria were having smoking-related COPD, having undergone pulmonary function testing with a spirometer (KoKo PFT; nSpire Health, Longmont, CO, USA), and having a post-bronchodilator FEV1/FVC ratio < 0.70. We excluded patients for whom any of the required test results were unavailable, as well as those who were taking drugs that can reduce lean mass and those who had any other disease known to affect body composition. The study was approved by the Hospital de Clínicas Ethics Committee on Human Research, and all participating patients gave written informed consent.
We collected clinical data, including lifetime smoking history, quantified in pack-years( 10 ); history of exacerbations in the last year; FEV1; the modified Medical Research Council dyspnea scale score( 11 ); the score on the COPD Assessment Test, which quantifies the overall impact that COPD has on health status( 12 ); and the six-minute walk distance.( 13 )
The patients were classified by the percentage of predicted FEV1 (i.e., the degree of obstruction): ≥ 80% (mild); 50-79% (moderate); 30-49% (severe); and < 30% (very severe).( 9 ) The severity (clinical stage) of COPD was determined according to the GOLD criteria( 9 ): post-bronchodilator FEV1; history of exacerbations in the last year; and symptoms such as dyspnea (measured by modified Medical Research Council dyspnea scale or COPD Assessment Test). On the basis of those criteria, each patient was categorized as having COPD that was at GOLD stage I, II, III, or IV.( 9 ) We evaluated COPD prognosis using the Body mass index, airflow Obstruction, Dyspnea, and Exercise capacity (BODE) index, stratifying the patients into four quartiles, the fourth being the most severe.( 14 )
Weight (in kg) was measured, with the patients wearing light clothing, on a digital electronic scale (Toledo do Brasil, São Bernardo do Campo, Brazil) with a maximum capacity of 200 kg and an accuracy of 50 g. Height (m) was measured while the patients were standing with their back straight, heels together, and arms at their sides. On the basis of the BMI, the patients were classified as underweight (BMI < 22 kg/m2), normal weight (BMI ≥ 22 and < 27 kg/m2), or overweight/obese (BMI ≥ 27 kg/m2), according to the categories established by Lipschitz et al.,( 15 ) which are the most suitable for use in middle-aged and elderly individuals.
For the assessment of body composition, all patients underwent dual-energy X-ray absorptiometry (DXA) in a whole-body scanner (Lunar Prodigy; GE Medical Systems, Madison, WI, USA), used in conjunction with enCORE 2002 software (GE Medical Systems). The software provides data about lean body mass (bone mass plus fat-free mass), bone-free lean mass (lean mass minus fat-free mass), fat mass, and bone mineral density.
Densitometric diagnosis of sarcopenia
The criteria for a diagnosis of sarcopenia by DXA were initially defined by Baumgartner et al.( 16 ) in a study involving a large sample of elderly individuals in the state of New Mexico. However, using those criteria, the authors found that the prevalence of sarcopenia was underdiagnosed, probably due to the high proportions of overweight and obese individuals in the population studied. Newman et al.( 17 ) proposed new methods for defining sarcopenia, by adjusting height and the appendicular lean mass (ALM) by the fat mass, which resulted in prevalence rates that were higher than those obtained with the former criteria.( 17 , 18 ) However, those authors found that the former criteria continued to be superior for diagnosing sarcopenia in underweight patients. In two recent studies conducted in Brazil, Domiciano et al.( 19 ) and Figueiredo et al.( 20 ) compared the two sets of criteria and concluded that the cut-off BMI value of 22 kg/m2 defined the choice of criteria to be used for the densitometric diagnosis of sarcopenia.
For the purpose of the densitometric diagnosis of sarcopenia, we used both systems of determining ALM: using the skeletal muscle index (SMI), calculated as ALM (in kg) relative to height squared in meters (ALM/height2), with cut-off values of 7.26 kg/m2 and 5.45 kg/m2 for men and women, respectively, hereafter referred to as the Baumgartner criteria( 16 ); and calculating ALM (in kg) relative to height in meters and adjusted for total body fat mass (in kg), hereafter referred to as the Newman criteria.( 17 ) The residuals of the regression were used in order to identify individuals with a lean mass lower than the value predicted for a given fat mass (given by an equation derived from the model). A positive residual would indicate a relatively muscular individual, whereas a negative residual would indicate an individual with sarcopenia. The equations derived from the model were as follows:
for men
ALM (in kg) = −28.15 + 27.49 × height (in m) + 0.1106 × fat mass (in kg)
for women
ALM (in kg) = −19.78 + 20.00 × height (in m) + 0.1554 × fat mass (in kg)
The 20th percentile of the distribution of residuals was used as the cut-off value for the diagnosis of sarcopenia, according to the ALM adjusted for fat mass, as previously defined.( 17 , 18 ) In our patient sample, that cut-off value corresponded to residuals of −2.021 for men and −1.082 for women. To make the densitometric diagnosis of sarcopenia, we applied the Baumgartner criteria for individuals with a BMI < 22 kg/m2 and the Newman criteria for individuals with a BMI ≥ 22 kg/m2.( 21 )
Statistical analysis
Data are presented as mean ± SD, except where otherwise specified. All statistical analyses were performed with the SPSS Statistics software package, version 20.0 (IBM Corporation, Armonk, NY, USA). For the variables evaluated, the normality of the data distribution was evaluated with the Kolmogorov-Smirnov test. For comparisons of quantitative variables between two groups, we used the Student's t-test for independent samples or the nonparametric Mann-Whitney test. For comparisons among three or more groups, we used one-way ANOVA and the least significant difference test for multiple comparisons or the nonparametric Kruskal-Wallis test. In the preliminary statistical analysis, we used Fisher's exact test and the chi-square test to assess the association between two qualitative variables. Values of p < 0.05 were considered statistically significant.
For multivariate analysis, we used logistic regression, considering sarcopenia as the response (dependent) variable and the following as explanatory (independent) variables: age (≤ 67 or > 67 years), female gender, GOLD stage III or IV, BODE quartile 3 or 4, and current smoking. For each variable, in the presence of the other variable included in the model, we tested the null hypothesis that the probability of sarcopenia is equal for the two classifications of the variable (lack of association between the variable and sarcopenia), versus the alternative hypothesis of different probabilities. We calculated the p values of the statistical tests, as well as odds ratios with their corresponding 95% confidence intervals.
RESULTS
Of the 96 patients evaluated, 5 were excluded because they did not perform all of the required tests. Therefore, the final sample comprised 91 patients (50 women and 41 men), with a mean age of 67.4 ± 8.7 years and a mean BMI of 25.8 ± 6.1 kg/m2. Twenty-five patients (27.4%) were classified as normal weight, 28 (30.7%) were classified as underweight, and 38 (41.7%) were classified as overweight. The overall mean percentage of total body fat mass was 32.3 ± 11.7% (37.8 ± 15.8% in women and 25.6 ± 7.1% in men; p = 0.000), and the overall mean SMI was 6.57 ± 1.1 (6.17 ± 5 for women and 7.05 ± 5.3 for men, p = 0.000). The mean smoking history was 60 ± 41.4 pack-years. Sixteen patients (17.6%) were current smokers at enrollment in the study.
On the basis of the FEV1 values, the degree of obstruction was classified as mild in 16 (17.6%) of the patients, moderate in 33 (36.3%), severe in 29 (31.9%), and very severe in 13 (14.3%). Among the 91 patients evaluated, COPD was classified as GOLD stage I in 15 (16.5%), as GOLD stage II in 22 (24.2%), as GOLD stage III in 34 (37.4%), and as GOLD stage IV in 20 (22%). Stratified by the BODE index, 36 patients (39.6%) were in the first quartile, 29 (31.9%) were in the second quartile, 15 (16.5%) were in the third quartile, and 11 (12.1%) were in the fourth quartile.
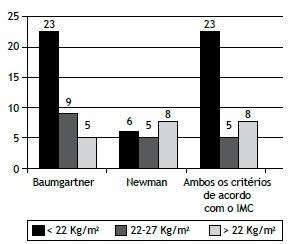
We found that BMI did not correlate significantly with FEV1 (p = 0.509), GOLD stage (p = 0.114), or BODE quartile (p = 0.114). Sarcopenia was diagnosed in 36 patients (39.6%): 16 women and 20 men. When we stratified that result by BMI, we found that sarcopenia was present in 5 (20.0%) of the 25 normal weight patients, 23 (82.1%) of the 28 underweight patients, and 8 (21.1%) of the 38 overweight patients. Figure 1 shows the number of patients with sarcopenia, by BMI, according to the set of criteria used in making the diagnosis. There were no significant differences in the prevalence of sarcopenia in relation to gender (p = 0.276), age (p = 0.309), or smoking history (p = 0.464). The mean SMI was 5.86 ± 0.7 in the patients with sarcopenia (5.38 ± 0.42 in women and 6.25 ± 0.57 in men), compared with 7.03 ± 1.0 in those without (6.54 ± 0.89 in women and 7.81 ± 0.77 in men), the difference between the two groups being significant (p < 0.001). As can be seen in Table 1, the patients with sarcopenia also showed lower BMI (p < 0.001), lower percentage of total body fat (p = 0.01), and lower total lean mass (p < 0.001).
Figure 1. Number of patients with sarcopenia, by BMI, depending on the set of criteria used for the diagnosis: (left) the criteria by Baumgartner et al.(16) in all patients; (center) the criteria by Newman et al.(17) in all patients; and (right) the criteria by Baumgartner et al.(16) for patients with a BMI < 22 kg/m2 and the criteria by Newman et al.(17) for patients with a BMI ≥ 22 kg/m2.
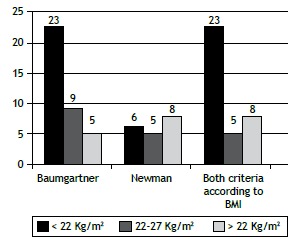
Table 1. Differences between COPD patients with and without sarcopenia.a .
| Variable | Sarcopenia | No sarcopenia | p |
|---|---|---|---|
| (n = 36) | (n = 55) | ||
| Age, years | 68.6 ± 10.4 | 66.6 ± 7.46 | 0.309 |
| BMI, kg/m2 | 22.2 ± 4.9 | 28.2 ± 5.6 | < 0.001* |
| % Total BF | 28 ± 14.2 | 35.1 ± 8.8 | 0.01* |
| Lean mass, kg | |||
| Arms | 4.6 ± 1.2 | 3.9 ± 1.0 | 0.003* |
| Legs | 11.1 ± 2.0 | 13.6 ± 3.2 | < 0.001* |
| Total | 37.4 ± 6.4 | 44.1 ± 9.3 | < 0.001* |
| Skeletal muscle indexb | |||
| All patients | 5.86 ± 0.7 | 7.03 ± 1.0 | < 0.001* |
| Women | 5.38 ± 0.42 | 6.25 ± 0.57 | < 0.001* |
| Men | 6.54 ± 0.89 | 7.81 ± 0.77 | < 0.001* |
% Total BF: percentage of total body fat. aResults expressed as mean ± SD. bAppendicular lean mass/height2.
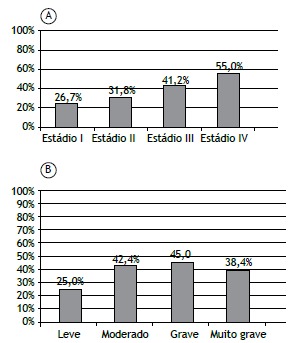
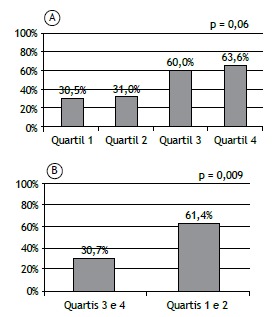
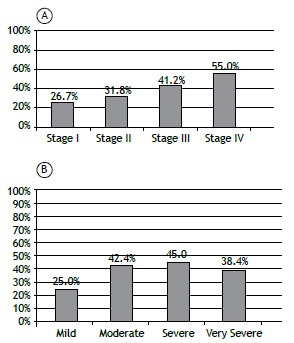
There was no association between the prevalence of sarcopenia and the severity of COPD, as determined by GOLD stage and FEV1 (Figures 2A and 2B). There was a tendency toward an association between the prevalence of sarcopenia and the BODE quartile (p = 0.06). As depicted in Figure 3A, 11 patients (30.5%) were in the first quartile, 9 (31%) were in the second, 8 (60%) were in the third, and 9 (63.6%) were in the fourth. Figure 3B shows that the prevalence of sarcopenia among the patients in quartile 3 or 4 was 61.4%, significantly higher than the 30.7% seen among those in quartile 1 or 2 (p = 0.009; OR = 3.89; 95% CI: 1.21-12.46). The multivariate analysis showed that, regardless of age, gender, GOLD stage, and smoking status, the BODE index was significantly associated with sarcopenia (Table 2).
Figure 3. Proportion of patients diagnosed with sarcopenia by densitometry according to the quartiles of the Body mass index, airflow Obstruction, Dyspnea, and Exercise capacity (BODE) prognostic index, grouped by quartile (in A) and pooled (in B) into a less severe group (quartiles 1 and 2) and a more severe group (quartiles 3 and 4).
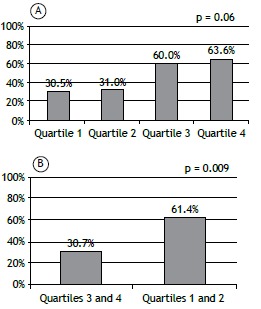
Table 2. Multivariate analysis in which sarcopenia was the dependent variable.
| Variable | Reference | p* | OR | 95% CI |
|---|---|---|---|---|
| Age | ≤ 67 years | 0.055 | 2.80 | 1.06-7.37 |
| Gender | Female | 0.266 | 1.69 | 0.66-4.31 |
| Clinical stage | GOLD stage III or IV | 0.744 | 1.19 | 0.41-3.42 |
| Smoking status | Current smoking | 0.138 | 2.57 | 0.73-9.13 |
| BODE index | Quartile 3 or 4 | 0.02* | 3.89 | 1.21-12.46 |
GOLD: Global Initiative for Chronic Obstructive Lung Disease; and BODE: Body mass index, airflow Obstruction, Dyspnea, and Exercise capacity. *Wald test (logistic regression) level of significance, p < 0.05.
Figure 2. Prevalence of sarcopenia, diagnosed with dual-energy X-ray absorptiometry, among COPD patients (N = 91), by COPD severity (GOLD stage, in A) and degree of obstruction (FEV1, in B). Sarcopenia did not correlate significantly with GOLD stage (p = 0.305) or FEV1 (p = 0.599). Degree of obstruction (FEV1): Mild (≥ 80%); Moderate (50-79%); Severe (30-49%); and Very severe (< 30%).
DISCUSSION
In our sample of COPD patients, there was a high prevalence of DXA-diagnosed sarcopenia, which was found to correlate with a poor prognosis. In patients with COPD, various factors have been shown to be associated with a worse prognosis, a higher number of hospitalizations, and shorter survival; chief among such factors is changes in body composition.( 4 ) Low BMI has been associated with acute exacerbations, mortality, and loss of lean mass in COPD patients.( 5 ) In the present study, we confirmed that a loss of lean body mass is associated with lower BMI in COPD patients. However, we did not find BMI to be associated with COPD severity or a worse prognosis, which is in agreement with the findings of recent studies demonstrating that reduced lean mass is a better predictor of mortality in COPD patients than is low BMI alone, the former reducing survival by up to 50%.( 22 )
In our study, the overall prevalence of sarcopenia was 39.6%, which is consistent with the literature on COPD patients, in which the reported prevalence is 20-40%. ( 5 , 22 ) Cesari et al.( 23 ) diagnosed sarcopenia in 30% of the COPD patients evaluated; when the authors adjusted for fat mass, that rate rose to 42.5%, a difference that was primarily attributed to the increased proportion of obese patients diagnosed. When we applied the Baumgartner criteria, we diagnosed sarcopenia in 37 patients (40.6%), compared with only 19 patients (21.0%) when we applied the Newman criteria. That was mainly due to the fact that the mean BMI in our sample was lower than that reported in the other studies cited. For overweight and obese patients, adjusting for fat mass (i.e., applying the Newman criteria) was especially important, because it increased the prevalence of sarcopenia by 8% over that obtained when the Baumgartner criteria were applied. This demonstrates the importance of making this adjustment, which can prevent underdiagnosis.
The loss of lean body mass in patients with COPD has previously been shown to be associated with lower BMI,( 6 ) and we confirmed that. However, sarcopenia also occurs in approximately 20% of normal-weight, overweight, and obese patients. One study showed that a decrease in muscle mass occurs in 21% of normal-weight patients with COPD,( 24 ) and another showed that 10-15% of COPD patients with a normal or high BMI have sarcopenia.( 25 )
Cigarette smoking is one of the mechanisms involved in the increased protein catabolism in COPD, as demonstrated in various epidemiological association studies on smoking and sarcopenia.( 26 ) Although there is controversy in the literature, one study demonstrated an association between smoking history and a loss of lean mass in COPD patients,( 27 ) whereas others have shown no such association.( 28 , 29 ) In the present study, we observed no association between smoking history and sarcopenia. One possible explanation for that finding is that patients with COPD show a high, persistent inflammatory state, with elevated levels of TNF-α, which is involved in the physiopathology of sarcopenia, independently of the smoking history.( 27 )
In our sample of COPD patients, we found that a diagnosis of sarcopenia correlated with lower BMI, a reduction in the overall percentage of body fat, lower total lean mass, and the SMI. These findings are consistent with those of other studies of sarcopenia in patients with and without COPD,( 30 , 31 ) an annual reduction in muscle mass of 1-2% over 50 years having been shown to occur in COPD patients.( 32 ) A loss of lean body mass occurs by several mechanisms, such as TNF-α-mediated motor neuron death, hormonal changes, nutritional status, and an increase in inflammatory factors. In our study, we detected no increase in the prevalence of sarcopenia with advancing age, which is in agreement with the findings of other studies of COPD.( 33 , 34 ) One possible explanation for this is that the severity of the disease and the elevated levels of inflammatory cytokines, present from the onset of COPD, contribute to a greater loss of lean mass, regardless of age.( 35 )
In the present study, neither the GOLD stage nor the degree of obstruction (FEV1) was found to correlate with a diagnosis of sarcopenia. The number of patients studied and the distribution of the severity grades could explain that lack of correlation. In contrast with our findings, Ischaki et al.( 36 ) showed that, in COPD patients, a greater loss of lean body mass translates to greater disease severity, as quantified by GOLD criteria and FEV1. However, those authors assessed body composition using bioelectrical impedance analysis, which is less reliable than is DXA.( 16 ) In another recent study, lower lean mass was also associated with worse FEV1, although, again, body composition was assessed by bioelectrical impedance analysis.( 37 )
The BODE index, a prognostic parameter, considers exercise capacity, which can affect lean mass. We observed a trend toward a higher prevalence of sarcopenia among COPD patients in the higher BODE quartiles, and there was a statistically significant difference between those in the lower quartiles and those in the higher quartiles. In our multivariate analysis, the BODE index was significantly associated with sarcopenia, which was more prevalent among the patients with a worse prognosis (in quartile 3 or 4). To our knowledge, there have been no other studies investigating this association. A reduction in lean mass leads to exercise intolerance, which has been described as an essential factor for impairing quality of life, increasing the frequency of exacerbations/hospital admissions, and increasing mortality.( 4 ) This confirms that sarcopenia is associated with a worse prognosis in COPD.
One limitation of our study is that we did not assess muscle strength. However, various studies have demonstrated a correlation between reduced lean body mass and decreased muscle strength.( 38 ) In addition, this limitation was likely offset by the fact that we applied the BODE index, which takes exercise capacity into account.
The results of the present study demonstrate that the prevalence of sarcopenia, as diagnosed by DXA, which is currently considered the gold standard method, was high in a sample of patients with COPD. Ours was a pioneering study in that we correlated the prevalence of sarcopenia with the BODE index quartile. The impairment and loss of lean mass are common and worrisome; as COPD extrapulmonary manifestations, they cause a reduction in exercise capacity. This can also result in even more pronounced loss of muscle mass, thus initiating a vicious cycle. Therefore, early diagnosis of sarcopenia, through the analysis of body composition, can facilitate the implementation of interventions aimed at preventing the deterioration of lean body mass and improving quality of life in patients with COPD.
Footnotes
Study carried out in the Serviço de Pneumologia and in the Serviço de Endocrinologia e Metabologia - SEMPR - Hospital de Clínicas, Universidade Federal do Paraná, Curitiba, Brasil.
Financial support: None.
REFERENCES
- 1.Eagan TM, Aukrust P, Ueland T, Hardie JA, Johannessen A, Mollnes TE. Body composition and plasma levels of inflammatory biomarkers in COPD. Eur Respir J. 2010;36(5):1027–1033. doi: 10.1183/09031936.00194209. http://dx.doi.org/10.1183/09031936.00194209 [DOI] [PubMed] [Google Scholar]
- 2.Maltais F. Body composition in COPD: looking beyond BMI. Int J Tuberc Lung Dis. 2014;18(1):3–4. doi: 10.5588/ijtld.13.0868. http://dx.doi.org/10.5588/ijtld.13.0868 [DOI] [PubMed] [Google Scholar]
- 3.Vilaró J, Ramirez-Sarmiento A, Martínez-Llorens JM, Mendoza T, Alvarez M, Sánchez-Cayado N. Global muscle dysfunction as a risk factor of readmission to hospital due to COPD exacerbations. Respir Med. 2010;104(12):1896–1902. doi: 10.1016/j.rmed.2010.05.001. http://dx.doi.org/10.1016/j.rmed.2010.05.001 [DOI] [PubMed] [Google Scholar]
- 4.Schols AM, Broekhuizen R, Weling-Scheepers CA, Wouters EF. Body composition and mortality in chronic obstructive pulmonary disease. Am J Clin Nutr. 2005;82(1):53–59. doi: 10.1093/ajcn.82.1.53. http://dx.doi.org/10.1016/j.rmedu.2005.09.028 [DOI] [PubMed] [Google Scholar]
- 5.Marquis K, Debigaré R, Lacasse Y, LeBlanc P, Jobin J, Carrier G, Maltais F. Midthigh muscle cross-sectional area is a better predictor of mortality than body mass index in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2002;166(6):809–813. doi: 10.1164/rccm.2107031. http://dx.doi.org/10.1164/rccm.2107031 [DOI] [PubMed] [Google Scholar]
- 6.Polkey MI, Moxham J. Attacking the disease spiral in chronic obstructive pulmonary disease. Clin Med. 2006;6(2):190–196. doi: 10.7861/clinmedicine.6-2-190. http://dx.doi.org/10.7861/clinmedicine.6-2-190 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Santilli V, Bernetti A, Mangone M, Paoloni M. Clinical definition of sarcopenia. Clin Cases Miner Bone Metab. 2014;11(3):177–180. http://dx.doi.org/10.11138/ccmbm/2014.11.3.177 [PMC free article] [PubMed] [Google Scholar]
- 8.Franssen FM, Sauerwein HP, Rutten EP, Wouters EF, Schols AM. Whole-body resting and exercise-induced lipolysis in sarcopenic [corrected] patients with COPD. Eur Respir J. 2008;32(6):1466–1471. doi: 10.1183/09031936.00014008. http://dx.doi.org/10.1183/09031936.00014008 [DOI] [PubMed] [Google Scholar]
- 9.Global Initiative for Chronic Obstructive Lung Disease . Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Lung Disease (Revised 2011) Bethesda: GOLD; 2011. pp. 90–90.http://www.goldcopd.org/uploads/users/files/GOLD_Report_2011_Feb21.pdf [Google Scholar]
- 10.Prignot J. Quantification and chemical markers of tobacco-exposure. Eur J Respir Dis. 1987;70(1):1–7. [PubMed] [Google Scholar]
- 11.Ferris BG. Epidemiology Standardization Project (American Thoracic Society) Pt 2Am Rev Respir Dis. 1978;118(6):1–120. [PubMed] [Google Scholar]
- 12.Jones PW, Harding G, Berry P, Wiklund I, Chen WH, Kline Leidy N. Development and first validation of the COPD Assessment Test. Eur Respir J. 2009;34(3):648–654. doi: 10.1183/09031936.00102509. http://dx.doi.org/10.1183/09031936.00102509 [DOI] [PubMed] [Google Scholar]
- 13.BALKE B. A SIMPLE FIELD TEST FOR THE ASSESSMENT OF PHYSICAL FITNESS. REP 63-6. Rep Civ Aeromed Res Inst US; 1963. pp. 1–8. [PubMed] [Google Scholar]
- 14.Celli BR, Cote CG, Marin JM, Casanova C, Montes de Oca M, Mendez RA. The body-mass index, airflow obstruction, dyspnea, and exercise capacity index in chronic obstructive pulmonary disease. N Engl J Med. 2004;350(10):1005–1012. doi: 10.1056/NEJMoa021322. http://dx.doi.org/10.1056/NEJMoa021322 [DOI] [PubMed] [Google Scholar]
- 15.Lipschitz DA. Screening for nutritional status in the elderly. Prim Care. 1994;21(1):55–67. [PubMed] [Google Scholar]
- 16.Baumgartner RN, Koehler KM, Gallagher D, Romero L, Heymsfield SB, Ross RR. Epidemiology of sarcopenia among the elderly in New Mexico. Am J Epidemiol. 1998;147(8):755–763. doi: 10.1093/oxfordjournals.aje.a009520. http://dx.doi.org/10.1093/oxfordjournals.aje.a009520 [DOI] [PubMed] [Google Scholar]
- 17.Newman AB, Kupelian V, Visser M, Simonsick E, Goodpaster B, Nevitt M. Sarcopenia: alternative definitions and associations with lower extremity function. J Am Geriatr Soc. 2003;51(11):1602–1609. doi: 10.1046/j.1532-5415.2003.51534.x. http://dx.doi.org/10.1046/j.1532-5415.2003.51534.x [DOI] [PubMed] [Google Scholar]
- 18.Delmonico MJ, Harris TB, Lee JS, Visser M, Nevitt M, Kritchevsky SB. Health, Aging and Body Composition Study. Alternative definitions of sarcopenia, lower extremity performance, and functional impairment with aging in older men and women. J Am Geriatr Soc. 2007;55(5):769–774. doi: 10.1111/j.1532-5415.2007.01140.x. http://dx.doi.org/10.1111/j.1532-5415.2007.01140.x [DOI] [PubMed] [Google Scholar]
- 19.Domiciano DS, Figueiredo CP, Lopes JB, Caparbo VF, Takayama L, Menezes PR. Discriminating sarcopenia in community-dwelling older women with high frequency of overweight/obesity: the São Paulo Ageing & Health Study (SPAH) Osteoporos Int. 2013;24(2):595–603. doi: 10.1007/s00198-012-2002-1. http://dx.doi.org/10.1007/s00198-012-2002-1 [DOI] [PubMed] [Google Scholar]
- 20.Figueiredo CP, Domiciano DS, Lopes JB, Caparbo VF, Scazufca M, Bonfá E, Pereira RM. Prevalence of sarcopenia and associated risk factors by two diagnostic criteria in community-dwelling older men: the São Paulo Ageing & Health Study (SPAH) Osteoporos Int. 2014;25(2):589–596. doi: 10.1007/s00198-013-2455-x. http://dx.doi.org/10.1007/s00198-013-2455-x [DOI] [PubMed] [Google Scholar]
- 21.Cruz-Jentoft AJ, Baeyens JP, Bauer JM, Boirie Y, Cederholm T, Landi F. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing. 2010;39(4):412–423. doi: 10.1093/ageing/afq034. http://dx.doi.org/10.1093/ageing/afq034 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Wagner PD. Possible mechanisms underlying the development of cachexia in COPD. Eur Respir J. 2008;31(3):492–501. doi: 10.1183/09031936.00074807. http://dx.doi.org/10.1183/09031936.00074807 [DOI] [PubMed] [Google Scholar]
- 23.Cesari M, Pedone C, Chiurco D, Cortese L, Conte ME, Scarlata S. Physical performance, sarcopenia and respiratory function in older patients with chronic obstructive pulmonary disease. Age Ageing. 2012;41(2):237–241. doi: 10.1093/ageing/afr167. http://dx.doi.org/10.1093/ageing/afr167 [DOI] [PubMed] [Google Scholar]
- 24.Bolton CE, Ionescu AA, Shiels KM, Pettit RJ, Edwards PH, Stone MD. Associated loss of fat-free mass and bone mineral density in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2004;170(12):1286–1293. doi: 10.1164/rccm.200406-754OC. http://dx.doi.org/10.1164/rccm.200406-754OC [DOI] [PubMed] [Google Scholar]
- 25.Vestbo J, Prescott E, Almdal T, Dahl M, Nordestgaard BG, Andersen T. Body mass, fat-free body mass, and prognosis in patients with chronic obstructive pulmonary disease from a random population sample: findings from the Copenhagen City Heart Study. Am J Respir Crit Care Med. 2006;173(1):79–83. doi: 10.1164/rccm.200506-969OC. http://dx.doi.org/10.1164/rccm.200506-969oc [DOI] [PubMed] [Google Scholar]
- 26.Rom O, Kaisari S, Aizenbud D, Reznick AZ. Sarcopenia and smoking: a possible cellular model of cigarette smoke effects on muscle protein breakdown. Ann N Y Acad Sci. 2012;1259:47–53. doi: 10.1111/j.1749-6632.2012.06532.x. http://dx.doi.org/10.1111/j.1749-6632.2012.06532.x [DOI] [PubMed] [Google Scholar]
- 27.Eagan TM, Gabazza EC, D'Alessandro-Gabazza C, Gil-Bernabe P, Aoki S, Hardie JA. TNF-α is associated with loss of lean body mass only in already cachectic COPD patients. Respir Res. 2012;13:48–48. doi: 10.1186/1465-9921-13-48. http://dx.doi.org/10.1186/1465-9921-13-48 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Tanni SE, Pelegrino NR, Angeleli AY, Correa C, Godoy I. Smoking status and tumor necrosis factor-alpha mediated systemic inflammation in COPD patients. J Inflamm (Lond) 2010;7:29–29. doi: 10.1186/1476-9255-7-29. http://dx.doi.org/10.1186/1476-9255-7-29 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Iwaniec UT, Fung YK, Cullen DM, Akhter MP, Haven MC, Schmid M. Effects of nicotine on bone and calciotropic hormones in growing female rats. Calcif Tissue Int. 2000;67(1):68–74. doi: 10.1007/s00223001099. http://dx.doi.org/10.1007/s00223001099 [DOI] [PubMed] [Google Scholar]
- 30.Rutten EP, Calverley PM, Casaburi R, Agusti A, Bakke P, Celli B. Changes in body composition in patients with chronic obstructive pulmonary disease: do they influence patient-related outcomes? Ann Nutr Metab. 2013;63(3):239–247. doi: 10.1159/000353211. http://dx.doi.org/10.1159/000353211 [DOI] [PubMed] [Google Scholar]
- 31.Verhage TL, Heijdra Y, Molema J, Vercoulen J, Dekhuijzen R. Associations of muscle depletion with health status. Another gender difference in COPD? Clin Nutr. 2011;30(3):332–338. doi: 10.1016/j.clnu.2010.09.013. http://dx.doi.org/10.1016/j.clnu.2010.09.013 [DOI] [PubMed] [Google Scholar]
- 32.Kim TN, Choi KM. Sarcopenia: definition, epidemiology, and pathophysiology. J Bone Metab. 2013;20(1):1–10. doi: 10.11005/jbm.2013.20.1.1. http://dx.doi.org/10.11005/jbm.2013.20.1.1 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Agustí A, Barberà JA, Wouters EF, Peinado VI, Jeffery PK. Lungs, bone marrow, and adipose tissue. A network approach to the pathobiology of chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2013;188(12):1396–1406. doi: 10.1164/rccm.201308-1404PP. http://dx.doi.org/10.1164/rccm.201308-1404PP [DOI] [PubMed] [Google Scholar]
- 34.Hopkinson NS, Tennant RC, Dayer MJ, Swallow EB, Hansel TT, Moxham J. A prospective study of decline in fat free mass and skeletal muscle strength in chronic obstructive pulmonary disease. Respir Res. 2007;8:25–25. doi: 10.1186/1465-9921-8-25. http://dx.doi.org/10.1186/1465-9921-8-25 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Ferrucci L, Penninx BW, Volpato S, Harris TB, Bandeen-Roche K, Balfour J. Change in muscle strength explains accelerated decline of physical function in older women with high interleukin-6 serum levels. J Am Geriatr Soc. 2002;50(12):1947–1954. doi: 10.1046/j.1532-5415.2002.50605.x. http://dx.doi.org/10.1046/j.1532-5415.2002.50605.x [DOI] [PubMed] [Google Scholar]
- 36.Ischaki E, Papatheodorou G, Gaki E, Papa I, Koulouris N, Loukides S. Body mass and fat-free mass indices in COPD: relation with variables expressing disease severity. Chest. 2007;132(1):164–169. doi: 10.1378/chest.06-2789. http://dx.doi.org/10.1378/chest.06-2789 [DOI] [PubMed] [Google Scholar]
- 37.Abbatecola AM, Fumagalli A, Spazzafumo L, Betti V, Misuraca C, Corsonello A. Body composition markers in older persons with COPD. Age Ageing. 2014;43(4):548–553. doi: 10.1093/ageing/aft196. http://dx.doi.org/10.1093/ageing/aft196 [DOI] [PubMed] [Google Scholar]
- 38.Hansen RD, Raja C, Aslani A, Smith RC, Allen BJ. Determination of skeletal muscle and fat-free mass by nuclear and dual-energy x-ray absorptiometry methods in men and women aged 51-84 y (1-3) Am J Clin Nutr. 1999;70(2):228–233. doi: 10.1093/ajcn.70.2.228. [DOI] [PubMed] [Google Scholar]