Abstract
Idiopathic pulmonary fibrosis is a type of chronic fibrosing interstitial pneumonia, of unknown etiology, which is associated with a progressive decrease in pulmonary function and with high mortality rates. Interest in and knowledge of this disorder have grown substantially in recent years. In this review article, we broadly discuss distinct aspects related to the diagnosis and treatment of idiopathic pulmonary fibrosis. We list the current diagnostic criteria and describe the therapeutic approaches currently available, symptomatic treatments, the action of new drugs that are effective in slowing the decline in pulmonary function, and indications for lung transplantation.
Keywords: Idiopathic pulmonary fibrosis/diagnosis, Idiopathic pulmonary fibrosis/therapy, Idiopathic pulmonary fibrosis/rehabilitation
CONCEPT
Idiopathic pulmonary fibrosis (IPF) is a specific form of chronic, progressive fibrosing interstitial pneumonia of unknown cause. It occurs primarily in older adults, predominantly in the sixth and seventh decades of life, being limited to the lungs. It is associated with the histological/radiological pattern of usual interstitial pneumonia (UIP).( 1 - 3 ) Prognosis is significantly worse in patients with the histologically confirmed UIP pattern of IPF than in those with other histological patterns of chronic interstitial pneumonia.( 4 ) Therefore, there is a need to establish an accurate diagnosis of IPF, a process that is undoubtedly challenging.
Patients with IPF present with a median survival of 50% at 2.9 years after diagnosis.( 1 , 4 ) However, given the varied natural history of the disease, it is difficult to determine an accurate prognosis for patients with newly diagnosed IPF.( 5 )
DIAGNOSTIC ASPECTS
For a definitive diagnosis of IPF, an integrated multidisciplinary approach involving pulmonologists, radiologists, and pathologists is required. The diagnosis of IPF is based on the absence of a known cause of pulmonary fibrosis and the presence of the UIP pattern, the former being a key factor in the diagnostic process. Even when a surgical lung biopsy (SLB) reveals a histological pattern of UIP, a definitive diagnosis requires the exclusion of other medical conditions that are associated with the UIP pattern, including connective tissue diseases, chronic hypersensitivity pneumonitis (CHP), drug-induced lung injury, asbestosis, familial pulmonary fibrosis, and Hermansky-Pudlak syndrome.( 1 , 6 , 7 )
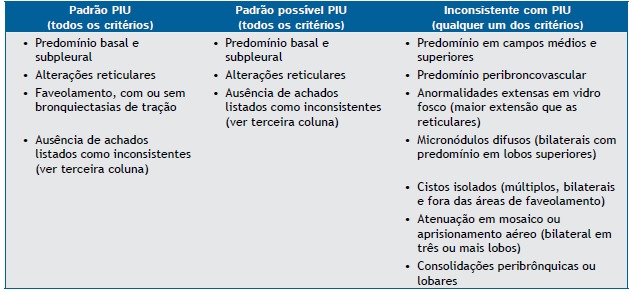
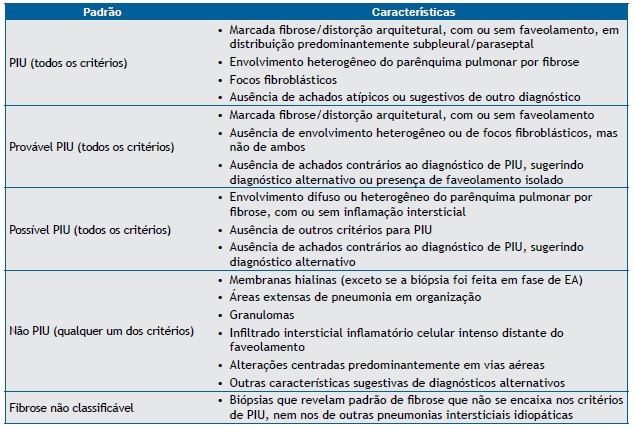
The 2011 American Thoracic Society (ATS)/European Respiratory Society (ERS)/Japanese Respiratory Society (JRS)/Asociación Latinoamericana del Tórax (ALAT) guidelines for the diagnosis of IPF recommend a combination of criteria involving HRCT findings and histopathological features.( 1 ) The ATS/ERS/JRS/ALAT guidelines reinforce previous conclusions that HRCT has a primary role in the diagnosis of IPF. In the appropriate clinical context, HRCT findings of UIP eliminate the need for SLB (Chart 1). However, SLB is recommended for patients in whom HRCT findings meet the criteria for "possible UIP" or "inconsistent with UIP" (Chart 2). Specific combinations of HRCT and histopathological patterns are also provided in the guidelines, the likelihood of IPF being defined as definite, probable, or possible (Chart 3).( 1 )
Chart 1. HRCT criteria for the diagnosis of usual interstitial pneumonia.a .
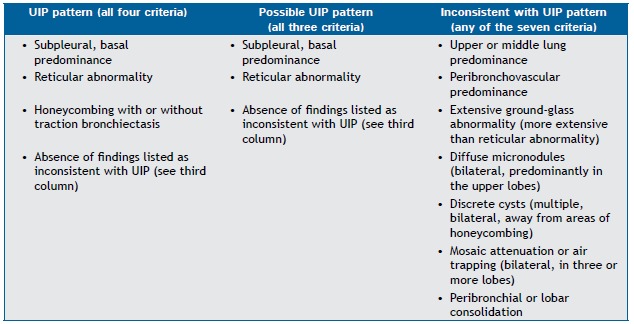
UIP: usual interstitial pneumonia. aBased on Raghu et al.(1)
Chart 2. Histological criteria for the diagnosis of usual interstitial pneumonia.a .
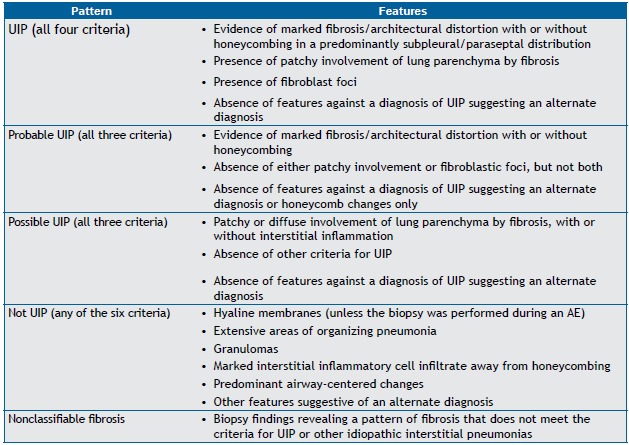
UIP: usual interstitial pneumonia; and AE: acute exacerbation. aBased on Raghu et al.(1)
Chart 3. Combination of HRCT and lung biopsy findings for the diagnosis of idiopathic pulmonary fibrosis.

UIP: usual interstitial pneumonia; and IPF: idiopathic pulmonary fibrosis. aBased on Raghu et al.(1)
After the publication of the ATS/ERS/JRS/ALAT guidelines,( 1 ) some questions were raised. The Brazilian Thoracic Association Guidelines for Interstitial Lung Diseases( 6 ) raised the question of whether HRCT findings meeting the criteria for possible UIP plus SLB findings consistent with possible UIP or nonclassifiable fibrosis can really be considered indicative of "probable IPF". The question was whether the presence of homogeneous fibrosis with inflammation, as described for possible UIP, is really consistent with the histological pattern of UIP.( 6 ) In addition, cases of nonclassifiable fibrosis might be secondary to sampling errors or clinical conditions other than IPF. Another important point is the possibility of IPF despite HRCT findings inconsistent with UIP. In the appropriate context, ground-glass opacities at the lung bases and in the subpleural regions, which are most commonly found in patients with accelerated IPF, plus SLB findings consistent with definite or probable UIP can be indicative of IPF. Therefore, the diagnostic criteria in the Brazilian Thoracic Association Guidelines for Interstitial Lung Diseases( 6 ) differ to some degree from those in the ATS/ERS/JRS/ALAT guidelines.( 1 ) In Brazil, IPF is not classified as definite, probable, or possible (Chart 4). Despite being more practical, these criteria have yet to gain wide acceptance in the country.
Chart 4. Combination of HRCT and lung biopsy findings for the diagnosis of idiopathic pulmonary fibrosis, in accordance with the 2012 Brazilian Thoracic Association Guidelines for Interstitial Lung Diseases.a .
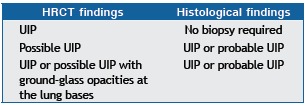
UIP: usual interstitial pneumonia. aBased on Baldi et al.(6)
In a case-control study conducted in Spain, 20 of 46 cases diagnosed with IPF on the basis of the 2011 ATS/ERS/JRS/ALAT guidelines( 1 ) were reviewed at a center specializing in CHP, where they were found to meet diagnostic criteria for CHP.( 8 ) Although the aforementioned findings raise concerns regarding the reliability of a UIP diagnosis based solely on HRCT findings, they were not sufficiently compelling to warrant changes in the 2011 ATS/ERS/JRS/ALAT diagnostic criteria for IPF.( 1 ) Nevertheless, they underscore the importance of thoroughly investigating environmental exposure in patients with interstitial lung disease.( 9 )
DIFFERENTIAL DIAGNOSIS
In patients suspected of having IPF, other diagnoses should be carefully considered. Patients with HRCT findings consistent with probable or possible UIP are frequently encountered in clinical practice, and the differential diagnosis should include CHP and fibrotic nonspecific interstitial pneumonia. However, a proportion of such patients do not undergo SLB, either because of contraindications (comorbidities, advanced age, or disease severity) or because of their unwillingness to undergo a surgical procedure.
In this context, bronchoscopy with BAL can be useful in raising the suspicion of CHP, lymphocytosis in BAL fluid generally being above 30%.( 1 , 6 ) It is of note that transbronchial biopsy is not useful in patients suspected of having UIP. However, recent data suggest that an emerging technique known as bronchoscopic cryobiopsy can be useful in this scenario.( 10 )
It is important to exclude pulmonary involvement by collagen vascular disease in patients with interstitial fibrosing diseases such as rheumatoid arthritis and systemic sclerosis, even in those in whom HRCT findings are consistent with UIP, especially in the presence of suggestive complaints or a family history of autoimmune disease.( 7 ) It is also important to screen family members (including distant relatives) for pulmonary conditions, given that familial interstitial lung disease is common.
Early and accurate diagnosis of IPF is a challenge. Auscultation findings of late inspiratory crackles and pan-inspiratory crackles, particularly "Velcro" crackles, constitute an important warning sign of IPF.( 11 ) Given that IPF is currently overdiagnosed on the basis of HRCT findings, there is an urgent need for standardizing diagnostic approaches. With regard to HRCT evaluation, it is still difficult to distinguish between honeycombing and traction bronchiectasis or between honeycombing and combined pulmonary fibrosis and emphysema, for example.( 12 ) Although it is often helpful to compare HRCT and histological findings, not all patients benefit from that. Multidisciplinary meetings are essential for an accurate diagnosis in patients in whom it is difficult to use the proposed criteria.
PARADIGM SHIFTS AND TREATMENT FAILURE
The treatment of IPF initially focused on inflammation and fibrosis; that is, injury or damage triggers inflammation, and the onset of fibrosis leads to lung repair.( 1 ) However, in patients with IPF, there is little or no inflammation, and fibrosis is progressive and massive. Paradigm shifts regarding the pathogenesis of IPF, which is now considered to be primarily a fibrosing, epithelial/mesenchymal disorder, led to studies investigating new therapeutic modalities.( 13 )
Until 2000, various terms were used in order to refer to IPF (including fibrosing alveolitis, chronic idiopathic pneumonia, and fibrosing pneumonitis), and various histological patterns were associated with it. In that year, an international consensus statement was published, standardizing the terminology and precisely defining the disease.( 14 ) Therefore, all studies published before 2000 have serious limitations because they did not use the current criteria for defining IPF. It is also of note that small case series and single-center studies conducted earlier have been complemented by randomized studies in which the sample size has been effectively calculated, many of which have been multicenter in nature.
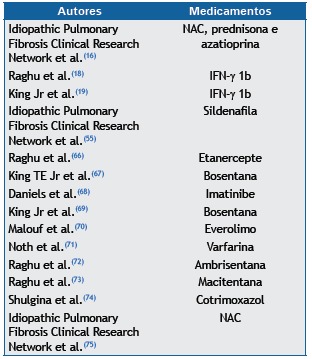
Recent studies investigating the treatment of IPF include numerous clinical trials showing negative results, some of which are summarized in Chart 5. The body of acquired knowledge on certain drugs is of particular interest.
Chart 5. A few randomized, double-blind, placebo-controlled clinical trials whose primary outcomes were not met.
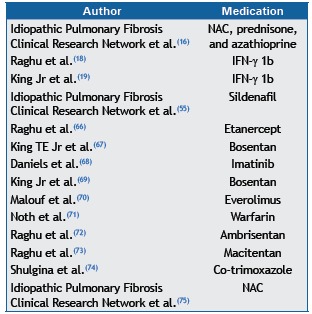
NAC: N-acetylcysteine.
For decades, corticosteroids have been the standard therapy for "pulmonary fibrosis", on the basis of retrospective studies including few patients and no clear definition of the lung disease being treated. ( 15 ) Although corticosteroids are quite useful in the treatment of interstitial lung diseases such as nonspecific interstitial pneumonia and cryptogenic organizing pneumonia, there is no evidence for the use of corticosteroids in the treatment of IPF. In addition to having many side effects and increasing the number of comorbidities, corticosteroids have been reported to be associated with an increased occurrence of acute exacerbations (AEs).( 15 )
The immunosuppressants azathioprine and cyclophosphamide, which are commonly used in the treatment of connective tissue disease-associated interstitial lung diseases, are not recommended for patients with IPF. In a randomized, double-blind, placebo-controlled study, hospitalization and mortality rates were significantly higher in the group of IPF patients receiving a combination of low-dose corticosteroids, N-acetylcysteine (NAC), and azathioprine than in the group of IPF patients receiving placebo.( 16 ) The immunosuppression caused by the combination of low-dose prednisone and azathioprine is likely to have substantially influenced the results. Therefore, the use of immunosuppressants in patients with IPF is currently proscribed.
IFN-γ is an endogenous cytokine that has antifibrotic, immunomodulatory, and antiproliferative properties. Numerous animal model studies have suggested that IFN-γ has a therapeutic role in patients with fibrotic lung disease. A preliminary study published in 1999 suggested that IFN-γ provides some degree of clinical efficacy.( 17 ) The aforementioned findings led to two multicenter, randomized, double-blind, placebo-controlled studies, the results of which were disappointing.( 18 , 19 ) Those two studies were important because they showed that large, placebo-controlled clinical trials were feasible in patients with IPF, marking the beginning of a new era in IPF clinical research.
A precursor of glutathione, NAC is a major endogenous antioxidant present in the lungs. Oxidative stress in alveolar epithelial cells is considered to be one of the pathways involved in the pathogenesis of IPF, and glutathione levels appear to be decreased in patients with IPF. NAC replacement increases blood glutathione levels in such patients. In the Idiopathic Pulmonary Fibrosis International Group Exploring N-Acetylcysteine I Annual (IFIGENIA) trial, it was suggested that the addition of 1,800 mg of NAC to a therapeutic regimen of low-dose prednisone and azathioprine can slow the decline in pulmonary function in patients with IPF.( 20 ) The methodological limitations of that study( 20 ) led to a randomized clinical trial designated PANTHER-IPF, conducted by the Idiopathic Pulmonary Fibrosis Clinical Research Network, sponsored by the US National Heart, Lung, and Blood Institute, and comparing the effects of NAC alone with those of placebo in patients with IPF.( 21 ) At 60 weeks, no statistically significant differences were found between the NAC group (in which there was a decline of 180 mL in FVC) and the placebo group (in which there was a decline of 190 mL in FVC).( 21 ) In addition, mortality was similar between the two groups, as were AE rates. Therefore, there is currently no evidence to support the use of high-dose NAC in the routine treatment of patients with IPF.
Albeit frustrating, the numerous clinical trials showing negative results were important because they provided a deeper understanding of the natural history of IPF and a better characterization of outcomes for future studies.
SPECIFIC TREATMENT OF LUNG DISEASE
Although several drugs have been investigated as potential treatments for IPF in randomized clinical trials, only two have been shown to be effective, namely pirfenidone and nintedanib.
For decades, the antifibrotic properties of pirfenidone have been investigated in various animal models. ( 22 ) There is mounting evidence that pirfenidone inhibits collagen deposition and protects lung function in rodents treated with bleomycin administered intratracheally.
The mechanisms whereby pirfenidone acts seem to be pleomorphic but have yet to be fully elucidated. Experimental data indicate that the drug reduces procollagen, TGF-β, and PDGF gene expression and inhibits TNF-α production. In addition, pirfenidone appears to have antioxidant properties.( 23 )
The first clinical studies of pirfenidone involved small samples, were uncontrolled, or used outcomes of limited clinical utility.( 24 - 26 )
There were three major randomized, double-blind, placebo-controlled studies of pirfenidone.( 27 - 29 ) In a multicenter study conducted by Taniguchi et al.,( 27 ) 267 IPF patients were randomized to receive, over a 52-week period, placebo or pirfenidone at doses of 1,200 mg/day or 1,800 mg/day. At the end of the study, pirfenidone was found to have significantly reduced the rate of decline in FVC in comparison with placebo, regardless of the dose used (placebo: −0.16 L; low-dose pirfenidone: −0.08 L; and high-dose pirfenidone: −0.09 L). In addition, high-dose pirfenidone was associated with a significant increase in progression-free survival (time to loss of lung function or death) in comparison with placebo.
Under the auspices of a program designated Clinical Studies Assessing Pirfenidone in IPF: Research of Efficacy and Safety Outcomes (CAPACITY), two randomized, double-blind, placebo-controlled clinical trials were conducted simultaneously.( 28 ) In study 004, patients were randomized to receive, over a 72-week period, placebo or pirfenidone at doses of 2,403 mg/day or 1,197 mg/day. At the end of the study, high-dose pirfenidone was found to have significantly reduced the rate of decline in FVC in comparison with placebo (−8.0% vs. −12.4%). The therapeutic effect of the drug was apparent from treatment week 24 onward. In addition, high-dose pirfenidone increased progression-free survival. In study 006, patients receiving pirfenidone at doses of 2,403 mg/day were compared with those receiving placebo. At the end of the study, no significant differences were found between the two groups of patients regarding the rate of decline in FVC, although the therapeutic effect of the drug on FVC was apparent from treatment week 12 to treatment week 48. A combined analysis of the two studies revealed that high-dose pirfenidone had a therapeutic effect on the rate of decline in FVC from treatment week 12 onward. At the end of the study, the rate of decline in FVC was significantly lower in the pirfenidone group than in the placebo group (−8.5% vs. −11.5%). In addition, progression-free survival was higher in the pirfenidone group.
The conflicting results of the two studies conducted under the auspices of the CAPACITY program regarding their primary outcome (i.e., the rate of decline in FVC) led to a clinical trial designated Assessment of Pirfenidone to Confirm Efficacy and Safety in Idiopathic Pulmonary Fibrosis (ASCEND).( 29 ) In that study, 277 patients with IPF received placebo, whereas 278 were treated with pirfenidone at a dose of 2,403 mg/day for 52 weeks. Pirfenidone was associated with a lower rate of decline in FVC and higher progression-free survival. At the end of the study, mean decline in FVC was 428 mL in the placebo group and 235 mL in the pirfenidone group. A combined analysis of the results of the CAPACITY and ASCEND studies revealed that all-cause mortality and IPF mortality were significantly lower in the groups of patients receiving pirfenidone than in those of those receiving placebo.( 28 , 29 )
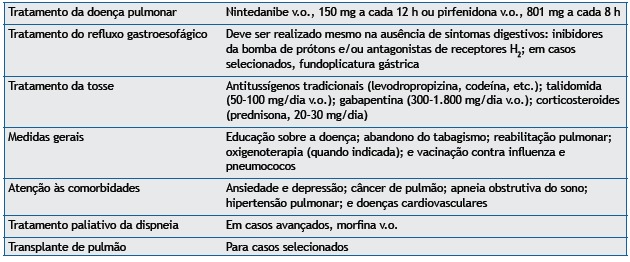
Pirfenidone capsules contain 267 mg of its salt, corresponding to 200 mg of the active ingredient. According to the manufacturer, pirfenidone should be taken orally at a dose of one 267-mg capsule every 8 h for 7 days. On day 8, the dose is increased to two 267-mg capsules (p.o.) every 8 h, and, from day 15 onward, patients should take three 267-mg capsules (p.o.) every 8 h. The medication should be taken with food in order to reduce the risk of nausea. Adjustments can be made if patients experience adverse effects, the most common of which are nausea, dyspeptic symptoms, rashes, photosensitivity, and liver enzyme abnormalities.( 28 , 29 )
Nintedanib was formerly known as BIBF 1120. An indolinone derivative, nintedanib was originally developed as an angiogenesis inhibitor to be used in the field of oncology.( 30 ) The drug has been tested for the treatment of solid tumors of different lineages, and its clinical efficacy has been demonstrated, especially in the treatment of non-small cell lung cancer.( 31 )
In patients with IPF, the mechanisms whereby nintedanib acts involve inhibition of receptor tyrosine kinases.( 32 ) The drug blocks the intracellular ATP-binding sites of specific tyrosine kinases. This results in inactivation of cellular receptors for mediators involved in the development of pulmonary fibrosis, particularly FGF and PDGF receptors. In addition, nintedanib inhibits the activity of VEGF receptors. As a result, fibroblast proliferation is inhibited and extracellular matrix deposition is reduced.
The first randomized clinical trial of nintedanib in patients with IPF was designated To imprOve pulMOnaRy fibROsis With BIBF1120 (TOMORROW) and lasted 12 months. In that study,( 33 ) 432 patients were randomized to receive placebo or increasing doses of nintedanib, the maximum dose being 150 mg twice daily. The use of 150 mg of nintedanib twice daily resulted in a significant reduction in the number of AEs in comparison with placebo. At the end of the study, the rate of decline in FVC was lower in the nintedanib group than in the placebo group (−0.06 L vs. −0.19 L; p = 0.06).
Two phase III trials of nintedanib in patients with IPF were conducted simultaneously, being designated INPULSIS-1 and INPULSIS-2.( 34 ) In both trials, the drug was used at a dose of 150 mg twice daily. In INPULSIS-1, nintedanib led to a significant reduction in the annual rate of decline in FVC when compared with placebo (−114.7 mL vs. −239.9 mL). In INPULSIS-2, nintedanib also led to a significant reduction in the annual rate of decline in FVC when compared with placebo (−113.6 mL vs. −207.3 mL). In that study, nintedanib was associated with a significant increase in the time to the first AE.
According to the manufacturer, nintedanib should be taken orally at a dose of 150 mg twice daily. The dose can be temporarily reduced to 100 mg/day if adverse reactions occur. The drug should be taken with a full glass of water and food. The most common adverse effects of nintedanib are gastrointestinal adverse effects, particularly diarrhea and nausea. Diarrhea occurs in approximately 62% of patients using nintedanib, but it can be controlled with the use of loperamide.
Although pirfenidone had been approved for sale in Japan and Europe on the basis of previous studies, the US Food and Drug Administration approved it for use in the USA only after the results of the ASCEND trial. On the same date, nintedanib was also approved for use in the country. The approval of the two drugs by the US Food and Drug Administration was primarily based on their beneficial effect on the rate of decline in FVC.( 35 ) Although FVC is a prognostic factor in IPF, the ideal would be to identify a positive effect of the new drugs on patient mortality. Unfortunately, long-term follow-up of a larger number of patients is required in order to characterize such an effect.
Long-term follow-up studies examining the aforementioned clinical trials have recently been published. Maintenance therapy with pirfenidone, even in patients showing a decline of at least 10% in FVC after 6 months of treatment, has been associated with a better outcome than has placebo. In addition, nintedanib use for up to 76 weeks and nintedanib use for 52 weeks have been shown to have the same efficacy and adverse effect profiles. Furthermore, it has been suggested that both drugs are effective in patients with early-stage IPF.
Because of the aforementioned data set, the 2015 ATS/ERS/JRS/ALAT guidelines for the treatment of IPF recommend the use of pirfenidone or nintedanib as treatment options for patients with the disease.( 36 )
It is of note that, at present, there is evidence that pirfenidone and nintedanib are effective in treating IPF, but there is no evidence that they are effective in treating other fibrosing interstitial lung diseases, such as CHP and collagen vascular disease-associated pulmonary impairment. In addition, the combined use of pirfenidone and nintedanib is not currently recommended, although an initial study has suggested that the combination is safe.( 37 ) In this context, the decision to use pirfenidone or nintedanib should be made on a case-by-case basis, on the basis of commercial availability, comorbidities, treatment adherence, patient tolerance to adverse effects, and previous treatment failure.
The best timing for treatment initiation has yet to be determined. Most experts recommend that IPF treatment with either drug be initiated as soon as the diagnosis is established. This is due to the usually poor prognosis of IPF and the risk of AEs. Therefore, pharmacological treatment is warranted even in those few IPF patients with normal lung function. However, some experts disagree, arguing that it is difficult to establish an individual prognosis, and AEs are more common in the advanced phase of the disease. In this context, one possibility is to monitor lung function for some time and initiate pharmacological treatment as soon as lung function decline is detected. This is a controversial issue that has yet to be resolved, and clinicians and patients should make the decision together. Finally, because of the exclusion criteria used in the studies, the true efficacy of pirfenidone and nintedanib for patients with extremely advanced disease has yet to be determined.
SYMPTOMATIC TREATMENT
Cough
Cough is a very common symptom that can be difficult to control in patients with IPF, significantly contributing to impaired quality of life. Although it might be related to gastroesophageal reflux (GER), cough is in most cases secondary to IPF itself, being more common in patients with more advanced disease.( 6 )
Empirical treatment of GER can improve cough in some cases. Few options are available for the treatment of IPF-related cough when traditional antitussives, such as codeine, fail. Despite having no effect on disease progression, corticosteroids (prednisone, 20-30 mg/day) can provide relief of cough.( 1 , 6 ) A randomized study showed that thalidomide (50-100 mg/day p.o.), a glutamic acid derivative, improves cough and quality of life in patients with IPF. However, thalidomide has yet to be approved for this use in Brazil.( 38 ) It has been suggested that gabapentin (300-1,800 mg/day) is also useful for the treatment of cough.( 39 )
Dyspnea
Progressive dyspnea is quite common in patients with IPF, being associated with impaired quality of life and an increased risk of depression and death; in many cases, it is difficult to control.( 40 ) In patients with IPF, dyspnea is due to disease progression and other factors, such as depression, anxiety, and muscle weakness. Although the available evidence is limited, morphine administered orally at low doses (of up to 20 mg/day) can be used in selected cases, the dose being adjusted on the basis of patient response and adverse effects, including somnolence and constipation. ( 6 , 41 ) For hypoxemic patients, oxygen supplementation at rest or during exercise can provide relief of dyspnea (Chart 6). Pulmonary rehabilitation can also contribute to reducing dyspnea.( 42 )
Chart 6. Indications for oxygen therapy in patients with idiopathic pulmonary fibrosis.

Depression and anxiety
Many IPF patients have symptoms of depression and anxiety, which should be routinely investigated in this population. The prevalence of depression in patients with IPF ranges from 25% to 50%, depression being associated with increased dyspnea and functional limitation.( 42 ) Anxiety occurs in 30-40% of cases and is also associated with increased dyspnea.( 42 ) In this context, despite the lack of robust evidence to support it, dyspnea management can improve anxiety and depression symptoms. Other strategies include psychological counseling and the use of anxiolytics and antidepressants.
RECOGNITION OF COMORBIDITIES
Certain comorbidities have been found to be common in patients with IPF. This is due, at least in part, to the fact that patients with IPF are at an advanced age and are usually former smokers. In this context, identification and treatment of comorbidities can contribute to improving quality of life and even survival.
GER
The existence of a relationship between IPF and microaspiration of gastric contents has been known for years and has been supported by biological and clinical data.( 43 ) High levels of gastric substances, such as pepsin, have been found in the BAL fluid of patients with AE of IPF.( 43 ) The presence of hiatal hernia on CT scans of the chest appears to be more common in patients with IPF than in those with other lung diseases, such as asthma and COPD. Acid GER as detected by pH monitoring was a common finding in two separate cohort studies. In one of the studies, 65 patients with IPF were compared with 133 patients with asthma, and acid GER was found to be significantly more common in the former, in whom the prevalence of acid GER was 87%.( 44 ) In the other study, patients with IPF were compared with those with other interstitial lung diseases, and GER was found to be significantly more common in the former than in the latter (94% vs. 50%). ( 45 ) However, in the aforementioned studies,( 44 , 45 ) only 47% and 25%, respectively, of the patients with IPF had classic GER symptoms. These data reinforce that GER symptoms should not be used as a screening tool.
To date, there have been no controlled clinical trials evaluating the effects of GER treatment on patients with IPF. In a case series of 4 IPF patients with GER treated with proton pump inhibitors (PPIs) or gastric fundoplication, stabilization of lung function was reported.( 46 ) Similar results were reported in a study of IPF patients awaiting lung transplantation and undergoing fundoplication for the treatment of symptomatic GER.( 47 ) An analysis of data from three randomized controlled trials revealed that, of the IPF patients who were assigned to the placebo groups of the trials, those who used PPIs or H2 receptor antagonists for 30 weeks had a lower rate of decline in FVC and a lower frequency of AEs.( 48 ) In a retrospective study of 204 patients followed at two medical centers in the USA, using GER medications and having undergone gastric fundoplication significantly increased survival.( 49 )
The use of PPIs, H2 receptor antagonists, or a combination of the two appears to be beneficial for IPF patients, including those who are asymptomatic. However, well-designed controlled clinical trials are needed in order to confirm that. The same appears to be true for gastric fundoplication in selected cases. Therefore, the 2015 ATS/ERS/JRS/ALAT guidelines reaffirm the recommendation made in the 2011 ATS/ERS/JRS/ALAT guidelines, i.e., that patients with IPF should be routinely treated for GER.( 36 )
Lung cancer
The risk of lung cancer is higher in patients with IPF than in the general population. In a study of 890 patients diagnosed with IPF, the risk of lung cancer was reported to be 7.31 times higher in those patients than in the general population, regardless of smoking history.( 50 ) The etiopathogenesis of the association between IPF and lung cancer has yet to be fully elucidated, and previously existing fibrotic abnormalities can hinder radiological detection. The coexistence of IPF and lung cancer interferes with the treatment of both entities, posing a risk of surgical complications, exacerbations, and pulmonary toxicity from drugs and radiation therapy.
Sleep disorders
Patients with IPF can have desaturation during sleep, regardless of the presence of obstructive sleep apnea (OSA). Sleep quality in IPF patients can be impaired by GER, nocturnal cough, use of medications, or even OSA.( 51 ) Sleep quality is worse and OSA and nocturnal desaturation are more common in patients with IPF than in healthy individuals in the same age group.
In one study, a diagnosis of OSA was confirmed by polysomnography in 88% of patients with IPF, most of whom had moderate to severe disease.( 52 ) In another study, nocturnal continuous positive airway pressure therapy was investigated in newly diagnosed IPF patients with moderate to severe OSA.( 53 ) Patients were divided into two groups: the poor-adherence group and the high-adherence group. Although both groups showed improvements in quality of life and sleep quality, improvements were less marked in the poor-adherence group. In addition, during the study period, survival was higher in the high-adherence group. Therefore, OSA should be actively investigated, and treatment with continuous positive airway pressure should be prescribed when indicated.
Pulmonary hypertension
Pulmonary hypertension is a well-recognized complication in patients with IPF, particularly those in the advanced phases of the disease. In patients awaiting lung transplantation, the prevalence of pulmonary hypertension is 46.1%.( 54 ) In most cases, pulmonary hypertension is mild; however, in approximately 9% of cases, it can be severe (mean pulmonary artery pressure ≥ 35 mmHg or mean pulmonary artery pressure ≥ 25 mmHg and a cardiac index of < 2 L/min/m2).
Severe pulmonary hypertension is associated with poor survival.( 1 , 6 ) In two clinical trials in which medication was used in order to reduce pulmonary hypertension in patients with IPF, the primary outcomes were not met.( 55 , 56 ) Nevertheless, in one of the studies, the use of sildenafil was associated with improved PaO2, DLCO, dyspnea, and quality of life. ( 55 ) A post hoc analysis of the data from that study suggested that sildenafil is more likely to be effective in patients with echocardiographic evidence of right ventricular systolic dysfunction.( 57 ) Although there is currently no strong evidence to support the routine use of medications to reduce pulmonary hypertension in patients with IPF, the issue has yet to be resolved.
Pulmonary emphysema
Smoking is a risk factor for IPF and pulmonary emphysema, and the prevalence of emphysema in patients with IPF ranges from 30% to 55%. Although combined pulmonary fibrosis and emphysema has previously been described, there is still debate as to whether it is a specific clinical entity that has a distinct genetic basis or a coincidence in smokers. ( 58 ) Most of the affected individuals are male and present with preserved lung volumes and markedly reduced DLCO. Prognosis is worse in patients with IPF and emphysema than in those with IPF alone. In the former, pulmonary hypertension is more severe and has a greater influence on survival than does reduced lung volumes.( 12 , 59 ) Because of the paucity of data in the literature, the therapeutic approach to such patients remains unclear, being based on oxygen supplementation, smoking cessation, and general measures.
Cardiovascular diseases
Patients with IPF appear to be at an increased risk of cardiovascular disease.( 1 , 6 ) In a study evaluating 920 patients with IPF, the risk of angina, deep vein thrombosis, and acute coronary syndrome was shown to be high in the period before the diagnosis of IPF. ( 60 ) After the diagnosis of IPF, the relative risks of deep vein thrombosis and acute coronary syndrome were found to be particularly high (3.39 and 3.14, respectively). Therefore, regular assessment of cardiovascular and thromboembolic events should be part of the management of IPF during the stable phase and during AEs.
NONPHARMACOLOGICAL TREATMENT
Education
It is essential that patients and their families remain informed of various aspects of the disease, including pathophysiology, symptoms, progression, and treatment (including palliative measures), in order to improve quality of life and prognosis. In addition, when relevant, questions regarding death should be addressed. In this context, for optimal management, patient preferences and beliefs should be valued and discussed by health care providers.
Vaccination
To date, there have been no studies evaluating the impact of vaccination on patients with IPF. However, IPF patients should receive influenza vaccination (annually) and pneumococcal vaccination.( 6 )
Oxygen supplementation
Hypoxemia is quite common in patients with IPF, and many IPF patients require supplemental oxygen during the course of the disease. All IPF patients should be periodically evaluated for hypoxemia at rest and during exercise.( 1 , 6 ) Despite the lack of randomized studies evaluating the impact of oxygen supplementation on mortality in patients with IPF, oxygen supplementation should be used in the situations described in Chart 6.
The oxygen flow rate should be adjusted to maintain SpO2 between 90% and 92%, resulting in improved exercise performance. The need for oxygen supplementation has been shown to be related to the prognosis of IPF patients, an increased required oxygen flow rate at rest translating to a decreased survival rate.( 1 , 6 ) The need for supplemental oxygen during air travel should be evaluated.
Pulmonary rehabilitation
Exercise limitation of varying degrees is common in patients with IPF and has multiple causes, including changes in gas exchange, ventilatory limitation, pulmonary hypertension, and peripheral muscle dysfunction, which can act in isolation or in combination. A pulmonary rehabilitation program involves aerobic training, muscle strengthening exercises, educational lectures, nutritional counseling, and psychosocial support. Although there have been few robust studies evaluating the impact of pulmonary rehabilitation on IPF, pulmonary rehabilitation can improve dyspnea and quality of life, as well as increasing exercise duration and the six-minute walk distance in IPF patients.( 61 ) A recent study demonstrated that the beneficial effects of pulmonary rehabilitation can be long-lasting, meaning that patients with IPF can undergo long-term pulmonary rehabilitation.( 62 ) Therefore, IPF patients should undergo at least 12 weeks of pulmonary rehabilitation, unless there are any contraindications. Pulmonary rehabilitation is safe in such patients, the risk of adverse events being low.
In the absence of a formal pulmonary rehabilitation program, patients can walk for 20-30 min at least three times a week, supplemental oxygen being used when necessary.
Lung transplantation
Lung transplantation is a treatment option that increases survival in patients with IPF.( 1 , 6 ) Among patients awaiting lung transplantation, mortality is highest in those with IPF because of rapid disease progression (in most patients), advanced age, and comorbidities. Therefore, IPF patients should be referred to a transplant center for evaluation in a timely manner, late referral being common in such patients. Ideally, patients should be referred for an initial evaluation at IPF diagnosis, regardless of the degree of dysfunction. The current indications and contraindications for lung transplantation in patients with IPF are shown in Chart 7.( 6 , 63 )
Chart 7. Indications and contraindications for lung transplantation in patients with idiopathic pulmonary fibrosis.
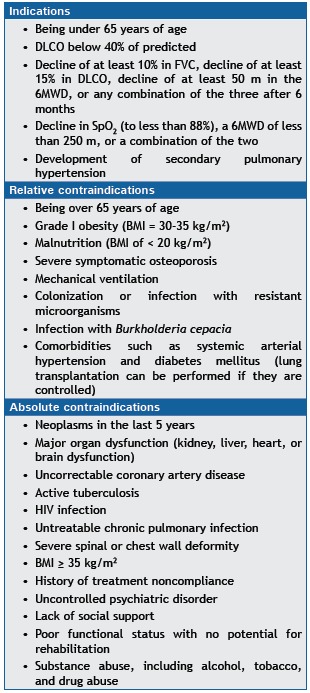
6MWD: six-minute walk distance.
In IPF patients undergoing lung transplantation, 5-year survival is approximately 50% (median survival, 4.5 years), being worse than that in other patients undergoing lung transplantation.
Although lung transplantation improves the prognosis of patients with IPF, only a few procedures are performed in Brazil, meaning that the demand is not being met. This is due to the fact that there are only a few transplantation referral centers in the country and the fact that the number of available donor lungs is quite small.
ACUTE EXACERBATIONS
An AE of IPF is defined as an acute worsening of patient clinical status, lasting less than 30 days and being characterized by increased dyspnea and an increased need for oxygen supplementation, as well as by new chest HRCT findings (ground-glass opacities or bilateral pulmonary consolidation) superimposed on a background pattern consistent with UIP.( 1 , 6 , 64 ) Clinical conditions such as heart failure, pulmonary thromboembolism, pneumothorax, and infection should be ruled out. In order to be characterized as AEs of IPF, these acute deteriorations should be of unidentifiable cause. AEs of IPF are associated with increased mortality and have been reported in up to 85% of cases.( 1 , 6 , 64 )
The incidence of AEs of IPF remains mostly unknown because there is no consensus regarding the definition of AE and because most studies evaluating AEs of IPF are retrospective in nature. The time to IPF diagnosis is possibly associated with an increased risk of AEs. The proportion of patients with AEs in the first year after IPF diagnosis has been reported to be lower than that of those with AEs in the third year after IPF diagnosis.
Risk factors for AEs of IPF are as follows: having an FVC of < 72% of predicted; having a DLCO of < 62%; never having smoked; and having pulmonary arterial hypertension.( 60 ) The risk of 3-month mortality from an AE of IPF is higher in patients with more extensive disease on HRCT scans than in those with less extensive disease. In a systematic review, the risk of death from an AE of IPF was shown to be 60% at 1 month and 67% at 3 months. After an AE of IPF, mean survival is 2.2 months.
The etiology of AEs of IPF is unknown. They might be triggered by a sudden acceleration of the underlying fibrotic disease, infection of unknown etiology, viral infection, thoracic and extrathoracic surgical procedures, bronchoscopy, or microaspiration of gastroesophageal refluxate.
The most common HRCT finding is that of new ground-glass opacities superimposed on a preexisting reticular or honeycomb pattern. The pattern of distribution of opacities appears to be associated with prognosis, small, peripheral opacities being associated with better outcomes and diffuse, multifocal opacities being associated with worse outcomes. Histology shows diffuse alveolar damage superimposed on a pattern consistent with UIP. A pattern of cryptogenic organizing pneumonia and nonspecific acute lung injury without hyaline membrane formation has also been described.
The treatment of AEs of IPF has yet to be established. To date, there have been no randomized, double-blind, placebo-controlled studies on the topic. Guidelines established by respiratory/thoracic societies recommend the use of corticosteroids and intensive clinical care. This is a weak recommendation based on low-quality evidence, with no specific dose, duration of treatment, or route of administration.( 1 , 6 , 64 )
Other therapeutic approaches have been studied, including direct hemoperfusion with a polymyxin B-immobilized fiber column, rituximab, thrombomodulin, and control of GER.( 65 )
Despite the lack of clear clinical evidence, the use of corticosteroids is based on the type of lung injury that occurs during an AE. The most common option is methylprednisolone pulse therapy at a dose of 1.0 g for 3 consecutive days. However, clinical experience suggests that, in some situations, lower doses are equally effective. When bronchoscopy cannot be performed or when infection cannot be completely ruled out, most clinicians tend to administer broad-spectrum antibiotic therapy before or simultaneously with corticosteroids.
FUTURE DIRECTIONS
There have been substantial advances in the field of IPF in recent decades. For the first time, there is a developing body of knowledge regarding IPF and there are molecules that can positively influence the natural history of the disease (Chart 8). In addition, several pharmaceutical companies are currently working on new treatment options for patients with IPF, which until recently was considered an orphan disease. Furthermore, several phase II and III studies involving new molecules, including immunobiological agents, are in progress, and this is good news.
Chart 8. Contemporary treatment of idiopathic pulmonary fibrosis.

It can therefore be assumed that, in the coming decades, survival will increase significantly in patients with IPF, meaning that the number of IPF patients being followed at specialized medical centers will also increase.
Despite the aforementioned advances, a substantial number of challenges remain to be met: (i) increasing patient and physician knowledge of IPF; (ii) developing diagnostic methods for early-stage IPF; (iii) gaining a better understanding of the genetic basis of IPF and of how it interacts with environmental agents; (iv) determining the worldwide incidence, prevalence, and distribution of IPF; (v) expediting the approval process for drugs whose efficacy has been confirmed; and (vi) ensuring universal access to pharmacological and nonpharmacological treatments for IPF.
The fight against IPF can only be won through the combined efforts of basic scientists, clinical researchers, physicians, pharmaceutical companies, associations representing patients and families, and, in many countries, the government.
Footnotes
Study carried out in the Divisão de Pneumologia, Departamento de Clínica Médica, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto (SP) Brasil.
Financial support: None.
REFERENCES
- 1.Raghu G, Collard HR, Egan JJ, Martinez FJ, Behr J, Brown KK. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;183(6):788–824. doi: 10.1164/rccm.2009-040GL. http://dx.doi.org/10.1164/rccm.2009-040GL [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Kawano-Dourado L, Kairalla RA. Usual interstitial pneumonia: a pattern or a disease? A reflection upon the topic. J Bras Pneumol. 2013;39(1):111–112. doi: 10.1590/S1806-37132013000100017. http://dx.doi.org/10.1590/S1806-37132013000100017 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Wells AU. The revised ATS/ERS/JRS/ALAT diagnostic criteria for idiopathic pulmonary fibrosis (IPF)--practical implications. Respir Res. 2013;14 Suppl 1:S2–S2. doi: 10.1186/1465-9921-14-S1-S2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.King TE Jr, Tooze JA, Schwarz MI, Brown KR, Cherniack RM. Predicting survival in idiopathic pulmonary fibrosis: scoring system and survival model. Am J Respir Crit Care Med. 2001;164(7):1171–1181. doi: 10.1164/ajrccm.164.7.2003140. http://dx.doi.org/10.1164/ajrccm.164.7.2003140 [DOI] [PubMed] [Google Scholar]
- 5.Martinez FJ, Safrin S, Weycker D, Starko KM, Bradford WZ, King TE Jr. The clinical course of patients with idiopathic pulmonary fibrosis. Pt 1Ann Intern Med. 2005;142(12):963–967. doi: 10.7326/0003-4819-142-12_part_1-200506210-00005. http://dx.doi.org/10.7326/0003-4819-142-12_Part_1-200506210-00005 [DOI] [PubMed] [Google Scholar]
- 6.Baldi BG, Pereira CA, Rubin AS, Santana AN, Costa AN, Carvalho CR. Highlights of the Brazilian Thoracic Association guidelines for interstitial lung diseases. J Bras Pneumol. 2012;38(3):282–291. doi: 10.1590/s1806-37132012000300002. http://dx.doi.org/10.1590/S1806-37132012000300002 [DOI] [PubMed] [Google Scholar]
- 7.Fischer A. Interstitial lung disease in suggestive forms of connective tissue disease. J Bras Pneumol. 39(6):641–643. doi: 10.1590/S1806-37132013000600001. http://dx.doi.org/10.1590/S1806-37132013000600001 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Morell F, Villar A, Montero MÁ, Mu-oz X, Colby TV, Pipvath S. Chronic hypersensitivity pneumonitis in patients diagnosed with idiopathic pulmonary fibrosis: a prospective case-cohort study. Lancet Respir Med. 2013;1(9):685–694. doi: 10.1016/S2213-2600(13)70191-7. http://dx.doi.org/10.1016/S2213-2600(13)70191-7 [DOI] [PubMed] [Google Scholar]
- 9.Cardoso J, Carvalho I. The value of family history in the diagnosis of hypersensitivity pneumonitis. J Bras Pneumol. 2014;40(2):183–187. doi: 10.1590/S1806-37132014000200013. http://dx.doi.org/10.1590/S1806-37132014000200013 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Pajares V, Puzo C, Castillo D, Lerma E, Montero MA, Ramos-Barbón D. Diagnostic yield of transbronchial cryobiopsy in interstitial lung disease: a randomized trial. Respirology. 2014;19(6):900–906. doi: 10.1111/resp.12322. http://dx.doi.org/10.1111/resp.12322 [DOI] [PubMed] [Google Scholar]
- 11.Cottin V, Cordier JF. Velcro crackles: the key for early diagnosis of idiopathic pulmonary fibrosis? Eur Respir J. 2012;40(3):519–521. doi: 10.1183/09031936.00001612. http://dx.doi.org/10.1183/09031936.00001612 [DOI] [PubMed] [Google Scholar]
- 12.Dias OM, Baldi BG, Costa AN, Carvalho CR. Combined pulmonary fibrosis and emphysema: an increasingly recognized condition. J Bras Pneumol. 2014;40(3):304–312. doi: 10.1590/S1806-37132014000300014. http://dx.doi.org/10.1590/S1806-37132014000300014 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Selman M, King TE, Pardo A, American Thoracic Society; European Respiratory Society; American College of Chest Physicians Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med. 2001;134(2):136–151. doi: 10.7326/0003-4819-134-2-200101160-00015. http://dx.doi.org/10.7326/0003-4819-134-2-200101160-00015 [DOI] [PubMed] [Google Scholar]
- 14.American Thoracic Society Idiopathic pulmonary fibrosis: diagnosis and treatment. International consensus statement. American Thoracic Society (ATS), and the European Respiratory Society (ERS) Pt 1Am J Respir Crit Care Med. 2000;161(2):646–664. doi: 10.1164/ajrccm.161.2.ats3-00. [DOI] [PubMed] [Google Scholar]
- 15.Richeldi L, Davies HR, Ferrara G, Franco F. Corticosteroids for idiopathic pulmonary fibrosis. Cochrane Database Syst Rev. 2003;(3):CD002880–CD002880. doi: 10.1002/14651858.CD002880. http://dx.doi.org/10.1002/14651858.cd002880 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Idiopathic Pulmonary Fibrosis Clinical Research Network, Raghu G, Anstrom KJ, King TE Jr, Lasky JA, Martinez FJ. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. N Engl J Med. 2012;366(21):1968–1977. doi: 10.1056/NEJMoa1113354. http://dx.doi.org/10.1056/NEJMoa1113354 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Ziesche R, Hofbauer E, Wittmann K, Petkov V, Block LH. A preliminary study of long-term treatment with interferon gamma-1b and low-dose prednisolone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 1999;341(17):1264–1269. doi: 10.1056/NEJM199910213411703. http://dx.doi.org/10.1056/NEJM199910213411703 [DOI] [PubMed] [Google Scholar]
- 18.Raghu G, Brown KK, Bradford WZ, Starko K, Noble PW, Schwartz DA. A placebo-controlled trial of interferon gamma-1b in patients with idiopathic pulmonary fibrosis. N Engl J Med. 2004;350(2):125–133. doi: 10.1056/NEJMoa030511. http://dx.doi.org/10.1056/NEJMoa030511 [DOI] [PubMed] [Google Scholar]
- 19.King TE Jr, Albera C, Bradford WZ, Costabel U, Hormel P, Lancaster L. Effect of interferon gamma-1b on survival in patients with idiopathic pulmonary fibrosis (INSPIRE): a multicentre, randomised, placebo-controlled trial. Lancet. 2009;374(9685):222–228. doi: 10.1016/S0140-6736(09)60551-1. http://dx.doi.org/10.1016/S0140-6736(09)60551-1 [DOI] [PubMed] [Google Scholar]
- 20.Demedts M, Behr J, Buhl R, Costabel U, Dekhuijzen R, Jansen HM. High-dose acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med. 2005;353(21):2229–2242. doi: 10.1056/NEJMoa042976. http://dx.doi.org/10.1056/NEJMoa042976 [DOI] [PubMed] [Google Scholar]
- 21.Idiopathic Pulmonary Fibrosis Clinical Research Network, Martinez FJ, de Andrade JA, Anstrom KJ, King TE Jr, Raghu G. Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2093–2101. doi: 10.1056/NEJMoa1401739. http://dx.doi.org/10.1056/NEJMoa1401739 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Iyer SN, Wild JS, Schiedt MJ, Hyde DM, Margolin SB, Giri SN. Dietary intake of pirfenidone ameliorates bleomycin-induced lung fibrosis in hamsters. J Lab Clin Med. 1995;125(6):779–785. [PubMed] [Google Scholar]
- 23.Carter NJ. Pirfenidone in idiopathic pulmonary fibrosis. Drugs. 2011;71(13):1721–1732. doi: 10.2165/11207710-000000000-00000. http://dx.doi.org/10.2165/11207710-000000000-00000 [DOI] [PubMed] [Google Scholar]
- 24.Raghu G, Johnson WC, Lockhart D, Mageto Y. Treatment of idiopathic pulmonary fibrosis with a new antifibrotic agent, pirfenidone: results of a prospective, open-label Phase II study. Pt 1Am J Respir Crit Care Med. 1999;159(4):1061–1069. doi: 10.1164/ajrccm.159.4.9805017. http://dx.doi.org/10.1164/ajrccm.159.4.9805017 [DOI] [PubMed] [Google Scholar]
- 25.Nagai S, Hamada K, Shigematsu M, Taniyama M, Yamauchi S, Izumi T. Open-label compassionate use one year-treatment with pirfenidone to patients with chronic pulmonary fibrosis. Intern Med. 2002;41(12):1118–1123. doi: 10.2169/internalmedicine.41.1118. http://dx.doi.org/10.2169/internalmedicine.41.1118 [DOI] [PubMed] [Google Scholar]
- 26.Azuma A, Nukiwa T, Tsuboi E, Suga M, Abe S, Nakata K. Double-blind, placebo-controlled trial of pirfenidone in patients with idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2005;171(9):1040–1047. doi: 10.1164/rccm.200404-571OC. http://dx.doi.org/10.1164/rccm.200404-571OC [DOI] [PubMed] [Google Scholar]
- 27.Taniguchi H, Ebina M, Kondoh Y, Ogura T, Azuma A, Suga M. Pirfenidone in idiopathic pulmonary fibrosis. Eur Respir J. 2010;35(4):821–829. doi: 10.1183/09031936.00005209. http://dx.doi.org/10.1183/09031936.00005209 [DOI] [PubMed] [Google Scholar]
- 28.Noble PW, Albera C, Bradford WZ, Costabel U, Glassberg MK, Kardatzke D. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomized trials. Lancet. 2011;377(9779):1760–1769. doi: 10.1016/S0140-6736(11)60405-4. http://dx.doi.org/10.1016/S0140-6736(11)60405-4 [DOI] [PubMed] [Google Scholar]
- 29.King TE Jr, Bradford WZ, Castro-Bernardini S, Fagan EA, Glaspole I, Glassberg MK. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2083–2092. doi: 10.1056/NEJMoa1402582. http://dx.doi.org/10.1056/NEJMoa1402582 [DOI] [PubMed] [Google Scholar]
- 30.Hilberg F, Roth GJ, Krssak M, Kautschitsch S, Sommergruber W, Tontsch-Grunt U. BIBF 1120: triple angiokinase inhibitor with sustained receptor blockade and good antitumor efficacy. Cancer Res. 2008;68(12):4774–4782. doi: 10.1158/0008-5472.CAN-07-6307. http://dx.doi.org/10.1158/0008-5472.CAN-07-6307 [DOI] [PubMed] [Google Scholar]
- 31.Rashdan S, Hanna N. Nintedanib for the treatment of non-small-cell lung cancer. Expert Opin Pharmacother. 2014;15(5):729–739. doi: 10.1517/14656566.2014.897695. http://dx.doi.org/10.1517/14656566.2014.897695 [DOI] [PubMed] [Google Scholar]
- 32.Wollin L, Wex E, Pautsch A, Schnapp G, Hostettler KE, Stowasser S. Mode of action of nintedanib in the treatment of idiopathic pulmonary fibrosis. Eur Respir J. 2015;45(5):1434–1445. doi: 10.1183/09031936.00174914. http://dx.doi.org/10.1183/09031936.00174914 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Richeldi L, Costabel U, Selman M, Kim DS, Hansell DM, Nicholson AG. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med. 2011;365(12):1079–1087. doi: 10.1056/NEJMoa1103690. http://dx.doi.org/10.1056/NEJMoa1103690 [DOI] [PubMed] [Google Scholar]
- 34.Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2071–2082. doi: 10.1056/NEJMoa1402584. http://dx.doi.org/10.1056/NEJMoa1402584 [DOI] [PubMed] [Google Scholar]
- 35.Karimi-Shah BA, Chowdhury BA. Forced vital capacity in idiopathic pulmonary fibrosis--FDA review of pirfenidone and nintedanib. N Engl J Med. 2015;372(13):1189–1191. doi: 10.1056/NEJMp1500526. http://dx.doi.org/10.1056/NEJMp1500526 [DOI] [PubMed] [Google Scholar]
- 36.Raghu G, Rochwerg B, Zhang Y, Garcia CA, Azuma A, Behr J. An official ATS/ERS/JRS/ALAT clinical practice guideline: Treatment of idiopathic pulmonary fibrosis. An update of the 2011 clinical practice guideline. Am J Respir Crit Care Med. 2015;192(2):e3–e19. doi: 10.1164/rccm.201506-1063ST. http://dx.doi.org/10.1164/rccm.201506-1063ST [DOI] [PubMed] [Google Scholar]
- 37.Ogura T, Taniguchi H, Azuma A, Inoue Y, Kondoh Y, Hasegawa Y. Safety and pharmacokinetics of nintedanib and pirfenidone in idiopathic pulmonary fibrosis. Eur Respir J. 2015;45(5):1382–1392. doi: 10.1183/09031936.00198013. http://dx.doi.org/10.1183/09031936.00198013 [DOI] [PubMed] [Google Scholar]
- 38.Horton MR, Santopietro V, Mathew L, Horton KM, Polito AJ, Liu MC. Thalidomide for the treatment of cough in idiopathic pulmonary fibrosis: a randomized trial. Ann Intern Med. 2012;157(6):398–406. doi: 10.7326/0003-4819-157-6-201209180-00003. http://dx.doi.org/10.7326/0003-4819-157-6-201209180-00003 [DOI] [PubMed] [Google Scholar]
- 39.Inoue K, Takano H. Gabapentin for refractory chronic cough. Lancet. 2013;381(9867):623–623. doi: 10.1016/S0140-6736(13)60338-4. http://dx.doi.org/10.1016/S0140-6736(13)60338-4 [DOI] [PubMed] [Google Scholar]
- 40.Ryerson CJ, Donesky D, Pantilat SZ, Collard HR. Dyspnea in idiopathic pulmonary fibrosis: a systematic review. J Pain Symptom Manage. 2012;43(4):771–782. doi: 10.1016/j.jpainsymman.2011.04.026. http://dx.doi.org/10.1016/j.jpainsymman.2011.04.026 [DOI] [PubMed] [Google Scholar]
- 41.Allen S, Raut S, Woollard J, Vassallo M. Low dose diamorphine reduces breathlessness without causing a fall in oxygen saturation in elderly patients with end-stage idiopathic pulmonary fibrosis. Palliat Med. 2005;19(2):128–130. doi: 10.1191/0269216305pm998oa. http://dx.doi.org/10.1191/0269216305pm998oa [DOI] [PubMed] [Google Scholar]
- 42.Holland AE, Fiore JF Jr, Bell EC, Goh N, Westall G, Symons K. Dyspnoea and comorbidity contribute to anxiety and depression in interstitial lung disease. Respirology. 2014;19(8):1215–1221. doi: 10.1111/resp.12360. http://dx.doi.org/10.1111/resp.12360 [DOI] [PubMed] [Google Scholar]
- 43.Lee JS. The role of gastroesophageal reflux and microaspiration in idiopathic pulmonary fibrosis. Clin Pulm Med. 2014;21(2):81–85. doi: 10.1097/cpm.0000000000000031. http://dx.doi.org/10.1097/CPM.0000000000000031 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Raghu G, Freudenberger TD, Yang S, Curtis JR, Spada C, Hayes J. High prevalence of abnormal acid gastro-oesophageal reflux in idiopathic pulmonary fibrosis. Eur Respir J. 2006;27(1):136–142. doi: 10.1183/09031936.06.00037005. http://dx.doi.org/10.1183/09031936.06.00037005 [DOI] [PubMed] [Google Scholar]
- 45.Tobin RW, Pope CE 2nd, Pellegrini CA, Emond MJ, Sillery J, Raghu G. Increased prevalence of gastroesophageal reflux in patients with idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 1998;158(6):1804–1808. doi: 10.1164/ajrccm.158.6.9804105. http://dx.doi.org/10.1164/ajrccm.158.6.9804105 [DOI] [PubMed] [Google Scholar]
- 46.Raghu G, Yang ST, Spada C, Hayes J; Pellegrini CA. Sole treatment of acid gastroesophageal reflux in idiopathic pulmonary fibrosis: a case series. Chest. 2006;129(3):794–800. doi: 10.1378/chest.129.3.794. http://dx.doi.org/10.1378/chest.129.3.794 [DOI] [PubMed] [Google Scholar]
- 47.Linden PA, Gilbert RJ, Yeap BY, Boyle K, Deykin A, Jaklitsch MT. Laparoscopic fundoplication in patients with end-stage lung disease awaiting transplantation. J Thorac Cardiovasc Surg. 2006;131(2):438–446. doi: 10.1016/j.jtcvs.2005.10.014. http://dx.doi.org/10.1016/j.jtcvs.2005.10.014 [DOI] [PubMed] [Google Scholar]
- 48.Lee JS, Collard HR, Anstrom KJ, Martinez FJ, Noth I, Roberts RS. Anti-acid treatment and disease progression in idiopathic pulmonary fibrosis: an analysis of data from three randomized controlled trials. Lancet Respir Med. 2013;1(5):369–376. doi: 10.1016/S2213-2600(13)70105-X. http://dx.doi.org/10.1016/S2213-2600(13)70105-X [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Lee JS, Ryu JH, Elicker BM, Lydell CP, Jones KD, Wolters PJ. Gastroesophageal reflux therapy is associated with longer survival in patients with idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2011;184(12):1390–1394. doi: 10.1164/rccm.201101-0138OC. http://dx.doi.org/10.1164/rccm.201101-0138OC [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Hubbard R, Venn A, Lewis S, Britton J. Lung cancer and cryptogenic fibrosing alveolitis. A population-based cohort study. Am J Respir Crit Care Med. 2000;161(1):5–8. doi: 10.1164/ajrccm.161.1.9906062. http://dx.doi.org/10.1164/ajrccm.161.1.9906062 [DOI] [PubMed] [Google Scholar]
- 51.Troy LK, Corte TJ. Sleep disordered breathing in interstitial lung disease: A review. World J Clin Cases. 2014;2(12):828–834. doi: 10.12998/wjcc.v2.i12.828. http://dx.doi.org/10.12998/wjcc.v2.i12.828 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Lancaster H, Mason WR, Parnell JA, Rice TW, Loyd JE, Milstone AP. Obstructive sleep apnea is common in idiopathic pulmonary fibrosis. Chest. 2009;136(3):772–778. doi: 10.1378/chest.08-2776. http://dx.doi.org/10.1378/chest.08-2776 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Mermigkis C, Bouloukaki I, Antoniou K, Papadogiannis G, Giannarakis I, Varouchakis G. Obstructive sleep apnea should be treated in patients with idiopathic pulmonary fibrosis. Sleep Breath. 2015;19(1):385–391. doi: 10.1007/s11325-014-1033-6. http://dx.doi.org/10.1007/s11325-014-1033-6 [DOI] [PubMed] [Google Scholar]
- 54.Shorr AF, Wainright JL, Cors CS, Lettieri CJ, Nathan SD. Pulmonary hypertension in patients with pulmonary fibrosis awaiting lung transplant. Eur Respir J. 2007;30(4):715–721. doi: 10.1183/09031936.00107206. http://dx.doi.org/10.1183/09031936.00107206 [DOI] [PubMed] [Google Scholar]
- 55.Idiopathic Pulmonary Fibrosis Clinical Research Network, Zisman DA, Schwarz M, Anstrom KJ, Collard HR, Flaherty KR. A controlled trial of sildenafil in advanced idiopathic pulmonary fibrosis. N Engl J Med. 2010;363(7):620–628. doi: 10.1056/NEJMoa1002110. http://dx.doi.org/10.1056/NEJMoa1002110 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Corte TJ, Keir GJ, Dimopoulos K, Howard L, Corris PA, Parfitt L. Bosentan in pulmonary hypertension associated with fibrotic idiopathic interstitial pneumonia. Am J Respir Crit Care Med. 2014;190(2):208–217. doi: 10.1164/rccm.201403-0446OC. http://dx.doi.org/10.1164/rccm.201403-0446OC [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Han MK, Bach DS, Hagan PG, Yow E, Flaherty KR, Toews GB. Sildenafil preserves exercise capacity in patients with idiopathic pulmonary fibrosis and right-sided ventricular dysfunction. Chest. 2013;143(6):1699–1708. doi: 10.1378/chest.12-1594. http://dx.doi.org/10.1378/chest.12-1594 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Fell CD. Idiopathic pulmonary fibrosis: phenotypes and comorbidities. Clin Chest Med. 2012;33(1):51–57. doi: 10.1016/j.ccm.2011.12.005. http://dx.doi.org/10.1016/j.ccm.2011.12.005 [DOI] [PubMed] [Google Scholar]
- 59.Mejia M, Carrillo G, Rojas-Serrano J, Estrada A, Suárez T, Alonso D. Idiopathic pulmonary fibrosis and emphysema: decreased survival associated with severe pulmonary arterial hypertension. Chest. 2009;136(1):10–15. doi: 10.1378/chest.08-2306. http://dx.doi.org/10.1378/chest.08-2306 [DOI] [PubMed] [Google Scholar]
- 60.Hubbard RB, Smith C, Le Jeune I, Gribbin J, Fogarty AW. The association between idiopathic pulmonary fibrosis and vascular disease: a population-based study. Am J Respir Crit Care Med. 2008;178(12):1257–1261. doi: 10.1164/rccm.200805-725OC. http://dx.doi.org/10.1164/rccm.200805-725OC [DOI] [PubMed] [Google Scholar]
- 61.Dowman L, Hill CJ, Holland AE. Pulmonary rehabilitation for interstitial lung disease. Cochrane Database Syst Rev. 2014;10:CD006322–CD006322. doi: 10.1002/14651858.CD006322.pub3. http://dx.doi.org/10.1002/14651858.cd006322.pub3 [DOI] [PubMed] [Google Scholar]
- 62.Ryerson CJ, Cayou C, Topp F, Hilling L, Camp PG, Wilcox PG. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203–210. doi: 10.1016/j.rmed.2013.11.016. http://dx.doi.org/10.1016/j.rmed.2013.11.016 [DOI] [PubMed] [Google Scholar]
- 63.Weill D, Benden C, Corris PA, Dark JH, Davis RD, Keshavjee S. A consensus document for the selection of lung transplant candidates: 2014--an update from the Pulmonary Transplantation Council of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant. 2015;34(1):1–15. doi: 10.1016/j.healun.2014.06.014. http://dx.doi.org/10.1016/j.healun.2014.06.014 [DOI] [PubMed] [Google Scholar]
- 64.Collard HR, Moore BB, Flaherty KR, Brown KK, Kaner RJ, King TE Jr. Acute exacerbations of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2007;176(7):636–643. doi: 10.1164/rccm.200703-463PP. http://dx.doi.org/10.1164/rccm.200703-463PP [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Juarez MM, Chan AL, Norris AG, Morrissey BM, Albertson TE. Acute exacerbation of idiopathic pulmonary fibrosis-a review of current and novel pharmacotherapies. J Thorac Dis. 2015;7(3):499–519. doi: 10.3978/j.issn.2072-1439.2015.01.17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Raghu G, Brown KK, Costabel U, Cottin V, du Bois RM, Lasky JA. Treatment of idiopathic pulmonary fibrosis with etanercept: an exploratory, placebo-controlled trial. Am J Respir Crit Care Med. 2008;178(9):948–955. doi: 10.1164/rccm.200709-1446OC. http://dx.doi.org/10.1164/rccm.200709-1446OC [DOI] [PubMed] [Google Scholar]
- 67.King TE Jr, Behr J, Brown KK, du Bois RM, Lancaster L, de Andrade JA. BUILD-1: a randomized placebo-controlled trial of bosentan in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2008;177(1):75–81. doi: 10.1164/rccm.200705-732OC. http://dx.doi.org/10.1164/rccm.200705-732OC [DOI] [PubMed] [Google Scholar]
- 68.Daniels CE, Lasky JA, Limper AH, Mieras K, Gabor E, Schroeder DR. Imatinib treatment for idiopathic pulmonary fibrosis: Randomized placebo-controlled trial results. Am J Respir Crit Care Med. 2010;181(6):604–610. doi: 10.1164/rccm.200906-0964OC. http://dx.doi.org/10.1164/rccm.200906-0964OC [DOI] [PubMed] [Google Scholar]
- 69.King TE Jr, Brown KK, Raghu G, du Bois RM, Lynch DA, Martinez F. BUILD-3: a randomized, controlled trial of bosentan in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2011;184(1):92–99. doi: 10.1164/rccm.201011-1874OC. http://dx.doi.org/10.1164/rccm.201011-1874OC [DOI] [PubMed] [Google Scholar]
- 70.Malouf MA, Hopkins P, Snell G, Glanville AR; Everolimus in IPF Study Investigators. An investigator-driven study of everolimus in surgical lung biopsy confirmed idiopathic pulmonary fibrosis. Respirology. 2011;16(5):776–783. doi: 10.1111/j.1440-1843.2011.01955.x. http://dx.doi.org/10.1111/j.1440-1843.2011.01955.x [DOI] [PubMed] [Google Scholar]
- 71.Noth I, Anstrom KJ, Calvert SB, de Andrade J, Flaherty KR, Glazer C. A placebo-controlled randomized trial of warfarin in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2012;186(1):88–95. doi: 10.1164/rccm.201202-0314OC. http://dx.doi.org/10.1164/rccm.201202-0314OC [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Raghu G, Behr J, Brown KK, Egan JJ, Kawut SM, Flaherty KR. Treatment of idiopathic pulmonary fibrosis with ambrisentan: a parallel, randomized trial. Ann Intern Med. 2013;158(9):641–649. doi: 10.7326/0003-4819-158-9-201305070-00003. http://dx.doi.org/10.7326/0003-4819-158-9-201305070-00003 [DOI] [PubMed] [Google Scholar]
- 73.Raghu G, Million-Rousseau R, Morganti A, Perchenet L, Behr J; MUSIC Study Group. Macitentan for the treatment of idiopathic pulmonary fibrosis: the randomised controlled MUSIC trial. Eur Respir J. 2013;42(6):1622–1632. doi: 10.1183/09031936.00104612. http://dx.doi.org/10.1183/09031936.00104612 [DOI] [PubMed] [Google Scholar]
- 74.Shulgina L, Cahn AP, Chilvers ER, Parfrey H, Clark AB, Wilson EC. Treating idiopathic pulmonary fibrosis with the addition of co-trimoxazole: a randomised controlled trial. Thorax. 2013;68(2):155–162. doi: 10.1136/thoraxjnl-2012-202403. http://dx.doi.org/10.1136/thoraxjnl-2012-202403 [DOI] [PubMed] [Google Scholar]
- 75.Idiopathic Pulmonary Fibrosis Clinical Research Network, Martinez FJ, de Andrade JA, Anstrom KJ, King TE Jr, Raghu G. Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2093–2101. doi: 10.1056/NEJMoa1401739. http://dx.doi.org/10.1056/NEJMoa1401739 [DOI] [PMC free article] [PubMed] [Google Scholar]