Abstract
Aim: The aim of this prospective clinical study was to assess whether it would be possible to reduce the rate of re-excisions and improve the quality using CMOS technology or digital breast tomosynthesis (DBT) compared to a conventional FFDM system. Material and Methods: An invasive breast cancer (BI-RADS 5) was diagnosed in 200 patients in the period from 5/2011 to 1/2012. After histological verification, a breast-conserving therapy was performed with intraoperative imaging. Three different imaging systems were used: 1) Inspiration™ (Siemens, Erlangen, Germany), amorphous selenium, tungsten source, focus 0.1 mm, resolution 85 µm pixel pitch, 8 l/mm as the standard; 2) BioVision™ (Bioptics, Tucson, USA), flat panel photodiode array, tungsten source, focus 0.05, resolution 50 µm pixel pitch, 12 l/mm; 3) Tomosynthesis (Siemens, Erlangen, Germany), amorphous selenium, tungsten source, focus 0.1 mm, resolution 85 µm pixel pitch, 8 l/mm, range: 50°, 25 projections, scan time > 20 s, geometry: uniform scanning, reconstruction: filtered back projection. The 600 radiograms were prospectively shown to 3 radiologists. Results: Out of a total of 200 patients with histologically confirmed breast cancer (BI-RADS 6) 156 patients required no further operative therapy (re-excision) after breast-conserving therapy. A retrospective analysis (n = 44) showed an increase in sensitivity with tomosynthesis compared to the BioVision™ (CMOS technology) and the Inspiration™ at a magnification of 1.0 : 1.0 of 8 % (p < 0.05), i.e. re-excision would not have been necessary in 16 patients with tomosynthesis. Conclusions: The sensitivity of tomosynthesis for intraoperative radiography is significantly (p < 0.05) higher compared to both CMOS technology and an FFDM system with a conventional detector. Additional studies using higher magnification, e.g. 2.0 : 1.0, but no zooming will be necessary to evaluate the method further.
Key words: breast, mammographic density, mammography, breast cancer
Abstract
Zusammenfassung
Ziel: Prospektive Untersuchung, ob mithilfe der CMOS-Technologie bzw. digitalen Brusttomosynthese (DBT) im Vergleich mit einem herkömmlichen FFDM-System eine Senkung der Rate an Re-Exzisionen und damit eine Qualitätssteigerung möglich ist. Material und Methode: In der Zeit von 5/2011 bis 1/2012 wurde bei 200 Patientinnen ein invasives Mammakarzinom (BI-RADS 5) diagnostiziert. Nach histologischer Sicherung erfolgte die brusterhaltende Therapie mit intraoperativem Präparateradiogramm mit 3 unterschiedlichen Systemen: 1. Inspiration™ (Siemens, Erlangen, Deutschland), amorphes Selen, W-Anode, Fokus 0,1 mm, Ortsauflösung 85 µm Pixelpitch, 8 l/mm als Standard. 2. BioVision™ (Bioptics, Tucson, USA), Photodioden Array Flat Panel, W-Anode, Fokus 0,05, Ortsauflösung 50 µm Pixelpitch, 12 l/mm. 3. Tomosynthese (Siemens, Erlangen, Deutschland), amorphes Selen, W-Anode, Fokus 0,1 mm, Ortsauflösung 85 µm Pixelpitch, 8 l/mm, Winkelbereich 50°, 25 Projektionen, Scandauer > 20 s, Geometrie: gleichförmige Abtastung, Rekonstruktion: gefilterte Rückprojektion. Die jeweils 600 Präparateradiogramme wurden prospektiv 3 Radiologen auf einem Befundungsmonitor präsentiert. Ergebnisse: Bei den 200 Patientinnen mit histologisch gesichertem Mammakarzinom (BI-RADS 6) war bei 156 Patientinnen nach erfolgter brusterhaltender Therapie keine weitere operative Therapie (Re-Exzision) indiziert. Die retrospektive Analyse (n = 44) ergab eine Steigerung der Sensitivität der Tomosynthese sowohl gegenüber des BioVision™ (CMOS-Technologie) als auch dem Inspiration™ bei einer Vergrößerung von 1,0 : 1,0 von 8 % (p < 0,05), d. h. bei 16 Patientinnen wäre mit der Tomosynthese eine Re-Exzision nicht notwendig gewesen. Schlussfolgerung: Der Einsatz der Tomosynthese zur Präparateradiografie erreicht eine signifikant (p < 0,05) bessere Sensitivität im Vergleich sowohl zur CMOS-Technologie als auch einem FFDM-System mit herkömmlichem Detektor. Studien unter Verwendung höherer Vergrößerungen, z. B. 2,0 : 1,0, jedoch kein Zooming, sind notwendig zur weiteren Evaluierung der Methode.
Schlüsselwörter: Mamma, mammografische Dichte, Mammografie, Mammakarzinom
Introduction
A womanʼs risk of developing breast cancer sometime in her life is around 10 %. Breast cancer is thus the most common malignant neoplasm in women and the most common cause of death in women between the ages of 35 and 55 years. In Germany, every year 55 000 women develop breast cancer and 20 000 die of it. The individual prognosis for women with breast cancer depends, above all, on the extent of the micro-metastases and the general spread of disease at the time of diagnosis and therapy 1, 2, 3, 4, 5, 6, 7.
The European Guidelines and the S3 Guidelines require that at least 70 % of all malignant breast lesions (BI-RADS 5) are histologically confirmed preoperatively – the target figure is 90 % 8, 9, 10, 11. The goal of preoperative histological verification of a diagnosed malignant lesion is that only a single operative intervention will be necessary. Preoperative histological examination also permits all non-palpable breast lesions to be marked prior to the actual operative intervention (e.g. wire marking) 8, 9, 10, 11.
Radiography is the method of choice to demonstrate complete removal of a lesion. One approach consists of transporting the resected specimen in a suitable container from the operating room directly to the radiology department for imaging 8, 9, 10, 11. In the optimal case, it would be better to carry out imaging (2 planes) of the specimen directly in the operating room. The findings could then be communicated directly both to the operating surgeon and to the pathologist, either on film (analogue/digital) or, even more efficiently, via PACS.
The re-excision rate in the literature for breast cancers after primary breast-conserving therapy for previously histologically confirmed breast cancer lesions (histologically B5 and thus BI-RADS 6) ranges between 10 and 57 %, depending on the defined safety margin 12, 13.
The aim of our prospective clinical study was to see whether the use of CMOS technology (Bioptics) and Tomosynthesis (Siemens) could reduce the re-excision rate compared to established digital full field mammography (Inspiration™, Siemens) in women with histologically confirmed invasive breast cancer undergoing breast-conserving therapy after wire marking of the lesion.
Material and Methods
An invasive breast cancer lesion (BI-RADS 5) diagnosed in 200 patients in the period from 5/2011 to 1/2012 using complementary diagnostics (clinic, mammography, sonography, MRT). Patient age ranged from 24 to 87 years (mean: 61 years). Lesion sizes, depending on the imaging method used, were between 4 mm and 18 mm (mean: 14 mm). All patients underwent targeted punch biopsy or stereotactic vacuum-assisted biopsy preoperatively in accordance with the European Guidelines and the S3 Guidelines 8, 9, 10, 11, and all lesions were classified histologically as B5 and diagnostically as BI-RADS 6. As none of the women had multifocal or multicentric lesions and all tumour diameters were less than 2.0 cm, no neoadjuvant chemotherapy was required in accordance with the S3 Guidelines 10, 11.
After histological classification as B5 and diagnostic classification as BI-RADS 6, all patients underwent targeted wire marking preoperatively, similar to the primary procedure used for histological verification, using either sonography or stereotactic radiography. This was followed by breast-conserving therapy including the sentinel lymph nodes (marking was carried out using acid blue or technetium 99m). The resected specimen was then marked (for orientation) (3 planes) and radiologically investigated (without compression) around the wire still placed in the segment 14 under AEC (automatic exposure control) using 3 different systems (Inspiration™, 2 planes, system 1; BioVision™, 2 planes, system 2; Tomosynthesis, 1 plane, system 3) magnification 1.0 : 1.0 (Table 1):
Table 1 Important basic technical characteristics and features of the systems (system 1: Inspiration™; system 2: BioVision™) for specimen radiograms. Tomosynthesis (system 3) creates projection slides/cine mode (angular range: 50°, 25 projections, scan time > 20 s, uniform scanning geometry, reconstruction of filtered back projections).
| System 1: Inspiration™ | System 2: BioVision™ | System 3: Tomosynthesis | |
| Manufacturer | Siemens | Bioptics | Siemens |
| Anode | Mo, W | W | Mo, Rh |
| Filter | Mo, Rh | beryllium | Mo, Rh |
| Scattered radiation grid | linear | no | linear |
| Conversion material | semiconductora-Se | photon conversion material: Gd202S: Tb (terbium-doped gadolinium oxysulfide) phosphorus | semiconductora-Se |
| Selection process | thin film transistors | progressive line-scan selection | thin film transistors |
| Pixel size | 85 µm | 50 µm | 85 µm |
| Spatial resolution (Nyquist frequency) | 8 Lp/mm | 12 Lp/mm | 8 Lp/mm |
| Field size | 24 × 30 cm2 | 24 × 30 cm2 | 24 × 30 cm2 |
Inspiration™ (Siemens, Erlangen, Germany), amorphous selenium, tungsten source, focus 0.1 mm, spatial resolution 85 µm pixel pitch, 8 l/mm, the standard.
BioVision™ (Bioptics, Tucson, USA), flat panel photodiode array, tungsten source, focus 0.05, spatial resolution 50 µm pixel pitch, 12 l/mm.
Tomosynthesis (Siemens, Erlangen, Germany), amorphous selenium, tungsten source, focus 0.1 mm, spatial resolution 85 µm pixel pitch, 8 l/mm, range 50°, 25 projections, scan time > 20 s, geometry: uniform scanning, reconstruction: filtered back projection.
Radiological images (digital full field mammography: Inspiration™, 2 planes, standard; CMOS technology, Bioptics, 2 planes; Tomosynthesis, 1 plane, 25 projections, cine mode) of the 200 segments resected during breast-conserving therapy were shown prospectively to 3 radiologists with varying degrees of experience in digital mammography, randomly allocated to the respective radiologist (random generator) who were only aware of the initial findings (histological classification B5, diagnostic classification BI-RADS 6). Images were shown intraoperatively to the radiologists on an monitor (Figs. 1 to 3). The results of the findings (focal lesion with sufficient safety margins [1.0 cm]) for all 3 types of radiological images [2 planes or 25 projections] or not) 10, 11 were correlated with the subsequent detailed histological findings; all 3 radiologists came to similar assessments.
Fig. 1.
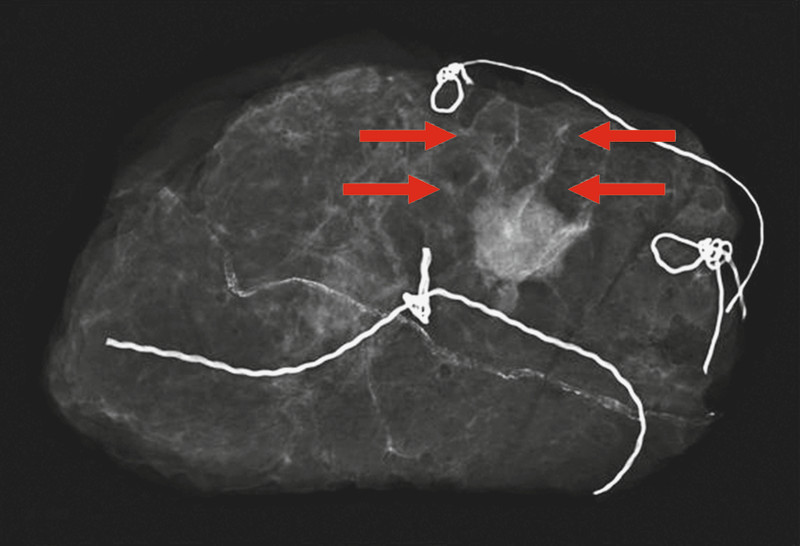
Radiological imaging: Inspiration™. Magnification 1.0 × 1.0; invasive breast cancer pT1cN0M0; diameter of the tumour: 1.6 cm; extent and differentiation of spiculations (arrows) from surrounding tissue could not be assessed.
Fig. 3.
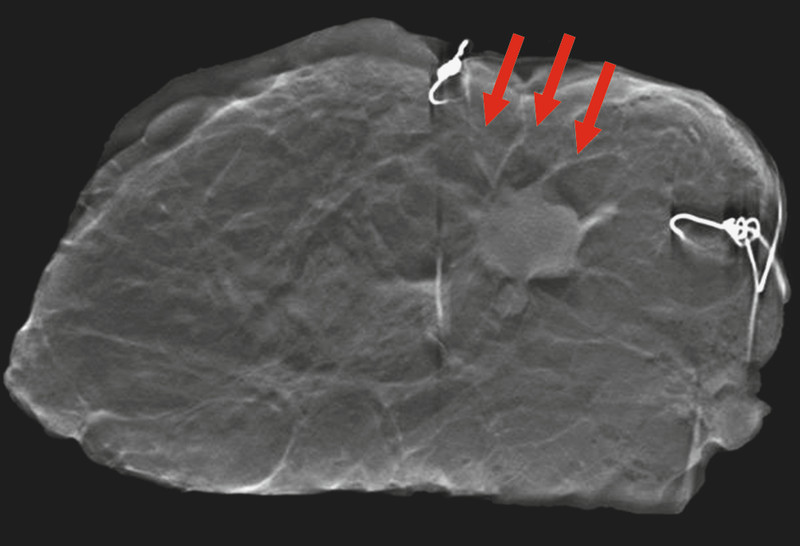
Tomosynthesis, image 7 of 25. Magnification 1.0 × 1.0; invasive breast cancer pT1cN0M0; diameter of the tumour: 1.6 cm; extent and differentiation of spiculations (arrows) from surrounding tissue could be clearly evaluated (with imaging and then confirmed histologically).
Results
Out of a total of 200 patients with histologically confirmed breast cancer (BI-RADS 6), 156 patients required no further operative intervention (re-excision) after breast-conserving therapy – findings which were confirmed by radiographic imaging done directly (intraoperatively) during the primary intervention (focal lesion with sufficient safety margins [1,0 cm] in all 3 types of radiological images). The radiogram in 2 planes, magnification 1.0 : 1.0 was defined as the standard (Fig. 1).
Subsequently, based on the standard radiographic image (Inspiration™, 2 planes, magnification 1.0 : 1.0) and the pathological findings (10 specimens, no resection margins in healthy tissue; 34 specimens, lesion had a histological safety margin < 1.0 cm), re-excision was carried out in 44 patients. Investigations carried out in parallel using CMOS technology (2 planes, magnification 1.0 : 1.0 (Fig. 2) and Tomosynthesis (25 projections, cine mode, magnification 1.0 : 1.0) (Fig. 3) showed that with Tomosynthesis only 28 patients would have required re-excision based on the above criteria.
Fig. 2.
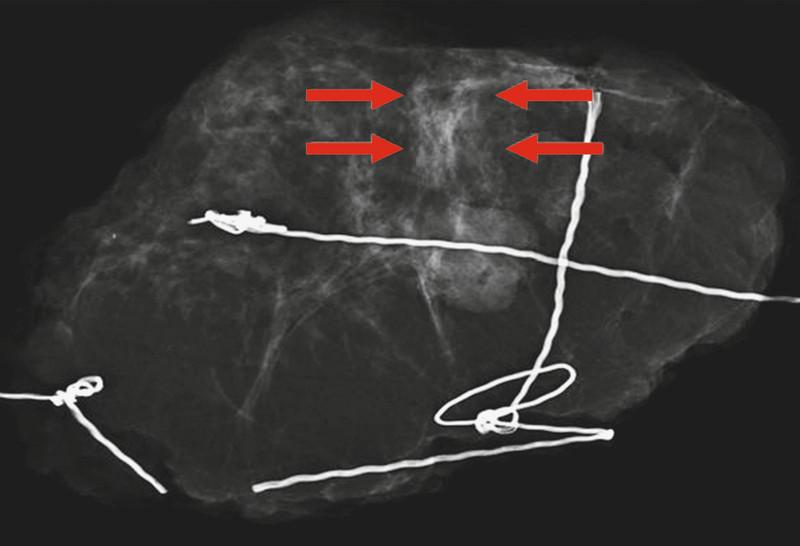
BioVision™. Magnification 1.0 × 1.0; invasive breast cancer pT1cN0M0; diameter of the tumour: 1.6 cm; extent and differentiation of spiculations (arrows) from surrounding tissue could not be assessed.
The final histopathological results for 44 operated patients (re-excision) showed that while in 10 patients the primary operation had not included the resection of margins in healthy tissue, only 12 other patients had a safety margin of < 1.0 cm, i.e. with no tumour remnants. This means that re-excision based on the final histopathological results would have been only justified in 22 patients. In 22 patients, the situation could be settled intraoperatively during the primary intervention, while in 22 patients a second intervention was required. Seven of these patients had invasive and 15 patients had intraductal tumour lesions.
A retrospective analysis (n = 44) which directly compared the radiographic images demonstrated an increased sensitivity of Tomosynthesis of 8 % (p < 0.05) compared to both the BioVision™ (CMOS technology) and the Inspiration™ at a magnification of 1.0 : 1.0, i.e., using Tomosynthesis re-excision would not have been necessary in 16 patients (Tables 2 and 3).
Table 2 Sensitivity and specificity of all three systems (system 1: Inspiration™; system 2: BioVision™, and system 3: Tomosynthesis) as determined by 3 radiologists through the prospective assessment of 600 specimen radiograms/projection slides (cine mode) from 200 patients with a total of 200 malignant lesions.
| Sensitivity (%) | Specificity (%) | |||||
| Magnification1.0 : 1.0 (all 3 systems) | System 1 Inspiration (85 µm) | System 2 BioVision (50 µm) | System 3 Tomosynthesis (85 µm) | System 1 Inspiration (85 µm) | System 2 BioVision (50 µm) | System 3 Tomosynthesis (85 µm) |
| Radiologist 1 | 78.0 | 79.0 | 86.0 | 100.0 | 100.0 | 100.0 |
| Radiologist 2 | 79.0 | 78.0 | 87.0 | 100.0 | 100.0 | 100.0 |
| Radiologist 3 | 78.0 | 78.0 | 87.0 | 100.0 | 100.0 | 100.0 |
| Mean | 78.3 | 78.3 | 86.6 | 100.0 | 100.0 | 100.0 |
Table 3 Detailed representation of results (R0/R1) (n = 200 specimens) for the three diagnostic systems (system 1: Inspiration™; system 2: BioVision™; system 3: Tomosynthesis) and the final histological result.
| n = 200 | |||
| Diagnostics: histology | R0: n = 156 | ||
| Diagnostics: Inspiration™ | R1: n = 44 | ||
| Diagnostics: BioVision™ | R1: n = 44 | Histology | R1: n = 22/R0: n = 22 |
| Diagnostics: Tomosynthesis | R1: n = 28 |
Discussion
The effectiveness of breast cancer therapy 1, 2, 3, 4, 5, 6, 7 can be increased during operations, i.e. intraoperatively, through the use of additional radiological imaging 10, 11. This should be done, where possible, on 2 planes in accordance with the specifications of the European Guidelines and the S3 Guidelines 8, 9, 10, 11. This would give surgeons immediate confirmation of the success of resection during an intervention. Direct imaging of the specimen over 2 planes could permit re-resection to be carried out immediately when the pathology has not been entirely contained by the specimen. The use of digital film combined with conventional analogue mammography already represents a big step forward. The procedure uses CCD chips and thus offers the possibility of using PACS, but its DQE (detector quantum efficiency) is much poorer compared to that of more recent fully digital systems 14, 15, 16, 17, 18, 19, 20, 21, 22. In the last 10–15 years, developments in radiology have focussed mainly on the creation of specimen radiograms which can be viewed at many different locations (e.g. the operating room, the radiology department, the pathology department). Here too, there has been a gradual switch from conventional systems using slides to fully digital systems 14, 15, 16, 17, 18, 19, 20, 21, 22 to CMOS technology 23 and Tomosynthesis 24. The most recent developments in digital breast tomosynthesis (DBT) 25, 26, 27, 28, 29, 30, 31, 32 make it possible to create specimen radiograms intraoperatively 24. The 3 investigating radiologists assessed 200 specimens (specimen radiograms) randomly assigned to them (random generator) with only a prior knowledge of the initial pathology findings (histological classification B5, diagnostic classification BI-RADS 6). Assessment of images created with the BioVision™ system (system 2: 2 planes) and with Tomosynthesis (1 plane) using both projection slides and the cine mode (system 3) was done intraoperatively. However, specimen radiographs in 2 planes (as created by system 1) were defined as the standard, and re-excision was performed in 44 patients based on this standard.
A direct comparison of the images created by Tomosynthesis compared to those of the BioVision™ and the Inspiration™ showed an increase of sensitivity of 8 % (p < 0.05). The reason for this may be that Tomosynthesis makes it possible to characterise the structure of breast parenchyma in the mammogram (c–c and obliq.) more precisely 30. The specimen radiograms showed a better differentiation (spiculations of the tumorous lesion and DCIS compared to surrounding benign parenchyma). The fact that the radiologists were aware of the initial diagnosis and findings constitutes a certain limitation of the results.
The breast re-excision rate after primary breast-conserving therapy (BET) for cancer lesions previously confirmed histologically (histological classification: B5 and therefore BI-RADS 6) was 22 % in our historical collective of patients but also in the retrospective assessment of our current collective. In the literature, the breast re-excision rate after BET is reported to be between 10 and 57 %, depending on the definition of the safety margin 12, 13. Quality only improved substantially with the introduction of the S3 Guidelines, the treatment of patients in certified breast centres, and the introduction of digital technologies 12. In future, to further reduce the re-excision rate, not simply in order to comply with the European Guidelines or S3 Guidelines but to spare patients from having to undergo a second operative intervention with all the side effects this entails, a volumetric assessment based on Tomosynthesis could offer an important contribution to mammography 31. However, it should be noted that our Tomosynthesis results corresponded to or even exceeded those provided by digital specimen radiograms, even with the use of zooming 23, 33, 34, 35, 36. To potentially improve results and thus the quality of specimen radiograms even more and to further reduce the rate of re-excisions, comparative studies of Tomosynthesis and specimen radiograms in real magnification (e.g. by a factor of 2.0) but without zooming would be necessary. The future use of 3-D technology in mammography including 3-D specimen radiograms also offers the potential to improve quality. The prerequisite for this is the integration of all components in an efficient PACS system for the online exchange of information between diagnosticians, pathologists and surgeons as part of a quality management drive 37.
Einleitung
Das Risiko einer Frau, im Laufe ihres Lebens an einem Mammakarzinom zu erkranken, beträgt etwa 10 %. Das Mammakarzinom ist damit die häufigste bösartige Geschwulst der Frau und die häufigste Todesursache für Frauen zwischen dem 35. und 55. Lebensjahr. In Deutschland erkranken pro Jahr 55 000 Frauen am Mammakarzinom, 20 000 versterben daran. Die individuelle Prognose von Patientinnen mit Mammakarzinom wird vor allem von dem Ausmaß der Mikrometastasierung und Generalisierung der Erkrankung zum Zeitpunkt der Diagnose und der Therapie bestimmt 1, 2, 3, 4, 5, 6, 7.
Sowohl gemäß der European Guidelines als auch der S3-Leitlinien wird gefordert, dass mindestens 70 % aller malignen Brustläsionen (BI-RADS 5) präoperativ histologisch zu verifizieren sind – gewünscht werden sogar 90 % 8, 9, 10, 11. Hierdurch soll erreicht werden, dass durch die präoperative Abklärung eines diagnostisch malignen Prozesses in Folge nur ein einzeitiger operativer Eingriff notwendig wird. Hinzukommend sind vor dem eigentlichen operativen Eingriff alle nicht palpablen Brustläsionen entsprechend zu markieren (z. B. Draht) 8, 9, 10, 11.
Die Präparateradiografie wird vielfach dann als Mittel der Wahl zum Nachweis der vollständigen Entfernung der Läsion angesehen. Als möglicher Weg wird dabei aufgezeigt, das Präparat vom OP-Saal zur Radiologie in einem entsprechenden Behältnis zu transportieren, um dort direkt geröntgt zu werden 8, 9, 10, 11 oder aber optimiert direkt intraoperativ im Operationssaal die Präparateradiografie (2 Ebenen) anzufertigen. Das Ergebnis der Präparateradiografie wird anschließend direkt sowohl dem Operateur als auch dem Pathologen mitgeteilt, entweder durch das Medium Film (analog/digital) oder aber effizienter direkt über das PACS.
Die Mamma-Re-Exzisionsrate nach primär brusterhaltender Therapie (BET) bei zuvor histologisch nachgewiesenem Mammakarzinom (histologisch B5 und damit BI-RADS 6) beträgt in Abhängigkeit des definierten Sicherheitssaums in der Literatur zwischen 10 und 57 % 12, 13.
Das Ziel unserer prospektiven Untersuchung war es zu evaluieren, ob mithilfe der CMOS-Technologie (Fa. Bioptics) und der Tomosynthese (Fa. Siemens) im Vergleich mit einem etablierten digitalen Vollfeld-Mammografiegerät (Inspiration™, Fa. Siemens), eine Senkung der Rate an Re-Exzisionen bei histologisch gesichertem invasivem Mammakarzinom und anschließend folgender brusterhaltender Therapie nach Drahtmarkierung möglich ist.
Material und Methoden
In der Zeit von 5/2011 bis 1/2012 wurde bei 200 Patientinnen aufgrund der komplementären Diagnostik (Klinik, Mammografie, Sonografie, MRT) ein invasives Mammakarzinom (BI-RADS 5) diagnostiziert. Das Alter der Patientinnen lag zwischen 24 und 87 Jahren (median: 61 Jahre). Die Größe der Läsionen lag nach den bildgebenden Verfahren zwischen 4 mm und 18 mm (median: 14 mm). Gemäß der European Guidelines und der S3-Leitlinien 8, 9, 10, 11 erfolgte bei allen Patientinnen präoperativ eine sonografisch gezielte Stanz- bzw. stereotaktisch/röntgenologisch geführte Vakuumbiopsie mit dem histologischen Ergebnis B5, diagnostisch dann BI-RADS 6. Da in allen Fällen keine Multifokalität bzw. -zentrizität bestand und die Größenausdehnung unter 2,0 cm lag, erfolgte aufgrund der S3-Leitlinien keine primäre neoadjuvante Chemotherapie 10, 11.
Nach der histologischen Diagnose B5, diagnostisch BI-RADS 6, wurde bei allen Patientinnen präoperativ entsprechend dem primären Verfahren der histologischen Sicherung der Befunde eine sonografisch geführte oder aber stereotaktisch/röntgenologisch gezielte Drahtmarkierung durchgeführt. Anschließend erfolgte eine brusterhaltende Therapie einschließlich Sentinel Lymph Node (Markierung sowohl mit Patentblau als auch mit Technetium-99m). Das operierte Segment wurde daraufhin fadenmarkiert (Orientierung) (3 Ebenen) und bei im Segment noch platzierten Draht radiologisch kompressionsfrei 14 mit 3 unterschiedlichen Systemen und jeweils unter AEC (Automatic Exposure Control) untersucht (Präparateradiografie) (Inspiration™, 2 Ebenen, System 1; BioVision™, 2 Ebenen, System 2; Tomosynthese, 1 Ebene, System 3) jeweils Vergrößerung 1,0 : 1,0 (Tab. 1):
Inspiration™ (Siemens, Erlangen, Deutschland), amorphes Selen, W-Anode, Fokus 0,1 mm, Ortsauflösung 85 µm Pixelpitch, 8 l/mm als Standard.
BioVision™ (Bioptics, Tucson, USA), Photodioden Array Flat Panel, W-Anode, Fokus 0,05, Ortsauflösung 50 µm Pixelpitch, 12 l/mm.
Tomosynthese (Siemens, Erlangen, Deutschland), amorphes Selen, W-Anode, Fokus 0,1 mm, Ortsauflösung 85 µm Pixelpitch, 8 l/mm, Winkelbereich 50°, 25 Projektionen, Scandauer > 20 s, Geometrie: gleichförmige Abtastung, Rekonstruktion: gefilterte Rückprojektion.
Die insgesamt bei 200 operierten Segmenten bei brusterhaltender Therapie angefertigten radiologischen Untersuchungen (digitale Vollfeldmammografie (Inspiration™) (2 Ebenen) (Standard); CMOS-Technologie (Bioptics) (2 Ebenen); Tomosynthese (1 Ebene) (25 Projektionen und Cine-Mode); wurden prospektiv 3 Radiologen mit unterschiedlicher Erfahrung in digitaler Mammografie zufallsverteilt (Zufallsgenerator), nur in Kenntnis des Ausgangsbefundes (histologisch Diagnose B5, diagnostisch BI-RADS 6), intraoperativ auf einem Befundungsmonitor präsentiert (Abb. 1 bis 3). Die Ergebnisse der Befundung (Herd in allen 3 Ebenen mit ausreichendem Sicherheitssaum (1,0 cm) in der Präparateradiografie (2 Ebenen bzw. 25 Projektionen) enthalten oder nicht) 10, 11 wurden mit dem abschließenden ausführlichen histologischen Gesamtbefund korreliert, wobei die 3 Befunder zu vergleichbaren Beurteilungen kamen.
Ergebnisse
Bei den 200 Patientinnen mit histologisch gesichertem Mammakarzinom (BI-RADS 6) war bei 156 Patientinnen nach erfolgter brusterhaltender Therapie keine weitere operative Therapie (Re-Exzision) indiziert – bestätigt durch direkt während der primären Operation (intraoperativ) durchgeführte Präparateradiogramme (Herd in allen 3 Ebenen mit ausreichendem Sicherheitssaum [1,0 cm] in der Präparateradiografie enthalten). Als Standard wurde dabei das Präparateradiogramm in 2 Ebenen, Vergrößerung 1,0 : 1,0 definiert (Abb. 1).
Anschließend wurde bei 44 Patientinnen aufgrund der Standardpräparateradiografie (Inspiration™, 2 Ebenen, Vergrößerung 1,0 : 1,0) und des pathologischen Befundes (10 Präparate, Operation non in sano; 34 Präparate, Läsion histologisch mit einem Sicherheitsabstand < 1,0 cm) eine Re-Exzision durchgeführt. Die parallel durchgeführte Untersuchung mit der CMOS-Technologie (2 Ebenen, Vergrößerung 1,0 : 1,0 (Abb. 2) und der Tomosynthese (25 Projektionen und Cine-Mode, Vergrößerung 1,0 : 1,0) (Abb. 3) ergab, dass bei der Tomosynthese lediglich bei 28 Pat. eine Re-Exzision aufgrund der angegebenen Kriterien notwendig sei.
Das endgültige histopathologische Ergebnis der 44 operierten Patientinnen (Re-Exzision) ergab dann das Ergebnis, dass bei 10 Patientinnen die primäre Operation non in sano erfolgt war, aber nur bei 12 Patientinnen, dass der Sicherheitsabstand < 1,0 cm vorlag, d. h. keine Resttumoranteile mehr nachweisbar waren. Dies bedeutet, dass eine Re-Exzision aufgrund des endgültigen histopathologischen Befundes nur bei 22 Patientinnen gerechtfertigt gewesen wäre. Bei 22 Patientinnen konnte die Situation noch intraoperativ beim Ersteingriff geklärt werden, bei 22 Patientinnen war ein 2-zeitiger Eingriff notwendig – es lagen bei 7 Patientinnen invasive bzw. bei 15 Patientinnen intraduktale Tumoranteile vor.
Die retrospektive Analyse (n = 44) im direkten Vergleich der Präparateradiogramme ergab eine Steigerung der Sensitivität der Tomosynthese sowohl gegenüber des BioVision™ (CMOS-Technologie) als auch dem Inspiration™ bei einer Vergrößerung von 1,0 : 1,0 von 8 % (p < 0,05), d. h. bei 16 Patientinnen wäre mit der Tomosynthese eine Re-Exzision nicht notwendig gewesen (Tab. 2 und 3).
Diskussion
Die Effektivität in der Behandlung des Mammakarzinoms 1, 2, 3, 4, 5, 6, 7 kann während, d. h. intraoperativ, durch zusätzliche Präparateradiogramme gesteigert werden 10, 11. Diese sollten nach Vorgabe der European Guidelines und der S3-Leitlinien nach Möglichkeit in 2 Ebenen durchgeführt werden 8, 9, 10, 11. So besteht die Möglichkeit, noch während der Operation die unmittelbare Bestätigung für den Operationserfolg zu erhalten. Durch die direkte Darstellung des Präparats in 2 Ebenen kann bei nicht im Präparat enthaltener Pathologie unmittelbar eine Nachresektion erfolgen. Ein großer Fortschritt war sicher, dass über die Nutzung konventioneller, analoger Mammografieeinrichtungen die digitalen Speicherfolien zum Einsatz kamen. Dieses Verfahren beruht auf CCD-Chips und der damit verbundenen Möglichkeiten der Nutzung des PACS – hat aber zu den aktuell vorhandenen volldigitalen Systemen eine deutlich schlechtere DQE (Detector Quantum Efficiency) 14, 15, 16, 17, 18, 19, 20, 21, 22. In den letzten 10–15 Jahren gab es nun Entwicklungen von Röntgeneinrichtungen ausschließlich zur Erstellung von Präparateradiogrammen, welche an unterschiedlichen Orten benutzt werden konnten (z. B. OP, Röntgenabteilung, Pathologie). Hierbei gab es ebenfalls eine Innovation von konventionellen, über Speicherfolien zu volldigitalen Systemen 14, 15, 16, 17, 18, 19, 20, 21, 22 bis hin zur CMOS-Technologie 23 und dem Einsatz der Tomosynthese 24. Durch die Neuentwicklung der digitalen Brusttomosynthese (DBT) 25, 26, 27, 28, 29, 30, 31, 32 besteht nun auch die Möglichkeit der Erstellung intraoperativer Präparateradiogramme 24. Die 3 Untersucher beurteilten zufallsverteilt (Zufallsgenerator), nur in Kenntnis des Ausgangsbefundes (histologisch Diagnose B5, diagnostisch BI-RADS 6), intraoperativ auf einem Befundungsmonitor die 200 Präparate (Präparateradiografie) mit dem BioVision™-System, 2 Ebenen (System 2) und der Tomosynthese (1 Ebene) einerseits sowohl anhand der Projektionsbilder als auch im Cine-Mode (System 3), wobei als Standard das Präparateradiogramm in 2 Ebenen (System 1) definiert wurde, aufgrund dessen bei 44 Patientinnen eine Re-Exzision durchgeführt wurde.
Im direkten Vergleich der Ergebnisse der Präparateradiografie von Tomosynthese zu BioVision™ und Inspiration™ ergab sich eine Steigerung der Sensitivität von 8 % (p < 0,05). Der Grund hierfür mag darin bestehen, dass die Tomosynthese es ermöglicht, die Textur des Brustparenchyms in der Übersichtsmammografie (c–c und obliq.) genauer zu charakterisieren 30 und dies sich nun in den Präparateradiogrammen ebenfalls zeigt: bessere Abgrenzbarkeit (Spiculae- und DCIS-Anteile des tumorösen Geschehens im Vergleich zum übrigen benignen Drüsenparenchym). Eine gewisse Einschränkung der Ergebnisse war sicher dadurch gegeben, dass den Befundern der Ausgangsbefund bekannt war.
Die Mamma-Re-Exzisionsrate nach primär brusterhaltender Therapie (BET) bei zuvor histologisch nachgewiesenem Mammakarzinom (histologisch: B5 und damit BI-RADS 6) beträgt in unserem historischen Patientinnenkollektiv, aber auch aktuell in unserer retrospektiven Auswertung 22 %, welche in Abhängigkeit des definierten Sicherheitssaums in der Literatur zwischen 10 und 57 % liegt 12, 13. Erst durch die Einführung der S3-Leitlinien und der Behandlung der Patientinnen in zertifizierten Brustzentren und digitaler Techniken ist es gelungen, die Qualität entscheidend zu verbessern 12. Um eine Senkung der Re-Exzisionsrate, nicht um die European Guidelines oder S3-Leitlinien zu erfüllen, sondern insbesondere den Patientinnen einen operativen Zweiteingriff mit all seinen Nebenwirkungen zu ersparen, zu erreichen, könnte die auf der Basis der Tomosynthese zukünftig bestehende Möglichkeit der Volumetrie in der Mammografietechnik einen wesentlichen Beitrag leisten 31. Darüber hinaus entsprechen bzw. übertreffen unsere Ergebnisse denen für Präparateradiogramme in digitaler Technik auch unter Verwendung des Zoomings 23, 33, 34, 35, 36. Um eventuell die Ergebnisse und damit die Qualität der Präparateradiografie noch zu verbessern und die Rate an Re-Exzisionen weiter zu reduzieren, wären vergleichende Untersuchungen von Tomosynthese und Präparateradiografien in realer Vergrößerung (z. B. Faktor 2,0), jedoch kein Zooming, notwendig. Ein weiteres Potenzial der Qualitätssteigerung könnte sich aber auch durch die zukünftige 3-D-Technologie in der Mammografie einschließlich der dann auch zu erwartenden 3-D-Präparateradiografie ergeben – Voraussetzung hierzu ist die Integration aller Komponenten in ein leistungsfähiges PACS zum Online-Austausch von Diagnostiker, Pathologen und Therapeuten im Rahmen des Qualitätsmanagements 37.
Footnotes
Conflict of Interests/Interessenkonflikt None./Nein.
Supporting Information
German supporting informations for this article
References
- 1.Ruckhaberle E, Solbach C, Kaufmann M. Conference report on the 31st annual San Antonio breast cancer symposium, December 10–14, 2008 “Continuing change in diagnostics and therapy of breast cancers – from molecular basics to tailored therapy”. Geburtsh Frauenheilk. 2009;69:202–211. [Google Scholar]
- 2.Kaufmann M, Rody A. Breast cancer: reduced mortality by early detection and adjuvant therapy. Geburtsh Frauenheilk. 2009;69:218–232. [Google Scholar]
- 3.Katalinic A. Breast cancer: declining mortality despite its increasing incidence. Geburtsh Frauenheilk. 2009;69:237–239. [Google Scholar]
- 4.Beckmann M W, Blohmer J U, Costa S D. et al. Zurich consensus: German expert opinion on the St. Gallen votes on 15 March 2009 (11th international conference at St. Gallen: primary therapy of early breast cancer) Geburtsh Frauenheilk. 2009;69:377–383. doi: 10.1159/000212164. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Ruckhaberle E, Rody A, Kaufmann M. Report of the 32nd annual St. Antonio breast cancer symposium, December 10–13, 2009 “An international scientific symposium for interaction and exchange among basic scientists and clinicians in breast cancer”. Geburtsh Frauenheilk. 2010;70:177–183. [Google Scholar]
- 6.Fasching P A, Fehm T, Janni W. et al. Breast cancer therapy – a state of the art review. Geburtsh Frauenheilk. 2010;70:875–886. [Google Scholar]
- 7.Fasching P A, Ekici A B, Adamietz B R. et al. Breast cancer risk – genes, environment and clinics. Geburtsh Frauenheilk. 2011;71:1056–1066. doi: 10.1055/s-0031-1280437. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Perry N M. Quality assurance in the diagnosis of breast disease. Eur J Cancer. 2001;37:159–172. doi: 10.1016/s0959-8049(00)00337-3. [DOI] [PubMed] [Google Scholar]
- 9.Wallis M, Tardivon A, Helbich T. et al. Guidelines from the European Society of Breast Imaging for diagnostic interventional breast procedures. Eur Radiol. 2007;17:581–588. doi: 10.1007/s00330-006-0408-x. [DOI] [PubMed] [Google Scholar]
- 10.Albert U SHrsg.S3-Leitlinie Brustkrebs-Früherkennung in Deutschland1. Aktualisierung 2008.München: W. Zuckschwerdt-Verlag; 2008http://www.senologie.org [Google Scholar]
- 11.Kreienberg R Kopp I Albert U S et al. S3-Leitlinie Diagnostik, Therapie und Nachsorge des Mammakarzinoms1. Aktualisierung.München: W. Zuckschwerdt-Verlag; 2008http://www.senologie.org [Google Scholar]
- 12.Bani M R, Lux M P, Heusinger K. et al. Factors correlating with reexcision after breast-conserving therapy. EJSO. 2009;35:32–37. doi: 10.1016/j.ejso.2008.04.008. [DOI] [PubMed] [Google Scholar]
- 13.DʼOrsi C J. Management of the breast specimen. Radiology. 1995;194:297–302. doi: 10.1148/radiology.194.2.7824700. [DOI] [PubMed] [Google Scholar]
- 14.Grunert J-H, Wiechmann U, Gmelin E. Kompressionsfreie Mammapräparateradiographie in 2 Ebenen mit Hilfe eines Radiographiecontainers. Fortschr Röntgenstr. 2003;175:413–417. doi: 10.1055/s-2003-37821. [DOI] [PubMed] [Google Scholar]
- 15.Kürzl R, Baltzer J, Lohe K J. Intraoperative specimen radiography in mammographically suspected, non palpable breast lesions. Experiences with the Faxitron unit. Fortschr Med. 1979;97:1688–1690. [PubMed] [Google Scholar]
- 16.Kürzl R, Lohe K J, Baltzer J. et al. Radiography used during operations for biopsies of non-palpable lesions of the breast which have been suspected because of mammography. J Gynecol Obstet Biol Reprod. 1981;10:431–434. [PubMed] [Google Scholar]
- 17.Moritz J D, Westerhof J P, Funke M. et al. Ein neues Präparatradiographiegerät mit maximal 20facher Vergrößerung für die Mammadiagnostik. Fortschr Röntgenstr. 1998;168:133–138. doi: 10.1055/s-2007-1015197. [DOI] [PubMed] [Google Scholar]
- 18.Grunert J H, Borchert B, Farber A. et al. Mikrokalknachweis in Mamma-Exzisionspräparaten mit Hilfe der DIMA-Vergrößerungspräparateradiographie vierfach im Vergleich zur konventionellen Vergrößerungsradiographie eineinhalbfach. Fortschr Röntgenstr. 1999;171:302–306. doi: 10.1055/s-1999-253. [DOI] [PubMed] [Google Scholar]
- 19.Grunert J-H, Flemming P, Borchert B. et al. Vergrößerungspräparateradiographie als Qualitätskontrolle der Mikrokalkerfassung im Rahmen der histopathologischen Aufarbeitung von Mammabiopsiegewebe. Fortschr Röntgenstr. 2000;172:68–72. doi: 10.1055/s-2000-280. [DOI] [PubMed] [Google Scholar]
- 20.Diekmann F, Grebe S, Bick U. et al. Digitale intraoperative Präparateradiographie bei diagnostischen Exzisionen nicht palpabler Läsionen der Brust. Fortschr Röntgenstr. 2000;172:969–971. doi: 10.1055/s-2000-9211. [DOI] [PubMed] [Google Scholar]
- 21.Muttalib M, Tisdall M, Scawn R. et al. Intra-operative specimen analysis using faxitron microradiography for excision of mammographically suspicious, non-palpable breast lesions. The Breast. 2004;13:307–315. doi: 10.1016/j.breast.2004.02.005. [DOI] [PubMed] [Google Scholar]
- 22.Schulz-Wendtland R, Wenkel E, Wacker T. et al. Quo vadis? Trends in digital mammography. Geburtsh Frauenheilk. 2009;69:108–117. [Google Scholar]
- 23.Schulz-Wendtland R, Bani M R, Lux M P. et al. CMOS-Technologie für intraoperative digitale Präparateradiografien. Geburtsh Frauenheilk. 2011;71:525–529. [Google Scholar]
- 24.Schulz-Wendtland R, Dilbat G, Bani M R. et al. Use of tomosynthesis in intraoperative digital specimen radiography – is a reduction of breast re-excision rates possible? Geburtsh Frauenheilk. 2011;71:1080–1084. doi: 10.1055/s-0031-1280427. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Niklason L T, Christian B T, Niklason L E. et al. Digital tomosynthesis in breast imaging. Radiology. 1997;205:399–406. doi: 10.1148/radiology.205.2.9356620. [DOI] [PubMed] [Google Scholar]
- 26.Schulz-Wendtland R, Wenkel E, Lell M. et al. Experimental phantom lesion detectability study using a digital breast tomosynthesis prototype system. Röfo. 2006;178:1219–1223. doi: 10.1055/s-2006-926933. [DOI] [PubMed] [Google Scholar]
- 27.Poplack S P, Tosteson T D, Kogel C A. et al. Digital breast tomosynthesis: initial experience in 98 women with abnormal digital screening mammography. AJR. 2007;189:616–623. doi: 10.2214/AJR.07.2231. [DOI] [PubMed] [Google Scholar]
- 28.Good W F, Abrams G S, Catullo V J. et al. Digital breast tomosynthesis: a pilot observer study. AJR. 2008;190:865–869. doi: 10.2214/AJR.07.2841. [DOI] [PubMed] [Google Scholar]
- 29.Gur D, Abrams G S, Chough D M. et al. Digital breast tomosynthesis: observer performance study. AJR. 2009;193:586–591. doi: 10.2214/AJR.08.2031. [DOI] [PubMed] [Google Scholar]
- 30.Kontos D, Bakic P R, Carton A K. et al. Parenchymal texture analysis in digital breast tomosynthesis for breast cancer risk estimation: a preliminary study. Acad Radiol. 2009;16:283–298. doi: 10.1016/j.acra.2008.08.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Schulz-Wendtland R, Fuchsjäger M, Wacker T. et al. Digital mammography: an update. Eur J Radiol. 2009;72:258–265. doi: 10.1016/j.ejrad.2009.05.052. [DOI] [PubMed] [Google Scholar]
- 32.Teertstra H J, Loo C E, van den Bosch M A. et al. Breast tomosynthesis in clinical practice: initial results. Eur Radiol. 2010;20:16–24. doi: 10.1007/s00330-009-1523-2. [DOI] [PubMed] [Google Scholar]
- 33.Schulz-Wendtland R, Hermann K-P, Wenkel E. et al. Vergleich der klinischen Wertigkeit von Zielaufnahmen mit reduzierter Pixelgröße des Detektors und digitalem Monitorzooming bei der Beurteilung von Mikrokalzifikationen in der digitalen Mammographie. Fortschr Röntgenstr. 2007;179:492–496. doi: 10.1055/s-2007-962980. [DOI] [PubMed] [Google Scholar]
- 34.Haygood T M, Arribas E, Brennan P C. et al. Conspicuity of microcalcifications on digital screening mammograms using varying degrees of monitor zooming. Acad Radiol. 2009;16:1509–1517. doi: 10.1016/j.acra.2009.07.010. [DOI] [PubMed] [Google Scholar]
- 35.Kim M J, Youk J H, Kang D R. et al. Zooming method (x 2.0) of digital mammography vs. digital magnification view (x 1.8) in full-field digital mammography for the diagnosis of microcalcifications. Br J Radiol. 2010;83:486–492. doi: 10.1259/bjr/16967819. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Koutalonis M, Delis H, Pascoal A. et al. Can electronic zoom replace magnification in mammography? BJR. 2010;83:569–577. doi: 10.1259/bjr/21753020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Schulz-Wendtland R, Bani M R, Lux M P. et al. Pilot study for the detection of simulated lesions at a 2D resp. 3D digital full-field mammography system with a new developed high resolution detector on the base of two shifts of a-Se. Geburtsh Frauenheilk. 2012;72:408–411. doi: 10.1055/s-0031-1298158. [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.
Supplementary Materials
German supporting informations for this article


