Abstract
Because of the heterogeneity in the definition of chemotherapy-induced amenorrhea (CIA) there are distinct differences in the literature with regard to its incidence as well as its dependence on various influencing factors. The occurrence of CIA varies greatly depending on the applied chemotherapy. The pathogenesis of CIA is especially based on a reduction of ovarian reserves. Various sonographic and biochemical factors can be used to exclude or confirm CIA. This is particularly important when an endocrine therapy with tamoxifen is not possible and the use of aromatase inhibitors is under consideration. CIA and especially the frequently thereby resulting early menopause can lead to pronounced restrictions in the quality of life of the affected patients, not least due to the resulting infertility. On the other hand, various studies have shown that CIA may have a positive prognostic significance. Thus, the identification of measures to prevent CIA (for example, through the use of GnRH analogues) is of particular importance.
Key words: chemotherapy-induced amenorrhea, breast cancer, chemotherapy, GnRH analogues
Abstract
Zusammenfassung
Aufgrund der Heterogenität in der Definition der chemotherapieinduzierten Amenorrhö (CIA) bestehen deutliche Unterschiede in der Literatur bez. ihrer Häufigkeit sowie der Abhängigkeit von verschiedenen Einflussfaktoren. Das Auftreten einer CIA variiert deutlich in Abhängigkeit von der angewandten Chemotherapie. Pathogenetisch liegt der CIA insbesondere eine Reduktion der ovariellen Reserve zugrunde. Verschiedene Ultraschall- und biochemische Faktoren können zum Ausschluss bzw. zur Feststellung einer CIA verwendet werden. Dies ist insbesondere dann wichtig, wenn eine endokrine Therapie mit Tamoxifen nicht möglich ist und der Einsatz von Aromatasehemmern erwogen wird. Eine CIA und insbesondere die daraus häufig resultierende vorzeitige Menopause können zu einer deutlichen Einschränkung der Lebensqualität der betroffenen Patientin, nicht zuletzt durch die resultierende Infertilität führen. Andererseits haben verschiedene Studien zeigen können, dass der CIA eine positive prognostische Bedeutung zukommen könnte. Daher kommt der Identifikation von Maßnahmen zur Vermeidung einer CIA (beispielsweise durch den Einsatz von GnRH-Analoga) ein besonderer Stellenwert zu.
Schlüsselwörter: chemotherapieinduzierte Amenorrhö, Mammakarzinom, Chemotherapie, GnRH-Analoga
Introduction
About 25 % of all breast cancers are diagnosed in premenopausal women and about 15 % occur in women under 45 years of age 1, 2, 3. With the increasing survival rates of (premenopausal) patients with breast cancer the long-term consequences of oncological therapy are gaining in importance 4, 5, 6. Accordingly, increasing numbers of studies are focusing on the recognition, treatment and prevention of chemotherapy-associated late sequelae 7. One of the consequences of chemotherapy in premenopausal women is the onset of chemotherapy-associated amenorrhea and, possibly also, the occurrence of an early menopause. Not least because of the increasing number of women who become pregnant for the first time at the age of 35 years or more, (neo)adjuvant therapy is increasingly being needed by women of child-bearing age who must then cope with the threat of infertility 8, 9, 10. On the one hand the unfulfilled desire for children of young women and on the other hand the menopausal symptoms arising from long-term hormone deficits can be additional stress factors. In addition, an early menopause leads to an increased risk for osteoporosis 11, cardiovascular diseases 12 and psychosocial problems 13, 14. On the other hand, a prognostically favorable relevance of chemotherapy-associated amenorrhea is being discussed.
Nomenclature and Definition of CIA
In the literature one finds various terms for the early onset of menopause caused by the premature termination of ovarian function: premature ovarian failure (POF), chemotherapy-induced amenorrhea (CIA), primary ovarian insufficiency (POI) and acute ovarian failure (AOF).
The term amenorrhea describes the lack of a menstrual cycle and can occur primarily (i.e., without the prior occurrence of a cycle) or secondarily (i.e., with the prior occurrence of a cycle). The term menopause describes the 12 months following the last bleeding and can thus strictly only be determined retrospectively. The average age for menopause is 51 years (40–60 years) 15. The postmenopausal period is characterized by a decline in the estrogen level combined with a compensatory increase in FSH; inhibin-B and anti-Mullerian hormone (AMH) levels are low 16. POF or, respectively, POI are names for the premature termination of ovarian function. Strictly speaking the cause for the termination of ovarian function in POF is not known, however, in the broader sense, POF also includes termination of the female cycle due to a genetic defect on the basis of an autoimmune constellation or iatrogenic factors (i.e., due to surgery, radiotherapy or cytotoxicity). Chemotherapy-associated amenorrhea describes the failure of the menstrual cycle as a consequence of chemotherapy.
The heterogeneity in the definitions of the first-mentioned terms ultimately represents a decisive barrier to the interpretation of most studies on this subject. In many studies the absence of menstrual bleeding is used as an indicator for CIA. Even when a temporary amenorrhea after completion of chemotherapy can be observed in the great majority of premenopausal patients it is indeed merely temporary for a significant number of these patients. Thus, a clear distinction must be made between a pure CIA and a chemotherapy-induced menopause (CIM). Pathogenetically, the latter can be a long-term consequence of the former. If a CIA does not progress to a CIM, menstruation can indeed start again after varying periods of time. Individual reports describe the renewed onset of menstruation after as many as 20 years 17.
Epidemiology of CIA
Data on the frequency of CIA in the literature cover a wide range which can be attributed to the heterogeneous definitions of CIA. In addition, numerous influencing factors with regard to the occurrence of CIA are known. These include young age at the time of chemotherapy, doses and duration of chemotherapy or a high basal follicle count. Thus, the occurrence of CIM in women aged 40 years or less amounts to 20–61 %, in women over 40 years chemotherapy leads in 61–97 % of the cases to CIM 18. Okanami et al. investigated the incidence of CIA in 66 premenopausal patients with breast cancer who were treated with anthracycline-containing (n = 17) or, respectively, anthracycline- and taxane-containing (n = 58) chemotherapies. 87.9 % of the patients were amenorrhetic during the chemotherapy, in 21.2 % of the cases the amenorrhea persisted beyond the duration of the chemotherapy. Patients who were older than 36 years at the start of the chemotherapy (97.9 %) were significantly more often amenorrhetic than patients under 36 years (63.2 %). Also a persistent amenorrhea was diagnosed more frequently in older patients than in younger ones (27.7 vs. 5.3 %). Age at the time of diagnosis proved to be an independent predictor for amenorrhea under chemotherapy in the multivariate correlation analysis 19. Also in the course of a retrospective analysis of the NSABP-B30 study, among others, the impact of age at therapy start on the incidence of CIA in premenopausal patients was examined. In this sub study premenopausal patients with breast cancer who had received an adjuvant sequential chemotherapy with doxorubicin/cyclophosphamide and docetaxel were investigated. In total 708 patients were examined. 83 % of the patients reported at least one episode of amenorrhea lasting for at least 6 months. The rates for the renewed onset of menstrual cycles were 45.3, 10.9 and 3.2 % for patients aged less than 40 years, from 40 to 50 years, and over 50 years, respectively. Patients receiving tamoxifen treatment were more frequently amenorrhetic (p = 0.003) 20.
Reproductive and behavior-associated risk factors for CIA
In addition, an increased probability for CIA has been described for patients with a late menarche (> 13 years) and in connection with nicotine abuse. Abusief et al. studied 431 premenopausal patients with breast cancer with regard to risk factors for CIA. The impact of gravidity and parity, age at menarche, age at first parity, alcohol and nicotine abuse, size and weight as well as body mass index (BMI) on the occurrence of a persistent CIA were analyzed 21. CIA was defined as a persisting amenorrhea of longer than 6 months after completion of the chemotherapy. The authors demonstrated that an age at menarche of > 13 years in comparison to one of 12–13 years was associated with a 2-fold higher risk of CIA. Also there was a (non-significant) relationship between an existing nicotine abuse at time point of therapy and the occurrence of CIA (odds ratio 2.4, 95 % confidence interval [CI] 0.86–6.75). None of the other above-mentioned reproductive factors was associated with the occurrence of CIA.
Impact of the performed therapy
The highest gonadotoxicity has been described for alkylating substances. An explanation for this could be that alkylating agents such as, for example, cyclophosphamide in contrast to other cytostatic agents do not exhibit any cell cycle specificity and rather also have a cytotoxic effect on non-proliferating cells 22. On the basis of the risks for gonadotoxicity, various chemotherapeutic agents were classified into high-risk and low-risk substances (Table 1).
Table 1 Various chemotherapeutic agents grouped according to the risk for the occurrence of CIA (adapted from 22).
| High risk | alkylating substances: |
|
| Medium risk | platinum: |
|
| anthracycline antibiotics: |
|
|
| taxoids: |
|
|
| Low risk | Vinca alkaloids: |
|
| anthracycline antibiotics: |
|
|
| antimetabolites: |
|
Further risk factors are high cumulated doses of drugs. In addition, it is a topic of discussion if the time point of application of the chemotherapy (e.g., for example, in the follicular phase of the menstrual cycle) 23, 24 or also genetic factors 25 can increase the frequency of CIA. There are even indications that the existence of breast cancer disease per se can influence the risk for CIA 26, 27.
The impact of a taxane supplement, such as paclitaxel or docetaxel, on the incidence of CIA has not been clarified with certainty. Several studies have led to the suggestion that the addition of taxanes may increase the risk for CIA 20, 28. Han et al. examined a cohort of 122 premenopausal women with breast cancer who received a neoadjuvant chemotherapy consisting of docetaxel/capecitabin (TX) or, respectively, doxorubicin/cyclophosphamide (AC) or an adjuvant anthracycline/taxane-containing sequential therapy (AC-T) or, respectively an anthracycline-containing chemotherapy (FAC). The respective CIA rates were 90.2 % (TX/AC), 73.5 % (AC-T) and 72.1 % (FAC, p = 0.002). After 3 years the corresponding rates were 66.7, 73.3 and 58.9 % (p = 0.268). Besides age, the use of taxanes was an independent predictor for amenorrhea after one year (p = 0.002) 29. Other studies could not reproduce this effect of taxanes 30, 31. The poor comparability of these studies due to the differing definitions of CIA, use of endocrine therapies, average patient age per study, etc. markedly limit their meaningfulness.
Also, it has been shown that the performance of a tamoxifen therapy after chemotherapy can lead to a significant increase in the rate of CIA 16, 26. Abusief et al. examined the above-mentioned cohort of 431 patients also with regard to the influence of different chemotherapies (doxorubicin/cyclophosphamide, followed by paclitaxel [AC-T]) every 3 weeks or as a dose-dense regime (every 2 weeks), among others, also in combination with trastuzumab. At the time of diagnosis the patients were on average 43 years old (range 25–55 years). 71 % of the patients received adjuvant treatment with tamoxifen. after a median follow-up time of 33 months an increased risk for CIA was observed (i.e., an amenorrhea after 6 months, OR 2.34, 95 % CI 1.54–3.56, p < 0.0001) 27. The reason for the potential influence of tamoxifen on the incidence of CIA or CIM, however, has not been completely clarified. It is assumed that tamoxifen can interfere with a feedback loop in the region of the hypothalamus and thus exert an effect on estrogen synthesis 32.
Pathogenesis of CIA
In general, menstruation ability and thus fertility of a woman depends on the number of primordial follicles in the ovary and the quality of the oocytes. These factors are known as the ovarian reserves. At birth the ovaries are occupied by a fixed number of inactive primordial follicles which, in the course of life, i.e., especially in the fertile phase of life, continuously decreases. In the life of a woman therefore, there is a continuous decrease in the number of recruitable follicles. During the menopausal transition this results in pronounced decrease in the estradiol level. In contrast to this the estrogen level remains practically stable as a consequence of the peripheral aromatase activity in fatty tissue. The FSH level increases in a compensatory manner.
If an early menopause occurs, for example, in the sense of CIM or, respectively, CIA due to chemotherapy, this is on the one hand attributable to an accelerated aging process of the steroid-synthesizing cells (e.g. follicular epithelial and theca cells), while on the other hand chemotherapy can lead to the induction of apoptosis in primordial follicles 3, 15, 33. Depending on the fraction of apoptotic primordial follicles either merely a CIA arises or in the further course a CIM develops 31. The threshold value of affected primordial follicles that results in a CIM is not known and probably varies from patient to patient.
Even when the ovarian reserves decrease with increasing age, age alone is by no means a reliable correlate. The identification of reliable predictors is thus of particular importance. The anti-Mullerian hormone (AMH) is produced by follicular epithelial cells 34, 35. Accordingly, serum AMH levels reflect the number of recruitable primordial follicles. During chemotherapy a decline in the AMH level can be observed, this is much more pronounced than the declines in the estradiol and inhibin-B levels. At the beginning of chemotherapy the AMH level can thus be considered as a potential biomarker for the ovarian reserves 36.
Diagnostics of CIA
POI is defined as the absence of menstruation for 3 months and the 2-fold determination of high FSH (> 40 IU/L) and low estradiol (< 10 pg/mL) levels at an interval of at least one month in women < 40 years old 15. For the diagnosis of ovarian failure, 2 consecutive determinations of follicle-stimulating hormone (FSH) with values above 40 mIU/mL independent of the presence of menstrual bleeding are needed. Accordingly, an amenorrhea is found in the great majority of cases. In addition there may also be a mamillary secretion as a result of an elevated prolactin level as sign of a dysfunction of the hypothalamic-hypophyseal-ovarian axis, weight changes, general weakness and hirsutism on the basis of an elevated androgen level.
The diagnostic procedure for CIA includes determination of the ovarian reserves and measurement of (peri-)menopausal hormone constellations. As a consequence of the falling estradiol level increases in the FSH and, to a lesser degree, the LH levels occur. Furthermore, the inhibin-B and AMH levels decline significantly (Table 2).
Table 2 Changes as a sign of CIA.
| Changes in menstruation cycle |
| Sonographic findings |
|
|
| Changes in laboratory values |
|
|
|
|
|
Indispensable are estradiol/FSH determinations at at least two different time points at an interval of 4 weeks, a single determination is not sufficient.
Furthermore, the consideration of influencing factors is essential. Thus, tamoxifen appears to effect an increase of estrogen and a fall of FSH levels. Aromatase inhibitors can also influence these levels. Thus, it has been shown that in postmenopausal women they can lower estrogen levels and increase FSH levels 37. In addition, interactions between not only tamoxifen or, respectively, its metabolites but also aromatase inhibitors and individual estrogen assays have been reported 37. The definition and evaluation of further reliable biomarkers is thus urgently needed. In this context, the AMH level 38 or, respectively, AMH and inhibin-B levels prior to chemotherapy have been investigated as predictors of CIA. Thus, AMH levels before the start of a chemotherapy should allow an estimation of the reproductive potential of the ovaries as well as the risk of POI 41. However, none of the various analyses have as yet justified the determination of the mentioned biomarkers in daily clinical routine. Fig. 1 shows a flow diagram for the recommended procedure for patients with hormone-dependent breast cancer in whom a switch from tamoxifen to aromatase inhibitors (AI) is planned.
Fig. 1.
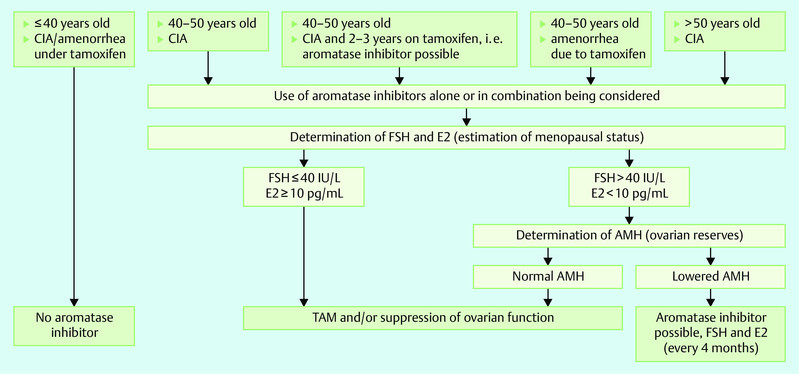
Practical algorithm for patients with hormone-dependent breast cancer in whom a switch from tamoxifen to aromatase inhibitors is planned.
Prevention of CIA
Against the background of not only preservation of fertility but also of avoiding a deterioration in the quality of life, impact on sexuality and maintaining bone and cardiovascular health, the continuation of ovarian function after chemotherapy is of special importance.
The assumption of efficacy of gonadotropin-releasing hormone (GnRH) agonists to avoid the risk of CIA is based on numerous small, non-randomized studies 42. On this basis, several randomized studies were performed but ultimately could not uniformly confirm this effect. In a Cochrane analysis 43 based on the evaluation of 4 randomized studies from the years 1987 to 2007 the authors concluded that the use of GnRH agonists in patients of child-bearing age and with the need for chemotherapy should be carefully assessed. The authors demonstrated that the intramuscular/subcutaneous administration of GnRH agonists lead to higher rates of menstruation (RR 1.90, 95 % CI 1.30–2.79) and ovulation (RR 2.70, 95 % CI 1.52–4.79). Even when the authors did not find any differences with regard to the resultant pregnancy rates (RR 0.21, 95 % CI 0.01–4,09), they evaluated these data as an indication that the use of GnRH agonists should be offered to premenopausal women before chemotherapy 43. A recent metaanalysis on the basis of 6 randomized studies came to the conclusion that the use of GnRH agonists increased the changes for preservation of the ovarian reserves 44.
In contrast, various other studies could not support these findings. In one of the most recent studies, for example, Munster et al. examined the influence of triptorelin administration during a neoadjuvant or adjuvant chemotherapy in premenopausal patients with breast cancer. The patients were stratified according to age, estrogen receptor status, the use of antihormonal therapy and the specifically applied chemotherapy regime. Target parameter of this randomized study was on the one hand the renewed onset of menstruation and, on the other hand, the levels of FSH, inhibin A and Inhibin B. The study was terminated prematurely because in an interim evaluation of 49 of the planned total of 124 participants no effects were observed. In 90 % of the women in the control group compared to 88 % in the therapy group menstruation started again (p = 0.36). Also no significant differences in the time to the renewed onset of menstruation could be detected (median 5.0 vs. 5.8 months in control vs. treatment arms, p = 0.58). Furthermore, the 2 spontaneously conceived pregnancies that were observed during the study occurred in the control arm. The above-mentioned hormonal parameters did not differ significantly between the two study arms 45.
Also in an open, randomized, multicenter study (GBG 37 ZORO) of the German Breast Group (GBG) the utility of GnRH to prevent CIA/CIM could not be confirmed. In this study Gerber et al. investigated the influence of a 4-week administration of goserelin (3.6 mg s. c.) in parallel to an anthracycline- or anthracycline/taxane-containing neoadjuvant chemotherapy on the preservation of ovarian function, defined as the renewed onset of two successive menstruations at an interval of 21–35 days up to 6 months after termination of the chemotherapy. 60 patients were enrolled in this study, of whom altogether 53 (88.3 %) exhibited amenorrhea (93.3 % of the patients with vs. 83.3 % of the patients without goserelin). No significant differences could be seen on a comparison of the two study arms with respect to the menstruation rate after 6 months (70.0 % with vs. 56.7 % without goserelin; p = 0.284). With the exception of one patient, all other participants exhibited renewed menstrual cycles after 2 years. Also there was no significant difference in the time to occurrence of regular menstrual cycles after chemotherapy (6.8 months with and 6.1 months without goserelin, p = 0.304) 46.
Some aspects of the design and evaluation of the study were subject to later criticism. Thus, the evaluation of the occurrence of two successive menstrual cycles as an adequate surrogate for a recovered ovarian function was questioned. It was also pointed out that practically all patients showed renewed menstruation after 2 years and so the necessity for ovarian protection in connection with the used chemotherapy regime was also called into question. Furthermore, the choice of a maximum age of 47 years for the patients was considered to be too high 47. In the light of all these objections, at present certainly no valid conclusions on the utility of goserelin for the prevention of CIA can be drawn from the results of the ZORO study.
It remains to be seen whether or not the results of more recent studies can confirm the utility of GnRH analogues for the prevention of CIA/CIM. Thus, for example, The Prevention of Early Menopause study (POEMS) of the Southwest Oncology Group (SWOG) is again examining the impact of goserelin administration on the rate of ovarian dysfunctions, the ovarian reserves and the resultant pregnancy rate in patients with breast cancer. The enrollment of about 416 patients is planned.
Various protocols for the preservation of fertility in the course of oncological therapies have been described 48. Against the background of the contradictory data situation and the fact that the use of GnRH agonist is confirmed at least in some metaanalyses, the working group “fertiPROTEKT”, recommends that “on the basis of the described data situation on the efficacy of GnRH agonists as ovarian protective agents […] these drugs should be offered to women undergoing chemotherapy, especially in the case of the lack of therapeutic alternatives for the preservation of fertility” (www.fertiprotekt.de) 49.
The commission “mamma” of the study group “Gynäkologische Onkologie” (AGO) on the other hand is markedly more reserved with regard to recommendations for the administration of GnRH analogues as prophylaxis for POF (www.ago-online.de, Table 3), however, an influence on the efficiency of chemotherapy of simultaneous endocrine alterations cannot be excluded with absolute certainty 50. Last but not least, the use of GnRH should be critically and comprehensively discussed with the patients against this background.
Table 3 Guidelines of the Study Group Gynäkologische Onkologie for the protection of ovarian function in premenopausal patients under adjuvant chemotherapy.
| Prophylaxis for ovarian function and preservation of fertility in premenopausal patients under adjuvant chemotherapy | |||
| Oxford/AGOLoE/GR | |||
| CT + GnRHa (GnRHa administration > 2 weeks before chemotherapy) | 1b | B | − |
|
1b | B | − |
|
1b | B | − |
|
4 | C | + |
|
4 | C | + |
Prognostic Significance of CIA
Also not conclusively clarified is the question as to what effect CIA has on the prognosis of the breast cancer being treated. Various studies have suggested a prognostic relevance of CIA in premenopausal women with breast cancer 51, 52.
In a retrospective analysis on the basis of data from the National Cancer Institute of Canada Clinical Trials Group (NCIC CTG) study MA.5 of 442 patients with breast cancer receiving adjuvant chemotherapy with CMF vs. CEF, Swain et al. investigated the influence of amenorrhea after 6 or, respectively, 12 months on the recurrence-free and overall survival of the patients. Even when the cumulative cyclophosphamide dose in the CMF arm was higher than that in the CEF arm, a higher amenorrhea rate was seen in the CEF arm after 6 months (relative risk in comparison with CMF 1.2; 95 % CI 1.0–1.3); after 12 months no significant differences were seen. In patients with hormone receptor-positive breast cancer, there was no significant influence of the amenorrhea rate after 6 months on the patientsʼ prognosis, after 12 months, however, there was a significantly improved recurrence-free survival (hazard ratio [HR] 0.51; 95 % CI 0.32–0.82; p = 0.005) and overall survival (HR 0.40; 95 % CI, 0.22–0.72; p = 0.002). On the basis of these data the authors concluded that the late CIA after 12 months could have a prognostic relevance for patients with hormone receptor-positive breast cancer 53.
Also a current report from a Korean research group confirms the unfavorable prognostic significance of the renewed onset of menstruation in patients with breast cancer. The authors carried out a retrospective analysis of the data of 872 patients with breast cancer. The patients had a median age of 41 years at the time of diagnosis. In 79.4 % of the patients a hormone receptor-positive breast cancer was diagnosed and the great majority of these patients received an endocrine therapy with tamoxifen. The CIA rate was 76.7 % (n = 669), defined as the lack of menstruation for at least 6 months. In 51.8 % (n = 452) of the patients menstrual bleeding restarted in the course of the follow-up. The latter was associated with a lower disease-free survival (p < 0.001, independent of hormone receptor status) 54. It can be concluded that the efficacy of modern chemotherapy regimes is due in part to their ovarian suppression and that the generous and unreflected administration of drugs for ovarian protection is called into question by the results of the above-mentioned studies. This should be considered especially against the background that more and more effective methods for preserving fertility are becoming available, e.g., cryoconservation of oocytes and ovarian tissue 55. It remains to be investigated to what extent ovarian suppression can increase the efficacy of an adjuvant chemotherapy in patients who did not become permanently amenorrhetic under chemotherapy.
Einleitung
Etwa 25 % der Mammakarzinome werden bei prämenopausalen Patientinnen diagnostiziert und etwa 15 % treten bei Frauen vor dem 45. Lebensjahr auf 1, 2, 3. Mit den steigenden Überlebensraten von (prämenopausalen) Patientinnen mit Mammakarzinom sind Langzeitfolgen der onkologischen Therapie besonders wichtig geworden 4, 5, 6. Folglich widmet sich eine zunehmende Anzahl an Studien der Erkennung, Behandlung und Prävention von chemotherapieassoziierten Spätfolgen 7. Eine der Folgen einer Chemotherapie bei prämenopausalen Patientinnen ist die Auslösung einer chemotherapieassoziierten Amenorrhö und ggf. Induktion einer prämaturen Menopause. Nicht zuletzt durch den zunehmenden Anteil an Frauen, die jenseits des 35. Lebensjahrs erstmalig schwanger werden, trifft eine (neo-)adjuvante Chemotherapie zunehmend Frauen im reproduktiven Alter, die sich mit einer drohenden Infertilität auseinandersetzen müssen 8, 9, 10. Einerseits können bei jungen Patientinnen der durch eine vorzeitige Menopause unterbundene Kinderwunsch und die aus einem langfristigen Hormonentzug resultierenden menopausalen Symptome belastend sein. Nicht zuletzt führt eine verfrühte Menopause zu einem erhöhten Risiko für eine Osteoporose 11, kardiovaskuläre Erkrankungen 12 und psychosoziale Probleme 13, 14. Andererseits wird jedoch eine prognostisch günstige Bedeutung der chemotherapieassoziierten Amenorrhö diskutiert.
Nomenklatur und Definition der CIA
In der Literatur finden sich verschiedene Begriffe für das verfrühte Einsetzen einer Menopause verursacht durch das vorzeitige Aussetzen der ovariellen Funktion: prämatures Ovarversagen (premature ovarian failure, POF), chemotherapieinduzierte Amenorrhö (CIA), primäre Ovarialinsuffizienz (POI) und akutes Ovarialversagen (acute ovarian failure, AOF).
Der Begriff Amenorrhö beschreibt das Fehlen eines Menstruationszyklus und kann primär (d. h. ohne zuvor bestehenden Zyklus) oder sekundär (d. h. nach einem zuvor bestehenden Zyklus) auftreten. Die Menopause beschreibt die 12 Folgemonate nach der letzen Regelblutung einer Frau und kann aufgrund dessen streng genommen lediglich retrospektiv bestimmt werden. Das mittlere Menopausealter liegt bei 51 Jahren (40–60 Jahre) 15. Die Postmenopause ist gekennzeichnet durch einen Abfall der Östrogenspiegel verbunden mit einem kompensatorischen Anstieg des FSH; Inhibin-B- und Anti-Müller-Hormon-(AMH-)Spiegel sind niedrig 16. Das POF bzw. die POI bezeichnen das vorzeitige Aussetzen der ovariellen Funktion. Streng genommen ist bei einem POF die Ursache für das Aussetzen der Ovarialfunktion nicht bekannt, im weiteren Sinne umfasst das POF jedoch auch das Aussetzen des weiblichen Zyklus durch einen genetischen Defekt, auf der Basis einer Autoimmunkonstellation oder iatrogen (d. h. operativ, radiotherapeutisch oder zytotoxisch). Die chemotherapieassoziierte Amenorrhö (CIA) bezeichnet das Ausbleiben des Menstruationszyklus als Folge einer Chemotherapie.
Die Heterogenität in der Definition der erstgenannten Begriffe stellt letztlich auch eine maßgebliche Hürde für die Interpretation der Mehrzahl der Studien zu dieser Thematik dar. In vielen Studien wird das Aussetzen der Regelblutung als Indikator einer CIA genutzt. Doch auch wenn eine vorübergehende Amenorrhö nach Abschluss der Chemotherapie in der großen Mehrzahl prämenopausaler Patientinnen beobachtet werden kann, ist diese bei einer signifikanten Anzahl an Patientinnen lediglich vorübergehend. Somit muss deutlich unterschieden werden zwischen der reinen CIA und der chemotherapieinduzierten Menopause (CIM). Pathogenetisch kann letztere die langfristige Konsequenz ersterer sein. Geht eine CIA nicht in eine CIM über, so kann sich die Menstruation nach einem unterschiedlichen Zeitraum wieder einstellen. Einzelfälle beschreiben ein Wiedereinsetzen der Mensis auch nach bis zu 20 Jahren 17.
Epidemiologie der CIA
Die Angaben zur Häufigkeit einer CIA in der Literatur weisen eine große Spannbreite auf, die auf die heterogene Definition der CIA zurückzuführen ist. Zudem ist eine Vielzahl von Einflussfaktoren hinsichtlich des Auftretens einer CIA bekannt. Zu diesen gehören junges Alter zum Zeitpunkt der Chemotherapie, Chemotherapiedosis und -dauer, Chemotherapiesubstanz oder eine höhere basale Follikelanzahl. So beträgt das Auftreten einer CIM bei Frauen unter 40 Jahren 20–61 %, bei Frauen über 40 Jahren führt die Chemotherapie in 61–97 % der Fälle zu einer CIM 18. Okanami et al. untersuchten die Inzidenz der CIA bei 66 prämenopausalen Patientinnen mit Mammakarzinom, welche mit einer anthrazyklinhaltigen (n = 17) bzw. anthrazyklin- und taxanhaltigen (n = 58) Chemotherapie behandelt worden waren. 87,9 % der Patientinnen wurden amenorrhoisch während der Chemotherapie, in 21,2 % der Fälle persistierte die Amenorrhö auch über die Dauer der Chemotherapie hinaus. Patientinnen, die zum Zeitpunkt des Chemotherapiebeginns älter als 36 Jahre waren (97,9 %), wurden signifikant öfter amenorrhoisch als Patientinnen unter 36 Jahren (63,2 %). Auch eine persistierende Amenorrhö wurde bei älteren Patientinnen öfter diagnostiziert als bei jüngeren Patientinnen (27,7 vs. 5,3 %). Das Alter zum Zeitpunkt der Diagnosestellung erwies sich in der multivariaten Korrelationsanalyse als ein unabhängiger Prädiktor für die Amenorrhö unter Chemotherapie 19. Auch im Rahmen einer retrospektiven Analyse der NSABP-B30-Studie wurde u. a. der Einfluss des Alters bei Therapie auf die Inzidenz einer CIA prämenopausaler Patientinnen analysiert. In dieser Substudie wurden prämenopausale Patientinnen mit Mammakarzinom untersucht, die eine adjuvante Sequenzchemotherapie mit Doxorubicin/Cyclophosphamid und Docetaxel erhalten hatten. 708 Patientinnen wurden insgesamt untersucht. 83 % der Patientinnen berichteten von mindestens einer Amenorrhö-Episode für die Dauer von mindestens 6 Monaten. Die Rate an wiederauftretenden Menstruationszyklen lag bei 45,3, 10,9 und 3,2 % für Patientinnen im Alter von weniger als 40 Jahren, 40 bis 50 Jahren und mehr als 50 Jahren. Patientinnen mit einer Tamoxifen-Behandlung wurden häufiger amenorrhoisch (p = 0,003) 20.
Reproduktive und verhaltensassoziierte Risikofaktoren für eine CIA
Des Weiteren wurde eine erhöhte Wahrscheinlichkeit für eine CIA für Patientinnen mit später Menarche (> 13 Jahre) und im Zusammenhang mit Nikotinabusus beschrieben. Abusief et al. untersuchten 431 prämenopausale Patientinnen mit Mammakarzinom hinsichtlich von Risikofaktoren für eine CIA. Analysiert wurde der Einfluss von Graviditäts- und Paritätsstatus, Alter zum Zeitpunkt der Menarche, Alter bei Erstparität, Alkohol- und Nikotinmissbrauch, Größe und Gewicht sowie Body-Mass-Index (BMI) auf das Auftreten einer persistierenden CIA 21. Eine CIA wurde definiert als eine persistierende Amenorrhö ≥ 6 Monate nach Beendigung der Chemotherapie. Die Autoren konnten zeigen, dass ein Menarchealter von > 13 Jahren im Vergleich zu einem Alter von 12–13 Jahren mit einer Verdopplung des Risikos für eine CIA assoziiert war. Zudem bestand ein (nicht signifikanter) Zusammenhang zwischen einem zum Zeitpunkt der Therapie bestehenden Nikotinabusus und dem Auftreten einer CIA (Odds Ratio 2,4, 95 %-Konfidenzintervall 0,86–6,75). Keiner der anderen o. g. reproduktiven Faktoren war mit dem Auftreten einer CIA signifikant assoziiert.
Einfluss der durchgeführten Therapie
Die höchste Gonadotoxizität wurde für alkylierende Substanzen beschrieben. Eine Erklärung hierfür könnte darin liegen, dass Alkylanzien wie beispielsweise Cyclophosphamid im Gegensatz zu anderen Zytostatika keine Zellzyklus-Spezifität aufweisen und vielmehr auch auf nicht proliferierende Zellen zytotoxisch wirken 22. Basierend auf ihrem Gonadotoxizitätsrisiko werden unterschiedliche Chemotherapeutika in Hochrisiko- und Niedrigrisiko-Substanzen unterteilt (Tab. 1).
Weitere Risikofaktoren sind hohe kumulative Medikamentendosen. Zudem wird diskutiert, ob der Zeitpunkt der Chemotherapieapplikation (d. h. bsw. während der Follikelphase des Menstruationszyklus) 23, 24 oder auch genetische Faktoren 25 die CIA-Frequenz erhöhen kann. Zudem bestehen Hinweise darauf, dass auch die Tatsache des Bestehens einer Mammakarzinomerkrankung per se das Risiko einer CIA beeinflussen kann 26, 27.
Der Einfluss einer Ergänzung einer Chemotherapie durch Taxane wie Paclitaxel oder Docetaxel auf die Inzidenz einer CIA ist nicht abschließend geklärt. Mehrere Studien haben nahegelegt, dass die Hinzunahme von Taxanen das Risiko für eine CIA erhöhen könne 20, 28. Han et al. untersuchten eine Kohorte von 122 prämenopausalen Patientinnen mit Mammakarzinom, die eine neoadjuvante Chemotherapie mit Docetaxel/Capecitabin (TX) bzw. Doxorubicin/Cyclophosphamid (AC) oder eine adjuvante anthrazyklin-taxanhaltige Sequenztherapie (AC-T) bzw. anthrazyklinhaltige Chemotherapie (FAC) erhielten. Die CIA-Raten lagen bei 90,2 % (TX/AC), 73,5 % (AC-T) und 72,1 % (FAC, p = 0,002). Diese Raten lagen nach 3 Jahren noch bei 66,7, 73,3 und 58,9 % (p = 0,268). Die Verwendung von Taxanen war neben dem Alter ein unabhängiger Prädiktor für eine Amenorrhö nach einem Jahr (p = 0,002) 29. Andere Studien konnten diesen Effekt der Taxane nicht nachvollziehen 30, 31. Die geringe Vergleichbarkeit dieser Studien aufgrund unterschiedlicher Definition der CIA, Verwendung endokriner Therapien, mittlerem Patientenalter je Studie etc. schränken die Aussagekraft dieser Studien jedoch deutlich ein.
Auch konnte gezeigt werden, dass die Durchführung einer Tamoxifen-Therapie nach einer Chemotherapie zu einer signifikanten Erhöhung der CIA-Rate führte 16, 26. Abusief et al. untersuchten die o. g. Kohorte von 431 Patientinnen zudem hinsichtlich des Einflusses unterschiedlicher Chemotherapien (Doxorubicin/Cyclophosphamid, gefolgt von Paclitaxel [AC-T]) alle 3 Wochen oder als dosisdichtes Regime (alle 2 Wochen), u. a. auch in Kombination mit Trastuzumab. Die Patientinnen waren zum Zeitpunkt der Diagnosestellung durchschnittlich 43 Jahre (Spannbreite 25–55 Jahre). 71 % der Patientinnen wurden adjuvant mit Tamoxifen behandelt. Nach einer medianen Nachbehandlungszeit von 33 Monaten zeigte sich ein erhöhtes Risiko für eine CIA (d. h. eine Amenorrhö nach 6 Monaten, OR 2,34, 95 %-KI 1,54–3,56, p < 0,0001) 27. Die Ursache für den potenziellen Einfluss von Tamoxifen auf die Inzidenz einer CIA bzw. CIM ist jedoch nicht abschließend geklärt. Es wird angenommen, dass Tamoxifen mit einem Feedback-Loop im Bereich des Hypothalamus interferieren könnte und so einen Einfluss auf die Östrogensynthese ausüben könnte 32.
Pathogenese der CIA
Generell sind die Menstruationsfähigkeit und damit die Fertilität einer Frau abhängig von der Anzahl an Primordialfollikeln in den Ovarien und der Oozytenqualität. Diese Faktoren bezeichnet man als Ovarialreserve. Zum Zeitpunkt der Geburt sind die Ovarien mit einer festgelegten Anzahl an inaktiven Primordialfollikeln besetzt, welche im Laufe des Lebens, d. h. insbesondere in der fertilen Lebensphase beständig abnehmen. Im Leben der Frau kommt es somit zu einer stetigen Senkung der Anzahl rekrutierbarer Follikel. Dieses resultiert während der menopausalen Transition in einem deutlichen Abfall der Östradiolspiegel. Im Gegensatz dazu bleiben die Östrogenspiegel nahezu stabil als Folge der peripheren Aromataseaktivität im Fettgewebe. Kompensatorisch steigen die FSH-Spiegel.
Kommt es vorzeitig zu einer Menopause, bsw. durch eine Chemotherapie im Sinne einer CIM bzw. CIA, so liegt dieses einerseits an einem beschleunigten Alterungsprozess der Steroidhormon synthetisierenden Zellen (d. h. der Granulosa- und Thekazellen), andererseits kann eine Chemotherapie zu einer Apoptoseinduktion in Primordialfollikeln führen 3, 15, 33. Abhängig von der Fraktion apoptotischer Primordialfollikel resultiert entweder lediglich eine CIA oder es kommt im weiteren Verlauf zu einer CIM 31. Der Schwellenwert betroffener Primordialfollikel, die in einer CIM resultieren, ist nicht bekannt und vermutlich von Patientin zu Patientin unterschiedlich.
Auch wenn die ovarielle Reserve mit steigendem Alter abnimmt, ist das Alter bei Weitem kein zuverlässiges Korrelat hierfür. Der Identifikation von zuverlässigen Prädiktoren kommt daher eine besondere Bedeutung zu. Das Anti-Müller-Hormon (AMH) wird durch die ovarialen Granulosazellen produziert 34, 35. Folglich spiegeln Serum-AMH-Spiegel die Nummer der rekrutierbaren Primordialfollifel wider. Während einer Chemotherapie kann ein Abfall der AMH-Spiegel beobachtet werden, der durchaus stärker ist als der Abfall der Östradiol- und Inhibin-B-Spiegel. Der AMH-Spiegel zu Beginn der Chemotherapie kann daher als potenzieller Biomarker für die ovarielle Reserve angesehen werden 36.
Diagnostik der CIA
Eine POI ist definiert als das Ausbleiben einer Mensis von 3 Monaten und der 2-maligen Bestimmung von hohem FSH (> 40 IU/l) und niedrigem Östradiol (< 10 pg/ml) im Abstand von mindestens einem Monat bei Frauen < 40 Jahren 15. Zur Diagnose eines ovariellen Versagens dient die Bestimmung von 2 konsekutiven Bestimmungen des follikelstimulierenden Hormons (FSH) mit Werten von mehr als 40 mIU/ml unabhängig von dem Vorliegen einer Menstruationsblutung. Dennoch findet sich in der überwiegenden Zahl der Fälle eine Amenorrhö. Zudem kann es zu einer Mamillensekretion als Folge erhöhter Prolaktinspiegel als Ausdruck einer Störung der hypothalamisch hypophysär-ovariellen Achse, Gewichtsänderung, Leistungsschwäche und Hirsutismus auf dem Boden erhöhter Androgenspiegel kommen.
Die Diagnostik der CIA umfasst die Bestimmung der Ovarialreserve und Messung (peri-)menopausaler Hormonkonstellationen. Als Folge der abfallenden Östradiolspiegel kommt es zu einem Anstieg der FSH- und in einem geringeren Ausmaß der LH-Spiegel. Darüber hinaus fallen Inhibin-B- und AMH-Level signifikant ab (Tab. 2).
Unerlässlich ist die Östradiol/FSH-Bestimmung zu mindestens 2 unterschiedlichen Zeitpunkten im Abstand von 4 Wochen, die einmalige Bestimmung ist nicht ausreichend.
Darüber hinaus ist das Beachten von Einflussfaktoren unerlässlich. So scheint Tamoxifen zu einem Anstieg der Östrogen- und einer Senkung der FSH-Spiegel zu führen. Aromatasehemmer können ebenfalls diese Spiegel beeinflussen. So konnte gezeigt werden, dass diese bei postmenopausalen Frauen Östrogenspiegel senken und FSH-Spiegel erhöhen können 37. Zudem wurden Interaktionen zwischen sowohl Tamoxifen bzw. seinen Metaboliten als auch Aromatasehemmern und einzelnen Östrogenassays beschrieben 37. Die Definition und Evaluation von weiteren, zuverlässigeren Biomarkern ist daher dringend notwendig. In diesem Kontext sind AMH-Spiegel 38 bzw. AMH- und Inhibin-B-Spiegel vor Beginn der Chemotherapie 39, 40 als Prädiktoren einer CIA untersucht worden. So sollen AMH-Spiegel vor Beginn der Chemotherapie eine Abschätzung des Reproduktionspotenzials der Ovarien sowie des Risikos einer POI erlauben 41. Keine der verschiedenen Analysen rechtfertigt jedoch bislang die Bestimmung der letztgenannten Biomarker in der täglichen klinischen Routine. Abb. 1 zeigt ein Fließschema für das empfohlene Vorgehen bei Patientinnen mit hormonabhängigem Mammakarzinom, bei denen ein Wechsel von Tamoxifen auf Aromataseinhibitoren (AI) vorgesehen ist.
Prävention der CIA
Vor dem Hintergrund sowohl eines Erhalts der Fertilität als auch der Vermeidung einer Verminderung der Lebensqualität, der Beeinflussung des Sexuallebens und dem Erhalt der Knochen- und kardiovaskulären Gesundheit wird dem Erhalt der ovariellen Funktion nach einer Chemotherapie eine besondere Bedeutung beigemessen.
Die Annahme einer Wirksamkeit von Gonadotropin-Releasing-Hormon-(GnRH-)Agonisten zur Verminderung des Risikos einer CIA basiert auf mehreren kleinen nicht randomisierten Beobachtungsstudien 42. Vor diesem Hintergrund wurden verschiedene randomisierte Studien durchgeführt, die diesen Effekt letztlich jedoch nicht einheitlich bestätigen konnten. In einer Cochrane-Analyse 43 basierend auf der Auswertung von 4 randomisierten Studien aus den Jahren 1987 bis 2007 kamen die Autoren zu dem Schluss, dass die Anwendung eines GnRH-Agonisten bei Patientinnen im reproduktiven Alter und Notwendigkeit einer Chemotherapie erwogen werden sollte. Die Autoren konnte zeigen, dass die intramuskuläre/subkutane Anwendung von GnRH-Agonisten zu einer erhöhten Menstruations- (RR 1,90, 95 %-KI 1,30–2,79) und Ovulationsrate (RR 2,70, 95 %-KI 1,52–4,79) führte. Auch wenn die Autoren keine Unterschiede hinsichtlich der resultierenden Schwangerschaftsrate aufzeigen konnten (RR 0,21, 95 %-KI 0,01–4,09) so werteten sie diese Daten als Hinweis darauf, dass prämenopausalen Patientinnen vor einer Chemotherapie die Anwendung von GnRH anzubieten sei 43. Auch eine neuere Metaanalyse auf der Basis 6 randomisierter Studien kommt zu dem Schluss, dass der Einsatz von GnRH-Agonisten die Chance auf einen Erhalt der ovariellen Reserve erhöht 44.
Verschiedene Studien hingegen können diese Daten nicht unterstützen. In einer der aktuellsten Studien bsw. untersuchten Munster et al. den Einfluss einer Triptorelin-Applikation während einer neoadjuvanten oder adjuvanten Chemotherapie bei prämenopausalen Patientinnen mit Mammakarzinom. Die Patientinnen wurden stratifiziert nach Alter, Östrogenrezeptorstatus, der Anwendung einer antihormonellen Therapie und dem spezifischen verwendeten Chemotherapieregime. Zielparameter dieser randomisierten Studie war zum einen das Wiederauftreten einer Menstruation sowie andererseits die Spiegel von FSH, Inhibin A und Inhibin B. Die Studie wurde vorzeitig abgebrochen, da in einer Zwischenauswertung anhand der Daten von 49 der insgesamt 124 geplanten Studienteilnehmerinnen kein Effekt zu verzeichnen war. Bei 90 % der Frauen in der Kontrollgruppe im Vergleich zu 88 % in der Therapiegruppe setzte die Menstruation wieder ein (p = 0,36). Auch in der Zeit bis zum Wiederauftreten einer Menstruation ließ sich kein signifikanter Unterschied erkennen (im Median 5,0 vs. 5,8 Monate im Kontroll- bzw. Behandlungsarm, p = 0,58). Auch wurden die 2 spontan konzipierten Schwangerschaften, die in der Studie dokumentiert wurden, im Kontrollarm beobachtet. Die o. g. hormonellen Parameter verhielten sich in beiden Studienarmen nicht signifikant unterschiedlich 45.
Und auch in einer offenen, randomisierten, Multicenterstudie (GBG 37 ZORO) der German Breast Group (GBG) konnte der Nutzen von GnRH zur Vermeidung einer CIA/CIM nicht belegt werden. In dieser Studie untersuchten Gerber et al. den Einfluss einer 4-wöchentlichen Goserelin-Applikation (3,6 mg s. c.) parallel zu einer anthrazyklin- oder anthrazyklin-taxanhaltigen neoadjuvanten Chemotherapie auf den Erhalt der ovariellen Funktion, definiert als das Wiedereinsetzen zweier aufeinanderfolgender Menstruationen im Abstand von 21–35 Tagen bis 6 Monate nach Beendigung der Chemotherapie. 60 Patientinnen wurde in diese Studie eingeschlossen, von denen insgesamt 53 (88,3 %) eine Amenorrhö zeigten (93,3 % bei Patientinnen mit vs. 83,3 % bei Patientinnen ohne Goserelin). Im Vergleich beider Studienarme konnte kein signifikanter Unterschied festgestellt werden in Bezug auf die Menstruationsrate nach 6 Monaten (70,0 % mit vs. 56,7 % ohne Goserelin; p = 0,284). Nach 2 Jahren war mit Ausnahme einer Patientin bei allen Studienteilnehmerinnen wieder ein Menstruationszyklus festzustellen. Auch in der Zeit bis zum Eintreten eines regulären Menstruationszyklus nach Chemotherapie zeigte sich kein signifikanter Unterschied (6,8 Monate mit und 6,1 Monate ohne Goserelin, p = 0,304) 46.
Das Design und die Auswertung der Studie sind in einigen Aspekten kritisch hinterfragt worden. So wurde die Bedeutung des Auftretens zweier aufeinanderfolgender Menstruationen als angemessenes Surrogat für eine wiederhergestellte Ovarialfunktion infrage gestellt. Auch wurde darauf hingewiesen, dass nach 2 Jahren nahezu alle Patientinnen erneut eine Menstruation zeigten und somit die Notwendigkeit einer ovariellen Protektion im Zusammenhang mit dem verwendeten Chemotherapieregime hinterfragt. Und auch die Wahl eines Patientinnenalters von maximal 47 Jahre wurde als zu hoch angesehen 47. Trotz aller dieser Einwände kann zum aktuellen Zeitpunkt aus den Ergebnissen der ZORO-Studie sicherlich kein valider Hinweis für einen Stellenwert von Goserelin in der Prävention des CIA abgeleitet werden.
Es bleibt daher abzuwarten, ob die Ergebnisse neuerer Studien den Stellenwert von GnRH-Analoga zur Prävention einer CIA/CIM belegen können. So untersucht beispielsweise die The-Prevention-of-Early-Menopause-Studie (POEMS) der Southwest Oncology Group (SWOG) nochmals den Einfluss einer Goserelin-Applikation auf die Rate ovarieller Dysfunktionen, die ovarielle Reserve und die resultierenden Schwangerschaftsraten bei Patientinnen mit Mammakarzinom. Vorgesehen ist der Einschluss von ca. 416 Patientinnen.
Verschiedene Vorgehensweisen zum Erhalt der Fertilität im Rahmen onkologischer Therapien wurden beschrieben 48. Vor dem Hintergrund der widersprüchlichen Datenlage und der Tatsache, dass ein Nutzen von GnRH-Agonisten zumindest in einigen Metaanalysen belegt ist, empfiehlt die Arbeitsgruppe „fertiPROTEKT“, dass „aufgrund der beschriebenen Datenlage zur Wirksamkeit von GnRH-Agonisten als Ovarialprotektiva […] diese Medikation dennoch chemotherapeutisch behandelten Frauen, insbesondere bei fehlenden therapeutischen Alternativen zum Fertilitätserhalt, angeboten werden“ solle (www.fertiprotekt.de) 49.
Die Kommission „Mamma“ der Arbeitsgemeinschaft Gynäkologische Onkologie (AGO) hingegen ist hinsichtlich der Empfehlung zur Gabe von GnRH-Analoga zur Prophylaxe eines POF deutlich zurückhaltender (www.ago-online.de, Tab. 3), denn letztlich kann eine Beeinflussung der Chemotherapieeffizienz durch die simultane endokrine Alteration nicht mit letzter Sicherung ausgeschlossen werden 50. Nicht zuletzt vor diesem Hintergrund sollte der Einsatz von GnRH mit der Patientin kritisch und ausführlich diskutiert werden.
Prognostische Bedeutung der CIA
Ebenso nicht abschließend geklärt bleibt die Tatsache, inwiefern sich eine CIA auf die Prognose der behandelten Brustkrebserkrankung auswirkt. Verschiedene Studien suggerieren eine prognostische Bedeutung der CIA bei prämenopausalen Patientinnen mit Mammakarzinom 51, 52.
In einer retrospektiven Analyse auf der Basis von Daten der National-Cancer-Institute-of-Canada-Clinical-Trials-Group-(NCIC CTG-)Studie MA.5 von 442 Patientinnen, die wegen eines Mammakarzinoms eine adjuvante Chemotherapie mit CMF vs. CEF erhalten hatten, untersuchten Swain et al. den Einfluss einer Amenorrhö nach 6 bzw. 12 Monaten auf das rezidivfreie bzw. Gesamtüberleben der Patientinnen. Auch wenn die kumulative Cyclophosphamid-Dosis im CMF-Arm höher lag als im CEF-Arm, so war im CEF-Arm eine erhöhte Amenorrhörate nach 6 Monaten zu verzeichnen (relatives Risiko im Vergleich zu CMF 1,2; 95 %-KI 1,0–1,3); nach 12 Monaten zeigte sich kein signifikanter Unterschied. Bei Patientinnen mit hormonrezeptorpositivem Mammakarzinom zeigte sich kein signifikanter Einfluss der Amenorrhörate nach 6 Monaten auf die Prognose der Patientinnen, nach 12 Monaten zeigte sich jedoch ein signifikant verbessertes rezidivfreies Überleben (Hazard Ratio [HR] 0,51; 95 %-KI 0,32–0,82; p = 0,005) und Gesamtüberleben (HR 0,40; 95 %-KI, 0,22–0,72; p = 0,002). Die Autoren schlussfolgerten auf der Basis dieser Daten, dass die späte CIA nach 12 Monaten eine prognostische Bedeutung für Patientinnen mit hormonrezeptorpositivem Mammakarzinom haben könne 53.
Auch in einer aktuellen Arbeit einer koreanischen Arbeitsgruppe wurde die ungünstige prognostische Bedeutung eines Wiederauftretens der Menstruation bei Patientinnen mit Mammakarzinom belegt. Die Autoren führten eine retrospektive Datenanalyse von 872 Patientinnen mit Mammakarzinom durch. Die Patientinnen zeigten ein medianes Alter von 41 Jahren bei Diagnosestellung. Bei 79,4 % der Patientinnen wurde ein hormonrezeptorpositives Mammakarzinom diagnostiziert, und der überwiegende Anteil dieser Patientin erhielt eine endokrine Therapie mit Tamoxifen. Die CIA-Rate lag bei 76,7 % (n = 669) definiert als Ausbleiben der Menstruation für mindestens 6 Monate. Bei 51,8 % (n = 452) der Patientinnen traten im Verlauf der Nachbeobachtungszeit erneut Menstruationsblutungen auf. Letzteres war mit einem verringerten erkrankungsfreien Überleben assoziiert (p < 0,001, unabhängig vom Hormonrezeptorstatus) 54. Es lässt sich schlussfolgern, dass die Effizienz moderner Chemotherapieregime durch deren ovarielle Suppression mitbestimmt wird und die großzügige und unreflektierte Gabe von Medikamenten zur Ovarprotektion durch die Ergebnisse der o. g. Studien infrage gestellt werden kann. Dieses ist insbesondere vor dem Hintergrund zu beachten, dass zunehmend effektive Methoden zur Verfügung stehen, die einen Fertilitätserhalt z. B. durch Kryokonservierung von Eizellen und Ovarialgewebe ermöglichen können 55. Es bleibt zu untersuchen, inwiefern die ovarielle Suppression bei Patientinnen, die unter einer Chemotherapie nicht permanent amenorrhoisch geworden sind, die Wirksamkeit einer adjuvanten Chemotherapie erhöhen kann.
Footnotes
Conflicts of Interest/Interessenkonflikt None. Nein.
Hinweis: Der Beitrag wurde laut folgendem Erratum am 5.12.2012 geändert:
Im Beitrag muss es in Fig. 1 unterhalb des Kastens "Determination of FSH and E2/(estimation of menopausal status)" im rechten Kasten korrekt heißen:
FSH > 40 IU/L
E2 < 10 pg/ml
Supporting Information
German supporting informations for this article
References
- 1.Hankey B F, Miller B, Curtis R. et al. Trends in breast cancer in younger women in contrast to older women. J Natl Cancer Inst Monogr. 1994;36:7–14. [PubMed] [Google Scholar]
- 2.Higgins S, Haffty B G. Pregnancy and lactation after breast-conserving therapy for early stage breast cancer. Cancer. 1994;73:2175–2180. doi: 10.1002/1097-0142(19940415)73:8<2175::aid-cncr2820730823>3.0.co;2-#. [DOI] [PubMed] [Google Scholar]
- 3.Bines J, Oleske D M, Cobleigh M A. Ovarian function in premenopausal women treated with adjuvant chemotherapy for breast cancer. J Clin Oncol. 1996;14:1718–1729. doi: 10.1200/JCO.1996.14.5.1718. [DOI] [PubMed] [Google Scholar]
- 4.Kümmel S, Kolberg H C, Lüftner D. et al. Mammakarzinom 2011 – Neue Aspekte. Geburtsh Frauenheilk. 2011;71:939–953. [Google Scholar]
- 5.Hartkopf A D, Banys M, Krawczyk N. et al. Circulating tumor cells in early-stage breast cancer. Geburtsh Frauenheilk. 2011;71:1067–1072. doi: 10.1055/s-0031-1280463. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Böhm J, Zikán M. Einfluss der prognostischen Faktoren auf die Therapie des duktalen Carcinoma in situ der Brust. Geburtsh Frauenheilk. 2011;71:967–972. [Google Scholar]
- 7.Gerber B, Müller H, Reimer T. Fertilitätserhaltung und Ovarprotektion bei Tumorerkrankungen: Bereits ein Standard? Geburtsh Frauenheilk. 67:620–627. [Google Scholar]
- 8.Thewes B, Meiser B, Taylor A. et al. Fertility- and menopause-related information needs of younger women with a diagnosis of early breast cancer. J Clin Oncol. 2005;23:5155–5165. doi: 10.1200/JCO.2005.07.773. [DOI] [PubMed] [Google Scholar]
- 9.Colleoni M, Rotmensz N, Robertson C. et al. Very young women (< 35 years) with operable breast cancer: features of disease at presentation. Ann Oncol. 2002;13:273–279. doi: 10.1093/annonc/mdf039. [DOI] [PubMed] [Google Scholar]
- 10.Oktay K, Buyuk E, Libertella N. et al. Fertility preservation in breast cancer patients: a prospective controlled comparison of ovarian stimulation with tamoxifen and letrozole for embryo cryopreservation. J Clin Oncol. 2005;23:4347–4353. doi: 10.1200/JCO.2005.05.037. [DOI] [PubMed] [Google Scholar]
- 11.Bruning P F, Pit M J, de Jong-Bakker M. et al. Bone mineral density after adjuvant chemotherapy for premenopausal breast cancer. Br J Cancer. 1990;61:308–310. doi: 10.1038/bjc.1990.58. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Jeanes H, Newby D, Gray G A. Cardiovascular risk in women: the impact of hormone replacement therapy and prospects for new therapeutic approaches. Expert Opin Pharmacother. 2007;8:279–288. doi: 10.1517/14656566.8.3.279. [DOI] [PubMed] [Google Scholar]
- 13.Zemlin C, Herrmann-Lingen C, Wiegard K. et al. Implementierung eines EDV- und Screening-gestützten psychoonkologischen Versorgungspfads. Geburtsh Frauenheilk. 2011;71:853–861. [Google Scholar]
- 14.Carter J, Rowland K, Chi D. et al. Gynecologic cancer treatment and the impact of cancer-related infertility. Gynecol Oncol. 2005;97:90–95. doi: 10.1016/j.ygyno.2004.12.019. [DOI] [PubMed] [Google Scholar]
- 15.De Vos M, Devroey P, Fauser B C. Primary ovarian insufficiency. Lancet. 2010;376:911–921. doi: 10.1016/S0140-6736(10)60355-8. [DOI] [PubMed] [Google Scholar]
- 16.Knauff E A, Eijkemans M J, Lambalk C B. et al. Anti-Mullerian hormone, inhibin B, and antral follicle count in young women with ovarian failure. J Clin Endocrinol Metab. 2009;94:786–792. doi: 10.1210/jc.2008-1818. [DOI] [PubMed] [Google Scholar]
- 17.Longway M, Matthews C A. Resumption of ovarian function 20 years after chemotherapy-induced ovarian failure: a case report. Fertil Steril. 2009;92:3.92E19–3.92E20. doi: 10.1016/j.fertnstert.2009.02.082. [DOI] [PubMed] [Google Scholar]
- 18.Del Mastro L, Venturini M, Sertoli M R. et al. Amenorrhea induced by adjuvant chemotherapy in early breast cancer patients: prognostic role and clinical implications. Breast Cancer Res Treat. 1997;43:183–190. doi: 10.1023/a:1005792830054. [DOI] [PubMed] [Google Scholar]
- 19.Okanami Y, Ito Y, Watanabe C. et al. Incidence of chemotherapy-induced amenorrhea in premenopausal patients with breast cancer following adjuvant anthracycline and taxane. Breast Cancer. 2011;18:182–188. doi: 10.1007/s12282-011-0256-7. [DOI] [PubMed] [Google Scholar]
- 20.Swain S M, Land S R, Ritter M W. et al. Amenorrhea in premenopausal women on the doxorubicin-and-cyclophosphamide-followed-by-docetaxel arm of NSABP B-30 trial. Breast Cancer Res Treat. 2009;113:315–320. doi: 10.1007/s10549-008-9937-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Abusief M E, Missmer S A, Ginsburg E S. et al. Relationship between reproductive history, anthropometrics, lifestyle factors, and the likelihood of persistent chemotherapy-related amenorrhea in women with premenopausal breast cancer. Fertil Steril. 2012;97:154–159. doi: 10.1016/j.fertnstert.2011.10.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Dann E J, Epelbaum R, Avivi I. et al. Fertility and ovarian function are preserved in women treated with an intensified regimen of cyclophosphamide, adriamycin, vincristine and prednisone (Mega-CHOP) for non-Hodgkin lymphoma. Hum Reprod. 2005;20:2247–2249. doi: 10.1093/humrep/dei018. [DOI] [PubMed] [Google Scholar]
- 23.Di Cosimo S, Alimonti A, Ferretti G. et al. Incidence of chemotherapy-induced amenorrhea depending on the timing of treatment by menstrual cycle phase in women with early breast cancer. Ann Oncol. 2004;15:1065–1071. doi: 10.1093/annonc/mdh266. [DOI] [PubMed] [Google Scholar]
- 24.Walshe J M, Denduluri N, Swain S M. Amenorrhea in premenopausal women after adjuvant chemotherapy for breast cancer. J Clin Oncol. 2006;24:5769–5779. doi: 10.1200/JCO.2006.07.2793. [DOI] [PubMed] [Google Scholar]
- 25.Stearns V, Schneider B, Henry N L. et al. Breast cancer treatment and ovarian failure: risk factors and emerging genetic determinants. Nat Rev Cancer. 2006;6:886–893. doi: 10.1038/nrc1992. [DOI] [PubMed] [Google Scholar]
- 26.Mertens A C, Yasui Y, Neglia J P. et al. Late mortality experience in five-year survivors of childhood and adolescent cancer: the Childhood Cancer Survivor Study. J Clin Oncol. 2001;19:3163–3172. doi: 10.1200/JCO.2001.19.13.3163. [DOI] [PubMed] [Google Scholar]
- 27.Partridge A H, Ruddy K J. Fertility and adjuvant treatment in young women with breast cancer. Breast. 2007;16 02:S175–S181. doi: 10.1016/j.breast.2007.07.029. [DOI] [PubMed] [Google Scholar]
- 28.Tham Y L, Sexton K, Weiss H. et al. The rates of chemotherapy-induced amenorrhea in patients treated with adjuvant doxorubicin and cyclophosphamide followed by a taxane. Am J Clin Oncol. 2007;30:126–132. doi: 10.1097/01.coc.0000251398.57630.4f. [DOI] [PubMed] [Google Scholar]
- 29.Han H S, Ro J, Lee K S. et al. Analysis of chemotherapy-induced amenorrhea rates by three different anthracycline and taxane containing regimens for early breast cancer. Breast Cancer Res Treat. 2009;115:335–342. doi: 10.1007/s10549-008-0071-9. [DOI] [PubMed] [Google Scholar]
- 30.Colleoni M, Gelber S, Goldhirsch A. et al. Tamoxifen after adjuvant chemotherapy for premenopausal women with lymph node-positive breast cancer: International Breast Cancer Study Group Trial 13-93. J Clin Oncol. 2006;24:1332–1341. doi: 10.1200/JCO.2005.03.0783. [DOI] [PubMed] [Google Scholar]
- 31.Abusief M E, Missmer S A, Ginsburg E S. et al. The effects of paclitaxel, dose density, and trastuzumab on treatment-related amenorrhea in premenopausal women with breast cancer. Cancer. 2010;116:791–798. doi: 10.1002/cncr.24835. [DOI] [PubMed] [Google Scholar]
- 32.Rose D P, Davis T E. Effects of adjuvant chemohormonal therapy on the ovarian and adrenal function of breast cancer patients. Cancer Res. 1980;40:4043–4047. [PubMed] [Google Scholar]
- 33.Warne G L, Fairley K F, Hobbs J B. et al. Cyclophosphamide-induced ovarian failure. N Engl J Med. 1973;289:1159–1162. doi: 10.1056/NEJM197311292892202. [DOI] [PubMed] [Google Scholar]
- 34.Weenen C, Laven J S, Von Bergh A R. et al. Anti-Mullerian hormone expression pattern in the human ovary: potential implications for initial and cyclic follicle recruitment. Mol Hum Reprod. 2004;10:77–83. doi: 10.1093/molehr/gah015. [DOI] [PubMed] [Google Scholar]
- 35.La Marca A, Broekmans F J, Volpe A. et al. Anti-Mullerian hormone (AMH): what do we still need to know? Hum Reprod. 2009;24:2264–2275. doi: 10.1093/humrep/dep210. [DOI] [PubMed] [Google Scholar]
- 36.Dittrich R, Maltaris T, Hoffmann I. et al. Fertility preservation in cancer patients. Minerva Ginecol. 2010;62:63–80. [PubMed] [Google Scholar]
- 37.Rossi E, Morabito A, Di Rella F. et al. Endocrine effects of adjuvant letrozole compared with tamoxifen in hormone-responsive postmenopausal patients with early breast cancer: the HOBOE trial. J Clin Oncol. 2009;27:3192–3197. doi: 10.1200/JCO.2008.18.6213. [DOI] [PubMed] [Google Scholar]
- 38.Anderson R A, Themmen A P, Al-Qahtani A. et al. The effects of chemotherapy and long-term gonadotrophin suppression on the ovarian reserve in premenopausal women with breast cancer. Hum Reprod. 2006;21:2583–2592. doi: 10.1093/humrep/del201. [DOI] [PubMed] [Google Scholar]
- 39.Anders C, Marcom P K, Peterson B. et al. A pilot study of predictive markers of chemotherapy-related amenorrhea among premenopausal women with early stage breast cancer. Cancer Invest. 2008;26:286–295. doi: 10.1080/07357900701829777. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Su H I, Sammel M D, Green J. et al. Antimullerian hormone and inhibin B are hormone measures of ovarian function in late reproductive-aged breast cancer survivors. Cancer. 2010;116:592–599. doi: 10.1002/cncr.24746. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Anderson R A, Cameron D A. Pretreatment serum anti-mullerian hormone predicts long-term ovarian function and bone mass after chemotherapy for early breast cancer. J Clin Endocrinol Metab. 2011;96:1336–1343. doi: 10.1210/jc.2010-2582. [DOI] [PubMed] [Google Scholar]
- 42.Sonmezer M, Oktay K. Fertility preservation in young women undergoing breast cancer therapy. Oncologist. 2006;11:422–434. doi: 10.1634/theoncologist.11-5-422. [DOI] [PubMed] [Google Scholar]
- 43.Chen H Li J Cui T et al. Adjuvant gonadotropin-releasing hormone analogues for the prevention of chemotherapy induced premature ovarian failure in premenopausal women Cochrane Database Syst Rev 201111CD008018 [DOI] [PubMed] [Google Scholar]
- 44.Bedaiwy M A, Abou-Setta A M, Desai N. et al. Gonadotropin-releasing hormone analog cotreatment for preservation of ovarian function during gonadotoxic chemotherapy: a systematic review and meta-analysis. Fertil Steril. 2011;95:906-14.e1–906-14.e4. doi: 10.1016/j.fertnstert.2010.11.017. [DOI] [PubMed] [Google Scholar]
- 45.Munster P N, Moore A P, Ismail-Khan R. et al. Randomized trial using gonadotropin-releasing hormone agonist triptorelin for the preservation of ovarian function during (neo)adjuvant chemotherapy for breast cancer. J Clin Oncol. 2012;30:533–538. doi: 10.1200/JCO.2011.34.6890. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Gerber B, von Minckwitz G, Stehle H. et al. Effect of luteinizing hormone-releasing hormone agonist on ovarian function after modern adjuvant breast cancer chemotherapy: the GBG 37 ZORO study. J Clin Oncol. 2011;29:2334–2341. doi: 10.1200/JCO.2010.32.5704. [DOI] [PubMed] [Google Scholar]
- 47.Blumenfeld Z ZORO study: discrepancy between the conclusion and the results J Clin Oncol 2011293340author reply 3341–3342 [DOI] [PubMed] [Google Scholar]
- 48.Lawrenz B, Neunhoeffer E, Wallwiener D. et al. Management des Fertilitätserhaltes bei Mammakarzinom-Patientinnen unter 40 Jahren an der Universitätsfrauenklinik Tübingen. Geburtsh Frauenheilk. 2007;96:A066. [Google Scholar]
- 49.von Wolff M, Montag M, Dittrich R. et al. Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkinʼs lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011;284:427–435. doi: 10.1007/s00404-011-1874-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Cruz M R, Prestes J C, Gimenes D L. et al. Fertility preservation in women with breast cancer undergoing adjuvant chemotherapy: a systematic review. Fertil Steril. 2010;94:138–143. doi: 10.1016/j.fertnstert.2009.02.055. [DOI] [PubMed] [Google Scholar]
- 51.Jung M, Shin H J, Rha S Y. et al. The clinical outcome of chemotherapy-induced amenorrhea in premenopausal young patients with breast cancer with long-term follow-up. Ann Surg Oncol. 2010;17:3259–3268. doi: 10.1245/s10434-010-1172-3. [DOI] [PubMed] [Google Scholar]
- 52.Swain S M, Jeong J H, Geyer C E Jr.. et al. Longer therapy, iatrogenic amenorrhea, and survival in early breast cancer. N Engl J Med. 2010;362:2053–2065. doi: 10.1056/NEJMoa0909638. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Parulekar W R, Day A G, Ottaway J A. et al. Incidence and prognostic impact of amenorrhea during adjuvant therapy in high-risk premenopausal breast cancer: analysis of a National Cancer Institute of Canada Clinical Trials Group Study – NCIC CTG MA.5. J Clin Oncol. 2005;23:6002–6008. doi: 10.1200/JCO.2005.07.096. [DOI] [PubMed] [Google Scholar]
- 54.Park I H, Han H S, Lee H. et al. Resumption or persistence of menstruation after cytotoxic chemotherapy is a prognostic factor for poor disease-free survival in premenopausal patients with early breast cancer. Ann Oncol. 2012;23:2283–2289. doi: 10.1093/annonc/mds006. [DOI] [PubMed] [Google Scholar]
- 55.Kupka M S, Dittrich R, Nawroth F. et al. Fertility protection for women. Techniques, indications and perspectives. Gynnäkologische Endokrinologie. 2012;10:98–104. [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.
Supplementary Materials
German supporting informations for this article


