Summary
L’utilisation des bactériophages, prédateurs naturels des bactéries, est une technique pionnière efficace de lutte contre les infections bactériennes. Tombée dans l’oubli depuis un demi-siècle du coté occidental de l’ex-rideau de fer, elle fait toujours partie de l’arsenal thérapeutique des pays de l’ex-Europe de l’Est, au point de constituer une arme de choix dans la politique de santé publique de ces pays. l’émergence de bactéries multirésistantes et le risque de revenir à l’ère pré-antibiotique ont fait ressortir la phagothérapie de l’oubli injuste auquel elle avait été confinée. la biologie et la place du bactériophage dans la nature sont décrites ici. les tenants et les aboutissants de la phagothérapie et les conditions de son retour sur le devant de la scène sont explicitées.
Keywords: bacteriophage, phagotherapie, infection, brûlure, résistances bactériennes
Abstract
The use of bacteriophages, natural predators of bacteria, is an effective technique in the fight against bacterial infections. Long since forgotten in the western world, it is still practised in parts of Eastern Europe as the primary weapon of choice against bacterial infections in public health policy. The global emergence of multidrug-resistant bacteria, or « superbugs », and the associated risk of returning to the pre-antibiotic era have brought the benefits of phagotherapy back to the fore. The purpose of this paper is to highlight the biology and place of bacteriophages in their natural context and explain why and how phagotherapy can be an effective solution to treat bacterial infections.
Introduction
L’émergence de bactéries résistantes aux antibiotiques et le manque de moyens thérapeutiques ont ramené sur le devant de la scène une thérapeutique ancienne que l’occident avait oubliée : la phagothérapie. Cette méthode consiste à mettre à profit les armes que l’évolution a créé pour lutter contre les bactéries. Ces armes sont des virus : les bactériophages.
Historique
C’est en observant des « plages claires » au sein d’une culture de bactéries sur gélose en 1917 que le franco-canadien Félix D’Hérelle a formulé l’hypothèse d’une part que ces plages claires correspondaient à une lyse bactérienne et d‘autre part que cette lyse pouvait être provoquée par un agent inconnu qu’il a appelé « microbe filtrant ».1 pour être exact, une constatation similaire avait été effectuée deux ans plus tôt par l’anglais Frederick Twort mais celui a semble-t-il interprété le phénomène de lyse comme étant d’origine chimique, employant d’ailleurs, à ce sujet, le terme de diastase.2 poursuivant son hypothèse d’un « microbe tueur de microbes », qu’il appellera bactériophage, D’Hérelle isole en quelques mois des phages actifs contre plusieurs espèces bactériennes.3 Dès 1918, il imagine un usage thérapeutique du bactériophage,4 qu’il concrétise en 1919 par le traitement (avec succès) d’enfants victimes de dysenterie bacillaire hospitalisés à l’hôpital necker de paris.5 la phagothérapie est née.
La méthode proposée par D’Hérelle fait la preuve de son efficacité avec notamment le traitement de cas de peste en Égypte durant l’année 19256 et son utilisation pour juguler une épidémie de choléra en inde en 1926.7 Ces premiers succès ont eu un retentissement tel qu’ils sont le point de départ d’une véritable « mondialisation » de la phagothérapie. pour la première fois, dès le début des années 30, le monde médical semble enfin disposer d’une arme efficace pour traiter les infections bactériennes.8 C’est dans cette perspective qu’en 1933 georgi Eliava, un élève de Félix D’Hérelle, crée à Tbilissi « l’institut du bactériophage », première institution au monde intégralement consacrée au bactériophage et à ses applications thérapeutiques.8
Après les premiers succès sont venus les premiers échecs, faisant naitre les premiers doutes et les premières polémiques.9 Certains, à l’instar de Jules Bordet , pensent même à l’époque que la théorie de D’Hérelle est fausse, à savoir que le bactériophage n’existe pas et que l’efficacité de la méthode repose sur un phénomène enzymatique,9 donnant ainsi naissance à 10 ans de polémiques. l’explication des échecs et des polémiques qui en ont découlé tient au fait que l’agent à l’origine de l’efficacité de la méthode – le bactériophage – n’avait pas encore été mis en évidence à l’époque. il faudra pour cela attendre l’invention du microscope électronique pour permettre à H. ruska d’observer et de photographier le premier bactériophage en 1940 (un phage actif contre E. coli). Si la rigueur d’expérimentateur de Félix D’Hérelle, acquise à l’institut pasteur de paris, lui a permis de dégager les facteurs clés du succès des préparations de bactériophages à usage thérapeutique, il n’en est pas de même de tous ceux qui prétendent, à l’époque, mettre en oeuvre la phagothérapie proposée par D’Hérelle, expliquant les échecs.9
Le coup de grâce a été porté à la phagothérapie par deux évènements successifs : la découverte de la pénicilline par Alexander Fleming en 1928 puis la seconde guerre mondiale, qui a généré des besoins immenses en traitements anti-infectieux. Dans ces conditions il est facile de comprendre la production de masse d’antibiotiques (plus aisés à fabriquer, plus stables et plus simples d’emploi) suivie de la montée en charge des grandes firmes pharmaceutiques qui en résultera. la seconde guerre mondiale a été le promoteur de l’âge d’or de l’antibiothérapie. En trois ou quatre décennies va naitre une trentaine de nouvelles molécules générant d’immenses espoirs thérapeutiques au point de faire dire à W. Stewart que « le temps est venu de fermer le livre des maladies infectieuses ». l’abandon progressif de la phagothérapie sera le pendant de cet âge d’or des antibiotiques. Cet abandon définitif dans les années 80, sera marqué par la destruction des collections de bactériophage de l’institut pasteur de paris (pr J.F. Vieu) et de l’institut pasteur de lyon (pr J. guillermet).10
Heureusement pour la phagothérapie, la guerre froide a interdit à la médecine des pays d’Europe de l’Est l’accès aux antibiotiques produits par l’industrie pharmaceutique occidentale. De plus, par décision du gouvernement de l’UrSS, les professionnels de la santé et les chercheurs de ces pays ne pouvaient se rendre à l’étranger pour faire état de leur savoir-faire et de leurs découvertes. Enfin, les publications dans les revues autres que celles des pays de l’Est leur étaient interdites et, qui plus est ces publications, écrites en langue russe ou géorgienne, étaient difficiles d’accès aux lecteurs des pays occidentaux. pour toutes ces raisons, la phagothérapie ne pouvait subir d’autre sort que l’oubli.
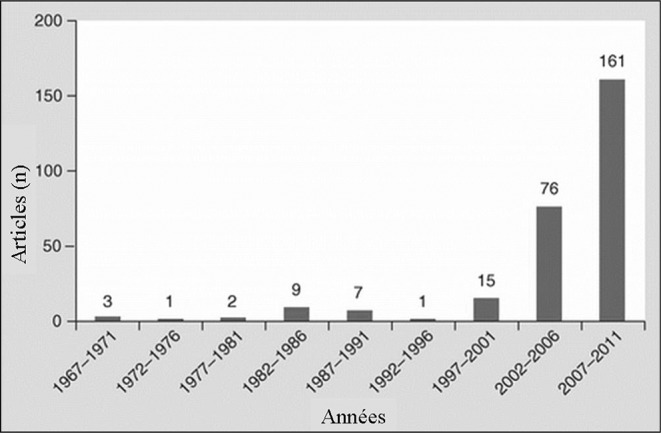
Cependant, depuis la chute des régimes communistes de l’Est et l’émergence de bactéries multirésistantes aux antibiotiques, la phagothérapie bénéficie d’un regain d’intérêt de la part des thérapeutes occidentaux, comme en témoigne la progression du nombre de publications consacrées au bactériophage depuis les années 200011 (Fig. 1).
Fig. 1. Articles consacrés au bactériophage et à la phagothérapie publiés dans les revues internationales entre 1967 et 2011.
Biologie des bacteriophages
Selon leur cycle biologique, on distingue 2 types de bactériophages : les phages lytiques et les phages tempérés.12
Les phages lytiques, comme leur nom l’indique, détruisent la bactérie. ils détournent la machinerie bactérienne à leur profit pour se reproduire et se multiplier. Au terme du processus appelé cycle lytique, la bactérie éclate et plusieurs dizaines de nouveaux phages – identiques à l’original - sont libérés dans le milieu et donc disponibles pour s’attaquer à d’autres bactéries de la même espèce. Véritables « tueurs professionnels », les phages lytiques sont les prédateurs naturels des bactéries. Ce sont précisément ces phages lytiques et eux seuls qui sont utilisés à des fins thérapeutiques (depuis D’Hérelle) pour lutter contre les infections bactériennes (phagothérapie).
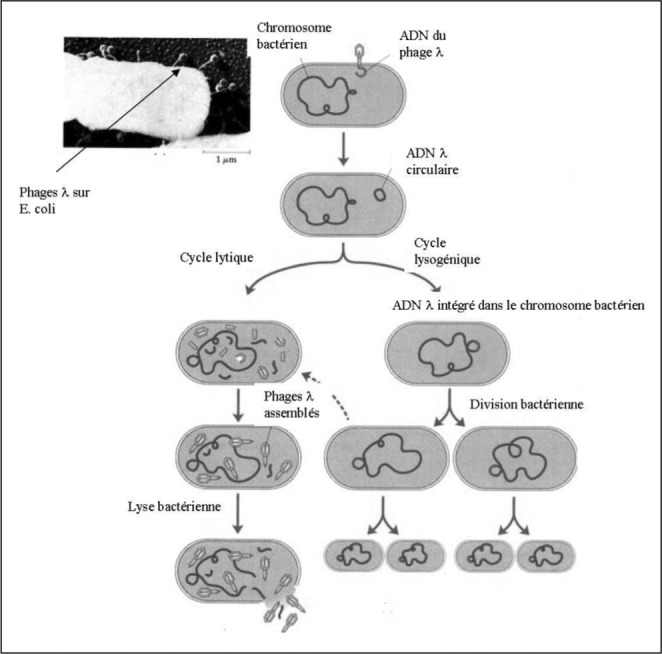
Les phages tempérés sont dotés de la propriété d’intégrer leur génome au chromosome bactérien. Ce phénomène est appelé transduction et le cycle phagique est dénommé cycle lysogénique (Fig. 2). les phages peuvent ainsi conférer de nouvelles propriétés à la bactérie, bénéfiques ou non (gènes de virulence par ex). ils peuvent rester quiescents pendant très longtemps - tels des « agents dormants », tapis dans le génome bactérien (on parle alors de prophages) avant d’entamer leur reproduction et d’entrer dans un cycle lytique. Ces phages tempérés ne sont pas utilisés en thérapeutique. lors de la production de bactériophages à usage thérapeutique on doit même s’assurer de l’absence de phage tempéré dans la préparation, car il sont de potentiels vecteurs de gènes dangereux pour le malade. En revanche, les phages tempérés sont les auxiliaires précieux des laboratoires de biologie moléculaire, qui les utilisent comme outils pour implanter des gènes à l’intérieur de bactéries afin d’en modifier le génome et permettre (par exemple) la fabrication de molécules par la bactérie, utilisée comme « usine ».
Fig. 2. Les 2 types de bactériophages (lytiques à g, tempérés à D) et leurs cycles (lytique et lysogénique).
Bactériophages et lyse bactérienne
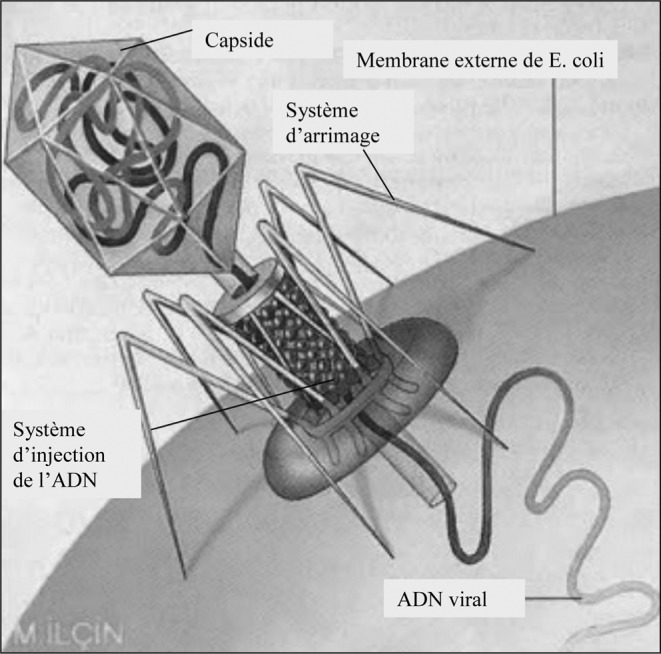
S’il existe différentes formes de bactériophages, la structure commune est la même.13 Elle comporte au minimum: le matériel génétique, en général contenu dans une capside (ou capsule), un dispositif d’arrimage à la bactérie cible et un dispositif d’injection du matériel génétique dans la bactérie (Fig. 3).
Fig. 3. Structure du bactériophage T4, spécifique de la bactérie Escherichia coli.
Le cycle lytique comporte différentes phases14:
Arrimage, c’est-à-dire fixation du phage sur la bactérie grâce à des récepteurs spécifiques au phage et à l’espèce bactérienne à laquelle il s’attaque.
Perforation de la paroi et de la membrane bactériennes à l’aide d’enzymes contenus dans le phage
Injection de l’ADn du phage dans le cytoplasme bactérien, le plus souvent à l’aide des molécules contractiles du fourreau, qui se comporte ainsi comme une seringue.
Production avec fragmentation de l’ADn bactérien et utilisation de celui-ci pour synthétiser les éléments constitutifs des futurs phages.
Maturation et assemblage des différents éléments produits.
Éclatement de la bactérie et libération des phages dans le milieu. Cette opération conduit à la mort bactérienne et à la production de 50 à 100 clones du phage original pour chaque cycle lytique. le cycle lytique produit ainsi un phénomène d’amplification considérable puisque pour une bactérie attaquée, il y a plus de 50 phages produits. la production totale de phages est, par ailleurs, d’autant plus importante que le nombre de bactéries (inoculum) est élevé.
Le cycle lytique se déroule habituellement en moins de 30 minutes alors que le processus de division bactérienne requiert environ 1 heure. la destruction des populations bactériennes (bactéricidie) est ainsi plus rapide que leurs capacités de renouvellement. par ailleurs chaque phage est spécifique d’une espèce bactérienne (son système d’arrimage est spécifique, son ADn est probablement lui aussi adapté à l’ADn bactérien qu’il va fragmenter). En revanche, il peut s’attaquer à une ou plusieurs souches dans la même espèce. Cette spécificité d’espèce interdit aux phages de modifier les autres espèces présentes dans le milieu.
Place des phages dans la nature
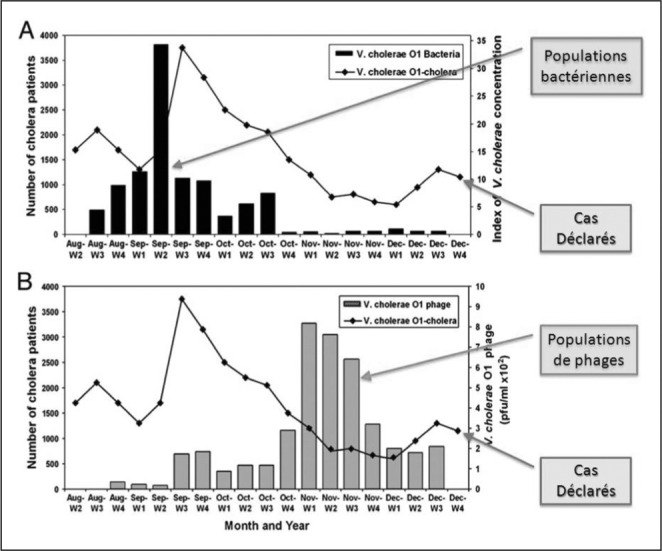
Les bactériophages, bien que méconnus, représentent la biomasse la plus importante de la planète. Considérant qu’il y en aurait dix à cent fois plus que de bactéries, leur abondance est évaluée à 1030-1032.16 On dénombre en moyenne 107 phages par ml dans les milieux liquides et jusqu’à 109 dans les sédiments. leur importance est donc considérable. ils seraient apparus sur terre avec les premières bactéries. leur ancienneté serait ainsi estimée à plusieurs milliards d’années. ils sont de ce fait soumis à l’influence de l’évolution depuis des temps immémoriaux et ont perduré depuis lors, en dépit des phénomènes cataclysmiques qui ont menacé l’existence de la vie sur notre planète. pour toutes ces raisons, on peut considérer que les bactériophages sont parfaitement fonctionnels, et étroitement adaptés aux milieux naturels qui les hébergent. les phages représentent la forme de vie la plus variée sur terre. pour chaque bactérie connue, il existe en effet, au moins un phage identifié (en moyenne 10 à 100). On trouve des bactériophages dans tous les écosystèmes, y compris dans des milieux aussi hostiles que les déserts17 et même dans la neige vierge.18 l’espèce humaine héberge elle aussi de nombreux phages : peau, muqueuses, et surtout tube digestif, dans lequel on a identifié plus de 100 phages différents. les bactériophages sont les acteurs de nombreux écosystèmes et, bien que leur importance soit considérable, leur rôle est encore mal connu (l’écologie microbienne est une discipline qui est apparue il y a moins de 20 ans). On sait cependant que les phages lytiques sont directement responsables d’au moins 50% de la mortalité bactérienne journalière en l’absence d’autres prédateurs. ils contribuent ainsi probablement au renouvellement des populations bactériennes et à leur régulation. ils contribueraient aussi à la mobilisation de substrats issus de la destruction des bactéries : ils ont donc aussi un rôle à jouer dans le cycle du carbone. les phages tempérés, quant à eux, contribuent aux échanges de matériel génétique entre bactéries ; ils joueraient ainsi un rôle dans leur évolution. pour comprendre le rôle que peuvent avoir les bactériophages au sein des milieux naturels, il faut s’intéresser aux travaux de Faruque sur le choléra19,20 (Fig. 4). Celui-ci montre que l’apparition et l’arrêt d’une épidémie de choléra correspondent à une modification de l’équilibre entre populations bactériennes (Vibrio cholerae) et populations de phages spécifiques. Tout se passe comme si la faible quantité de bactériophages au sein des eaux provoquait une explosion démographique chez Vibrio cholerae au point que les populations bactériennes dépassent le seuil infectant, permettant à l’épidémie de se déclencher. De la même manière, il semble que ce soit l’accroissement des populations de bactériophages spécifiques qui réduise les populations bactériennes faisant ainsi décroitre puis s’éteindre l’épidémie. Ces constatations tendent à confirmer le rôle du bactériophage dans la régulation des populations bactériennes au sein des milieux naturels.
Fig. 4. Relations phages – bactéries : cas déclarés au cours d’une épidémie de choléra.
Les interactions-hôtes bactéries et leur co-évolution laissent apparaître la possibilité de résistances des bactéries à l’action des bactériophages et laissent entrevoir une possible inefficacité des phages sur les bactéries. On a pu montrer qu’il était assez facile de produire in-vitro des bactéries résistantes à un phage. En revanche, il est surprenant de constater que ce n’est pas le cas dans la nature.15 Ce mécanisme n’est pas encore compris mais il est probable que bactériophages et bactéries hôtes subissent en permanence des mutations qui rendent les résistances labiles. De ce fait, si les bactéries peuvent facilement devenir résistantes aux phages, ceux-ci peuvent à leur tour, par mutation, recouvrer l’efficacité vis-à-vis de leur bactérie cible.
Que deviennent les phages après disparition de leurs bactéries hôtes? D’Hérelle avait déjà montré que les phages sont très résistants dans la nature et qu’ils tolèrent des conditions physico-chimiques biens plus difficiles que celles supportées par les bactéries, probablement équivalentes à celles des spores bactériennes.21,22 il est donc probable qu’ils peuvent survivre dans les milieux naturels hors la présence de leur bactérie-hôte, mais leur survie doit avoir des limites, pour l’instant inconnues.
Utilisation des bacteriophages à des fins thérapeutiques (phagothérapie)
L'utilisation thérapeutique des bactériophages présente des avantages et des limites. Compte tenu de la rapidité de leur multiplication et du nombre de clones issus de chaque cycle lytique, il est logique d’attendre de la phagothérapie une bactéricidie intense et rapide. Celle-ci est plus rapide que celle obtenue par les antibiotiques. Elle sera d’autant plus importante que les populations bactériennes sont élevées, à la différence des antibiotiques. Du fait de la spécificité des phages pour une espèce bactérienne donnée, la pression de sélection est sans doute réduite et leur impact sur les écosystèmes sera, en principe, limité. par ailleurs, la résistance bactérienne aux phages est connue comme rare in vivo et surtout particulièrement labile. l’efficacité du produit à usage thérapeutique est ainsi espérée comme stable dans le temps. Dans la mesure ou notre organisme héberge des phages, il n’y a pas de raison pour que la tolérance des solutions de phages à usage thérapeutique soit mauvaise, et l’expérience de plus de 80 ans d’utilisation en géorgie nous renforce dans cette conviction.
Limites de la phagothérapie
Dans la mesure où leur cible est la bactérie, il ne faut en espérer aucun bénéfice sur les infections fongiques, parasitaires et virales.
Leur application chez l’homme paraît limitée aux seules infections où le bactériophage peut être amené au contact de la bactérie.23 Tous ce qui nécessite l’injection de phages (septicémies, infections parenchymateuses) paraît voué à l’échec puisque les phages seront en principe détruits par le système immunitaire. De la même manière il ne faut en attendre aucun bénéfice sur les infections produites par des bactéries intracellulaires (tuberculose, légionellose par ex.).
Par ailleurs, les bactéries en phase de croissance lente (bactéries quiescentes), c’est-à-dire celles dont le métabolisme est ralenti, et qui sont protégées par un biofilm seraient théoriquement moins sensibles à l’action du bactériophage. néanmoins, les seules utilisations thérapeutiques occidentales rapportées décrivent un usage compassionnel sur des bactéries à l’origine d’infections chroniques donc en phase de croissance lente. les succès obtenus sont de nature à dissiper les craintes que l’on pourrait nourrir quant à l’efficacité des phages sur les bactéries en phase de croissance lente, responsable d’infections chroniques.
Plus préoccupant est l’absence de cadre réglementaire quant à l’usage de la phagothérapie.24 les bactériophages n’existent pas aux yeux du législateur : ce ne sont ni des médicaments, ni des organes, ni des tissus, ni des vaccins, ni des dispositifs médicaux. ils ne sont pas reconnus par les autorités de tutelle, et ne seront donc pas remboursés par les assurances de santé. On n’a théoriquement pas le droit de les utiliser….mais rien ne nous interdit de le faire. En revanche, en cas d’incident lié à l’emploi de la phagothérapie, aucune assurance professionnelle ne couvrira le thérapeute puisqu’il n’existe aucun cadre légal à la phagothérapie. la seule option possible dans ce contexte est de l’utiliser sous l’égide de la convention d’Helsinki qui précise qu’en présence d’une situation où toutes les thérapeutiques reconnues ont échoué, le thérapeute est en droit de recourir à l’option thérapeutique qu’il estimera efficace. pour se procurer des solutions de bactériophages à usage thérapeutique, il n’y a pas d’autre choix que de s’adresser soit aux organismes des pays de l’ex Europe de l’Est (institut Eliava – phage Therapy Center - Tbilissi - géorgie / institut d’immunologie et de Thérapie Expérimentale – Wroclaw – pologne…) soit à produire soit même ces solutions à partir de phages extraits des milieux naturels. En revanche, si la première solution paraît la plus simple, sa mise en oeuvre n’est pas facile car il est difficile de faire franchir les frontières à des virus – à fortiori des bactériophages qui n’ont aucune existence légale – sans tomber sous le coup des lois sur le bioterrorisme.
Les solutions à usage thérapeutique peuvent théoriquement constituer un vecteur potentiel de gènes. Ces solutions à usage thérapeutique ne doivent en effet contenir que des phages lytiques et jamais de phages tempérés. il est vraisemblablement prudent de n’utiliser, à des fins thérapeutiques, que des phages naturels et d’éviter de tenter d’utiliser des phages génétiquement modifiés (si tant est qu’il en existe).
Dans la mesure où les produits destinés à la phagothérapie ne contiennent que des phages naturels, ceuxci seront impossibles à protéger par un brevet, puisqu’inventés par la nature. pour une firme pharmaceutique ou une société commerciale, le retour sur investissement est sans doute difficilement garanti.
Facteurs-clé de succès
Pour se prémunir contre l’apparition de résistances23 (même si celles-ci ne semblent pas aussi problématiques qu’avec les antibiotiques) et garantir une efficacité thérapeutique optimale, il est recommandé que le produit contienne au moins 3 phages différents actifs sur la souche bactérienne à traiter. le titre de la solution doit également s’avérer suffisant, c’est-à-dire dépasser le seuil de 105 PFU/ml (pFU = phages formant unité).
Les préparations à usage thérapeutique doivent respecter un certain nombre de bonnes pratiques (bonnes pratiques de laboratoire, bonnes pratiques pharmaceutiques) et notamment ne contenir ni pyrogènes, ni cytokines, ni endotoxines… ni phages tempérés.
Les phages doivent être administrés au contact de la bactérie (application directe, pulvérisation, aérosols…). pour les produits destinés à traiter les infections bactériennes du tube digestif, il faut ainsi préserver le produit du contact avec le pH acide de l’estomac et donc soit modifier le pH gastrique, soit utiliser des vecteurs qui ne libèrent les phages qu’après le passage de la cavité gastrique.
Aspects pratiques
Préparation des phages
La préparation des bactériophages est un procédé techniquement simple, c’est-à-dire à la portée de pays à bas niveau de vie.25 les bactériophages sont issus d’eau « sale », qu’il faut centrifuger, décanter puis passer sur un filtre qui retient les bactéries. il convient de mettre le filtrat en présence d’un bouillon de culture de la bactérie pathogène que l’on souhaite traiter. il suffit de quelques heures d’incubation à 35°C sous agitation douce pour produire des phages thérapeutiques en quantité suffisante. A l’issue du processus, il suffit d’ajouter quelques gouttes de chloroforme pour détruire les bactéries résiduelles sans détruire les phages, puis centrifuger et filtrer de nouveau pour éliminer les débris bactériens. la solution obtenue contiendra ainsi un ou plusieurs phages actifs sur la bactérie - cible, et en quantité suffisante. On pourra en vérifier l’efficacité en déposant une goutte de la préparation sur une gélose contenant un « tapis » de la bactérie à traiter. la présence d’une plage claire à l’endroit du dépôt signe la lyse bactérienne. il est même possible d’aller plus loin dans la préparation et d’obtenir des solutions pures d’un clone à partir d’une plage de lyse.
Mode d’emploi des bactériophages
On peut imaginer, par analogie avec l’utilisation des antibiotiques, plusieurs règles d’emploi des bactériophages :
Dans le cas d’une situation plutôt urgente, où il est préférable de ne pas différer le traitement dans l’attente des résultats bactériologiques, on peut envisager le recours à des préparations du commerce. Dans ce cas il s’agirait d’une phagothérapie « probabiliste ».
L’autre cas est celui d’une phagothérapie « adaptée ». 2 situations peuvent alors être envisagées :
La bactérie est connue mais, pour diverses raisons, la fabrication d’une préparation extemporanée spécifique de la souche à traiter n’est pas possible. On fait alors appel à un produit du commerce le plus proche possible de la souche à traiter. la souche bactérienne peut être soit connue d’emblée soit secondairement, à la suite de prélèvements réalisés avant l’instauration d’une phagothérapie probabiliste. Dans ce dernier cas, l’adaptation thérapeutique constitue une « désescalade ».
La bactérie est connue et la production d’une préparation extemporanée spécifique de la souche à traiter est possible. Dans ce cas on peut parler de phagothérapie « sur mesure ».
Bacteriophages vs antibiotiques
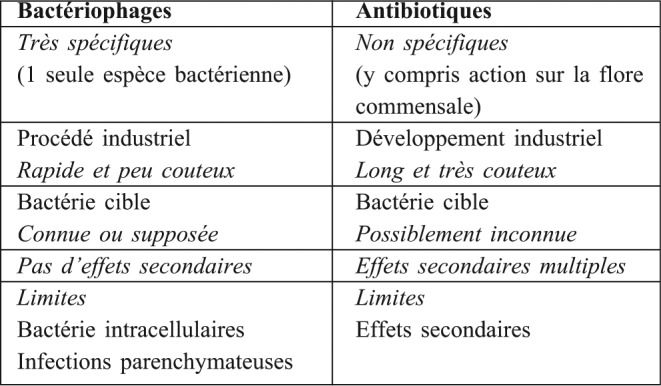
Les antibiotiques sont irremplaçables dans certaines situations (infections à germes intracellulaires / infections parenchymateuses). les phages semblent indispensables dans d’autres situations (infections à bactéries multirésistantes aux antibiotiques). De plus, il y aurait avantage à utiliser phages et antibiotiques concomitamment, car le bactériophage réduit l’inoculum bactérien ce qui permet à l’antibiotique d’agir plus efficacement et probablement avec une pression de sélection réduite (moindre probabilité d’apparition de résistances puisque l’inoculum bactérien est plus faible). De plus, l’utilisation des bactériophages va s’accompagner d’un moindre recours aux antibiotiques. Dans la mesure où c’est précisément l’utilisation des antibiotiques qui fait le lit des résistances bactériennes, l’utilisation de la phagothérapie doit permettre de réduire les résistances bactériennes aux antibiotiques. On le voit, il y a un bénéfice à utiliser antibiotiques et bactériophages non seulement pour leur effets synergiques mais aussi parce que tant les antibiotiques que les bactériophages sont irremplaçables dans certaines situations. Antibiotiques et bactériophages ne sont donc pas concurrents mais bien complémentaires et la phagothérapie doit être envisagée comme une arme supplémentaire dans l’arsenal de la lutte contre les infections bactériennes. (Tableau I)
Tableau I. Caractéristiques respectives de la phagothérapie et de l’antibiothérapie.
Usages non médicaux ou non thérapeutiques
Les bactériophages sont d’ores et déjà utilisés dans l’industrie alimentaire26 : la FDA a autorisé depuis plusieurs années la mise sur le marché d’une préparation commerciale (listex®) destinée à éradiquer l’espèce Listeria dans les fabrications issues de l’industrie laitière. il a aussi été imaginé un usage agro-alimentaire à plus grande échelle et notamment en aquaculture pour réduire l’usage intensif des antibiotiques.
Une préparation à usage vétérinaire est encore disponible à ce jour aux USA.
En géorgie, des solutions de bactériophages sont utilisées en pulvérisation cutanée dans le cadre de l’asepsie préopératoire.
On peut également voir dans le bactériophage un moyen intéressant de décontamination du tube digestif permettant ainsi de se débarrasser du portage intestinal de BMr, chose impossible jusqu’alors. Ceci ouvre des perspectives très intéressantes : réduction de la morbi-mortalité associée au portage de BMr, réduction de la charge en soins résultant de la mise en place de mesures d’hygiène renforcées (personnel dédié, isolement, habillement), réduction des coûts.
On peut aussi envisager l’utilisation du bactériophage à des fins diagnostiques. En effet, en testant différentes souches de bactériophages connus sur une bactérie inconnue, on peut identifier non seulement l’espèce bactérienne, mais aussi la souche et disposer d’un moyen thérapeutique efficace (le bactériophage). Dans la mesure où le bactériophage est très rapidement bactéricide, on peut imaginer qu’une telle méthode permettrait d’identifier la bactérie beaucoup plus rapidement qu’avec les méthodes conventionnelles.
Ce ne sont ici que quelques possibilités imaginées au vu des connaissances actuelles sur le bactériophage. nul doute que l’arrivée de la phagothérapie et la progression des connaissances vont ouvrir de nouvelles possibilités thérapeutiques.
Protocole PHAGOBURN
Pour espérer utiliser les bactériophages à des fins thérapeutiques, ils convient d’en définir les règles d’utilisation dans le cadre des « bonnes pratiques » (bonnes pratiques de laboratoire, bonnes pratiques pharmaceutiques, bonnes pratiques médicales), de construire l’arsenal règlementaire permettant l’usage de la phagothérapie et enfin de disposer d’une étude humaine respectant les bonnes pratiques scientifiques. C’est l’objectif du protocole multicentrique européen PHAGOBURN (http://www.phagoburn.eu) qui vise à évaluer la phagothérapie pour traiter les infections cutanées bactériennes (E. coli et P. æruginosa) chez les patients brûlés.
Les étapes à franchir sont nombreuses et difficiles dans un domaine d’expérimentation aussi novateur :
Sélectionner les phages anti Escherichia coli et anti Pseudomonas æruginosa et en tirer des cocktails à usage thérapeutique.
Tester la stabilité des cocktails dans différentes conditions physico chimiques mais également en présence des antiseptiques et topiques utilisés pour traiter les brûlures
Définir une technique d’emploi des bactériophages pour traiter les brûlures infectées : la méthodologie retenue repose sur l’imprégnation de pansements hydrocolloïdes du commerce par les cocktails de phages suivie de l’application de l’hydrocolloïde vecteur de phages sur la brulure à traiter.
Évaluer le comportement des cocktails vis à vis de tous les pansements hydrocolloïdes commercialisés en Europe.
Tester la méthodologie retenue sur un modèle animal dans les conditions les plus proches possibles de l’utilisation clinique.
Construire un dossier conforme aux règles, souvent complexes, de l’administration européenne dans le but d’obtenir un soutien (notamment financier) de l’Europe ce qui est chose faite depuis janvier 2013.
Définir (en accord avec les agences Européennes) un cadre règlementaire provisoire permettant de lancer l’expérimentation chez l’homme. PHAGOBURN est ainsi une étude de phase i-ii s’inscrivant dans le cadre du « médicament ». l’Europe pense définir à terme, sur les bases de cette expérimentation clinique, un nouveau cadre réglementaire appelé pour l’instant « médicament biologique ».
Mettre en place une bioproduction « industrielle » des cocktails phagiques respectant les règles en vigueur dans le domaine du médicament, même si ces règles ne conviennent pas nécessairement à ce type de produit à usage thérapeutique. A ce titre il nous est demandé d’évaluer la stabilité des 2 cocktails sélectionnés et contenant pour l’un 15 et pour l’autre 13 phages différents, spécifiques de la bactérie à traiter (respectivement E. coli et P. æruginosa). Comment y parvenir sachant que 2 phages peuvent différer l’un de l’autre par 2 paires de bases nucléiques seulement ? Que signifie une régression de 3 ou 4 log après quelques mois pour un phage d’un cocktail sachant qu’in vivo le moindre phage va être soumis à un phénomène d’amplification considérable donnant lieu en quelques minutes à la production de plusieurs milliers de phages ? Cette réduction de plusieurs log ne peut traduire une baisse d’efficacité du cocktail en raison précisément du phénomène d’amplification produite par le cycle lytique.
Finaliser le protocole clinique en tenant compte des règles en vigueur dans des pays différents tout en satisfaisant aux contraintes de l’analyse statistique des résultats attendus.
Mettre en place la logistique complexe d’une étude clinique sensée être menée à bien dans 7 centres de traitement de brulés de 3 pays européens différents.
PHAGOBURN est conduit dans 3 centres de brulés français sous l’égide du Service de Santé des Armées (HiA percy à Clamart, CH St Joseph St luc à lyon et CHU de nantes), dans 3 centres belges sous l’autorité de l’École royale Militaire Belge de Médecine (Hôpital reine Astrid à Bruxelles, centre des Brulés de loverval et CHU de liège) et dans un centre suisse sous l’autorité de l’Université de lausanne (CHU Vaudois, lausanne). la partie expérimentale est à la charge de pherecydes pharma® et la bioproduction assurée par Clean Cells®. Statitec® est chargée du recueil des données et de leur traitement. la partie administrative est confiée à une société spécialisée : France Europe innovation®. les grandes lignes de ce protocole ont été mises en place après une année de travail, permettant le lancement officiel de l’étude en juin 2013. les premières inclusions de patients sont attendues pour le second trimestre 2015, sauf imprévu.
References
- 1.D’Hérelle F. Sur un microbe invisible antagoniste des bacilles dysentériques. Compte rendu de l’Académie des Sciences. 1917;165:373–5. [Google Scholar]
- 2.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Découverte des virus et bactériophages; pp. 55–8. [Google Scholar]
- 3.D’Hérelle F. Sur le microbe bactériophage. Comptes rendus de la Société de Biologie. 1919;82:1237. [Google Scholar]
- D’Hérelle F. Sur le rôle du microbe filtrant bactériophage dans la dysenterie bacillaire. Compte rendu de l’Académie des Sciences. 1918;167:970–2. [Google Scholar]
- 5.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Premiers traitements; pp. 108–9. [Google Scholar]
- 6.D’Hérelle F. Essai de traitement de la peste bubonique par le bactériophage. La presse Médicale. 1925;33:1393. [Google Scholar]
- 7.Morison J. Bacteriophage in cholera. Transactions of the royal Society of Tropical Medicine. 1935;28:563. [Google Scholar]
- 8.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Extension mondiale; pp. 110–5. [Google Scholar]
- 9.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Dix années de polémique; pp. 115–21. [Google Scholar]
- 10.Dublanchet A, Fruciano E. Brève histoire de la phagothérapie. Med Mal infect. 2008;38:415–20. doi: 10.1016/j.medmal.2008.06.016. [DOI] [PubMed] [Google Scholar]
- 11.Pirnay JP, Verbeken G, Rose T, Jennes S, Zizi M, Huys I, et al. Introducing yesterday’s phage therapy in todays medicine. Future Virol. 2012;7:379–90. [Google Scholar]
- 12.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Reproduction et propagation; pp. 69–73. [Google Scholar]
- 13.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Morphologie et classification; pp. 60–4. [Google Scholar]
- 14.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Cycle phagique; pp. 73–7. [Google Scholar]
- 15.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Habitat naturel des bactériophages; pp. 77–82. [Google Scholar]
- 16.Weinbauer Mg. Ecology of prokaryotic viruses. FEMS Microbiology reviews. 2004;28:127–81. doi: 10.1016/j.femsre.2003.08.001. [DOI] [PubMed] [Google Scholar]
- 17.Souza V, Espinoza-Asuar L, Escalante A, Eguiarte L, Farmer J, Forney L, et al. An endangered oasis of aquatic microbial biodiversity in the Chihuahuan desert. Proceedings of the National Academy of Sciences. 2006;103:6565–70. doi: 10.1073/pnas.0601434103. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Arloing F, Chavanne F. Propriétés empêchantes des eaux de l’isère à l’égard de diverses cultures microbiennes. Comptes rendus de la Société de biologie. 1925;92:257. [Google Scholar]
- 19.Faruque S, Naser I, Islam M, Faruque A, Gosh A, Nair G, et al. Seasonal epidemics of cholera inversely correlate with the prevalence of environmental cholera phages. Proceedings of the National Academy of Sciences. 2005;102:1702–7. doi: 10.1073/pnas.0408992102. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Faruque S, Islam M, Ahmad Q, Faruque A, Sack D, Nair G, et al. Self-limiting nature of seasonal cholera epidemics: role of host-mediated amplification of phage. Proceedings of the National Academy of Sciences. 2005;102:6119–24. doi: 10.1073/pnas.0502069102. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Survie des bactériophages dans la nature; pp. 84–5. [Google Scholar]
- 22.D’Hérelle F, editor. Le bactériophage et son comportement. Masson; 1926. [Google Scholar]
- 23.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Apparition des antibiotiques; pp. 125–32. [Google Scholar]
- 24.Verbeken G, De Vos D, Vaneechoutte M, Merabashvili M, Zizi M, Pirnay JP. European regulatory conundrum of phage therapy. Future Microbiology. 2007;2:485–91. doi: 10.2217/17460913.2.5.485. [DOI] [PubMed] [Google Scholar]
- 25.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Préparer des suspensions à usage thérapeutique; pp. 86–94. [Google Scholar]
- 26.Dublanchet A, editor. Des virus pour combattre les infections. Favre Ed; 2009. Phagothérapie classique avec des phages naturels; pp. 144–50. [Google Scholar]


