Summary
Each year, the SFB congress features a different topic, which in 2015 was nutrition. Eight speakers reviewed ongoing scientific knowledge, current practices in their centres and the latest recommendations, issued in 2013. The aim of this paper is to divulge these presentations
Keywords: burns, nutrition, rationale, practices, recommendations
Abstract
Chaque année, le congrès de la SFB est l’occasion d’une mise au point sur un thème (« table ronde ».) Celui choisi en 2015 était la nutrition. Huit orateurs se sont succédés, faisant le point sur les données actuelles de la science, les pratiques dans les centres, et les recommandations actuelles, datant de 2013. Cet article se propose de diffuser les interventions
Les auteurs, après avoir assisté aux interventions, on repris la capture audio-visuelle des communications pour commettre ce travail. L’un a choisi l’exhaustivité et la précision, l’autre le résumé. Le lecteur connaissant les énergumènes sauront qui a choisi quelle forme…
La séance a été ouverte par Mette Berger (MB- Lausanne), exposant les particularités du patient brûlé.
Le patient brûlé présente un certain nombre de particularités qui influent sur sa dépense énergétique et ses besoins nutritionnels:
Perte de la barrière cutanée qui expose aux déperditions thermiques, liquidiennes et accroît le risque d’infections
Réanimation liquidienne précoce et abondante, exposant parfois au risque d’apports excessifs qui peuvent entraîner des complications (« fluid creep »). Par ailleurs l’oedème associé à la brûlure perturbe l’évaluation correcte du poids du patient, expliquant ainsi que ce n’est que vers le 15e-20e jour que le brûlé retrouve son poids de base.
Les besoins énergétiques et protéiques sont accrus en raison de l’hypermétabolisme (catabolisme) résultant de la réaction endocrinienne associée à la brûlure.
Le tube digestif est agressé et pourtant il est important de le maintenir fonctionnel.
Il existe un déficit bien documenté en micronutriments, avec notamment des travaux récents qui concernent la vitamine D.
Les patients sont souvent en situation prolongée de dépendance à la ventilation artificielle.
Les séjours pour brûlures sont volontiers de longue durée (1 journée d’hospitalisation par % de brûlure).
Le déficit nutritionnel peut s’avérer considérable. C’est ainsi que, dans les années 1970, il était courant d’observer une perte de poids dépassant 20% du poids initial après 8 semaines, pour des brûlures de plus de 40% de la surface corporelle.1 Ceci a donc conduit à proposer une réanimation « hyper » (calorique – protidique), dont on a depuis mesuré les effets délétères, amenant des propositions plus raisonnables. Les objectifs sont : la couverture des besoins de base, notamment énergétiques (bien que ceux-ci soient variables au cours du séjour) et la prévention de la malnutrition (apports qualitatifs) ; le maintien l’activité du tube digestif (nutrition entérale à privilégier), la prévention des déficits précoces en micronutriments et agents antioxydants ; le maintien de la masse maigre, d’autant plus que les patients sont des sujets jeunes ; la stimulation (maintien de l’immunité, solliciter le tube digestif -nutrition entérale/éviter le parentéral-, apport de micronutriments spécifiques. La nutrition entérale doit être privilégiée car de nombreux travaux font état de son efficacité et des bénéfices qu’elle apporte : elle préserve la sécrétion de gastrine et la motilité intestinale, elle prévient les atteintes intestinales de type ischémie-reperfusion, elle augmente la perméabilité intestinale, elle diminue la sécrétion d’endotoxines et de médiateurs de l’inflammation, elle maintient fonctionnelle la barrière muqueuse…et réduit la mortalité.2,3 En revanche elle doit être réalisée le plus tôt possible puisque, plus on en retarde le début, plus l’on voit apparaître d’intolérance gastrique, qui en rend l’application difficile sinon impossible.4 L’explication tient dans l’oedème du tube digestif, oedème associé à la brûlure (potentiellement aggravé par le remplissage) qui, une fois constitué inhibe, la motilité gastrique. La nutrition entérale précoce est rarement impossible, la gastrostomie (y compris en zone brûlée) restant une bonne solution, facile à mettre en place.
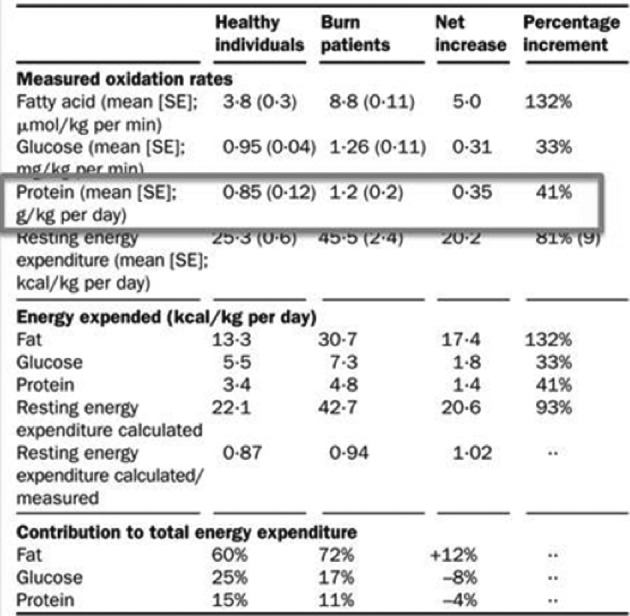
combien d’énergie et de protéines? La dépense énergétique est considérable. Le métabolisme de repos est très augmenté et, en miroir, l’excrétion d’azote est augmentée dans les mêmes proportions. Ceci traduit un hypercatabolisme, qui légitime l’usage des β bloquants.5,6 Or, la cicatrisation cutanée requiert l’apport de nutriments (acides aminés -dont glutamine, arginine, cystéine-, glucides, acides gras libres), d’oxygène et de micronutriments. Il est impossible de répondre à la question « combien ? », faute de recommandations. Un groupe d’experts de la brûlure s’est donc constitué pour élaborer un consensus, à l’issue d’un très important et rigoureux travail méthodologique, sous l’égide plusieurs sociétés savantes. Celui-ci a récemment été publié.7 Il apporte les éléments suivants : Les formules fixes, type Curreri, sont à proscrire, car elles n’adaptent pas les apports à la demande, variable comme le montre la mesure de calorimétrie indirecte (Fig. 1). Les apports doivent donc s’appuyer sur les mesures de calorimétrie indirecte et à défaut sur la seule formule valide (Toronto) en débutant sur la base de 30 kcal/kg le 1er jour : TEE = -4343 + (10.5 x %TBSA) + (0.23 x CI) + (0.84 x HBEE) + (114 x Temp. (°C)) - (4.5 x PBD) avec TEE = besoins caloriques ; TBSA = surface brûlée ; CI= apport calorique de la veille ; HBEE = métabolisme basal selon Harris et Benedict ; PBD = nombre de jours post brûlure. 8 Pour les substrats, les recommandations sont les suivantes : glucides = 55 à 60% de l’apport énergétique total (AET), lipides = 10 à 15% de l’AET (0,5g/kg), protéines = 1,5 à 2 g/kg/j dont 30g de glutamine (ou son équivalent alpha cétoglutarate d’ornithine), vitamines 2 à 5 fois les besoins habituels, éléments trace = Cu 3mg, Se 300 à 500 μg, Zn 30mg. Il faut faire attention à la « surnutrition » (overfeeding) car une étude pédiatrique nécropsique a retrouvé chez 80% des 37 enfants examinés une infiltration hépatique par des acides gras dont on connaît le lien avec l’incidence de syndrome septique (d’ailleurs tous ces enfants étaient décédés d’infection).9 Aucun parenchyme hépatique n’est « normal » après J6. Les foies de tous les enfants de cette étude objectivent une vacuolisation (macro ou microscopique) avec infiltrats associés. Le mécanisme en a été expliqué par une étude américaine (Fig. 2) qui met en évidence le rôle central des hormones de « stress » qui provoquent une accélération de la production de glucose pour répondre aux besoins de la cicatrisation. 10 Augmenter les apports glucidiques aboutit cependant à augmenter la production de triglycérides et d’acides gras, stockés au niveau du foie. Cet effet délétère est aggravé par toute atteinte hépatique septique. L’apport protidique s’inscrit dans une stratégie de limitation de l’érosion de la masse maigre. Cette stratégie vise à promouvoir l’anabolisme selon les bases suivantes : Moduler l’inflammation (SIRS), prévenir et traiter l’infection, éviter l’acidose, complémenter en éléments trace, apporter des hydrates de carbone et des protéines, maintenir la glycémie entre 5 et 8 mmol/l par l’insuline, supplémenter en acides aminés spécifiques, utiliser les hormones anabolisantes. La masse musculaire contribue à alimenter un pool plasmatique d’acides aminés que la nutrition seule ne suffit pas à enrichir (Fig. 3).11 Ces acides aminés sont destinés au fonctionnement hépatique mais aussi aux besoins de la cicatrisation (brûlures + zones donneuses). Les besoins et le turn-over en acides aminés sont importants car, non seulement tous les cycles métaboliques sont activés, mais aussi il y a des pertes qu’il faut compenser. Ce turnover protéique est très important chez le brûlé, avec un catabolisme (notamment de la masse musculaire) qui excède l’anabolisme pendant une très longue période. Les flux d’acides aminés sont augmentés (arginine, ornithine, leucine, proline, glutamine notamment), la conversion d’arginine en ornithine est augmentée, l’oxydation de l’arginine et de l’ornithine est augmentée.12 C’est ainsi qu’arginine et glutamine deviennent des acides aminés essentiels chez le brûlé (besoins en glutamine estimés à 0,3-0,5 g/kg) alors qu’ils ne le sont pas chez le sujet sain. Pour l’instant seules les solutions contenant de la glutamine ont montré leur efficacité chez l’homme. Il est fondamental de monitorer la nutrition, notamment pour évaluer les besoins caloriques, dont on sait qu’ils sont importants chez le brûlé, mais aussi variables au cours du séjour. En effet, le seuil de dénutrition est différent chez le patient brûlé. Une étude lithuanienne a montré que, sur 100 patients, ceux dont les besoins nutritionnels étaient les plus importants (>40 kCal/kg/J) présentaient la moitié des pneumopathies et des infections.13 Ce monitorage doit aussi impérativement évaluer ce que le patient reçoit effectivement, c’està-dire si l’apport calorique prévu a bien été délivré mais aussi absorbé. Il est donc indispensable d’évaluer ce que fait le patient de ce qu’on lui apporte. Les moyens à déployer pour manipuler la réponse métabolique sont le maintien d’une température ambiante à 28-30°c, l’excision-greffe précoce, la prévention de l’infection et certains agents pharmacologiques (β bloquants, insuline, oxandrolone, hormone de croissance). Les β bloquants non sélectifs (type propranolol) ont montré leur efficacité sur la réponse métabolique. Une étude américaine conduite par l’équipe de Galveston, portant sur un collectif de 25 enfants brûlés sur plus de 50% de la surface corporelle, a montré que, lorsque le propranolol est prescrit durant 15 jours dans le but d’obtenir une fréquence cardiaque 20% plus basse que dans le groupe témoin, on observe que : la dépense énergétique est significativement plus faible dans le groupe traité (cette baisse persistant jusqu’à 2 ans après la brûlure ; le catabolisme est significativement réduit ( études isotopiques) ; la sécrétion de catécholamines est abaissée, l’anabolisme est augmenté, la prise de poids est augmentée (la masse maigre augmente, la masse grasse augmente).14 Les anabolisants tels que l’oxandrolone (analogue non virilisant de la testostérone) ont été évalués dans le cadre d’une étude portant sur 150 enfants gravement brûlés (>30%SC).15 Elle normalise quasiment la minéralisation osseuse et augmente la masse maigre. Le contrôle glycémique a été évalué car on sait que l’hyperglycémie obère la cicatrisation des greffes.16 Contrôler la glycémie en se fixant comme cible 5-8 mmol/l (contrôle glycémique modéré) permet la réduction significative des hypoglycémies (contrairement à ce que l’on pouvait craindre) tout en évitant les hyperglycémies. Au total, les sociétés savantes recommandent une nutrition entérale précoce adaptée aux besoins (calorimétrie indirecte ou formule de Toronto) comprenant un apport suffisant en éléments trace et agents antioxydants, de moduler la réponse métabolique (bétabloquants et oxandrolone), d’exciser et greffer précocement et d’évaluer la réponse au traitement nutritionnel.
Fig. 1. ABLS courses.
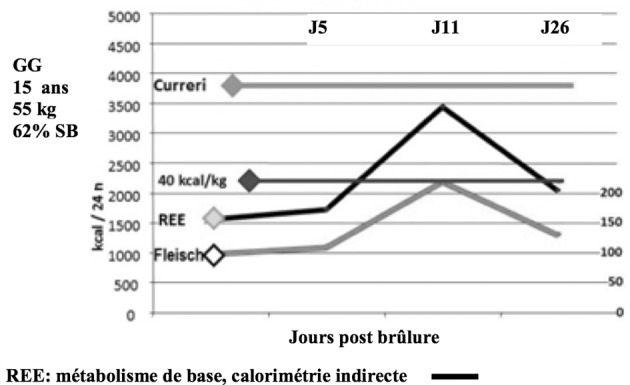
Fig. 2. Mécanisme de la dysfonction hépatique, d’après 10.
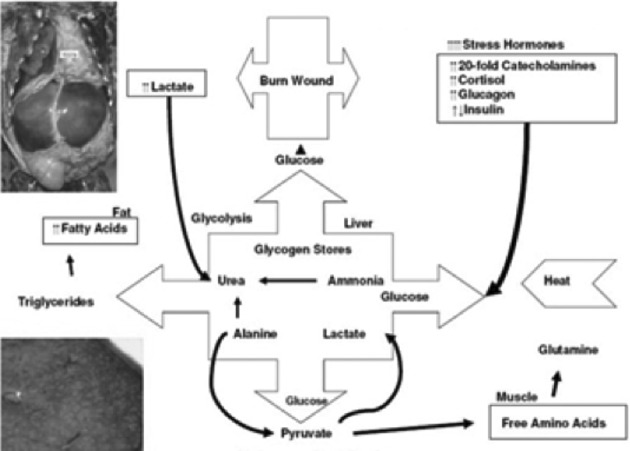
Fig. 3. Principes de la nutrition du brûlé, d’après 11.

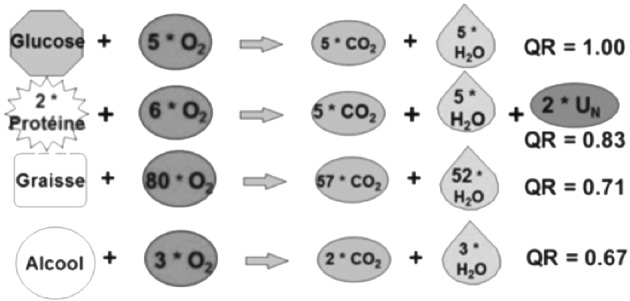
Marie Reine Losser (MRL- Metz) a ensuite répondu à la question : « comment évaluer les besoin caloriques ? ». La dénutrition et la surnutrition ayant un impact majeur sur le devenir des patients brûlés, il est important de mesurer (plutôt qu’estimer) les besoins caloriques. C’est le rôle de la calorimétrie indirecte et donc des calorimètres. La calorimétrie indirecte donne accès au métabolisme de repos, qu’il est important de connaître car il conditionne le maintien des gradients électrochimiques, des biosynthèses et des homéostasies. Elle évalue l’énergie utilisée pour satisfaire à l’équilibre nutritionnel normal (énergie produite à l’échelon cellulaire par l’hydrolyse de l’ATP générée par l’oxydation des nutriments). Le métabolisme de repos est la somme de plusieurs composantes : le métabolisme basal, l’effet thermique des nutriments, la thermorégulation, l’activité musculaire. Les besoins énergétiques sont éminemment variables au cours du séjour mais aussi au cours la même journée, au gré des soins et actes pratiqués. C’est ainsi que la kinésithérapie - par exemple - augmente la V̀O2 d’un facteur 4 par rapport à une situation de repos.17 Par ailleurs, pour un même patient, dans des conditions métaboliques identiques, les formules disponibles conduisent à des estimations très différentes, allant du simple au double.18 Il faut donc mesurer et pour cela, le marché propose actuellement deux appareils : un appareil autonome le Quark RMR® et un module GE-DATEX®, adaptable à un respirateur ou moniteur de la même marque. La calorimétrie indirecte mesure les flux totaux de consommation d’oxygène et de production de gaz carbonique et, dans la mesure où l’oxydation des différents nutriments conduit à la consommation d’O2 et à la production de CO2, les flux totaux de ces 2 gaz pourront permettre d’évaluer les processus d’utilisation des nutriments (Fig. 4). Cependant production de CO2 et consommation d’O2 varient selon les nutriments utilisés, définissant ainsi le quotient respiratoire QR = V̀CO2/V̀O2 (Fig.5). Le principe de la calorimétrie indirecte est d’utiliser les valeurs de V̀CO2 et de V̀O2 pour calculer la dépense énergétique à l’aide d’équations (que vont utiliser les industriels) : Équation de Elia et Livesey DE totale (kcal) = 3,8*V̀O2(L) + 1,24*V̀CO2 (L) – 1,1 x Nu (excrétion urinaire d’azote en g) et équation de Weir DE totale (kcal) = 3,9*V̀O2(L) + 1,1 xV̀CO2 (L). Cette méthode doit, pour être fiable, obéir à des conditions de mesure précises et respecter quelques limites : Neutralité thermique et stabilité hémodynamique, FiO2 < 60% (ou 80% selon l’appareil) avec FR<35/mn (pour des raisons techniques), ventilation stable sans fuite de gaz, absence d’humidificateur chauffant ou de nébuliseur ou de dispositif administrant du NO (le NO peut endommager les cellules de mesure), au moins 30 mn de stabilité. En outre, cette technologie rend captif d’une marque et représente un coût, d’acquisition du matériel et de consommables. Le recours à la calorimétrie indirecte ne doit pas se substituer à l’évaluation globale de l’état nutritionnel ni à l’évolution de celui-ci dans le temps. Il faut aussi savoir faire des mesures dans des conditions différentes de celle de la stabilité (état septique…) pour avoir une idée des besoins dans ces situations.
Fig. 4. Voies métaboliques et calorimétrie indirecte, d’après 17.

Fig. 5. Quotients respiratoires selon les substrats.
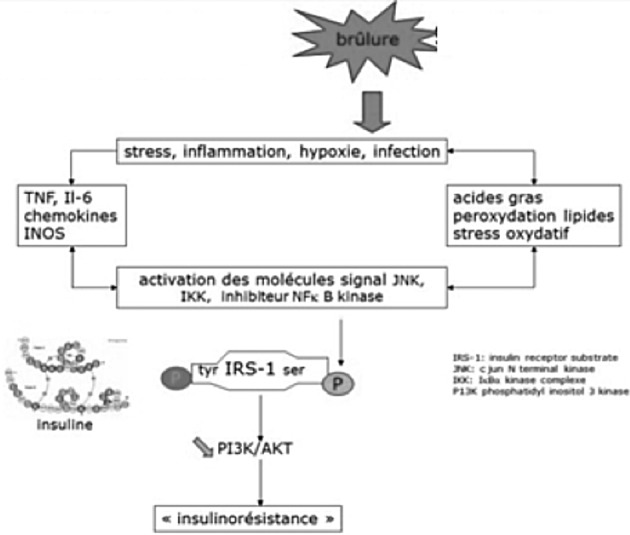
Gérard Perro (Bordeaux) a ensuite abordé la gestion des besoins et apports glucidiques. La réaction inflammatoire associée à la brûlure met en jeu un certain nombre de mécanismes qui concourent à l’hyperglycémie (Fig. 6).19 Parallèlement à ces mécanismes hyperglycémiants, survient une insulinorésistance, multifactorielle (« stress », hypoxie), principalement sous- tendue par les molécules de l’inflammation (syndrome inflammatoire associé à la brûlure, sepsis). L’insuline, pour être fonctionnelle doit phosphoryler un récepteur (Fig. 7) …que les médiateurs mis en jeu bloquent, la rendant non fonctionnelle. Cette hyperglycémie associée à une insulinorésistance peut entraîner une « simple » polyurie osmotique chez le sujet sain mais, chez le diabétique, être à l’origine de déséquilibres importants. En fait, cette orientation métabolique est plutôt logique puisqu’elle vise à approvisionner en glucose des tissus insulino-indépendants (système immunitaire, tissu cicatriciel, érythrocytes). Autrefois il était ainsi d’usage de respecter cette hyperglycémie, d’où le terme d’hyperglycémie dite « de sécurité » avec des valeurs fixées à 1,5 à 2 g/l, par crainte des événements hypoglycémiques, considérés comme dangereux. A la suite de l’étude de Greet Van den Berghe, le contrôle glycémique strict a montré son intérêt et a conduit à modifier l’attitude quant à l’hyperglycémie dont les effets délétères ont été démontrés.20 L’hyperglycémie est néfaste chez le brûlé car les tissus insulino indépendants sont confrontés à un volume important de substrats, saturant les tissus. Les mécanismes de protection contre l’hyperglycémie sont dépassés, la production d’ATP et de chaleur sont dérégulées, la glycolyse intracellulaire et le fonctionnement mitochondrial s’emballent conduisant a la production massive d’ions superoxyde et de peroxynitrites entraînant la mort cellulaire. Cet effet est particulièrement délétère puisque ces phénomènes intéressent surtout les cellules immunitaires et le tissu cicatriciel. La même étude a conduit à s’intéresser à l’insuline dont un certain nombre d’effets propres ont alors été découverts aidant à comprendre les effets bénéfiques des apports importants d’insuline: effet anti-inflammatoire avec une action anti cytokinique et une réduction de la production de radicaux libres ; effet protecteur endothélial en réduisant le stress oxydatif local, en limitant l’activation des plaquettes et des facteurs pro-coagulants ; effet immunitaire en favorisant la phagocytose, exerçant ainsi une activité bactéricide indirecte. Cependant, bien que les conclusions de cette étude n’aient pu être confirmées par d’autres, il semble bien que les variations brutales de la glycémie sont associées à une morbi-mortalité accrue en réanimation.21 Chez le brûlé peu d’études ont été conduites mais, en dépit de leur manque de puissance, elles apportent un certain nombre d’éléments intéressants : L’hyperglycémie chronique aggrave le pronostic, les hypoglycémies sont un facteur indépendant de risque et sont plus fréquemment observées dans les protocoles où un contrôle strict de la glycémie est recherché ; les variations brutales de la glycémie sont nocives.22 Le seuil de tolérance au glucose du sujet sain est estimé à 5 mg/kg/mn ce qui correspond à 400 à 500 g de glucose par jour. L’utilisation de la formule de Toronto permet d’assurer des apports suffisants, inférieurs au seuil de tolérance. Elle permet de respecter les bonnes pratiques qui sont les suivantes : Apports azotés ≤ 0,3 g N par kg et par jour, rapport calorico-azoté idéal à 125 cal/g N, lipides <30% de la ration calorique sans dépasser 85 g par jour, glucides <5/mg/kg/mn (soit 400 g/jour pour 75kg) avec un apport d’insuline calibré pour obtenir une glycémie < 9 mmol/l (1-1,5g/l). Il faut se méfier des erreurs de mesures des glucomètres, qui peuvent entraîner de fausses hyperglycémies, notamment en cas d’apports massifs de vitamine C et/ou de chute de l’hématocrite …en attendant l’arrivée de dispositifs automatiques à boucle de régulation, qui permettront un contrôle continu de la glycémie.23,24
Fig. 6. Déterminants de l’hyperglycémie chez le brûlé, d’après 19.
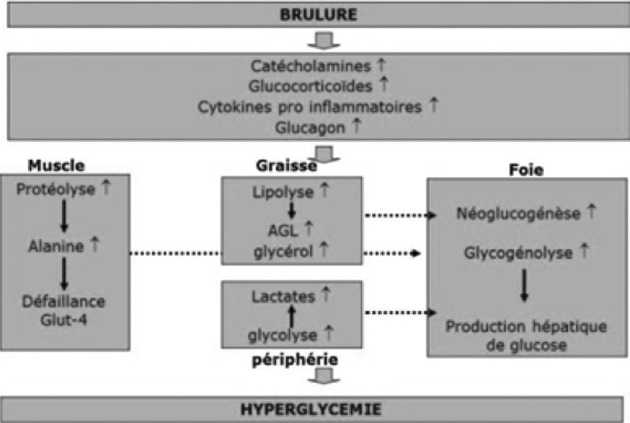
Fig. 7. Dysrégulation de la glycémie et insulinorésistance, d’après 19.
Les besoins et apports protidiques ont ensuite été abordés pas Sandrine Wiramus (SW, Marseille). On sait depuis longtemps que le déficit protidique du patient brûlé est en relation directe avec le catabolisme. Celui-ci explique la perte de poids mais aussi le pronostic puisqu’on sait qu’avec 10% de perte de poids il existe déjà une dysimmunité et qu’au delà de 40% le pronostic vital est engagé. 25 Le patient brûlé est caractérisé par un « turn over » protéique très important dont le résultat est l’équilibre entre synthèse et lyse (Fig. 8). Ceci a pour but de satisfaire aux besoins en protéines (architecture et fonctionnement celénergétique). Le catabolisme protidique du brûlé vise ainsi à mobiliser des acides aminés pour en enrichir le pool disponible pour de nouvelles synthèses. L’apport nutritionnel doit ainsi être conforme aux besoins, c’est-à-dire apporter d’une part les acides aminés nécessaires et d’autre part les apporter en quantité suffisante faute de quoi l’organisme va puiser dans ses propres ressources c’est-à-dire dans sa masse maigre (protéines musculaires). Cet hypercatabolisme protidique a largement été documenté par de nombreuses études dont celle de l’équipe de Galveston chez l’enfant (Fig. 9).26 Outre son importance, ce qui caractérise cet hypercatabolisme est sa durée, qui, selon certains, peut se prolonger jusqu’à 1 an après la brûlure.27 Outre les pertes par catabolisme, il existe aussi des pertes par exsudation au travers des zones brûlés, loin d’être négligeables puisqu’elles peuvent représenter jusqu’à 25% des pertes azotées. L’hypercatbolisme est sous tendu par une baisse de la production d’hormones anabolisantes (hormone de croissance notamment) et une augmentation simultanée de la production de médiateurs protéolytiques (glucagon, glucocorticoïdes, catécholamines, TNF alpha, IL6…).28 Chez le patient brulé, les synthèses protéiques sont également augmentées, doublées par rapport à la normale. Cet anabolisme s’accompagne d’une néoglucogénèse, qui est conduite en partie aux dépends des acides aminés. 29 En matière de nutrition, il est important de tenir compte des calories protéiques, c’est pourquoi on s’intéresse à la mesure du rapport calorico-azoté. Les études objectivent ainsi que la bonne valeur du rapport calorico azoté est d’au moins 150/1 lorsque la surface brulée est supérieure à 10% contre 100/1 lorsqu’elle est en deça de 10%.30 Il ne faut pas ici méconnaitre les apports caloriques occultes (solvants glucosés, propofol…). Les besoins protéiques quotidiens ont été évalués chez le brûlé à 1,5-2 g/kg/jour chez l’adulte et 1,5-3 g/kg pour l’enfant.31,32 Si certaines études estiment bénéfique de conduire une nutrition hyperprotidique, l’excès d’apport en acides aminés n’est pas sans risque, notamment par le biais d’une hyperammoniémie induite. 33 Sur le plan qualitatif, il ne semble pas y avoir de différence significative entre hydrolysat de protéines et acides aminés libres.34 Cependant, l’apport nutritionnel semblerait devoir être enrichi en glutamine et arginine, deux acides aminés non essentiels qui le deviennent chez les brûlés, en raison d’une augmentation importante des besoins en ces deux composants.35 La glutamine est un élément indispensable au bon fonctionnement des entérocytes intestinaux et les apports en glutamine seraient associés à une réduction des évenements infectieux, notamment chez le brûlé.36,37 Malheureusement, la glutamine est absente de la plupart des solutés de nutrition parentérale. Certains auteurs ont ainsi proposé de remplacer utilement la glutamine par son précurseur, l’alphacétoglutarate d’ornithine.38 Néanmoins, d’autres études ont rapporté des effets imprévisibles de la supplémentation en glutamine chez le patient septique ou porteur de défaillance multiviscérale.39 Des études complémentaires sont donc nécessaires. La glutamine, si on l’utilise, doit être prescrite à la dose de 0,25mg/kg/jour, en complément d’une alimentation hyperprotéinée. 40 L’arginine est un élément essentiel au maintien de l’immunité et la supplémentation serait utile à la réduction de la réaction inflammatoire du patient brûlé.41 D’autres études contredisent ces résultats, si bien qu’il ne peut être recommandé de supplémenter en arginine le patient brûlé. En revanche, on doit rappeler les bénéfices apportés par la réduction du catabolisme protidique via l’utilisation de β bloquants (propranolol) chez le brûlé.14 Au total, l’alimentation entérale (ou orale) est plus favorable au bilan protidique que l’alimentation parentérale, surtout si cette alimentation entérale est débutée précocement. La nutrition entérale idéale serait hyperprotidique avec un rapport calorico-azoté supérieur ou égal à 100/1 (idéal ≈125/1) avec peu de lipides et une supplémentaion en glutamine, sur la base de 0,25mg/kg/j. Malheureusement, cette nutrition entérale idéale n’existe pas, et les solutions du commerce proposent des rapports calorico-azotés fixes qui ne conviennent pas forcément à la situation à laquelle est confrontée le thérapeute. De plus, il faut se méfier des nutritions mixtes (entérale + parentérale), car celles ci conduisent souvent à des excès d’apports caloriques pouvant accroître la morbi-mortalité. Il faut le plus possible évaluer les besoins caloriques (notamment chez l’enfant) et délivrer 20-25% de l’apport calorique sous forme de protéines,sur la base de 1,5-2 g/kg/j pour l’adulte et 1,5-3 g/kg/j pour l’enfant. Il est recommandé de supplémenter en glutamine mais pas en arginine.7
Fig. 8. Métabolisme protidique.
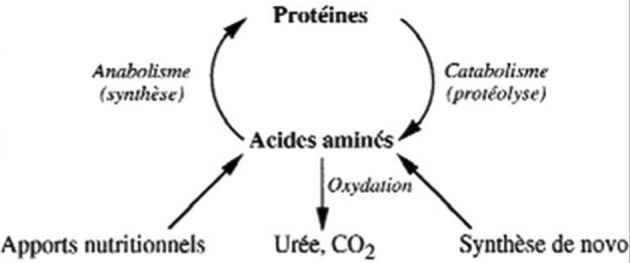
Fig. 9. Contribution des principaux substrats à l’augmentation du métabolisme chez les brûlés, d’après 26.
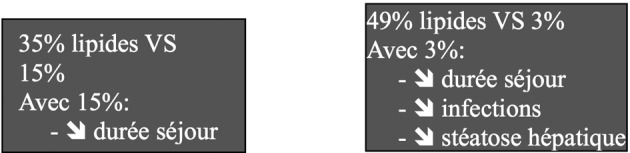
La dernière conférence de cette première demi-session était le fait de Anne-Françoise Rousseau (AFR, Liège), et avait pour trait les besoins et les apports lipidiques. Le terme « lipides » englobe plusieurs types de molécules (acides gras, glycérides, phospholipides, glycolipides etc.). Cette famille de molécules joue un rôle très important : substrat métabolique, stockage de l’énergie, constitution des membranes cellulaires, messagers intercellulaires. Les lipides alimentaires sont principalement des triglycérides, molécules constitués de 3 acides gras et de glycérol, les acides gras représentant la forme moléculaire utile. Parmi les acides gras on distingue les acides gras saturés, dépourvus de double liaison carbone-carbone (tel l’acide palmitique) et les acides gras insaturés (Fig. 10), qui comportent une ou plusieurs double- liaisons carbone-carbone dont la position dans la molécule sert à classer celle-ci dans la catégorie. La brûlure perturbe considérablement le métabolisme lipidique. En effet, sous la dépendance de la réaction neuroendocrinienne de stress, la lipolyse est majorée, ce qui entraîne une augmentation de la libération d’acides gras libres (dont 30% seulement vont être utilisés, le reste étant Réestérifié en triglycérides, entraînant une insulino résistance). La lipolyse est aussi à l’origine d’une libération de glycérol, utilisé dans la néoglucogenèse. De plus, la production hépatique de VLDL (molécules de « transport ») est diminuée, ce qui retentit sur le métabolisme. Enfin, la β oxydation des acides gras est augmentée mais la cétogenèse est réduite. La résultante est une stéatose hépatique avec infiltration graisseuse du parenchyme hépatique, qui contribue à accroître la mortalité. Il est difficile de déterminer la quantité d’acides gras à apporter. Il en faut cependant un minimum, puisque certains sont essentiels (l’acide linoléique doit constituer 4% de l’apport énergétique total) mais il n’y a pas de consensus concernant la limite maximale. C’est ainsi qu’en Europe on recommande de ne pas dépasser 35% de calories lipidiques, au Canada 20% des calories non protéiques alors que pour l’équipe de Galveston la recommandation est de 3 à 15% du total calorique.7,42,43 Les études, tant chez l’animal que chez l’homme, sont favorables à la réduction des apports lipidiques car ceci serait associé à une réduction à la fois du nombre d’infections et de la durée de séjour (Fig. 11).44,45 Malheureusement, les solutés destinés à la nutrition entérale proposent des apports lipidiques s’étendant entre 35 et 40% de l’apport calorique total. De plus il faut se méfier des apports caloriques occultes (par ex : 1ml de propofol = 1kcal) et les prendre en compte dans le bilan nutritionnel. Les apports prescrits ne sont pas nécessairement ceux recommandés ni même ceux que le malade a réellement reçus, c’est pourquoi un bilan nutritionnel quotidien est recommandé et pour cela il ne faut pas hésiter à utiliser l’aide que peut apporter un tableur type EXCEL® de même que des prélèvements biologiques hebdomadaires (triglycérides / enzymes hépatiques). L’apport en triglycérides à chaîne moyenne (TCM) paraît intéressant car ces molécules sont rapidement hydrolysées, peu stockées et ont une oxydation non dépendante de la carnithine or les patients de réanimation (encore plus ceux placés sous EER) sont souvent carencés en carnithine. On n’a cependant pas de preuve à ce jour de l’utilité des TCM chez le patient brûlé. Les acides gras polyinsaturés type ω3 (huiles de poisson) sont intéressants pour leurs propriétés anti inflammatoires car, à l’inverse des acides gras polyinsaturés type ω6, ils diminuent la sécrétion des eïcosanoïdes (substances pro inflammatoires). Leur bénéfice chez le brûlé n’a été testé que dans une seule étude, qui montre des effets favorables.46 Chez le patient non brûlé, le bénéfice apporté par les acides gras polyinsaturés type ω3 fait consensus, pour autant que ces produits soient administrés sous forme continue et non pas en bolus.47 Ces huiles de poisson auraient même un effets favorable sur la synthèse des protéines musculaires.48 En dépit de ces effets bénéfiques, les arguments ne sont pas assez solides, à ce jour, pour recommander l’usage tant des TCM que des ω3 chez les patients brûlés. La composition des solutés de nutrition disponibles sur le marché est très variable suivant le produit considéré, non seulement pour la proportion de lipides totaux (voir plus haut) mais aussi vis-à-vis des acides gras et triglycérides. Aucune formule du commerce ne peut ainsi être recommandée. La vitamine D est un stérol un peu particulier et c’est pratiquement une hormone. Or le brûlé présente un déficit en vitamine D, notamment parce que la peau brûlée, même après cicatrisation, est incapable d’hydroxyler la vitamine D sous l’action de la lumière….d’autant plus que le port de vêtements compressifs et le conseil d’éviter l’exposition solaire sont habituels. Les effets ostéo- calciques de la vitamine D sont plus connus que son rôle dans le maintien des défenses immunitaires ainsi que dans les capacités d’anabolisme musculaire, plus récemment découverts. Chez le brûlé, les besoins en vitamine D sont augmentés et la supplémentation est recommandée.7 En pratique, il est nécessaire de limiter les apports lipidiques à moins de 35% des calories totales (idéalement entre 10 et 20%), de privilégier les acides gras polyinsaturés type ω3 … sans pouvoir formuler des recommandations quant aux quantités à apporter.
Fig. 10. Acides gras insaturés.
Fig. 11. Comparaison de régimes riches et pauvres en lipides, d’après 44 et 45.
La séance s’est poursuiviepar une discussion rapportée ci après
Comment se procurer l’oxandrolone en France ?MB: Il s’agit d’une substance non autorisée, qui n’est plus produite en Europe. Il faut donc se la procurer aux USA et peut être, comme en Suisse, solliciter une autorisation spéciale d’utilisation auprès de l’agence nationale des médicaments (Swissmedic). L’utilisation (après autorisation) est très reglementée et le malade doit être informé de l’utilisation du produit.
Quand, comment et à quelles doses prescrire les β bloquants?MB: l’introduction des β bloquants est licite dès la sortie de la phase initiale (≈ fin de la première semaine). Il faut tenter de les introduire le plus tôt possible, car l’effet anti catabolisant est surtout marqué durant les 3 premières semaines. Ceci ne pose habituellement pas trop de problèmes chez les moins de 60% de surface corporelle brûlée. Le produit utilisé à Lausanne est le propranolol sur la base de 10mg x 3/jour chez un adulte de 60 kg et l’on augmente la dose jusqu’à ce que la fréquence cardiaque soit inférieure à 100/mn.
Lorsque vous pratiquez une calorimétrie indirecte, utilisez vous le Quotient Respiratoire ?MrL: Nous tenons compte de la valeur de la calorimétrie concernant l’apport énergétique total à satisfaire mais aussi des valeurs dérivées comme le quotient respiratoire. Celui-ci va guider la répartition préférentielle de nos nutriments. Nous examinons le QR et selon qu’il est plutôt proche de 1 ou de 0,7, nous adaptons le rapport glucides / lipides.
MB: Il faut toujours garder à l’esprit qu’une calorimétrie de courte durée (30-40mn) ne représente pas la dépense énergétique quotidienne car la dépense énergétique du patient varie et seule une mesure continue sur 24h parait représentative des besoins réels du patient. Il faut aussi rappeler que la calorimétrie est toujours plus proche de la réalité que les équations. Par ailleurs, les calorimètres disponibles soufrent encore de plusieurs limites et, pour les franchir, l’Universite de Geneve a mis au point un prototype, actuellement en test dans 7 universités européennes, qui devrait aboutir d’ici 2 ans à un produit commercial vendu sur la base d’un budget de 10 000€.
L’utilisation des Triglycérides à Chaine Moyenne sur des modèles animaux montre un accroissement du risque de stéatose, par le biais d’un effet de premier passage hépatique. Doit on vraiment recommander l’utilisation des TCM chez le patient brûlé et/ou le patient de réanimation?
MB: Je ne partage pas ce septicisme vis-à-vis des TCM. Notre pharmacien publie un travail comparatif portant sur 2 solutions lipidiques. C’est précisément celle qui contient des TCM qui induit le moins d’hypertriglycéridémies (indicatrices de stéatose hépatique). Par ailleurs, chez les brûlés graves (40% et plus), le déficit en carnithine est plus important qu’on ne croit et le métabolisme des lipides (non carnitine dépendant) est lui aussi plus important qu’on ne croit, ce qui plaide pour la réduction de la part des lipides dans l’apport nutritionnel du brûlé grave. C’est ce qu’a montré le travail de D. Garrel qu’a présenté AF. Rousseau. De plus, un travail uruguayen récent montre qu’au dela de 40% de lipides, on induit un catabolisme persistant. Le meilleur moyen de réduire l’apport lipidique est d’utiliser, comme aux USA, des solutions modulaires en lieu et place des produits de composition fixe que l’industrie propose.
L’apport nutritionnel sur 24h n’est pas toujours garanti, notamment parce que la nutrition entérale est très souvent interrompue par des évenements extérieurs tels que le passage au bloc opératoire. Comment faites vous dans vos centres pour garantir que le patient recevra bien l’apport prescrit ?
AFr: A Liège, nous essayons d’interrompre la nutrition le moins possible et c’est ainsi qu’elle est poursuivie au bloc opératoire. Lorsqu’elle doit être interrompue, le programme informatique de suivi nutritionnel permet de monitorer ces interruptions et de compenser le déficit sur le reste de la journée.
SW: A Marseille, la situation dépend du praticien. Mais l’habitude veut qu’elle soit interrompue durant le bloc opératoire en raison de plusieurs expériences malheureuses de régurgitations per opératoire. Pour autant, elle sera interrompue le moins possible, c’est-à-dire arrêtée lors du départ au bloc et reprise dès le retour du patient dans la chambre.
MB: A Lausanne, nous avons adopté le principe d’un arrêt le plus tardif possible (lors du départ au bloc) et d’une reprise la plus précoce possible (lors du retour en chambre) chez tous les patients intubés ou trachéotomisés. En revanche, l’équipe soignante a pour consigne de rattraper le retard en augmentant les débits au prorata.
La première oratrice de la deuxième partie de la session consacrée à la nutrition était Alice BLET (Paris), exposant le rôle du tissu adipeux. Il est représenté par les adipocytes et ne forme donc pas d’organe au sens anatomique du terme. Ces adipocytes sont, pour l’essentiel d’entre eux (85%), localisés au niveau sous-cutané. Sa fonction, en bonne partie régulée par l’insuline et les catécholamines ne se limite pas à un simple lieu de stockage calorique. Un rôle endocrine, interférant sur les régulations métabolique et énergétique, l’insulinorésistance, la réponse inflammatoire et la fonction endothéliale lui est maintenant reconnu. Les principaux organes- cibles (tissu graisseux lui-même, foie, muscles) se trouvent être des cibles majeures de l’insuline. Ils sont sollicités par le biais des adipokines, dont les 2 principales sont la leptine et l’adiponectine. La leptine passe la barrière hémato-méningée et agit sur l’hypothalamus pour un rétrocontrôle de la prise alimentaire. Elle régule la lipogenèse hépatique et l’oxydation musculaire des acides gras. Proche structurellement des IL 6, 11 et 12, elle a plutôt une rôle pro-inflammatoire, contrairement à l’adiponectine, plutôt anti-inflammatoire. Cette adipokine, la plus importante quantitativement, joue un rôle anti-obésité. Elle augmente l’élimination des cellules en apoptose, tout en protégeant les cellules endothéliales contre cette apoptose. Les situations de stress augmentent la lipolyse, mais avec une utilisation métabolique de seulement 35% des acides gras libérés (« cycle futile »), ceci étant en grande partie liée au défaut d’efficacité de l’insuline. On constate, dans une cohorte de 17 patients brûlés sur 45 +/- 20%, une baisse des concentrations sanguines de leptine et de liponectine.49 Par ailleurs, en expérimental, on constate que l’administration de leptine diminue la réponse inflammatoire et les dysfonctions d’organe, que le blocage de l’adiponectine augmente les concentrations de cytokines pro-inflammatoires et la mortalité due au sepsis.50 En conclusion, alors qu’il a longtemps été considéré comme un simple lieu de stockage, le tissu adipeux apparaît actuellement comme un acteur essentiel de la réponse métabolique au stress. Les adipokines pourraient être un marqueur prédictif et la cible d’interventions thérapeutiques futures.
Mette Berger a ensuite répondu à la question: « Que reste t’il de l’immunonutrition? » Celle-ci consiste à apporter aux patients des nutriments aux effets immunitaires « allégués », qui sont les acides gras Ω3, la glutamine (Gln) et l’arginine, les éléments traces et les vitamines. En ce qui concerne les acides gras, il est montré que des régimes à 15% d’acides gras dans les apports caloriques totaux, ces acides gras comprenant de l’huile de foie de poissons (riche en Ω3) permettent de diminuer les infections, les PAVM et la durée de séjour.44 Notons ici que les mélanges industriels apportent 30 à 35% des calories sous forme lipidique. Bien que moins nombreuses que celles montrant le contraire (et qui plus est entachées de biais), les études montrant l’absence d’efficacité de la supplémentation en Gln ont introduit un doute. Il est cependant très probable que l’apport de 0,2 à 0,3 g/kg/j de Gln améliore l’immunité, en partie au moins via l’augmentation de la Heat Shock Protein 70.51 Les concentrations sanguines de Gln peuvent aussi être normalisées via son précurseur, l’α cétoglutarate d’ornithine.52 Les vitamines (en particulier A, D, C et B6) ainsi que les oligo-éléments (en particulier Cu, Zn et Se) jouent, en tant que coenzymes ou éléments structurants d’enzymes, un rôle majeur dans l’immunité et la « détoxification » des radicaux oxygénés actifs. Or (étude en cours), les patients brûlés ont une perte massive de ces ions et molécules dans les exsudats. Il ne s’agit donc pas de « traiter » mais de remplacer. On peut noter que, si les études nord-américaines ne trouvent pas d’intérêt à la supplémentation en Se (constitutif de la glutathion peroxydase plasmatique), c’est car on trouve très peu de Se dans l’environnement européen, et donc que le « stock » des européens en Se est très limité, ce à la différence de l’Amérique septentrionale. Au total, il ne faut pas parler d’immunonutrition, mais de nutrition adaptée à la pathologie du patient. Ce qui veut, chez les brûlés, dire : 1- Nourrir 2- Nourrir correctement, en limitant les apports lipidiques et assurant des apports en Ω3 3- Compenser les pertes massives de ces patients (est l’on ne parle donc pas de « médicament » mais de « nutriment ») en glutamine, éléments traces et vitamines.
Jean-François Perrier(Nancy), a ensuite exposé les indices nutritionnels. La littérature concernant leur utilisation chez le brûlé est fort pauvre. Les indices cliniques viennent immédiatement à l’esprit. Il est important de dépister un état de dénutrition préalable à la brûlure. Son existence est en effet un marqueur fort d’évolution défavorable, avec des odds ratio autour de 2,8-3. Cette dénutrition est plus fréquente chez les sujets cancéreux, ceux porteurs de pathologies chroniques et les plus âgés. (On peut constater que l’habitus de nombre de nos patients les conduit à un état nutritionnel précaire, NDRLF). La courbe de poids et l’IMC sont peu utilisables au stade initial, du fait de l’oedème. Cependant, leur évolution à partir de la 2-3ème semaine mérite d’être surveillée. La comparaison des apports réels (tenant compte des apports prescrits et de leur suspension pour chirurgie, examens etc., rattrapée ou non) et les pertes (en particulier en cas de diarrhée) est utile bien que difficilement quantifiable pour ces dernières.
L’anthropométrie est peu utilisable. Non seulement elle est très observateur- dépendante mais elle obérée initialement par l’oedème et ensuite par le défaut de compliance cutanée en zone brûlée. Les kinésithérapeutes sont précieux, en évaluant la force musculaire et la fatigabilité, trop souvent ignorées. Leur évaluation « objective », au moyen de dynamomètres, est plus difficile car dépend de la coopération du patient (encore l’évaluation subjective en dépende t’elle aussi) et de la possibilité d’appareillage en zone cicatricielle. Si une cicatrisation simple laisse augurer un état nutritionnel correct, il est plus difficile de trouver la cause d’une cicatrisation défectueuse (dénutrition certes mais aussi infection, défaut de coopération du patient etc). Les indices biologiques simples ne sont pas non plus fiables au tout début, du fait des remaniements liés à la brûlure (inflammation, pertes cutanées) et à la réanimation initiale. La 3 méthyl-histidine urinaire, rapportée à la créatininurie, est le meilleur reflet du catabolisme musculaire. Mise en défaut en cas d’insuffisance rénale, elle est assez peu utilisée. Quatre protéines plasmatiques peuvent être utilisées pour évaluer l’état nutritionnel. Un dosage unique n’a que peu d’intérêt, en particulier au tout début mais leur évolution permet d’adapter la nutrition. L’albumine, dont la ½ vie est de 20 jours est un excellent marqueur de dénutrition chronique mais un pauvre marqueur de dénutrition chez les patients de réanimation, qui plus est chez les brûlés. Sa surveillance peut cependant être utile dans le cadre de l’équilibre oncotique plasmatique. La transferrine a une ½ vie moins longue de 10 h mais sa concentration est fortement impactée par l’inflammation et le métabolisme du fer. Elle n’est donc pas utile en nutrition mais peut l’être dans le cadre de l’exploration d’une anémie. Toutes les études s’accordent sur la mauvaise qualité de la surveillance de la Retinol Binding Protein (RBP) dans ce contexte. Au bout du compte, la meilleure « protéine nutritionnelle » est la préalbumine, aussi connue sous le nom de transthyrétine (TTR). Sa demi-vie est de 2j, et elle augmente rapidement sous l’effet d’une nutrition correcte. Ici encore, c’est son évolution (1/semaine) qui est intéressante. Un taux de plus de 0,25 g/L augure d’un état nutritionnel correct. Parmi les indices biologique multiparamétriques, le bilan azoté (à tout le moins son évolution) apparaît comme fiable. Cependant, les pertes sont difficiles à évaluer (diarrhée, pertes cutanées du brûlé) d’une part et, lorsque les patients mangent, les apports sont difficiles à quantifier faute de présence d’une diététicienne (ce qui n’est pas l’habitude des services de réanimation, et surtout des administrateurs hospitaliers, NDRLF). Les autres indicent mettent en balance inflammation et nutrition. Le Pronostic Inflammatory and Nutritionnal Index (PINI) est le rapport (orosomucoïde – mg/L*CRP – mg/L)/(albumine – g/L*TTR – g/L). Il est normal quand < 1 quand une valeur > 30 représente un fort risque de mortalité. La nécessité de faire 4 dosages a amené la définition du PINI simplifié : CRP/TTR. Ici, le pronostic vital est engagé quand il est > 2. Un index de Maastricht [20,68- (0,24*albumine)- (19,21*TTR)- (1,86*lymphocytes)- (0,04*poids idéal)] positif est un indicateur de dénutrition. Il n’est pas validé chez les brûlés et pose des problèmes d’interprétation en cas de leucopénie. Les index biophysiques comme la bioimpédence et l’absorption biphotonique sont plutôt du domaine de la recherche. Au total, une surveillance hebdomadaire pouvant faire appel au bilan azoté, à la TTR, au PINI simplifié et à l’évolution de la cicatrisation semble être de bon aloi chez un patient brûlé.
L’oratrice suivante, Isabelle Constant (Paris), a exposé les particularités de la nutrition de l’enfant brûlé. Physiologiquement, les besoins caloriques diminuent avec l’âge et sont corrélés au poids, passant globalement de 100 Cal/kg/j pendant la première année à 35 chez l’adulte jeune, la croissance étant fortement consommatrice d’énergie. Il existe cependant une très importante variation interindividuelle. Ces besoins subissent, à la suite d’une brûlure, les mêmes modifications que celles observées chez l’adulte à savoir une augmentation des besoins (+ 20 à + 50%) liée à un hypercatabolisme intense. Il est cependant difficile d’utiliser la littérature qui, quand elle s’adresse à la population pédiatrique, confond le plus souvent les âges de 0 à 10 ans alors mêmes que les besoins sont variables selon les tranches d’âge et que la population pédiatrique brûlée est essentiellement composée d’enfants de moins de 3 ans (80%). La dénutrition protéique est bien plus le fait des pertes (dans la zone brûlée, par hypercatabolisme, néoglucogenèse, synthèse des protéines de l’inflammation et cicatrisation) que par déficit des voies de synthèse. Il est difficile d’évaluer cette perte protéique, cependant une urée sanguine < 3 mmol/L laisse soupçonner un déficit nutritionnel quand la normalité de la transthyrétine donne à penser que la nutrition est de bon aloi. Les besoins azotés se situent entre 2,5 et 4 g/kg/j, avec un rapport calorico- azoté entre 200 et 250 Cal/g N, nettement supérieur à celui conseillé chez l’adulte. La nutrition parentérale, souvent utilisée chez les enfants les plus gravement atteints (> 60% SCT), seule ou en complément de nutrition entérale est, dans les 10 premiers jours, glucido-protidique. Quand des apports lipidiques deviennent nécessaires, un régime riche en acides riches en Ω3 est privilégié. Les préparations commerciales étant mal adaptés à la nutrition parentérale pédiatrique, elle est réalisée extemporanément selon les besoins de chacun, en macro- comme en micronutriments, dont les besoins sont considérablement augmentés dans cette population.43 Les glucides représentent la principale source d’apports caloriques. En quantité suffisante, ils permettent de limiter le catabolisme protidique en limitant la néoglucogenèse, alors qu’ils entrent dans la lipogenèse s’ils sont prescrits trop abondamment. La capacité de métabolisation du glucose diminue avec l’âge, passant de 19 g/kg/j avant 3 ans à 5 g/kg/j chez l’adolescent. Une étude, critiquable, a objectivé une capacité maximale de 5 mg/kg/mn (7 g/kg/j) chez l’enfant hypermétabolique. 53 Alors que les besoins sont augmentés, la tolérance à la charge glucidique est diminuée en raison d’une insulinorésistance, source d’une hyperglycémie dont les effets délétères sont maintenant bien connus et justifiant le recours à l’insuline exogène. La prescription d’une nutrition artificielle, préférentiellement entérale par abord nasogastrique, précoce, en continu, est nécessaire dès 10% SCT. Les solutés isocaloriques sont préféré aux solutés hypercaloriques et sont de composition différente (ici ce sont des mélanges industriels qui sont utilisés) selon les âges. 40% de glucides (G) + 48% de lipides (L) + 12% de protides (P) avant 1 an (Infantrini®), 50% G, 40% L, 10% P entre 1 et 6 ans (Nutrini®), et le même Nutrison® que chez l’adulte au-delà de 6 ans (40% G, 35% L, 16% P). Des diètes semi-élémentaires peuvent être nécessaires, en complément de nutrition parentérale, chez les enfants les plus atteints souffrant d’une intolérance digestive. L’utilisation sans contrôle des formules de calcul des besoins est fortement déconseillées, car elle peuvent différer de 500 à 600 Cal des besoins mesurés par calorimétrie indirecte, qui doit être le socle de la prescription nutritionnelle. La manipulation du métabolisme est peu utilisée, et privilégie la clonidine plutôt que les β bloqueurs largement prescrits outre Atlantique, en gardant en mémoire qu’une analgésie de qualité et une lutte efficace contre le stress subi par l’enfant diminuent efficacement les besoins nutritionnels. Au total, la nutrition de l’enfant brûlé est une nutrition « pédiatrique », différente de celle de l’adulte, s’en rapprochant cependant par la nécessité d’une mise en route précoce et d’une montée en charge progressive.
Didier Quilliot (Nancy) a ensuite abordé la nutrition du brûlé dénutri, sur lequel pèsent les risques de syndrome de renutrition inappropriée et de surnutrition. La nutrition entérale (NE) est à privilégier et à débuter dans les 12 h. Cette NE, même ne couvrant que 15% des apports (très variables d’un patient à l’autre et au cours de l’évolution d’un patient) permet de maintenir la trophicité intestinale et améliore l’immunité des patients. Les brûlés souffrent volontiers d’une ischémie intestinale à la phase précoce, d’un oedème des parois digestives, d’un syndrome du compartiment abdominal et d’une gastroparésie, plus fréquente en cas de début tardif de NE, quasi systématique au-delà de 40% de SB. Un déficit nutritionnel est quasi constamment observé en réanimation. Il est cumulatif, pouvant atteindre jusqu’à plus de la moitié des apports nécessaires. La durée moyenne d’interruption de nutrition chez les patients de réanimation est évaluée à 8,9 h (!!!). L’intolérance digestive (11%) y participe beaucoup moins que les soins et les interventions chirurgicales (j’observe régulièrement des jeûnes préopératoires de 8 h chez des patients ayant déjà un abord trachéal, NDRLF). On note ici aussi que la présence journalière d’une diététicienne dans l’unité diminue fortement ce déficit, en particulier par le biais d’un rattrapage du retard. L’intolérance digestive est le plus souvent due à une gastroparésie. Lorsque le traitement médicamenteux est inefficace, il faut savoir rapidement passer en site post-pylorique. A noter qu’à côté des abords sous endoscopie ou avec des sondes autopropulsées (qui passent même en cas de gastroparésie, NDRLF) existent des sondes que l’on peut positionner par aimantation avec une mise en place en une trentaine de minutes. La nutrition parentérale (NP) peut être utile lorsqu’elle est instituée rapidement, par exemple pour atteindre d’emblée les niveaux nutritionnels visés, le temps de la montée en charge de la NE ou en cas d’intolérance ne permettant pas d’atteindre 60% de la cible. Elle est alors peu dangereuse.54,55 Elle a été fort critiquée chez les brûlés, mais il semble que les effets délétères et la surmortalité observés étaient essentiellement en rapport avec une surnutrition. Les recommandations actuelles tendent à la prescription de NP au plus tard en fin de première semaine, si la cible nutritionnelle n’est pas atteinte avec la NE seule. Une nutrition artificielle est nécessaire au-delà de 20% SB (ou si un patient moins brûlé ne mange pas correctement). L’abord initial est gastrique, éventuellement par gastrostomie si la NE est supposée durer longtemps. Les apports, très variables d’un patient et d’un jour à l’autre, sont idéalement à adapter aux mesures calorimétriques. En cas d’intolérance, le plus souvent par gastroparésie, il faut savoir passer rapidement en post-pylorique (voire systématiquement au-delà de 40% SB). Et si cette intolérance persiste, il est nécessaire de se tourner vers la NP tout en maintenant une NE représentant au moins 15% des besoins, aux fins de trophicité digestive. La réalisation pratique de la NE peut se baser sur l’équation de Toronto et le métabolisme calculé par la formule de Harris-Benedict. Il faut utiliser au maximum 20% de lipides dans le mélange (1,5 à 2,5 Cal/mL) utilisé, mais les mélanges commercialisés en contiennent 35%. On peut supplémenter avec protides et glucides soit avec une NP binaire (mais NP), soit en faisant réaliser (en biberonnerie) un mélange Protiphar ®-maltodextrine que l’on administrera en plus de la NE (sans oublier glutamine, oligo-éléments, vitamines, la glutamine étant à prendre en compte dans les apports azotés). Il est à noter qu’il est connu depuis longtemps, et vérifié chez les brûlés, que les apports à haute teneur énergétiques doivent être hypercaloriques, faute de quoi se produira une lipogenèse.56,57 C’est en fin de cursus que le risque de surnutrition est le plus important. Si l’on ne dispose pas de calorimètre, on peut se baser sur un poids-cible (soit habituel soit idéal pour le patient), calculer le métabolisme basal et apporter 20 à 30% de plus. Au total, les clés de la nutrition du patient brûlé sont la mise en route précoce, l’adaptation de la voie d’abord à la tolérance (postpylorique voire parentéral), éviter et compenser les baisses d’apport nutritionnel, apporter au moins 1,5 g de protides/ kg, ne passer dépasser 20% de lipides dans les apports caloriques, éviter la surnutrition en adaptant les apports aux besoins, éminemment variables, éventuellement manipuler catabolisme (β-) et anabolisme (oxandrolone, GH chez l’enfant), assurer une activité musculaire (car on fabrique des muscles si on les sollicite).
La dernière intervention a été le fait de Ronan Le Floch, rapportant une enquête sur les pratiques nutritionnelles dans les cTB français (« la vraie vie »). Elle a consisté en un appel téléphonique à 11 CTB métropolitains adultes et mixtes, 1 ultramarin (celui avec le décalage horaire le plus favorable). Avec les pratiques nantaises, ce sont donc les habitudes de 14 CTB qui ont été explorées. Les questions ont suivi les recommandations concernant la nutrition des brûlés (Tableau I) parues en 2013.7 Tous les centres réalisent une NE, la nutrition étant mixte (NE+NP) dans un centre lorsque les apports dépassent 1 500 Cal. Le site initial est toujours gastrique. Le contrôle du positionnement de la sonde est réalisé spécifiquement 10 fois (dont 1 avec opacification), 3 fois en même temps que le cliché thoracique réalisé systématiquement à l’entrée et 1 fois au stéthoscope. Le début est décrit par tous comme précoce. Ce qui correspond à « dès l’admission » (7 CTB), « dès que la température dépasse 36°C » (1 CTB), « dès que possible » (1), lors de la « première prescription de jour » 3 fois, « à 16 h le jour ou le lendemain de l’entrée » (ce qui pourrait faire à h23 si le patient rentre à 17 h, NDRLF) et « à h6-h8 » dans 1 CTB. La cible est basée sur l’expérience (entre 1 500 et 3 000 Cal) dans 1 CTB ; sur Harris Benedict x 1,5 1 fois et x 2 2 fois ; en Cal/kg dans 4 CTB, répartis entre 25, 25 à 30, 30 à 35 et 35 ; sur la calorimétrie 1 fois ; de 2 000 Cal + NP (sans plus de précision) 1 fois ; sur Toronto et définie par la diététicienne 1 fois. Ce qui fait 13 car j’ai oublié de le demander 1 fois. Cette cible est dite atteinte « rapidement » par tous. Ce qui se traduit par « en 2-3 j » dans 10 CTB, « à la cible d’emblée » (1 CTB), « par paliers journaliers de 500 ml » 1 fois (ce qui nous fait 5 j pour 3 000 Cal, NDRLF), « en 4 j » (1) et « en 6-7 j » (1). La diète est toujours polymérique. Les solutés sont iso- (8, « surtout au début ») ou hypercaloriques (à 1,5 -9 fois- ou 2 -4 fois- Cal/mL). Trois centres utilisent des solutions semi élémentaires au début, 2 en cas d’intolérance, 2 utilisent des mélanges enrichis en fibres, 1 une « immunonutrition », qui représente 50% des apports. Il s’agit toujours de produits commerciaux. La NP est dite « très rare » mais semble cependant relativement régulièrement utilisée dans 12 CTB, le plus souvent (8) en complément quand la NE est mal tolérée, ailleurs au-delà de 1 500 Cal au total (1), « au début » (1) ou « chez les plus extensivement brûlés » (3). En cas d’intolérance, 7 CTB diminuent le débit de NE quand 1 l’arrête, 2 ne changent rien et 1 passe en diète semi-élémentaire. Neuf CTB adjoignent ou augmentent la NP quand 2 s’y refusent. Des prokinétiques sont utilisés partout et utilisent 1 ou 2 molécules parmi l’érythromycine, la dompéridone et le métoclopramide. Le site post-pylorique, par sonde autopropulsée, est régulièrement utilisé dans 2 CTB. Ceux (3) qui recourent à une mise en place endoscopique par un gastroentérologue n’utilisent que rarement ce site, quand les 9 CTB restant ne l’utilisent pas. Tous les CTB adjoignent des préparations commerciales multi vitaminiques, à raison de 1 (5 CTB) ou 2 (9) unités/j. Des apports vitaminiques complémentaires sont aussi fréquemment utilisés. Douze CTB ajoutent de la Vit. C, 9 (arguant de l’alcoolisme habituel des patients) de la Vit. B1, 5 B6, K ou E (ce ne sont pas les 3 dans 5 CTB), 2 de l’acide folique et l’on trouve biotine ou PP dans 2 x 1 CTB. Les oligo-éléments sont équitablement prescrits à raison de 1 (7) ou 2 (7 aussi puisque équitablement) unités/j. Huit CTB ajoutent du Se (1 à 5 amp. selon le centre), 7 du Zn (1 à 5 amp.), 1 ajoute 2 amp. de Cu. Un CTB ajoute de la L carnithine. Tous les centres régulent la glycémie, le plus souvent (12) entre 6 et 8 mmol/L, ailleurs (1) entre 4 et 6 ou entre 10 et 11 (1). L’efficacité peut être surveillée au moyens de plusieurs paramètre. Nous avons relevé la TTR 9 fois (la RBP, à Nantes, a été remplacée depuis ce congrès par la TTR), la cicatrisation (8), le poids (4), la calorimétrie (3), le bilan azoté (2), l’albumine (2), le calcul des apports réels (1), le PINI (1), le dosage de Zn et Se (qui revient en 1 semaine) dans un centre. Tous les CTB surveillent le bilan hépatique, 1 à 2 fois par semaine. En cas d’intervention chirurgicale, 1 centre poursuit la nutrition en per opératoire, 5 l’arrêtent au départ, 3 à h-4 et 4 x 1 CTB à h-1, h-2, h-6 ou 2 h du matin (même chez des patients porteurs d’un abord trachéal, précision demandée pendant l’entretien, NDRLF). La reprise est réalisée pendant la réfection du pansement (1 centre, qui opère les patients en chambre), au retour en chambre (5), à h+4 (1), quand la température dépasse 36°C (2) ou 37°C (1) ou à 18 h (le CTB qui arrête à 2 h du matin). Je n’ai pas demandé si un rattrapage était réalisé après les suspensions. L’arrêt définitif de la NE est progressive, chez des patients déventilés ayant repris une alimentation orale (3 fois jugée comme correcte par une diététicienne) et en bonne voie de cicatrisation. Il est habituellement maintenu une alimentation nocturne de 1 000 ou 1 500 Cal de complément avant un arrêt, l’alimentation étant alors éventuellement optimisée avec des compléments. Aucun centre ne réalise de β blocage systématique, 6 l’utilisent parfois chez certains patients, restant très cataboliques, mais à distance de l’accident. Un centre utilise la testostérone 1 fois par semaine. Tous sont intéressés par l’oxandrolone, qui n’a actuellement une ATU limitée au retard de croissance.
Tableau I. Recommandations ESPN concernant la nutrition des brûlés,d’après 7.
Le titre de la présentation comprenait « faut – il en changer » ? A la suite de cette enquête, j’ai constaté que, si on mélangeait les pratiques de tous les CTB interrogés, les recommandations de 2013 s’avéreraient suivies, mais qu’aucun CTB ne les appliquait toutes. Il existe en particulier un déficit de calorimètres (si quelqu’un sait comment convaincre des administrateurs, faisant tout pour ne pas appliquer correctement les décrets de 2007, d’en acheter, qu’il en fasse état, NDRLF). Il serait bon aussi d’entreprendre des démarches pour étendre l’ATU de l’oxandrolone, aux brûlés graves sous nutrition artificielle (par exemple).
Il n’y a pas eu de discussion à la suite de cette session, l’horaire ayant été largement dépassé.
References
- 1.Newsome TW, Mason AD Jr, Pruitt BA Jr. Weight loss following thermal injury. Ann Surg. 1973;178:215–217. doi: 10.1097/00000658-197308000-00019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Chen Z, Wang S, Yu B, Li A. A comparison study between early enteral nutrition and parenteral nutrition in severe burn patients. Burns. 2007;33:708–712. doi: 10.1016/j.burns.2006.10.380. [DOI] [PubMed] [Google Scholar]
- 3.Dung N, Vien T, Lam N, Tuong T, Cadisch G. Early enteral feeding for burned patients - An effective method which should be encouraged in developing countries. Burns. 2008;34:192–196. doi: 10.1016/j.burns.2007.03.010. [DOI] [PubMed] [Google Scholar]
- 4.Raff T, Germann G, Hatmann B. The value of early enteral nutrition in the prophylaxis of stress ulcer in the severely burned patient. Burns. 1997;23:313–318. doi: 10.1016/s0305-4179(97)89875-0. [DOI] [PubMed] [Google Scholar]
- 5.Long CL, Schaffel N, Geiger JW, Schiller WR, Blakemore WS. Metabolic response to injury and illness: estimation of energy and protein needs from indirect calorimetry and nitrogen balance. J Parenter Enteral Nutr. 1979;3:452–456. doi: 10.1177/014860717900300609. [DOI] [PubMed] [Google Scholar]
- 6.Cunningham JJ, Hegarty MT, Meara PA, Burke JF. Measured and predicted calorie requirements of adults during recovery from severe burn trauma. Am J Clin Nutr. 1989;49:404–408. doi: 10.1093/ajcn/49.3.404. [DOI] [PubMed] [Google Scholar]
- 7.Rousseau AF, Losser MR, Ichai C, Berger MM. ESPEN endorsed recommendations: Nutritional therapy in major burns. Clin Nut. 2013;32:497–502. doi: 10.1016/j.clnu.2013.02.012. [DOI] [PubMed] [Google Scholar]
- 8.Allard JP, Pichard C, Hoshino E, Stechison S et al. Validation of a new formula for calculating the energy requirements of burn patients. J Enteral Nutr. 1990;14:115–118. doi: 10.1177/0148607190014002115. [DOI] [PubMed] [Google Scholar]
- 9.Barret JP, Jeschke MG, Herndon DN. Fatty infiltration of the liver in severely burned pediatric patients: autopsy findings and clinical implications. J Trauma. 2001;51:736–729. doi: 10.1097/00005373-200110000-00019. [DOI] [PubMed] [Google Scholar]
- 10.Williams FN, Jeschke MG, Chinkes DL, Suman OE, et al. Modulation of the hypermetabolic response to trauma: temperature, nutrition, and drugs. J Am Coll Surg. 2009;208:489–502. doi: 10.1016/j.jamcollsurg.2009.01.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Al-Ibrahim MS, Gross JY. In: Traité de Nutrition. Rousseau AF, Cynober L, Berger MM, editors. in press; 2015. Nutrition du brûlé. [Google Scholar]
- 12.Yu YM, Ryan CM, Castillo L, Lu XM et al. Arginine and ornithine kinetics in severely burned patients: increased rate of arginine disposal. Am J Physiol Endocrinol Metab. 2001;280:E509–E511. doi: 10.1152/ajpendo.2001.280.3.E509. [DOI] [PubMed] [Google Scholar]
- 13.Rimdeika R, Gudaviciene D, Adamonis K, Barauskas G et al. The effectiveness of caloric value of enteral nutrition in patients with major burns. Burns. 2006;32:83–86. doi: 10.1016/j.burns.2005.08.003. [DOI] [PubMed] [Google Scholar]
- 14.Herndon DN, Hart DW, Wolf SE, Chinkes DL, Wolfe RR. Reversal of catabolism by beta-blockade after severe burns. N Engl J Med. 2001;345:1223–1229. doi: 10.1056/NEJMoa010342. [DOI] [PubMed] [Google Scholar]
- 15.Porro L, Herndon DN, Rodriguez N, Jennings K et al. Five-year outcomes after oxandrolone administration in severely burned children: a randomized clinical trial of safety and efficacy. J Am Coll Surg. 2012;214:489–502. doi: 10.1016/j.jamcollsurg.2011.12.038. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Mowlavi A, Andrews K, Milner S, Herndon DN, Heggers JP. The effects of hyperglycemia on skin graft survival in the burn patient. Ann Surg. 2000;45:629–632. doi: 10.1097/00000637-200045060-00010. [DOI] [PubMed] [Google Scholar]
- 17.Faisy C, Taylor SJ. Dépense énergétique en reanimation. Réanimation. 2009;18:477–485. [Google Scholar]
- 18.Mendonça Machado N, Gragnani A, Masako Ferreira L. Burns, metabolism and nutritional requirements. Nutr Hosp. 2011;26:692–700. doi: 10.1590/S0212-16112011000400005. [DOI] [PubMed] [Google Scholar]
- 19.Gauglitz GG, Herndon DN, Jeschke MG. Insulin resistance postburn: underlying mechanisms and current therapeutic strategies. J Burn Care Res. 2008;29:683–694. doi: 10.1097/BCR.0b013e31818481ce. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Van den Berghe G, Wouters P, Weekers F, Verwaest C et al. Intensive insulin therapy in critically ill patients. N Engl J Med. 2001;345:1359–1367. doi: 10.1056/NEJMoa011300. [DOI] [PubMed] [Google Scholar]
- 21.NICE-SUGAR Study Investigators: Intensive versus conventional glucose control in critically ill patients. N Engl J Med. 2009;360:1283–1297. doi: 10.1056/NEJMoa0810625. [DOI] [PubMed] [Google Scholar]
- 22.Jeschke MG, Pinto R, Herndon DN, Finnerty CC, Kraft R. Hypoglycemia is associated with increased postburn morbidity and mortality in pediatric patients. Rit Care Med. 2014;42:1221–1231. doi: 10.1097/CCM.0000000000000138. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Sartor Z, Kesey J, Dissanaike S. The effects of intravenous vitamin C on point-of-care glucose monitoring. J Burn Care Res. 2015;36:50–56. doi: 10.1097/BCR.0000000000000142. [DOI] [PubMed] [Google Scholar]
- 24.Tran NK, Godwin ZR, Bockhold JC, Passerini AG et al. Clinical impact of sample interference on intensive insulin therapy in severely burned patients: a pilot study. J Burn Care Res. 2014;35:72–79. doi: 10.1097/BCR.0b013e31829b3700. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Chang DW, DeSanti L, Demling RH. Anticatabolic and anabolic strategies in critical illness: a review of current treatment modalities. Schock, 1998;10:155–160. doi: 10.1097/00024382-199809000-00001. [DOI] [PubMed] [Google Scholar]
- 26.Herndon DN, Tompkins RG. Support of the metabolic response to burn injury. Lancet. 2004;363:1895–1902. doi: 10.1016/S0140-6736(04)16360-5. [DOI] [PubMed] [Google Scholar]
- 27.Jahoor F, Desai M, Herndon DN, Wolfe RR. Dynamics of the protein metabolic response to burn injury. Metabolism. 1988;37:330–337. doi: 10.1016/0026-0495(88)90132-1. [DOI] [PubMed] [Google Scholar]
- 28.De Bandt JP, Chollet-Martin S, Hernvann A, Lioret N et al. Cytokine response to burn injury: relationship with protein metabolism. J Trauma. 1994;36:624–628. doi: 10.1097/00005373-199405000-00004. [DOI] [PubMed] [Google Scholar]
- 29.Wolfe RR, Goodenough RD, Burke JF, Wolfe MH. Response of protein and urea kinetics in burn patients to different levels of protein intake. Ann Surg. 1983;197:163–171. doi: 10.1097/00000658-198302000-00007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Matsuda T, Kagan RJ, Hanumadass M, Jonasson O. The importance of burn wound size in determining the optimal calorie : nitrogen ratio. Surgery. 1983;94:562–568. [PubMed] [Google Scholar]
- 31.Wolfe RR, Goodenough RD, Wolfe MH. Isotopic approaches to the estimation of protein requirements in burn patients. Adv Shock Res. 1983;9:81–98. [PubMed] [Google Scholar]
- 32.Chan MM, Chan GM. Nutritional therapy for burns in children and adults. Nutrition. 2009;25:261–269. doi: 10.1016/j.nut.2008.10.011. [DOI] [PubMed] [Google Scholar]
- 33.Alexander JW, MacMillan BG, Stinnett JD, Ogle CK et al. Beneficial effects of aggressive protein feeding in severely burned children. Ann Surg. 1980;192:505–517. doi: 10.1097/00000658-198010000-00009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Badetti C, Cynober L, Bernini V, Garabedian M, Manelli JC. Protéines nutritionnelles et catabolisme musculaire chez le brûlé grave. Effets comparatifs de petits peptides ou d’acides aminés libres. Ann Fr Anesth Reanim. 1994;13:654–662. doi: 10.1016/s0750-7658(05)80721-x. [DOI] [PubMed] [Google Scholar]
- 35.Soeters PB, van de Poll MC, van Gemert WG, Dejong CH. Amino acid adequacy in pathophysiological states. J Nutr. 2004;134:1575S–1582S,. doi: 10.1093/jn/134.6.1575s. [DOI] [PubMed] [Google Scholar]
- 36.De-Souza DA, Greene LJ. Intestinal permeability and systemic infections in critically ill patients: effect of glutamine. Crit Care Med. 2005;33:1125–1135. doi: 10.1097/01.ccm.0000162680.52397.97. [DOI] [PubMed] [Google Scholar]
- 37.Garrel D, Patenaude J, Nedelec B, Samson L et al. Decreased mortality and infectious morbidity in adult burn patients given enteral glutamine supplements: a prospective, controlled, randomized clinical trial. Crit Care Med. 2003;31:2444–2449. doi: 10.1097/01.CCM.0000084848.63691.1E. [DOI] [PubMed] [Google Scholar]
- 38.Coudray-Lucas C, Le Bever H, Cynober L, De Bandt JP, Carsin H. Ornithine alpha-ketoglutarate improves wound healing in severe burn patients: a prospective randomized double-blind trial versus isonitrogenous controls. Crit Care Med. 2000;28:1772–1776. doi: 10.1097/00003246-200006000-00012. [DOI] [PubMed] [Google Scholar]
- 39.Oudemans-van Straaten HM, van Zanten AR. Glutamine supplementation in the critically ill: friend or foe? Crit Care. 2014;18:143–145. doi: 10.1186/cc13879. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Graves C, Saffle J, Cochran A. Actual burn nutrition care practices an update. J Burn Care Res. 2009;30:77–82. doi: 10.1097/BCR.0b013e3181921f0d. [DOI] [PubMed] [Google Scholar]
- 41.Yan H, Peng X, Huang Y, Zhao M, Li F, Wang P. Effects of early enteral arginine supplementation on resuscitation of severe burn patients. Burns. 2007;33:179–184. doi: 10.1016/j.burns.2006.06.012. [DOI] [PubMed] [Google Scholar]
- 42.Abdullahi A, Jeschke MG. Nutrition and anabolic pharmacotherapies in the care of burn patients. Nutr Clin Pract. 2014;29:621–630. doi: 10.1177/0884533614533129. [DOI] [PubMed] [Google Scholar]
- 43.Rodriguez N, Jeschke M, Williams F, Kamolz LP, Herndon D. Nutrition in burns. Galveston contribution. J Parenter Enter Nutr. 2011;35:704–714. doi: 10.1177/0148607111417446. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Garrel DR, Razi M, Larivière F, Jobin N et al. Improved clinical status and length of care with low-fat nutrition support in burn patients. J Parenter Enteral Nutr. 1995;19:482–511. doi: 10.1177/0148607195019006482. [DOI] [PubMed] [Google Scholar]
- 45.Lee J, Gauglitz G, Herndon DN, Hawkins H, Haldes G, Jeschke M. Association between dietary fat content and outcomes in pediatric burn patients. J Surg Res. 1995;161:482–511. doi: 10.1016/j.jss.2010.10.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Abribat T, Nedelec B, Jobin N, Garrel DR. Decreased serum insulin- like growth factor-I in burn patients: relationship with serum insulin-like growth factor binding protein-3 proteolysis and the influence of lipid composition in nutritional support. Crit Care Med. 2000;28:2366–2372. doi: 10.1097/00003246-200007000-00031. [DOI] [PubMed] [Google Scholar]
- 47.Glenn JO, Wischmeyer PE. Enteral fish oil in critical illness: perspectives and systematic review. Curr Opin Clin Nutr Metab Care. 2014;17:116–123. doi: 10.1097/MCO.0000000000000039. [DOI] [PubMed] [Google Scholar]
- 48.Di Girolamo FG, Situlin R, Mazzucco S, Valentini R et al. Omega 3 fatty acids and protein metabolism: enhancement of anabolic interventions for sarcopenia. Curr Opin Clin Nutr Metab Care. 2014;17:145–150. doi: 10.1097/MCO.0000000000000032. [DOI] [PubMed] [Google Scholar]
- 49.Wade C, Mora A, Shields B, Pidcoke H et al. Signals from fat after injury: Plasma adipokines and ghrelin concentrations in the severely burned. Cytokine. 2013;61:78–83. doi: 10.1016/j.cyto.2012.08.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Cakir B, Cevik H, Contuk G, Ercan F et al. Leptin ameliorates multiple organ damage and modulates postburn immune response in rats. Regul Pept. 2005;125:135–144. doi: 10.1016/j.regpep.2004.08.032. [DOI] [PubMed] [Google Scholar]
- 51.Ziegler T, Ogden L, Singleton K, Luo M et al. Parenteral glutamine increases serum heat shock protein 70 in critically ill patients. Intensive Care Med. 2005;31:1079–1086. doi: 10.1007/s00134-005-2690-5. [DOI] [PubMed] [Google Scholar]
- 52.Le Boucher J, Coudrais-Lucas C, Lasnier E, Jardel A et al. Enteral administration of ornithine alpha-ketoglurate or arginine alpha-ketoglurate: a comparative study of their effects on glutaminepools in burned-injured rats. Crit Care Med. 1997;25:293–298. doi: 10.1097/00003246-199702000-00017. [DOI] [PubMed] [Google Scholar]
- 53.Sheridan R, Yu YM, Prelack K, Young V, Burke J, Tompkins R. Maximal parenteral glucose oxidation in hypermetabolic young children: a stable isotope study. J Parenter Enter Nutr. 1998;22:212–216. doi: 10.1177/0148607198022004212. [DOI] [PubMed] [Google Scholar]
- 54.Casaer MP, Mesottean D, Hermans G, Wouters PJ et al. Early VS late parenteral nutrition in critically ill adults. New Engl Med J. 2011;365:506–517. doi: 10.1056/NEJMoa1102662. [DOI] [PubMed] [Google Scholar]
- 55.Heidegger CP, Berger MM, Graf S, Zingg W et al. Optimization of energy provision with supplemental parenteral nutrition in critically ill patients: a randomized controlled clinical trial. Lancet. 2013;381:385–393. doi: 10.1016/S0140-6736(12)61351-8. [DOI] [PubMed] [Google Scholar]
- 56.Hill G, Church J. Energy and protein requirements of general surgical patients requiring intravenous nutrition. Br J Surg. 1984;71:1–9. doi: 10.1002/bjs.1800710102. [DOI] [PubMed] [Google Scholar]
- 57.Hart D, Wolf S, Herndon D, Chinkes D, Lal S, Obeng M. Energy expenditure and caloric balance after burns: increased feeding leads to fat rather than lean body mass accretion. Ann Surg. 2002;235:152–161. doi: 10.1097/00000658-200201000-00020. [DOI] [PMC free article] [PubMed] [Google Scholar]


