Resumen
El protocolo de un ensayo clínico es la base para planificar, ejecutar, publicar y evaluar el ensayo. Sin embargo, los protocolos y las guías que existen para su elaboración varían enormemente en cuanto a su calidad y contenido. En este artículo se describe la elaboración sistemática y el alcance de la Declaración SPIRIT 2013 (denominada así por la sigla en inglés de Standard Protocol items: Recommendations for Interventional Trials o Elementos estándares de un protocolo: recomendaciones para los ensayos de intervención), una guía en la que se establecen los contenidos mínimos que debe tener el protocolo de un ensayo clínico.
La lista de comprobación de la declaración SPIRIT, que consta de 33 elementos, se aplica a los protocolos de todos los ensayos clínicos y se centra más en el contenido que en el formato. En esta lista se recomienda hacer una descripción completa de lo que se ha planificado, aunque no se establece cómo diseñar o ejecutar un ensayo. Al brindar orientación sobre los contenidos fundamentales, las recomendaciones SPIRIT procuran facilitar la redacción de protocolos de alta calidad. El cumplimiento de las recomendaciones SPIRIT debería mejorar la transparencia y la exhaustividad de los protocolos de los ensayos en beneficio de los investigadores, los participantes, los pacientes, los patrocinadores, los financiadores, los comités de ética de la investigación o las juntas de revisión institucionales, los revisores, las revistas biomédicas, los registros de ensayos, los formuladores de políticas, los organismos reguladores y otras partes interesadas clave.
Abstract
The protocol of a clinical trial serves as the foundation for study planning, conduct, reporting, and appraisal. However, trial protocols and existing protocol guidelines vary greatly in content and quality. This article describes the systematic development and scope of SPIRIT (Standard Protocol Items: Recommendations for Interventional Trials) 2013, a guideline for the minimum content of a clinical trial protocol.
The 33-item SPIRIT checklist applies to protocols for all clinical trials and focuses on content rather than format. The checklist recommends a full description of what is planned; it does not prescribe how to design or conduct a trial. By providing guidance for key content, the SPIRIT recommendations aim to facilitate the drafting of high-quality protocols. Adherence to SPIRIT would also enhance the transparency and completeness of trial protocols for the benefit of investigators, trial participants, patients, sponsors, funders, research ethics committees or institutional review boards, peer reviewers, journals, trial registries, policymakers, regulators, and other key stakeholders.
El protocolo de un ensayo clínico cumple una función clave en la planificación, conducción, interpretación, supervisión y evaluación externa de un ensayo puesto que en él se detalla el plan desde la aprobación ética hasta la diseminación de los resultados. Un protocolo bien redactado facilita una evaluación adecuada de los aspectos científicos, éticos y de seguridad antes de que comience un ensayo, así como de la sistematicidad y el rigor en su conducción, y la valoración plena de su ejecución y sus resultados una vez finalizado. La importancia de los protocolos ha sido destacada por editores de revistas biomédicas (1–6), revisores (7–10), investigadores (11–15) y defensores del público (16).
A pesar de la función central que tienen los protocolos, una revisión sistemática mostró que las guías existentes sobre el contenido de los protocolos varían mucho en cuanto a su alcance y recomendaciones, pocas veces describen la manera en que fueron elaboradas, y rara vez indican una amplia participación de las partes interesadas o evidencia empírica que respalde sus recomendaciones (17). Estas limitaciones pueden explicar en parte por qué es oportuno mejorar la calidad de los protocolos. En muchos protocolos de ensayos aleatorizados no se describen adecuadamente los resultados principales (inadecuados en 25% de los ensayos) (18, 19), los métodos de asignación del tratamiento (inadecuados en 54% a 79%) (20, 21), el uso de enmascaramiento (inadecuado en 9% a 34%) (21, 22), los métodos para informar sobre los eventos adversos (inadecuados en 41%) (23), los componentes del cálculo del tamaño de la muestra (inadecuados en 4% a 40%) (21, 24), los planes de análisis de datos (inadecuados en 20% a 77%) (21, 24–26), las políticas de publicación (inadecuadas en 7%) (27) ni las funciones de los patrocinadores e investigadores en el diseño del estudio o en el acceso a los datos (inadecuado en 89% a 100%) (28, 29). Los problemas subyacentes pueden a su vez conducir a enmiendas del protocolo evitables, a una conducción deficiente del ensayo y a información inadecuada en la publicación del ensayo (15, 30).
En respuesta a estas lagunas en el contenido de los protocolos y en la orientación que se brinda sobre ellos, en el año 2007 pusimos en marcha la iniciativa SPIRIT (denominada así por la sigla en inglés de Standard Protocol Items: Recommendations for Interventional Trials o Elementos estándares de un protocolo: recomendaciones para los ensayos de intervención). El objetivo de este proyecto internacional es lograr que los protocolos de los ensayos sean más completos al brindar recomendaciones basadas en la evidencia sobre un conjunto mínimo de elementos o ítems que deben incluirse en los protocolos. La Declaración SPIRIT 2013 incluye una lista de comprobación de 33 elementos (cuadro 1) y un diagrama (figura). En un documento explicativo asociado (SPIRIT 2013 Explanation and Elaboration) (31) se detallan la justificación y la evidencia que respalda cada elemento de la lista, junto con orientación y ejemplos que sirven de modelo tomados de protocolos reales.
CUADRO 1.
Lista de comprobación de la Declaración SPIRIT 2013: elementos que se recomienda abordar en el protocolo de un ensayo clínico y en los documentos relacionadosa
| Sección/elemento | Número | Descripción |
|---|---|---|
| Información administrativa | ||
| Título | 1 | Título descriptivo que indique el diseño, la población, las intervenciones y, cuando corresponda, la sigla o abreviatura del ensayo. |
| Registro del ensayo | 2a | Identificador del estudio y nombre del registro. Si no se lo ha registrado aun, nombre del registro donde se propone inscribirlo. |
| 2b | Todos los elementos del conjunto de datos del registro de ensayos de la Organización Mundial de la Salud, (véase el cuadro del apéndice, disponible en la versión original en inglés en www.annals.org) | |
| Versión del protocolo | 3 | Fecha e identificación de la versión |
| Financiación | 4 | Fuentes y tipo de apoyo financiero, material o de otra índole |
| Funciones y responsabilidades | 5a | Nombre, afiliaciones y funciones de quienes contribuyeron con el protocolo |
| 5b | Nombre e información de contacto del patrocinador del estudio | |
| 5c | Funciones del patrocinador y de los financiadores del estudio, si los hubiera, en el diseño; la recolección, gestión, análisis e interpretación de los datos; la redacción de los informes; y la decisión de someterlo para publicación, especificando si tendrán la última palabra en cualquiera de estas actividades | |
| 5d | Composición, funciones y responsabilidades del centro coordinador, el comité directivo, el comité evaluador del criterio de valoración, el equipo de gestión de datos y de cualquier otra persona o grupo que supervise el ensayo, si corresponde (véase el elemento 21a sobre el comité de monitoreo de datos) | |
| Introducción | ||
| Antecedentes y justificación | 6a | Descripción de la pregunta de investigación y justificación para emprender el ensayo, incluido un resumen de los estudios relevantes (publicados y no publicados) que hayan analizado los beneficios y daños de cada intervención |
| 6b | Explicación de la elección del comparador o los comparadores | |
| Objetivos | 7 | Objetivos o hipótesis específicos |
| Diseño del ensayo | 8 | Descripción del diseño del ensayo, incluido el tipo de ensayo (por ejemplo, de grupos paralelos, de grupos cruzados, factorial, de un solo grupo), razón de asignación y marco de trabajo (por ejemplo, superioridad, equivalencia, no inferioridad, exploratorio). |
| Métodos | ||
| Participantes, intervenciones y resultados | ||
| Ámbito del estudio | 9 | Descripción de los centros del estudio (por ejemplo, consultorio de atención primaria, hospital académico) y lista de los países donde se recopilarán los datos. Referencia a dónde puede obtenerse la lista de los centros participantes. |
| Criterios de selección | 10 | Criterios de inclusión y de exclusión de los participantes. Si corresponde, criterios de selección de los centros del estudio y las personas que realizarán las intervenciones (por ejemplo, cirujanos o psicoterapeutas). |
| Intervenciones | 11a | Intervenciones para cada grupo con detalles suficientes que permitan reproducirlas, incluido cómo y cuándo serán administradas. |
| 11b | Criterios para interrumpir o modificar las intervenciones asignadas a cada sujeto en el ensayo (por ejemplo, cambio en la dosis por daños al participante, a petición del participante o debido a una mejoría o a un empeoramiento de la enfermedad). | |
| 11c | Estrategias para mejorar el cumplimiento de protocolos de intervención, así como cualquier método para vigilar el cumplimiento (por ejemplo, retorno de la medicación, pruebas de laboratorio). | |
| 11d | Cuidados concomitantes e intervenciones relevantes permitidos y prohibidos durante el ensayo | |
| Resultados | 12 | Resultado principal y secundario, y otras valoraciones de la evolución o el desenlace, incluida la variable específica de medición (por ejemplo, presión arterial sistólica), la métrica de análisis (por ejemplo, cambio con respecto al valor inicial o línea de base, valor final, o tiempo hasta el evento), el método de agregación (por ejemplo, mediana, proporción) y el momento de cada variable. Se recomienda especialmente explicar la relevancia clínica de las variables de eficacia y seguridad (daños) seleccionadas. |
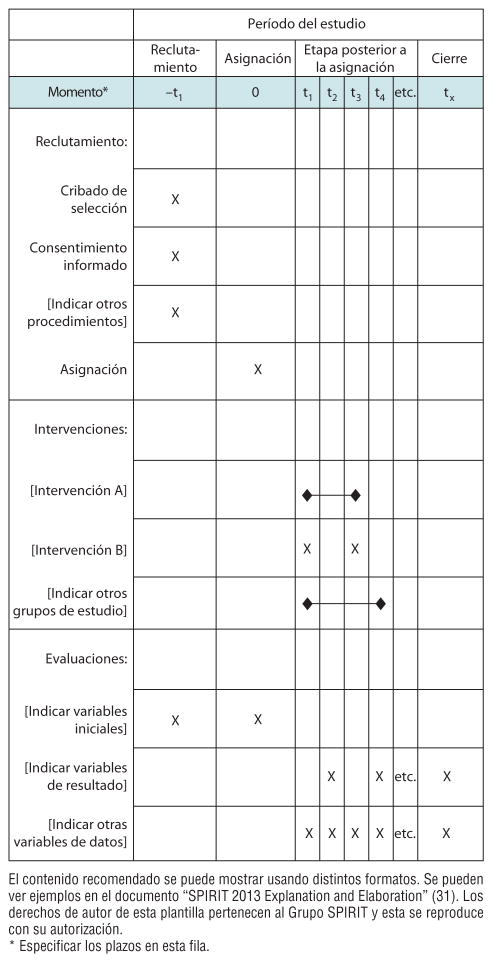
| Cronograma con respecto a los participantes | 13 | Cronograma para reclutar, realizar las intervenciones (incluidos períodos de preinclusión y de lavado), evaluar y visitar a los participantes. Se recomienda especialmente incluir un diagrama esquemático (véase la figura). |
| Tamaño de la muestra | 14 | Número estimado de participantes que se necesitan para alcanzar los objetivos del estudio y explicación sobre cómo se determinó dicho número, incluidas las premisas clínicas y estadísticas que respalden el cálculo del tamaño de la muestra. |
| Reclutamiento | 15 | Estrategias para lograr el reclutamiento adecuado a fin de alcanzar el tamaño de muestra previsto. |
| Asignación de las intervenciones (para los ensayos clínicos controlados) | ||
| Asignación generación de la secuencia | 16a | Método para generar la secuencia de asignación (por ejemplo, números aleatorios generados por computadora) y lista de cualquier factor utilizado en la estratificación. Para reducir la predictibilidad de la secuencia aleatoria, los detalles de cualquier restricción planificada (por ejemplo, bloques) deberían facilitarse en un documento aparte que no esté disponible para quienes deben reclutar a los participantes o asignar las intervenciones. |
| Mecanismo para ocultar la asignación | 16b | Mecanismo para aplicar la secuencia de asignación (por ejemplo, un teléfono central o sobres sellados, opacos y numerados de manera secuencial), con una descripción de toda medida para ocultar la secuencia hasta que se hayan asignado las intervenciones. |
| Ejecución | 16c | Quién generará la secuencia de asignación, quién reclutará a los participantes y quién asignará las intervenciones a los participantes. |
| Enmascaramiento (cegamiento) | 17a | Quién estará enmascarado después de la asignación de las intervenciones (por ejemplo, los participantes en el ensayo, los prestadores de atención de salud, los evaluadores de los resultados, los analistas de los datos) y cómo se hará el enmascaramiento. |
| 17b | Si hay enmascaramiento, circunstancias bajo las cuales se permite desenmascarar y procedimiento para revelar la intervención asignada a un participante durante el ensayo. | |
| Recolección, gestión y análisis de datos | ||
| Métodos de recolección de datos | 18a | Planes para evaluar y recoger las variables iniciales, de evolución y otros datos del estudio, incluido cualquier proceso para mejorar la calidad de los datos (por ejemplo, mediciones por duplicado, capacitación de los evaluadores) y descripción de los instrumentos utilizados en el estudio (por ejemplo, cuestionarios, pruebas de laboratorio) junto con su fiabilidad y validez, si se conocen. Indicar dónde pueden encontrarse los formularios de recolección de datos, si no se encuentran en el protocolo. |
| 18b | Planes para promover la retención de los participantes y lograr un seguimiento completo, incluida una lista de los datos que se recopilarán de los participantes que abandonen el ensayo o se desvíen de él. | |
| Gestión de datos | 19 | Planes para ingresar, codificar, proteger y guardar los datos, incluido cualquier proceso para mejorar su calidad (por ejemplo, ingreso por duplicado o revisión del rango de valores). Especificar dónde pueden encontrarse los detalles del procedimiento de gestión de datos que no figuren en el protocolo. |
| Métodos estadísticos | 20a | Métodos estadísticos para analizar la variable principal y las secundarias. Especificar dónde pueden encontrarse los detalles del plan de análisis estadístico que no figuren en el protocolo. |
| 20b | Métodos para cualquier otro análisis adicional (por ejemplo, análisis de subgrupos o análisis ajustados). | |
| 20c | Definición de la población de análisis en relación con la falta de cumplimiento del protocolo (por ejemplo, análisis conforme a la aleatorización) y de cualquier método estadístico para tratar los datos faltantes (por ejemplo, imputación múltiple). | |
| Monitoreo | ||
| Monitoreo de datos | 21a | Composición del comité de monitoreo de datos, resumen de su función y procedimiento de notificación, declaración sobre su independencia con respecto al patrocinador y sobre sus conflictos de intereses. Especificar dónde pueden encontrarse otros detalles sobre sus estatutos que no se hayan incluido en el protocolo. Alternativamente, explicar por qué no se necesita este comité. |
| 21b | Descripción de cualquier análisis intermedio y de las reglas de interrupción, incluido quién tendrá acceso a los resultados intermedios y quien tomará la decisión final de terminar el ensayo. | |
| Daños | 22 | Planes para recoger, evaluar, informar y gestionar los eventos adversos, tanto los informados espontáneamente como aquellos cuya información se obtuvo al solicitarla, y otros efectos imprevistos de las intervenciones o de la realización del estudio. |
| Auditoría | 23 | Frecuencia y métodos para auditar la realización del estudio, si los hubiera, y si estos procesos son independientes de los investigadores y del patrocinador. |
| Ética y diseminación | ||
| Aprobación ética de la investigación | 24 | Planes para obtener la aprobación del comité de ética o de la junta de revisión institucional |
| Enmiendas del protocolo | 25 | Planes para comunicar las enmiendas importantes introducidas en el protocolo (por ejemplo, cambios en los criterios de selección, en las variables de resultados, en el análisis) a las partes pertinentes (por ejemplo, investigadores, comité de ética o junta de revisión institucional, participantes en el ensayo, registros de ensayos, revistas biomédicas, organismos reguladores) |
| Consentimiento o conformidad | 26a | Quién obtendrá el consentimiento informado o el asentimiento de los participantes en el estudio o de sus representantes autorizados y cómo se hará (véase el elemento 32). |
| 26b | Disposiciones adicionales de consentimiento para la recolección y el uso de datos y muestras biológicas de los participantes de estudios auxiliares, cuando corresponda. | |
| Confidencialidad | 27 | Cómo se recopilará, compartirá y guardará la información de carácter personal de los participantes potenciales y reclutados, con el fin de proteger la confidencialidad antes, durante y después del ensayo. |
| Declaración de intereses | 28 | Conflictos de interés de tipo económico o de otra índole de los investigadores principales tanto para el ensayo en su conjunto como de cada centro. |
| Acceso a los datos | 29 | Declaración de quién tendrá acceso al conjunto de datos finales del ensayo y revelación de los acuerdos contractuales que limiten tal acceso a los investigadores. |
| Atención adicional y posterior al estudio | 30 | Disposiciones, si las hubiera, con respecto a la atención adicional y posterior al ensayo, y para la compensación en el caso de aquellos que sufran algún daño por haber participado en el estudio. |
| Política de diseminación | 31a | Planes de los investigadores y del patrocinador para comunicar los resultados del ensayo a los participantes, los profesionales de la salud, el público y otros grupos pertinentes (por ejemplo, en una publicación, presentación de información en bases de datos de resultados u otros arreglos para difundir los datos), incluida cualquier restricción de publicación. |
| 31b | Pautas para elegir a los autores y si se pretende usar redactores científicos profesionales. | |
| 31c | Planes, de haberlos, para hacer público el protocolo completo, el conjunto de datos de los participantes y el código estadístico. | |
| Apéndices | ||
| Materiales del consentimiento informado | 32 | Modelo del formulario del consentimiento informado y documentación relacionada que se entregue a los participantes o a sus representantes legales autorizados. |
| Muestras biológicas | 33 | Planes para recoger, estudiar y guardar muestras biológicas para análisis genéticos o moleculares, tanto presentes como futuros, cuando corresponda. |
Se recomienda enfáticamente que esta lista de comprobación se lea junto con el documento “SPIRIT 2013 Explanation and Elaboration” (31) donde se hacen importantes aclaraciones sobre los elementos. Las enmiendas al protocolo deben ser localizables y estar fechadas. Los derechos de autor de la lista de comprobación pertenecen al Grupo SPIRIT y se reproducen con autorización.
FIGURA. Ejemplo de plantilla con el contenido recomendado del cronograma para reclutar y realizar las intervenciones y evaluaciones.
ELABORACIÓN DE LA DECLARACIÓN SPIRIT 2013
La Declaración SPIRIT 2013 fue elaborada a partir de una amplia consulta con 115 actores clave, incluidos investigadores (n = 30); profesionales de atención de la salud (n = 31); metodólogos (n = 34); estadísticos (n = 16); coordinadores de ensayos (n = 14); editores de revistas biomédicas (n = 15); y representantes de la comunidad de ética de la investigación (n = 17), de los financiadores tanto dentro como fuera de la industria (n = 7) y de los organismos reguladores (n = 3), cuyas funciones no son mutuamente excluyentes. Como se detalla más adelante, la guía SPIRIT se ha elaborado por medio de dos revisiones sistemáticas, un proceso formal de consenso Delphi, dos reuniones presenciales de consenso y una prueba piloto (32).
La lista de comprobación de la Declaración SPIRIT 2013 evolucionó a lo largo de varias versiones. El proceso comenzó con una lista preliminar de 59 elementos extraídos de una revisión sistemática de las guías para protocolos ya existentes (17). En el año 2007, 96 expertos procedentes de 17 países de ingresos bajos (n = 1), medianos (n = 6) y altos (n = 10) pulieron esa lista inicial en tres rondas de encuestas de consenso Delphi realizadas por correo electrónico (33). Los expertos calificaron cada elemento en una escala del 1 (sin ninguna importancia) al 10 (muy importante), sugirieron nuevos elementos y formularon observaciones que se distribuyeron en las siguientes rondas. En la ronda final se incluyeron aquellos elementos con una puntuación mediana de 8 o más, mientras que los elementos que recibieron una puntuación de 5 o menos fueron excluidos. Los elementos con una puntuación entre 5 y 8 fueron retenidos para analizarlos más a fondo en las reuniones de consenso.
Después de la encuesta Delphi, 16 miembros del Grupo SPIRIT (designados como autores de este trabajo) se reunieron en diciembre de 2007 en Ottawa (Canadá) y 14 miembros se reunieron en septiembre de 2009 en Toronto (Canadá) a fin de revisar los resultados de la encuesta, analizar los elementos polémicos y perfeccionar la lista de comprobación preliminar. Después de cada reunión, la lista revisada se circuló nuevamente dentro del Grupo SPIRIT para recibir más observaciones.
En una segunda revisión sistemática se estableció la evidencia empírica sobre la relevancia de elementos específicos del protocolo en cuanto a la conducción del ensayo o el riesgo de sesgo. Los resultados de esta revisión justificaron incluir o excluir elementos de la lista de comprobación. Esta revisión también proporcionó la base de evidencia de los estudios citados en el documento explicativo asociado (SPIRIT 2013, Explanation and Elaboration) (31). En el caso de algunos elementos, se encontró poca o ninguna evidencia empírica (por ejemplo, sobre el título) y se los incluyó en la lista de comprobación sobre la base de una sólida justificación pragmática o ética.
Por último, se llevó a cabo una prueba piloto de la lista preliminar en los años 2010 y 2011 con estudiantes de maestría de la Universidad de Toronto que usaron la lista para elaborar protocolos de ensayos como parte de un curso de métodos de ensayos clínicos. Sus observaciones sobre el contenido, el formato y la utilidad de la lista se obtuvieron mediante una encuesta anónima y se incorporaron en la lista de comprobación definitiva de la Declaración SPIRIT 2013.
DEFINICIÓN DEL PROTOCOLO DE UN ENSAYO CLÍNICO
Aunque todos los estudios deben tener un protocolo, la definición precisa de lo que es un protocolo varía entre los distintos investigadores, patrocinadores y otras partes interesadas. En el caso de la iniciativa SPIRIT, un protocolo se define como el documento que proporciona suficientes detalles a fin de entender los antecedentes, la justificación, los objetivos, la población de estudio, las intervenciones, los métodos, los análisis estadísticos, las consideraciones éticas, los planes de diseminación y la administración del ensayo; reproducir los aspectos clave de los métodos y la conducción del ensayo; y evaluar el rigor científico y ético del ensayo desde su aprobación ética hasta la diseminación de los resultados.
El protocolo es más que una lista de elementos. Debe ser un documento cohesivo en el que se brinde el contexto y una descripción apropiada a fin de comprender plenamente los elementos del ensayo. Por ejemplo, en la descripción de una intervención compleja puede ser necesario incluir figuras y materiales de capacitación para que pueda ser reproducida por personas con la experiencia adecuada.
El protocolo completo debe someterse a una junta de revisión institucional o un comité de ética de la investigación para su aprobación (34). Se recomienda que los investigadores o los patrocinadores del ensayo verifiquen todos los elementos de la lista de comprobación antes de presentar el protocolo. Si aun faltaran los detalles sobre alguno de los elementos, esto debe mencionarse en el protocolo y estos elementos deben actualizarse a medida que sean desarrollados.
El protocolo es un documento “vivo” que suele modificarse durante el ensayo. Una parte esencial del registro científico es la documentación transparente de las fechas de los cambios importantes en el diseño y la conducción del ensayo. Se espera que los investigadores y los patrocinadores de ensayos cumplan el protocolo tal como fue aprobado por la junta de revisión institucional y que documenten las enmiendas en la versión más reciente del protocolo. Las enmiendas importantes del protocolo deben informarse a la junta de revisión institucional y a los registros de ensayos a medida que ocurren, y luego ser descritas en los informes del ensayo.
ALCANCE DE LA DECLARACIÓN SPIRIT 2013
La Declaración SPIRIT 2013 se aplica al contenido de un protocolo de ensayo clínico, incluidos sus anexos. Un ensayo clínico es un estudio prospectivo en el que se asignan una o varias intervenciones a participantes humanos para evaluar los efectos en los resultados relacionados con la salud. El principal ámbito de aplicación de estas recomendaciones son los ensayos aleatorizados, pero las mismas consideraciones se aplican sustancialmente a todos los tipos de ensayos clínicos, independientemente del diseño del estudio, la intervención o el tema.
La Declaración SPIRIT 2013 proporciona una guía sobre el contenido mínimo que debe tener un protocolo, aunque en ciertas circunstancias se pueden requerir elementos adicionales. Por ejemplo, un estudio con diseño factorial puede necesitar una justificación específica, los ensayos con tratamientos alternados (cross-over) tienen consideraciones estadísticas únicas, como los efectos residuales (carry-over), y los ensayos patrocinados por la industria pueden tener requerimientos regulatorios adicionales.
El protocolo y sus anexos son a menudo la única fuente de información detallada pertinente sobre cada uno de los elementos de la lista de comprobación. Por medio de los protocolos de ensayos existentes, hemos encontrado ejemplos que sirven de modelo para cada elemento (31), lo que muestra que es factible abordar todos los elementos de la lista en un único documento de protocolo. En el caso de algunos ensayos, algunos detalles relevantes pueden aparecer en documentos relacionados, como los planes de análisis estadístico, el formulario de recogida de datos, el manual de operaciones o el contrato con el investigador (35, 36). En esos casos, en el protocolo se deben describir los principios fundamentales y hacer referencia a estos documentos para que se sepa que existen.
La Declaración SPIRIT 2013 se relaciona más con el contenido que con el formato del protocolo, que a menudo está sujeto a regulaciones locales, prácticas habituales o procedimientos normalizados de trabajo. No obstante, el cumplimiento de ciertas convenciones sobre el formato, como el índice, los encabezados de sección, el glosario, la lista de abreviaturas, la lista de referencias, y un cronograma esquemático del reclutamiento, las intervenciones y las evaluaciones, facilitará la revisión del protocolo (figura).
Finalmente, la Declaración SPIRIT 2013 intenta promover la transparencia y la descripción completa de lo que se tiene previsto hacer, pero no pretende establecer cómo debería diseñarse o conducirse un ensayo. La lista de comprobación no debe utilizarse para juzgar la calidad del ensayo, dado que el protocolo de un ensayo mal diseñado puede incluir todos los elementos de la lista de comprobación al dar una descripción completa de sus características de diseño poco adecuadas. Sin embargo, el uso de la Declaración SPIRIT 2013 puede mejorar la validez y el éxito de los ensayos al recordar a los investigadores algunos temas importantes que deben considerar durante la etapa de planificación.
RELACIÓN CON LAS GUÍAS EXISTENTES SOBRE ENSAYOS CLÍNICOS
Dado el proceso de desarrollo sistemático, la consulta con todas las partes interesadas a escala internacional y el artículo explicativo en el que se cita la evidencia empírica relevante (31), en la Declaración SPIRIT 2013 se aprovechan otras guías internacionales aplicables a los protocolos de ensayos clínicos. Además se respetan los principios éticos requeridos por la Declaración de Helsinki del año 2008, en particular el requisito de que en el protocolo se aborden consideraciones éticas específicas, como los conflictos de intereses (34).
Además, en estas recomendaciones se incluyen los elementos de un protocolo recomendados en los lineamientos para la buena práctica clínica de la Conferencia Internacional de Armonización, redactados en 1996 para los ensayos clínicos cuyos resultados se presentarán a los organismos reguladores (37). En la Declaración SPIRIT 2013 se avanza con respecto a estos lineamientos para la buena práctica clínica al proporcionar recomendaciones adicionales sobre elementos clave del protocolo (por ejemplo, la ocultación de la secuencia de asignación, el registro del ensayo y los procesos de consentimiento). En contraste con SPIRIT, en los lineamientos para la buena práctica clínica se utilizaron métodos de consenso informales, no se aclara la contribución de cada colaborador ni se incluyeron citas de evidencia empírica de respaldo (38).
La Declaración SPIRIT 2013 también apoya los requisitos de registro de los ensayos clínicos de la Organización Mundial de la Salud (39), del Comité Internacional de Editores de Revistas Médicas (40), de la legislación pertinente en ClinicalTrials.gov (41), la Comisión Europea (42) y otras organizaciones. Por ejemplo, el elemento 2b de la lista de comprobación recomienda que el protocolo incluya el conjunto de datos del registro de ensayos clínicos de la Organización Mundial de la Salud (cuadro en el apéndice, disponible en la versión original en inglés en www.annals.org), que es la cantidad mínima de datos que el Comité Internacional de Editores de Revistas Médicas exige para los registros de ensayos clínicos. El propósito de tener este conjunto mínimo de datos en una sección propia del protocolo no solo es que sirva como un resumen del ensayo, sino también que ayude a mejorar la calidad de la información que se ingresa en los registros. Los datos específicos de registro pueden entonces encontrarse fácilmente en la sección del protocolo y copiarse en los campos del registro. Además, las enmiendas a esta sección del protocolo podrían impulsar a los investigadores a actualizar los datos en el registro.
La Declaración SPIRIT 2013 refleja los elementos aplicables de la versión 2010 de CONSORT (Consolidated Standards of Reporting Trials o normas consolidadas para la comunicación de los ensayos) (43). Redactar y estructurar congruentemente los elementos comunes en ambas listas facilitará la transición de un protocolo basado en SPIRIT a un informe final basado en CONSORT. A fin de armonizar los esfuerzos internacionales de promoción de la transparencia y la alta calidad del contenido de los protocolos, el Grupo SPIRIT también ha involucrado a líderes de otras iniciativas relativas a los estándares de los protocolos, como los registros de ensayos, el grupo de representación de protocolos del Consorcio de Estándares para el Intercambio de Datos Clínicos y el grupo de Ensayos Clínicos Aleatorizados Controlados Pragmáticos en el Cuidado de la Salud.
POSIBLE EFECTO
Un amplio abanico de partes interesadas podrían beneficiarse del uso generalizado de la Declaración SPIRIT 2013 y su respectivo documento explicativo (cuadro 2). Las pruebas piloto y el proceso de retroalimentación informal han mostrado que es particularmente valiosa para los investigadores al redactar sus protocolos. También puede servir de recurso de información para los nuevos investigadores, revisores y miembros de las juntas de revisión institucionales.
CUADRO 2.
Posibles beneficios y propuesta de acciones para que las partes interesadas apoyen el cumplimiento de SPIRIT 2013
| Partes interesadas | Acciones propuestas | Posibles beneficios |
|---|---|---|
| Grupos, investigadores, patrocinadores de ensayos clínicos | Adoptar SPIRIT como guía estándar | Mejora de la calidad, exhaustividad y congruencia del protocolo |
| Usar SPIRIT como un instrumento para redactar protocolos | Mejor comprensión de los fundamentos y de los aspectos que se deben considerar en los elementos clave del protocolo | |
| Mayor eficiencia en la revisión del protocolo | ||
| Comités de ética de la investigación, juntas de revisión institucionales, organismos de financiación o de regulación | Establecer o promover el cumplimiento de SPIRIT para presentar protocolos | Mejora de la calidad, exhaustividad y congruencia del protocolo |
| Usar SPIRIT como instrumento de formación | Mayor eficiencia en la revisión y menos consultas sobre los requisitos del protocolo | |
| Educadores | Usar la lista SPIRIT y el documento explicativo como instrumentos de formación | Mejor comprensión de los fundamentos y de los aspectos a considerarse con respecto a los elementos clave del protocolo |
| Pacientes, participantes en ensayos, formuladores de políticas | Alentar el uso de SPIRIT por parte de investigadores y patrocinadores | Mejor contenido del protocolo en cuanto a la transparencia, la rendición de cuentas, la valoración crítica y la supervisión |
| Registros de ensayos | Alentar que los protocolos se basen en SPIRIT | Mayor calidad de la información del registro |
| Registrar protocolos completos para acompañar la difusión de resultados | Estímulo a los investigadores para actualizar los datos del registro si se modifica el elemento 2b (conjunto de datos del registro) del protocolo | |
| Mejora de la calidad, la exhaustividad y la congruencia del protocolo en aquellos registros que los incluyen protocolos y resultados completos | ||
| Empresas editoriales y editores de revistas biomédicas | Avalar SPIRIT como guía estándar para protocolos, sean publicados o inéditos | Mejora de la calidad, la exhaustividad y la congruencia del protocolo |
| Incluir la referencia a SPIRIT en las instrucciones para los autores | Mejora de la revisión del manuscrito de los ensayos mediante un contenido más completo del protocolo, que se puede usar para evaluar su cumplimiento y la selectividad de la presentación de la información | |
| Solicitar que se presenten los protocolos junto con el manuscrito, pasarlos a los revisores y fomentar que los autores los publiquen como anexos en la web | Mejora de la transparencia y de la interpretación de los ensayos por los lectores. |
SPIRIT = Elementos estándares de un protocolo: recomendaciones para los ensayos de intervención (por su sigla en inglés).
Además ofrece un posible beneficio para la ejecución del protocolo. La demora excesiva desde el diseño del protocolo hasta la aprobación del comité de ética y el inicio del reclutamiento de los participantes sigue siendo una de las principales preocupaciones en torno a los ensayos clínicos (44). Una mayor exhaustividad de los protocolos podría ayudar a mejorar la eficiencia del proceso de revisión al reducir las consultas evitables a los investigadores sobre información incompleta o poco clara. Al promover una documentación completa de la información clave y una mayor conciencia de algunas consideraciones importantes antes de que se inicie el ensayo, el uso de las recomendaciones SPIRIT también podría ayudar a reducir el número y la carga que suponen las enmiendas posteriores del protocolo, muchas de las cuales pueden evitarse con una redacción y desarrollo cuidadosos del protocolo (15). La adopción generalizada de la Declaración SPIRIT 2013 como norma única por parte de las juntas de revisión institucionales, las organizaciones de financiación, los organismos reguladores y las revistas biomédicas podría simplificar la labor de los investigadores y patrocinadores de ensayos, quienes podrían cumplir con los requisitos comunes de solicitud de múltiples partes interesadas por medio de un único protocolo basado en las recomendaciones SPIRIT. Mejores protocolos podrían ayudar también al personal a cargo de conducir el ensayo, uno de los propósitos de los autores de la Declaración SPIRIT 2013.
Además, el cumplimiento de la Declaración SPIRIT 2013 podría ayudar a asegurar que los protocolos contengan la información necesaria para que se pueda hacer la evaluación e interpretación crítica del ensayo. Los protocolos de alta calidad pueden proporcionar información importante sobre los métodos del ensayo y su conducción que no está disponible en las revistas biomédicas o los registros de ensayos (45–47). Al ser un registro transparente del propósito original de los investigadores, la comparación del protocolo con los informes finales del ensayo puede ayudar a identificar el informe selectivo de los resultados y las enmiendas no declaradas (48), como los cambios en las variables principales (19, 49). Sin embargo, los protocolos de ensayos clínicos generalmente no están a disposición del público (45). La Declaración SPIRIT 2013 tendrá un efecto mayor cuando los protocolos estén a disposición del público a fin de facilitar una evaluación completa de la validez del ensayo y su aplicabilidad (11, 12, 14, 50).
La guía SPIRIT necesita del apoyo de los interesados directos clave para lograr el mayor impacto posible (cuadro 2), como se ha visto con las guías para la presentación de informes ampliamente adoptadas, como CONSORT (51). Publicaremos los nombres de las organizaciones que hayan avalado la Declaración SPIRIT 2013 en el sitio web de SPIRIT (www.spirit-statement.org) y proporcionaremos recursos para facilitar su aplicación. La adopción generalizada de las recomendaciones SPIRIT puede ayudar a mejorar la redacción, el contenido y la ejecución del protocolo; facilitar el registro, la eficiencia y la evaluación crítica de los ensayos; y, en última instancia, aumentar la transparencia en beneficio de la atención al paciente.
Appendix Table.
World Health Organization Trial Registration Data Set*
| Item | Description |
|---|---|
| 1. Primary registry and trial-identifying number | Name of primary registry and the unique identifier assigned by the primary registry |
| 2. Date of registration in primary registry | Date when the trial was officially registered in the primary registry |
| 3. Secondary identifying numbers | Other identifiers, if any
|
| 4. Sources of monetary or material support | Major sources of monetary or material support for the trial (e.g., funding agency, foundation, company, institution) |
| 5. Primary sponsor | Person, organization, group, or other legal entity that takes responsibility for initiating and managing a study |
| 6. Secondary sponsor(s) | Additional persons, organizations, or other legal persons, if any, who have agreed with the primary sponsor to take on responsibilities of sponsorship |
| 7. Contact for public queries | E-mail address, telephone number, and postal address of the contact who will respond to general queries, including information about current recruitment status |
| 8. Contact for scientific queries | Name and title, e-mail address, telephone number, postal address, and affiliation of the principal investigator and e-mail address, telephone number, postal address, and affiliation of the contact for scientific queries about the trial (if applicable) |
| 9. Public title | Title intended for the lay public in easily understood language |
| 10. Scientific title | Scientific title of the study as it appears in the protocol submitted for funding and ethical review; include trial acronym, if available |
| 11. Countries of recruitment | Countries from which participants will be recruited |
| 12. Health condition(s) or problem(s) studied | Primary health condition(s) or problem(s) studied (e.g., depression, breast cancer, medication error) |
| 13. Intervention(s) | For each group of the trial, record a brief intervention name plus an intervention description Intervention name: For drugs, use the generic name; for other types of interventions, provide a brief descriptive name Intervention description: Must be sufficiently detailed for it to be possible to distinguish between the groups of a study; for example, interventions involving drugs may include dosage form, dosage, frequency, and duration |
| 14. Key inclusion and exclusion criteria | Inclusion and exclusion criteria for participant selection, including age and sex |
| 15. Study type | Method of allocation (randomized/nonrandomized) Blinding/masking (identify who is blinded) Assignment (e.g., single group, parallel, crossover, factorial) Purpose Phase (if applicable) For randomized trials: Method of sequence generation and allocation concealment |
| 16. Date of first enrollment | Anticipated or actual date of enrollment of the first participant |
| 17. Target sample size | Total number of participants to enroll |
| 18. Recruitment status | Pending: Participants are not yet being recruited or enrolled at any site Recruiting Suspended: Temporary halt in recruitment and enrollment Complete: Participants are no longer being recruited or enrolled Other |
| 19. Primary outcome(s) | The primary outcome should be the outcome used in sample size calculations or the main outcome used to determine the effects of the intervention For each primary outcome provide:
|
| 20. Key secondary outcome(s) | As for primary outcomes, for each secondary outcome provide:
|
Adapted from www.who.int/ictrp/network/trds/en/index.html.
Agradecimientos
Los autores agradecen a las doctoras Mona Loufty y Patricia Parkin por realizar la prueba piloto de la lista de comprobación con estudiantes de cursos de posgrado. Los autores también agradecen la participación de la doctora Genevieve Dubois-Flynn en la reunión sobre SPIRIT que tuvo lugar en 2009.
La Revista Panamericana de Salud Pública agradece a An-Wen Chan, Luis Gabriel Cuervo, Iveta Simera y Eleana Villanueva por su iniciativa, gestión y revisión editorial para lograr esta traducción y al Women’s College Hospital por haber otorgado la autorización. A Gerard Urrútia Cuchí y Erik Cobo por la versión inicial de la traducción y su revisión editorial, al Departamento de Traducciones de la Organización Panamericana de la Salud (OPS) por la revisión de la traducción y al Departamento Legal de la OPS por su apoyo con la firma de los acuerdos y autorizaciones.
Footnotes
Traducción oficial al español del artículo original en inglés efectuada por la Organización Panamericana de la Salud, con licencia del Women’s College Hospital, Toronto, Canadá. En caso de discrepancia entre ambas versiones, prevalecerá la original (en inglés). La versión en inglés de este artículo se publicó en www.annals.org el 8 de enero de 2013.
Financiación. El apoyo económico para las reuniones del grupo SPIRIT fue proporcionado por los Canadian Institutes of Health Research (subsidio DET- 106068), el National Cancer Institute of Canada (actualmente llamado Canadian Cancer Society Research Institute) y la Canadian Agency for Drugs and Technologies in Health. Los Canadian Institutes of Health Research también financiaron actividades de diseminación en curso (subsidio MET-117434).
Declaración. La Dra. Krleža-Jerić fue empleada anteriormente por los Canadian Institutes of Health Research (División de transferencia del conocimiento) y el Dr. Parulekar es miembro del NCIC Clinical Trials Group. Los financiadores no han participado en el diseño o en la realización del proyecto; en la recolección, gestión, análisis o interpretación de los datos; ni en la preparación, revisión o aprobación del manuscrito. El Dr. Berlín es empleado de la compañía farmacéutica Janssen de Johnson & Johnson, el Dr. Sox es Editor Emérito de la revista Annals of Internal Medicine y el Dr. Rockhold es empleado de GlaxoSmithKline.
Conflictos de interés posibles. las declaraciones pueden verse en www.acponline.org/authors/icmje/ConflictOfInterestForms.do?msNum=M12-1905
REFERENCIAS
- 1.Rennie D. Trial registration: a great idea switches from ignored to irresistible. JAMA. 2004;292:1359–62. doi: 10.1001/jama.292.11.1359. [DOI] [PubMed] [Google Scholar]
- 2.Strengthening the credibility of clinical research [artículo editorial] Lancet. 2010;375:1225. doi: 10.1016/S0140-6736(10)60523-5. [DOI] [PubMed] [Google Scholar]
- 3.Summerskill W, Collingridge D, Frankish H. Protocols, probity, and publication. Lancet. 2009;373:992. doi: 10.1016/S0140-6736(09)60590-0. [DOI] [PubMed] [Google Scholar]
- 4.Jones G, Abbasi K. Trial protocols at the BMJ [artículo editorial] BMJ. 2004;329:1360. doi: 10.1136/bmj.329.7479.1360. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Groves T. Let SPIRIT take you towards much clearer trial protocols. [Acceso el 1 de octubre de 2012];BMJ Group Blogs. 2009 Septiembre; Disponible en http://blogs.bmj.com/bmj/2009/09/25/trish-groves-let-spirittake-you-towards-much-clearer-trial-protocols/
- 6.Altman DG, Furberg CD, Grimshaw JM, Rothwell PM. Lead editorial: trials-using the opportunities of electronic publishing to improve the reporting of randomised trials [artículo editorial] Trials. 2006;7:6. doi: 10.1186/1745-6215-7-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Turner EH. A taxpayer-funded clinical trials registry and results database [artículo editorial] PLoS Med. 2004;1:e60. doi: 10.1371/journal.pmed.0010060. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Coultas D. Ethical considerations in the interpretation and communication of clinical trial results. Proc Am Thorac Soc. 2007;4:194–8. doi: 10.1513/pats.200701-007GC. [DOI] [PubMed] [Google Scholar]
- 9.Siegel JP. Editorial review of protocols for clinical trials [carta] N Engl J Med. 1990;323:1355. doi: 10.1056/NEJM199011083231921. [DOI] [PubMed] [Google Scholar]
- 10.Murray GD. Research governance must focus on research training. BMJ. 2001;322:1461–2. [Google Scholar]
- 11.Chan A-W. Access to clinical trial data [ artículo editorial] BMJ. 2011;342:d80. doi: 10.1136/bmj.d80. [DOI] [PubMed] [Google Scholar]
- 12.Miller JD. Registering clinical trial results: the next step. JAMA. 2010;303:773–4. doi: 10.1001/jama.2010.207. [DOI] [PubMed] [Google Scholar]
- 13.Krleža-Jerić K, Chan A-W, Dickersin K, Sim I, Grimshaw J, Gluud C. Principles for international registration of protocol information and results from human trials of health related interventions: Ottawa statement (part 1) BMJ. 2005;330:956–8. doi: 10.1136/bmj.330.7497.956. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Lassere M, Johnson K. The power of the protocol. Lancet. 2002;360:1620–2. doi: 10.1016/S0140-6736(02)11652-7. [DOI] [PubMed] [Google Scholar]
- 15.Getz KA, Zuckerman R, Cropp AB, Hindle AL, Krauss R, Kaitin KI. Measuring the incidence, causes, and repercussions of protocol amendments. Drug Inf J. 2011;45:265–75. [Google Scholar]
- 16.Public Citizen Health Research Group v. Food and Drug Administration, 964 F Supp. 413 (DDC 1997).
- 17.Tetzlaff JM, Chan A-W, Kitchen J, Sampson M, Tricco A, Moher D. Guidelines for randomized clinical trial protocol content: a systematic review. Syst Rev. 2012;1:43. doi: 10.1186/2046-4053-1-43. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Chan A-W, Hróbjartsson A, Haahr MT, Gøtzsche PC, Altman DG. Empirical evidence for selective reporting of outcomes in randomized trials: comparison of protocols to published articles. JAMA. 2004;291:2457–65. doi: 10.1001/jama.291.20.2457. [DOI] [PubMed] [Google Scholar]
- 19.Smyth RM, Kirkham JJ, Jacoby A, Altman DG, Gamble C, Williamson PR. Frequency and reasons for outcome reporting bias in clinical trials: interviews with trialists. BMJ. 2011;342:c7153. doi: 10.1136/bmj.c7153. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Pildal J, Chan A-W, Hróbjartsson A, Forfang E, Altman DG, Gøtzsche PC. Comparison of descriptions of allocation concealment in trial protocols and the published reports: cohort study. BMJ. 2005;330:1049. doi: 10.1136/bmj.38414.422650.8F. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Mhaskar R, Djulbegovic B, Magazin A, Soares HP, Kumar A. Published methodological quality of randomized controlled trials does not reflect the actual quality assessed in protocols. J Clin Epidemiol. 2012;65:602–9. doi: 10.1016/j.jclinepi.2011.10.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Hróbjartsson A, Pildal J, Chan A-W, Haahr MT, Altman DG, Gøtzsche PC. Reporting on blinding in trial protocols and corresponding publications was often inadequate but rarely contradictory. J Clin Epidemiol. 2009;62:967–73. doi: 10.1016/j.jclinepi.2009.04.003. [DOI] [PubMed] [Google Scholar]
- 23.Scharf O, Colevas AD. Adverse event reporting in publications compared with sponsor database for cancer clinical trials. J Clin Oncol. 2006;24:3933–8. doi: 10.1200/JCO.2005.05.3959. [DOI] [PubMed] [Google Scholar]
- 24.Chan A-W, Hróbjartsson A, Jørgensen KJ, Gøtzsche PC, Altman DG. Discrepancies in sample size calculations and data analyses reported in randomized trials: comparison of publications with protocols. BMJ. 2008;337:a2299. doi: 10.1136/bmj.a2299. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Al-Marzouki S, Roberts I, Evans S, Marshall T. Selective reporting in clinical trials: analysis of trial protocols accepted by The Lancet [Letter] Lancet. 2008;372:201. doi: 10.1016/S0140-6736(08)61060-0. [DOI] [PubMed] [Google Scholar]
- 26.Hernández AV, Steyerberg EW, Taylor GS, Marmarou A, Habbema JD, Maas AI. Subgroup analysis and covariate adjustment in randomized clinical trials of traumatic brain injury: a systematic review. Neurosurgery. 2005;57:1244–53. doi: 10.1227/01.neu.0000186039.57548.96. [DOI] [PubMed] [Google Scholar]
- 27.Gøtzsche PC, Hróbjartsson A, Johansen HK, Haahr MT, Altman DG, Chan A-W. Constraints on publication rights in industry- initiated clinical trials [carta] JAMA. 2006;295:1645–6. doi: 10.1001/jama.295.14.1645. [DOI] [PubMed] [Google Scholar]
- 28.Gøtzsche PC, Hróbjartsson A, Johansen HK, Haahr MT, Altman DG, Chan A-W. Ghost authorship in industry-initiated randomised trials. PLoS Med. 2007;4:e19. doi: 10.1371/journal.pmed.0040019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Lundh A, Krogsbøll LT, Gøtzsche PC. Access to data in industry-sponsored trials [Letter] Lancet. 2011;378:1995–6. doi: 10.1016/S0140-6736(11)61871-0. [DOI] [PubMed] [Google Scholar]
- 30.Hopewell S, Dutton S, Yu LM, Chan A-W, Altman DG. The quality of reports of randomised trials in 2000 and 2006: comparative study of articles indexed in PubMed. BMJ. 2010;340:c723. doi: 10.1136/bmj.c723. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Chan A-W, Tetzlaff JM, Gøtzsche PC, Altman DG, Mann H, Berlin JA, et al. SPIRIT 2013 explanation and elaboration: guidance for protocols of clinical trials. BMJ. 2013;346:e7586. doi: 10.1136/bmj.e7586. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Moher D, Schulz KF, Simera I, Altman DG. Guidance for developers of health research reporting guidelines. PLoS Med. 2010;7:e1000217. doi: 10.1371/journal.pmed.1000217. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Tetzlaff JM, Moher D, Chan A-W. Developing a guideline for clinical trial protocol content: Delphi consensus survey. Trials. 2012;13:176. doi: 10.1186/1745-6215-13-176. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.World Medical Association. [Acceso el 1 de octubre de 2012];WMA Declaration of Helsinki-Ethical Principles for Medical Research Involving Human Subjects. Disponible en www.wma.net/en/30publications/10policies/b3/index.html.
- 35.International Conference on Harmonisation. ICH Harmonised Tripartite Guideline: General Considerations for Clinical Trials: E8. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use; 17de julio de 1997; [Acceso el 1 de octubre de 2012]. Disponible en www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E8/Step4/E8_Guideline.pdf. [Google Scholar]
- 36.International Conference on Harmonisation. ICH Harmonised Tripartite Guideline: Statistical Principles for Clinical Trials: E9. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use; 5 de febrero de 1998; [Acceso el 1 de octubre de 2012]. Disponible en www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E9/Step4/E9_Guideline.pdf. [Google Scholar]
- 37.International Conference on Harmonisation. ICH Harmonised Tripartite Guideline: Guideline for Good Clinical Practice: E6. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use; 10 June 1996; [Acceso el 1 de octubre de 2012]. Disponible en www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E6_R1/Step4/E6_R1__Guideline.pdf. [Google Scholar]
- 38.Grimes DA, Hubacher D, Nanda K, Schulz KF, Moher D, Altman DG. The Good Clinical Practice guideline: a bronze standard for clinical research. Lancet. 2005;366:172–4. doi: 10.1016/S0140-6736(05)66875-4. [DOI] [PubMed] [Google Scholar]
- 39.Sim I, Chan A-W, Gülmezoglu AM, Evans T, Pang T. Clinical trial registration: transparency is the watchword. Lancet. 2006;367:1631–3. doi: 10.1016/S0140-6736(06)68708-4. [DOI] [PubMed] [Google Scholar]
- 40.Laine C, De Angelis C, Delamothe T, Drazen JM, Frizelle FA, Haug C, et al. Clinical trial registration: looking back and moving ahead [artículo editorial] Ann Intern Med. 2007;147:275–7. doi: 10.7326/0003-4819-147-4-200708210-00166. [DOI] [PubMed] [Google Scholar]
- 41.Expanded Clinical Trial Registry Data Bank; Food and Drug Administration Amendments Act of 2007, HR 2580, 110th Congress, 1st Sess, Title VIII, §801; 2007. [Acceso el 1 de octubre de 2012]. Disponible en www.govtrack.us/congress/billtext.xpd?bill_h110-3580. [Google Scholar]
- 42.Comisión Europea. Comunicación de la Comisión relativa a la directriz sobre los campos de datos que figuran en la base de datos de ensayos clínicos prevista en el artículo 11 de la Directiva 2001/20/CE y que deben incluirse en la base de datos sobre medicamentos prevista en el artículo 57 del Reglamento (CE) nº No 726/2004 (2008/C 168/02) Diario Oficial de la Unión Europea. 2008;51:3–4. [Google Scholar]
- 43.Schulz KF, Altman DG, Moher D CONSORT Group. CONSORT 2010 statement: updated guidelines for reporting parallel group randomized trials. Ann Intern Med. 2010;152:726–32. doi: 10.7326/0003-4819-152-11-201006010-00232. [DOI] [PubMed] [Google Scholar]
- 44.National Research Council. A National Cancer Clinical Trials System for the 21st Century: Reinvigorating the NCI Cooperative Group Program. Washington, DC: National Academies Pr; 2010. [PubMed] [Google Scholar]
- 45.Chan A-W. Out of sight but not out of mind: how to search for unpublished clinical trial evidence. BMJ. 2012;344:d8013. doi: 10.1136/bmj.d8013. [DOI] [PubMed] [Google Scholar]
- 46.Wieseler B, Kerekes MF, Vervoelgyi V, Mc-Gauran N, Kaiser T. Impact of document type on reporting quality of clinical drug trials: a comparison of registry reports, clinical study reports, and journal publications. BMJ. 2012;344:d8141. doi: 10.1136/bmj.d8141. [DOI] [PubMed] [Google Scholar]
- 47.Reveiz L, Chan A-W, Krleža-Jerić K, Granados CE, Pinart M, Etxeandia I, et al. Reporting of methodologic information on trial registries for quality assessment: a study of trial records retrieved from the WHO search portal. PLoS One. 2010;5:e12484. doi: 10.1371/journal.pone.0012484. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Dwan K, Altman DG, Cresswell L, Blundell M, Gamble CL, Williamson PR. Comparison of protocols and registry entries to published reports for randomized controlled trials. Cochrane Database Syst Rev. 2011:MR000031. doi: 10.1002/14651858.MR000031.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Dwan K, Altman DG, Arnaiz JA, Bloom J, Chan A-W, Cronin E, et al. Systematic review of the empirical evidence of study publication bias and outcome reporting bias. PLoS One. 2008;3:e3081. doi: 10.1371/journal.pone.0003081. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.GlaxoSmithKline. Public disclosure of clinical research. [Acceso el 1 de octubre de2012];Global Public Policy Issues. 2011 Octubre; Disponible en www.gsk.com/policies/GSK-on-disclosure-of-clinical-trial-information.pdf.
- 51.Turner L, Shamseer L, Altman DG, Schulz KF, Moher D. Does use of the CONSORT Statement impact the completeness of reporting of randomised controlled trials published in medical journals? A Cochrane review. Syst Rev. 2012;1:60. doi: 10.1186/2046-4053-1-60. [DOI] [PMC free article] [PubMed] [Google Scholar]