Résumé
L’objectif de cette étude était de valider la version francophone de l’échelle composite multidimensionnelle de douleur UNESP-Botucatu (MCPS-Fr) chez les chats. Deux vétérinaires et une étudiante de médecine vétérinaire francophones ont identifié trois catégories de comportements distincts sur des vidéos : «les changements psychomoteurs», «la protection de la région douloureuse» et «les variables physiologiques». La cohérence interne était excellente (score total du coefficient alpha de Cronbach était de 0,94; 0,90; et 0,61, respectivement). La bonne concordance entre les évaluations à l’aveugle des observateurs et l’évaluateur de référence confirme la validité de cet instrument. La fiabilité inter- et intra-évaluateur était bonne à très bonne. Le point limite optimal pour l’analgésie de secours, identifié avec une courbe ROC, était au-delà de 7 (échelle allant de 0 à 30 points), avec une sensibilité de 97,8 % et une spécificité de 99,1 %. La MCPS-Fr est un outil valide et sensible pour l’évaluation de la douleur aiguë chez les chattes ayant subi une ovariohystérectomie.
Abstract
Validation of the French version of the UNESP-Botucatu multidimensional composite pain scale for assessing postoperative pain in cats. The aim of this study was to validate the French version of the UNESP-Botucatu multidimensional composite pain scale (MCPS-Fr) to assess postoperative pain in cats. Two veterinarians and one DVM student identified three domains of behavior based on video analyses: “psychomotor change”, “protection of the painful area” and “physiological variables”. Internal consistency was excellent (Cronbach’s alpha coefficient of 0.94, 0.90 and 0.61, respectively). Criterion validity was good to very good when evaluations from the three observers were compared with a “gold standard”. Inter- and intra-rater reliability for each scale item were good to very good. The optimal cut-off point identified with a ROC curve was > 7 (scale range 0–30 points), with a sensitivity of 97.8% and specificity of 99.1%. The MCPS-Fr is a valid, reliable and responsive instrument for assessing acute pain in cats undergoing ovariohysterectomy.
(Translated by Dr. Beatriz Monteiro)
Introduction
Reconnaitre la douleur est un élément crucial en pratique vétérinaire (1). L’évaluation de la douleur est basée sur l’appréciation adéquate des changements de comportement en présence de douleur chez les chats (2). Des échelles de douleur ont été développées et validées en tant qu’instruments subjectifs pour évaluer la douleur clinique dans cette espèce (2–7). L’échelle de douleur composite UNESP-Botucatu (2–6) ainsi qu’un instrument de mesure composite basé uniquement sur le comportement (7), tiennent compte de différentes catégories telles que la posture, le confort, l’activité, et parfois des variables physiologiques (MCPS seulement). Ces systèmes fournissent un «point limite» pour l’analgésie interventionnelle (ou de secours) qui permet d’orienter la thérapie en contexte clinique. La MCPS a initialement été développée en portugais du Brésil (MCPS-Port), mais a également été validée en anglais (MCPS-Angl) et en espagnol (MCPS-Esp) (2–6).
Étant donné qu’un instrument doit être validé lorsqu’il est traduit dans une autre langue pour prendre en considération d’éventuelles différences culturelles (8–9), le but de cette étude était de procéder à la validation psychométrique de la MCPS en langue française (MCPS-Fr) à l’aide d’analyses de vidéos, tout en suivant les lignes directrices internationales pour la validation interculturelle (9–12). Les auteurs ont formulé l’hypothèse que la validité et la fiabilité de la version francophone de cet instrument seraient similaires aux caractéristiques de la MCPS en anglais et en espagnol.
Matériels et méthodes
Traduction, traduction inverse et équivalence sémantique
Tout d’abord, l’échelle de douleur a été traduite par deux traducteurs indépendants et francophones (MM et AML), à partir de la version anglophone de l’UNESP-Botucatu-MCPS (2). Ensuite, les deux versions ont été mises en commun par une tierce personne francophone (ET). Cette version a été traduite à nouveau en anglais par une traductrice indépendante (DF) parfaitement bilingue et sans accès à la version originale anglaise. La traduction anglophone a été comparée à l’échelle d’origine afin de déterminer si elles étaient comparables en termes de contenu (PS). Quelques ajustements mineurs ont été apportés par trois évaluateurs bilingues (PS, ET et BM) sur la MCPS-Fr basés sur la comparaison entre les deux échelles en anglais (Annexe 1) afin de maintenir une équivalence sémantique maximale.
Annexe 1.
Version française de l’échelle de douleur composite multidimensionnelle UNESP-Botucatu
| Sous échelle 1 : CHANGEMENTS PSYCHOMOTEURS (0–12) | ||
|
| ||
| Posture | • Le chat est dans une position naturelle avec des muscles relâchés (bouge normalement) | 0 |
| • Le chat est dans une position naturelle mais tendu (il bouge peu ou est réticent à bouger) | 1 | |
| • Le chat est assis ou en décubitus sternal avec un dos arqué et la tête basse; ou le chat est en décubitus dorso-latéral avec les membres pelviens étendus ou contractés | 2 | |
| • Le chat change fréquemment de position dans le but de trouver une posture confortable | 3 | |
| Confort | • Le chat est confortable, éveillé ou endormi et interagit lorsque stimulé (il interagit avec l’observateur et/ou est intéressé par son environnement) | 0 |
| • Le chat est tranquille et légèrement réceptif lorsque stimulé (il interagit peu avec l’observateur et/ou n’est pas vraiment intéressé à son environnement) | 1 | |
| • Le chat est tranquille et est «dissocié de son environnement» (même lorsque stimulé, il n’interagit pas avec l’observateur et/ou n’est pas intéressé à son environnement). Le chat peut faire face à l’arrière de la cage | 2 | |
| • Le chat est inconfortable, agité (change fréquemment de position) et est légèrement réceptif lorsque stimulé, ou est dissocié de son environnement. Le chat peut faire face à l’arrière de la cage | 3 | |
| Activité | • Le chat bouge normalement (il bouge immédiatement lorsque la cage est ouverte; en dehors de la cage, il bouge spontanément lorsque stimulé ou manipulé) | 0 |
| • Le chat bouge plus que la normale (à l’intérieur de la cage, il bouge continuellement d’un côté à l’autre) | 1 | |
| • Le chat est plus calme que la normale (il peut hésiter à sortir de la cage et tend à y retourner s’il y est retiré. En dehors de la cage, il bouge un peu après stimulation ou manipulation) | 2 | |
| • Le chat est réticent à bouger (il peut hésiter à sortir de la cage et tend à y retourner s’il y est retiré. En dehors de la cage, il ne bouge pas même après stimulation ou manipulation) | 3 | |
| Attitude | Observer et noter la présence d’états mentaux définis ci-dessous | |
| A — Satisfait : Le chat est alerte et intéressé par son environnement (explore son environnement), il est amical et interagit avec l’observateur (joue et/ou répond au stimulus) * Le chat peut au début interagir avec l’observateur par des jeux afin de se distraire de la douleur. Observer attentivement afin de discerner une réponse au jeu par distraction (de la douleur) plutôt que par satisfaction |
A | |
| B — Désintéressé : Le chat n’interagit pas avec l’observateur (n’est pas intéressé par des jouets ou joue peu, ne répond pas aux appels ni aux caresses de l’observateur) * Chez le chat qui n’aime pas jouer, évaluer l’interaction avec l’observateur par sa réponse aux appels et aux caresses |
B | |
| C — Indifférent : Le chat n’est pas intéressé par son environnement (il n’est pas curieux; il n’explore pas son environnement) * Le chat peut être effrayé d’explorer son environnement au début. L’observateur doit manipuler le chat et l’encourager à bouger de lui-même (en le prenant hors de la cage et/ou en le changeant de position) |
C | |
| D — Anxieux : Le chat est effrayé (il essaie de fuir ou de se cacher) ou nerveux (démontre de l’impatience et grogne, gémit ou crache lorsque caressé ou manipulé) | D | |
| E — Agressif : Le chat est agressif (il essaie de mordre ou de griffer lorsque caressé ou manipulé) | E | |
| • Présence de l’état mental A | 0 | |
| • Présence de l’un des états mentaux B, C, D ou E | 1 | |
| • Présence de deux des états mentaux B, C, D ou E | 2 | |
| • Présence de trois des états mentaux B, C, D ou E | 3 | |
| Comportements divers | Observer et noter la présence de comportements définis ci-dessous : | |
| A — Le chat est couché et tranquille, mais il remue la queue | A | |
| B — Le chat contracte et étire ses membres pelviens et/ou contracte ses muscles abdominaux (flanc) | B | |
| C — Le chat a les yeux pratiquement fermés (yeux mi-clos) | C | |
| D — Le chat lèche et/ou mord la plaie chirurgicale | D | |
| • Aucun des comportements ci-haut n’est présent | 0 | |
| • Présence d’un de ces comportements | 1 | |
| • Présence de deux de ces comportements | 2 | |
| • Présence de trois ou de tous ces comportements | 3 | |
| Vocalisation | • Le chat est tranquille, il ronronne lorsque stimulé ou miaule en interagissant avec l’observateur. Le chat ne grogne pas, ne gémit pas et ne crache pas | 0 |
| • Le chat ronronne spontanément (sans être stimulé ou manipulé par l’observateur) | 1 | |
| • Le chat grogne, gémit ou crache lorsque manipulé par l’observateur (lorsque la position de l’animal est changée par l’observateur) | 2 | |
| • Le chat grogne, gémit ou crache spontanément (sans être stimulé ou manipulé par l’observateur) | 3 | |
|
| ||
| Sous échelle 2 : PROTECTION DE LA RÉGION DOULOUREUSE (0–12) | ||
|
| ||
| Réaction à la palpation de la plaie chirurgicale | • Le chat ne réagit pas lorsque la plaie chirurgicale est touchée ou pressée; ou il n’y a aucun changement par rapport à la réponse pré-chirurgicale (si une évaluation initiale a été effectuée) | 0 |
| • Le chat ne réagit pas lorsque la plaie chirurgicale est touchée, cependant il réagit lorsque la plaie est pressée. Il peut vocaliser et/ou tenter de mordre | 1 | |
| • Le chat réagit lorsque la plaie chirurgicale est touchée et pressée. Il peut vocaliser et/ou tenter de mordre | 2 | |
| • Le chat réagit lorsque l’observateur approche la plaie chirurgicale. Il peut vocaliser et/ou tenter de mordre. Le chat ne permet pas la palpation de la plaie chirurgicale | 3 | |
| Réaction à la palpation de l’abdomen/flanc | • Le chat ne réagit pas lorsque l’abdomen/flanc est touché ou pressé; ou il n’y a aucun changement par rapport à la réponse pré-chirurgicale (si une évaluation initiale a été effectuée). L’abdomen/flanc n’est pas tendu | 0 |
| • Le chat ne réagit pas lorsque l’abdomen/flanc est touché, cependant il réagit lorsque l’abdomen/flanc est pressé. L’abdomen/flanc est tendu |
1 | |
| • Le chat réagit lorsque l’abdomen/flanc est touché et pressé. L’abdomen/flanc est tendu | 2 | |
| • Le chat réagit lorsque l’observateur approche de l’abdomen/flanc. Le chat peut vocaliser et/ou tenter de mordre. Il ne permet pas la palpation de son abdomen/flanc | 3 | |
|
| ||
| Sous échelle 3 : VARIABLES PHYSIOLOGIQUES (0–6) | ||
|
| ||
| Pression artérielle | • 0 % à 15 % au-dessus de la valeur pré-chirurgicale | 0 |
| • 16 % à 29 % au-dessus de la valeur pré-chirurgicale | 1 | |
| • 30 % à 45 % au-dessus de la valeur pré-chirurgicale | 2 | |
| • > 45 % au-dessus de la valeur pré-chirurgicale | 3 | |
| Appétit | • Le chat mange normalement | 0 |
| • Le chat mange plus que la normale | 1 | |
| • Le chat mange moins que la normale | 2 | |
| • Le chat n’est pas intéressé par la nourriture | 3 | |
| SCORE TOTALE (0–30) | ||
|
| ||
| Directives pour l’usage de l’échelle | ||
|
| ||
| Débuter par observer le comportement du chat sans ouvrir la cage. Observer s’il est au repos ou actif, intéressé ou non par son environnement, calme ou vocalisant. Vérifier la présence de comportements spécifiques (voir «Comportements divers» ci-haut). Ouvrir la cage et observer si le chat sort rapidement de la cage ou hésite à quitter la cage. Approcher le chat et évaluer sa réaction : amicale, agressive, effrayée, indifférente ou vocalisant. Toucher le chat et interagir avec lui, vérifier s’il est réceptif (s’il apprécie être caressé et/ou s’il est intéressé à jouer). Si le chat hésite à quitter la cage, encourager le chat à bouger en le stimulant (appeler-le par son nom, caresser-le) et manipuler le chat en changeant sa position et/ou en le sortant de sa cage. Observer le chat hors de la cage, s’il bouge spontanément de manière réservée ou avec réticence. Offrez-lui de la nourriture appétissante et observer sa réponse.* Finalement, placer le chat en décubitus latéral ou sternal et mesurer sa pression artérielle. Évaluer la réaction du chat lorsque l’abdomen/flanc est touché (glisser vos doigts sur la région) et qu’une pression délicate est appliquée (appliquer la pression directement sur la région). Attendre un moment et répéter la même procédure pour apprécier la réaction du chat à la palpation de la plaie chirurgicale. | ||
Pour évaluer l’appétit durant la période post-opératoire immédiate, débuter par offrir une petite quantité de nourriture appétissante immédiatement après le réveil anesthésique. À ce moment, la plupart des chats mangent normalement indépendamment de la présence ou non de douleur. Attendre un moment, puis offrir de nouveau de la nourriture et observer la réaction du chat.
Analyse audiovisuelle
Pour cette partie, les enregistrements («vidéos») utilisés ont été ceux obtenus lors de l’étude de la validation de l’échelle de douleur (5).
Trente chattes de race croisée ont subi une ovariohystérectomie (OVH) via une approche ventrale sur la ligne blanche (13). Les données détaillées de la population étudiée ont été rapportées lors de l’étude originale (13). Les comportements observés et interactifs ont été enregistrés à quatre moments spécifiques de la période périopératoire : T1 «préopératoire» (entre 18 et 24 heures précédant la chirurgie), T2 «entre 30 minutes et une heure après la fin de la chirurgie et avant l’administration d’analgésiques additionnels», T3 «environ quatre heures après l’analgésie postopératoire» et T4 «environ 24 heures après la fin de la chirurgie». Les vidéos ont été randomisées pour assurer l’évaluation à l’aveugle par les observateurs. Un total de 27 vidéos ont été regardées de façon indépendante par un groupe de trois francophones du même genre (une étudiante vétérinaire [AML], une candidate au doctorat [BM] et une vétérinaire comportementaliste certifiée [DF]) et l’évaluation de la douleur a été réalisée en utilisant la MCPS-Fr. Les évaluatrices étaient à l’aveugle, et ne savaient pas à quel moment de la période péri-opératoire, les enregistrements avaient été effectués.
Validité de construit — Analyse factorielle
L’analyse des principaux critères composant l’échelle en français a été effectuée sur la moyenne des appréciations données par les trois évaluatrices à l’aide de la rotation des axes factoriels (varimax). Cette information, ainsi que les critères de Kaiser, ont permis d’évaluer la structure interne de l’échelle; les facteurs de l’échelle ayant une valeur propre (eigenvalue) supérieure à 1 ont ainsi été sélectionnés (14).
Validité de construit
La validité de construit — La réactivité (un élément de sensibilité) a été évaluée en testant les hypothèses suivantes : 1) Si l’échelle mesure effectivement la douleur, le niveau de douleur obtenu en période post-opératoire avant l’administration d’analgésiques (T2) devrait être plus grand que celui obtenu en période préopératoire (T1); 2) la douleur post-opératoire avant l’administration d’analgésiques (T2) devrait être plus forte qu’après l’administration d’analgésiques (T3); 3) l’intensité de la douleur aiguë devrait diminuer dans le temps (entre T3 et T4). La médiane et l’étendue ont été calculées sur l’ensemble des résultats et une comparaison statistique a été réalisée à l’aide du test de Wilcoxon pour séries appariées (P < 0,05).
Validité de critère — Analyse convergente par comparaison avec un observateur de référence
La validité de critère — Convergence a été réalisée en évaluant la concordance entre les résultats obtenus par les observateurs précédents et ceux obtenus par l’observateur de référence JTB) qui avait procédé à l’évaluation en direct du patient. Le degré de concordance a été déterminé par l’importance du coefficient Kappa avec un intervalle de confiance de 95 % (15). La classification d’Altman a été utilisée afin d’interpréter ce coefficient, soit : 0,81–1,00 pour un accord presque parfait (très bon); 0,61–0,80 pour un accord important (bon); 0,41–0,6 pour un accord modéré; 0,21–0,4 pour un accord passable et < 0,2 pour un accord faible (16).
Fiabilité — Cohérence interne
La cohérence interne de l’échelle francophone de douleur a été évaluée à l’aide du coefficient alpha de Cronbach (17). Le coefficient a été calculé pour l’ensemble de l’échelle et pour chacune des catégories identifiées par l’analyse factorielle. Les coefficients supérieurs à 0,7 ont été considérés comme étant acceptables.
Fiabilité intra-observateur
Pour évaluer la fiabilité intra-observateur, une deuxième analyse audiovisuelle a été faite par les mêmes trois observatrices que la première fois, mais deux mois plus tard. La séquence des vidéos pour chacun des chats avait été modifiée (randomisée) afin de ne pas influencer les résultats. Par la suite, les résultats ont été analysés tel que mentionné dans la section «fiabilité inter-observateur».
Fiabilité inter-observateur
La concordance des résultats entre les différents observateurs a été évaluée en utilisant le coefficient de concordance intra-classe avec un intervalle de confiance de 95 % (18). Les coefficients ont été calculés pour chaque élément contenu dans l’échelle à chaque temps donné. Les résultats ainsi obtenus ont été interprétés à l’aide de la classification d’Altman, qui a précédemment été présentée.
Point limite pour l’analgésie de secours
Pour identifier le score minimal auquel un animal devrait recevoir une thérapie analgésique, les observateurs devaient identifier les chattes qui auraient nécessité des analgésiques additionnels à la fin de chaque vidéo. Les scores de douleur ont été résumés à la médiane et à la plage de variation. Le test signé des rangs de Wilcoxon a été utilisé pour fin de comparaisons statistiques (P < 0,05). Le point limite permettant de déterminer si l’administration d’un analgésique était nécessaire a été déterminé à l’aide d’une courbe «ROC» (receiver operating characteristic) (12). Pour chaque point limite, la sensibilité et la spécificité ont été calculées. Les différentes sensibilités ont ensuite été portées en ordonnée sur un graphique avec les pourcentages de faux positifs (1-spécificité) placés en abscisse. L’aire sous la courbe représente alors la capacité discriminatoire de l’échelle de la douleur. L’aire sous la courbe se situe théoriquement entre les valeurs de 0,5 (non discriminatoire) et 1,0 (parfaitement discriminatoire) avec des valeurs entre 0,50 et 0,70 (faiblement discriminatoire), 0,70 et 0,90 (modérément discriminatoire) et plus de 0,9 (fortement discriminatoire).
Résultats
Validité de construit — Analyse factorielle
Les analyses des principaux facteurs de la MCPS-Fr sont présentées au tableau 1. L’analyse factorielle de la version francophone a identifié 3 facteurs ayant des valeurs propres de 4,24; 2,32 et 1,50. Le facteur 1 a permis d’expliquer 42,4 % de la variance et a été dénommé «Changement psychomoteur». Ce paramètre inclut la posture, le confort, l’activité, l’attitude, la vocalisation et divers comportements. Le facteur 2 comptait pour 23,2 % de la variance et représentait la dimension de «Protection de la région douloureuse», qui regroupait la réaction à la palpation de la plaie chirurgicale ainsi que la réaction à la palpation de l’abdomen/du flanc. Le facteur 3, composé des variables de pression sanguine et d’appétit, a été nommé «Variables physiologiques» et contribuait à 15,0 % de la variance totale.
Tableau 1.
Résultats de l’analyse factorielle de la version française de l’échelle UNESP-Botucatu-MCPS
| Facteur de charge* | ||||
|---|---|---|---|---|
|
|
||||
| Item | Facteur 1 | Facteur 2 | Facteur 3 | Communalité† |
| Posture | 0,878‡ | 0,239 | 0,151 | 0,851 |
| Confort | 0,875‡ | 0,192 | 0,167 | 0,830 |
| Activité | 0,891‡ | 0,091 | 0,235 | 0,858 |
| Attitude | 0,823‡ | 0,258 | 0,274 | 0,819 |
| Comportements divers | 0,832‡ | 0,256 | 0,214 | 0,803 |
| Réaction à la palpation de la plaie chirurgicale | 0,187 | 0,900‡ | 0,119 | 0,859 |
| Réaction à la palpation de l’abdomen/flanc | 0,199 | 0,928‡ | 0,049 | 0,902 |
| Appétit | 0,231 | 0,044 | 0,913‡ | 0,888 |
| Vocalisation | 0,498‡ | 0,471 | 0,377 | 0,612 |
| Pression artérielle | 0,409 | 0,437 | 0,535‡ | 0,644 |
| Eigenvalue | 4,24 | 2,32 | 1,50 | NA |
| Variance (%) | 42,4 | 23,2 | 15,0 | NA |
| Variance accumulée (%) | 42,4 | 65,6 | 80,6 | NA |
L’analyse a été faite par la méthode d’extraction de composante principale et la rotation des axes factoriels (varimax) avec le critère de Kaiser.
Facteur de charge représente la corrélation entre les variables et facteurs.
Communalité représente la proportion de la variance de chaque item qui peut être expliqué par le facteur.
Item a été sensiblement chargé pour le facteur.
NA = Non applicable.
Validité de construit — Réactivité
L’analyse des facteurs a confirmé la nature multidimensionnelle de l’échelle et, par conséquent, la validité de construit a été déterminée pour le score total ainsi que pour le score partiel, lesquels étaient significativement augmentés à T2 (après la chirurgie, mais avant l’analgésie postopératoire) lorsque comparés à T1 (période préopératoire). Les scores étaient significativement diminués après l’analgésie de secours (T2 vs. T3) et au fil du temps entre T2 et T4 (Tableau 2).
Tableau 2.
Scores totaux et partiels de douleur déterminée par des observateurs en aveugles et l’observateur de référence — analyse de vidéos
| Période périopératoire | Scores de douleur | Observateur de référence | Observateurs en aveugle | ||
|---|---|---|---|---|---|
|
| |||||
| Observateur 1 | Observateur 2 | Observateur 3 | |||
| T1 préopératoire | Total (0–30) | 0,0 (5,0) | 0,0 (5,0) | 0,0 (4,0) | 1,0 (7,0) |
| Sous-échelle 1 (0–18) | 0,0 (5,0) | 0,0 (5,0) | 0,0 (4,0) | 0,0 (6,0) | |
| Sous-échelle 2 (0–6) | 0,0 (0,0) | 0,0 (0,0) | 0,0 (0,0) | 0,0 (0,0) | |
| Sous-échelle 3 (0–6) | 0,0 (0,0) | 0,0 (1,0) | 0,0 (2,0) | 0,0 (1,0) | |
| T2 post-opératoire : avant analgésie de secours | Total (0–30) | 20,5 (14,0)* | 21,0 (18,0)* | 20,0 (14,0)* | 17,0 (15,0)* |
| Sous-échelle 1 (0–18) | 14,0 (9,0)* | 14,0 (12,0)* | 14,0 (9,0)* | 12,0 (10,0)* | |
| Sous-échelle 2 (0–6) | 4,0 (6,0)* | 3,0 (6,0)* | 4,0 (6,0)* | 3,0 (6,0)* | |
| Sous-échelle 3 (0–6) | 3,0 (6,0)* | 3,0 (6,0)* | 2,0 (6,0)* | 3,0 (6,0)* | |
| T3 post-opératoire : après analgésie de secours | Total (0–30) | 0,0 (6,0)† | 1,0 (5,0)† | 1,0 (4,0)† | 1,0 (7,0)† |
| Sous-échelle 1 (0–18) | 0,0 (5,0)† | 0,0 (3,0)† | 0,0 (4,0)† | 0,0 (6,0)† | |
| Sous-échelle 2 (0–6) | 0,0 (1,0)† | 0,0 (1,0)† | 0,0 (1,0)† | 0,0 (0,0)† | |
| Sous-échelle 3 (0–6) | 0,0 (2,0)† | 0,0 (2,0)† | 0,0 (2,0)† | 1,0 (3,0)† | |
| T4 post-opératoire : 24 heures après la fin de la chirurgie | Total (0–30) | 4,0 (14,0)† | 4,0 (13,0)† | 3,0 (16,0)† | 3,0 (12)† |
| Sous-échelle 1 (0–18) | 0,0 (8,0)† | 1,0 (8,0)† | 0,0 (10,0)† | 0,0 (7,0)† | |
| Sous-échelle 2 (0–6) | 2,0 (4,0)† | 2,0 (5,0)† | 2,0 (5,0)† | 2,0 (4,0)† | |
| Sous-échelle 3 (0–6) | 0,0 (2,0)† | 0,0 (3,0)† | 0,0 (2,0)† | 0,0 (3,0)† | |
Médiane et la fourchette des scores totaux et partiels de douleur déterminée par observateurs en aveugles et l’observateur de référence et basée sur l’analyse de vidéo enregistrée à 4 points spécifiques durant la période périopératoire chez les chattes subissant une ovariohystérectomie.
Scores de douleur à T2 était sensiblement plus élevé que T1 (P < 0,001).
Scores de douleur à T3 et T4 étaient sensiblement plus bas que T2 (P < 0,001).
Sous-échelle 1 : posture, confort, activité, attitude, comportements divers et vocalisation.
Sous-échelle 2 : réaction à la palpation de la plaie chirurgicale et réaction à la palpation de l’abdomen/flanc.
Sous-échelle 3 : pression artérielle et appétit.
Validité de critère — Convergence par comparaison avec un observateur de référence
À toutes les périodes d’évaluation péri-opératoire, l’accord entre les observateurs et l’observateur de référence, évalué par le coefficient kappa, était bon à très bon, et ce pour le score total et tous les éléments de l’échelle (Tableau 3). Seule l’étudiante vétérinaire (AML) avait un accord légèrement plus faible avec l’observateur de référence.
Tableau 3.
Accord entre les observateurs en aveugle et l’observateur de référence pour chaque item — analyse des vidéos
| Item | Observateur 1 (BM) | Observateur 2 (DF) | Observateur 3 (AML) |
|---|---|---|---|
| Posture | 0,90 (0,86–0,95) | 0,90 (0,86–0,94) | 0,96 (0,93–0,99) |
| Confort | 0,87 (0,80–0,94) | 0,88 (0,81–0,95) | 0,76 (0,67–0,86) |
| Activité | 0,89 (0,80–0,95) | 0,86 (0,80–0,94) | 0,85 (0,78–0,93) |
| Attitude | 0,90 (0,84–0,94) | 0,94 (0,89–0,98) | 0,73 (0,62–0,83) |
| Comportements divers | 0,97 (0,95–0,99) | 0,92 (0,88–0,96) | 0,97 (0,96–0,99) |
| Réaction à la palpation de la plaie chirurgicale | 0,97 (0,94–0,99) | 0,90 (0,84–0,96) | 0,91 (0,86–0,97) |
| Réaction à la palpation de l’abdomen/flanc | 0,88 (0,83–0,92) | 0,89 (0,82–0,95) | 0,83 (0,75–0,91) |
| Appétit | 0,84 (0,73–0,94) | 0,92 (0,85–0,99) | 0,75 (0,64–0,86) |
| Vocalisation | 0,84 (0,72–0,96) | 0,93 (0,87–0,98) | 0,84 (0,74–0,93) |
Accord entre les observateurs en aveugle et l’observateur de référence évaluée par le coefficient poids de kappa (IC à 95 %) pour chaque item contenu dans l’échelle à chaque temps donné (préopératoire, post-opératoire avant et après analgésie de secours, et 24 heures après la fin de la chirurgie).
Interprétation : 0,81–1,0 très bon; 0,61–0,80 bon; 0,41–0,6 modéré; 0,21–0,4 passable; < 0,2 faible.
Fiabilité — Cohérence interne
Le score total du coefficient alpha de Cronbach de l’échelle était de 0,918, ce qui indique une excellente cohérence interne. La cohérence interne des catégories 1 (Changements psychomoteurs) et 2 (Protection de la région douloureuse) était également excellente, soit 0,938 et 0,900, respectivement. La catégorie 3 (Variables physiologiques) démontrait une cohérence interne modérée, soit 0,608.
Fiabilités intra- et inter-observateur
Les résultats de la fiabilité intra-observateurs et inter-observateurs sont présentés aux tableaux 4 et 5, respectivement.
Tableau 4.
Fiabilité intra-observateur pour chaque item — analyse des vidéos
| Item | Observateur 1 (BM) | Observateur 2 (DF) | Observateur 3 (AML) |
|---|---|---|---|
| Posture | 0,90 (0,86–0,93) | 0,88 (0,83–0,92) | 0,94 (0,90–0,96) |
| Confort | 0,84 (0,78–0,89) | 0,92 (0,88–0,95) | 0,87 (0,78–0,89) |
| Activité | 0,91 (0,87–0,94) | 0,86 (0,80–0,91) | 0,83 (0,75–0,88) |
| Attitude | 0,85 (0,79–0,90) | 0,93 (0,89–0,91) | 0,87 (0,81–0,91) |
| Comportements divers | 0,98 (0,98–0,99) | 0,92 (0,88–0,94) | 0,98 (0,97–0,99) |
| Réaction à la palpation de la plaie chirurgicale | 0,91 (0,87–0,94) | 0,93 (0,89–0,95) | 0,90 (0,86–0,93) |
| Réaction à la palpation de l’abdomen/flanc | 0,88 (0,83–0,92) | 0,94 (0,92–0,96) | 0,95 (0,93–0,97) |
| Appétit | 0,73 (0,63–0,81) | 0,97 (0,96–0,98) | 0,77 (0,66–0,84) |
| Vocalisation | 0,88 (0,83–0,92) | 0,96 (0,94–0,97) | 0,88 (0,83–0,92) |
La fiabilité intra-évaluateur a été évaluée en utilisant le coefficient de concordance intra-classe (IC 95 %) pour chaque item contenu dans l’échelle à chaque temps donné (préopératoire, postopératoire avant et après analgésie de secours, et 24 heures après la fin de la chirurgie).
Interprétation : 0,81–1,0 très bon; 0,61–0,80 bon; 0,41–0,6 modéré; 0,21–0,4 passable; < 0,2 faible.
Tableau 5.
Fiabilité inter-observateur pour chaque item — analyse des vidéos
| Items | Fiabilité inter-observateur |
|---|---|
| Posture | 0,88 (0,84–0,91) |
| Confort | 0,76 (0,68–0,82) |
| Activité | 0,85 (0,78–0,93) |
| Attitude | 0,77 (0,69–0,83) |
| Comportements divers | 0,93 (0,90–0,95) |
| Réaction à la palpation de la plaie chirurgicale | 0,92 (0,89–0,94) |
| Réaction à la palpation de l’abdomen/flanc | 0,85 (0,80–0,89) |
| Appetite | 0,72 (0,61–0,80) |
| Vocalisation | 0,80 (0,74–0,85) |
La fiabilité inter-évaluateur a été évaluée en utilisant le coefficient de concordance intraclasse (IC 95 %) pour chaque item contenu dans l’échelle à chaque temps donné (préopératoire, post-opératoire avant et après analgésie de secours, et 24 heures après la fin de la chirurgie).
Interprétation : 0,81–1,0 très bon; 0,61–0,80 bon; 0,41–0,6 modéré; 0,21–0,4 passable; < 0,2 faible.
Point limite pour l’analgésie de secours
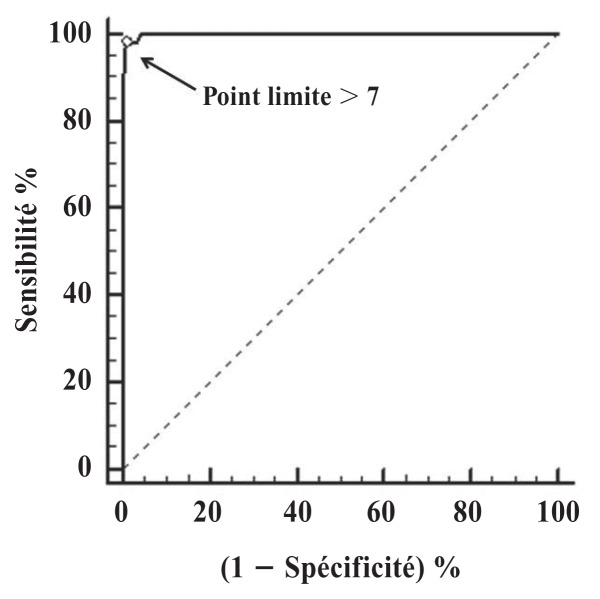
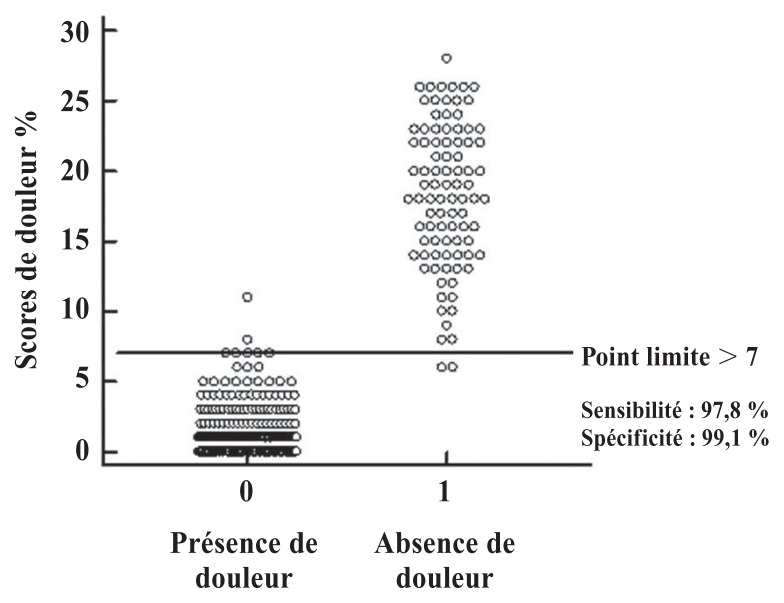
À partir de l’analyse de la courbe ROC, différents points limites ont été suggérés, mettant en évidence le point représenté simultanément par les plus grandes valeurs de sensibilité et de spécificité. Le point limite optimal identifié était > 7 points (échelle allant de 0 à 30 points), avec une sensibilité de 97,8 % (95 % IC : 92,2–99,7 %) et une spécificité de 99,1 % (95 % IC : 96,9–99,9 %). La grande aire sous la courbe (ASC ou AUC), soit 0,999 (95 % IC : 0,986–1,000; P < 0,0001) indique que l’instrument possède une excellente capacité discriminatoire (Figure 1 et 2). Ainsi, l’utilisation d’une analgésie supplémentaire est recommandée pour les scores ≥ 8 (0–30 points). Cela représente 26,6 % du score total maximal de l’échelle.
Figure 1.
Courbe ROC (receiver operating characteristic) démontrant le point limite optimal > 7 pour l’analgésie de secours (0–30 points), avec une sensibilité de 97,8 %, une spécificité de 99,1 % et aire sous la courbe de 0,999, basées sur l’analyse des vidéos enregistrée à 4 points spécifique durant la période périopératoire chez les chattes subissant une ovariohystérectomie.
Figure 2.
Illustration du point de limite optimal pour l’analgésie de secours identifié par l’analyse de la courbe ROC, basées sur l’analyse des vidéos enregistrée à 4 points spécifique durant la période périopératoire chez les chattes subissant une ovariohystérectomie.
Discussion
Cette étude a confirmé la structure multidimensionnelle de la MCPS-Fr et en a attesté la validité et la fiabilité lorsqu’elle est utilisée par des individus ayant une expérience différente pour évaluer la douleur aiguë chez des chattes ayant subi une OVH. De plus, nous sommes parvenus à déterminer une valeur au-dessus de laquelle l’administration d’analgésie de secours est recommandée, de manière similaire aux MCPS en anglais et en espagnol. La validité et la fiabilité de la MCPS-Fr étaient excellentes, à l’instar de la version en anglais (2) et de la version originale en portugais brésilien (3–4). Ces résultats sont en faveur de l’hypothèse stipulant que la traduction et l’adaptation culturelle de la version francophone étaient adéquates.
La validité de construit se penche sur la capacité d’un instrument à détecter des changements dans la construction, ce qui fournit l’évidence la plus solide pour la validation (19). Dans cette étude, la validité de construit a été évaluée au moyen d’une analyse factorielle ainsi que par un test de réactivité de réponse de la grille. L’analyse factorielle est communément utilisée pour étudier la structure interne d’un indice de santé qui comprend des composantes séparées, chacune reflétant un aspect différent de la santé. L’analyse factorielle peut également être utilisée dans la validation de construit en indiquant une association entre les composantes des mesures d’une sous-échelle, où des échelles mesurant différents sujets se rapporteraient sur des sous-échelles ou sur des facteurs différents (11). La MCPS-Fr était semblable à la MCPS-Ang et à la MCPS-Esp en ce qui concerne la validité de construit — analyse factorielle puisque toutes ont donné lieu à l’identification de trois facteurs, à la différence de la MCPS-Port qui a montré une solution à quatre facteurs. Cependant, les valeurs propres (eigenvalue) de la version francophone différaient de celles de la version anglophone. Pour cette première, les eigenvalues pour les facteurs 1, 2 et 3 étaient respectivement 4,24; 2,32 et 1,50; alors que pour cette dernière, ces valeurs étaient respectivement 3,07; 3,04 et 1,20. En raison de cela, les éléments de la version française ont été réorganisés en sous-échelles ou dimensions différentes. Chaque facteur ou sous-échelle pour chacune des versions de l’échelle était nommé différemment et contenait des points différents. Par exemple, le facteur 1 de la version française a été nommé «Changements psychomoteurs» et comprenait posture, confort, activité, attitude, vocalisation et comportements variés, alors que le facteur 1 de la version anglaise a été nommé «Expression de la douleur» et comprenait comportements variés, réaction à la palpation de la plaie de chirurgie, réaction à la palpation de l’abdomen/du flanc et vocalisation. Les critères «réaction à la palpation de la plaie de chirurgie» et «réaction à la palpation de l’abdomen/du flanc» ont été inclus au facteur 2 de la version française nommé «Protection de la région douloureuse», ce qui était similaire au facteur 2 identifié dans la MCPS-Port (3). Indépendamment des items compris dans chaque sous-échelle, il a été suggéré qu’une structure à trois facteurs serait plus appropriée que la structure à 4 facteurs de l’échelle originale en portugais (3).
La validité de construit — Réactivité a aussi été testée selon les hypothèses que le temps et l’intervention (chirurgie, administration d’analgésiques) modifieraient le score de douleur. Les changements dans les scores au fur et à mesure du temps ont déjà été utilisés en médecine vétérinaire pour valider des échelles de la douleur (20–21), tandis que les changements dans les scores de la douleur suite à une intervention sont décrits pour les patients pédiatriques (22–23). À l’instar des résultats de validation de la MCPS-Ang et de la MCPS-Esp, les scores de douleur totaux et pour chaque sous-échelle ont augmenté suite à la chirurgie et ont diminué après l’analgésie postopératoire ainsi qu’avec le temps, ce qui supporte la validité de construit.
La validité de critère — Convergence permet d’établir la validité d’un instrument de mesure en le comparant avec un critère externe et, dans la présente étude, elle a été déterminée en examinant l’accord entre les scores de douleur enregistrés par les observateurs et ceux de l’observateur de référence, tel que rapporté précédemment (2,24). L’observateur de référence considéré était le chercheur ayant développé l’échelle et qui possède une grande expertise en évaluation de la douleur féline. Tous les éléments ont démontré un accord allant de bon à très bon, confirmant la validité de convergence, même lorsqu’un individu avec moins d’expérience était inclus (étudiante vétérinaire). Cette dernière a suivi la formation sur l’évaluation de la douleur telle qu’offerte sur le site web www.animalpain.com.br. L’échelle peut donc être utilisée en toute confiance par des étudiants, par exemple, à condition qu’ils aient suivi une formation. Un tel accord s’est avéré supérieur à ce qui avait été observé pour la MCPS-Ang et pour la MCPS-Port, où chaque paramètre tel que le confort, l’attitude, l’activité et l’appétit avaient un accord moyen; et similaire à la MCPS-Esp. Ces différences pourraient être reliées au nombre d’observateurs dans chaque étude, qui contribuerait à augmenter la variabilité. Cinq observateurs distincts avec une expérience et une formation différentes ont été utilisés pour valider la MCPS-Ang et la MCPS-Esp. De plus, la validation en français ne comprenait pas de véritable étude clinique puisqu’elle reposait sur l’évaluation de vidéos. Ceci constitue une limite à l’application de l’échelle. Pour tenter de renforcer la validation de la MCPS-Fr, une application de cette échelle à la clinique est actuellement en développement à l’Université de Montréal. Une comparaison avec une autre échelle composite pour l’évaluation de la douleur aiguë chez le chat est aussi prévue (7). Cette dernière échelle est un outil basé sur le comportement avec un point limite pour le traitement de secours. Une discussion sur les différences entre la MCPS-Ang et l’échelle de Calvo et al. (2014) a été rapportée précédemment (7).
La fiabilité d’une échelle est évaluée en testant sa cohérence interne, ce qui vérifie les relations réciproques entre les différentes composantes de l’échelle. Il est également nécessaire d’évaluer la capacité de l’instrument à produire des résultats similaires lorsqu’il est utilisé par différents individus (fiabilité ou reproductibilité inter-observateur) ou lorsqu’il est utilisé à différents moments par le même individu (fiabilité ou stabilité intra-observateur) (25). De manière similaire à la MCPS-Ang, la cohérence interne du score total et des scores partiels des sous-échelles «changements psychomoteurs» et «protection de la région douloureuse», calculée par le coefficient alpha de Cronbach indiquait une excellente cohérence interne. La sous-échelle «variables physiologiques» indiquait quant à elle une cohérence interne moyenne ou inacceptable pour la MCPS-Fr et pour la MCPS-Ang, respectivement. Ces résultats différaient de ceux observés pour la version originale de l’échelle, dont la cohérence interne pour cette sous-échelle était très bonne (3–4). Cependant, ces trois versions ne peuvent être comparée à ce sujet. En effet, dans la présente étude, le paramètre «pression sanguine artérielle» n’a pas été évalué puisque cette mesure n’était pas disponible lors de l’évaluation des vidéos. Ainsi, la cohérence interne de cette sous-échelle était basée uniquement sur l’évaluation de l’appétit. L’utilisation de variables physiologiques telles que la pression sanguine et l’appétit comme faisant partie de l’évaluation de la douleur est controversée (2), car elles sont réputées peu spécifiques à la condition douloureuse (influence importante du stress), et pourrait s’avérer peu pratique dans un contexte clinique. Considérant que ces paramètres comptent pour 15 % et 12 % de la variance totale dans les versions française et anglaise, ils pourraient être omis de l’échelle sans compromettre l’évaluation globale de la douleur. Toutefois, si cette sous-échelle était considérée, elle ne devrait être utilisée qu’en association avec les sous-échelles 1 et 2 (2).
Dans l’étude présentée ici, la fiabilité intra-observateur était bonne à très bonne pour tous les éléments de l’échelle, tel que cela a été observé dans toutes les versions précédentes de la MCPS. Ainsi, la MCPS-Fr a démontré une fiabilité adéquate. De manière similaire, la fiabilité inter-observateur variait de bonne à très bonne, ce qui est supérieur à la MCPS-Ang et semblable à la MCPS-Esp. La bonne performance de l’échelle en termes de reproductibilité et de stabilité lorsqu’utilisée par des évaluateurs ayant une expérience différente, résulte probablement de la description détaillée des comportements de douleur comprise dans la MCPS. Il est intéressant de noter que la validité de critère était bonne à très bonne, en comparant les résultats des analyses de vidéos avec ceux de l’observateur de référence qui avait évalué les chattes dans un contexte clinique.
La définition d’un point limite au sein d’une échelle de douleur est un outil précieux pour recommander l’administration d’analgésie de secours lors de l’évaluation et de la reconnaissance de la douleur; de plus, cela fournit une mesure importante de l’efficacité de la thérapie analgésique, tant en recherche qu’en contexte clinique. Dans cette étude, l’analyse de la courbe ROC a été utilisée pour déterminer le point limite pour l’analgésie de secours (2–4). Cette technique permet de déterminer la capacité d’un test à faire la distinction entre deux groupes, à choisir le point limite optimal et à comparer la performance de deux ou plusieurs tests (12). En utilisant le critère de sensibilité et spécificité balancées, le meilleur point limite identifié était > 7, ce qui signifie que l’utilisation d’analgésie additionnelle est recommandée pour les scores égalant 8 et plus (sur une échelle de 0–30 points). Cela représente 26,6 % du score maximal de l’échelle et est en accord avec la MCPS-Port, la MCPS-Ang et la MCPS-Esp (2–6). Sur la base de ce résultat, en présence de douleur postopératoire, on pourrait donc recommander d’appliquer une analgésie de secours dès que l’évaluation (quel qu’en soit l’outil) atteint 25 % du maximum. Par contre, une étude récente a démontré que l’administration de la kétamine peut produire un effet confondant sur le «Changement psychomoteur» de la MCPS-Ang. Cet effet pourrait surestimer les scores de la douleur (26).
L’analyse par vidéos a été faite par trois observatrices. Le genre a été rapporté comme un facteur de biais dans plusieurs études en médecine humaine (27–30). Récemment, il y a été rapporté que les femmes ont tendance à attribuer des scores de douleur plus forts que les hommes dans une variété de conditions douloureuses en médecine vétérinaire (31–32). Le genre de l’observateur doit donc influencer l’évaluation de la douleur. Cela pourrait avoir biaisé les résultats de notre étude.
La MCPS-Fr est une échelle valide, fiable et sensible, dans nos conditions expérimentales, pour l’évaluation de la douleur aiguë chez les chattes ayant subi une OVH, lorsqu’utilisée par des individus ayant chacun une expérience différente. Cette étude a également défini un point limite au-dessus duquel l’analgésie de secours est recommandée.
Remerciements
Maxim Moreau (MM) pour la traduction française de l’échelle à partir de la version anglophone de l’UNESP-Botucatu-MCPS. Dre Hélène Ruel pour la révision du français. CVJ
Footnotes
Use of this article is limited to a single copy for personal study. Anyone interested in obtaining reprints should contact the CVMA office (hbroughton@cvma-acmv.org) for additional copies or permission to use this material elsewhere.
Références
- 1.Steagall PV, Monteiro-Steagall BP. Multimodal analgesia for perioperative pain in three cats. J Feline Med Surg. 2013;15:737–743. doi: 10.1177/1098612X13476033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Brondani JT, Mama KR, Luna SPL, et al. Validation of the English version of the UNESP-Botucatu multidimensional composite pain scale for assessing postoperative pain in cats. BMC Vet Res. 2013;9:143. doi: 10.1186/1746-6148-9-143. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Brondani JT, Luna SPL, Minto BW, et al. Confiabilidade e pontuação minima relacionada à intervenção analgésica de uma escala multidimensional para avaliação de dor pós-operatória em gatos. Arq Bras Med Vet Zootec. 2013;65:153–162. [Google Scholar]
- 4.Brondani JT, Luna SPL, Minto BW, et al. Validade e responsividade de uma escala multidimensional para avaliação de dor pós-operatória em gatos. Arq Bras Med Vet Zootec. 2012;64:1529–1538. [Google Scholar]
- 5.Brondani JT, Luna SPL, Padovani CR. Refinement and initial validation of a multidimensional composite scale for use in assessing acute postoperative pain in cats. Am J Vet Res. 2011;72:174–183. doi: 10.2460/ajvr.72.2.174. [DOI] [PubMed] [Google Scholar]
- 6.Brondani JT, Luna SPL, Crosignani N, et al. Validez y confiabilidad de la versión en español de la escala multidimensional de la UNESP-Botucatu para evaluar el dolor postoperatorio en gatos. Arch Med Vet. 2014;46:477–486. [Google Scholar]
- 7.Calvo G, Holden E, Reid J, et al. Development of a behaviour-based measurement tool with defined intervention level for assessing acute pain in cats. J Small Anim Pract. 2014;55:622–629. doi: 10.1111/jsap.12280. [DOI] [PubMed] [Google Scholar]
- 8.Guillemin F, Bombardier C, Beaton D. Cross-cultural adaptation of health-related quality of life measures: Literature review and proposed guidelines. J Clin Epidemiol. 1993;46:1417–1432. doi: 10.1016/0895-4356(93)90142-n. [DOI] [PubMed] [Google Scholar]
- 9.Souza VD, Rojjanasrirat W. Translation, adaptation and validation of instruments or scales for use in cross-cultural health care research: A clear and user-friendly guideline. J Eval Clin Pract. 2011;17:268–274. doi: 10.1111/j.1365-2753.2010.01434.x. [DOI] [PubMed] [Google Scholar]
- 10.Beaton DE, Bombardier C, Guillemin F, Ferraz MB. Guidelines for the process of cross-cultural adaptation of self-report measures. Spine. 2000;25:3186–3191. doi: 10.1097/00007632-200012150-00014. [DOI] [PubMed] [Google Scholar]
- 11.McDowell I. Measuring health: A guide to rating scales and questionnaires. 3rd ed. New York, USA: Oxford University Press; 2006. [Google Scholar]
- 12.Streiner DL, Cairney J. What’s under the ROC? An introduction to receiver operating characteristics curves. Can J Psychiatry. 2007;52:121–128. doi: 10.1177/070674370705200210. [DOI] [PubMed] [Google Scholar]
- 13.Brondani JT, Luna SPL, Beier SL, Minto BW, Padovani CR. Analgesic efficacy of perioperative use of vedaprofen, tramadol or their combination in cats undergoing ovariohysterestomy. J Fel Med Surg. 2009;11:420–429. doi: 10.1016/j.jfms.2008.10.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Kaiser HF. The varimax criterion for analytic rotation in factor analysis. Psychometrika. 1958;23:187–200. [Google Scholar]
- 15.Cohen J. Weighted kappa: Nominal scale agreement with provision for scaled disagreement or partial credit. Psych Bull. 1968;70:213–220. doi: 10.1037/h0026256. [DOI] [PubMed] [Google Scholar]
- 16.Altman DG. Practical statistics for medical research. 1st ed. London, England: Chapman and Hall; 1991. pp. 404–408. [Google Scholar]
- 17.Cronbach LJ. Coefficient alpha and the internal structure of tests. Psychometrika. 1951;16:297–333. [Google Scholar]
- 18.Bartko JJ. The intraclass correlation coefficient as a measure of reliability. Psycol Rep. 1966;19:3–11. doi: 10.2466/pr0.1966.19.1.3. [DOI] [PubMed] [Google Scholar]
- 19.Crellin D, Sullivan TP, Babl FE, O’Sullivan, Hutchinson A. Analysis of the validation of existing behavioral pain and distress scales for use in the procedural setting. Paediatr Anaesth. 2007;17:720–733. doi: 10.1111/j.1460-9592.2007.02218.x. [DOI] [PubMed] [Google Scholar]
- 20.Morton CM, Reid J, Scott ME, Holton LL, Nolan AM. Application of a scaling model to establish and validate an interval level pain scale for assessment of acute pain in dogs. Am J Vet Res. 2005;66:2154–2166. doi: 10.2460/ajvr.2005.66.2154. [DOI] [PubMed] [Google Scholar]
- 21.Murrell JC, Psatha EP, Scott EM, Reid J, Hellebrekers LJ. Application of a modified form of the Glasgow pain scale in a veterinary teaching centre in the Netherlands. Vet Rec. 2008;162:403–408. doi: 10.1136/vr.162.13.403. [DOI] [PubMed] [Google Scholar]
- 22.Bullock B, Tenenbein M. Validation of 2 pain scales for use in the pediatric emergency department. Pediatrics. 2002;110:1–6. doi: 10.1542/peds.110.3.e33. [DOI] [PubMed] [Google Scholar]
- 23.Manworren RC, Hynan L. Clinical validation of FLACC: Preverbal patient pain scale. Pediatr Nurs. 2003;29:140–146. [PubMed] [Google Scholar]
- 24.Gauvain-Piquard A, Rodary C, Rezvani A, Serbouti S. The development of the DEGRR: A scale to assess pain in young children with cancer. Eur J Pain. 1999;3:165–176. doi: 10.1053/eujp.1999.0118. [DOI] [PubMed] [Google Scholar]
- 25.Streiner DL, Norman GR. Health measurement scales: a practical guide to their development and use. 4th ed. New York, USA: Oxford University Press; 2008. p. 431. [Google Scholar]
- 26.Buisman M, Wagner MC, Hasiuk MM, Prebble M, Law L, Pang DS. Effects of ketamine and alfaxalone on application of a feline pain assessment scale. J Feline Med Surg. 2016;18:643–651. doi: 10.1177/1098612X15591590. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Criste A. Do nurse anesthetists demonstrate gender bias in treating pain? A national survey using a standardized pain model. AANA J. 2003;71:206–209. [PubMed] [Google Scholar]
- 28.Criste A. Update for nurse anesthetists. Gender and pain. AANA J. 2002;70:475–480. [PubMed] [Google Scholar]
- 29.Hoffmann DE, Tarzian AJ. The girl who cried pain: A bias against women in the treatment of pain. J Law Med Ethics. 2001;29:13–27. doi: 10.1111/j.1748-720x.2001.tb00037.x. [DOI] [PubMed] [Google Scholar]
- 30.Nevin K. Influence of sex on pain assessment and management. Ann Emerg Med. 1996;27:424–426. doi: 10.1016/s0196-0644(96)70222-6. [DOI] [PubMed] [Google Scholar]
- 31.Hunt JR, Knowles TG, Lascelles BD, Murrell JC. Prescription of perioperative analgesics by UK small animal veterinary surgeons in 2013. Vet Rec. 2015;176:493. doi: 10.1136/vr.102834. [DOI] [PubMed] [Google Scholar]
- 32.Capner CA, Lascelles BD, Waterman-Pearson AE. Current British veterinary attitudes to perioperative analgesia for dogs. Vet Rec. 1999;145:95–99. doi: 10.1136/vr.145.4.95. [DOI] [PubMed] [Google Scholar]