Abstract
Axillary lymph node status remains an important prognostic factor in early breast cancer. It is regarded as an indicator for (neo)adjuvant systemic treatment and postoperative radiotherapy of the regional lymphatics. Commenced in September 2015, the INSEMA trial is investigating whether operative determination of nodal status as part of breast conserving therapy (BCT) for early stage breast cancer (c/iT1–2 c/iN0) can be avoided without reducing oncological safety. After inclusion of 1001 patients there was general acceptance of the complex study design by patients and study doctors so that recruitment for the first randomisation (axillary sentinel lymph node biopsy [SLNB]: yes or no) achieved predicted case numbers. The second randomisation however (SLNB alone versus complete axillary dissection when one or two macrometastases are present at SLNB) recruited fewer cases than expected for the following three reasons: a) the 13 % rate of one or two macrometastases after SLNB in the INSEMA trial collective was lower than expected; b) around 20 % of patients refused the second randomisation; c) there was delayed inclusion of the Austrian study centres, which only recruited for the second randomisation. Lack of knowledge of nodal status when SLNB is avoided represents a new challenge for the postoperative tumour board. In particular decisions on chemotherapy for luminal-like tumours and irradiation of the lymphatics (excluding axilla) must be guided by tumour biological parameters. The INSEMA trial does not provide answers to some important questions, e.g. it remains unclear whether patients without SLNB can be offered partial breast irradiation alone in low-risk situations and whether SLNB can also be avoided in patients with stage T1–2 tumours who have a mastectomy indication.
Key words: breast cancer, INSEMA trial, nodal status, sentinel lymph node biopsy, radiotherapy
Zusammenfassung
Der axilläre Nodalstatus wird beim frühen Mammakarzinom immer noch als wichtiger Prognosefaktor und Indikator für eine (neo-)adjuvante System- und postoperative Strahlentherapie der Lymphabflusswege (LAW) gesehen. Die im September 2015 gestartete INSEMA-Studie untersucht, ob beim frühen Mammakarzinom (c/iT1–2 c/iN0) auf die operative Bestimmung des Nodalstatus im Rahmen der brusterhaltenden Therapie (BET) verzichtet werden kann, ohne dass die onkologische Sicherheit beeinträchtigt wird. Nach Einschluss von 1001 Patientinnen war die Akzeptanz des komplexen Studiendesigns bei Patientinnen und Prüfärzten gegeben, sodass die Rekrutierung für die erste Randomisierung (axilläre Sentinel-Lymphknoten-Biopsie [SLNB]: ja oder nein) im Rahmen der Fallzahlprognose liegt. Die 2. Randomisierung (SLNB allein versus Komplettierung der Axilladissektion bei 1 oder 2 Makrometastasen in der SLNB) rekrutiert dagegen aus 3 Gründen weniger als erwartet: a) Der Nachweis von 1 bis 2 Makrometastasen nach der SLNB im INSEMA-Kollektiv ist mit 13 % geringer als erwartet; b) etwa 20 % der Patientinnen lehnten die 2. Randomisierung ab; c) der Einstieg der österreichischen Prüfzentren, die ausschließlich für die 2. Randomisierung rekrutieren, erfolgt zeitlich verzögert. Die Unkenntnis des Nodalstatus bei Verzicht auf die SLNB bringt eine neue Herausforderung für die postoperative Tumorkonferenz. Insbesondere die Indikation zur Chemotherapie bei Luminal-like-Tumoren und zur Bestrahlung der LAW (ohne Axilla) muss nun an den tumorbiologischen Parametern ausgerichtet werden. Einige wichtige Fragen können durch die INSEMA-Studie nicht beantwortet werden. Unklar bleibt beispielsweise, ob Patientinnen ohne SLNB eine alleinige Teilbrustbestrahlung in Low-Risk-Situationen angeboten werden kann bzw. ob auch bei Patientinnen mit einer Mastektomieindikation auf die SLNB im Stadium T1–2 verzichtet werden kann.
Schlüsselwörter: Mammakarzinom, INSEMA, Nodalstatus, Sentinel-Lymphknoten- Biopsie, Strahlentherapie
Introduction
The Intergroup-Sentinel-Mamma (INSEMA) trial (NCT02466737, GBG75, ABCSG43) is a prospective, randomised trial comparing sentinel lymph node biopsy (SLNB) versus no axillary surgery in patients with early invasive breast carcinoma (clinically/radiologically ≤ 5 cm; c/iT1–2 c/iN0) who are having breast conserving therapy (BCT) including postoperative whole breast irradiation (Fig. 1). In a second phase, analogous to the ACOSOG Z0011 trial 1, patients with sentinel lymph node positivity are randomised to either no further surgery or complete axillary lymph node dissection (ALND). The INSEMA trial is sponsored by the University Medicine Rostock; it is financed by the Deutsche Krebshilfe GmbH (German Cancer Aid Ltd); data management is performed by the German Breast Group (GBG) (Neu-Isenburg, Germany). Over 130 German trial centres recruit for both analyses; the “first patient in” was on 17.09.2015 in Rostock. On 09.03.2016 the first patient was recruited in Austria at the Salzburg centre. The remaining Austrian Breast & Colorectal Cancer Study Group (ABCSG) centres will only recruit for the second randomisation.
Fig. 1.
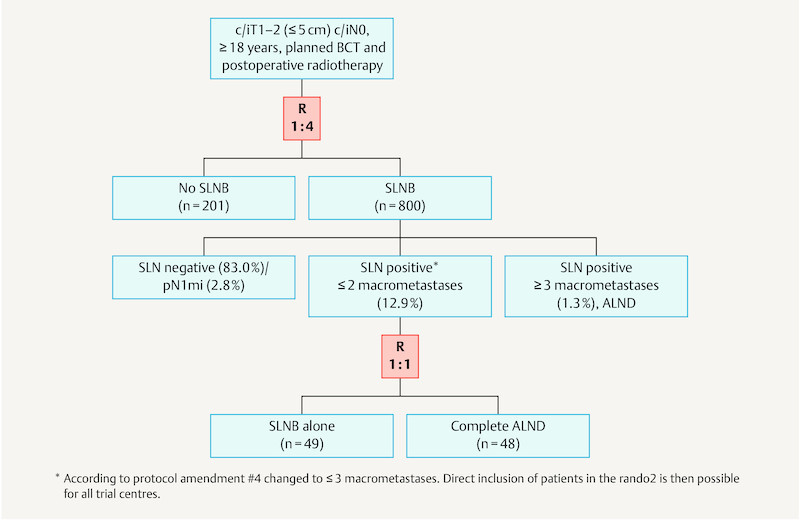
Flow chart of the INSEMA trial showing the distribution after recruitment of 1001 patients.
The rationale of the study is based on the available data at the time of protocolling (2011–2014) 2, 3. This sees the removal of the axillary sentinel lymph node (SLN) in a critical light – at least in the context of BCT when lymph nodes are normal on palpation and ultrasound. Complete ALND appears to be of no benefit even to patients with one to two positive SLNs whereas avoidance of SLNB could reduce costs (marking, operative capacity, pathology), reduce axilla-related morbidity (e.g. lymphoedema) and improve quality of life 4. Review of the Rostock Cancer Registry from 2014 and 2015 found that for the Rostock University Womenʼs Hospital 53.1 % of newly diagnosed breast cancer patients fulfilled INSEMA inclusion criteria. Thus results of the INSEMA trial could potentially influence the operative management of every second breast cancer patient.
Materials and Methods
Essential inclusion criteria for the INSEMA trial (recent changes according to protocol amendment #4 from 15.09.2016 in bold type):
Histologically confirmed unilateral invasive breast carcinoma (punch biopsy, Mammotome biopsy or open biopsy possible)
Age ≥ 18 years
Tumour size clinically and radiologically ≤ 5 cm (iT1/iT2) independent of hormone receptor and HER2 status
Clinically and sonographically tumour-free axillary lymph nodes before biopsy (c/iN0); if cN0/iN+ negative core biopsy or fine needle aspiration of suspicious lymph node required
No suspicion of distant metastases
Planned BCT with postoperative whole-breast irradiation and adequate systemic therapy
Essential exclusion criteria for the INSEMA trial:
History of carcinoma in the previous 5 years
Invasive breast cancer treated with neoadjuvant therapy
c/iT3-T4 tumours
Planned mastectomy
Planned exclusive intraoperative partial breast irradiation (e.g. INTRABEAM) or exclusive postoperative partial breast irradiation (e.g. multi-catheter technique); both methods allowed as boost
Pregnancy and breastfeeding
Male breast cancer
Study aims
Statistical analysis in the INSEMA trial is based on non-inferiority so that per protocol analysis is mainly performed. The primary outcome for both study questions is invasive disease-free survival. Secondary outcomes are overall survival, local and axillary recurrence rates and determination of actual applied radiotherapy dose at each axillary level. In addition, analyses of quality of life and translational research in the form of a biobanking program are integrated.
Approximately 6000 patients will be recruited in 130 trial centres in Germany and one in Austria for both INSEMA trial analyses. A further 10 ABCSG centres will contribute 800 cases exclusively for the second randomisation. The 1000th study patient was recruited on 22.06.2016, the INSEMA trial thus linking up with the SOUND study (Sentinel Node versus Observation After Axillary UltraSound, NCT02167490) 4, which has been running since 2012. In the SOUND study 1560 patients with breast tumours up to 2 cm in size (T1 stage) and BCT are to be randomised 1 : 1 to axillary SLNB versus no axillary surgery. In contrast to the INSEMA trial the primary outcome measure is distant disease-free survival.
Results
A first analysis of patient characteristics (n = 1001) is summarised in Table 1. The median age of the study population as a whole was 61 years, though there were somewhat more premenopausal women recruited to the non-SLNB group (< 50 years: 17.4 vs. 10.8 % in the SLNB group). Statistical analysis of the age distribution showed no significant difference between the groups (p = 0.051).
Table 1 Selected patient characteristics of the first 1 001 INSEMA patients.
| Parameter | Category | SLNB (n = 800) | No SLNB (n = 201) | Total (n = 1 001) | p-value |
|---|---|---|---|---|---|
| BMI = body mass index; HR = hormone receptor; ER = estrogen receptor; PgR = progesterone receptor | |||||
| Age (years) | mean | 61.1 | 60.0 | 60.9 | 0.236 |
| median | 61.0 | 60.0 | 61.0 | ||
| min-max | 36–87 | 36–89 | 36–89 | ||
| BMI (kg/m2) | mean | 27.0 | 27.2 | 27.1 | 0.707 |
| median | 25.8 | 25.9 | 25.8 | ||
| HR status | ER/PgR negative | 23 (2.9 %) | 8 (4.0 %) | 31 (3.1 %) | 0.493 |
| ER and/or PgR positive | 774 (97.1 %) | 193 (96.0 %) | 967 (96.9 %) | ||
| HER2 status | negative | 728 (92.0 %) | 178 (89.4 %) | 906 (91.5 %) | 0.255 |
| positive | 63 (8.0 %) | 21 (10.6 %) | 84 (8.5 %) | ||
| Grading | G1 | 269 (33.6 %) | 65 (32.3 %) | 334 (33.4 %) | 0.942 |
| G2 | 488 (61.0 %) | 125 (62.2 %) | 613 (61.2 %) | ||
| G3 | 43 (5.4 %) | 11 (5.5 %) | 54 (5.4 %) | ||
| Histological subtype | invasive ductal | 586 (73.5 %) | 152 (75.6 %) | 738 (73.9 %) | 0.774 |
| invasive lobular | 89 (11.2 %) | 24 (11.9 %) | 113 (11.3 %) | ||
| mixed or other | 122 (15.3 %) | 25 (12.5 %) | 147 (14.7 %) | ||
| Ki-67 | ≤ 20 % | 648 (84.3 %) | 160 (82.9 %) | 808 (84.0 %) | 0.661 |
| > 20 % | 121 (15.7 %) | 33 (17.1 %) | 154 (16.0 %) | ||
After analysis of preoperative imaging 889 cases (88.9 %) were assigned to stage cT1 (≤ 2 cm) and 111 cases (11.1 %) to stage cT2 (> 2 cm). The vast majority of the 1001 breast carcinomas were hormone receptor positive (96.9 %). Only 8.5 % of all tumours were HER2 positive and only 5.4 % of all cases were G3 on tumour grading. These figures support the assumption that in Germany triple negative and HER2 positive tumours are currently more likely to be treated during neoadjuvant therapy.
In the SLNB arm (n = 755 after exclusion of drop-outs) the detection rate for the sentinel lymph node was 99.5 %. Pathology analysis of 751 SLNBs performed showed the following distribution of nodal status: 83.0 % pN0 (n = 623); 2.8 % micrometastasis (pN1mi; n = 21); 12.9 % with 1–2 macrometastases (n = 97); and 1.3 % ≥ 3 macrometastases (n = 10). Thus the case rate of 85.8 % without demonstrable axillary lymph node macrometastasis was significantly above the 70 % predicted at protocolling. This can be credited to the thorough preoperative workup at the trial centres (e.g. ultrasound ± axillary core biopsy) during INSEMA recruitment. On the other hand many breast centres (internationally too) currently achieve pN0 rates of around 80 % for SLNB through increased screening.
Discussion
Avoidance of SLNB and oncological safety
The oncological safety of avoiding SLNB is often questioned during informed consent to INSEMA trial participation. The request for maximal oncological safety from patients and relatives must be weighed up against the desire for adequate cosmesis in the axilla and the avoidance of operative morbidity. Studies from the pre-SLNB era compared ALND to no axillary surgery for clinically tumour-negative axillary lymph nodes. Case numbers were often low, however with adequate long-term follow-up these studies showed that although the rate of axillary recurrence is slightly increased, this does not affect disease-free survival or overall survival (Table 2).
Table 2 Prospective randomised trials with avoidance of axillary lymphadenectomy in patients with early stage breast cancer vs. complete axillary dissection/axillary radiotherapy.
| Author/Study | Patients | n | Follow-up | Axillary recurrence | Disease-free survival | Overall survival |
|---|---|---|---|---|---|---|
| # Veronesi et al. randomised patients without axillary surgery to no further treatment vs. axillary radiation.* 42 % of patients with tumours > 2 cmy = years, mo. = months, ME = mastectomy, MRM = modified radical mastectomy, DDFS = distant disease-free survival | ||||||
| Fisher et al. 50 (2002)NSABP B-04 | All ages, cN0, MRM vs. ME alone vs. ME plus radiation, no systemic therapy | 1 079 | 25 y | 18.6 % in ME-only arm | 19 vs. 19 vs. 13 %; p = 0.65 | 25 vs. 26 vs. 19 %; p = 0.68 |
| Veronesi et al. 51 (2005)# | > 45 y, tumour < 1.2 cm, cN0 | 435 | 63 mo. | 0.5 vs. 1.5 % | 97 vs. 95 %; p = 0.19 | 99 vs. 97 %; p = 0.23 |
| Rudenstam et al. 52 (2006) IBCSG 10-93 | > 60 y, pT1–2*, cN0 | 473 | 6.6 y | 0.9 vs. 2.5 %; n. s. | 67 vs. 66 %; p = 0.69 | 75 vs. 73 %; p = 0.77 |
| Martelli et al. 53 (2014) | ≥ 65 y, pT1 cN0, tamoxifen | 238 | 15 y | 0 vs. 6 % | DDFS p = 0.95 | p = 0.64 |
| Agresti et al. 54 (2014) INT09/98 | 30–65 J., cT1cN0, tamoxifen ± chemotherapy | 565 | 10 y | 0 vs. 9 % | 92.4 vs. 91.3 %; p = 0.9 | 93.3 vs. 91.5 %; p = 0.78 |
When discussing oncological safety it must be mentioned that the randomised trials that lead to the acceptance of SLNB in routine clinical practice had false negative rates of 5–8 %, which however did not influence disease-free or overall survival 5, 6.
In the IBCSG 23-01 trial 931 patients with SLN micrometastases were randomised to either no further axillary surgery or complete axillary dissection 7. After adequate systemic therapy, radiotherapy and a median follow-up of 5 years the locoregional recurrence rate (0.9 % in both arms), disease-free survival (87.8 vs. 84.4 %) and overall survival (98.0 vs. 97.6 %) were not significantly different. Since publication of these data complete axillary dissection has generally been avoided – even outside of clinical trials – when SLNB shows pN1mi (St. Gallen 2013 consensus recommendation) 8.
Oncological safety with avoidance of complete axillary dissection despite SLNB tumour cell positivity
The ACOSOG Z0011 trial provides data on this subject that were first presented at the ASCO 2010 and brought up to date after extended follow-up at the ASCO 2016. In the Z0011 trial almost 900 patients with BCT and SLN micro- and macrometastases were randomised to either no further axillary surgery or complete ALND. Here too, after a median follow-up of 9.25 years, there were no significant differences in recurrence rates locally (5.6 % in the ALND arm vs. 3.8 % in the “SLNB only” arm; p = 0.13) or in the axilla (0.5 % in the ALND arm vs. 1.5 % in the “SLNB only” arm), nor in locoregional recurrence-free survival (p = 0.36) 9. It is noteworthy that 4 of the total 5 axillary lymph node recurrences in the “SLNB only” arm (1.5 %) occurred within the first five years. Indeed, 3.6 % of cases in the “SLNB only” arm were found to have more than two macrometastases at definitive histology.
The previously mentioned limitations of the Z0011 trial (e.g. 37.5 % only SLN axillary micrometastasis, numerous violations of protocol during postoperative radiotherapy) lead to the commencement of further validation trials. Almost all subsequent protocols focus on patients with SLN axillary macrometastasis. Interestingly, some study groups extend the inclusion criteria beyond those of the classical Z0011 design: Inclusion of mastectomy patients (POSNOC 10, SENOMAC 11, Dutch BOOG 2013-07 12, SINODAR ONE 13); inclusion of patients with SLNB before neoadjuvant systemic treatment, T3 tumours and male patients (SENOMAC 11); inclusion of patients with more than two macrometastases at SLNB (Dutch BOOG 2013-07, French SERC/IPC 2012-001).
The need for a second INSEMA randomisation
As a result of the ACOSOG Z0011 trial avoidance of ALND is regarded by many as standard. Thus in the USA 54 % of patients with one or two involved SLNs already no longer undergo complete lymphadenectomy 14. The Oncology Working Group – Breast (AGO-Mamma) has given this approach (avoidance of complete ALND with one or two involved SLNs and breast conserving operation) a +/− recommendation, thus not yet declaring it standard 15. The second INSEMA randomisation therefore deals with a still unresolved issue. In order to increase the power of validation studies investigators from the SENOMAC and INSEMA trials will aim for pooled analysis of BCT cases.
The following changes to recruitment for the second study question of the INSEMA trial are contained in the current protocol amendment #4:
Inclusion of patients with one to three macrometastases following SNLB;
German trial centres may recruit directly for the second randomisation.
In contrast to the ACOSOG Z0011 – where 37.5 % of patients “only” had axillary micrometastasis – the INSEMA trial will only include patients with macrometastasis, meaning that the axillary tumour load between the two study collectives will differ significantly 16. It is also expected that postoperative radiotherapy in the two studies will not be identical. In the Z0011 approx. 50 % of patients received a so-called high tangent with significant dose to the axilla levels I and II; in addition 18.9 % of cases had received radiation to the regional lymph drainage areas, which was not consistent with protocol. On the other hand 11 % of patients did not receive postoperative whole-breast irradiation 17. In the INSEMA protocol ascertainment of the actually administered radiotherapy dose for each axilla level was made a secondary study outcome. Also, a central review of the first three radiation treatment plans in each case was integrated. Up until the end of August 2016 144 radiotherapy protocols from 58 centres have been reviewed and are already complete for 24 centres.
Significance of transcapsular spread in involved lymph nodes
The prognostic significance of lymph node capsule infiltration and capsule rupture with extranodal tumour spread is controversial. For instance capsule infiltration/rupture was classified as pN1biii in the 5th edition of the American Joint Committee on Cancer (AJCC)’s “Cancer Staging Manual”, but in the currently valid 6th edition is not specifically listed 18, 19. In the ACOSOG Z0011 trial only “matted nodes” or evidence of macroscopic extranodal tumour (“gross extranodal disease”) at the time of SNLB were exclusion criteria.
In a current meta-analysis of 5 analysable studies including a total 624 patients (163 with, 461 without transcapsular spread) with a median follow-up of 58 months, patients with transcapsular spread had a significantly increased recurrence rate (RR = 2.07, 95 % CI: 1.38–3.10, p < 0.0001) and mortality (RR = 2.51; 95 % CI: 1.66–3.79, p < 0.0001) 20. Other studies have shown, however, that extracapsular tumour spread ≤ 2 mm, and thus also capsule infiltration alone, did not significantly worsen prognosis 21, 22, 23, 24. Capsule rupture itself has shown significant correlation with further involved axillary lymph nodes and other unfavourable tumour parameters. In a study that took the ACOSOG Z0011 criteria into account (pT1–2, cN0, ≤ 2 positive SLNs) only 1109 cases from a study population of 11 730 were found to have one to two positive SLNs on H & E staining. Of these, 30 % (n = 331) had capsule rupture (≤ 2 mm: n = 180; > 2 mm: n = 151) 22. Local operative treatment i.e. complete axillary dissection does not appear to be necessary for transcapsular spread in the current era of modern multimodality treatment. In a study at the Memorial Sloan-Kettering Cancer Center in New York only 45 of 111 patients with capsule rupture underwent axillary dissection. After a median follow-up of 21 months there was not a single case of local recurrence among the 66 patients without complete axillary dissection 25. There is currently no standard pathological definition of capsule rupture. Neoplastic emboli, nests of free tumour cells or marginal sinus metastases should not be documented as relevant transcapsular spread 20. The pathological diagnosis “sentinel macrometastasis with transcapsular spread” does not preclude inclusion in the INSEMA randomisation 2, therefore there is no need for the INSEMA protocol to define these parameters. Other studies (e.g. AMAROS, SENOMAC) also recruit (or have recruited) cases with lymph node metastases and transcapsular spread.
Deciding on irradiation of the regional lymphatics depending on nodal status
Three prospective randomised trials (MA.20, EORTC, French-trial) 26, 27, 28 and one cohort study (DBCG-IMN) 29 have dealt with the effects of irradiating the regional lymphatics (parasternal ± supraclavicular) in patients with node-positive or node-negative high-risk tumours or tumours with medial location. All three randomised trials found no significant advantage for overall survival (primary study outcome) after a follow-up period of 10 years. A meta-analysis of these three trials did however show a significant effect (HR 0.90; 95 % CI: 0.82–0.99) 30. The Danish cohort study DBCG-IMN achieved its primary study outcome (significant difference in overall survival after 8.9 years: 75.9 % with and 72.2 % without parasternal irradiation; p = 0.005). This positive effect was however only demonstrated when ≥ 4 lymph nodes were involved. These data are confirmed by a Swedish cohort study in which irradiation of the regional lymphatics in patients with 1–3 involved lymph nodes was not associated with a survival advantage, only well-known side effects 31. The AGO treatment guidelines give a single “plus” recommendation (= of limited use, may be used) to irradiation of regional lymphatics in the presence of 1–3 involved axillary lymph nodes only when further risk factors are present (medial/central tumour localisation, G2–3, ER/PgR negative, premenopause) 15.
It must however be critically noted that in all the studies on regional lymphatic irradiation mentioned above, tumour biology in terms of intrinsic subtypes was not adequately taken into consideration, and systemic treatments did not match current standards (e.g. no anti-HER2) 32. In addition, these study populations are not comparable with the INSEMA collective since they have a significantly higher proportion of node-positive cases (MA.20 trial: 90 % pN+, DBCG-IMN: 100 % pN+). The current INSEMA protocol (amendment #4) has adopted irradiation of the regional lymphatics as clearly indicated when 4 or more lymph nodes are involved (≥ stage pN2a).
Rate of axillary recurrence in studies using partial breast irradiation alone
It is currently assumed that in the context of BCT axillary recurrence is minimised by postoperative whole breast irradiation, even in patients with negative SLNB 33. In practice there is significant incidental irradiation of the ipsilateral axilla, at least at level I, even when so-called “standard tangents” are used 34. This is considered an important contributor to the results of the Z0011 trial. Modern radiotherapy techniques (e.g. RapidArc technology) may soon enable reduction of this “collateral” irradiation of the ipsilateral axilla.
With this in mind the interpretation of published studies with partial breast irradiation alone becomes more interesting. In this context, dependent on tumour localisation, the ipsilateral axilla levels may receive no or only very little irradiation. Table 3 summarises an analysis of 5 studies on this theme. Among these only the ELIOT study showed a significantly increased regional lymph node recurrence rate 35. In contrast no significant difference was found between the different treatment arms in the TARGIT-A and GEC-ESTRO trials 36, 37. One explanation for this is certainly the significantly higher proportion of node-positive cases in the ELIOT. Nevertheless the axillary recurrence rate of 1.4 % in the ELIOT study, with intraoperative partial breast irradiation, is still very low. A meta-analysis of three studies, taking 5–8 years of follow-up into account, found no significant increase in axillary recurrence rate following partial breast irradiation alone 38.
Table 3 Axillary recurrence rates in studies comparing whole breast vs. partial breast irradiation alone in the context of breast conserving treatment.
| Study | Number of cases (n) | Proportion of pN+ | Follow-up | Regional lymph node recurrence (n) | p-value | |
|---|---|---|---|---|---|---|
| WBI | PBI | |||||
| WBI = whole breast irradiation, PBI = partial breast irradiation | ||||||
| Dodwell 55 (2005) | 174 | 41 % (PBI-arm) | 8 years | 4 | 10 | 0.05 |
| Rodriguez 56 (2013) | 102 | 0 % | 5 years | 0 | 0 | n. s. |
| ELIOT 35 (2013) | 1 305 | 26 % | 5.8 years | 2 | 9 | 0.03 |
| TARGIT-A 36 (2014) | 3 451 | 16 % | 5 years | 6 | 8 | 0.609 |
| GEC-ESTRO 37 (2016) | 1 184 | 1 % pN1mi | 5 years | 1 | 3 | 0.39 |
Thus there is no clear evidence that minimising postoperative radiotherapy of the remaining breast in a low-risk SLNB collective increases the axillary recurrence rate. It is still unclear whether the concept of avoiding SLNB can also be applied to patients receiving partial breast irradiation alone. Currently partial breast irradiation alone is not a treatment option for INSEMA trial participants. The results of SOUND and INSEMA will thus not be applicable to this patient group. This interesting and relevant question lends itself to an INSEMA follow-on project.
Deciding on systemic treatment and radiotherapy without knowledge of nodal status
With subtyping of breast carcinoma according to hormone receptor (HR) status, HER2 status, tumour grade and Ki-67 systemic treatment is planned according to the intrinsic tumour subtypes rather than nodal status 39. Chemotherapy ± anti-HER2 therapy is always indicated for triple-negative and HER2 positive tumours (stage pT1b and above). There is consensus in all guidelines and treatment recommendations that chemotherapy is not automatically indicated for luminal-like tumours with axillary lymph node involvement 15, 40, 41, 42, 43, 44, 45. In particular luminal-A subtype tumours with ≤ 3 involved lymph nodes can be sufficiently treated with endocrine therapy alone 46. Analysis of the ABCSG-8 study (HR positive cases, endocrine therapy alone) using the PAM50 test to classify tumours according to intrinsic subtypes showed clear differences within the node-positive subgroup (n = 431) dependent on luminal status. The 10-year survival rate without distant metastases was 90.6 % for node-positive luminal-A patients and 71.0 % for node-positive luminal-B tumours 47. Chemotherapy is indicated for the luminal-like subtype when 4 or more lymph nodes are involved (Table 4).
Table 4 Indications for adjuvant postoperative chemotherapy dependent on tumour biology according to the current St. Gallen consensus recommendations 46.
| MaCa-subtype | Indications for postoperative chemotherapy | Comments |
|---|---|---|
| Luminal-like |
|
* … Expected rate of pN+ with ≥ 4 positive lymph nodes 3.7 % of the whole non-SLNB population (after AMAROS data 57). The proportion of luminal-like cases in INSEMA with pN+(≥ 4 LKs) will constitute 3 % of the non-SLNB population at most. |
| HER2 positive | Chemotherapy in combination with anti-HER2 treatment from stage pT1b independent of nodal status | No anti-HER2 treatment at stage pT1a |
| TNBC (triple-neg.) | Chemotherapy regardless of nodal status |
Information on the number of involved lymph nodes is naturally missing for cases in the non-SLNB arm of the INSEMA trial. Following the AMAROS data analysis it was expected for INSEMA that approx. 3 % of all luminal-like tumours in a SLNB collective could potentially have more than three lymph nodes involved 48. In the INSEMA control arm with SLNB after recruitment of the first 1001 patients only 11 of 771 cases (1.4 %) were found to have three or more involved lymph nodes. Of these 11 patients 8 had three, and 1 had 4, 5 and 6 involved nodes respectively so that the proportion of patients with the relevant pN2a tumour stage was only 0.375 %. Thus guideline conform systemic treatment is theoretically possible in 99 % of INSEMA patients without SLNB on the basis of tumour biological parameters alone.
The discussion surrounding indications for irradiation of the regional lymphatics (excluding the axilla) dependent on nodal status/number of involved nodes (see above) is similarly controversial. Most guidelines and treatment recommendations regard more than three positive axillary lymph nodes as the only definite indication 49. This however only applies to a few individual cases within the INSEMA cohort. The current version of the INSEMA protocol (amendment #4) has taken this treatment recommendation into account following the full text publication of the MA.20 and EORTC data.
Take Home Message
As anticipated there have been no unexpected results from the INSEMA trial after recruitment of the first 1001 patients. Acceptance of study participation is high among both patients and doctors. Fortunately economic aspects such as DRG downgrading (from DRG J07B to J25Z) through SLNB avoidance have not played an ostensible role for participating study centres. In the longer term however further negotiations with financing institutions/medical insurance companies will be required in order to unlink the DRG from the SLNB procedure (as is already the case e.g. in Austria). The proportion of patients with pN0/pN1mi-status in the control arm where SLNB was performed is very high (83 % pN0, 3 % pN1mi). A degree of selection bias at the trial centres before recruitment is probably contributary, high-risk cases being more likely to receive neoadjuvant therapy. The field of neoadjuvant therapy also has approaches that attempt to reduce the radicality of axillary surgery, especially after publication of the SENTINA and ACOSOG Z1071 data. Postoperative treatment decisions with respect to adjuvant systemic and radiotherapy can be made in accordance with guidelines without knowledge of nodal status in almost all cases, based solely on available tumour parameters. Future studies should investigate the avoidance of axillary SLNB in patients with a mastectomy indication and in those with partial breast irradiation alone after breast conserving surgery.
Einleitung
Die Intergroup-Sentinel-Mamma-(INSEMA-)Studie (NCT02466737, GBG75, ABCSG43) ist eine prospektiv randomisierte Studie zum Vergleich der Sentinel-Lymphknoten-Biopsie (SLNB) versus keiner Axillachirurgie bei Patientinnen mit einem frühen invasiven Mammakarzinom (klinisch/bildgebend ≤ 5 cm; c/iT1–2 c/iN0) und brusterhaltender Therapie (BET) mit postoperativer Ganzbrustbestrahlung (Abb. 1). In einer zweiten Fragestellung werden Patientinnen mit positivem Sentinel-Lymphknoten in Analogie zur ACOSOG Z0011-Studie 1 zu keiner weiteren Operation oder kompletter Axilladissektion (ALND) randomisiert. Sponsor der INSEMA-Studie ist die Universitätsmedizin Rostock; die Studie wird durch die Deutsche Krebshilfe gGmbH finanziert und das Datenmanagement erfolgt durch die German Breast Group (GBG) Forschungs GmbH (Neu-Isenburg, Deutschland). Mehr als 130 deutsche Prüfzentren rekrutieren für beide Fragestellungen; „first-patient-in“ war am 17.09.2015 in Rostock. Am 09.03.2016 wurde am Salzburger Zentrum die 1. Patientin aus Österreich eingeschlossen. Die weiteren Zentren der Austrian Breast & Colorectal Cancer Study Group (ABCSG) werden ausschließlich für die 2. Randomisierung rekrutieren.
Abb. 1.
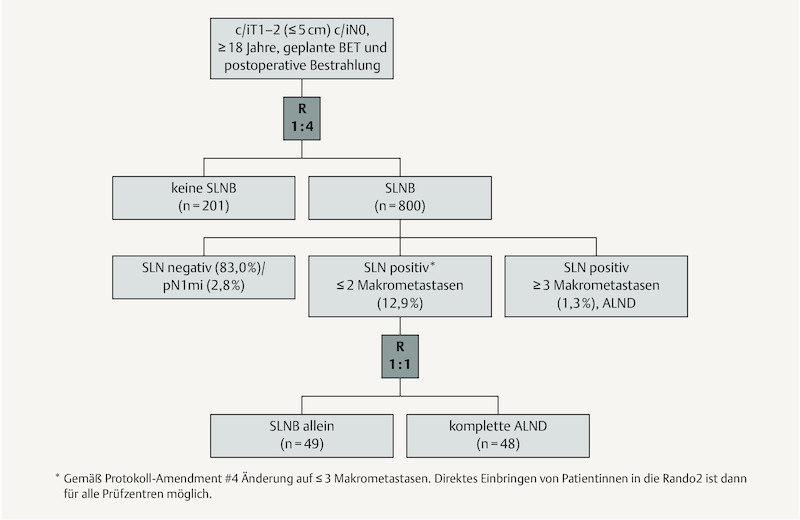
Flow Chart der INSEMA-Studie mit der Verteilung nach 1001 eingeschlossenen Patientinnen.
Die Rationale der Studie basiert auf die im Zeitraum der Protokollerstellung (2011–2014) verfügbaren Daten 2, 3, wonach – zumindest bei palpatorisch und sonografisch unauffälligen axillären Lymphknoten und BET – eine Entnahme der axillären Sentinel-Lymphknoten (SLN) kritisch hinterfragt werden muss. Selbst bei 1–2 positiven SLN erscheint eine komplette ALND ohne Nutzen für die Patientin zu sein. Letztlich könnte die Vermeidung der SLNB zur Kostenersparnis (Markierung, OP-Kapazität, Pathologie), zur Senkung der axillabedingten Morbidität (z. B. Lymphödem) und zur Verbesserung der Lebensqualität der Patientinnen beitragen 4. Die Auswertung am Krebsregister Rostock der Jahre 2014 und 2015 ergab für die Universitäts-Frauenklinik Rostock, dass 53,1 % der neu diagnostizierten Mammakarzinompatienten die Einschlusskriterien der INSEMA-Studie erfüllen. Somit könnte das Ergebnis der INSEMA-Studie die operative Therapie bei jeder zweiten Brustkrebspatientin beeinflussen.
Material und Methodik
Wesentliche Einschlusskriterien der INSEMA-Studie sind (fett hervorgehoben sind aktuelle Änderungen gemäß Protokoll-Amendment #4 vom 15.09.2016):
histologisch gesichertes einseitiges invasives Mammakarzinom (Stanzbiopsie, Mammotome-Biopsie oder offene Biopsie möglich)
Alter ≥ 18 Jahre
klinisch und bildgebende Tumorgröße ≤ 5 cm (iT1/iT2) unabhängig vom Hormonrezeptor- und HER2-Status
klinisch und sonografisch tumorfreie axilläre Lymphknoten vor der Biopsie (c/iN0); bei cN0/iN+ ist eine negative Stanzbiopsie bzw. Feinnadelaspiration vom suspekten Lymphknoten notwendig
kein Anhalt für Fernmetastasen
geplante BET mit postoperativer Ganzbrustbestrahlung und adäquater Systemtherapie
Wesentliche Ausschlusskriterien der INSEMA-Studie sind:
Karzinomanamnese in den letzten 5 Jahren
neoadjuvant behandeltes invasives Mammakarzinom
c/iT3-T4-Tumor
geplante Mastektomie
geplante alleinige intraoperative Teilbrustbestrahlung (z. B. INTRABEAM) oder alleinige postoperative Teilbrustbestrahlung (z. B. Multikathetertechnik); beide Techniken sind als Boost erlaubt
Schwangerschaft und Stillzeit
Mammakarzinom des Mannes
Studienziele
Bei der INSEMA-Studie wird statistisch auf Nichtunterlegenheit geprüft (non-inferiority-Design), sodass vorrangig eine Per-Protokoll-Analyse durchgeführt wird. Primäres Studienziel für beide Fragestellungen ist das invasive krankheitsfreie Überleben. Sekundäre Studienziele sind das Gesamtüberleben, die lokalen bzw. axillären Rezidivraten und die Ermittlung der tatsächlich applizierten Strahlentherapiedosen auf den jeweiligen Axilla-Level. Zusätzlich sind Lebensqualität-Analysen und translationale Fragestellungen in Form eines Biobanking-Programms integriert.
Für beide Fragestellungen der INSEMA-Studie werden etwa 6000 Patientinnen in 130 Prüfzentren aus Deutschland und in 1 Zentrum aus Österreich rekrutiert. Weitere 10 ABCSG-Zentren werden 800 Fälle exklusiv für die 2. Randomisierung einbringen. Am 22.06.2016 wurde die 1000. Patientin in die Studie eingeschlossen. Damit schließt die INSEMA-Studie zu der bereits seit 2012 laufenden SOUND-Studie (Sentinel Node versus Observation After Axillary UltraSound, NCT02167490) auf 4. In der SOUND-Studie sollen 1560 Patientinnen mit einem bis 2 cm großen Mammakarzinom (T1-Stadium) und BET im Verhältnis 1 : 1 zur axillären SLNB versus keiner Axilla-Operation randomisiert werden. Primäres Studienziel der SOUND-Studie ist im Gegensatz zur INSEMA-Studie das distante krankheitsfreie Überleben.
Ergebnisse
Eine erste Analyse der Patientinnencharakteristika (n = 1001) ist in Tab. 1 zusammengefasst. Das mediane Alter der Gesamtpopulation ist 61 Jahre, wobei in der Non-SLNB-Gruppe tendenziell mehr prämenopausale Patientinnen (< 50 Jahre: 17,4 vs. 10,8 % in der SLNB-Gruppe) rekrutiert wurden. Die statistische Analyse mit Rücksicht auf die Altersgruppenverteilung erbrachte jedoch keinen signifikanten Unterschied (p = 0,051).
Tab. 1 Ausgewählte Patientinnencharakteristika der ersten 1 001 INSEMA-Patientinnen.
| Parameter | Kategorie | SLNB (n = 800) | keine SLNB (n = 201) | gesamt (n = 1 001) | p-Wert |
|---|---|---|---|---|---|
| BMI = Body-Mass-Index; HR = Hormonrezeptor; ER = Estrogenrezeptor; PgR = Progesteronrezeptor | |||||
| Alter (Jahre) | Mean | 61,1 | 60,0 | 60,9 | 0,236 |
| Median | 61,0 | 60,0 | 61,0 | ||
| Min-Max | 36–87 | 36–89 | 36–89 | ||
| BMI (kg/m2) | Mean | 27,0 | 27,2 | 27,1 | 0,707 |
| Median | 25,8 | 25,9 | 25,8 | ||
| HR-Status | ER/PgR negativ | 23 (2,9 %) | 8 (4,0 %) | 31 (3,1 %) | 0,493 |
| ER und/oder PgR positiv | 774 (97,1 %) | 193 (96,0 %) | 967 (96,9 %) | ||
| HER2-Status | negativ | 728 (92,0 %) | 178 (89,4 %) | 906 (91,5 %) | 0,255 |
| positiv | 63 (8,0 %) | 21 (10,6 %) | 84 (8,5 %) | ||
| Grading | G1 | 269 (33,6 %) | 65 (32,3 %) | 334 (33,4 %) | 0,942 |
| G2 | 488 (61,0 %) | 125 (62,2 %) | 613 (61,2 %) | ||
| G3 | 43 (5,4 %) | 11 (5,5 %) | 54 (5,4 %) | ||
| histologischer Subtyp | invasiv duktal | 586 (73,5 %) | 152 (75,6 %) | 738 (73,9 %) | 0,774 |
| invasiv lobulär | 89 (11,2 %) | 24 (11,9 %) | 113 (11,3 %) | ||
| gemischt oder andere | 122 (15,3 %) | 25 (12,5 %) | 147 (14,7 %) | ||
| Ki-67 | ≤ 20 % | 648 (84,3 %) | 160 (82,9 %) | 808 (84,0 %) | 0,661 |
| > 20 % | 121 (15,7 %) | 33 (17,1 %) | 154 (16,0 %) | ||
Nach Befundung der präoperativen Bildgebung wurden 889 Fälle (88,9 %) dem cT1-Stadium (≤ 2 cm) und 111 Fälle (11,1 %) dem cT2-Stadium (> 2 cm) zugeordnet. Die überwiegende Mehrheit der 1001 Mammakarzinome war hormonrezeptorpositiv (96,9 %). Nur 8,5 % aller Tumoren hatten einen positiven HER2-Status und lediglich 5,4 % aller Fälle zeigten im Tumorgrading einen G3-Befund. Diese Zahlen unterstützen die Vermutung, dass in Deutschland triple-negative und HER2-positive Karzinome aktuell eher im neoadjuvanten Therapieansatz behandelt werden.
Die Detektionsrate für den Sentinel-Lymphknoten lag im SLNB-Arm (n = 755 nach Ausschluss der Drop-outs) bei 99,5 %. Nach Aufarbeitung von 751 durchgeführten SLNBs ergab der pathologische Nodalstatus folgende Verteilung: 83,0 % mit pN0 (n = 623); 2,8 % mit Nachweis einer Mikrometastasierung (pN1mi; n = 21); 12,9 % mit 1–2 Makrometastasen (n = 97); und 1,3 % mit ≥ 3 Makrometastasen (n = 10). Somit liegt die Rate der Fälle ohne Nachweis einer Makrometastasierung in den axillären Lymphknoten mit 85,8 % deutlich über den prognostizierten 70 % bei Protokollerstellung. Dies spricht für die Prüfzentren in der Selektion von INSEMA-Fällen durch eine umfassende präoperative Diagnostik (z. B. Sonografie ± Stanzbiopsie der Axilla). Andererseits erreichen viele Brustzentren (auch international) aktuell eine pN0-Rate von etwa 80 % für die SLNB durch den erhöhten Anteil von Screening-Patientinnen.
Diskussion
Onkologische Sicherheit bei Verzicht auf die SLNB
Die onkologische Sicherheit des Verzichts auf die SLNB wird häufig im Rahmen der INSEMA-Aufklärung hinterfragt. Der Anspruch auf maximale onkologische Sicherheit seitens der Patientin bzw. deren Familienangehörigen muss hier mit dem Wunsch nach Schonung der Axillaregion mit Vermeidung der operativen Morbidität in Einklang gebracht werden. Studien aus der Vor-SLNB-Ära haben den Stellenwert der ALND gegenüber keiner Axillachirurgie bei klinisch nicht befallenen axillären Lymphknoten verglichen. Auch wenn die Fallzahl in diesen Studien oft begrenzt ist, zeigen die Ergebnisse mit ausreichend langem Follow-up zwar eine geringfügig erhöhte Rate an axillären Rezidiven, die aber keinerlei Auswirkungen auf das krankheitsfreie Überleben oder auf das Gesamtüberleben hatte (Tab. 2).
Tab. 2 Prospektiv randomisierte Studien mit Verzicht auf die axilläre Lymphonodektomie bei Patientinnen mit einem frühen Mammakarzinom vs. kompletter Axilladissektion bzw. axillärer Strahlentherapie.
| Autor/Studie | Patienten | n | Follow-up | axilläre Rezidive | krankheitsfreies Überleben | Gesamtüberleben |
|---|---|---|---|---|---|---|
| # Veronesi et al. randomisierten Patienten ohne Axillachirurgie zu keiner weiteren Therapie vs. axillärer Strahlentherapie.* 42 % der Patienten mit Tumoren > 2 cmJ. = Jahre, Mon. = Monate, ME = Mastektomie, MRM = modifiziert radikale Mastektomie, DDFS = distantes krankheitsfreies Überleben | ||||||
| Fisher et al. 50 (2002)NSABP B-04 | jedes Alter, cN0, MRM vs. ME allein vs. ME plus Radiatio, keine Systemtherapie | 1 079 | 25 J. | 18,6 % im ME-allein-Arm | 19 vs. 19 vs. 13 %; p = 0,65 | 25 vs. 26 vs. 19 %; p = 0,68 |
| Veronesi et al. 51 (2005)# | > 45 J., Tumor < 1,2 cm, cN0 | 435 | 63 Mon. | 0,5 vs. 1,5 % | 97 vs. 95 %; p = 0,19 | 99 vs. 97 %; p = 0,23 |
| Rudenstam et al. 52 (2006) IBCSG 10-93 | > 60 J., pT1–2*, cN0 | 473 | 6,6 J. | 0,9 vs. 2,5 %; n. s. | 67 vs. 66 %; p = 0,69 | 75 vs. 73 %; p = 0,77 |
| Martelli et al. 53 (2014) | ≥ 65 J., pT1 cN0, Tamoxifen | 238 | 15 J. | 0 vs. 6 % | DDFS p = 0,95 | p = 0,64 |
| Agresti et al. 54 (2014) INT09/98 | 30–65 J., cT1cN0, Tamoxifen ± Chemotherapie | 565 | 10 J. | 0 vs. 9 % | 92,4 vs. 91,3 %; p = 0,9 | 93,3 vs. 91,5 %; p = 0,78 |
In der Diskussion hinsichtlich onkologischer Sicherheit muss auch erwähnt werden, dass in den randomisierten Studien, die zur Akzeptanz der SLNB in der klinischen Routine führten, die falsch negative Rate 5–8 % betrug, was aber auf das krankheitsfreie Überleben und das Gesamtüberleben keine Auswirkung hatte 5, 6.
In der IBCSG 23-01-Studie wurden 931 Patientinnen mit Mikrometastasen im SLN zu keiner weiteren Axillachirurgie bzw. kompletter Axilladissektion randomisiert 7. Nach adäquater Systemtherapie und Bestrahlung sowie einem medianen Follow-up von 5 Jahren waren die lokoregionäre Rezidivrate mit 0,9 % in beiden Armen wie auch das krankheitsfreie (87,8 vs. 84,4 %) und das Gesamtüberleben (98,0 vs. 97,6 %) nicht signifikant verschieden. Seit der Publikation dieser Daten wird bei einem pN1mi-Befund im Rahmen der SLNB auf die Komplettierung der Axilladissektion auch außerhalb von klinischen Studien generell verzichtet (St.-Gallen-2013-Konsensusempfehlung) 8.
Onkologische Sicherheit bei Verzicht auf die komplette Axilladissektion trotz Tumorzellnachweis im Rahmen der SLNB
Zu dieser Thematik gibt es bereits Daten von der ACOSOG Z0011-Studie, die erstmalig beim ASCO 2010 präsentiert und beim ASCO 2016 mit längerem Follow-up aktualisiert wurde. In der Z0011-Studie wurden knapp 900 Patientinnen mit BET sowie Mikro- und Makrometastasen im SLN zu keiner weiteren Axillachirurgie bzw. kompletten ALND randomisiert. Auch hier zeigten sich nach einem medianen Follow-up von 9,25 Jahren keine signifikanten Unterschiede in der Rate lokaler (5,6 % im ALND-Arm vs. 3,8 % im SLNB-allein-Arm; p = 0,13) und axillärer Rezidive (0,5 % im ALND-Arm vs. 1,5 % im SLNB-allein-Arm) bzw. beim lokoregionären rezidivfreien Überleben (p = 0,36) 9. Bemerkenswert ist, dass 4 der insgesamt 5 axillären Lymphknotenrezidive im alleinigen SLNB-Arm (1,5 %) innerhalb der ersten 5 Jahre auftraten. Im alleinigen SLNB-Arm wiesen immerhin 3,6 % der Fälle mehr als 2 Makrometastasen in der endgültigen Histologie auf.
Die bereits diskutierten Einschränkungen der Z0011-Studie (z. B. 37,5 % nur axilläre Mikrometastasierung im SLN, zahlreiche Protokollverletzungen im Rahmen der postoperativen Strahlentherapie) führten zum Start weiterer Validierungsstudien. Nahezu alle Nachfolgeprotokolle fokussieren auf Patienten mit axillärer Makrometastasierung im SLN. Interessanterweise weiten einige Studiengruppen die Einschlusskriterien über das klassische Z0011-Design deutlich aus: Einschluss von Mastektomiepatienten (POSNOC 10, SENOMAC 11, Dutch BOOG 2013-07 12, SINODAR ONE 13), Einschluss von Patienten mit SLNB vor neoadjuvanter Systemtherapie, Einschluss von T3-Tumoren und männlichen Patienten (SENOMAC 11), Einschluss von Patienten mit mehr als 2 Makrometastasen in der SLNB (Dutch BOOG 2013-07, French SERC/IPC 2012-001).
Notwendigkeit der 2. INSEMA-Randomisierung
Im Ergebnis der ACOSOG Z0011-Studie sehen viele Behandler den Verzicht auf die ALND bei befallenem SLN bereits als „Standard“ an. So werden in den USA bereits 54 % der Patientinnen mit 1–2 befallenen SLN nicht mehr einer kompletten Lymphonodektomie unterzogen 14. Die AGO-Mamma hat den Verzicht auf eine komplette ALND bei 1–2 befallenen SLN und brusterhaltender Operation mit einer +/−-Empfehlung eingestuft, also noch nicht zum Standard erklärt 15. Somit bleibt auch die 2. INSEMA-Randomisierung eine aktuell noch offene Fragestellung. Um die Aussagekraft der Validierungsstudien zu erhöhen, wird beispielsweise eine gemeinsame Auswertung der BET-Fälle von der SENOMAC- und INSEMA-Studienleitung angestrebt.
Um die Rekrutierung für die 2. Fragestellung der INSEMA-Studie zu verbessern, werden im aktuellen Protokoll-Amendment #4 folgende Änderungen vorgenommen:
Einschluss von Patientinen mit 1–3 Makrometastasen nach der SLNB;
deutsche Prüfzentren können auch direkt in die 2. Randomisierung rekrutieren.
Im Gegensatz zur ACOSOG Z0011 – in dieser Studie wiesen 37,5 % der Patientinnen „nur“ axilläre Mikrometastasen auf – werden in der INSEMA-Studie ausschließlich Patientinnen mit Makrometastasen eingeschlossen, sodass sich die axilläre Tumorlast in beiden Kollektiven deutlich unterscheiden wird 16. Zudem wird erwartet, dass die postoperative Strahlentherapie in beiden Studien nicht identisch sein wird. In der Z0011 erhielten etwa 50 % der Patienten eine sogenannte hohe Tangente mit signifikanter Dosis für die Axilla-Level I und II; zusätzlich wurden bei 18,9 % der Fälle die regionären Lymphabflussgebiete nicht protokollkonform bestrahlt. Andererseits erhielten 11 % der Patienten keine postoperative Ganzbrustbestrahlung 17. Im INSEMA-Protokoll wurde die Erfassung der tatsächlich applizierten Strahlentherapiedosis im jeweiligen Axilla-Level als sekundäres Studienziel aufgenommen. Integriert wurde zusätzlich ein zentrales Review der jeweils ersten 3 Strahlentherapieplanungen. Bis Ende August 2016 wurden 144 Bestrahlungspläne aus 58 Zentren begutachtet, wobei für 24 Zentren das Review bereits abgeschlossen ist.
Bedeutung des Kapseldurchbruchs bei befallenen Lymphknoten
Die Infiltration der Lymphknotenkapsel wie auch der Kapseldurchbruch mit extranodulärer Tumorausbreitung werden hinsichtlich ihrer prognostischen Bedeutung als Prognosefaktoren kontrovers diskutiert. So war in der 5. Ausgabe des „Cancer Staging Manual“ des American Joint Committee on Cancer (AJCC) die Kapselinfiltration/-durchbruch mit pN1biii klassifiziert worden, ist aber in der derzeitig gültigen 6. Ausgabe nicht mehr gesondert aufgeführt 18, 19. In der ACOSOG Z0011-Studie waren nur verbackene Lymphknoten („matted nodes“) oder der makroskopische extranodale Tumornachweis („grossly extranodal disease“) zum Zeitpunkt der SLNB ein Ausschlusskriterium.
In einer aktuellen Metaanalyse von 5 auswertbaren Studien mit insgesamt 624 Patientinnen (163 mit und 461 ohne Kapseldurchbruch) und einem medianen Follow-up von 58 Monaten zeigte sich eine signifikant erhöhte Rezidivrate (RR = 2,07, 95 %-KI: 1,38–3,10, p < 0,0001) und Mortalität (RR = 2,51; 95 %-KI: 1,66–3,79, p < 0,0001) für Patientinnen mit Kapseldurchbruch 20. Allerdings konnten andere Studien zeigen, dass eine extrakapsuläre Tumorausbreitung ≤ 2 mm und damit auch die alleinige Kapselinfiltration zu keiner signifikanten Prognoseverschlechterung führte 21, 22, 23, 24. Ein Kapseldurchbruch per se korrelierte signifikant mit weiteren befallenen axillären Lymphknoten und anderen ungünstigen Tumorparametern. Unter Berücksichtigung der ACOSOG Z0011-Kriterien (pT1–2, cN0, ≤ 2 positive SLNs) fanden sich in einem Gesamtkollektiv von 11 730 Patientinnen lediglich 1109 Fälle mit 1–2 positiven SLN in der H & E-Färbung. Davon zeigten 30 % der Patientinnen (n = 331) einen Kapseldurchbruch (≤ 2 mm: n = 180; > 2 mm: n = 151) 22. Die lokale operative Therapie in Form einer kompletten Axilladissektion bei Kapseldurchbruch scheint aber im Zeitalter einer modernen multimodalen Therapie nicht zwingend erforderlich zu sein. In einer Untersuchung aus dem Memorial Sloan-Kettering Cancer Center in New York wurden von 111 Patientinnen mit Kapseldurchbruch lediglich 45 Patientinnen einer Axilladissektion unterzogen. Bei den 66 Patientinnen ohne komplette Axilladissektion zeigte sich nach einem medianen Follow-up von 21 Monaten kein einziges Lokalrezidiv 25. Gegenwärtig existiert keine Standarddefinition für den Pathologen betreffend den Kapseldurchbruch. Neoplastische Emboli, freie Tumorzellnester im Fettgewebe oder Metastasen im Marginalsinus sollten nicht als relevanter Kapseldurchbruch dokumentiert werden 20. Der pathologische Befund „Sentinel-Makrometastase mit Kapseldurchbruch“ schließt eine Teilnahme an der INSEMA-Randomisierung 2 nicht aus. Somit entfällt auch die Notwendigkeit im INSEMA-Protokoll diesen Parameter zu definieren. Auch andere Studien (z. B. AMAROS, SENOMAC) rekrutierten bzw. rekrutieren Fälle mit Kapseldurchbruch bei nachweisbarer Lymphknotenmetastasierung.
Entscheidung zur Strahlentherapie der Lymphabflusswege (LAW) in Abhängigkeit vom Nodalstatus
In 3 prospektiv randomisierten Studien (MA.20, EORTC, French-trial) 26, 27, 28 und einer Kohortenstudie (DBCG-IMN) 29 wurden der Effekt einer Bestrahlung der regionären LAW (parasternal ± supraklavikulär) bei Patientinnen mit nodal-positiven oder nodal-negativen, High-Risk-Tumoren oder medialem Tumorsitz untersucht. Alle 3 randomisierten Studien konnte nach 10 Jahren Nachbeobachtung keinen signifikanten Vorteil für das Gesamtüberleben (primäres Studienziel) nachweisen. Erst eine Metaanalyse dieser 3 Studien konnte einen signifikanten Effekt (HR 0,90; 95 %-KI: 0,82–0,99) für die Bestrahlung der LAW aufweisen 30. In der dänischen Kohortenstudie DBCG-IMN wurde das primäre Studienziel erreicht (signifikanter Unterschied im Gesamtüberleben nach 8,9 Jahren: 75,9 % mit und 72,2 % ohne parasternale Bestrahlung; p = 0,005). Allerdings war dieser positive Effekt erst bei ≥ 4 befallenen axillären Lymphknoten nachweisbar. Bestätigt werden diese Daten in einer Kohortenstudie aus Schweden, in der die Bestrahlung der LAW bei Patientinnen mit 1–3 befallenen Lymphknoten keinen Überlebensvorteil zeigte, aber die bekannten Nebenwirkungen 31. In den AGO-Therapieempfehlungen wurde die Bestrahlung der LAW bei 1–3 befallenen axillären Lymphknoten nur bei weiteren Risikofaktoren (medialer/zentraler Tumorsitz, G2–3, ER/PgR-negativ, Prämenopause) mit einem einfachen „+“ (= begrenzter Nutzen, kann erfolgen) empfohlen 15.
Bei allen genannten Studien zur Strahlentherapie der LAW muss kritisch angemerkt werden, dass die Tumorbiologie hinsichtlich der intrinsischen Subtypen nur unzureichend berücksichtigt wurde und die Systemtherapie nicht den gegenwärtigen Standards entsprach (z. B. keine Anti-HER2-Therapie) 32. Weiterhin sind die Studienpopulationen mit dem INSEMA-Kollektiv nicht vergleichbar, da insbesondere der Anteil nodal-positiver Fälle deutlich höher ist (MA.20-Studie: 90 % pN+, DBCG-IMN: 100 % pN+). Die klare Indikation zur Radiatio der LAW ab 4 oder mehr befallenen Lymphknoten (≥ pN2a-Stadium) wurde im aktuellen INSEMA-Protokoll (Amendment #4) aufgenommen.
Zur axillären Rezidivrate in Studien mit alleiniger Teilbrustbestrahlung
Gegenwärtig wird angenommen, dass im Rahmen der BET durch die postoperative Ganzbrustbestrahlung das Auftreten axillärer Rezidive, selbst im Kollektiv mit negativer SLNB, minimiert wird 33. Tatsächlich erfolgt selbst bei den sogenannten „Standard-Tangenten“ eine signifikante Mitbestrahlung der ipsilateralen Axilla, zumindest im Level I 34. Dieser Fakt wird maßgeblich auch zur Erklärung der Ergebnisse der Z0011-Studie herangezogen. Mit modernen Bestrahlungstechniken (z. B. Rapid-Arc-Technologie) könnte in naher Zukunft diese „Mitbestrahlung“ der ipsilateralen Axillaregion reduziert werden.
Unter diesem Gesichtspunkt ist die Auswertung der publizierten Studien mit alleiniger Teilbrustbestrahlung äußerst interessant. Hier dürfte in Abhängigkeit vom jeweiligen Tumorsitz keine oder nur eine geringe Mitbestrahlung der ipsilateralen Axilla-Levels erfolgen. Die Auswertung von 5 Studien zu dieser Fragestellung ist in Tab. 3 zusammengefasst. Hier zeigte jedoch nur die ELIOT-Studie eine signifikant höhere Rezidivrate in den regionären Lymphknoten 35. Demgegenüber war in der TARGIT-A- bzw. in der GEC-ESTRO-Studie kein signifikanter Unterschied zwischen den Behandlungsarmen nachzuweisen 36, 37. Eine Erklärung ist sicherlich der deutlich höhere Anteil nodal-positiver Fälle in der ELIOT-Studie. Trotzdem ist auch die axilläre Rezidivrate mit 1,4 % nach alleiniger intraoperativer Teilbrustbestrahlung in der ELIOT-Studie sehr gering. Eine Metaanalyse, in der die Daten von 3 Studien nach 5 bzw. 8 Jahren Nachbeobachtung berücksichtigt wurden, erbrachte keine signifikant erhöhte axilläre Rezidivrate nach alleiniger Teilbrustbestrahlung 38.
Tab. 3 Axilläre Rezidivraten in Studien mit dem Vergleich Ganzbrustbestrahlung vs. alleiniger Teilbrustbestrahlung im Rahmen einer brusterhaltenden Therapie.
| Studie | Fallzahl (n) | Anteil pN+ | Follow-up | Rezidive regionäre Lymphknoten (n) | p-Wert | |
|---|---|---|---|---|---|---|
| WBI | PBI | |||||
| WBI = Whole Breast Irradiation/Ganzbrustbestrahlung, PBI = Partial Breast Irradiation/Teilbrustbestrahlung | ||||||
| Dodwell 55 (2005) | 174 | 41 % (PBI-Arm) | 8 J. | 4 | 10 | 0,05 |
| Rodriguez 56 (2013) | 102 | 0 % | 5 J. | 0 | 0 | n. s. |
| ELIOT 35 (2013) | 1 305 | 26 % | 5,8 J. | 2 | 9 | 0,03 |
| TARGIT-A 36 (2014) | 3 451 | 16 % | 5 J. | 6 | 8 | 0,609 |
| GEC-ESTRO 37 (2016) | 1 184 | 1 % pN1mi | 5 J. | 1 | 3 | 0,39 |
Somit gibt es keine eindeutigen Hinweise, dass in einem Low-Risk-SLNB-Kollektiv die Minimierung der postoperativen Strahlentherapie der Restbrust die axilläre Rezidivrate erhöhen muss. Es ist unklar, ob auch im Kollektiv mit alleiniger Teilbrustbestrahlung das Konzept mit Verzicht auf eine SLNB verfolgt werden kann. Aktuell bedeutet die Teilnahme an der INSEMA-Studie, dass eine alleinige Teilbrustbestrahlung nicht angewendet werden darf. Die Ergebnisse von SOUND und INSEMA werden sich somit nicht auf diese Patientengruppe übertragen lassen. Hier würde sich eine interessante und relevante Fragestellung für ein INSEMA-Nachfolgeprojekt anbieten.
Entscheidung zur System- und Strahlentherapie ohne Kenntnis des Nodalstatus
Mit der Subtypisierung der Mammakarzinome aufgrund des Hormonrezeptor-(HR-), HER2-Status, Grading und Ki-67 erfolgt die Systemtherapie nach den intrinsischen Subtypen und weniger nach dem Nodalstatus 39. Bei triple-negativen und HER2-positiven (ab Stadium pT1b) Tumoren ist immer eine Chemotherapie ± Anti-HER2-Therapie indiziert. Es besteht in allen Leitlinien und Therapieempfehlungen Konsens, dass bei Luminal-like-Tumoren und Befall axillärer Lymphknoten nicht automatisch eine Chemotherapie indiziert ist 15, 40, 41, 42, 43, 44, 45. Insbesondere beim Luminal-A-Subtyp und ≤ 3 befallenen Lymphknoten ist eine alleinige endokrine Therapie ausreichend 46. Die Auswertung der ABCSG-8-Studie (HR-positive Fälle, alleinige endokrine Therapie) unter Nutzung des PAM50-Tests zur Klassifikation nach intrinsischen Subtypen ergab deutliche Unterschiede in der nodal-positiven Subgruppe (n = 431) in Abhängigkeit vom Luminal-Status. Das fernmetastasenfreie 10-Jahres-Überleben war 90,6 % für die nodal-positiven Luminal-A-Tumoren verglichen mit 71,0 % für die nodal-positiven Luminal B-Tumoren 47. Bei 4 und mehr befallenen Lymphknoten besteht beim Luminal-like-Subtyp eine Indikation zur Chemotherapie (Tab. 4).
Tab. 4 Indikationen für eine adjuvante postoperative Chemotherapie in Abhängigkeit von der Tumorbiologie gemäß der aktuellen St.-Gallen-Konsensusempfehlungen 46.
| MaCa-Subtyp | Indikatoren für eine postoperative Chemotherapie | Bemerkungen |
|---|---|---|
| Luminal-like |
|
* … Die Rate von pN+ mit ≥ 4 positiven Lymphknoten wird in der gesamten Non-SLNB-Population mit 3,7 % erwartet (nach AMAROS-Daten 57). Somit wird der Anteil der Luminal-like-Fälle in INSEMA mit pN+(≥ 4 LKs) maximal 3 % der Non-SLNB-Population betragen. |
| HER2-positiv | Chemotherapie in Kombination mit Anti-HER2-Therapie ab Stadium pT1b unabhängig vom Nodalstatus | keine Anti-HER2-Therapie im Stadium pT1a |
| TNBC (triple-negativ) | Chemotherapie unabhängig vom Nodalstatus |
Im Non-SLNB-Arm der INSEMA-Studie fehlt natürlich diese Information hinsichtlich der Anzahl befallener Lymphknoten. Nach Auswertung der AMAROS-Daten wurde für INSEMA erwartet, dass in einem SLNB-Kollektiv etwa bei 3 % aller Luminal-like-Tumoren mehr als 3 befallene Lymphknoten vorhanden sein könnten 48. Nach Rekrutierung der ersten 1001 Patienten waren im INSEMA-Kontrollarm mit Durchführung einer SLNB nur in 11 Fällen von 771 SLNBs (1,4 %) 3 und mehr befallene Lymphknoten nachweisbar. Von den 11 Patientinnen hatten 8 Fälle 3 und jeweils eine Patientin 4, 5 bzw. 6 befallene Lymphknoten, sodass der Anteil von Patientinnen mit dem relevanten Stadium pN2a nur 0,375 % beträgt. Somit ist theoretisch bei 99 % aller INSEMA-Patientinnen ohne SLNB allein aufgrund der tumorbiologischen Parameter eine leitlinienkonforme Systemtherapie möglich.
Kontrovers ist analog die Diskussion zur Indikation einer Radiatio der regionären LAW (ohne Axilla) in Abhängigkeit vom Nodalstatus bzw. Anzahl befallener Lymphknoten (siehe oben). Eine klare Indikation besteht in den meisten Leitlinien und Empfehlungen nur bei mehr als 3 positiven axillären Lymphknoten 49. Somit trifft dies für INSEMA-Patientinnen wiederum nur in Einzelfällen zu. In der aktuellen INSEMA-Protokollversion (Amendment #4) wurde diese Therapieempfehlung nach der Volltext-Publikation der MA.20- und EORTC-Daten berücksichtigt.
Fazit für die Praxis
Erwartungsgemäß zeigen sich nach Einschluss der ersten 1001 Patientinnen in die INSEMA-Studie keine unerwarteten Ereignisse. Die Akzeptanz einer Studienteilnahme ist bei Patientinnen und Ärzten sehr hoch. Erfreulicherweise spielen ökonomische Aspekte, wie das DRG-Downgrading durch Vermeidung der SLNB (Wechsel von der DRG J07B zu J25Z), für die teilnehmenden Prüfzentren keine vordergründige Rolle. Perspektivisch müssen hier jedoch Nachverhandlungen mit den Kostenträgern erfolgen, um eine Entkopplung der DRG von der Durchführung einer SLNB (wie z. B. in Österreich bereits der Fall) zu erreichen. Der Anteil von Patientinnen mit pN0/pN1mi-Status ist im Kontrollarm mit Durchführung der SLNB sehr hoch (83 % pN0, 3 % pN1mi). Hier findet vor Rekrutierung sicherlich eine gewisse Selektion an den Prüfzentren statt bzw. werden High-Risk-Fälle eher im neoadjuvanten Ansatz behandelt. In der neoadjuvanten Situation gibt es ebenfalls Ansätze, die Radikalität der Axillachirurgie zu reduzieren; insbesondere nach Publikation der SENTINA- und ACOSOG Z1071-Daten. Die postoperative Therapieentscheidung hinsichtlich der adjuvanten System- und Strahlentherapie kann auch ohne Kenntnis des Nodalstatus in fast allen Fällen anhand der verfügbaren Tumorparameter leitliniengerecht erfolgen. Nachfolgende Studienkonzepte sollten die Vermeidung einer axillären SLNB bei Patientinnen mit einer Mastektomieindikation und mit einer alleinigen Teilbrustbestrahlung nach einer brusterhaltenden Operation untersuchen.
Acknowledgements
We thank the patients and trial centres for their participation in the INSEMA trial, see Table 5 for the top 10 recruiting trial centres. The INSEMA trial is financially supported by the Deutsche Krebshilfe gGmbH (Bonn, Projekt 110 580). Mrs S. Klöcking enabled access to data from the Rostock clinical cancer registry.
Table 5 Top 10 INSEMA trial recruiting centres (at 30.06.2016; n = 1 000 for Rando1).
| Trial centre | Location | Patients (rando1) | Patients (rando2) |
|---|---|---|---|
| University Womenʼs Hospital at Klinikum Südstadt | Rostock | 73 | 8 |
| University Hospital | Ulm | 37 | 3 |
| Ev. Waldkrankenhaus Spandau | Berlin | 33 | 2 |
| University Hospital | Heidelberg | 30 | 2 |
| Klinikum Hanau GmbH | Hanau | 30 | 2 |
| Breast Centre/Practice Network | Troisdorf | 30 | 3 |
| Niels-Stensen-Kliniken, Franziskus-Hospital Harderberg | Georgsmarienhütte | 29 | 4 |
| HELIOS Klinikum | Schwerin | 29 | 2 |
| Klinikum Worms gGmbH | Worms | 25 | 1 |
| Klinikum Esslingen | Esslingen a. N. | 25 | 2 |
Danksagung
Wir danken den Patientinnen und Prüfzentren für ihre Teilnahme an der INSEMA-Studie, siehe Tab. 5 für die 10 am besten rekrutierenden Prüfzentren. Finanziell wird die INSEMA-Studie durch die Deutsche Krebshilfe gGmbH (Bonn, Projekt 110580) unterstützt. Daten aus dem Klinischen Krebsregister Rostock wurden von Frau S. Klöcking zur Verfügung gestellt.
Tab. 5 Top-10-Rekrutierer der INSEMA-Studie (Stand 30.06.2016; n = 1 000 für Rando1).
| Prüfzentrum | Ort | Patientinnen (Rando1) | Patientinnen (Rando2) |
|---|---|---|---|
| Univ.-Frauenklinik am Klinikum Südstadt | Rostock | 73 | 8 |
| Univ.-Klinikum | Ulm | 37 | 3 |
| Ev. Waldkrankenhaus Spandau | Berlin | 33 | 2 |
| Univ.-Klinikum | Heidelberg | 30 | 2 |
| Klinikum Hanau GmbH | Hanau | 30 | 2 |
| Brustzentrum/Praxisnetzwerk | Troisdorf | 30 | 3 |
| Niels-Stensen-Kliniken, Franziskus-Hospital Harderberg | Georgsmarienhütte | 29 | 4 |
| HELIOS Klinikum | Schwerin | 29 | 2 |
| Klinikum Worms gGmbH | Worms | 25 | 1 |
| Klinikum Esslingen | Esslingen a. N. | 25 | 2 |
Footnotes
Conflict of Interest/Interessenkonflikt None./Nein.
References/Literatur
- 1.Giuliano A E, McCall L, Beitsch P. Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases: the American College of Surgeons Oncology Group Z0011 randomized trial. Ann Surg. 2010;252:426–432. doi: 10.1097/SLA.0b013e3181f08f32. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Gerber B, Heintze K, Stubert J. Axillary lymph node dissection in early-stage invasive breast cancer: is it still standard today? Breast Cancer Res Treat. 2011;128:613–624. doi: 10.1007/s10549-011-1532-0. [DOI] [PubMed] [Google Scholar]
- 3.Reimer T, Hartmann S, Stachs A. Local treatment of the axilla in early breast cancer: concepts from the national surgical adjuvant breast and bowel project B-04 to the planned intergroup sentinel mamma trial. Breast Care (Basel) 2014;9:87–95. doi: 10.1159/000360411. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Gentilini O, Botteri E, Dadda P. Physical function of the upper limb after breast cancer surgery. Results from the SOUND (Sentinel node vs. Observation after axillary Ultra-souND) trial. Eur J Surg Oncol. 2016;42:685–689. doi: 10.1016/j.ejso.2016.01.020. [DOI] [PubMed] [Google Scholar]
- 5.Lyman G H, Temin S, Edge S B. Sentinel lymph node biopsy for patients with early-stage breast cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2014;32:1365–1383. doi: 10.1200/JCO.2013.54.1177. [DOI] [PubMed] [Google Scholar]
- 6.Galimberti V, Manika A, Maisonneuve P. Long-term follow-up of 5262 breast cancer patients with negative sentinel node and no axillary dissection confirms low rate of axillary disease. Eur J Surg Oncol. 2014;40:1203–1208. doi: 10.1016/j.ejso.2014.07.041. [DOI] [PubMed] [Google Scholar]
- 7.Galimberti V, Cole B F, Zurrida S. Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases (IBCSG 23-01): a phase 3 randomised controlled trial. Lancet Oncol. 2013;14:297–305. doi: 10.1016/S1470-2045(13)70035-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Goldhirsch A, Winer E P, Coates A S. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol. 2013;24:2206–2223. doi: 10.1093/annonc/mdt303. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Giuliano A E, Ballman K, McCall L. Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases: long-term follow-up from the American College of Surgeons Oncology Group (Alliance) ACOSOG Z0011 randomized trial. Ann Surg. 2016;264:413–420. doi: 10.1097/SLA.0000000000001863. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Goyal A, Dodwell D. POSNOC: a randomised trial looking at axillary treatment in women with one or two sentinel nodes with macrometastases. Clin Oncol (R Coll Radiol) 2015;27:692–695. doi: 10.1016/j.clon.2015.07.005. [DOI] [PubMed] [Google Scholar]
- 11.Senomac 2016. Online:http://www.senomac.selast access: 20.09.2016
- 12.van Roozendaal L M, de Wilt J H, van Dalen T. The value of completion axillary treatment in sentinel node positive breast cancer patients undergoing a mastectomy: a Dutch randomized controlled multicentre trial (BOOG 2013-07) BMC Cancer. 2015;15:610. doi: 10.1186/s12885-015-1613-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Tinterri C, Canavese G, Bruzzi P. SINODAR ONE, an ongoing randomized clinical trial to assess the role of axillary surgery in breast cancer patients with one or two macrometastatic sentinel nodes. Breast. 2016;30:197–200. doi: 10.1016/j.breast.2016.06.016. [DOI] [PubMed] [Google Scholar]
- 14.Caretta-Weyer H, Greenberg C G, Wilke L G. Impact of the American College of Surgeons Oncology Group (ACOSOG) Z0011 trial on clinical management of the axilla in older breast cancer patients: a SEER-medicare analysis. Ann Surg Oncol. 2013;20:4145–4152. doi: 10.1245/s10434-013-3193-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.AGO Diagnostic and treatment of early and metastatic breast cancer 2016. Online:http://www.ago-online.orglast access: 20.09.2016
- 16.Giuliano A E, Hunt K K, Ballman K V. Axillary dissection vs. no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial. JAMA. 2011;305:569–575. doi: 10.1001/jama.2011.90. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Jagsi R, Chadha M, Moni J. Radiation field design in the ACOSOG Z0011 (Alliance) Trial. J Clin Oncol. 2014;32:3600–3606. doi: 10.1200/JCO.2014.56.5838. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Greene F L, Page D L, Fleming I D, Fritz A G, Balch C M, Haller D G, Morrow M.eds.AMERICAN JOINT COMMITTEE ON CANCER: Cancer Staging Manual. 6th ed New York: Springer; 2002 [Google Scholar]
- 19.Fleming I D, Henson D E. Philadelphia, PA: Lippincott-Raven; 1997. AJCC Cancer Staging Manual. [Google Scholar]
- 20.Nottegar A, Veronese N, Senthil M. Extra-nodal extension of sentinel lymph node metastasis is a marker of poor prognosis in breast cancer patients: a systematic review and an exploratory meta-analysis. Eur J Surg Oncol. 2016;42:919–925. doi: 10.1016/j.ejso.2016.02.259. [DOI] [PubMed] [Google Scholar]
- 21.Choi A H, Blount S, Perez M N. Size of extranodal extension on sentinel lymph node dissection in the American College of Surgeons Oncology Group Z0011 trial era. JAMA Surg. 2015;150:1141–1148. doi: 10.1001/jamasurg.2015.1687. [DOI] [PubMed] [Google Scholar]
- 22.Gooch J, King T A, Eaton A. The extent of extracapsular extension may influence the need for axillary lymph node dissection in patients with T1-T2 breast cancer. Ann Surg Oncol. 2014;21:2897–2903. doi: 10.1245/s10434-014-3752-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Mittendorf E A, Hunt K K, Boughey J C. Incorporation of sentinel lymph node metastasis size into a nomogram predicting nonsentinel lymph node involvement in breast cancer patients with a positive sentinel lymph node. Ann Surg. 2012;255:109–115. doi: 10.1097/SLA.0b013e318238f461. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Caudle A S, Kuerer H M, Le-Petross H T. Predicting the extent of nodal disease in early-stage breast cancer. Ann Surg Oncol. 2014;21:3440–3447. doi: 10.1245/s10434-014-3813-4. [DOI] [PubMed] [Google Scholar]
- 25.Dengel L C, King T A.The presence and extent of extracapsular extension (ECE) and the need for axillary lymph node dissection (ALND) in patients who meet ACOSOG Z11 eligibility criteria J Clin Oncol 201331(Suppl.)Abstr. 1019 [Google Scholar]
- 26.Whelan T J, Olivotto I A, Parulekar W R. Regional nodal irradiation in early-stage breast cancer. N Engl J Med. 2015;373:307–316. doi: 10.1056/NEJMoa1415340. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Poortmans P M, Collette S, Kirkove C. Internal mammary and medial supraclavicular irradiation in breast cancer. N Engl J Med. 2015;373:317–327. doi: 10.1056/NEJMoa1415369. [DOI] [PubMed] [Google Scholar]
- 28.Hennequin C, Bossard N, Servagi-Vernat S. Ten-year survival results of a randomized trial of irradiation of internal mammary nodes after mastectomy. Int J Radiat Oncol Biol Phys. 2013;86:860–866. doi: 10.1016/j.ijrobp.2013.03.021. [DOI] [PubMed] [Google Scholar]
- 29.Thorsen L B, Offersen B V, Dano H. DBCG-IMN: a population-based cohort study on the effect of internal mammary node irradiation in early node-positive breast cancer. J Clin Oncol. 2016;34:314–320. doi: 10.1200/JCO.2015.63.6456. [DOI] [PubMed] [Google Scholar]
- 30.Budach W, Bölke E, Kammers K. Adjuvant radiation therapy of regional lymph nodes in breast cancer - a meta-analysis of randomized trials- an update. Radiat Oncol. 2015;10:258. doi: 10.1186/s13014-015-0568-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Nordenskjold A E, Fohlin H, Albertsson P. No clear effect of postoperative radiotherapy on survival of breast cancer patients with one to three positive nodes: a population-based study. Ann Oncol. 2015;26:1149–1154. doi: 10.1093/annonc/mdv159. [DOI] [PubMed] [Google Scholar]
- 32.Speers C, Pierce L J. Postoperative radiotherapy after breast-conserving surgery for early-stage breast cancer: a review. JAMA Oncology. 2016;2:1075–1082. doi: 10.1001/jamaoncol.2015.5805. [DOI] [PubMed] [Google Scholar]
- 33.van Wely B J, Teerenstra S, Schinagl D A. Systematic review of the effect of external beam radiation therapy to the breast on axillary recurrence after negative sentinel lymph node biopsy. Br J Surg. 2011;98:326–333. doi: 10.1002/bjs.7360. [DOI] [PubMed] [Google Scholar]
- 34.Belkacemi Y, Allab-Pan Q, Bigorie V. The standard tangential fields used for breast irradiation do not allow optimal coverage and dose distribution in axillary levels I–II and the sentinel node area. Ann Oncol. 2013;24:2023–2028. doi: 10.1093/annonc/mdt151. [DOI] [PubMed] [Google Scholar]
- 35.Veronesi U, Orecchia R, Maisonneuve P. Intraoperative radiotherapy versus external radiotherapy for early breast cancer (ELIOT): a randomised controlled equivalence trial. Lancet Oncol. 2013;14:1269–1277. doi: 10.1016/S1470-2045(13)70497-2. [DOI] [PubMed] [Google Scholar]
- 36.Vaidya J S, Wenz F, Bulsara M. Risk-adapted targeted intraoperative radiotherapy versus whole-breast radiotherapy for breast cancer: 5-year results for local control and overall survival from the TARGIT-A randomised trial. Lancet. 2014;383:603–613. doi: 10.1016/S0140-6736(13)61950-9. [DOI] [PubMed] [Google Scholar]
- 37.Strnad V, Ott O J, Hildebrandt G. 5-year results of accelerated partial breast irradiation using sole interstitial multicatheter brachytherapy versus whole-breast irradiation with boost after breast-conserving surgery for low-risk invasive and in-situ carcinoma of the female breast: a randomised, phase 3, non-inferiority trial. Lancet. 2016;387:229–238. doi: 10.1016/S0140-6736(15)00471-7. [DOI] [PubMed] [Google Scholar]
- 38.Marta G N, Macedo C R, Carvalho Hde A. Accelerated partial irradiation for breast cancer: systematic review and meta-analysis of 8653 women in eight randomized trials. Radiother Oncol. 2015;114:42–49. doi: 10.1016/j.radonc.2014.11.014. [DOI] [PubMed] [Google Scholar]
- 39.Sorlie T, Perou C M, Tibshirani R. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A. 2001;98:10869–10874. doi: 10.1073/pnas.191367098. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Anampa J, Makower D, Sparano J A. Progress in adjuvant chemotherapy for breast cancer: an overview. BMC Med. 2015;13:195. doi: 10.1186/s12916-015-0439-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Freedman O C, Fletcher G G, Gandhi S. Adjuvant endocrine therapy for early breast cancer: a systematic review of the evidence for the 2014 Cancer Care Ontario systemic therapy guideline. Curr Oncol. 2015;22:S95–S113. doi: 10.3747/co.22.2326. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Gandhi S, Fletcher G G, Eisen A. Adjuvant chemotherapy for early female breast cancer: a systematic review of the evidence for the 2014 Cancer Care Ontario systemic therapy guideline. Curr Oncol. 2015;22:S82–S94. doi: 10.3747/co.22.2321. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Gradishar W J, Anderson B O, Balassanian R. NCCN Guidelines Insights Breast Cancer, Version 1.2016. J Natl Compr Canc Netw. 2015;13:1475–1485. doi: 10.6004/jnccn.2015.0176. [DOI] [PubMed] [Google Scholar]
- 44.Henry N L, Somerfield M R, Abramson V G. Role of patient and disease factors in adjuvant systemic therapy decision making for early-stage, operable breast cancer: American Society of Clinical Oncology Endorsement of Cancer Care Ontario Guideline Recommendations. J Clin Oncol. 2016;34:2303–2311. doi: 10.1200/JCO.2015.65.8609. [DOI] [PubMed] [Google Scholar]
- 45.Mates M, Fletcher G G, Freedman O C. Systemic targeted therapy for HER2-positive early female breast cancer: a systematic review of the evidence for the 2014 Cancer Care Ontario systemic therapy guideline. Curr Oncol. 2015;22:S114–S122. doi: 10.3747/co.22.2322. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Coates A S, Winer E P, Goldhirsch A. Tailoring therapies-improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann Oncol. 2015;26:1533–1546. doi: 10.1093/annonc/mdv221. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Gnant M, Filipts M, Greil R. Predicting distant recurrences in receptor-positive breast cancer patients with limited clinicopathological risk: using the PAM50 risk of recurrence score in 1478 postmenopausal patients of the ABCSG-8 trial treated with adjuvant endocrine therapy alone. Ann Oncol. 2014;25:339–345. doi: 10.1093/annonc/mdt494. [DOI] [PubMed] [Google Scholar]
- 48.Straver M E, Meijnen P, van Tienhoven G. Role of axillary clearance after a tumor-positive sentinel node in the administration of adjuvant therapy in early breast cancer. J Clin Oncol. 2010;28:731–737. doi: 10.1200/JCO.2008.21.7554. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Burstein H J, Morrow M. Nodal irradiation after breast-cancer surgery in the era of effective adjuvant therapy. N Engl J Med. 2015;373:379–381. doi: 10.1056/NEJMe1503608. [DOI] [PubMed] [Google Scholar]
- 50.Fisher B, Anderson S, Bryant J. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med. 2002;347:1233–1241. doi: 10.1056/NEJMoa022152. [DOI] [PubMed] [Google Scholar]
- 51.Intra M, Trifiro G, Viale G. Second biopsy of axillary sentinel lymph node for reappearing breast cancer after previous sentinel lymph node biopsy. Ann Surg Oncol. 2005;12:895–899. doi: 10.1245/ASO.2005.10.018. [DOI] [PubMed] [Google Scholar]
- 52.Rudenstam C M, Zahrieh D, Forbes J F. Randomized trial comparing axillary clearance versus no axillary clearance in older patients with breast cancer: first results of International Breast Cancer Study Group Trial 10-93. J Clin Oncol. 2006;24:337–344. doi: 10.1200/JCO.2005.01.5784. [DOI] [PubMed] [Google Scholar]
- 53.Martelli G, Boracchi P, Orenti A. Axillary dissection versus no axillary dissection in older T1N0 breast cancer patients: 15-year results of trial and out-trial patients. Eur J Surg Oncol. 2014;40:805–812. doi: 10.1016/j.ejso.2014.03.029. [DOI] [PubMed] [Google Scholar]
- 54.Agresti R, Martelli G, Sandri M. Axillary lymph node dissection versus no dissection in patients with T1N0 breast cancer: a randomized clinical trial (INT09/98) Cancer. 2014;120:885–893. doi: 10.1002/cncr.28499. [DOI] [PubMed] [Google Scholar]
- 55.Dodwell D J, Dyker K, Brown J. A randomised study of whole-breast vs. tumour-bed irradiation after local excision and axillary dissection for early breast cancer. Clin Oncol (R Coll Radiol) 2005;17:618–622. doi: 10.1016/j.clon.2005.07.018. [DOI] [PubMed] [Google Scholar]
- 56.Rodriguez N, Sanz X, Dengra J. Five-year outcomes, cosmesis, and toxicity with 3-dimensional conformal external beam radiation therapy to deliver accelerated partial breast irradiation. Int J Radiat Oncol Biol Phys. 2013;87:1051–1057. doi: 10.1016/j.ijrobp.2013.08.046. [DOI] [PubMed] [Google Scholar]
- 57.Straver M E, Meijnen P, van Tienhoven G. Sentinel node identification rate and nodal involvement in the EORTC 10981-22023 AMAROS trial. Ann Surg Oncol. 2010;17:1854–1861. doi: 10.1245/s10434-010-0945-z. [DOI] [PMC free article] [PubMed] [Google Scholar]


