Résumé
Objectif
Permettre aux médecins de famille de comprendre l’épidémiologie, le tableau clinique, le diagnostic et la prise en charge de l’hidradénite suppurée.
Sources d’information
Une recherche de la littérature a été effectuée sur PubMed à l’aide des mots-clés MeSH hidradenitis suppurativa.
Message principal
L’hidradénite suppurée est une affection cutanée chronique, récidivante et incapacitante. C’est un trouble inflammatoire de l’épithélium folliculaire, bien qu’une infection bactérienne secondaire se produise souvent. Le diagnostic, posé en clinique, repose sur les lésions typiques (nodules, abcès, tractus sinusal), le siège (plis cutanés), la nature des rechutes et le caractère chronique. De nombreuses comorbidités sont associées à l’hidradénite suppurée, y compris l’obésité, le syndrome métabolique, la maladie intestinale inflammatoire et la spondylarthropathie. Même si l’absence de traitement curatif et la nature récidivante de l’hidradénite suppurée en compliquent le traitement, il existe des options efficaces pour prendre en charge les symptômes.
Conclusion
Les médecins de famille doivent soupçonner l’hidradénite suppurée chez les patients qui présentent des abcès cutanés récidivants dans les plis cutanés. Les médecins de famille jouent un rôle important dans le diagnostic précoce, l’instauration du traitement et la recommandation en dermatologie avant que l’hidradénite suppurée ne progresse vers une atteinte terminale incapacitante.
L’hidradénite suppurée, aussi connue sous le nom d’acné inversée, est une affection cutanée inflammatoire chronique, récidivante et incapacitante1,2. C’est un trouble de l’épithélium folliculaire qui se manifeste fréquemment sous les aisselles, dans les plis inframammaires et à l’aine1,3. Les lésions précoces de l’hidradénite suppurée ressemblent à celles d’autres affections cutanées et c’est pourquoi on pose souvent un diagnostic erroné de furonculose ou de furoncles récidivants. Le délai avant le diagnostic peut atteindre 12 années ou plus4. En reconnaissant les symptômes et en amorçant le traitement de façon hâtive, on peut réduire le risque que l’hidradénite suppurée évolue en une affection terminale incapacitante. Les effets psychosociaux de la maladie sont dévastateurs en raison de la douleur, des pertes malodorantes et des cicatrices qui y sont associées. En fait, l’hidradénite suppurée est associée à une plus grande perturbation de la qualité de vie et des activités professionnelles que les autres affections chroniques de la peau, comme le psoriasis ou la dermatite atopique3,5.
Description de cas
Un homme obèse de 45 ans présente des d’abcès cutanés sous les aisselles et à l’aine, qui récidivent depuis la fin de la vingtaine, et certaines de ces lésions ont avec le temps formé des tractus sinusaux. Il présente également depuis longtemps des lésions de type acnéique dans le haut du dos et à la taille. Un diagnostic d’hidradénite suppurée est posé. Le patient est traité avec de la clindamycine et de la rifampicine pendant 2 mois, de la tétracycline pendant un an, de l’isotrétinoïne pendant 9 mois et de l’acitrétine pendant 6 mois. Malheureusement, les récidives d’hidradénite suppurée continuent de se manifester et les cicatrices sont sévères sous les aisselles.
Sources de l’information
À l’aide des mots-clés MeSH hidradenitis suppurativa, nous avons effectué une recherche dans les publications PubMed pour relever des essais randomisés contrôlés, des revues systématiques, des études d’observation, des séries de cas et des rapports de cas entre la date la plus reculée possible et février 2015. Seuls les articles publiés en anglais ont été inclus. Nous avons aussi manuellement dépouillé les listes de références des articles relevés.
Message principal
L’hidradénite suppurée est-elle fréquente?
La prévalence d’hidradénite suppurée est d’environ 1 à 4 % en Europe, mais elle est inférieure en Amérique du Nord6–8. L’hidradénite suppurée se manifeste plus souvent chez les femmes, le ratio femme : homme étant de 4:18. La maladie apparaît habituellement après la puberté et avant 40 ans, le pic se situant dans la deuxième et la troisième décennie de vie9. Bien que l’hidradénite suppurée soit rare chez les enfants prépubères, l’affection a été rapportée chez un enfant aussi jeune que 6 ans10.
Quelle est la cause de l’hidradénite suppurée?
La cause est nébuleuse, mais est probablement multifactorielle. L’hérédité joue un rôle, puisque jusqu’à 40 % des patients atteints présentent des antécédents familiaux, mais il n’existe pas d’étude de concordance monozygote portant sur l’hidradénite suppurée11. Bien que l’hidradénite suppurée se transmette rarement selon un mode autosomique dominant, ce type de transmission a été rapporté12. On ignore quel est le locus du gène responsable de l’hidradénite suppurée, mais la mutation γ-sécrétase a été associée à la maladie13.
Plusieurs facteurs exogènes sont associés à l’hidradénite suppurée. Les hormones jouent un rôle puisque l’affection apparaît après la puberté et avant la ménopause. Particulièrement, les médicaments à base d’androgènes la précipitent ou l’aggravent, et les agents anti-androgéniques sont utilisés dans son traitement10. En outre, l’obésité serait un facteur d’aggravation, probablement en raison du stress mécanique accru sur la peau des régions intertrigineuses3. L’obésité est observée plus souvent dans les cas d’hidradénite suppurée, mais la corrélation entre l’indice de masse corporelle et la sévérité de l’affection est controversée7,9. Finalement, le lien entre le tabagisme et l’hidradénite suppurée est bien documenté, l’incidence d’hidradénite suppurée est plus élevée chez les fumeurs que chez les non-fumeurs7,14,15.
Bien que l’hidradénite suppurée ait toujours été jugée comme une maladie des glandes sudoripares, les données actuelles laissent croire qu’il s’agit d’un trouble de l’épithélium folliculaire découlant d’un stress mécanique répétitif chez les personnes génétiquement vulnérables2,3. Plus précisément, l’hidradénite suppurée commence par un bouchon folliculaire causé par les facteurs exogènes mentionnés ci-dessus. L’unité pilosébacée bouchée s’enflamme alors et forme un abcès. La rupture folliculaire subséquente favorise la formation de tractus sinusaux, lesquels s’infectent aussi3,16.
Quel est le tableau clinique de l’HS?
L’hidradénite suppurée se manifeste habituellement par des nodules inflammatoires, des abcès, des comédons, des tractus sinusaux ou des cicatrices1,3. Son apparition est insidieuse; elle commence par une gêne légère, un érythème, une sensation de brûlure, un prurit et l’hyperhidrose. Elle évolue pour former des nodules profonds sensibles au toucher, qui s’élargissent et se transforment en gros abcès douloureux. La rupture de ces abcès cause un écoulement malodorant et purulent. L’hidradénite suppurée récidivante ou persistante entraîne la formation de comédons à 2 extrémités, de tractus sinusaux et de cicatrices3,17.
L’hidradénite suppurée s’observe fréquemment dans les régions intertrigineuses, dont les aisselles, le périnée et les plis inframammaires et inguinaux, habituellement des 2 côtés (Figure 1). À mesure que la maladie progresse, les zones exposées à un stress mécanique répétitif, comme la nuque, le tronc et la taille, sont aussi touchées (Figure 2)3.
Figure 1.
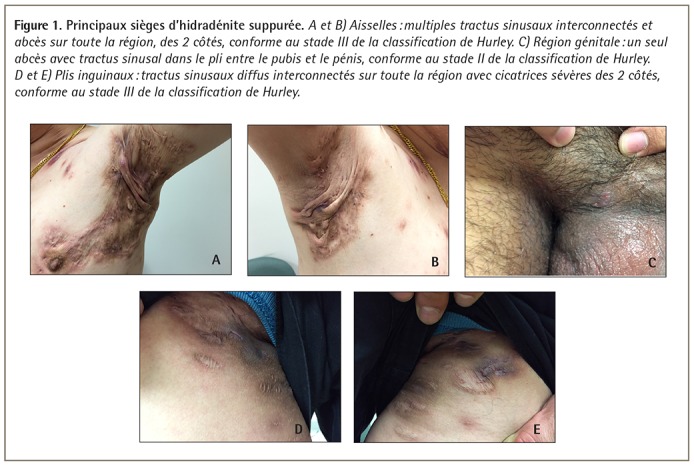
Principaux sièges d’hidradénite suppurée. A et B) Aisselles : multiples tractus sinusaux interconnectés et abcès sur toute la région, des 2 côtés, conforme au stade III de la classification de Hurley. C) Région génitale : un seul abcès avec tractus sinusal dans le pli entre le pubis et le pénis, conforme au stade II de la classification de Hurley. D et E) Plis inguinaux : tractus sinusaux diffus interconnectés sur toute la région avec cicatrices sévères des 2 côtés, conforme au stade III de la classification de Hurley.
Figure 2.
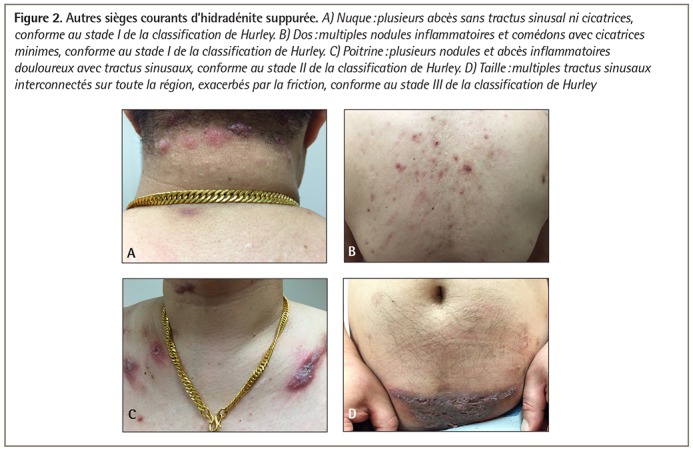
Autres sièges courants d’hidradénite suppurée. A) Nuque : plusieurs abcès sans tractus sinusal ni cicatrices, conforme au stade I de la classification de Hurley. B) Dos : multiples nodules inflammatoires et comédons avec cicatrices minimes, conforme au stade I de la classification de Hurley. C) Poitrine : plusieurs nodules et abcès inflammatoires douloureux avec tractus sinusaux, conforme au stade II de la classification de Hurley. D) Taille : multiples tractus sinusaux interconnectés sur toute la région, exacerbés par la friction, conforme au stade III de la classification de Hurley
Les complications de l’hidradénite suppurée sont pénibles. Localement, la maladie cause des cicatrices associées à une mobilité restreinte des membres; des sténoses ou des fistules à l’anus et à l’urètre qui découlent de l’inflammation; de même qu’un défigurement17. Rarement, un carcinome épidermoïde au siège de l’hidradénite suppurée a été rapporté18. Sur le plan général, l’hidradénite suppurée qui s’accompagne d’une infection grave peut causer fièvre et septicémie. L’anémie est aussi associée à la maladie19. De nombreuses comorbidités sont liées à l’hidradénite suppurée, y compris l’obésité, le syndrome métabolique, la maladie intestinale inflammatoire et la spondylarthropathie20,21.
Comment poser un diagnostic d’HS?
L’hidradénite suppurée est un diagnostic clinique qui demeure difficile à poser. On pose souvent un diagnostic erroné de furonculose ou de furoncles récidivants à la présentation, et 12 ans ou plus peuvent s’écouler entre l’apparition des symptômes et le diagnostic4. Il importe de noter que l’hidradénite suppurée est une maladie inflammatoire; cependant, l’infection bactérienne secondaire est fréquente. Les diagnostics différentiels de la maladie figurent dans l’Encadré 13. Un élément de la tétrade d’occlusions folliculaires, l’hidradénite suppurée est connue pour être associée aux autres éléments de la tétrade : cellulite disséquante, acné conglobata et kyste pilonidal (Figure 3)3.
Encadré 1. Diagnostics différentiels de l’hidradénite suppurée.
Les diagnostics différentiels de l’hidradénite suppurée sont les suivants :
Anthrax
Furoncle
Kyste épidermoïde ou dermoïde
Érésipèle
Lymphogranulomatose vénérienne
Granulome inguinal
Tuberculose
Tétrade d’occlusions folliculaires
Données tirées d’Alikhan et coll.3
Figure 3.
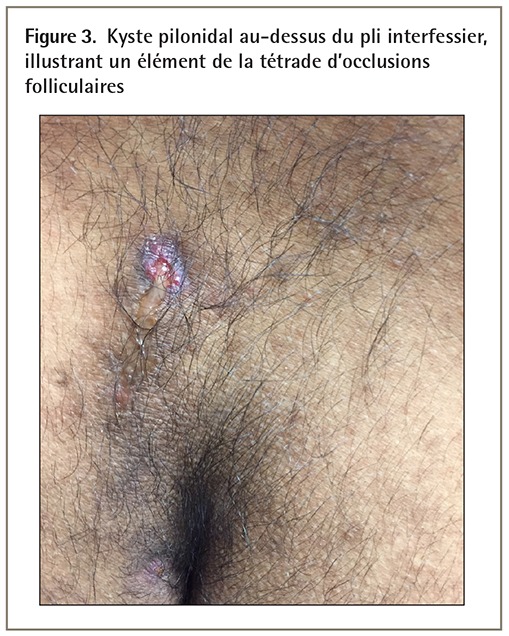
Kyste pilonidal au-dessus du pli interfessier, illustrant un élément de la tétrade d’occlusions folliculaires
Les 3 manifestations cliniques importantes étayant un diagnostic d’hidradénite suppurée sont : lésions typiques, sièges typiques, et rechute et caractère chronique (Encadré 2)1,21. Ainsi, une constellation de nodules inflammatoires, de tractus sinusaux et de cicatrices inflammatoires dans les zones intertrigineuses évoque fortement l’hidradénite suppurée1. Les antécédents familiaux d’hidradénite suppurée, l’apparition initiale des symptômes et les symptômes gastro-intestinaux (étant donné le lien avec la maladie de Crohn) sont d’autres éléments à obtenir durant l’anamnèse20. L’examen physique doit évaluer l’étendue et la sévérité de l’atteinte, et caractériser les lésions. La classification clinique de Hurley, décrite au Tableau 1, est souvent utilisée pour évaluer la sévérité de l’atteinte3,21,22.
Encadré 2. Diagnostic clinique d’hidradénite suppurée.
Les 3 caractéristiques cliniques importantes qui étayent le diagnostic d’hidradénite suppurée sont les suivantes :
Lésions typiques, y compris nodules, abcès, tractus sinusaux et cicatrices
Sièges typiques, y compris aisselles, plis inframammaires, aine et périnée
Rechutes et caractère chronique (> 2 fois en 6 mois)
Tableau 1.
Recommandations pour le traitement de l’hidradénite suppurée en fonction de la sévérité, selon la classification clinique de Hurley
| CLASSIFICATION CLINIQUE DE HURLEY | CARACTÉRISTIQUES | TRAITEMENT RECOMMANDÉ | ||
|---|---|---|---|---|
|
| ||||
| NON MÉDICAL | PHARMACOLOGIQUE | CHIRURGICAL | ||
| Stade I (léger) | Abcès unique ou multiples sans tractus sinusaux ni cicatrices | Il faut envisager les étapes suivantes, sans égard à la sévérité de l’hidradénite suppurée (grade F, niveau III) :
|
Traitements de première intention :
Traitements de deuxième intention :
|
Incision et drainage (déconseillé) |
| Stade II (modéré) | Abcès récidivants avec tractus sinusaux et cicatrices | Traitements de première intention :
Traitements de deuxième intention :
Traitement de troisième intention :
|
Si plusieurs traitements médicaux ont échoué, recommander le patient à un chirurgien plastique pour excision | |
| Stade III (sévère) | Tractus sinusal diffus ou multiples tractus sinusaux interconnectés et abcès sur toute la région | Recommandation en dermatologie où les traitements suivants pourraient être amorcés :
|
Si plusieurs traitements médicaux ont échoué, recommander le patient à un chirurgien plastique pour excision | |
Devant les complications de l’hidradénite suppurée, il faut passer aux analyses. Le bilan initial comprend la formule sanguine complète, les analyses de biochimie sanguine de routine et les marqueurs de l’inflammation. Dans certains cas, il faut procéder à la biopsie d’une hidradénite suppurée périanale soupçonnée afin d’éliminer les affections malignes ou la maladie de Crohn. La biopsie de la peau est rarement indiquée, à moins que le diagnostic soit incertain ou qu’il soit nécessaire d’éliminer d’autres affections, surtout si les lésions évoquent un carcinome épidermoïde. Les cultures des plaies sont envisagées lorsque les lésions présentent des signes d’infection secondaire1,21.
Comment prendre en charge l’HS?
Bien que l’hidradénite suppurée soit difficile à traiter et qu’elle soit incurable, il existe des interventions efficaces pour maîtriser l’affection et atténuer les symptômes. Le traitement de l’hidradénite suppurée vise à prévenir l’apparition de nouvelles lésions, à traiter précocement et efficacement les lésions nouvellement formées, et à enlever les nodules et les tractus sinusaux existants. L’approche générale consiste en des interventions non médicales, des médicaments topiques et systémiques et la chirurgie. Le Tableau 1 présente un résumé des interventions recommandées en fonction de la sévérité de l’atteinte selon la classification de Hurley3,21,22. Il faut envisager de recommander le patient en dermatologie dans les cas d’hidradénite suppurée réfractaire ou d’hidradénite suppurée de stade II et III selon la classification de Hurley.
Traitement non médical : Il faut mettre en place des mesures générales chez tous les patients, peu importe la sévérité de l’atteinte. Les modifications du mode de vie consistent en l’abandon du tabac, la perte pondérale et l’alimentation saine. Il importe aussi de réduire le stress mécanique sur la peau en portant des vêtements amples en coton3. Parmi les autres mesures à prendre, mentionnons l’application de compresses chaudes et l’emploi d’antiseptiques topiques et de savon antibactérien. L’efficacité des mesures générales de prise en charge de l’hidradénite suppurée n’a pas été évaluée formellement, mais les bienfaits qui y sont associés sont illustrés dans les études de cas1,23.
Aussi, compte tenu des effets psychologiques considérables liés à l’hidradénite suppurée, il importe de rassurer les patients en disant que la maladie n’est pas causée par une piètre hygiène et qu’elle n’est pas contagieuse. Il faut par ailleurs aviser les patients que les récidives sont fréquentes et que l’affection est incurable avec les traitements actuels. Il faut aussi gérer la douleur liée à l’hidradénite suppurée de manière appropriée3,21.
Traitement médical : Beaucoup des médicaments utilisés pour traiter l’hidradénite suppurée sont d’une efficacité limitée et sont associés à un taux élevé de récidive, comme le rapportent les séries et les rapports de cas, les essais randomisés contrôlés, et les études rétrospectives22. Ainsi, nous traitons ici des traitements étayés par des données probantes de bonne qualité21,22,24. L’approche médicale générale se fait par paliers, en commençant par un traitement topique dans les cas légers, et un traitement systémique dans les cas modérés à sévères.
Résorcinol topique : Le résorcinol est un agent de desquamation chimique doté de propriétés kératolytiques et anti-inflammatoires. Son emploi dans les cas d’hidradénite suppurée a été évalué dans une série de cas comptant 12 femmes atteintes d’hidradénite suppurée de stade I ou II selon la classification de Hurley. Le résorcinol topique à 15 % a été appliqué directement sur les nodules inflammatoires et s’est avéré soulager la douleur et favoriser la guérison25. Les lignes directrices européennes actuelles sur le traitement de l’hidradénite suppurée recommandent de l’appliquer 2 fois par jour durant les poussées actives et 1 fois par jour durant le traitement d’entretien21.
-
Antibiotiques : La clindamycine topique (solution ou gel à 1 % 2 fois par jour pendant 3 mois) est souvent utilisée en traitement de première intention de l’hidradénite suppurée légère ou localisée, avec un bon profil d’innocuité et de tolérabilité. Elle peut réduire le nombre de lésions inflammatoires légères et traiter ou prévenir l’infection secondaire. Elle est aussi efficace que la tétracycline par voie orale, comme l’a montré un essai randomisé contrôlé à double insu mené auprès de 46 patients atteints d’hidradénite suppurée de stade I et de stade II léger de Hurley26.
Les antibiotiques par voie orale sont souvent envisagés dans les cas réfractaires ou étendus d’hidradénite suppurée. Puisque les antibiotiques sont administrés pour leurs effets anti-inflammatoires, il est nécessaire de prolonger le traitement, soit 2 ou 3 mois, pour maîtriser les symptômes. Il n’existe pas de choix de première intention, mais la tétracycline à 500 mg 2 fois par jour pendant 4 mois est le seul antibiotique oral ayant fait l’objet d’une étude randomisée contrôlée26. Une fois l’antibiothérapie terminée, la récidive est fréquente26.
On peut envisager le traitement d’association par clindamycine orale (300 mg 2 fois par jour) et rifampicine (600 mg 1 fois par jour) pendant 10 semaines chez les patients qui ne répondent pas aux antibiotiques mentionnés ci-dessus. Dans une étude de cohorte rétrospective comptant 116 patients atteints d’hidradénite suppurée sévère, l’association s’est montrée très efficace et a permis d’atteindre la rémission prolongée27. Des études rétrospectives de petite envergure ont donné lieu à des résultats comparables28,29.
Hormonothérapie : Comme les androgènes interviennent dans l’apparition de l’hidradénite suppurée, le traitement anti-androgénique a été étudié et s’est montré efficace. L’acétate de cyprotérone (100 mg par jour) et les pilules contraceptives orales contenant du norgestrel administrés pendant 6 mois ont atténué l’hidradénite suppurée avec une efficacité comparable, comme l’a montré un essai transversal contrôlé et à double insu comptant 24 femmes atteintes d’hidradénite suppurée de stade II ou III selon la classification de Hurley30,31. Le finastéride (5 mg par jour) est aussi un médicament efficace ayant été utilisé en pédiatrie et chez les adultes des 2 sexes, comme l’ont démontré certaines séries de cas10,32.
Rétinoïdes par voie orale : Les effets antiproliférateurs et immunomodulateurs des rétinoïdes par voie orale peuvent maîtriser la nature inflammatoire de l’hidradénite suppurée. L’acitrétine administrée pendant 9 à 12 mois a fait disparaître les lésions et la douleur, et l’amélioration a persisté même après l’arrêt du traitement, comme l’a montré une étude de cohorte rétrospective comptant 12 patients atteints d’hidradénite suppurée sévère et récalcitrante33. Elle n’est toutefois pas recommandée chez les femmes en âge de procréer, car celles-ci ne doivent pas concevoir pendant 3 ans, même après l’arrêt du traitement. D’un autre côté, bien que la demi-vie de l’isotrétinoïne soit plus courte et que les femmes puissent tenter de concevoir 1 mois après le traitement, ses effets thérapeutiques sont limités dans les cas modérés à sévères, comme l’a montré une étude de cohorte rétrospective comptant 68 patients atteints d’hidradénite suppurée de stades variés34.
Traitement immunosuppresseur : Comme l’hidradénite suppurée serait due à une dysrégulation du système immunitaire inné et adaptatif, on se tourne parfois vers les agents immunosuppresseurs pour traiter l’affection. Une injection intralésionnelle de corticostéroïdes avec 5 à 10 mg/mL d’acétonide de triamcinolone a été utilisée comme traitement adjuvant pour accélérer la disparition des nodules inflammatoires douloureux au stade précoce1,21. Ce traitement doit être évité dans les cas d’infection bactérienne secondaire. Un traitement bref par prednisone orale avec diminution rapide de la dose peut atténuer l’inflammation aiguë21. Dans les cas réfractaires, la cyclosporine entraîne une amélioration modérée à marquée, comme l’ont montré les études de cas; mais la durée du traitement est souvent limitée par ses effets indésirables35.
Agents biologiques : Les agents biologiques dotés de propriétés anti-facteur de nécrose tumorale-α peuvent être envisagés chez les patients dont l’affection est réfractaire au traitement médical classique. L’infliximab et l’adalimumab sont efficaces dans les cas modérés à sévères, comme l’ont montré les séries de cas, les études rétrospectives et les essais randomisés contrôlés36–39. L’adalimumab a récemment reçu l’homologation de la Food and Drug Administration des États-Unis et de l’Agence européenne des médicaments pour le traitement de l’hidradénite suppurée modérée à sévère.
Chirurgie : La chirurgie permet d’exciser les lésions et de réviser les cicatrices, elle est donc efficace pour prendre en charge les lésions isolées d’hidradénite suppurée3,21,40. Il n’existe toutefois pas de données probantes de bonne qualité quant au moment approprié pour la chirurgie et à ses résultats connexes comparativement aux traitements médicaux. L’approche standard consiste à opérer les patients dont l’affection est réfractaire ou qui répondent partiellement aux multiples traitements médicaux, ou les patients atteints d’hidradénite suppurée intraitable de stade III selon la classification de Hurley. Il faut poursuivre les mesures générales et les traitements médicaux après la chirurgie afin de prévenir les récidives. Il faut cependant ajouter que la chirurgie n’est pas curative et qu’elle s’accompagne d’un taux élevé de récidive.
Réexamen du cas
Ce patient de 45 ans présentait la forme classique d’hidradénite suppurée récalcitrante de stade III selon la classification de Hurley. Depuis qu’il a entrepris le schéma thérapeutique consistant en adalimumab, peroxyde de benzoyle à 5 % topique et clindamycine à 1 %, il y plus de 6 ans, de grandes améliorations ont été observées. Il a aussi subi 2 chirurgies pour enlever les tractus sinusaux.
Conclusion
L’hidradénite suppurée est une affection cutanée inflammatoire chronique associée à des effets psychologiques considérables. La reconnaissance des lésions typiques dans des zones typiques et le caractère récidivant de l’affection permettent de poser un diagnostic précoce. Il faut offrir des mesures générales à tous les patients atteints d’hidradénite suppurée, dont les modifications du mode de vie, l’éducation et le counseling. La prise en charge médicale doit suivre une approche par paliers, en fonction de la sévérité de l’atteinte. La prise en charge chirurgicale doit être envisagée en dernier recours, après que le traitement médical eut été optimisé.
POINTS DE REPÈRE DU RÉDACTEUR
L’hidradénite suppurée (HS) est une affection cutanée inflammatoire chronique, récidivante et incapacitante. Elle est un trouble de l’épithélium folliculaire et se manifeste fréquemment sous les aisselles, dans les plis inframammaires et à l’aine. Les effets psychosociaux de la maladie sont dévastateurs en raison de la douleur, des pertes malodorantes et des cicatrices qui y sont associées.
Les lésions précoces de l’hidradénite suppurée ressemblent à celles d’autres affections cutanées et c’est pourquoi on pose souvent un diagnostic erroné de furonculose ou de furoncles récidivants. Le délai avant le diagnostic peut être de 12 ans ou plus. En reconnaissant les symptômes et en instaurant le traitement de façon hâtive, on peut réduire le risque que l’hidradénite suppurée évolue en une affection terminale incapacitante.
L’hidradénite suppurée est incurable, mais il existe des interventions efficaces. En particulier, les agents biologiques dotés de propriétés antifacteur de nécrose tumorale-α sont maintenant une option pour les patients dont l’atteinte est modérée ou grave et qui ne répondent pas aux traitements classiques.
Footnotes
Cet article donne droit à des crédits d’autoapprentissage certifiés Mainpro+. Pour obtenir des crédits, rendez-vous sur www.cfp.ca et cliquez sur le lien Mainpro+.
Cet article a fait l’objet d’une révision par des pairs.
The English version of this article is available at www.cfp.ca on the table of contents for the February 2017 issue on page 114.
Collaborateurs
Tous les auteurs ont contribué à l’examen et à l’interprétation de la littérature, ainsi qu’à la préparation du manuscrit aux fins de soumission.
Intérêts concurrents
Aucun déclaré
Références
- 1.Jemec GB. Clinical practice. Hidradenitis suppurativa. N Engl J Med. 2012;366(2):158–64. doi: 10.1056/NEJMcp1014163. [DOI] [PubMed] [Google Scholar]
- 2.Sellheyer K, Krahl D. “Hidradenitis suppurativa” is acne inversa! An appeal to (finally) abandon a misnomer. Int J Dermatol. 2005;44(7):535–40. doi: 10.1111/j.1365-4632.2004.02536.x. [DOI] [PubMed] [Google Scholar]
- 3.Alikhan A, Lynch PJ, Eisen DB. Hidradenitis suppurativa: a comprehensive review. J Am Acad Dermatol. 2009;60(4):539–61. doi: 10.1016/j.jaad.2008.11.911. [DOI] [PubMed] [Google Scholar]
- 4.Mebazaa A, Ben Hadid R, Cheikh Rouhou R, Trojjet S, El Euch D, Mokni M, et al. Hidradenitis suppurativa: a disease with male predominance in Tunisia. Acta Dermatovenerol Alp Pannonica Adriat. 2009;18(4):165–72. [PubMed] [Google Scholar]
- 5.Matusiak Ł, Bieniek A, Szepietowski JC. Hidradenitis suppurativa maredly decreases quality of life and professional activity. J Am Acad Dermatol. 2010;62(4):706–8. 708.e1. doi: 10.1016/j.jaad.2009.09.021. [DOI] [PubMed] [Google Scholar]
- 6.Jemec GB, Heidenheim M, Nielsen NH. The prevalence of hidradenitis suppurativa and its potential precursor lesions. J Am Acad Dermatol. 1996;35(2 Pt 1):191–4. doi: 10.1016/s0190-9622(96)90321-7. [DOI] [PubMed] [Google Scholar]
- 7.Revuz JE, Canoui-Poitrine F, Wolkenstein P, Viallette C, Gabison G, Pouget F, et al. Prevalence and factors associated with hidradenitis suppurativa: results from two case-control studies. J Am Acad Dermatol. 2008;59(4):596–601. doi: 10.1016/j.jaad.2008.06.020. [DOI] [PubMed] [Google Scholar]
- 8.Cosmatos I, Matcho A, Weinstein R, Montgomery MO, Stang P. Analysis of patient claims data to determine the prevalence of hidradenitis suppurativa in the United States. J Am Acad Dermatol. 2013;68(3):412–9. doi: 10.1016/j.jaad.2012.07.027. [DOI] [PubMed] [Google Scholar]
- 9.Canoui-Poitrine F, Le Thuaut A, Revuz JE, Viallette C, Gabison G, Poli F, et al. Identification of three hidradenitis suppurativa phenotypes: latent class analysis of a cross-sectional study. J Invest Dermatol. 2013;133(6):1506–11. doi: 10.1038/jid.2012.472. Publ. en ligne du 13 déc. 2012. [DOI] [PubMed] [Google Scholar]
- 10.Randhawa HK, Hamilton J, Pope E. Finasteride for the treatment of hidradenitis suppurativa in children and adolescents. JAMA Dermatol. 2013;149(6):732–5. doi: 10.1001/jamadermatol.2013.2874. [DOI] [PubMed] [Google Scholar]
- 11.Von der Werth JM, Williams HC. The natural history of hidradenitis suppurativa. J Eur Acad Dermatol Venereol. 2000;14(5):389–92. doi: 10.1046/j.1468-3083.2000.00087.x. [DOI] [PubMed] [Google Scholar]
- 12.Al-Ali FM, Ratnamala U, Mehta TY, Naveed M, Al-Ali MT, Al-Khaja N, et al. Hidradenitis suppurativa (or acne inversa) with autosomal dominant inheritance is not linked to chromosome 1p21.1–1q25.3 region. Exp Dermatol. 2010;19(9):851–3. doi: 10.1111/j.1600-0625.2010.01088.x. [DOI] [PubMed] [Google Scholar]
- 13.Pink AE, Simpson MA, Desai N, Trembath RC, Barker JN. γ-Secretase mutations in hidradenitis suppurativa: new insights into disease pathogenesis. J Invest Dermatol. 2013;133(3):601–7. doi: 10.1038/jid.2012.372. Publ. en ligne du 25 oct. 2012. [DOI] [PubMed] [Google Scholar]
- 14.Sartorius K, Emtestam L, Jemec GB, Lapins J. Objective scoring of hidradenitis suppurativa reflecting the role of tobacco smoking and obesity. Br J Dermatol. 2009;161(4):831–9. doi: 10.1111/j.1365-2133.2009.09198.x. Publ. en ligne du 29 avr. 2009. [DOI] [PubMed] [Google Scholar]
- 15.Vazquez BG, Alikhan A, Weaver AL, Wetter DA, Davis MD. Incidence of hidradenitis suppurativa and associated factors: a population-based study of Olmsted County, Minnesota. J Invest Dermatol. 2013;133(1):97–103. doi: 10.1038/jid.2012.255. Publ. en ligne du 30 août 2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Van der Zee HH, Laman JD, Boer J, Prens EP. Hidradenitis suppurativa: viewpoint on clinical phenotyping, pathogenesis and novel treatments. Exp Dermatol. 2012;21(10):735–9. doi: 10.1111/j.1600-0625.2012.01552.x. Publ. en ligne du 7 août 2012. [DOI] [PubMed] [Google Scholar]
- 17.Wiseman MC. Hidradenitis suppurativa: a review. Dermatol Ther. 2004;17(1):50–4. doi: 10.1111/j.1396-0296.2004.04007.x. [DOI] [PubMed] [Google Scholar]
- 18.Dufresne RG, Jr, Ratz JL, Bergfeld WF, Roenigk RK. Squamous cell carcinoma arising from the follicular occlusion triad. J Am Acad Dermatol. 1996;35(3 Pt 1):475–7. doi: 10.1016/s0190-9622(96)90632-5. [DOI] [PubMed] [Google Scholar]
- 19.Tennant F, Jr, Bergeron JR, Stone OJ, Mullins JF. Anemia associated with hidradenitis suppurativa. Arch Dermatol. 1968;98(2):138–40. [PubMed] [Google Scholar]
- 20.Van der Zee HH, de Winter K, van der Woude CJ, Prens EP. The prevalence of hidradenitis suppurativa in 1093 patients with inflammatory bowel disease. Br J Dermatol. 2014;171(3):673–5. doi: 10.1111/bjd.13002. Publ. en ligne du 22 juill. 2014. [DOI] [PubMed] [Google Scholar]
- 21.Zouboulis CC, Desai N, Emtestam L, Hunger RE, Ioannides D, Juhász I, et al. European S1 guideline for the treatment of hidradenitis suppurativa/acne inversa. J Eur Acad Dermatol Venereol. 2015;29(4):619–44. doi: 10.1111/jdv.12966. Publ. en ligne du 30 janv. 2015. [DOI] [PubMed] [Google Scholar]
- 22.Alhusayen R, Shear NH. Pharmacologic interventions for hidradenitis suppurativa: what does the evidence say? Am J Clin Dermatol. 2012;13(5):283–91. doi: 10.2165/11631880-000000000-00000. [DOI] [PubMed] [Google Scholar]
- 23.Danby FW, Margesson LJ. Hidradenitis suppurativa. Dermatol Clin. 2010;28(4):779–93. doi: 10.1016/j.det.2010.07.003. [DOI] [PubMed] [Google Scholar]
- 24.Ingram JR, Woo PN, Chua SL, Ormerod AD, Desai N, Kai AC, et al. Interventions for hidradenitis suppurativa. Cochrane Database Syst Rev. 2015;(10):CD010081. doi: 10.1002/14651858.CD010081.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Boer J, Jemec GB. Resorcinol peels as a possible self-treatment of painful nodules in hidradenitis suppurativa. Clin Exp Dermatol. 2010;35(1):36–40. doi: 10.1111/j.1365-2230.2009.03377.x. Publ. en ligne du 22 juin 2009. [DOI] [PubMed] [Google Scholar]
- 26.Jemec GB, Wendelboe P. Topical clindamycin versus systemic tetracycline in the treatment of hidradenitis suppurativa. J Am Acad Dermatol. 1998;39(6):971–4. doi: 10.1016/s0190-9622(98)70272-5. [DOI] [PubMed] [Google Scholar]
- 27.Gener G, Canoui-Poitrine F, Revuz JE, Faye O, Poli F, Gabison G, et al. Combination therapy with clindamycin and rifampicin for hidradenitis suppurativa: a series of 116 consecutive patients. Dermatology. 2009;219(2):148–54. doi: 10.1159/000228334. Publ. en ligne du 8 juill. 2009. [DOI] [PubMed] [Google Scholar]
- 28.Van der Zee HH, Boer J, Prens EP, Jemec GB. The effect of combined treatment with oral clindamycin and oral rifampicin in patients with hidradenitis suppurativa. Dermatology. 2009;219(2):143–7. doi: 10.1159/000228337. Publ. en ligne du 8 juill. 2009. [DOI] [PubMed] [Google Scholar]
- 29.Mendonça CO, Griffiths CE. Clindamycin and rifampicin combination therapy for hidradenitis suppurativa. Br J Dermatol. 2006;154(5):977–8. doi: 10.1111/j.1365-2133.2006.07155.x. [DOI] [PubMed] [Google Scholar]
- 30.Sawers RS, Randall VA, Ebling FJ. Control of hidradenitis suppurativa in women using combined antiandrogen (cyproterone acetate) and oestrogen therapy. Br J Dermatol. 1986;115(3):269–74. doi: 10.1111/j.1365-2133.1986.tb05741.x. [DOI] [PubMed] [Google Scholar]
- 31.Mortimer PS, Dawber RP, Gales MA, Moore RA. A double-blind controlled cross-over trial of cyproterone acetate in females with hidradenitis suppurativa. Br J Dermatol. 1986;115(3):263–8. doi: 10.1111/j.1365-2133.1986.tb05740.x. [DOI] [PubMed] [Google Scholar]
- 32.Joseph MA, Jayaseelan E, Ganapathi B, Stephen J. Hidradenitis suppurativa treated with finasteride. J Dermatolog Treat. 2005;16(2):75–8. doi: 10.1080/09546630510031403. [DOI] [PubMed] [Google Scholar]
- 33.Boer J, Nazary M. Long-term results of acitretin therapy for hidradenitis suppurativa. Is acne inversa also a misnomer? Br J Dermatol. 2011;164(1):170–5. doi: 10.1111/j.1365-2133.2010.10071.x. [DOI] [PubMed] [Google Scholar]
- 34.Boer J, van Gemert MJ. Long-term results of isotretinoin in the treatment of 68 patients with hidradenitis suppurativa. J Am Acad Dermatol. 1999;40(1):73–6. doi: 10.1016/s0190-9622(99)70530-x. [DOI] [PubMed] [Google Scholar]
- 35.Rose RF, Goodfield MJ, Clark SM. Treatment of recalcitrant hidradenitis suppurativa with oral ciclosporin. Clin Exp Dermatol. 2006;31(1):154–5. doi: 10.1111/j.1365-2230.2005.01983.x. [DOI] [PubMed] [Google Scholar]
- 36.Delage M, Samimi M, Atlan M, Machet L, Lorette G, Maruani A. Efficacy of infliximab for hidradenitis suppurativa: assessment of clinical and biological inflammatory markers. Acta Derm Venereol. 2011;91(2):169–71. doi: 10.2340/00015555-1025. [DOI] [PubMed] [Google Scholar]
- 37.Lesage C, Adnot-Desanlis L, Perceau G, Bonnet M, Palot JP, Bernard P, et al. Efficacy and tolerance of prolonged infliximab treatment of moderate-to-severe forms of hidradenitis suppurativa. Eur J Dermatol. 2012;22(5):640–4. doi: 10.1684/ejd.2012.1795. [DOI] [PubMed] [Google Scholar]
- 38.Miller I, Lynggaard CD, Lophaven S, Zachariae C, Dufour DN, Jemec GB. A double-blind placebo-controlled randomized trial of adalimumab in the treatment of hidradenitis suppurativa. Br J Dermatol. 2011;165(2):391–8. doi: 10.1111/j.1365-2133.2011.10339.x. Publ. en ligne du 30 juin 2011. [DOI] [PubMed] [Google Scholar]
- 39.Kimball AB, Kerdel F, Adams D, Mrowietz U, Gelfand JM, Gniadecki R, et al. Adalimumab for the treatment of moderate to severe hidradenitis suppurativa: a parallel randomized trial. Ann Intern Med. 2012;157(12):846–55. doi: 10.7326/0003-4819-157-12-201212180-00004. [DOI] [PubMed] [Google Scholar]
- 40.Van Hattem S, Spoo JR, Horváth B, Jonkman MF, Leeman FW. Surgical treatment of sinuses by deroofing in hidradenitis suppurativa. Dermatol Surg. 2012;38(3):494–7. doi: 10.1111/j.1524-4725.2011.02255.x. Publ. en ligne du 30 déc. 2011. [DOI] [PubMed] [Google Scholar]


