Abstract
Introduction
In Germany vaccination recommendations are revised annually and published by the Standing Committee on Vaccination at the Robert Koch Institute (STIKO). In 2010 the vaccination recommendations were amended to include the proposal that pregnant women in the 2nd trimester of pregnancy and pregnant women with additional underlying disease in the 1st trimester of pregnancy should be vaccinated against seasonal influenza. This paper reports on vaccination rates and the factors influencing them.
Method
A cross-sectional study was carried out in two level 1 perinatal centers in two different German federal states (Saarland and Rhineland-Palatinate) during the influenza seasons of 2012/2013 and 2013/2014. A total of 253 pregnant women were included in the study. Pregnant women were interviewed using a standardized, pre-tested questionnaire and asked whether they were aware of the recommendation to vaccinate against seasonal influenza and about possible factors which might influence their decision to be vaccinated. In addition, data from their vaccination certificates and pregnancy passports were evaluated.
Results
Overall, the records of only 19.5 % of the pregnant women showed that they had been vaccinated against influenza in pregnancy. Among the group of pregnant women who had a previous history of vaccinations against influenza the willingness to be vaccinated was high (43.3 %) and this figure was statistically significant. The vaccination rate was even higher (49.9 %) and even more statistically significant among pregnant women whose gynecologist or family physician had recommended that they should be vaccinated. In contrast, only 3.3 % of pregnant women who had not been given the recommendation to vaccinate by their physicians were vaccinated against influenza.
Discussion
The failure to recommend that pregnant women be vaccinated against influenza and womenʼs lack of any previous experience of influenza vaccination were the main reasons for the inadequate influenza vaccination coverage in pregnancy.
Conclusion
One of the key points to increase the influenza vaccination rate is to intensify the counselling of the pregnant women through the gynecologist.
Key words: vaccination recommendations, vaccination against influenza, pregnancy, influencing factors, vaccination coverage
Zusammenfassung
Einleitung In Deutschland werden die Impfempfehlungen jährlich von der Ständigen Impfkommission am Robert Koch-Institut (= STIKO) überarbeitet und veröffentlicht. Im Jahre 2010 wurde die Impfempfehlung dahin gehend geändert, dass nun schwangere Frauen ab dem 2. Trimenon und solche mit zusätzlicher Grunderkrankung bereits ab dem 1. Trimenon die Impfung gegen saisonale Influenza erhalten sollten. Diese Arbeit beschäftigt sich mit der Impfquote und den Faktoren, die diese beeinflussen.
Methode Hierzu wurde in den beiden Influenzasaisons 2012/2013 und 2013/2014 eine Querschnittsstudie an 2 Level-1-Perinatalzentren in 2 verschiedenen Bundesländern (Saarland und Rheinland-Pfalz) mit insgesamt 253 schwangeren Frauen durchgeführt. Schwangere wurden mittels standardisiertem und vorgetestetem Fragebogen bezüglich ihres Kenntnisstands zur Impfempfehlung der saisonalen Influenza und eventueller, die Impfentscheidung beeinflussender Faktoren befragt. Weiterhin wurden Daten aus dem Impfpass und dem Mutterpass ausgewertet.
Ergebnisse Insgesamt war bei 19,5 % der Graviden eine Influenzaimpfung in der Schwangerschaft angegeben. Eine signifikant hohe Influenza-Impfbereitschaft zeigte sich mit 43,3 % in der Gruppe der Schwangeren, die bereits vor der Schwangerschaft Influenzaimpfungen erhalten hatten. Eine noch höhere und auch signifikante Impfquote fand sich mit 49,4 % bei den Schwangeren, die diese Impfung durch ihren Frauen- oder Hausarzt empfohlen bekommen haben. Im Gegensatz dazu waren nur 3,3 % der Graviden gegen Influenza geimpft, die diese Empfehlung nicht durch ihren Arzt erhalten haben.
Diskussion Die ungenügende Anwendung der Empfehlung zur Influenza-Schutzimpfung bei Schwangeren sowie die mangelnde Vorerfahrung der Graviden mit dieser Impfung sind Hauptgründe für eine mangelnde Impfbereitschaft gegen Influenza in der Schwangerschaft.
Schlussfolgerung Einer der Hauptpunkte um die Influenzaimpfrate zu erhöhen, besteht in der Beratungsintensivierung der Schwangeren durch die Gynäkologen.
Schlüsselwörter: Impfempfehlung, Influenzaimpfung, Schwangerschaft, Einflussfaktoren, Impfrate
Introduction
In Germany vaccination recommendations are revised annually and published by the Standing Committee on Vaccination at the Robert Koch Institute (STIKO) 1. The STIKO vaccination recommendations published in 2010 were expanded to include the recommendation that pregnant women in the 2nd trimester of pregnancy should also be vaccinated against seasonal influenza. The recommendations stated that pregnant women with additional underlying disease should already be vaccinated in the 1st trimester of pregnancy 2. As the influenza vaccine is an inactivated vaccine, pregnant women can be vaccinated at any stage during pregnancy. The rationale behind the STIKO recommendation to only vaccinate healthy pregnant women in the 2nd trimester of their pregnancy is based on the fact that spontaneous abortions are relatively common in the 1st trimester of pregnancy and STIKO does not want to create any association between these spontaneous abortions and the influenza vaccination 3.
Most of the studies on the morbidity, mortality and course of disease in pregnant women who had influenza were carried out during the influenza pandemics of 1918, 1957 and 2009. While pregnant women are not more likely to contract influenza than non-pregnant persons, if they do come down with influenza pregnant women are significantly more likely to require hospitalization because they have a higher risk of developing influenza-associated complications 4, 5, 6, 7, 8, 9. Compared to the normal population, the risk of hospitalization for pregnant women during the H1N1 pandemic of 2009 in the USA was 0.32/100 000 pregnant women compared to just 0.08 per 100 000 persons in the normal population. The risk of requiring hospitalization for influenza A (H1N1) was therefore 4 times higher for pregnant women compared to the normal population 7. Moreover, pregnant women with influenza have a significantly increased risk of miscarriage or preterm delivery, although detailed data have only been collected during influenza pandemics 6, 7, 8, 9, 10, 11. Several studies have shown that maternal influenza infection during pregnancy is not only associated with an increased risk of spontaneous abortion but also with an increased risk of preterm delivery, low birth weight, a high rate of small for gestational age (SGA) infants, and higher rates of fetal mortality 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18.
During the pandemic of 1918 in the USA and the United Kingdom it was found that pregnant women had higher rates of secondary pneumonia and higher mortality rates compared to the normal population 19, 20, 21. A higher mortality rate for pregnant women compared to non-pregnant women of child-bearing age was also recorded during pandemic of 1957 22, 23.
During these two influenza pandemics, 50 % of pregnant women with influenza developed pneumonia which was associated with a maternal mortality rate of 50 % and an overall rate of lost pregnancies of 52 % 24, 25, 26. The percentage of pregnant women among the influenza-related deaths registered for the 2009 influenza A infection in the USA was 5 %. The mortality rate for pregnant women who required intensive medical care was 20 %. Of these women, 8.9 % were in the 1st trimester, 26.8 % in the 2nd trimester and 64.3 % in the 3rd trimester of pregnancy 27.
Kelly et al. calculated a relative risk of dying from an H1N1 influenza infection of 1.4 for pregnant women compared to the normal population 28.
The reported mortality figures for pregnant women who were hospitalized because of an influenza infection range between 3.6 and 20 % 27, 29, 30, 31.
Based on two meta-analyses it has been calculated that pregnant women had a relative risk of 6.8 (95 % confidence interval [CI]: 4.5–12.3) for being hospitalized, i.e. a significantly increased risk of being admitted to hospital as an in-patient, compared to non-pregnant women who had an odds ratio (OR) of 2.44 (95 % CI: 1.22–4.87) 32, 33.
Another study reported an influenza-related morbidity rate resulting in hospitalization for pregnant women in their 3rd trimester of 2.5 per 1000 pregnant women in the last third of their pregnancies 34.
During the influenza seasons of 1998/1999 and 2001/2002, Cox et al. found a morbidity rate for respiratory diseases which led to hospitalization of the pregnant woman of 22.3/1000, which was double that reported for other periods of time outside the influenza season 35.
A study from Canada is one of the few studies which has investigated the hospitalization rates of pregnant women outside pandemics. The study was able to show that the hospitalization rate for pregnant women in the 3rd trimester of pregnancy was five times higher during the influenza season than that of non-pregnant women. It was also able to show that the hospitalization rate for pregnant women during the influenza season was more than double that of the rate outside the influenza season 36.
Vaccination against influenza during pregnancy is generally considered harmless as an inactivated vaccine is used for vaccination. There are no indications or evidence for any teratogenicity. In fact, some studies found that the complications described above decreased significantly following vaccination 8, 37, 38, 39, 40, 41, 42, 43, 44. Influenza vaccination also has a protective effect on the unborn child because of the transfer of maternal antibodies across the placenta 39, 40, 41, 42, 43, 44, 45, 46. These antibodies continue to circulate in the infantʼs bloodstream until around the 4th month of life and during this time they offer a certain level of protection against infections which the infantile immune system is not yet capable of providing 44.
The conclusion to be drawn from these facts is that vaccination against seasonal influenza can reduce the number of people who develop the infection and therefore also the number of pregnant women requiring in-patient care and the number of cases with serious infection requiring intensive care. For the unborn child, vaccination could bring benefits by potentially reducing the rate of preterm births and the number of births of SGA infants. Post partum, the transfer of maternal antibodies across the placenta to the fetus can provide the newborn with some protection against influenza. Thus, vaccination against seasonal influenza offers numerous benefits to pregnant women and their unborn and newborn children, and the risks associated with vaccination are contained.
Up to now there was not much data available in Germany on how the amendments to the vaccination recommendations of 2010 have been accepted by pregnant women.
Almost all of the data on influenza-related morbidity, mortality, and the course of illness in pregnant women go back to the influenza pandemics of 1918, 1957 and 2009.
Data on the seasonal influenza-related morbidity and mortality in pregnant women are not collected systematically in Germany. There is only an obligation to notify the authorities if laboratory testing has confirmed the presence of the influenza virus.
This study aimed to investigate the acceptance of influenza vaccination recommendations among pregnant women and to determine the influencing factors which encourage or mitigate against vaccination.
Methods
Survey methods
A study to determine the influenza vaccination status of pregnant women was carried out at the University Gynecological Hospital in Homburg/Saar from December 2012 to February 2014 and at the Gynecology Department of Worms Hospital from February 2013 to February 2014. All pregnant women presenting to either of these gynecology hospitals, whether to give birth or attend a prenatal clinic, were requested to complete a standardized, pre-tested questionnaire (Fig. 1) and to bring their vaccination certificate along. During the main survey period, i.e. 2013, 1286 births were recorded for the hospital in Homburg/Saar and 1585 births for the hospital in Worms.
Fig. 1.

Questionnaire used to collect data on factors affecting vaccination status.
Collected parameters
The questionnaire was used to collect data on the pregnant womanʼs medical history, including any general illnesses or disorders such as cardiac disease, pulmonary or intestinal disorders, hypertension and diabetes. Questions were also asked about preeclampsia and infectious diseases. General information collected included the womanʼs profession and whether she did any sports before or during her pregnancy. In the questions focused specifically on vaccination status, women were asked whether they had had any vaccinations during the pregnancy, in particular any influenza vaccinations during or prior to the pregnancy and who had recommended that they should be vaccinated against influenza. Women were also asked about any prior negative experiences with the influenza vaccination.
The questionnaire also included an open question on potential reasons for having refused to be vaccinated against influenza.
Data were also obtained from womenʼs pregnancy passports and vaccination certificates after receiving prior permission from the women in writing (Table 1).
Table 1 Data collected from pregnancy passports and vaccination certificates.
| Pregnancy passport | Vaccination certificate |
|---|---|
|
|
Women were asked about their age, BMI, number of pregnancies, whether they did sports, whether they had been given the recommendation to be vaccinated against influenza, about their previous illnesses, whether they had been vaccinated against influenza before becoming pregnant, whether they had had a nuchal scan, what their profession was, and whether they worked in the healthcare sector, as these were considered factors which could potentially influence the decision to be vaccinated against influenza.
To investigate whether women with a higher BMI were more likely to be advised to vaccinate against influenza, the women were divided into 2 groups based on WHO criteria 47. Women with a BMI (body mass index) of up to 24.99 kg/m2 were classified as normal weight and women with a BMI of 25.00 kg/m2 and above were classified as overweight.
Description of the study population
A total of 187 women who attended the University Gynecological Hospital in Homburg/Saar and 66 women who attended the Gynecology Department of Worms Hospital were included in the study, resulting in an overall study population of 253 pregnant women. Of these 253 pregnant women, 236 women (93.28 %) provided at least one useable statement about their seasonal influenza vaccination status. On 17 questionnaires, the question whether the respondent had been vaccinated against influenza was not answered.
The study focused on finding out more about the influenza vaccination status of pregnant women and the factors which could influence the decision for or against vaccination. The decision on vaccination and vaccination recommendations were then correlated with the investigated parameters.
Patients were repeatedly unable to answer individual questions on the questionnaire. The missing data for individual parameters was subsequently deducted from the analysis of the overall number of samples. The percentages therefore always refer to the respective amended total number.
Statistical analysis
Statistical analysis was done using the statistics program IBM® SPSS® Statistics 21.0. Statistical tests used for analysis included the Kolmogorov-Smirnov test, Mann-Whitney U-test, Fisherʼs exact test and the χ2-test. The Kolmogorov-Smirnov test was used to test whether variables were normally distributed. Mann-Whitney U-test was used to compare two groups by detecting differences in the distributions of continuous variables; Fisherʼs exact test and the χ2-test were used to compare the distribution of nominal variables of two groups. Results were considered statistically significant when p < 0.05.
Ethics vote number: 144/14
Results
Influenza vaccination during pregnancy
Out of the total patient population treated at both hospitals (n = 236 women), the records showed that only 46 women (19.5 %) had been vaccinated against influenza in pregnancy.
When the groups were studied in more detail, the patient cohort from the Rhineland-Palatinate (i.e. Worms) showed a significantly higher willingness to be vaccinated (28.6 %) than the cohort from the Saarland (i.e. Homburg) with 16.2 %.
Normal distribution
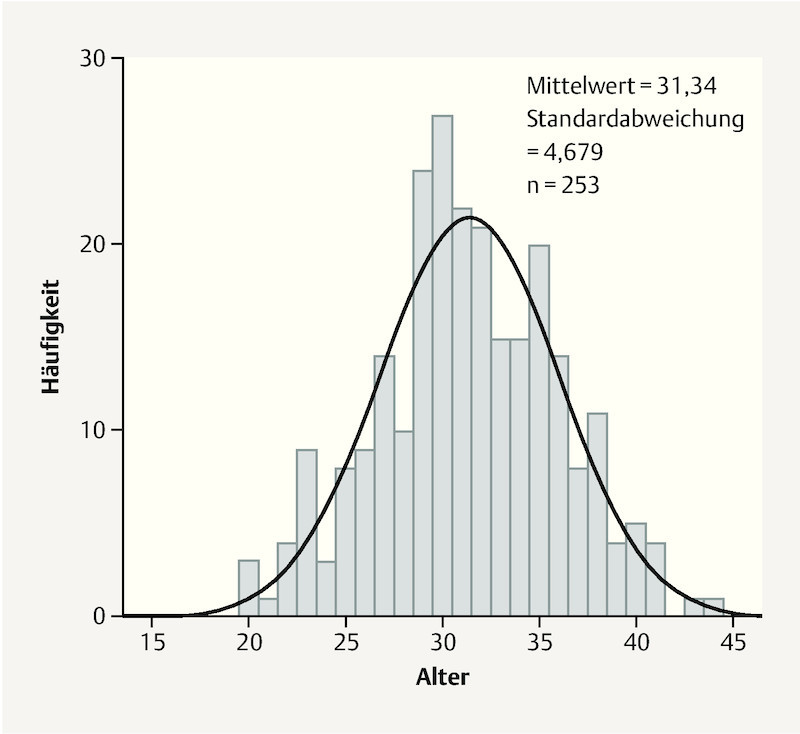
Kolmogorov-Smirnov test was used to test whether sample data were normally distributed for the total patient population and the respective subgroups. Graphically, the probability density of normal distribution is depicted as a Gaussian curve. The standard deviation (SD) indicates the percentage of values around the mean. Fig. 2 shows the typical representation of a normal distribution, in this case for the age of the women in the overall patient population (n = 253).
Fig. 2.
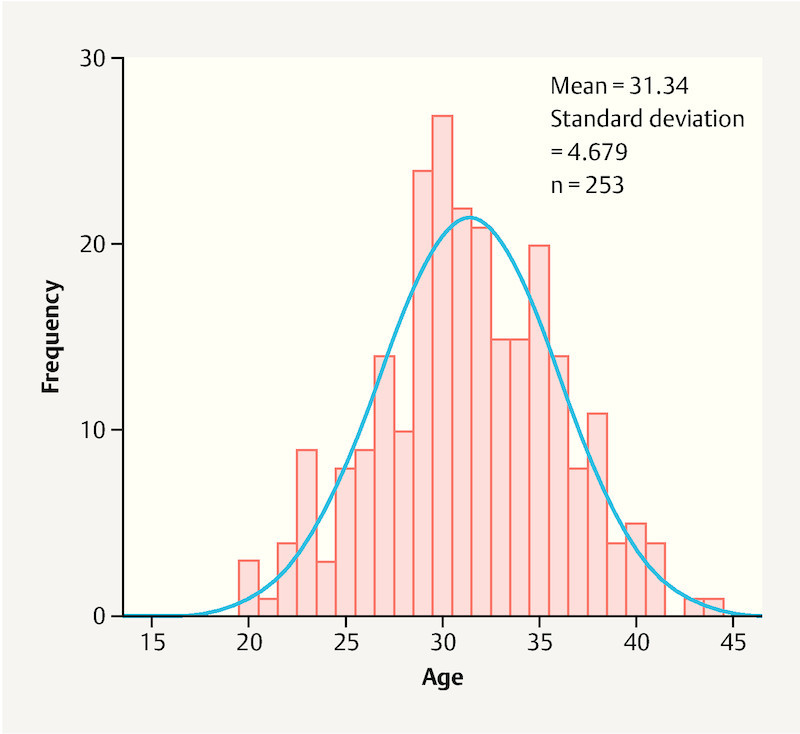
Graph showing normal distribution of the variable “age” for the total patient population (n = 253).
The parameters “age”, “BMI” and “number of pregnancies” were all normally distributed. The mean and standard deviation for these three variables in the overall patient population are given in Table 2. The other parameters were surveyed using yes-no questions which, of course, only permitted yes-no answers.
Table 2 Parameters with normal distribution.
| Parameter | Total study population (n) | Mean | Standard deviation |
|---|---|---|---|
| Age | 253 | 31.34 | 4.679 |
| BMI | 117 | 24.54 | 5.089 |
| Number of pregnancies | 187 | 1.75 | 1.013 |
Association between age and influenza vaccination
The mean age of the normally distributed overall patient population with 253 participants was 31.34 years (SD = 4.7). The age distribution of these pregnant women showed that the cohort of pregnant women who had opted to be vaccinated against influenza (n = 46) had a mean age of 32.6 years (SD = 4.5) while the pregnant women who refused vaccination (n = 190) were on average 30.9 years old (SD = 4.5). There was therefore no significant difference (p = 0.6) between groups for the overall study population of women who reported their vaccination status (n = 236; mean age: 31.2 years; SD = 4.6).
While there was no significant difference in the mean ages of pregnant women who accepted and the pregnant women who rejected vaccination in the Homburg cohort (p = 0.47), the difference in mean age between the two groups in the Worms cohort was significant (p = 0.01). In Worms the mean age of the women who were vaccinated against influenza was higher at 32.8 years (SD = 4.8) compared to a mean age of 29.2 years (SD = 4.4) for the pregnant women who rejected influenza vaccination.
Association between pregnancy and documented influenza vaccination
52.9 % (n = 99) of the surveyed women were pregnant for the first time. In the total patient population it was found that the percentage of multiparae who were vaccinated against influenza during pregnancy was higher with 21.7 % (n = 18) compared to the percentage of primiparae (14.1 %; n = 13). The trend was not statistically significant (p = 0.135).
Association between BMI (body mass index) and influenza vaccination
No significant association was found between BMI and vaccination coverage either in the total patient population (n = 107) or in the subgroups. In all patient cohorts it was found that more women with a higher BMI chose to be vaccinated against influenza. The mean BMI of vaccinated women in the total patient population (n = 17) was 27.1 kg/m2 (SD = 7.8) compared to a BMI of 24.2 kg/m2 (SD = 4.6) for women who did not choose to be vaccinated (n = 90; p = 0.099).
Association between BMI and influenza vaccination recommendation
To investigate whether women with a higher BMI were more likely to have received the recommendation to vaccinate against influenza, the patient population was divided into 2 groups. One group consisted of women who were of normal weight or underweight (BMI ≤ 24.99 kg/m2); the other group consisted of women who were overweight (BMI > 25.00 kg/m2). Out of the total patient population of women for whom a BMI was calculated (n = 117), 63.25 % (n = 74) had a normal weight or were underweight and 36.75 % (n = 43) were considered overweight according to the WHO definition. For 49 of these pregnant women, the records showed that vaccination had been recommended. For the subgroups this meant that 29 of the normal weight or underweight women and 20 of the overweight women had received the recommendation to be vaccinated against influenza during pregnancy. Given as a percentage, this means that 39.19 % of normal weight or underweight women and 46.51 % of overweight women had been given a recommendation by their physician or midwife to be vaccinated against influenza during pregnancy. The difference between groups was not significant (p = 0.13).
Association between receiving a vaccination recommendation and recorded influenza vaccination
A total of 157 (65.4 %) out of 240 women from the total patient population who stated whether or not they had received the recommendation to be vaccinated against influenza reported that they had not been informed about the possibility of being vaccinated against influenza.
Of the 83 women (34.6 %) who had been informed about the possibility of being vaccinated against influenza, 28.3 % (n = 68) were told about it by their gynecologist and 1.7 % (n = 4) were given the recommendation to be vaccinated by both their gynecologist and their family practitioner. 2.5 % (n = 6) of pregnant women were only informed about the possibility of being vaccinated against influenza by their family practitioner.
2.1 % (n = 5) of informed pregnant women obtained the information about the possibility of being vaccinated against influenza from other sources such as the company physician or the physicians and midwives at the hospital.
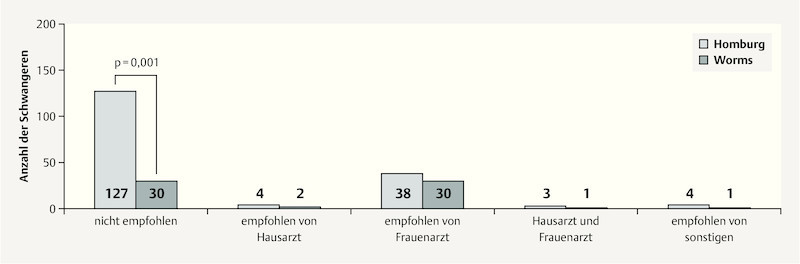
When the subgroups were studied, significant differences in information status were found between the two surveyed locations. While 27.8 % (n = 49) of patients in the Homburg group were informed about the option of being vaccinated against influenza, the percentage in the Worms group was 53.1 % (n = 34). The most important source of information for women in both study populations were their gynecologists. Table 3 shows the sources of information and their distribution for both surveyed locations.
Table 3 Source of vaccination information/recommendation for the subgroups from Homburg and Worms.
| Recommendation | Number (HOM) | Percentage (HOM) | Number (WO) | Percentage (WO) |
|---|---|---|---|---|
| No recommendation given | 127 | 72.2 | 30 | 46.9 |
| Recommended by family practitioner (GP) | 4 | 2.3 | 2 | 3.1 |
| Recommended by others | 4 | 2.3 | 1 | 1.6 |
| Recommended by gynecologist (GYN) | 38 | 21.6 | 30 | 46.9 |
| Recommended by GP and GYN | 3 | 1.7 | 1 | 1.6 |
| Total | 176 | 100 | 64 | 100 |
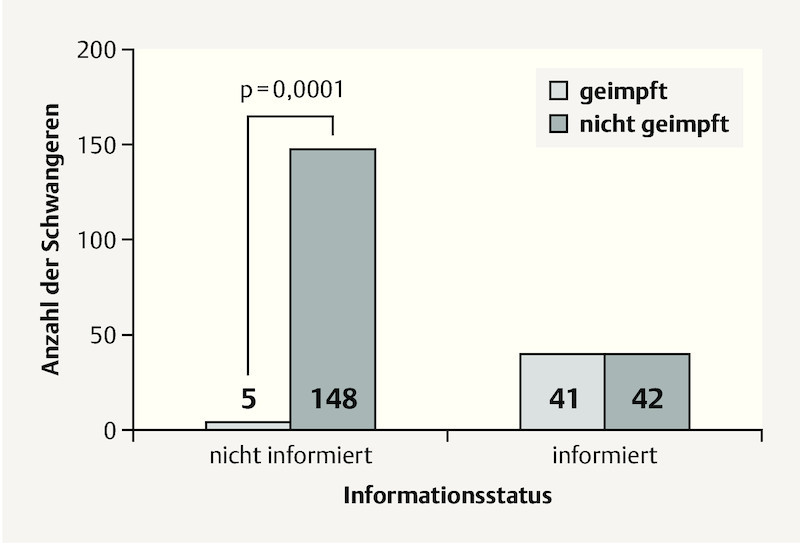
To show the impact of an explicit recommendation to get vaccinated, the pregnant women were divided into two groups: “informed” vs. “not informed”. All pregnant women who had not been given the recommendation to be vaccinated, including those women who had sought out the information themselves, were grouped into the latter cohort.
As Fig. 3 shows, 49.4 % (n = 41) of women who were given the vaccination recommendation actually subsequently went on to be vaccinated against influenza. Only 3.3 % of pregnant women (n = 5) who had not received a vaccination recommendation opted for vaccination. The difference between these two groups was statistically highly significant (p = 0.0001).
Fig. 3.
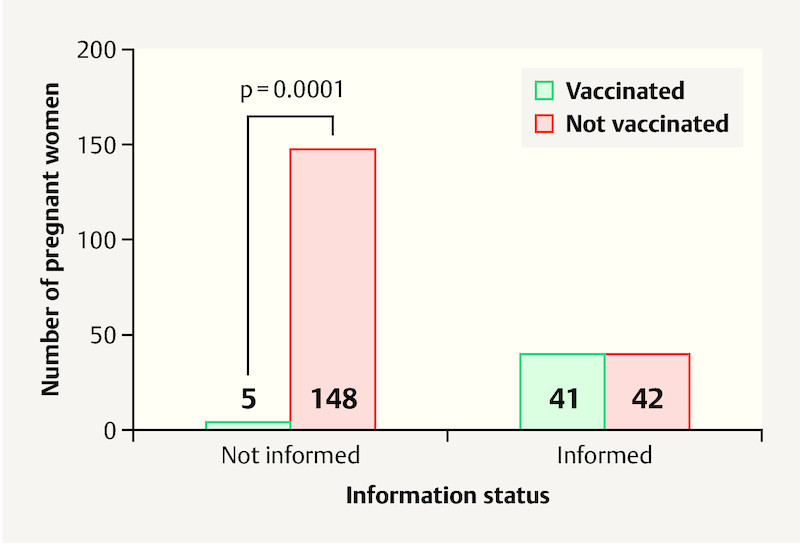
Information status and influenza vaccination for the total patient population (n = 236).
This high level of significance continued for the subgroups in Homburg and Worms (p = 0.0001 for both groups).
One disparity between the two subgroups was found for the group of “not-informed” women; 5 of the “not-informed” women in the Homburg cohort (4.0 %) opted independently to be vaccinated while none of the “not informed” pregnant women in the Worms cohort chose to be vaccinated.
Fig. 4 shows that women who were given the recommendation to be vaccinated against influenza in pregnancy, were significantly more likely to be vaccinated (p = 0.001), particularly if the recommendation was given by their gynecologist.
Fig. 4.
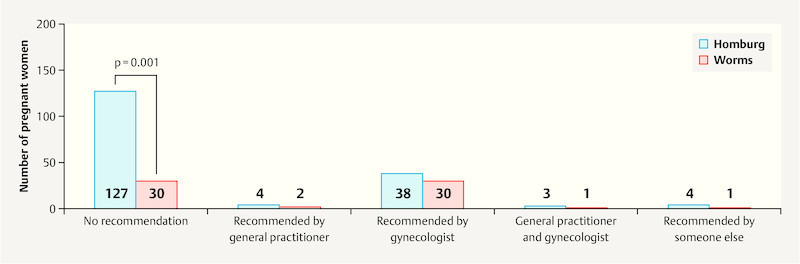
Vaccination recommendation and implementation for the total patient population (Homburg n = 176; Worms n = 64).
Association between previous influenza vaccination and influenza vaccination in pregnancy
Data on prior vaccinations obtained from vaccination certificates was available for a total of 229 pregnant women. Table 4 shows how many of the surveyed women were vaccinated against influenza and how often they had been vaccinated against influenza before they were pregnant.
Table 4 Recorded number of previous vaccinations for the total patient population.
| Number of previous vaccinations | Number (n) | Percentage |
|---|---|---|
| 0 | 163 | 71.2 |
| 1 | 29 | 12.7 |
| 2 | 14 | 6.1 |
| 3 | 6 | 2.6 |
| 4 | 9 | 3.9 |
| 5 | 3 | 1.3 |
| 6 | 4 | 1.7 |
| 7 | 0 | 0 |
| 8 | 1 | 0.4 |
| Total | 229 | 100 |
To investigate the association between being vaccinated against influenza prior to pregnancy and choosing to vaccinate during pregnancy, the total patient population was divided into two groups: a “prior vaccination-yes” and a “prior vaccination-no” group.
Analysis showed a highly significant association between the number of influenza vaccinations before pregnancy and the decision to be vaccinated against influenza during pregnancy (p = 0.0001). Of the 66 women who had had at least one influenza vaccination before their pregnancy, 26 women (43.3 %) also requested an influenza vaccination during their pregnancy. In contrast, only 17 (11.0 %) of the 154 women who had never had a previous influenza vaccination were vaccinated during pregnancy. When the two locations were analyzed separately, the differences between the group of women who had had prior vaccinations and the group which had not were also significant at both locations (p = 0.0001 Homburg group; p = 0.003 Worms group).
Table 5 lists the most common objections to the influenza vaccination cited by pregnant women in the open part of the survey.
Table 5 Reasons cited against being vaccinated against influenza during pregnancy.
| Risk of influenza is underestimated | Vaccine considered too risky | Various other counterarguments |
|---|---|---|
|
|
|
Two main types of arguments emerged. In one line of argumentation, the risk of developing influenza and the associated danger were underestimated; the other line of argumentation was that pregnant women considered the vaccine too risky.
Discussion
The main difficulty when carrying out this study was that while many pregnant women completed the questionnaire, many of them could not find their vaccination certificate. This meant that it was difficult to objectively verify the data provided by the women regarding their vaccination behavior.
For the target groups for whom the STIKO recommends seasonal influenza vaccination, the goal is to achieve a vaccination coverage of at least 75 % based on the guidelines of the World Health Organization (WHO). However, this is not currently achieved for any of the target groups in Germany 48, 49. Other countries have also not managed to achieve the WHO target. The figures on vaccination behavior vary greatly between countries. Thus, for the influenza season of 2011/2012, the percentage of pregnant women vaccinated against influenza was 2 % in Slovenia and 47 % in the USA 50, 56, 57. The causes for this are many and varied. They range from the differences between systems providing information to different forms of financing the vaccinations and to differences in the time points recommended for vaccinating pregnant women.
If you look at the average vaccination rates for the different target groups listed by the STIKO during the seasons 2007/2008 to 2010/2011, on average 26 % of medical staff, 52 % of persons over 60 years of age and 42 % of chronically sick persons were vaccinated against seasonal influenza 51. Compared to the national average in Germany, the federal states of the Saarland and the Rhineland-Palatinate made a particularly poor showing. In the season 2007/2008 less than 50 % (Saarland) and less than 40 % (Rhineland-Palatinate) of persons aged 60 and above were vaccinated 52. No reasons why vaccination rates are lowest in the Rhineland-Palatine and the Saarland could be found in the literature.
Compared to these rates, the vaccination rates of pregnant women in our study were significantly lower at 19.5 %. But this vaccination coverage corresponds to the data reported by Bödecker et al. In a national survey of 1025 pregnant women conducted across Germany in the period between February and March 2013, i.e., over a shorter time period but around the same time of year, the influenza vaccination rate was 23 % 53. As this finding was from a national survey, this suggests that the vaccination rate we found in the two German federal states is not an unusually low outlier but instead mirrors the average coverage across Germany. This means that a particularly low vaccination rate is not a regional issue but more likely to be a collective problem.
The recommendation to vaccinate pregnant women with chronic underlying disease against influenza has existed in the USA since 1966. In 1995 the influenza vaccination was recommended for all pregnant women in the third trimester of pregnancy, from 1997 it was also recommended to women in the second trimester of pregnancy and finally, from 2004, it was recommended for all pregnant women 54, 55, 56, 57.
The recommendations to vaccinate pregnant women against influenza in the USA are therefore quite different to those in Germany. With vaccinations considered part of standard prenatal care, the vaccination rates between 2009 and 2013 in the USA ranged from 47.1 to 50.5 % 55, 58, 59. This vaccination coverage is more than double the vaccination rates found in our patient population. When looking at the potential factors which can influence patient behavior in the context of influenza vaccinations, there was a slight but not significant trend with respect to age and body mass index whereby older pregnant women and women with a higher body mass index were more likely to opt for vaccination. One potential explanation could be that overweight women are more aware of their increased risk of cardiovascular disease and of pregnancy-related co-morbidities and therefore they make an effort to minimize other potential risk factors where possible 60, 61. This awareness of their increased risk does not only appear to play a role for the affected women themselves, it also appears to influence their physicians and midwives. The data showed that overweight pregnant women were slightly more likely to be given the recommendation to be vaccinated against influenza, although the difference to the group of normal-weight women was not significant.
The trend with regard to age is consistent with the fact that women who have had one or more previous pregnancies are more likely to opt to be vaccinated against influenza during their current pregnancy. This is also congruent with the fact that primiparae are on average younger than multiparae.
If a woman chose to be vaccinated against influenza before she was pregnant, the probability that she would choose to be vaccinated during pregnancy was significantly higher at 43.3 % compared to 11 % of women who had not been previously vaccinated but chose to be vaccinated against influenza when they were pregnant.
One reason for this could be that pregnant women who had not been previously vaccinated against influenza lacked any experience of the vaccination. In contrast, when women who had previously been vaccinated against influenza became pregnant, they were able to refer to their own prior experience of vaccination. Moreover, it should also be noted that primiparae were less likely to vaccinate against influenza during pregnancy with a vaccination rate of 14.1 %, compared to multiparae who had a vaccination rate of 21.7 %. The difference was not statistically significant but could be explained by the fact that a woman for whom pregnancy constitutes an entirely new experience might try to avoid any risks, even if it is only a subjectively perceived risk.
Extensive dissemination of information is the best way of reducing such subjective fears. This was borne out by the fact that if the pregnant womanʼs general practitioner or gynecologist explicitly recommended that she should be vaccinated against influenza during her pregnancy, the recommendation correlated very significantly with an increase in vaccination rates. Out of a total of 83 women who were given the recommendation to be vaccinated, 41 women went on to be vaccinated. In contrast, only 5 of the 157 women who did not receive a recommendation to be vaccinated went of their own accord to be vaccinated against influenza during their pregnancy. In the study carried out in Germany by Bödeker et al. referred to above, mistrust was the main reason cited by pregnant women why they did not opt to be vaccinated 53. Other reasons included a lack of awareness of the importance of being vaccinated against influenza and the lack of any official recommendation for vaccination. These findings correspond with our results. As Table 5 shows, the two main reasons which mitigated against being vaccinated against influenza in pregnancy were that the risk of an influenza infection was seriously underestimated and that the vaccine was considered too dangerous during pregnancy.
Numerous other studies have also reported that one of the arguments commonly voiced by pregnant women opposed to vaccination is their concern about the safety of the influenza vaccine 62, 63, 64, 65, 66.
The influence of treating physicians on the vaccination behavior of pregnant women has already been identified as a significant factor affecting vaccination coverage 67. Honkanen et al. (1996) came to the conclusion that the extensive information provided by physicians was the main reason for the high rate of influenza vaccinations among elderly patients in Finland 68. In their study of the influenza seasons 2006/2007 and 2007/2008 in Germany, Blank et al. were able to show that the recommendation by a physician to be vaccinated was one of the main reasons (with rates of 71 and 76.4 %, respectively) for people to choose to be vaccinated against seasonal influenza 69, 70, a finding which was confirmed by the survey of Wortberg et al. 71.
Studies from Australia and Hong Kong also came to the conclusion that the willingness to be vaccinated against influenza during pregnancy was not correlated with age but depended significantly on whether their physician recommended that they should be vaccinated 72, 73, 74.
Thus, the two main factors influencing the decision of pregnant women to be vaccinated during pregnancy were the womanʼs own experience of vaccination and the attitude of her treating physician. This is remarkable as information on the importance of influenza vaccination during pregnancy can be found on internet forums and in pregnancy guides 75, 76.
Nevertheless, only five of the patients surveyed in our study opted to be vaccinated on their own volition or based on their own research. Consequently, the treating physicians are the determining factor for vaccination coverage.
A survey carried out in Germany investigated the reasons why gynecologists in private practice did not recommend that their patients should be vaccinated against influenza in pregnancy. Of the persons surveyed 39.6 % expressed security concerns about the unborn infant, followed by the excessive time and effort required to inform patients in details (30.2 %), as well as security concerns on the part of the pregnant woman (29.2 %).
This was followed by a number of counterarguments against vaccination, which included doubts about the benefits of the vaccination and complaints about the low remuneration (24.0 % respectively), while 16.7 % stated that there was no need for vaccination 77.
These figures show that even in 2016 numerous physicians in private practice in Germany are not sufficiently informed about the safety and benefits of vaccinating against influenza in pregnancy.
The limitations of the study are that it was only carried out at two medical centers, meaning that the studyʼs validity with regard to the general vaccination status of pregnant women across all of Germany is limited.
Another weakness of the study is that the pregnant women in the two centers were not surveyed during the same period of time. This could result in a distortion of the data. Such a distortion of data could also result from the fact that the survey was carried out both in winter and in summer, and the vaccination rate in winter differed from the vaccination rate in summer.
Nevertheless, the findings of the study by Bödeker et al. with regard to influenza vaccination coverage and the reservations cited against vaccination were comparable with the results found in our study 53.
To improve the findings of our study it would have been useful to have asked in which week of pregnancy the women were vaccinated or had received the recommendation to be vaccinated and in which week of pregnancy the patient was when she was given the questionnaire. It would also have been useful to record at what time of year the survey was carried out; to have classified the patientsʼ level of education in more detail, and to have included socio-economic factors such as household income and nationality.
One of the strengths of the study is that it did not merely record the patientsʼ subjective statement about influenza vaccination in pregnancy but also attempted to get objective facts by verifying the statement using the patientsʼ vaccination certificate. However, verification of the patientsʼ general vaccination status and their status with regard to the influenza vaccination based on their vaccination certificates proved to be difficult as a large number of pregnant women were no longer able to locate their vaccination certificates.
Conclusions
As treating physicians are clearly the most important professionals consulted by pregnant women on health issues, information campaigns targeting physicians in private practice could lead to substantially higher vaccination rates.
This increase in information should be directed first and foremost at gynecologists, as they are the main professionals consulted by pregnant women. But general practitioners and midwives should also be targeted in an information campaign, as they too are confronted with questions respecting vaccinations during pregnancy.
Five Key Points
The documented influenza vaccination rate for the total study population of pregnant women was 19.5 %.
The influenza vaccination rate is therefore far below the target rate of 75 % proposed by the STIKO and the WHO.
The willingness to be vaccinated against influenza is high among pregnant women who have previously been vaccinated against influenza before they became pregnant.
The most important factor which affects vaccination coverage is the recommendation given to the pregnant woman by her treating physician.
Vaccination coverage can be increased if physicians help to raise patientsʼ awareness and provide information.
Footnotes
Conflict of Interest The authors declare that they have no conflict of interest.
References/Literatur
- 1.Robert Koch-Institut (RKI) Ständige Impfkommission Aufgaben und Methodik 2013. Online:http://www.rki.de/DE/Content/Kommissionen/STIKO/Aufgaben_Methoden/methoden_node.htmllast access: 07.03.2013
- 2.Robert Koch-Institut (RKI) . Epidemiologisches Bulletin 30/2010 (30)
- 3.Robert Koch-Institut Saisonale Influenzaimpfung: Häufig gestellte Fragen und AntwortenOnline:http://www.rki.de/SharedDocs/FAQ/Impfen/Influenza/faq_ges.html?nn=2375548last access: 26.01.2017
- 4.Doyle T J, Goodin K, Hamilton J J. Maternal and neonatal outcomes among pregnant women with 2009 pandemic influenza A (H1N1) illness in Florida, 2009–2010: a population-based cohort study. PLoS One. 2013;8:e79040. doi: 10.1371/journal.pone.0079040. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Knuf M. Influenzainfektion in der Gravidität. Gynäkologe. 2011;44:593–600. [Google Scholar]
- 6.Laibl V R, Sheffield J S. Influenza and pneumonia in pregnancy. Clin Perinatol. 2005;32:727–738. doi: 10.1016/j.clp.2005.04.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Jamieson D J, Honein M A, Rasmussen S A. H1N1 2009 influenza virus infection during pregnancy in the USA. Lancet. 2009;374:451–458. doi: 10.1016/S0140-6736(09)61304-0. [DOI] [PubMed] [Google Scholar]
- 8.Rasmussen S A, Jamieson D J, Uyeki T M. Effects of influenza on pregnant women and infants. Am J Obstet Gynecol. 2012;207:S3–S8. doi: 10.1016/j.ajog.2012.06.068. [DOI] [PubMed] [Google Scholar]
- 9.Ortiz J R, Englund J A, Neuzil K M. Influenza vaccine for pregnant women in resource-constrained countries: a review of the evidence to inform policy decisions. Vaccine. 2011;29:4439–4452. doi: 10.1016/j.vaccine.2011.04.048. [DOI] [PubMed] [Google Scholar]
- 10.Haberg S E, Trogstad L, Gunnes N. Risk of fetal death after pandemic influenza infection or vaccination during pregnancy. N Engl J Med. 2013;368:333–340. doi: 10.1056/NEJMoa1207210. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Hardy J M, Azarowicz E N, Mannini A. The effect of Asian influenza on the outcome of pregnancy, Baltimore, 1957–1958. Am J Public Health Nations Health. 1961;51:1182–1188. doi: 10.2105/ajph.51.8.1182. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Mosby L G, Rasmussen S A, Jamieson D J. 2009 pandemic influenza A (H1N1) in pregnancy: a systematic review of the literature. Am J Obstet Gynecol. 2011;205:10. doi: 10.1016/j.ajog.2010.12.033. [DOI] [PubMed] [Google Scholar]
- 13.Harris J W. Influenza occurring in pregnant women. JAMA. 1919;72:978. [Google Scholar]
- 14.Centers for Disease Control and Prevention (CDC) . Maternal and infant outcomes among severely ill pregnant and postpartum women with 2009 pandemic influenza A (H1N1)–United States, April 2009-August 2010. MMWR Morb Mortal Wkly Rep. 2011;60:1193–1196. [PubMed] [Google Scholar]
- 15.Bloom-Feshbach K, Simonsen L, Viboud C. Natality decline and miscarriages associated with the 1918 influenza pandemic: the Scandinavian and United States experiences. J Infect Dis. 2011;204:1157–1164. doi: 10.1093/infdis/jir510. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.McNeil S A, Dodds L A, Fell D B. Effect of respiratory hospitalization during pregnancy on infant outcomes. Am J Obstet Gynecol. 2011;204:S54–S57. doi: 10.1016/j.ajog.2011.04.031. [DOI] [PubMed] [Google Scholar]
- 17.Mendez-Figueroa H, Raker C. Neonatal characteristics and outcomes of pregnancies complicated by influenza infection during the 2009 pandemic. Am J Obstet Gynecol. 2011;204:S58–S63. doi: 10.1016/j.ajog.2011.02.058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Yates L, Pierce M, Stephens S. Influenza A/H1N1v in pregnancy: an investigation of the characteristics and management of affected women and the relationship to pregnancy outcomes for mother and infant. Health Technol Assess. 2010;14:109–182. doi: 10.3310/hta14340-02. [DOI] [PubMed] [Google Scholar]
- 19.Bland P B. Influenza in its relation to pregnancy and labor. Am J Obstet Dis Women Child. 1919;79:184–197. [Google Scholar]
- 20.Harris J W. Influenza occurring in pregnant women. JAMA. 1919;72:978–980. [Google Scholar]
- 21.Mortimer P. Influenza-related death rates for pregnant women. Emerging Infect Dis J. 2006;12:1805–1806. doi: 10.3201/eid1211.061071. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Freeman D W, Barno A. Deaths from Asian influenza associated with pregnancy. Am J Obstet Gynecol. 1959;78:1172–1175. doi: 10.1016/0002-9378(59)90570-8. [DOI] [PubMed] [Google Scholar]
- 23.DEATHS from Asian influenza, 1957; a report by the Public Health Laboratory Service based on records from hospital and public health laboratories. Br Med J. 1958;1:915–919. [PMC free article] [PubMed] [Google Scholar]
- 24.Kort B A, Cefalo R C, Baker V V. Fatal influenza A pneumonia in pregnancy. Am J Perinatol. 1986;3:179–182. doi: 10.1055/s-2007-999862. [DOI] [PubMed] [Google Scholar]
- 25.Kirshon B, Faro S, Zurawin R K. Favourable outcome after amantadine and ribaviron in a pregnancy complicated by influenza pneumonia. J Reprod Med. 1988;33:399–401. [PubMed] [Google Scholar]
- 26.Schoenbaum S C, Weinstein L. Respiratory infection in pregnancy. Clin Obstet Gynecol. 1979;22:293–300. doi: 10.1097/00003081-197906000-00006. [DOI] [PubMed] [Google Scholar]
- 27.Siston A M, Rasmussen S A, Honein M A. Pandemic 2009 influenza A (H1N1) virus illness among pregnant women in the United States. JAMA. 2010;303:1517–1525. doi: 10.1001/jama.2010.479. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Kelly H, Mercer G, Cheng A. Quantifying the risk of pandemic influenza in pregnancy and indigenous people in Australia in 2009. Euro Surveill. 2009;14:pii:19441. [PubMed] [Google Scholar]
- 29.ANZIC Influenza Investigators and Australasian Maternity Outcomes Surveillance System . Critical illness due to 2009 A/H1N1 influenza in pregnant and postpartum women: population based cohort study. BMJ. 2010;340:c1279. doi: 10.1136/bmj.c1279. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Jain S, Kamimoto L, Bramley A M. Hospitalized patients with 2009 H1N1 influenza in the United States, April-June 2009. N Engl J Med. 2009;361:1935–1944. doi: 10.1056/NEJMoa0906695. [DOI] [PubMed] [Google Scholar]
- 31.Donaldson L J, Rutter P D, Ellis B M. Mortality from pandemic A/H1N1 2009 influenza in England: public health surveillance study. BMJ. 2009;339:b5213. doi: 10.1136/bmj.b5213. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Van Kerkhove M D, Vandemaele K A, Shinde V. Risk factors for severe outcomes following 2009 influenza A (H1N1) infection: a global pooled analysis. PLoS Med. 2011;8:e1001053. doi: 10.1371/journal.pmed.1001053. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Mertz D, Geraci J, Winkup J. Pregnancy as a risk factor for severe outcomes from influenza virus infection: a systematic review and meta-analysis of observational studies. Vaccine. 2017;35:521–528. doi: 10.1016/j.vaccine.2016.12.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Neuzil K M, Reed G W, Mitchel E F. Impact of influenza on acute cardiopulmonary hospitalizations in pregnant women. Am J Epidemiol. 1998;148:1094–1102. doi: 10.1093/oxfordjournals.aje.a009587. [DOI] [PubMed] [Google Scholar]
- 35.Cox S, Posner S F, McPheeters M. Influenza and pregnant women: hospitalization burden, United States, 1998-2002. J Womens Health (Larchmt) 2006;15:891–893. doi: 10.1089/jwh.2006.15.891. [DOI] [PubMed] [Google Scholar]
- 36.Dodds L, McNeil S A, Fell D B. Impact of influenza exposure on rates of hospital admissions and physician visits because of respiratory illness among pregnant women. CMAJ. 2007;176:463–468. doi: 10.1503/cmaj.061435. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Legge A, Dodds L, MacDonald N E. Rates and determinants of seasonal influenza vaccination in pregnancy and association with neonatal outcomes. CMAJ. 2014;186:E157–E164. doi: 10.1503/cmaj.130499. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Mak T K, Mangtani P, Leese J. Influenza vaccination in pregnancy: current evidence and selected national policies. Lancet Infect Dis. 2008;8:44–52. doi: 10.1016/S1473-3099(07)70311-0. [DOI] [PubMed] [Google Scholar]
- 39.Manske J M. Efficacy and effectiveness of maternal influenza vaccination during pregnancy: a review of the evidence. Matern Child Health J. 2014;18:1599–1609. doi: 10.1007/s10995-013-1399-2. [DOI] [PubMed] [Google Scholar]
- 40.Munoz F M. Safety of influenza vaccines in pregnant women. Am J Obstet Gynecol. 2009;207:S33–S37. doi: 10.1016/j.ajog.2012.06.072. [DOI] [PubMed] [Google Scholar]
- 41.Munoz F M, Greisinger A J, Wehmanen O A. Safety of influenza vaccination during pregnancy. Am J Obstet Gynecol. 2005;192:1098–1106. doi: 10.1016/j.ajog.2004.12.019. [DOI] [PubMed] [Google Scholar]
- 42.Omer S B, Goodman D, Steinhoff M C. Maternal influenza immunization and reduced likelihood of prematurity and small for gestational age births: a retrospective cohort study. PLoS Med. 2011;8:e1000441. doi: 10.1371/journal.pmed.1000441. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Skowronski D M, De Serres G. Is routine influenza immunization warranted in early pregnancy? Vaccine. 2009;27:4754–4770. doi: 10.1016/j.vaccine.2009.03.079. [DOI] [PubMed] [Google Scholar]
- 44.Tamma P D, Ault K A, del Rio C. Safety of influenza vaccination during pregnancy. Am J Obstet Gynecol. 2009;201:547–552. doi: 10.1016/j.ajog.2009.09.034. [DOI] [PubMed] [Google Scholar]
- 45.Zaman K, Roy E, Arifeen S E. Effectiveness of maternal influenza immunization in mothers and infants. N Engl J Med. 2008;359:1555–1564. doi: 10.1056/NEJMoa0708630. [DOI] [PubMed] [Google Scholar]
- 46.Eick A A, Uyeki T M, Klimov A. Maternal influenza vaccination and effect on influenza virus infection in young infants. Arch Pediatr Adolesc Med. 2011;165:104–111. doi: 10.1001/archpediatrics.2010.192. [DOI] [PubMed] [Google Scholar]
- 47.WHO BMI classificationOnline:http://apps.who.int/bmi/index.jsp?introPage=intro_3.htmllast access: 28.03.2017
- 48.World Health Organization . Influenza vaccines – WHO position paper. Weekly Epidemiological Record. 2005;33:279–287. [Google Scholar]
- 49.Poethko-Müller C, Schmitz R. Impfstatus von Erwachsenen in Deutschland. Bundesgesundheitsbl. 2013;56:845–857. doi: 10.1007/s00103-013-1693-6. [DOI] [PubMed] [Google Scholar]
- 50.OʼFlanagan D, Cotter S, Mereckiene J.Seasonal influenza vaccination in EU/EEA, influenza season 2011–12 2013. Online:http://venice.cineca.org/VENICE%20Seasonal%20Influenza%202011?12%201.0v.pdflast access: 15.11.2013
- 51.Böhmer M M. Berlin: FU-Berlin; 2013. Impfquoten, Impfverhalten und Impfakzeptanz bei Erwachsenen in Deutschland [Dissertation]
- 52.Robert Koch-Institut GBE Kompakt – 1/2011 – Grippeschutzimpfung in Deutschland – Ergebnisse der Studie „Gesundheit in Deutschland aktuell“ (GEDA) 2009. Online:http://www.rki.de/DE/Content/Gesundheitsmonitoring/Gesundheitsberichterstattung/GBEDownloadsK/2011_1_Grippeschutzimpfung.html?nn=2531734last access: 03.02.2011
- 53.Bödeker B, Walter D, Reiter S. Cross-sectional study on factors associated with influenza vaccine uptake and pertussis vaccination status among pregnant women in Germany. Vaccine. 2014;32:4131–4139. doi: 10.1016/j.vaccine.2014.06.007. [DOI] [PubMed] [Google Scholar]
- 54.Advisory Committee on Immunization Practices (ACIP) Morbidity and mortality weekly report. Updated interim influenza vaccination recommendations. 2004–05 Influenza seasonOnline:http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5350a7.htmlast access: 16.03.2014
- 55.The American College of Obstetricians and Gynecologists Committee Opinion. (Replaces No. 305, November 2004). 2010 2010. 468: 1–2
- 56.Vanessen G, Palache A, Forleo E. Influenza vaccination in 2000: recommendations and vaccine use in 50 developed and rapidly developing countries. Vaccine. 2003;21:1780–1785. doi: 10.1016/s0264-410x(03)00072-0. [DOI] [PubMed] [Google Scholar]
- 57.Kennedy E D, Ahluwalia I B, Ding H. Monitoring seasonal influenza vaccination coverage among pregnant women in the United States. Am J Obstet Gynecol. 2012;207:S9–S16. doi: 10.1016/j.ajog.2012.06.069. [DOI] [PubMed] [Google Scholar]
- 58.Centers for Disease Control and Prevention (CDC) . Influenza vaccination coverage among pregnant women - 29 Sates and New York City, 2009-10 season. MMWR Morb Mortal Wkly Rep. 2012;61:113–118. [PubMed] [Google Scholar]
- 59.Centers for Disease Control and Prevention (CDC) . Influenza vaccination coverage among pregnant women—United States, 2012-13 influenza season. MMWR Morb Mortal Wkly Rep. 2013;62:787–792. [PMC free article] [PubMed] [Google Scholar]
- 60.Cedergren M I. Maternal morbid obesity and the risk of adverse pregnancy outcome. Obstet Gynecol. 2004;103:219–224. doi: 10.1097/01.AOG.0000107291.46159.00. [DOI] [PubMed] [Google Scholar]
- 61.Sebire N J, Jolly M, Harris J P. Maternal obesity and pregnancy outcome: a study of 287,213 pregnancies in London. Int J Obes Relat Metab Disord. 2001;25:1175–1182. doi: 10.1038/sj.ijo.0801670. [DOI] [PubMed] [Google Scholar]
- 62.Eppes C, Wu A, You W. Barriers to influenza vaccination among pregnant women. Vaccine. 2013;31:2874–2878. doi: 10.1016/j.vaccine.2013.04.031. [DOI] [PubMed] [Google Scholar]
- 63.Centers for Disease Control and Prevention (CDC) . Influenza vaccination coverage among pregnant women: 2011-12 influenza season, United States. MMWR Morb Mortal Wkly Rep. 2012;61:758–763. [PubMed] [Google Scholar]
- 64.Wiley K E, Massey P D, Cooper S C. Uptake of influenza vaccine by pregnant women: a cross-sectional survey. Med J Aust. 2013;198:373–375. doi: 10.5694/mja12.11849. [DOI] [PubMed] [Google Scholar]
- 65.Yudin M H, Salaripour M, Sgro M D. Pregnant womenʼs knowledge of influenza and the use and safety of the influenza vaccine during pregnancy. J Obstet Gynaecol Can. 2009;31:120–125. doi: 10.1016/s1701-2163(16)34095-6. [DOI] [PubMed] [Google Scholar]
- 66.Meyer C, Reiter S. [Vaccine opponents and sceptics. History, background, arguments, interaction] Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2004;47:1182–1188. doi: 10.1007/s00103-004-0953-x. [DOI] [PubMed] [Google Scholar]
- 67.Riegger A. Pressegespräch anlässlich des 4. Deutschen Influenza-Kongresses. Die Influenza – eine immer währende Bedrohung. Donnerstag, 27. September 2012
- 68.Honkanen P O, Keistinen T, Kivela S. Factors associated with influenza vaccination coverage among the elderly: role of health care personnel. Public Health. 1996;110:163–168. doi: 10.1016/s0033-3506(96)80070-9. [DOI] [PubMed] [Google Scholar]
- 69.Blank P R, Schwenkglenks M, Szucs T D. Influenza vaccination coverage rates in five European countries during season 2006/07 and trends over six consecutive seasons. BMC Public Health. 2008;8:272. doi: 10.1186/1471-2458-8-272. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Blank P R, Schwenkglenks M, Szucs T D. Disparities in influenza vaccination coverage rates by target group in five European countries: trends over seven consecutive seasons. Infection. 2009;37:390–400. doi: 10.1007/s15010-009-8467-y. [DOI] [PubMed] [Google Scholar]
- 71.Wortberg S, Walter D, Knesebeck M. Niedergelassene Ärzte als Multiplikatoren der Influenzaimpfung bei älteren Menschen, chronisch Kranken und medizinischem Personal. Bundesgesundheitsbl. 2009;52:945–952. doi: 10.1007/s00103-009-0871-z. [DOI] [PubMed] [Google Scholar]
- 72.Maher L, Hope K, Torvaldsen S. Influenza vaccination during pregnancy: coverage rates and influencing factors in two urban districts in Sydney. Vaccine. 2013;31:5557–5564. doi: 10.1016/j.vaccine.2013.08.081. [DOI] [PubMed] [Google Scholar]
- 73.Taksdal S E, Mak D B, Joyce S. Predictors of uptake of influenza vaccination—a survey of pregnant women in Western Australia. Aust Fam Physician. 2013;42:582–586. [PubMed] [Google Scholar]
- 74.Yuet Sheung Yuen C, Yee Tak Fong D, Lai Yin Lee I. Prevalence and predictors of maternal seasonal influenza vaccination in Hong Kong. Vaccine. 2013;31:5281–5288. doi: 10.1016/j.vaccine.2013.08.063. [DOI] [PubMed] [Google Scholar]
- 75.eltern.de Schwangerschaft Grippe-Impfung für werdende Mütter? – Gesundheit & Fitness – Eltern.deOnline:http://www.eltern.de/schwangerschaft/gesundheit-und-fitness/schwangerschaft-grippe-impfung.htmllast access: 16.03.2014
- 76.Forum goFeminin.Grippeimpfung in der Schwangerschaft 2009. Online:http://forum.gofeminin.de/forum/matern1/__f101941_matern1-Grippeimpfung-in-der-Schwangerschaft.htmllast access: 16.03.2014
- 77.Bödeker B, Seefeld L, Buck S. [Implementation of seasonal influenza and human papillomavirus vaccination recommendations in gynecological practices in Germany] Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2016;59:396–404. doi: 10.1007/s00103-015-2303-6. [DOI] [PubMed] [Google Scholar]