Abstract
Aims The aim of this official guideline published and coordinated by the German Society of Gynecology and Obstetrics (DGGG) was to provide consensus-based recommendations obtained by evaluating the relevant literature for the diagnostic treatment and management of women with fetal growth restriction.
Methods This S2k guideline represents the structured consensus of a representative panel of experts with a range of different professional backgrounds commissioned by the Guideline Committee of the DGGG.
Recommendations Recommendations for diagnostic treatment, management, counselling, prophylaxis and screening are presented.
Key words: IUGR, growth restriction, guideline
I Guideline Information
Guidelines Program of the DGGG, OEGGG and SGGG
Information on the program is provided at the end of the article.
Guideline documents
The complete long version (in German), a PDF slideshow for PowerPoint presentations and a summary of the conflicts of interest of all the authors is available on the AWMF homepage under: http://www.awmf.org/leitlinien/detail/ll/015-080.html
Guideline authors
The following professional and scientific societies/working groups/organizations/associations have stated their interest in contributing to the compilation of the guideline text and participating in the consensus conference and have sent representatives to the consensus conference ( Table 1 ).
Table 1 Authors and representatives: participation of the target user group.
| Author Mandate holder |
DGGG working group/AWMF/non AWMF professional association/organization/society |
|---|---|
| Lead author and/or coordinating author: | |
| PD Dr. med. Sven Kehl | German Society of Gynecology and Obstetrics (Deutsche Gesellschaft für Gynäkologie und Geburtshilfe e. V. [DGGG]) |
| Other lead authors: | |
| PD Dr. med. Dagmar Schmitz | German Academy for Ethics in Medicine (Akademie für Ethik in der Medizin [AEM]) |
| PD Dr. med. Dietmar Schlembach | Working Group Hypertension in Pregnancy/ Gestosis (Arbeitsgemeinschaft Schwangerschaftshochdruck/Gestose e. V. [AG Gestose]) |
| Prof. Dr. med. Kurt Hecher | Germany Society for Ultrasound in Medicine (Deutsche Gesellschaft für Ultraschall in der Medizin e. V. [DEGUM]) |
| Prof. Dr. med. Holger Stepan | German Society of Gynecology and Obstetrics (Deutsche Gesellschaft für Gynäkologie und Geburtshilfe e. V. [DGGG]) |
| Prof. Dr. med. Jörg Dötsch | German Society for Pediatric and Adolescent Medicine (Deutsche Gesellschaft für Kinder- und Jugendmedizin e. V. [DGKJ]) and German Society for Neonatology and Pediatric Intensive Care (Gesellschaft für Neonatologie und Pädiatrische Intensivmedizin [GNPI]) |
| Prof. Dr. med. Ulrich Gembruch | German Society of Perinatal Medicine (Deutsche Gesellschaft für Perinatale Medizin e. V. [DGPM]) |
Abbreviations
- AED
absent end-diastolic
- AEDF
absent end-diastolic flow
- ARED
absent or reversed end-diastolic
- ASA
acetylsalicylic acid
- CPR
cerebroplacental ratio
- CTG
cardiotocography
- GW
week of gestation
- hCG
human choriogonadotropin
- IUFD
intrauterine fetal death
- IUGR
intrauterine growth restriction
- NT
nuchal translucency
- PAPP-A
pregnancy-associated plasma protein A
- PI
pulsatility index
- PlGF
placental growth factor
- PP13
placental protein 13
- RDS
respiratory distress syndrome
- RED
reversed end-diastolic
- REDF
reversed end-diastolic flow
- RR
relative risk
- SGA
small for gestational age
- SDP
single deepest pocket
- s/p
status post
- STV
short-term variation
II Guideline Application
Purpose and Objectives
This guideline aims to summarize the current state of knowledge on intrauterine growth restriction (IUGR). It focuses on the definition, etiology, diagnosis and management of care and states the best time to deliver the baby.
Targeted areas of patient care
Inpatient care
Outpatient care
Target patient groups
This guideline is aimed at pregnant patients.
Target user groups/target audience
This guideline is aimed at the following groups:
Gynecologists in private practice (non-hospital based)
Hospital-based gynecologists
Midwives
Adoption of the guideline and period of validity
This guideline is valid from May 1, 2017 through to April 30, 2020. Because of the contents of this guideline, the above-mentioned period of validity is only an estimate. If important changes to the available evidence should occur, then amendments to the guideline will be published even before the period of validity has expired, after a careful review of the new evidence in accordance with the methodology published by the AWMF.
III Methodology
Basic principles
The methodology used to prepare this guideline is determined by the class assigned to the guideline. The AWMF Guidance Manual (version 1.0) has set out the respective rules and requirements for different classes of guidelines. Guidelines are differentiated into lowest (S1), intermediate (S2) and highest (S3) class. The lowest class is defined as a set of recommendations for action compiled by a non-representative group of experts. In 2004 the S2 class was divided into two subclasses: the systematic evidence-based subclass S2e and the structural consensus-based subclass S2k. The highest S3 class combines both approaches.
This guideline is classified as: S2k
Grading of recommendations
While the classification of the quality of the evidence (strength of evidence) serves as an indication of the robustness of the published data and therefore expresses the extent of certainty/uncertainty about the data, the classification of the level of recommendation reflects the results of weighing up the desirable and adverse consequences of alternative approaches.
The grading of evidence and the grading of recommendations was not envisaged for S2k class guidelines. Individual recommendations are differentiated by syntax, not by symbols. The syntax chosen for the level of recommendation should be described in the background text ( Table 2 ).
Table 2 Grading of recommendations.
| Description of grade of recommendation | Syntax |
|---|---|
| Strong recommendation, highly binding | must/must not |
| Recommendation, moderately binding | should/should not |
| Open recommendation, not binding | may/may not |
Statements
Expert statements included in this guideline which are not recommendations for action but are simple statements of fact are referred to as Statements . It is not possible to provide a level of evidence for these statements.
Achieving consensus and level of consensus
During structured consensus-based decision-making (S2k/S3 level), authorized participants present at a session vote on draft Statements and Recommendations. Discussions during sessions may lead to significant changes in the wording of Statements and Recommendations. The extent of agreement, which depends on the number of participants, is determined at the end of the session ( Table 3 ).
Table 3 Classification of extent of agreement in consensus decision-making
| Symbol | Level of consensus | Extent of agreement in percent |
|---|---|---|
| +++ | Strong consensus | > 95% of participants agree |
| ++ | Consensus | > 75 – 95% of participants agree |
| + | Majority agreement | > 50 – 75% of participants agree |
| – | No consensus | < 50% of participants agree |
Expert consensus
As the name implies, this refers to consensus decisions taken with regard to specific Recommendations/Statements without a previous systematic search of the literature (S2k) or when evidence is lacking (S2e/S3). The term “Expert Consensus” (EC) used here is synonymous with terms such as “Good Clinical Practice” (GCP) and “Clinical Consensus Point” (CCP) used in other guidelines. The level of recommendation is graded as previously described in the Chapter Grading of recommendations but only semantically (“must”/“must not” or “should”/“should not” or “may”/“may not”) and without the use of symbols.
IV Guideline
1 Definition
| Consensus-based Statement 1.S1 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 1 , 2 , 3 | |
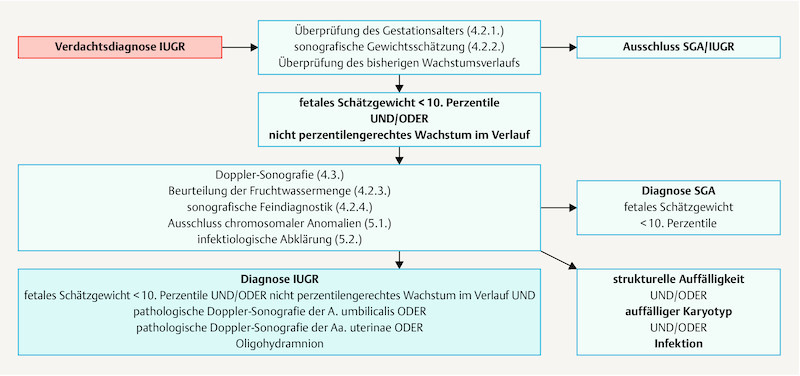
| SGA = estimated fetal weight or birth weight < 10th percentile IUGR = estimated fetal weight < 10th percentile and/or non-percentile appropriate fetal growth during pregnancy and pathological Doppler of umbilical artery or pathological Doppler of uterine artery or oligohydramnios | |
| Consensus-based Statement 1.S2 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 4 | |
| Estimated fetal weight or birth weight < 3rd percentile is associated with higher levels of morbidity and mortality. | |
2 Epidemiology and Etiology
| Consensus-based Recommendation 2.E1 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 5 , 6 , 7 | |
| Based on their full medical history, all pregnant women must be evaluated for potential risk factors which could predispose to IUGR. Further diagnostic investigations must be offered or carried out if risk factors are present. | |
IUGR is a condition which affects approximately 5 – 10% of all pregnancies 5 , 6 . The etiology of IUGR is roughly divided into maternal, placental and fetal causes ( Table 4 ) 7 . Although the underlying pathophysiological mechanisms may be very different, they often (but not always) lead to the same endpoint: suboptimal uteroplacental perfusion and fetal nutrition. IUGR is therefore associated with high levels of morbidity and mortality.
Table 4 Risk factors for developing intrauterine growth restriction. Common risk factors are highlighted in bold .
| Maternal causes |
Alcohol abuse
8
Hypertensive disease of pregnancy (pre-eclampsia, gestational hypertension) 9 Drug/nicotine abuse10 , 11 Embryotoxic or fetotoxic medication 12 Maternal age (≥ 35/ > 40 years ) 13 Maternal weight (high or very low BMI) 14 Low socio-economic status 15 , 16 Nulliparity 17 s/p hypertensive disorder in a previous pregnancy s/p IUFD 9 s/p SGA/IUGR 9 |
|
Preexisting maternal diseases, which can lead to reduced uteroplacental perfusion or reduced oxygenation of maternal blood, e.g.:
Chronic respiratory disease Chronic hypertension 18 Chronic renal disease 19 Diabetes mellitus with vascular disease 20 Heart disease, especially cyanotic heart disease 21 Severe anemia Systemic lupus erythematosus and antiphospholipid syndrome 22 | |
| Uteroplacental causes |
Placental abruption
23
Velamentous cord insertion Placental infarction 24 Disorders of placentation with inadequate trophoblast invasion and increased maternal risk of pre-eclampsia 25 Placental tumors |
| Fetal causes |
Chromosomal abnormalities and syndromic disease26
,
27
Intrauterine infections (particularly cytomegaly, toxoplasmosis, rubella, varicella zoster virus) Multiple pregnancy 28 |
3 Diagnostics to Detect Possible IUGR
In addition to taking the patientʼs history, a clinical examination and various diagnostic procedures must be carried out to rule out or confirm IUGR. This is an important part of antenatal care as the majority of IUGR are not detected prenatally 29 and undetected IUGR is associated with an 8-fold higher risk of intrauterine fetal death 30 .
3.1 Clinical examination
| Consensus-based Recommendation 3.E2 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 31 | |
| Clinical examinations are of only limited value when screening for SGA/IUGR. Ultrasound biometry must be carried out for further medical evaluation if there is a suspicion of anomalies. | |
3.2 Sonography
3.2.1 Biometry in early pregnancy (crown-rump length)
| Consensus-based Recommendation 3.E3 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 32 , 33 , 34 , 35 , 36 | |
| Fetal gestational age (based on maternal medical history) must be verified through measurement of the crown-rump length in early pregnancy and corrected if the discrepancy is 7 days or more. | |
3.2.2 Fetometry
| Consensus-based Recommendation 3.E4 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| Further diagnostic investigations must be carried out if the estimated fetal weight is less than the 10th percentile. | |
In addition to estimated fetal weight, fetal abdominal circumference is the most important indicator of IUGR. Fetal head-to-abdomen discrepancy can also be an indication of IUGR. Assessment of estimated fetal weight should also take maternal and paternal characteristics into account 37 , 38 , 39 , 40 . If the estimated fetal weight is below the 10th percentile, further diagnostic investigations must be carried out (including precise sonographic diagnostics, Doppler sonography).
3.2.3 Amniotic fluid
3.2.4 Precise sonographic diagnostics (additional procedures for the differential diagnosis of different organs)
3.3 Doppler sonography
| Consensus-based Recommendation 3.E7 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 48 | |
| Doppler sonography must be carried out to investigate for possible IUGR. | |
3.4 Cardiotocography (CTG)
Cardiotocography (CTG) is known to have a high false-positive rate for the prediction of poor outcomes and is more likely to detect acute hypoxic events than chronic conditions 49 . Its value for detecting possible IUGR is therefore only limited; nevertheless, according to the German Maternity Guidelines, CTG should be carried out as part of antenatal care if there is a suspicion of placental insufficiency 48 .
4 Differential diagnosis of a SGA/IUGR fetus
4.1 Chromosomal anomalies
4.2 Infections
| Consensus-based Recommendation 4.E9 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 53 | |
| Examination for possible infections should be considered when an SGA/IUGR fetus is identified. | |
5 Management of IUGR
There is still very little evidence about the best antenatal method to monitor a fetus with IUGR 54 . No single monitoring method provides a valid prediction for the outcome of IUGR, which is why a combination of different procedures to monitor growth-retarded fetuses is recommended.
5.1 Diagnostic monitoring
5.1.1 Clinical examination
| Consensus-based Recommendation 5.E10 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| Monitoring should be carried out to detect early signs of pre-eclampsia when IUGR is caused by uteroplacental insufficiency. | |
5.1.2 Sonography (fetometry)
| Consensus-based Recommendation 5.E11 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 55 | |
| Serial sonographic monitoring of fetal growth must be carried out when IUGR has been identified or there is a suspicion of IUGR. | |
| Consensus-based Recommendation 5.E12 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| The interval between individual sonography scans to monitor fetal growth should be at least two weeks. | |
5.1.3 Sonography (amniotic fluid)
| Consensus-based Recommendation 5.E13 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| Sonographic assessment of amniotic fluid volume must only be interpreted in the context of and together with other monitoring methods. | |
5.1.4 Doppler sonography (umbilical artery)
| Consensus-based Recommendation 5.E16 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| The intervals between control Doppler scans should always depend on the severity of IUGR and on previous Doppler findings. | |
| Consensus-based Recommendation 5.E17 | |
|---|---|
| Expert consensus | Level of consensus +++ |
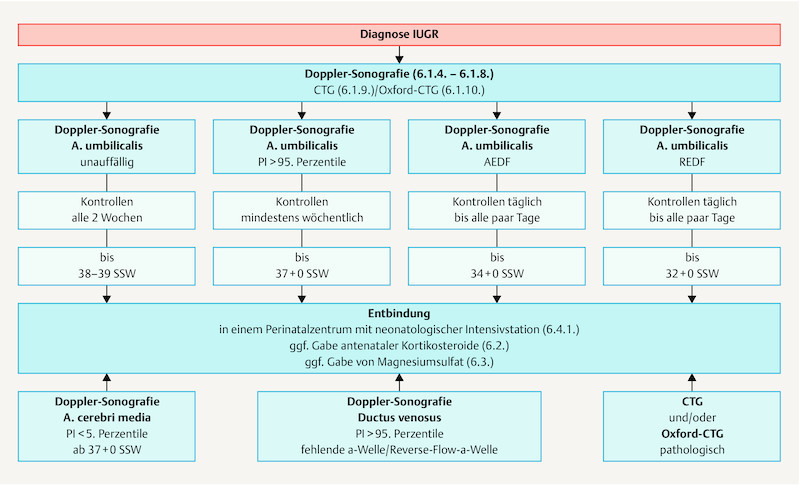
| It is not clear how long the intervals between control Doppler scans should be if the findings of the umbilical artery are pathological. If pulsatility is increased (PI > 95th percentile) controls should be carried out at least once a week; in cases of ARED flow, monitoring must be carried out at even more frequent intervals. | |
| Consensus-based Recommendation 5.E18 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| If Doppler sonography of the umbilical artery shows abnormalities, additional Doppler scans of other vessels (middle cerebral artery, ductus venosus) should be carried out. | |
5.1.5 Doppler sonography (middle cerebral artery)
5.1.6 Doppler sonography (cerebroplacental ratio, CPR)
| Consensus-based Statement 5.S7 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 70 , 71 , 76 , 77 , 78 , 79 , 80 | |
| The cerebroplacental ratio (CPR), which is calculated by dividing the PI of the middle cerebral artery by the PI of the umbilical artery, can be useful to monitor IUGR as a low CPR is a predictor for poor perinatal outcome. | |
5.1.7 Doppler sonography (ductus venosus)
5.1.8 Doppler sonography (other vessels)
The predictive value of Doppler sonography of the uterine arteries in the last third of pregnancy is unclear as no evidence-based data are available. Doppler sonography of other arterial (e.g. the fetal aorta) and venous (e.g. umbilical vein, inferior vena cava) vessels is currently only recommended if it is carried out as part of a study, as the evidence for its usefulness is still insufficient.
5.1.9 Cardiotocography (CTG)
5.1.10 Computerized CTG (Dawes-Redman CTG analysis)
5.1.11 Biophysical profile
5.2 Antenatal corticosteroids (RDS prophylaxis)
| Consensus-based Recommendation 5.E23 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 104 | |
| Antenatal corticosteroids should be administered once between GW 24 + 0 and GW 34 + 0 if it is expected that the infant will be delivered within the next 7 days. | |
5.3 Magnesium sulfate for fetal neuroprotection
| Consensus-based Recommendation 5.E24 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 105 , 106 , 107 , 108 , 109 , 110 , 111 , 112 , 113 , 114 , 115 | |
| Magnesium sulfate for fetal neuroprotection may be administered if preterm birth (GW < 32 + 0) is expected, as there are indications that it has a neuroprotective effect. | |
5.4 Delivery
5.4.1 Place of delivery
5.4.2 Time of delivery
| Consensus-based Recommendation 5.E26 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 62 | |
| Early IUGR and late IUGR must be assessed differently. Increasing deterioration in a fetus with early IUGR is reflected in abnormalities of venous Doppler parameters, while increasing deterioration in a fetus with late IUGR is primarily visible in abnormal cerebral Doppler findings. | |
| Consensus-based Recommendation 5.E27 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 118 | |
| When planning the time of delivery, the risks associated with preterm birth must be weighed up against the risks of remaining in the womb. | |
| Consensus-based Recommendation 5.E28 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 100 | |
| If CTG pathologies such as recurrent decelerations resistant to treatment occur, delivery of the infant must be considered at all times. | |
| Consensus-based Recommendation 5.E29 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 100 | |
| Delivery of the infant must be considered if short-term variation (STV) < 2.6 ms occurs between GW 26 + 0 and GW 28 + 6 or a STV < 3 ms occurs between GW 29 + 0 and GW 32 + 0. | |
| Consensus-based Recommendation 5.E32 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| If Doppler sonography of the umbilical artery reveals reversed end-diastolic flow (REDF), the infant should be delivered by GW 32 + 0 at the latest. | |
| Consensus-based Recommendation 5.E33 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| If Doppler sonography of the umbilical artery reveals absent end-diastolic flow (AEDF), the infant should be delivered by GW 34 + 0 at the latest. | |
| Consensus-based Recommendation 5.E34 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 123 | |
| If Doppler sonography of the umbilical artery reveals increased pulsatility (PI > 95th percentile), the aim should be to deliver the infant from GW 37 + 0. | |
| Consensus-based Recommendation 5.E35 | |
|---|---|
| Expert consensus | Level of consensus ++ |
| If Doppler sonography of the middle cerebral artery reveals decreased pulsatility (PI < 5th percentile), delivery of the infant by GW 37 + 0 at the latest should be considered. | |
| Consensus-based Recommendation 5.E38 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| In the case of an isolated SGA (normal Doppler results, no additional risks), the due date must not be exceeded. | |
5.4.3 Type of delivery
| Consensus-based Recommendation 5.E39 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| Not every pregnant woman with IUGR must be delivered by C-section. | |
| Consensus-based Recommendation 5.E40 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 127 , 128 , 129 , 130 , 131 , 132 , 133 | |
| In the case of IUGR with normal Doppler results or increased pulsatility in the umbilical artery (> 95th percentile), labor may be induced with the goal of vaginal delivery but not if ARED flow is present. However the higher risk of complications must be taken into account and continuous intrapartum monitoring is required. | |
5.4.4 Additional recommendations
Outpatient or inpatient monitoring and care
| Consensus-based Recommendation 5.E41 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| The decision for either outpatient or inpatient monitoring and care of the pregnant woman with IUGR must be taken on an individual basis. | |
Bed rest
There is very little evidence-based data on hospitalization with bed rest when there is a suspicion of fetal growth restriction, and the data have not shown any benefit 134 .
Diet
Changes in diet, dietary measures or additional intake of food supplements (e.g. calcium 135 ) have not shown any benefit 136 and are therefore not recommended.
Cessation of nicotine use
| Consensus-based Recommendation 5.E42 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 137 | |
| Cessation of nicotine use must be recommended to all pregnant women. | |
Progesterone
Progesterone has shown no benefit in reducing IUGR 138 and should therefore not be administered for that purpose.
Maternal oxygen administration
The studies on the benefits of maternal oxygen administration are insufficient and some have methodological flaws. These studies were evaluated in an older Cochrane analysis which drew the conclusion that the existing evidence is insufficient to assess the benefits and risk of maternal oxygen administration 139 ; maternal oxygen should therefore not be administered.
Other interventions
Numerous interventions which aim to improve blood flow to the placenta have been studied 140 . But neither the increase in plasma volume 141 nor the administration of low-dose ASA 142 or sildenafil 143 , 144 showed any benefit, and they are therefore not recommended.
Antihypertensive therapy of pregnant women with hypertensive disease does not improve fetal growth 145 , 146 and should not be recommended and neither should the administration of NO donors or vasodilator substances as they have not been sufficiently investigated yet 147 .
6 Information and counseling
The pregnant woman or parents-to-be should receive detailed information and extensive counseling sessions about IUGR as a complication of pregnancy and the individual course and consequences of IUGR. The mother/parents-to-be should also be told that the infant could be constitutionally small, which does not inevitably lead to increased perinatal morbidity. These talks should be given by an interdisciplinary team which includes a specialist for prenatal medicine/obstetrician and neonatologist. Depending on the fetal clinical picture, additional pediatric specialists or specialists for human genetics should also be consulted. In addition to information about the possible causes, information should also be provided about the short-term and long-term consequences, the risk of recurrence and, depending on the case, the possible diagnostic investigations.
The individual medical, psychological and social questions of the pregnant woman or the parents-to-be about the diagnosis must then be discussed during a comprehensive medical consultation. All necessary decisions should be taken as part of a joint decision-making process. The most important results of the information and counseling sessions should be documented transparently (see also the S2k-guideline “Preterm infants born at the limits of viability”, currently only available in German: “Frühgeborene an der Grenze der Lebensfähigkeit” (196)).
Additional psychological or pastoral care, ideally initiated before the birth, can be an important aspect for parents-to-be 148 .
7 Prophylaxis
Particularly after a previous IUGR pregnancy, the aim must be to prevent a recurrence of IUGR. Numerous approaches have been used in the past, but only a few of them offer an evidence-based benefit.
Acetylsalicylic acid (ASA)
Antihypertensive therapy
Antihypertensive therapy of mild to moderate hypertension during pregnancy does not appear to increase the risk of SGA fetus (RR: 1.02; 95% CI: 0.89 – 1.16) 145 . However, the use of beta-blockers in antihypertensive therapy is associated with growth restriction (RR: 1.36, 95% CI: 1.02 – 1.82) 152 and should therefore be avoided if possible.
Bed rest
There is no evidence that prophylactic (outpatient or inpatient) bed rest can prevent IUGR 134 .
Diet
Heparin
| Consensus-based Statement 7.S11 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 159 , 160 , 161 | |
| The administration of low-molecular-weight heparin appears to be a promising prophylactic approach in IUGR. Nevertheless, the currently available evidence is not sufficient for it to be recommended, particularly as there is insufficient evidence concerning possible severe side-effects. | |
Nicotine
8 Screening
Antenatal detection of IUGR is vitally important, as early detection significantly influences both the course of pregnancy and the neonatal outcome 29 , 164 , 165 .
Medical history
A careful investigation of the patientʼs medical history, particularly with regard to potential risk factors for IUGR (see Chapter 2. Epidemiology and Etiology), is essential as close monitoring can be initiated if there is an increased risk of IUGR 166 .
Clinical examination
(Cf. Chapter 3.1. Clinical examination)
Sonography
The basic prerequisite for effective screening is accurate data collection (Chapter 3.2.1. Crown-rump length).
In addition, it is suggested that, similar to pre-eclampsia screening in the 1st trimester of pregnancy, an attempt could be made to screen for SGA/IUGR using a combination of different markers (maternal medical history, Doppler sonography of the uterine arteries, middle arterial pressure, NT and the maternal serum markers PAPP-A, free β-hCG, PlGF, PP13, and ADAM 12). General screening is not currently recommended yet.
Doppler sonography
| Consensus-based recommendation 8 .E46 | |
|---|---|
| Expert consensus | Level of consensus +++ |
| References: 167 , 168 | |
| Abnormal Doppler results for the uterine arteries in the form of increased pulsatility (PI > 95th percentile) should be a signal to start regular sonographic monitoring of fetal growth and Doppler sonography of the umbilical artery. | |
9 Appendix
Fig. 1.
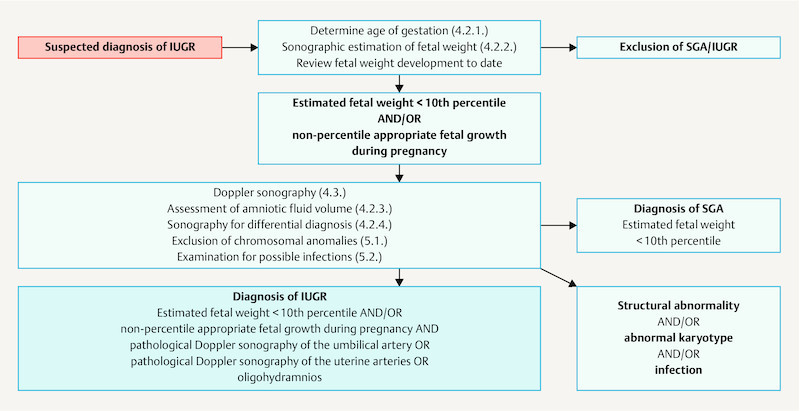
Algorithm for the diagnosis of IUGR.
Fig. 2.
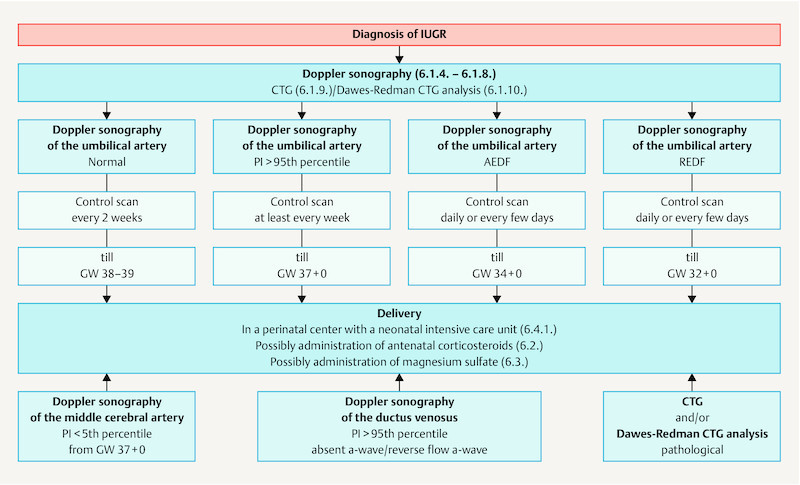
Algorithm for the management of IUGR.
Citation format.
Intrauterine Growth Restriction. Guideline of the German Society of Gynecology and Obstetrics (S2k-Level, AWMF Registry Number 015/080, October 2016). Geburtsh Frauenheilk 2017; 77: 1157–1173
Guideline Program. Editors.
Leading Professional Medical Associations



German Society of Gynecology and Obstetrics (Deutsche Gesellschaft für Gynäkologie und Geburtshilfe e. V. [DGGG]) Head Office of DGGG and Professional Societies Hausvogteiplatz 12 DE-10117 Berlin info@dggg.de http://www.dggg.de/
President of DGGG Prof. Dr. Birgit Seelbach-Göbel Universität Regensburg Klinik für Geburtshilfe und Frauenheilkunde St. Hedwig-Krankenhaus Barmherzige Brüder Steinmetzstraße 1–3 DE-93049 Regensburg
DGGG Guidelines Representative Prof. Dr. med. Matthias W. Beckmann Universitätsklinikum Erlangen Frauenklinik Universitätsstraße 21–23 DE-91054 Erlangen
Guidelines Coordination Dr. med. Paul Gaß, Tobias Brodkorb, Marion Gebhardt Universitätsklinikum Erlangen Frauenklinik Universitätsstraße 21–23 DE-91054 Erlangen fk-dggg-leitlinien@uk-erlangen.de http://www.dggg.de/leitlinienstellungnahmen
Austrian Society of Gynecology and Obstetrics (Österreichische Gesellschaft für Gynäkologie und Geburtshilfe [OEGGG]) Innrain 66A AT-6020 Innsbruck stephanie.leutgeb@oeggg.at http://www.oeggg.at
President of OEGGG Prof. Dr. med. Petra Kohlberger Universitätsklinik für Frauenheilkunde Wien Währinger Gürtel 18–20 AT-1180 Wien
OEGGG Guidelines Representative Prof. Dr. med. Karl Tamussino Universitätsklinik für Frauenheilkunde und Geburtshilfe Graz Auenbruggerplatz 14 AT-8036 Graz
Swiss Society of Gynecology and Obstetrics (Schweizerische Gesellschaft für Gynäkologie und Geburtshilfe [SGGG]) Gynécologie Suisse SGGG Altenbergstraße 29 Postfach 6 CH-3000 Bern 8 sekretariat@sggg.ch http://www.sggg.ch/
President of SGGG Dr. med. David Ehm FMH für Geburtshilfe und Gynäkologie Nägeligasse 13 CH-3011 Bern
SGGG Guidelines Representative Prof. Dr. med. Daniel Surbek Universitätsklinik für Frauenheilkunde Geburtshilfe und feto-maternale Medizin Inselspital Bern Effingerstraße 102 CH-3010 Bern
10 References/Literatur
- 1.Unterscheider J, Daly S, Geary M P. Definition and management of fetal growth restriction: a survey of contemporary attitudes. Eur J Obstet Gynecol Reprod Biol. 2014;174:41–45. doi: 10.1016/j.ejogrb.2013.11.022. [DOI] [PubMed] [Google Scholar]
- 2.Alberry M, Soothill P. Management of fetal growth restriction. Arch Dis Child Fetal Neonatal Ed. 2007;92:F62–F67. doi: 10.1136/adc.2005.082297. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Lees C, Marlow N, Arabin B. Perinatal morbidity and mortality in early-onset fetal growth restriction: cohort outcomes of the trial of randomized umbilical and fetal flow in Europe (TRUFFLE) Ultrasound Obstet Gynecol. 2013;42:400–408. doi: 10.1002/uog.13190. [DOI] [PubMed] [Google Scholar]
- 4.Unterscheider J, Daly S, Geary M P. Optimizing the definition of intrauterine growth restriction: the multicenter prospective PORTO Study. Am J Obstet Gynecol. 2013;208:2900–2.9E8. doi: 10.1016/j.ajog.2013.02.007. [DOI] [PubMed] [Google Scholar]
- 5.Albu A R, Anca A F, Horhoianu V V. Predictive factors for intrauterine growth restriction. J Med Life. 2014;7:165–171. [PMC free article] [PubMed] [Google Scholar]
- 6.Parker S E, Werler M M. Epidemiology of ischemic placental disease: a focus on preterm gestations. Semin Perinatol. 2014;38:133–138. doi: 10.1053/j.semperi.2014.03.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Berlit S, Nickol J, Weiss C. Zervixdilatation und Kürettage während eines primären Kaiserschnitts – eine retrospektive Analyse. Z Geburtshilfe Neonatol. 2013 doi: 10.1055/s-0033-1361316. [DOI] [Google Scholar]
- 8.Jaddoe V W, Bakker R, Hofman A. Moderate alcohol consumption during pregnancy and the risk of low birth weight and preterm birth. The generation R study. Ann Epidemiol. 2007;17:834–840. doi: 10.1016/j.annepidem.2007.04.001. [DOI] [PubMed] [Google Scholar]
- 9.Ananth C V, Peltier M R, Chavez M R. Recurrence of ischemic placental disease. Obstet Gynecol. 2007;110:128–133. doi: 10.1097/01.AOG.0000266983.77458.71. [DOI] [PubMed] [Google Scholar]
- 10.Gouin K, Murphy K, Shah P S. Effects of cocaine use during pregnancy on low birthweight and preterm birth: systematic review and metaanalyses. Am J Obstet Gynecol. 2011;204:3400–3.4E14. doi: 10.1016/j.ajog.2010.11.013. [DOI] [PubMed] [Google Scholar]
- 11.Kramer M S, Platt R, Yang H. Are all growth-restricted newborns created equal(ly)? Pediatrics. 1999;103:599–602. doi: 10.1542/peds.103.3.599. [DOI] [PubMed] [Google Scholar]
- 12.Maulik D. Fetal growth restriction: the etiology. Clin Obstet Gynecol. 2006;49:228–235. doi: 10.1097/00003081-200606000-00006. [DOI] [PubMed] [Google Scholar]
- 13.Odibo A O, Nelson D, Stamilio D M. Advanced maternal age is an independent risk factor for intrauterine growth restriction. Am J Perinatol. 2006;23:325–328. doi: 10.1055/s-2006-947164. [DOI] [PubMed] [Google Scholar]
- 14.Gardosi J, Francis A. Adverse pregnancy outcome and association with small for gestational age birthweight by customized and population-based percentiles. Am J Obstet Gynecol. 2009;201:280–2.8E9. doi: 10.1016/j.ajog.2009.04.034. [DOI] [PubMed] [Google Scholar]
- 15.Kleijer M E, Dekker G A, Heard A R. Risk factors for intrauterine growth restriction in a socio-economically disadvantaged region. J Matern Fetal Neonatal Med. 2005;18:23–30. doi: 10.1080/14767050500127674. [DOI] [PubMed] [Google Scholar]
- 16.Blumenshine P, Egerter S, Barclay C J. Socioeconomic disparities in adverse birth outcomes: a systematic review. Am J Prev Med. 2010;39:263–272. doi: 10.1016/j.amepre.2010.05.012. [DOI] [PubMed] [Google Scholar]
- 17.Knowledge Synthesis Group on Determinants of LBW/PT births . Shah P S. Parity and low birth weight and preterm birth: a systematic review and meta-analyses. Acta Obstet Gynecol Scand. 2010;89:862–875. doi: 10.3109/00016349.2010.486827. [DOI] [PubMed] [Google Scholar]
- 18.Allen V M, Joseph K, Murphy K E. The effect of hypertensive disorders in pregnancy on small for gestational age and stillbirth: a population based study. BMC Pregnancy Childbirth. 2004;4:17. doi: 10.1186/1471-2393-4-17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Fink J C, Schwartz S M, Benedetti T J. Increased risk of adverse maternal and infant outcomes among women with renal disease. Paediatr Perinat Epidemiol. 1998;12:277–287. doi: 10.1046/j.1365-3016.1998.00129.x. [DOI] [PubMed] [Google Scholar]
- 20.Howarth C, Gazis A, James D. Associations of Type 1 diabetes mellitus, maternal vascular disease and complications of pregnancy. Diabet Med. 2007;24:1229–1234. doi: 10.1111/j.1464-5491.2007.02254.x. [DOI] [PubMed] [Google Scholar]
- 21.Drenthen W, Pieper P G, Roos-Hesselink J W. Outcome of pregnancy in women with congenital heart disease: a literature review. J Am Coll Cardiol. 2007;49:2303–2311. doi: 10.1016/j.jacc.2007.03.027. [DOI] [PubMed] [Google Scholar]
- 22.Yasuda M, Takakuwa K, Tokunaga A. Prospective studies of the association between anticardiolipin antibody and outcome of pregnancy. Obstet Gynecol. 1995;86:555–559. doi: 10.1016/0029-7844(95)00247-o. [DOI] [PubMed] [Google Scholar]
- 23.Costa S L, Proctor L, Dodd J M. Screening for placental insufficiency in high-risk pregnancies: is earlier better? Placenta. 2008;29:1034–1040. doi: 10.1016/j.placenta.2008.09.004. [DOI] [PubMed] [Google Scholar]
- 24.Laurini R, Laurin J, Marsal K. Placental histology and fetal blood flow in intrauterine growth retardation. Acta Obstet Gynecol Scand. 1994;73:529–534. doi: 10.3109/00016349409006268. [DOI] [PubMed] [Google Scholar]
- 25.Salafia C M, Minior V K, Pezzullo J C. Intrauterine growth restriction in infants of less than thirty-two weeksʼ gestation: associated placental pathologic features. Am J Obstet Gynecology. 1995;173:1049–1057. doi: 10.1016/0002-9378(95)91325-4. [DOI] [PubMed] [Google Scholar]
- 26.Eydoux P, Choiset A, Le Porrier N. Chromosomal prenatal diagnosis: study of 936 cases of intrauterine abnormalities after ultrasound assessment. Prenat Diagn. 1989;9:255–269. doi: 10.1002/pd.1970090405. [DOI] [PubMed] [Google Scholar]
- 27.Khoury M J, Erickson J D, Cordero J F. Congenital malformations and intrauterine growth retardation: a population study. Pediatrics. 1988;82:83–90. [PubMed] [Google Scholar]
- 28.Powers W F, Kiely J L. The risks confronting twins: a national perspective. Am J Obstet Gynecol. 1994;170:456–461. doi: 10.1016/s0002-9378(94)70211-x. [DOI] [PubMed] [Google Scholar]
- 29.Chauhan S P, Beydoun H, Chang E. Prenatal detection of fetal growth restriction in newborns classified as small for gestational age: correlates and risk of neonatal morbidity. Am J Perinatol. 2014;31:187–194. doi: 10.1055/s-0033-1343771. [DOI] [PubMed] [Google Scholar]
- 30.Gardosi J, Madurasinghe V, Williams M. Maternal and fetal risk factors for stillbirth: population based study. BMJ. 2013;346:f108. doi: 10.1136/bmj.f108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Goetzinger K R, Tuuli M G, Odibo A O. Screening for fetal growth disorders by clinical exam in the era of obesity. J Perinatol. 2013;33:352–357. doi: 10.1038/jp.2012.130. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Mongelli M, Wilcox M, Gardosi J. Estimating the date of confinement: ultrasonographic biometry versus certain menstrual dates. Am J Obstet Gynecol. 1996;174:278–281. doi: 10.1016/s0002-9378(96)70408-8. [DOI] [PubMed] [Google Scholar]
- 33.Whitworth M, Bricker L, Mullan C. Ultrasound for fetal assessment in early pregnancy. Cochrane Database Syst Rev. 2015;(07):CD007058. doi: 10.1002/14651858.CD007058.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Wisser J, Dirschedl P, Krone S. Estimation of gestational age by transvaginal sonographic measurement of greatest embryonic length in dated human embryos. Ultrasound Obstet Gynecol. 1994;4:457–462. doi: 10.1046/j.1469-0705.1994.04060457.x. [DOI] [PubMed] [Google Scholar]
- 35.Committee opinion no 611: method for estimating due date. Obstet Gynecol. 2014;124:863–866. doi: 10.1097/01.AOG.0000454932.15177.be. [DOI] [PubMed] [Google Scholar]
- 36.Standards zur Ultraschalluntersuchung in der Frühschwangerschaft. Leitlinie der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (S1-Level, AWMF-Register Nr. 015/032, August 2010)Online:http://www.dggg.de/leitlinienstellungnahmen/archivierte-leitlinien/federfuehrende-leitlinien-der-dggg/?eID=dam_frontend_push&docID=2068last access: 20.07.2016
- 37.Gardosi J, Chang A, Kalyan B. Customised antenatal growth charts. Lancet. 1992;339:283–287. doi: 10.1016/0140-6736(92)91342-6. [DOI] [PubMed] [Google Scholar]
- 38.Unterscheider J, Geary M P, Daly S. The customized fetal growth potential: a standard for Ireland. Eur J Obstet Gynecol Reprod Biol. 2013;166:14–17. doi: 10.1016/j.ejogrb.2012.09.007. [DOI] [PubMed] [Google Scholar]
- 39.Figueras F, Figueras J, Meler E. Customised birthweight standards accurately predict perinatal morbidity. Arch Dis Child Fetal Neonatal Ed. 2007;92:F277–F280. doi: 10.1136/adc.2006.108621. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Groom K M, Poppe K K, North R A. Small-for-gestational-age infants classified by customized or population birthweight centiles: impact of gestational age at delivery. Am J Obstet Gynecol. 2007;197:2390–2.39E7. doi: 10.1016/j.ajog.2007.06.038. [DOI] [PubMed] [Google Scholar]
- 41.Chauhan S P, Magann E F, Dohrety D A. Prediction of small for gestational age newborns using ultrasound estimated and actual amniotic fluid volume: published data revisited. Aust N Z J Obstet Gynaecol. 2008;48:160–164. doi: 10.1111/j.1479-828X.2008.00830.x. [DOI] [PubMed] [Google Scholar]
- 42.Owen P, Khan K S, Howie P. Single and serial estimates of amniotic fluid volume and umbilical artery resistance in the prediction of intrauterine growth restriction. Ultrasound Obstet Gynecol. 1999;13:415–419. doi: 10.1046/j.1469-0705.1999.13060415.x. [DOI] [PubMed] [Google Scholar]
- 43.Patterson R M, Prihoda T J, Pouliot M R. Sonographic amniotic fluid measurement and fetal growth retardation: a reappraisal. Am J Obstet Gynecol. 1987;157:1406–1410. doi: 10.1016/s0002-9378(87)80233-8. [DOI] [PubMed] [Google Scholar]
- 44.Niknafs P, Sibbald J. Accuracy of single ultrasound parameters in detection of fetal growth restriction. Am J Perinatol. 2001;18:325–334. doi: 10.1055/s-2001-17856. [DOI] [PubMed] [Google Scholar]
- 45.Snijders R J, Sherrod C, Gosden C M. Fetal growth retardation: associated malformations and chromosomal abnormalities. Am J Obstet Gynecol. 1993;168:547–555. doi: 10.1016/0002-9378(93)90491-z. [DOI] [PubMed] [Google Scholar]
- 46.Wallenstein M B, Harper L M, Odibo A O. Fetal congenital heart disease and intrauterine growth restriction: a retrospective cohort study. J Matern Fetal Neonatal Med. 2012;25:662–665. doi: 10.3109/14767058.2011.597900. [DOI] [PubMed] [Google Scholar]
- 47.Raynor B D, Richards D. Growth retardation in fetuses with gastroschisis. J Ultrasound Med. 1997;16:13–16. doi: 10.7863/jum.1997.16.1.13. [DOI] [PubMed] [Google Scholar]
- 48.Kehl S, Schmidt U, Spaich S. Where are the limits of accuracy for fetal weight estimation with two-dimensional parameters? Ultrasound Obstet Gynecol. 2011;38:151. doi: 10.1002/uog.10094. [DOI] [PubMed] [Google Scholar]
- 49.Evertson L R, Gauthier R J, Schifrin B S. Antepartum fetal heart rate testing. I. Evolution of the nonstress test. Am J Obstet Gynecol. 1979;133:29–33. doi: 10.1016/0002-9378(79)90406-x. [DOI] [PubMed] [Google Scholar]
- 50.Bahado-Singh R O, Lynch L, Deren O. First-trimester growth restriction and fetal aneuploidy: the effect of type of aneuploidy and gestational age. Am J Obstet Gynecol. 1997;176:976–980. doi: 10.1016/s0002-9378(97)70388-0. [DOI] [PubMed] [Google Scholar]
- 51.Anandakumar C, Chew S, Wong Y C. Early asymmetric IUGR and aneuploidy. J Obstet Gynaecol Res. 1996;22:365–370. doi: 10.1111/j.1447-0756.1996.tb00990.x. [DOI] [PubMed] [Google Scholar]
- 52.Wilkins-Haug L, Roberts D J, Morton C C. Confined placental mosaicism and intrauterine growth retardation: a case-control analysis of placentas at delivery. Am J Obstet Gynecol. 1995;172:44–50. doi: 10.1016/0002-9378(95)90082-9. [DOI] [PubMed] [Google Scholar]
- 53.Hendrix N, Berghella V. Non-placental causes of intrauterine growth restriction. Semin Perinatol. 2008;32:161–165. doi: 10.1053/j.semperi.2008.02.004. [DOI] [PubMed] [Google Scholar]
- 54.Grivell R M, Wong L, Bhatia V. Regimens of fetal surveillance for impaired fetal growth. Cochrane Database Syst Rev. 2012;(06):CD007113. doi: 10.1002/14651858.CD007113.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Mongelli M, Ek S, Tambyrajia R. Screening for fetal growth restriction: a mathematical model of the effect of time interval and ultrasound error. Obstet Gynecol. 1998;92:908–912. doi: 10.1016/s0029-7844(98)00349-4. [DOI] [PubMed] [Google Scholar]
- 56.Nabhan A F, Abdelmoula Y A.Amniotic fluid index versus single deepest vertical pocket as a screening test for preventing adverse pregnancy outcome Cochrane Database Syst Rev 200803CD006593 10.1002/14651858.CD006593.pub2 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Nabhan A F, Abdelmoula Y A. Amniotic fluid index versus single deepest vertical pocket: a meta-analysis of randomized controlled trials. Int J Gynaecol Obstet. 2009;104:184–188. doi: 10.1016/j.ijgo.2008.10.018. [DOI] [PubMed] [Google Scholar]
- 58.Kehl S, Schelkle A, Thomas A. Single deepest vertical pocket or amniotic fluid index as evaluation test for predicting adverse pregnancy outcome (SAFE trial): a multicenter, open-label, randomized controlled trial. Ultrasound Obstet Gynecol. 2016;47:674–679. doi: 10.1002/uog.14924. [DOI] [PubMed] [Google Scholar]
- 59.Alfirevic Z, Stampalija T, Gyte G M. Fetal and umbilical Doppler ultrasound in high-risk pregnancies. Cochrane Database Syst Rev. 2013;(11):CD007529. doi: 10.1002/14651858.CD007529.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Society for Maternal-Fetal Medicine Publications Committee . Berkley E, Chauhan S P, Abuhamad A. Doppler assessment of the fetus with intrauterine growth restriction. Am J Obstet Gynecol. 2012;206:300–308. doi: 10.1016/j.ajog.2012.01.022. [DOI] [PubMed] [Google Scholar]
- 61.OʼDwyer V, Burke G, Unterscheider J. Defining the residual risk of adverse perinatal outcome in growth-restricted fetuses with normal umbilical artery blood flow. Am J Obstet Gynecol. 2014;211:4200–4.2E7. doi: 10.1016/j.ajog.2014.07.033. [DOI] [PubMed] [Google Scholar]
- 62.Baschat A A. Fetal growth restriction – from observation to intervention. J Perinat Med. 2010;38:239–246. doi: 10.1515/jpm.2010.041. [DOI] [PubMed] [Google Scholar]
- 63.Nicolaides K H, Bilardo C M, Soothill P W. Absence of end diastolic frequencies in umbilical artery – a sign of fetal hypoxia and acidosis. Brit Med J. 1988;297:1026–1027. doi: 10.1136/bmj.297.6655.1026. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Kingdom J C, Burrell S J, Kaufmann P. Pathology and clinical implications of abnormal umbilical artery Doppler waveforms. Ultrasound Obstet Gynecol. 1997;9:271–286. doi: 10.1046/j.1469-0705.1997.09040271.x. [DOI] [PubMed] [Google Scholar]
- 65.Brodszki J, Morsing E, Malcus P. Early intervention in management of very preterm growth-restricted fetuses: 2-year outcome of infants delivered on fetal indication before 30 gestational weeks. Ultrasound Obstet Gynecol. 2009;34:288–296. doi: 10.1002/uog.7321. [DOI] [PubMed] [Google Scholar]
- 66.Hartung J, Kalache K D, Heyna C. Outcome of 60 neonates who had ARED flow prenatally compared with a matched control group of appropriate-for-gestational age preterm neonates. Ultrasound Obstet Gynecol. 2005;25:566–572. doi: 10.1002/uog.1906. [DOI] [PubMed] [Google Scholar]
- 67.Vasconcelos R P, Brazil Frota Aragao J R, Costa Carvalho F H. Differences in neonatal outcome in fetuses with absent versus reverse end-diastolic flow in umbilical artery Doppler. Fetal Diagn Ther. 2010;28:160–166. doi: 10.1159/000319800. [DOI] [PubMed] [Google Scholar]
- 68.Nienhuis S J, Vles J S, Gerver W J. Doppler ultrasonography in suspected intrauterine growth retardation: a randomized clinical trial. Ultrasound Obstet Gynecol. 1997;9:6–13. doi: 10.1046/j.1469-0705.1997.09010006.x. [DOI] [PubMed] [Google Scholar]
- 69.McCowan L M, Harding J E, Roberts A B. A pilot randomized controlled trial of two regimens of fetal surveillance for small-for-gestational-age fetuses with normal results of umbilical artery doppler velocimetry. Am J Obstet Gynecol. 2000;182:81–86. doi: 10.1016/s0002-9378(00)70494-7. [DOI] [PubMed] [Google Scholar]
- 70.Dubiel M, Gudmundsson S, Gunnarsson G. Middle cerebral artery velocimetry as a predictor of hypoxemia in fetuses with increased resistance to blood flow in the umbilical artery. Early Hum Dev. 1997;47:177–184. doi: 10.1016/s0378-3782(96)01777-x. [DOI] [PubMed] [Google Scholar]
- 71.Morris R K, Say R, Robson S C. Systematic review and meta-analysis of middle cerebral artery Doppler to predict perinatal wellbeing. Eur J Obstet Gynecol Reprod Biol. 2012;165:141–155. doi: 10.1016/j.ejogrb.2012.07.027. [DOI] [PubMed] [Google Scholar]
- 72.Baschat A A, Cosmi E, Bilardo C M. Predictors of neonatal outcome in early-onset placental dysfunction. Obstet Gynecol. 2007;109:253–261. doi: 10.1097/01.AOG.0000253215.79121.75. [DOI] [PubMed] [Google Scholar]
- 73.Severi F M, Bocchi C, Visentin A. Uterine and fetal cerebral Doppler predict the outcome of third-trimester small-for-gestational age fetuses with normal umbilical artery Doppler. Ultrasound Obstet Gynecol. 2002;19:225–228. doi: 10.1046/j.1469-0705.2002.00652.x. [DOI] [PubMed] [Google Scholar]
- 74.Hershkovitz R, Kingdom J C, Geary M. Fetal cerebral blood flow redistribution in late gestation: identification of compromise in small fetuses with normal umbilical artery Doppler. Ultrasound Obstet Gynecol. 2000;15:209–212. doi: 10.1046/j.1469-0705.2000.00079.x. [DOI] [PubMed] [Google Scholar]
- 75.Cruz-Martinez R, Figueras F, Hernandez-Andrade E. Fetal brain Doppler to predict cesarean delivery for nonreassuring fetal status in term small-for-gestational-age fetuses. Obstet Gynecol. 2011;117:618–626. doi: 10.1097/AOG.0b013e31820b0884. [DOI] [PubMed] [Google Scholar]
- 76.Rizzo G, Capponi A, Arduini D. The value of fetal arterial, cardiac and venous flows in predicting pH and blood gases measured in umbilical blood at cordocentesis in growth retarded fetuses. Br J Obstet Gynaecol. 1995;102:963–969. doi: 10.1111/j.1471-0528.1995.tb10903.x. [DOI] [PubMed] [Google Scholar]
- 77.Morales-Rosello J, Khalil A. Fetal cerebral redistribution: a marker of compromise regardless of fetal size. Ultrasound Obstet Gynecol. 2015;46:385–388. doi: 10.1002/uog.15664. [DOI] [PubMed] [Google Scholar]
- 78.Flood K, Unterscheider J, Daly S. The role of brain sparing in the prediction of adverse outcomes in intrauterine growth restriction: results of the multicenter PORTO Study. Am J Obstet Gynecol. 2014;211:2880–2.88E7. doi: 10.1016/j.ajog.2014.05.008. [DOI] [PubMed] [Google Scholar]
- 79.Khalil A A, Morales-Rosello J, Elsaddig M. The association between fetal Doppler and admission to neonatal unit at term. Am J Obstet Gynecol. 2015;213:570–5.7E8. doi: 10.1016/j.ajog.2014.10.013. [DOI] [PubMed] [Google Scholar]
- 80.Khalil A A, Morales-Rosello J, Morlando M. Is fetal cerebroplacental ratio an independent predictor of intrapartum fetal compromise and neonatal unit admission? Am J Obstet Gynecol. 2015;213:540–5.4E11. doi: 10.1016/j.ajog.2014.10.024. [DOI] [PubMed] [Google Scholar]
- 81.Baschat A A, Gembruch U, Weiner C P. Qualitative venous Doppler waveform analysis improves prediction of critical perinatal outcomes in premature growth-restricted fetuses. Ultrasound Obstet Gynecol. 2003;22:240–245. doi: 10.1002/uog.149. [DOI] [PubMed] [Google Scholar]
- 82.Turan O M, Turan S, Berg C. Duration of persistent abnormal ductus venosus flow and its impact on perinatal outcome in fetal growth restriction. Ultrasound Obstet Gynecol. 2011;38:295–302. doi: 10.1002/uog.9011. [DOI] [PubMed] [Google Scholar]
- 83.Yagel S, Kivilevitch Z, Cohen S M. The fetal venous system, Part II: ultrasound evaluation of the fetus with congenital venous system malformation or developing circulatory compromise. Ultrasound Obstet Gynecol. 2010;36:93–111. doi: 10.1002/uog.7622. [DOI] [PubMed] [Google Scholar]
- 84.Turan S, Turan O M, Berg C. Computerized fetal heart rate analysis, Doppler ultrasound and biophysical profile score in the prediction of acid-base status of growth-restricted fetuses. Ultrasound Obstet Gynecol. 2007;30:750–756. doi: 10.1002/uog.4101. [DOI] [PubMed] [Google Scholar]
- 85.Baschat A A, Guclu S, Kush M L. Venous Doppler in the prediction of acid-base status of growth-restricted fetuses with elevated placental blood flow resistance. Am J Obstet Gynecol. 2004;191:277–284. doi: 10.1016/j.ajog.2003.11.028. [DOI] [PubMed] [Google Scholar]
- 86.Soothill P W, Ajayi R A, Campbell S. Prediction of morbidity in small and normally grown fetuses by fetal heart rate variability, biophysical profile score and umbilical artery Doppler studies. Br J Obstet Gynaecol. 1993;100:742–745. doi: 10.1111/j.1471-0528.1993.tb14265.x. [DOI] [PubMed] [Google Scholar]
- 87.Almstrom H, Axelsson O, Cnattingius S. Comparison of umbilical-artery velocimetry and cardiotocography for surveillance of small-for-gestational-age fetuses. Lancet. 1992;340:936–940. doi: 10.1016/0140-6736(92)92818-z. [DOI] [PubMed] [Google Scholar]
- 88.German Society of Gynecology and Obstetrics (DGGG); Maternal Fetal Medicine Study Group (AGMFM); German Society of Prenatal Medicine and Obstetrics (DGPGM) ; German Society of Perinatal Medicine (DGPM) . S1-Guideline on the use of CTG during pregnancy and labor. Long version – AWMF Registry No. 015/036. Geburtsh Frauenheilk. 2014;74:721–732. doi: 10.1055/s-0034-1382874. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Street P, Dawes G S, Moulden M. Short-term variation in abnormal antenatal fetal heart rate records. Am J Obstet Gynecol. 1991;165:515–523. doi: 10.1016/0002-9378(91)90277-x. [DOI] [PubMed] [Google Scholar]
- 90.Dawes G S, Moulden M, Redman C W. Short-term fetal heart rate variation, decelerations, and umbilical flow velocity waveforms before labor. Obstet Gynecol. 1992;80:673–678. [PubMed] [Google Scholar]
- 91.Anceschi M M, Ruozi-Berretta A, Piazze J J. Computerized cardiotocography in the management of intrauterine growth restriction associated with Doppler velocimetry alterations. Int J Gynaecol Obstet. 2004;86:365–370. doi: 10.1016/j.ijgo.2004.05.012. [DOI] [PubMed] [Google Scholar]
- 92.Dawes G, Meir Y J, Mandruzzato G P. Computerized evaluation of fetal heart-rate patterns. J Perinat Med. 1994;22:491–499. doi: 10.1515/jpme.1994.22.6.491. [DOI] [PubMed] [Google Scholar]
- 93.Piazze J J, Anceschi M M, Ruozzi Berretta A. The combination of computerized cardiotocography and amniotic fluid index for the prediction of neonatal acidemia at birth: a modified biophysical profile. J Matern Fetal Med. 2001;10:323–327. doi: 10.1080/714052769. [DOI] [PubMed] [Google Scholar]
- 94.Serra V, Moulden M, Bellver J. The value of the short-term fetal heart rate variation for timing the delivery of growth-retarded fetuses. BJOG. 2008;115:1101–1107. doi: 10.1111/j.1471-0528.2008.01774.x. [DOI] [PubMed] [Google Scholar]
- 95.Guzman E R, Vintzileos A M, Martins M. The efficacy of individual computer heart rate indices in detecting acidemia at birth in growth-restricted fetuses. Obstet Gynecol. 1996;87:969–974. doi: 10.1016/0029-7844(96)00020-8. [DOI] [PubMed] [Google Scholar]
- 96.Nijhuis I J, ten Hof J, Mulder E J. Fetal heart rate in relation to its variation in normal and growth retarded fetuses. Eur J Obstet Gynecol Reprod Biol. 2000;89:27–33. doi: 10.1016/s0301-2115(99)00162-1. [DOI] [PubMed] [Google Scholar]
- 97.Ribbert L S, Snijders R J, Nicolaides K H. Relation of fetal blood gases and data from computer-assisted analysis of fetal heart rate patterns in small for gestation fetuses. Br J Obstet Gynaecol. 1991;98:820–823. doi: 10.1111/j.1471-0528.1991.tb13489.x. [DOI] [PubMed] [Google Scholar]
- 98.Serra V, Bellver J, Moulden M. Computerized analysis of normal fetal heart rate pattern throughout gestation. Ultrasound Obstet Gynecol. 2009;34:74–79. doi: 10.1002/uog.6365. [DOI] [PubMed] [Google Scholar]
- 99.Visser G H, Sadovsky G, Nicolaides K H. Antepartum heart rate patterns in small-for-gestational-age third-trimester fetuses: correlations with blood gas values obtained at cordocentesis. Am J Obstet Gynecol. 1990;162:698–703. doi: 10.1016/0002-9378(90)90989-k. [DOI] [PubMed] [Google Scholar]
- 100.Lees C C, Marlow N, van Wassenaer-Leemhuis A. 2 year neurodevelopmental and intermediate perinatal outcomes in infants with very preterm fetal growth restriction (TRUFFLE): a randomised trial. Lancet. 2015;385:2162–2172. doi: 10.1016/S0140-6736(14)62049-3. [DOI] [PubMed] [Google Scholar]
- 101.Baschat A A, Galan H L, Bhide A. Doppler and biophysical assessment in growth restricted fetuses: distribution of test results. Ultrasound Obstet Gynecol. 2006;27:41–47. doi: 10.1002/uog.2657. [DOI] [PubMed] [Google Scholar]
- 102.Kaur S, Picconi J L, Chadha R. Biophysical profile in the treatment of intrauterine growth-restricted fetuses who weigh < 1000 g. Am J Obstet Gynecol. 2008;199:2640–2.64E6. doi: 10.1016/j.ajog.2008.06.074. [DOI] [PubMed] [Google Scholar]
- 103.Lalor J G, Fawole B, Alfirevic Z.Biophysical profile for fetal assessment in high risk pregnancies Cochrane Database Syst Rev 200801CD000038 10.1002/14651858.CD000038.pub2 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 104.Roberts D, Dalziel S.Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth Cochrane Database Syst Rev 200603CD004454 10.1002/14651858.CD004454.pub2 [DOI] [PubMed] [Google Scholar]
- 105.Doyle L W, Crowther C A, Middleton P.Magnesium sulphate for women at risk of preterm birth for neuroprotection of the fetus Cochrane Database Syst Rev 200901CD004661 10.1002/14651858.CD004661.pub3 [DOI] [PubMed] [Google Scholar]
- 106.Marret S, Marpeau L, Zupan-Simunek V. Magnesium sulphate given before very-preterm birth to protect infant brain: the randomised controlled PREMAG trial*. BJOG. 2007;114:310–318. doi: 10.1111/j.1471-0528.2006.01162.x. [DOI] [PubMed] [Google Scholar]
- 107.Rouse D J, Hirtz D G, Thom E. A randomized, controlled trial of magnesium sulfate for the prevention of cerebral palsy. N Engl J Med. 2008;359:895–905. doi: 10.1056/NEJMoa0801187. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 108.Crowther C A, Hiller J E, Doyle L W. Effect of magnesium sulfate given for neuroprotection before preterm birth: a randomized controlled trial. JAMA. 2003;290:2669–2676. doi: 10.1001/jama.290.20.2669. [DOI] [PubMed] [Google Scholar]
- 109.Mittendorf R, Dambrosia J, Pryde P G. Association between the use of antenatal magnesium sulfate in preterm labor and adverse health outcomes in infants. Am J Obstet Gynecol. 2002;186:1111–1118. doi: 10.1067/mob.2002.123544. [DOI] [PubMed] [Google Scholar]
- 110.Vayssiere C, Sentilhes L, Ego A. Fetal growth restriction and intra-uterine growth restriction: guidelines for clinical practice from the French College of Gynaecologists and Obstetricians. Eur J Obstet Gynecol Reprod Biol. 2015;193:10–18. doi: 10.1016/j.ejogrb.2015.06.021. [DOI] [PubMed] [Google Scholar]
- 111.Kehl S, Brade J, Schmidt U. Role of fetal abdominal circumference as a prognostic parameter of perinatal complications. Arch Gynecol Obstet. 2011;284:1345–1349. doi: 10.1007/s00404-011-1888-8. [DOI] [PubMed] [Google Scholar]
- 112.Hornemann A, Bohlmann M K, Diedrich K. Spontaneous uterine rupture at the 21st week of gestation caused by placenta percreta. Arch Gynecol Obstet. 2011;284:875–878. doi: 10.1007/s00404-011-1927-5. [DOI] [PubMed] [Google Scholar]
- 113.Aronow H D, Peyser P A, Eagle K A. Predictors of length of stay after coronary stenting. Am Heart J. 2001;142:799–805. doi: 10.1067/mhj.2001.119371. [DOI] [PubMed] [Google Scholar]
- 114.Aronsson A, Bygdeman M, Gemzell-Danielsson K. Effects of misoprostol on uterine contractility following different routes of administration. Hum Reprod. 2004;19:81–84. doi: 10.1093/humrep/deh005. [DOI] [PubMed] [Google Scholar]
- 115.Committee Opinion No. 652 Summary: magnesium sulfate use in obstetrics. Obstet Gynecol. 2016;127:195. doi: 10.1097/AOG.0000000000001262. [DOI] [PubMed] [Google Scholar]
- 116.Liu J, Wang X F, Wang Y. The incidence rate, high-risk factors, and short- and long-term adverse outcomes of fetal growth restriction: a report from Mainland China. Medicine. 2014;93:e210. doi: 10.1097/MD.0000000000000210. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 117.Doctor B A, OʼRiordan M A, Kirchner H L. Perinatal correlates and neonatal outcomes of small for gestational age infants born at term gestation. Am J Obstet Gynecol. 2001;185:652–659. doi: 10.1067/mob.2001.116749. [DOI] [PubMed] [Google Scholar]
- 118.Baschat A A. Doppler application in the delivery timing of the preterm growth-restricted fetus: another step in the right direction. Ultrasound Obstet Gynecol. 2004;23:111–118. doi: 10.1002/uog.989. [DOI] [PubMed] [Google Scholar]
- 119.Group G S. A randomised trial of timed delivery for the compromised preterm fetus: short term outcomes and Bayesian interpretation. BJOG. 2003;110:27–32. doi: 10.1046/j.1471-0528.2003.02014.x. [DOI] [PubMed] [Google Scholar]
- 120.Thornton J G, Hornbuckle J, Vail A. Infant wellbeing at 2 years of age in the Growth Restriction Intervention Trial (GRIT): multicentred randomised controlled trial. Lancet. 2004;364:513–520. doi: 10.1016/S0140-6736(04)16809-8. [DOI] [PubMed] [Google Scholar]
- 121.Ferrazzi E, Bozzo M, Rigano S. Temporal sequence of abnormal Doppler changes in the peripheral and central circulatory systems of the severely growth-restricted fetus. Ultrasound Obstet Gynecol. 2002;19:140–146. doi: 10.1046/j.0960-7692.2002.00627.x. [DOI] [PubMed] [Google Scholar]
- 122.Wilkinson A R, Ahluwalia J, Cole A. Management of babies born extremely preterm at less than 26 weeks of gestation: a framework for clinical practice at the time of birth. Arch Dis Child Fetal Neonatal Ed. 2009;94:F2–F5. doi: 10.1136/adc.2008.143321. [DOI] [PubMed] [Google Scholar]
- 123.Unterscheider J, Daly S, Geary M P. Predictable progressive Doppler deterioration in IUGR: does it really exist? Am J Obstet Gynecol. 2013;209:5390–5.39E9. doi: 10.1016/j.ajog.2013.08.039. [DOI] [PubMed] [Google Scholar]
- 124.Boers K E, Vijgen S M, Bijlenga D. Induction versus expectant monitoring for intrauterine growth restriction at term: randomised equivalence trial (DIGITAT) BMJ. 2010;341:c7087. doi: 10.1136/bmj.c7087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 125.van Wyk L, Boers K E, van der Post J A. Effects on (neuro)developmental and behavioral outcome at 2 years of age of induced labor compared with expectant management in intrauterine growth-restricted infants: long-term outcomes of the DIGITAT trial. Am J Obstet Gynecol. 2012;206:4060–4.06E9. doi: 10.1016/j.ajog.2012.02.003. [DOI] [PubMed] [Google Scholar]
- 126.Boers K E, van Wyk L, van der Post J A. Neonatal morbidity after induction vs expectant monitoring in intrauterine growth restriction at term: a subanalysis of the DIGITAT RCT. Am J Obstet Gynecol. 2012;206:3440–3.44E9. doi: 10.1016/j.ajog.2012.01.015. [DOI] [PubMed] [Google Scholar]
- 127.Karsdorp V H, van Vugt J M, van Geijn H P. Clinical significance of absent or reversed end diastolic velocity waveforms in umbilical artery. Lancet. 1994;344:1664–1668. doi: 10.1016/s0140-6736(94)90457-x. [DOI] [PubMed] [Google Scholar]
- 128.Forouzan I. Absence of end-diastolic flow velocity in the umbilical artery: a review. Obstet Gynecol Surv. 1995;50:219–227. doi: 10.1097/00006254-199503000-00026. [DOI] [PubMed] [Google Scholar]
- 129.Baschat A A, Weiner C P. Umbilical artery doppler screening for detection of the small fetus in need of antepartum surveillance. Am J Obstet Gynecol. 2000;182:154–158. doi: 10.1016/s0002-9378(00)70505-9. [DOI] [PubMed] [Google Scholar]
- 130.Li H, Gudmundsson S, Olofsson P. Prospect for vaginal delivery of growth restricted fetuses with abnormal umbilical artery blood flow. Acta Obstet Gynecol Scand. 2003;82:828–833. doi: 10.1034/j.1600-0412.2003.00213.x. [DOI] [PubMed] [Google Scholar]
- 131.Lin C C, Moawad A H, Rosenow P J. Acid-base characteristics of fetuses with intrauterine growth retardation during labor and delivery. Am J Obstet Gynecol. 1980;137:553–559. doi: 10.1016/0002-9378(80)90695-x. [DOI] [PubMed] [Google Scholar]
- 132.Resnik R. Intrauterine growth restriction. Obstet Gynecol. 2002;99:490–496. doi: 10.1016/s0029-7844(01)01780-x. [DOI] [PubMed] [Google Scholar]
- 133.Hornbuckle J, Vail A, Abrams K R. Bayesian interpretation of trials: the example of intrapartum electronic fetal heart rate monitoring. BJOG. 2000;107:3–10. doi: 10.1111/j.1471-0528.2000.tb11571.x. [DOI] [PubMed] [Google Scholar]
- 134.Gulmezoglu A M, Hofmeyr G J.Bed rest in hospital for suspected impaired fetal growth Cochrane Database Syst Rev 200002CD000034 10.1002/14651858.CD000034 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 135.Hofmeyr G J, Lawrie T A, Atallah A N. Calcium supplementation during pregnancy for preventing hypertensive disorders and related problems. Cochrane Database Syst Rev. 2014;(06):CD001059. doi: 10.1002/14651858.CD001059.pub4. [DOI] [PubMed] [Google Scholar]
- 136.Say L, Gulmezoglu A M, Hofmeyr G J.Maternal nutrient supplementation for suspected impaired fetal growth Cochrane Database Syst Rev 200301CD000148 10.1002/14651858.CD000148 [DOI] [PubMed] [Google Scholar]
- 137.Figueras F, Meler E, Eixarch E. Association of smoking during pregnancy and fetal growth restriction: subgroups of higher susceptibility. Eur J Obstet Gynecol Reprod Biol. 2008;138:171–175. doi: 10.1016/j.ejogrb.2007.09.005. [DOI] [PubMed] [Google Scholar]
- 138.Meher S, Duley L.Progesterone for preventing pre-eclampsia and its complications Cochrane Database Syst Rev 200604CD006175 10.1002/14651858.CD006175 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 139.Say L, Gülmezoglu A M, Hofmeyr G J.Maternal oxygen administration for suspected impaired fetal growth Cochrane Database Syst Rev 200301CD000137 10.1002/14651858.CD000137 [DOI] [PubMed] [Google Scholar]
- 140.Nozaki A M, Francisco R P, Fonseca E S. Fetal hemodynamic changes following maternal betamethasone administration in pregnancies with fetal growth restriction and absent end-diastolic flow in the umbilical artery. Acta Obstet Gynecol Scand. 2009;88:350–354. doi: 10.1080/00016340902730334. [DOI] [PubMed] [Google Scholar]
- 141.Gülmezoglu A M, Hofmeyr G J.Plasma volume expansion for suspected impaired fetal growth Cochrane Database Syst Rev 200002CD000167 10.1002/14651858.CD000167 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 142.Newnham J P, Godfrey M, Walters B J. Low dose aspirin for the treatment of fetal growth restriction: a randomized controlled trial. Aust N Z J Obstet Gynaecol. 1995;35:370–374. doi: 10.1111/j.1479-828x.1995.tb02144.x. [DOI] [PubMed] [Google Scholar]
- 143.von Dadelszen P, Dwinnell S, Magee L A. Sildenafil citrate therapy for severe early-onset intrauterine growth restriction. BJOG. 2011;118:624–628. doi: 10.1111/j.1471-0528.2010.02879.x. [DOI] [PubMed] [Google Scholar]
- 144.Maternal Fetal Medicine Committee . Lausman A, Kingdom J. Intrauterine growth restriction: screening, diagnosis, and management. J Obstet Gynaecol Can. 2013;35:741–757. doi: 10.1016/S1701-2163(15)30865-3. [DOI] [PubMed] [Google Scholar]
- 145.Abalos E, Duley L, Steyn D W. Antihypertensive drug therapy for mild to moderate hypertension during pregnancy. Cochrane Database Syst Rev. 2014;(02):CD002252. doi: 10.1002/14651858.CD002252.pub3. [DOI] [PubMed] [Google Scholar]
- 146.Gülmezoglu A M, Hofmeyr G J.Betamimetics for suspected impaired fetal growth Cochrane Database Syst Rev 200104CD000036 10.1002/14651858.CD000036 [DOI] [PubMed] [Google Scholar]
- 147.Schleussner E, Lehmann T, Kahler C. Impact of the nitric oxide-donor pentaerythrityl-tetranitrate on perinatal outcome in risk pregnancies: a prospective, randomized, double-blinded trial. J Perinat Med. 2014;42:507–514. doi: 10.1515/jpm-2013-0212. [DOI] [PubMed] [Google Scholar]
- 148.Härtel C, Herting E. Nachsorge von Frühgeborenen. Pädiatrische Praxis. 2010;75:3–20. [Google Scholar]
- 149.Bujold E, Roberge S, Lacasse Y. Prevention of preeclampsia and intrauterine growth restriction with aspirin started in early pregnancy: a meta-analysis. Obstet Gynecol. 2010;116:402–414. doi: 10.1097/AOG.0b013e3181e9322a. [DOI] [PubMed] [Google Scholar]
- 150.Henderson J T, Whitlock E P, OʼConnor E. Low-dose aspirin for prevention of morbidity and mortality from preeclampsia: a systematic evidence review for the U.S. Preventive Services Task Force. Ann Intern Med. 2014;160:695–703. doi: 10.7326/M13-2844. [DOI] [PubMed] [Google Scholar]
- 151.Roberge S, Nicolaides K H, Demers S. Prevention of perinatal death and adverse perinatal outcome using low-dose aspirin: a meta-analysis. Ultrasound Obstet Gynecol. 2013;41:491–499. doi: 10.1002/uog.12421. [DOI] [PubMed] [Google Scholar]
- 152.Magee L A, Duley L.Oral beta-blockers for mild to moderate hypertension during pregnancy Cochrane Database Syst Rev 200303CD002863 10.1002/14651858.CD002863 [DOI] [PubMed] [Google Scholar]
- 153.Khoury J, Henriksen T, Christophersen B. Effect of a cholesterol-lowering diet on maternal, cord, and neonatal lipids, and pregnancy outcome: a randomized clinical trial. Am J Obstet Gynecol. 2005;193:1292–1301. doi: 10.1016/j.ajog.2005.05.016. [DOI] [PubMed] [Google Scholar]
- 154.Ota E, Tobe-Gai R, Mori R. Antenatal dietary advice and supplementation to increase energy and protein intake. Cochrane Database Syst Rev. 2012;(09):CD000032. doi: 10.1002/14651858.CD000032.pub2. [DOI] [PubMed] [Google Scholar]
- 155.Pena-Rosas J P, De-Regil L M, Garcia-Casal M N. Daily oral iron supplementation during pregnancy. Cochrane Database Syst Rev. 2015;(07):CD004736. doi: 10.1002/14651858.CD004736.pub5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 156.Ota E, Mori R, Middleton P. Zinc supplementation for improving pregnancy and infant outcome. Cochrane Database Syst Rev. 2015;(02):CD000230. doi: 10.1002/14651858.CD000230.pub5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 157.Makrides M, Crosby D D, Bain E. Magnesium supplementation in pregnancy. Cochrane Database Syst Rev. 2014;(04):CD000937. doi: 10.1002/14651858.CD000937.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 158.De-Regil L M, Palacios C, Lombardo L K. Vitamin D supplementation for women during pregnancy. Cochrane Database Syst Rev. 2016;(01):CD008873. doi: 10.1002/14651858.CD008873.pub3. [DOI] [PubMed] [Google Scholar]
- 159.Dodd J M, McLeod A, Windrim R C. Antithrombotic therapy for improving maternal or infant health outcomes in women considered at risk of placental dysfunction. Cochrane Database Syst Rev. 2013;(07):CD006780. doi: 10.1002/14651858.CD006780.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 160.Duffett L, Rodger M. LMWH to prevent placenta-mediated pregnancy complications: an update. Br J Haematol. 2015;168:619–638. doi: 10.1111/bjh.13209. [DOI] [PubMed] [Google Scholar]
- 161.Rodger M A, Carrier M, Le Gal G. Meta-analysis of low-molecular-weight heparin to prevent recurrent placenta-mediated pregnancy complications. Blood. 2014;123:822–828. doi: 10.1182/blood-2013-01-478958. [DOI] [PubMed] [Google Scholar]
- 162.Lumley J, Chamberlain C, Dowswell T.Interventions for promoting smoking cessation during pregnancy Cochrane Database Syst Rev 200903CD001055 10.1002/14651858.CD001055.pub3 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 163.McCowan L M, Dekker G A, Chan E. Spontaneous preterm birth and small for gestational age infants in women who stop smoking early in pregnancy: prospective cohort study. BMJ. 2009;338:b1081. doi: 10.1136/bmj.b1081. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 164.Lindqvist P G, Molin J. Does antenatal identification of small-for-gestational age fetuses significantly improve their outcome? Ultrasound Obstet Gynecol. 2005;25:258–264. doi: 10.1002/uog.1806. [DOI] [PubMed] [Google Scholar]
- 165.Marsal K. Obstetric management of intrauterine growth restriction. Best Pract Res Clin Obstet Gynaecol. 2009;23:857–870. doi: 10.1016/j.bpobgyn.2009.08.011. [DOI] [PubMed] [Google Scholar]
- 166.Gaudineau A. [Prevalence, risk factors, maternal and fetal morbidity and mortality of intrauterine growth restriction and small-for-gestational age] J Gynecol Obstet Biol Reprod (Paris) 2013;42:895–910. doi: 10.1016/j.jgyn.2013.09.013. [DOI] [PubMed] [Google Scholar]
- 167.Cnossen J S, Morris R K, ter Riet G. Use of uterine artery Doppler ultrasonography to predict pre-eclampsia and intrauterine growth restriction: a systematic review and bivariable meta-analysis. CMAJ. 2008;178:701–711. doi: 10.1503/cmaj.070430. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 168.Stampalija T, Gyte G M, Alfirevic Z.Utero-placental Doppler ultrasound for improving pregnancy outcome Cochrane Database Syst Rev 201009CD008363 10.1002/14651858.CD008363.pub2 [DOI] [PMC free article] [PubMed] [Google Scholar]