ABSTRACT
Objective:
To determine the current use and potential acceptance (by tuberculosis experts worldwide) of novel rapid tests for the diagnosis of tuberculosis that are in line with World Health Organization target product profiles.
Methods:
A multilingual survey was disseminated online between July and November of 2016.
Results:
A total of 723 individuals from 114 countries responded to the survey. Smear microscopy was the most commonly used rapid tuberculosis test (available to 90.9% of the respondents), followed by molecular assays (available to 70.7%). Only a small proportion of the respondents in middle- and low-income countries had access to interferon-gamma-release assays. Serological and lateral flow immunoassays were used by more than a quarter (25.4%) of the respondents. Among the respondents who had access to molecular tests, 46.7% were using the Xpert assay overall, that proportion being higher in lower middle-income countries (55.6%) and low-income countries (76.6%). The data also suggest that there was some alignment of pricing for molecular assays. Respondents stated they would accept novel rapid tuberculosis tests if available, including molecular assays (acceptable to 86.0%) or biomarker-based serological assays (acceptable to 81.7%). Simple biomarker-based assays were more commonly deemed acceptable in middle- and low-income countries.
Conclusions:
Second-generation molecular assays have become more widely available in high- and low-resource settings. However, the development of novel rapid tuberculosis tests continues to be considered important by tuberculosis experts. Our data also underscore the need for additional training and education of end users.
Keywords: Tuberculosis/diagnosis, Surveys and questionnaires, Income, Mycobacterium tuberculosis/isolation & purification, Molecular diagnostic techniques/methods, Serologic tests/methods
INTRODUCTION
Tuberculosis continues to be one of the most prevalent human infections worldwide, the World Health Organization (WHO) reporting that an estimated 10.4 million new tuberculosis cases occurred in 2015.1 In approximately one third of those cases, the affected individuals are sputum smear-positive (i.e., have active tuberculosis) and could therefore transmit the disease.1 A core aspect of tuberculosis control is the rapid identification and effective treatment of individuals transmitting the Mycobacterium tuberculosis complex, the causative agent of tuberculosis.1-8 However, in most settings, more than half of all active tuberculosis cases are not confirmed through laboratory testing or the diagnosis is delayed because reliable diagnostic tools are not available.1,3,8
The most common microbiological test to detect M. tuberculosis is microscopic examination of sputum or other clinical material stained for AFB, commonly referred to as smear microscopy,9 in which a positive result is defined as 5,000-10,000 stained bacilli/mL. Therefore, its sensitivity is variable, depending on several factors, and can be as low as 20-30% in some settings.9 In contrast, culture for M. tuberculosis, which is still considered the gold standard, can detect positivity on the basis of only 10-100 viable bacilli/mL of specimen, thus identifying M. tuberculosis in more than 80% of active tuberculosis cases, with a specificity greater than 98%. However, liquid cultures can take two to four weeks to produce a positive result and, due to the growth characteristics of M. tuberculosis, solid cultures can take up to eight weeks.9
Rapid M. tuberculosis culture methods and molecular assays could play an important role in hastening the diagnosis of tuberculosis and generally have high specificity.10,11 However, the implementation of these methods is not possible in all clinical settings.10-17 In addition, although molecular assays for the diagnosis of tuberculosis-such as the Xpert MTB-RIF assay for the identification of M. tuberculosis and the detection of rifampin resistance (hereafter referred to as the Xpert assay)-are becoming more widely available, they are still quite costly, especially at facilities where their use is not supported by external funding sources.18 Serology-based tuberculosis tests potentially have the necessary characteristics to overcome these problems. They can be performed rapidly at a low cost and could be used as point-of-care tests, even in low-resource clinical settings.8,18 However, the commercial serological tests for active tuberculosis that are currently available have suboptimal sensitivity and specificity,19 as well as low reproducibility.20 Due to those limitations, the WHO does not recommend the use of any of the currently available commercial serological tests for the diagnosis of tuberculosis.21
Based on the considerations above and with the aim of improving tuberculosis control worldwide, the WHO has recently released a document outlining the indications for and desirable characteristics of novel tuberculosis tests.8 That document also defined stringent sensitivity and specificity criteria for novel rapid diagnostic tests for tuberculosis, known as target product profiles (TPPs).8 There are four such TPPs, three of which are focused on the rapid identification of tuberculosis cases8,22: a triage test and a biomarker-based test (both suitable for point-of-care use); and a rapid sputum-based test for detecting M. tuberculosis at the microscopy-center level. Although the target sensitivity level varies among these test types, depending on the form of tuberculosis, it is estimated to be > 90% for all three.22 Similarly (with the exception of the triage screening test), the target specificity is quite high, ideally in excess of 98%.22 However, an effective novel test for tuberculosis might yet encounter further barriers to its acceptance and implementation, including costs and infrastructure requirements.17,18,22 Currently, there is limited knowledge on the perceptions and attitudes of end users toward novel tests for tuberculosis, which could represent an additional hurdle for incorporating novel assays into the clinical diagnostic routine. This study aimed to determine the current use of existing tuberculosis tests, as well as the acceptability of future tuberculosis tests, among experts involved in tuberculosis diagnostics worldwide.
METHODS
Survey design and data collection
The survey was based on a structured questionnaire, designed to elicit feedback, that included a total of 52 questions, organized into 18 sections: section 1, General expertise; section 2, Specific expertise in tuberculosis field; section 3, Diagnostic tests in current use; sections 4-9, Previous experience with diagnostic tests for tuberculosis; sections 10-16, Acceptability of novel diagnostic tests for tuberculosis; section 17, Accepted performance characteristics of novel diagnostic tests for tuberculosis; and section 18, Current price of the diagnostic tests and potential acceptability of pricing for novel tests. Participation in the survey was voluntary. Data were collected anonymously, no personal data, except for respondent ages or electronic tracking (Internet protocol address or other encoding identification) of the survey submission data, being recorded. Respondents were aware that they were participating in research and that the results would be published. Respondents were given the opportunity to provide their e-mail address in order to be informed of the project results toward the end of the survey. In addition, respondents were given the opportunity to provide their name and institution at the end of the survey in the event that they wished to be named as a project collaborator in the resulting publications. According to the current standards set by European Directive 2001/20/EC and their implementation in national regulations (e.g., UK National Research Ethics Service regulations, Governance Arrangements for Research Ethics Committees, paragraph 2.3.13), research ethics committee review is not required for research involving healthcare staff recruited as research participants, by virtue of their professional role.
To maximize its accessibility to tuberculosis experts worldwide, the questionnaire was offered in English, Spanish, and French. The multilingual questionnaires were accessible online on a Google platform for a 4-month period extending from 16 July 2016 to 16 November 2016. The English-language version of the survey instrument is available online (https://docs.google.com/forms/d/188ZEQ-juNaYeKlIEzMBzGwhzSuHm00loTcf0m_wHths/edit?usp=sharing). The survey links were distributed, by e-mail, to various groups of tuberculosis experts, including the tuberculosis experts registered with the Global Laboratory Initiative of the WHO (via its “listserv” mailing list); the Mycobacteriology Working Group of the Italian Society of Clinical Microbiology; the European Society of Mycobacteriology; the Paediatric Tuberculosis Network European Trials Group; and the laboratory specialists of the Tuberculosis Network European Trialsgroup Clinical Research Collaboration.
This study was conducted within the framework established jointly by the Latin-American Thoracic Association and European Respiratory Society. It was supported by the Brazilian Thoracic Society and guided by the tenets of the Latin-American Thoracic Association/European Respiratory Society SinTB project, which is focused on eliminating tuberculosis in Latin America.
Statistical analysis, primary data stratification, and characteristics of the survey population
Data from individual language databases were pooled into a single file for the purpose of analysis. The information provided for the entry “Country of work” was used in order to define the WHO region, as well as the World Bank classification and stratification of the country by its 2015 gross national income (GNI) per capita, according to the Atlas method calculation (in US dollars: http://data.worldbank.org/indicator/NY.GNP.PCAP.CD?order=wbapi_data_value_2014 ± wbapi_data_value ± wbapi_data_value-last&sort=desc). Those two parameters were used for the primary stratification of the survey data. Each country was classified as low-income (GNI per capita ≤ US$1,025); lower middle-income (GNI per capita of US$1,026-4,035); upper middle-income (GNI per capita of US$4,036-12,475); or high-income (GNI per capita ≥ US$12,476). Data were available for all entry countries, although not for Palestine, which was therefore not included in any of the sub-stratification analyses.
Analyses were carried out with the SPSS Statistics software package for Windows, version 19.0 (SPSS Italia SRL, Bologna, Italy), Prism 6 (Graphpad Software, San Diego, CA, USA), and the Real Statistics add-in for Excel (available at http://www.real-statistics.com/). Continuous variables are expressed as mean ± standard deviation, whereas dichotomous and categorical variables are expressed as absolute and relative frequencies. For the comparison of continuous variables among groups, ANOVA was used, whereas the chi-square test and logistic regression were used for the comparison of dichotomous and categorical variables. After multiple comparisons, Bonferroni correction was used if required. Values of p ≤ 0.05 after Bonferroni correction were considered statistically significant.
RESULTS
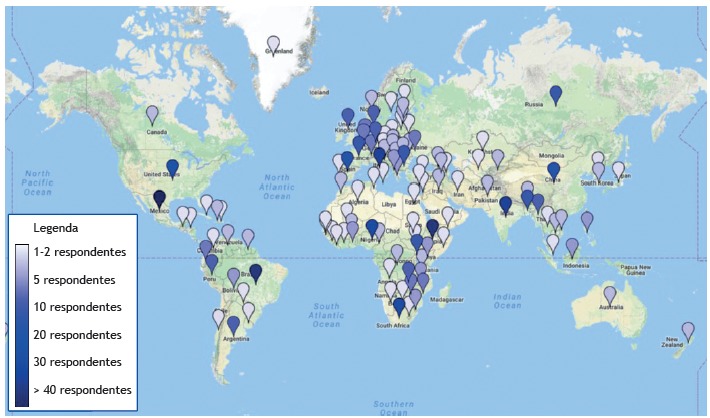
A total of 723 respondents from 114 countries and territories participated in the survey. Figure 1 shows the geographical location of the survey respondents. For 15 countries-including most of the countries on the WHO list of high tuberculosis burden countries1-there were 10 or more respondents; for 27 countries, there was only one respondent. Table 1 summarizes the characteristics of the respondents, including age, level of education, place of work, work experience, and expertise. The three largest groups of professional respondents included those with expertise in infectious diseases, those with expertise in pulmonology, and those with expertise in microbiology, collectively comprising nearly two thirds (64.45%) of the study population, with no significant differences among respondents in terms of their background in clinical or laboratory work (p = 0.1075).
Figure 1. Geographic distribution of the survey respondents, by country. A graded color scale (bottom left) indicates the density of respondents in each country.
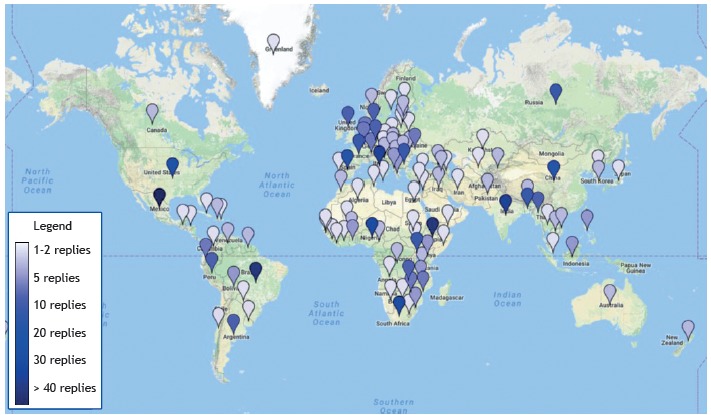
Table 1. Characteristics of the survey respondents.a.
| Variable | Income level of the countries (World Bank classification) | Total | p* | |||
|---|---|---|---|---|---|---|
| High | Upper middle | Lower middle | Low | |||
| (n = 191) | (n = 263) | (n = 172) | (n = 96) | (n = 723b ) | ||
| Proportional distribution, % | 26.4 | 36.4 | 23.8 | 13.3 | 100.0 | < 0.00001 |
| Age (years), mean ± SD | 48.2 ± 9.9 | 46.3 ± 11.0 | 44.3 ± 10.3 | 42.2 ± 10.2 | 45.8 ± 10.6 | < 0.00001 |
| Age range (years) | < 0.00001 | |||||
| 21-30 | 5 (2.6) | 16 (6.1) | 14 (8.1) | 7 (7.3) | 42 (5.8) | |
| 31-40 | 38 (19.9) | 77 (29.3) | 56 (32.6) | 43 (44.8) | 215b (29.7) | |
| 41-50 | 74 (38.7) | 63 (24.0) | 54 (31.4) | 27 (28.1) | 218 (30.2) | |
| 51-60 | 54 (28.3) | 81 (30.8) | 39 (22.7) | 15 (15.6) | 189 (26.1) | |
| ≥ 61 | 20 (9.4) | 26 (9.8) | 9 (5.1) | 4 (4.1) | 54 (8.2) | |
| Total | 191 (100.0) | 263 (100.0) | 172 (100.0) | 96 (100.0) | 723b (100.0) | |
| Highest level of education | < 0.00001 | |||||
| High school | 2 (1.0) | 2 (0.8) | 2 (1.2) | 1 (1.0) | 7 (1.0) | |
| Undergraduate degree | 24 (12.6) | 79 (30.0) | 37 (21.5) | 22 (22.9) | 163b (22.5) | |
| Masters degree | 35 (18.3) | 76 (28.9) | 69 (40.1) | 49 (51.0) | 229 (31.7) | |
| Doctorate | 85 (44.5) | 65 (24.7) | 42 (24.4) | 19 (19.8) | 211 (29.2) | |
| Postgraduate work | 45 (23.6) | 41 (15.6) | 22 (12.8) | 5 (5.2) | 113 (15.6) | |
| Total | 191 (100.0) | 263 (100.0) | 172 (100.0) | 96 (100.0) | 723b (100.0) | |
| Experience in tuberculosis | < 0.00001 | |||||
| 1-5 years | 25 (13.1) | 48 (18.3) | 30 (17.4) | 23 (24.0) | 127b (17.6) | |
| 6-9 years | 42 (22.0) | 53 (20.2) | 51 (29.7) | 28 (29.2) | 174 (24.1) | |
| 10-20 years | 83 (43.5) | 75 (28.5) | 62 (36.0) | 32 (33.3) | 252 (34.9) | |
| > 20 years | 41 (21.5) | 87 (33.1) | 29 (16.9) | 13 (13.5) | 170 (23.5) | |
| Total | 191 (100.0) | 263 (100.0) | 172 (100.0) | 96 (100.0) | 723b (100.0) | |
| Main employer | < 0.00001 | |||||
| Public health | 94 (49.2) | 163 (62.0) | 82 (47.7) | 51 (53.1) | 391b (54.1) | |
| Academic institution | 54 (28.3) | 44 (16.7) | 30 (17.4) | 15 (15.6) | 143 (19.8) | |
| Other publicly funded institute | 19 (9.9) | 23 (8.7) | 15 (8.7) | 14 (14.6) | 71 (9.8) | |
| Private healthcare facility | 5 (2.6) | 24 (9.1) | 12 (7.0) | 2 (2.1) | 43 (5.9) | |
| Industry | 5 (2.6) | 2 (0.8) | 1 (0.6) | 1 (1.0) | 9 (1.2) | |
| Other private concern | 14 (7.3) | 7 (2.7) | 32 (18.6) | 13 (13.5) | 66 (9.1) | |
| Total | 191 (100.0) | 263 (100.0) | 172 (100.0) | 96 (100.0) | 723b (100.0) | |
| Main focus in tuberculosis | < 0.00001 | |||||
| Adult | 78 (40.8) | 128 (48.7) | 42 (24.4) | 22 (22.9) | 271 (37.5) | |
| Pediatric | 30 (15.7) | 3 (1.1) | 20 (11.6) | 4 (4.2) | 57 (7.9) | |
| Adult and pediatric | 83 (43.5) | 129 (49.0) | 107 (62.2) | 69 (71.9) | 388 (53.7) | |
| No answer provided | 0 (0.0) | 3 (1.1) | 3 (1.7) | 1 (1.0) | 7 (1.0) | |
| Total | 191 (100.0) | 263 (100.0) | 172 (100.0) | 96 (100.0) | 723b (100.0) | |
| Main area of expertise | < 0.00001 | |||||
| Infectious diseases | 58 (30.4) | 57 (21.7) | 35 (20.3) | 32 (33.3) | 183b (25.3) | |
| Pulmonology | 39 (20.4) | 72 (27.4) | 33 (19.2) | 11 (11.5) | 155 (21.4) | |
| General medicine (adult) | 1 (0.5) | 34 (12.9) | 11 (6.4) | 12 (12.5) | 58 (8.0) | |
| Pediatrics | 10 (5.2) | 2 (0.8) | 7 (4.1) | 3 (3.1) | 22 (3.0) | |
| Microbiology | 43 (22.5) | 44 (16.7) | 30 (17.4) | 11 (11.5) | 128 (17.7) | |
| Immunology | 10 (5.2) | 12 (4.6) | 7 (4.1) | 3 (3.1) | 32 (4.4) | |
| Laboratory medicine | 10 (5.2) | 8 (3.0) | 19 (11.0) | 12 (12.5) | 49 (6.8) | |
| Basic science | 4 (2.1) | 9 (3.4) | 5 (2.9) | 0 (0.0) | 18 (2.5) | |
| Other | 16 (8.4) | 25 (9.5) | 25 (14.5) | 12 (12.5) | 78 (10.8) | |
| Total | 191 (100.0) | 263 (100.0) | 172 (100.0) | 96 (100.0) | 723b (100.0) | |
| Area of interest in tuberculosis (multiple answers allowed) | 0.0542 | |||||
| Clinical | 126 (66.0) | 184 (70.0) | 93 (54.1) | 54 (56.3) | 458b (63.3) | |
| Laboratory | 89 (46.6) | 133 (50.6) | 84 (48.8) | 45 (46.9) | 351 (48.5) | |
| Research | 105 (55.0) | 146 (55.5) | 98 (57.0) | 71 (74.0) | 420 (58.1) | |
| Policy Maker | 25 (13.1) | 53 (20.2) | 40 (23.3) | 36 (37.5) | 154 (21.3) | |
| Test Producer | 12 (6.3) | 34 (12.9) | 8 (4.7) | 6 (6.3) | 60 (8.3) | |
| Other Industry | 1 (0.5) | 2 (0.8) | 2 (1.2) | 3 (3.1) | 8 (1.1) | |
| Other | 11 (5.8) | 11 (4.2) | 10 (5.8) | 9 (9.4) | 41 (5.7) | |
| Total | 191 (100.0) | 263 (100.0) | 172 (100.0) | 96 (100.0) | 723b (100.0) | |
Values expressed as n (%), except where otherwise indicated. bIncludes one respondent working in a country that could not be classified according to the World Bank classification. *ANOVA or chi-square test, with Bonferroni correction.
In agreement with the general global trend reported by the United Nations,23 the age of the survey respondents was significantly lower in low-income countries than in high-income and upper middle-income countries (p < 0.0001 for both comparisons). As can be seen in Table 1, respondent ages were also lower in the lower middle-income countries than in the high-income countries (p = 0.0003). In addition, the survey respondents in high-income countries included a significantly higher proportion of respondents with graduate degrees and professorships (p < 0.0001 for all comparisons), although no such differences were detected among the other subgroups (Table 1). The distribution of the respondents by their years of experience in the area of tuberculosis was comparable between lower middle-income and low-income countries (p = 0.59), whereas the number of respondents with long-term experience in tuberculosis was significantly higher in high-income and upper middle-income countries than in lower middle-income and low-income countries (p < 0.0001 for all comparisons), as shown in Table 1.
Stratification of the survey data by GNI per capita (the World Bank classification) allowed an assessment of the differences between countries with different tuberculosis testing needs, as well as different tuberculosis incidence rates. The main differences observed regarding age and expertise were considered for correction in the subsequent analyses.
Laboratory throughput and current tests for the diagnosis of active tuberculosis
Of the 723 survey respondents, 690 (95.4%) had access to or were regularly performing laboratory tests for tuberculosis. Table 2 shows the number of diagnostic tests for tuberculosis performed per year and the range of tests to which the survey respondents stated they had access. More than half of the survey respondents had access to laboratory facilities performing more than 1,000 diagnostic tests for tuberculosis per year. As expected, the proportion of respondents with access to a laboratory performing more than 5,000 diagnostic tests for tuberculosis per year was higher among respondents working in low-income countries than among those working in high-income and upper middle-income countries (p < 0.05 for both comparisons).
Table 2. Diagnostic tuberculosis tests in current use and total annual throughput as stated by the respondents.a.
| Variable | Total | Income level of the countries (World Bank classification) | p* | |||
|---|---|---|---|---|---|---|
| High | Upper middle | Lower middle | Low | |||
| (n = 690b ) | (n = 179) | (n = 257) | (n = 162) | (n = 91) | ||
| Proportional distribution, % | 25.94 | 37.25 | 23.48 | 13.19 | ||
| Tuberculosis tests per year | 0.023 | |||||
| < 100 | 70 (10.14) | 25 (13.97) | 28 (10.89) | 13 (8.02) | 3 (3.30) | |
| 100-1,000 | 175 (25.36) | 36 (20.11) | 77 (29.96) | 41 (25.31) | 21 (23.08) | |
| 1,000-5,000 | 187 (27.10) | 56 (31.28) | 68 (26.46) | 42 (25.93) | 21 (23.08) | |
| > 5,000 | 196 (28.41) | 49 (27.37) | 64 (24.90) | 52 (32.10) | 31 (34.07) | |
| Not known | 62 (8.99) | 13 (7.26) | 20 (7.78) | 14 (8.64) | 15 (16.48) | |
| Type of test (multiple answers) | < 0.00001 | |||||
| AFB staining | 627c (90.87) | 158 (88.27) | 228 (88.72) | 155 (95.68) | 85 (93.41) | |
| Solid culture | 509c (73.77) | 142 (79.33) | 187 (72.76) | 111 (68.52) | 68 (74.73) | |
| Liquid culture | 468c (67.83) | 151 (84.36) | 155 (60.31) | 103 (63.58) | 58 (63.74) | |
| First-line drug susceptibility | 500 (72.46) | 140 (78.21) | 174 (67.70) | 121 (74.69) | 65 (71.43) | |
| Second-line drug susceptibility | 317 (45.94) | 102 (56.98) | 99 (38.52) | 78 (48.15) | 38 (41.76) | |
| “In-house” molecular assay | 193 (27.97) | 70 (39.11) | 58 (22.57) | 44 (27.16) | 21 (23.08) | |
| Commercial molecular assay | 413 (59.86) | 145 (81.01) | 131 (50.97) | 90 (55.56) | 47 (51.65) | |
| IGRA | 264 (38.26) | 144 (80.45) | 76 (29.57) | 37 (22.84) | 7 (7.69) | |
| ELISA-based assay (serology) | 124 (17.97) | 31 (17.32) | 63 (24.51) | 18 (11.11) | 12 (13.19) | |
| LFIA | 75 (10.87) | 26 (14.53) | 26 (10.12) | 12 (7.41) | 11 (12.09) | |
| Other | 20 (2.90) | 8 (4.47) | 9 (3.50) | 3 (1.85) | 0 (0.00) | |
| Any serological test (ELISA+LFIA) | 175 (25.36) | 50 (27.93) | 76 (29.57) | 27 (16.67) | 22 (24.18) | 0.0723 |
| Any molecular assay | 488 (70.72) | 157 (87.71) | 154 (59.92) | 115 (70.99) | 62 (68.13) | < 0.00001 |
IGRA: interferon-gamma release assay; and LFIA: lateral flow immunoassay. aValues expressed as n (%), except where otherwise indicated. bIncludes data only from respondents who stated that they were performing tests. cIncludes one respondent working in a country that could not be classified according to the World Bank classification. *Chi-square test, with Bonferroni correction.
Among assays for the diagnosis of active tuberculosis, AFB staining was the most widely available test (available to 90.8% of the survey respondents), followed by solid culture (73.7%). In high-income countries, liquid culture was more widely available than was solid culture (Table 2). As expected, molecular assays were more widely available in high-income countries than in other countries, comparisons being made for commercial molecular assays (p < 0.00001 for all comparisons), in-house molecular assays (p < 0.02 for all comparisons), and any molecular assay (p < 0.00001 for all comparisons). However, the data show that more than two thirds of the respondents in low- and lower middle-income countries had access to molecular assays (Table 2). This contrasts with the availability of interferon-gamma release assays (IGRAs) among survey respondents, which was strongly correlated with the country income classification (p = 0.0026). We found that IGRAs were more widely available in laboratories located in high-income countries than in those located in other countries (p < 0.00001 for all comparisons).
Finally, although the use of the currently available commercial serological tests for tuberculosis has been strongly discouraged by the WHO since 2010,21 the survey data suggest that they remain widely available in tuberculosis laboratories. More than a quarter of the survey respondents stated that either ELISA-based serological tests or lateral flow immunoassays were in use in their laboratories, with no significant differences between countries by income (p = 0.0723 for all comparisons), as shown in Table 2.
Prices of rapid diagnostic tests for tuberculosis
In the multivariate analysis of the responses (Table 3), the prices of rapid tuberculosis assays were found to be associated with the availability of commercial molecular assays and with the availability of AFB staining only, regardless of the country income classification (p < 0.002 for all comparisons). In contrast, the type of employing institution, number of tests performed per year, years of experience in the area of tuberculosis, level of education, and decision-making capacity were not associated with the stated prices for the tests (p > 0.09 for all comparisons, data not shown).
Table 3. Price ranges (in US$), declared by the survey respondents, of rapid tests for the diagnosis of active tuberculosis, excluding labor and overhead.a.
| Parameter | Total | Income level of the countries (World Bank classification) | p | |||
|---|---|---|---|---|---|---|
| High | Upper middle | Lower middle | Low | |||
| Price range (US$) | Users of AFB staining only | |||||
| 1-10 | 123 (25.68) | 16 (14.04) | 30 (17.44) | 47 (36.43) | 30 (46.88) | < 0.00001 |
| 11-20 | 146 (30.48) | 17 (14.91) | 51 (29.65) | 54 (41.86) | 24 (37.50) | |
| 20-30 | 59 (12.32) | 23 (20.18) | 22 (12.79) | 9 (6.98) | 5 (7.81) | |
| 30-50 | 57 (11.90) | 25 (21.93) | 18 (10.47) | 11 (8.53) | 3 (4.69) | |
| > 50 | 94 (19.62) | 33 (28.95) | 51 (29.65) | 8 (6.20) | 2 (3.13) | |
| Subtotal | 479 | 114 | 172 | 129 | 64 | |
| Not known | 244b (33.75) | 77 (40.31) | 91 (34.60) | 43 (25.00) | 32 (33.33) | |
| Total | 723b | 191 | 263 | 172 | 96 | |
| Price range (US$) | Users of molecular assays only | |||||
| 1-10 | 64 (20.71) | 9 (9.57) | 14 (13.46) | 28 (35.90) | 13 (39.39) | < 0.00001 |
| 11-20 | 99 (32.04) | 14 (14.89) | 34 (32.69) | 36 (46.15) | 15 (45.45) | |
| 20-30 | 38 (12.30) | 19 (20.21) | 13 (12.50) | 5 (6.41) | 1 (3.03) | |
| 30-50 | 40 (12.94) | 20 (21.28) | 14 (13.46) | 3 (3.85) | 3 (9.09) | |
| > 50 | 68 (22.01) | 32 (34.04) | 29 (27.88) | 6 (7.69) | 1 (3.03) | |
| Subtotal | 309 | 94 | 104 | 78 | 33 | |
| Not known | 104 (25.18) | 51 (35.17) | 27 (20.61) | 12 (13.33) | 14(29.79) | |
| Total | 413 | 145 | 131 | 90 | 47 | |
| Users of AFB staining and commercial molecular assays | ||||||
| Price range (US$) | Total | AFB staining plus commercial molecular assays | AFB staining only | Commercial molecular assays only | ||
| 1-10 | 113 (25.11) | 64 (21.84) | 49 (34.75) | 0 (0.00) | 0.0262 | |
| 11-20 | 134 (29.78) | 91 (31.06) | 35 (24.82) | 8 (50.00) | ||
| 20-30 | 56 (12.44) | 35 (11.95) | 18 (12.77) | 3 (18.75) | ||
| 30-50 | 55 (12.22) | 37 (12.63) | 15 (10.64) | 3 (18.75) | ||
| > 50 | 92 (20.44) | 66 (22.53) | 24 (17.02) | 2 (12.50) | ||
| Subtotal | 450 | 293 | 141 | 16 | ||
| Not known | 202 (30.98) | 95 (24.48) | 98 (41.00) | 9 (36.00) | ||
| Total | 652 | 388 | 239 | 25 | ||
Values expressed as n (%), except where otherwise indicated. bIncludes one respondent working in a country that could not be classified according to the World Bank classification.
As can be seen in Table 3, more than a third of the survey respondents did not know the current prices (i.e., the costs, excluding labor and overhead) of rapid tests for the diagnosis of tuberculosis. The prices stated by the respondents working in high-income countries were generally higher than the prices stated by those working in the other countries (p < 0.0055 for all comparisons). Similarly, the stated prices were higher in upper middle-income countries than in lower middle- and low-income countries (p < 0.00001 for all comparisons). As expected, the use of commercial molecular assays represented the main reason for high prices of tests for the diagnosis of active tuberculosis. As can be seen in Table 3, the survey respondents who had access only to AFB staining stated lower prices than did those who had access to AFB staining plus molecular assays and those who had access only to molecular assays (p < 0.05 for all comparisons).
Impact of the Xpert assay on the availability and pricing of molecular tests
For survey respondents working in lower middle- and low-income countries where molecular assays were available, the price range most often indicated for rapid tests was US$ 10-20 (Table 3). This is in accordance with the pricing negotiated by the Foundation for Innovative New Diagnostics for the Xpert assay in low-resource settings. Therefore, we attempted to ascertain whether access to that specific test plays a significant role in determining the rapid test price range indicated in lower middle- and low-income countries.
Among 413 survey respondents who reported having access to commercial molecular assays, 193 (46.7%) reported using the Xpert assay alone or in combination with other molecular assays for the diagnosis of tuberculosis. As shown in Table 4, the proportions of respondents using Xpert assays were higher than those of respondents using other molecular assays in the lower middle- and low-income countries, and that ratio was lower in the high-income and upper middle-income countries (p < 0.05 for all comparisons).
Table 4. Declared use of molecular assays among the survey respondents.a.
| Test used | Total | Income level of the countries (World Bank classification) | p | |||
|---|---|---|---|---|---|---|
| High | Upper middle | Lower middle | Low | |||
| Xpert MTB/RIF | 193 (46.73) | 52 (35.86) | 55 (41.98) | 50 (55.56) | 36 (76.60) | < 0.00001 |
| Other molecular assays | 220 (53.27) | 92 (63.45) | 76 (58.02) | 41 (45.56) | 11 (23.40) | |
| Total | 413 | 145 | 131 | 90 | 47 | |
Xpert MTB/RIF: rapid molecular assay for the identification of Mycobacterium tuberculosis and the detection of rifampin resistance. aValues expressed as n (%), except where otherwise indicated.
Table 5 shows the reported prices for rapid tests among molecular assay users, stratified by the use of Xpert assays. Apart from the differences observed among countries by income, no significant differences were observed between the prices reported for the Xpert assay and those reported for other molecular assays in each income subgroup. This suggests that manufacturers of other commercial molecular assays have adjusted the pricing of their assays to match that of the Xpert assay. Table 6 shows the level of experience of the survey respondents with molecular tests, stratified by use of the Xpert assay and other molecular assays.
Table 5. Rapid tuberculosis test prices, as reported by the molecular assay users surveyed, stratified by use of the Xpert assay and other molecular assays.a.
| Price range (US$) | Total | Income level of the countries (World Bank classification) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| High | Upper middle | Lower middle | Low | |||||||
| Molecular assay use | Molecular assay use | Molecular assay use | Molecular assay use | Molecular assay use | ||||||
| Xpert | Other | Xpert | Other | Xpert | Other | Xpert | Other | Xpert | Other | |
| 1-10 | 40 (26.32) | 24 (15.29) | 5 (12.20) | 4 (7.55) | 6 (13.33) | 8 (13.56) | 18 (43.90) | 10 (27.03) | 11 (44.00) | 2 (25.00) |
| 11-20 | 54 (35.53) | 45 (28.66) | 7 (17.07) | 7 (13.21) | 17 (37.78) | 17 (28.81) | 19 (46.34) | 17 (45.95) | 11 (44.00) | 4 (50.00) |
| 20-30 | 17 (11.18) | 21 (13.38) | 10 (24.39) | 9 (16.98) | 5 (11.11) | 8 (13.56) | 1 (2.44) | 4 (10.81) | 1 (4.00) | 0 (0.00) |
| 30-50 | 12 (7.89) | 28 (17.83) | 6 (14.63) | 14 (26.42) | 4 (8.89) | 10 (16.95) | 0 (0.00) | 3 (8.11) | 2 (8.00) | 1 (12.50) |
| > 50 | 29 (19.08) | 39 (24.84) | 13 (31.71) | 19 (35.85) | 13 (28.89) | 16 (27.12) | 3 (7.32) | 3 (8.11) | 0 (0.00) | 1 (12.50) |
| Subtotal | 152 | 157 | 41 | 53 | 45 | 59 | 41 | 37 | 25 | 8 |
| p | 0.0621 | 0.5569 | 0.7336 | 0.1354 | 0.3818 | |||||
| Do not know | 40 (20.83) | 64 (28.96) | 12 (22.64) | 39 (42.39) | 10 (18.18) | 17 (22.37) | 9 (18.00) | 3 (7.50) | 9 (26.47) | 5 (38.46) |
| Total | 192 | 221 | 53 | 92 | 55 | 76 | 50 | 40 | 34 | 13 |
Xpert: rapid molecular assay for the identification of Mycobacterium tuberculosis and the detection of rifampin resistance. aValues expressed as n (%), except where otherwise indicated.
Table 6. Experience with molecular tests among survey respondents, stratified by use of the Xpert assay and other molecular assays.a.
| Test used | Income level of the countries (World Bank classification) | p* | |||||||
|---|---|---|---|---|---|---|---|---|---|
| High income | Upper middle income | Lower middle income | Low-income | ||||||
| Years of experience with molecular assays | |||||||||
| 1-10 | > 10 | 1-10 | > 10 | 1-10 | > 10 | 1-10 | > 10 | ||
| Xpert MTB/RIF | 23 (46.94) | 26 (53.06) | 46 (86.79) | 7 (13.21) | 42 (84.00) | 8 (16.00) | 30 (88.24) | 4 (11.76) | < 0.00001 |
| Other molecular assays | 29 (35.80) | 52 (64.20) | 45 (66.18) | 23 (33.82) | 20 (74.07) | 7 (25.93) | 6 (75.00) | 2 (25.00) | 0.003 |
| p* | 0.2846 | 0.0742 | 0.3891 | 0.3923 | |||||
Values expressed as n (%), except where otherwise indicated. *Corrected for respondent age.
Acceptability of novel rapid diagnostic tests for tuberculosis
The level of acceptability (an indirect indicator of the need for novel rapid diagnostic tests for tuberculosis) was determined for two different prototype assays: a novel molecular assay in line with the WHO TPP for a rapid sputum-based test for detecting M. tuberculosis; and a novel serological test in line with the WHO TPP for a biomarker-based triage test. Table 7 summarizes the results regarding the acceptability of the two assays among the survey respondents. More than 80% of the respondents would accept either novel test, provided that certain criteria were met, and there was no statistical difference between the two tests in terms of their acceptability (p = 0.084).
Table 7. Acceptability of a novel rapid sputum-based molecular assay and a novel serological assay.a.
| Acceptability | Total | Income level of the countries (World Bank classification) | p | |||
|---|---|---|---|---|---|---|
| High | Upper middle | Lower middle | Low | |||
| Novel rapid molecular assay (prototype of a sputum-based assay) | ||||||
| Not acceptable | 38 (5.26) | 9 (4.71) | 12 (4.56) | 7 (4.07) | 10 (10.42) | 0.0825 |
| Acceptable | 622b (86.03) | 157 (82.20) | 235 (89.35) | 153 (88.95) | 76 (79.17) | |
| Do not know | 63 (8.71) | 25 (13.09) | 16 (6.08) | 12 (6.98) | 10 (10.42) | |
| Total | 723b | 191 | 263 | 172 | 96 | |
| Acceptable only if fully validated | 355 (57.07) | 70 (44.59) | 140 (59.57) | 101 (66.01) | 44 (57.89) | 0.0025 |
| Acceptable even if still being validatedc | 227 (36.50) | 78 (49.68) | 81 (34.47) | 41 (26.80) | 27 (35.53) | |
| Acceptable (manufacturer’s assurance sufficient) | 40b (6.43) | 9 (5.73) | 14 (5.96) | 11 (7.19) | 5 (6.58) | |
| Novel serological assay (prototype of a biomarker-based triage test) | ||||||
| Not acceptable | 61 (8.44) | 20 (10.47) | 19 (7.22) | 17 (9.88) | 5 (5.21) | 0.0383 |
| Acceptable | 591b (81.74) | 141 (73.82) | 227 (86.31) | 140 (81.40) | 82 (85.42) | |
| Do not know | 71 (9.82) | 30 (15.71) | 17 (6.46) | 15 (8.72) | 9 (9.38) | |
| Total | 723b | 191 | 263 | 172 | 96 | |
| Acceptable only if fully validated and in line with WHO indications | 378b (63.96) | 78 (55.32) | 144 (63.44) | 100 (71.43) | 55 (67.07) | 0.1250 |
| Acceptable even if still being validated,c provided it was developed in line with WHO indications | 193 (32.66) | 59 (41.84) | 73 (32.16) | 36 (25.71) | 25 (30.49) | |
| Acceptable (manufacturer’s assurance sufficient) | 20 (3.38) | 4 (2.84) | 10 (4.41) | 4 (2.86) | 2 (2.44) | |
Values expressed as n (%), except where otherwise indicated. bIncludes one respondent working in a country that could not be classified according to the World Bank classification. cIf sufficiently independent peer-reviewed data are available.
With regard to novel molecular assays, responses regarding general acceptability did not differ significantly among countries stratified by World Bank classification income level (p = 0.0825). The level of acceptance was significantly associated with a higher level of respondent education, defined as a doctorate or professorship (p < 0.002, data not shown), although not with the respondent having a decision-making role, respondent age, or respondent years of experience in the area of tuberculosis (p > 0.05 for all comparisons). It is noteworthy that the conditional acceptance based on validation differed between country types by income (p < 0.0025): survey respondents working in high-income countries were most likely to accept a test still undergoing validation (p < 0.05 for all comparisons), as shown in Table 7. Acceptance of a molecular assay still undergoing validation was positively associated with a higher level of respondent education (p < 0.003, data not shown) and expertise in immunology (p < 0.002, data not shown), whereas it showed no association with the respondent having a decision-making role, respondent age, or respondent years of experience in the area of tuberculosis (p > 0.05, data not shown).
In contrast to the responses regarding the general acceptability of molecular assays, those regarding that of a novel serological assay differed significantly among countries by income level (p = 0.0283). As can be seen in Table 7, fewer than three quarters of respondents working in high-income countries stated that such a test would be acceptable, which was significantly lower than that found for respondents working in other countries (p < 0.05 for all comparisons). Additional analyses revealed no association between acceptability and the level of education of the respondent, respondent age, and respondent years of experience in the area of tuberculosis (p > 0.05 for all comparisons, data not shown), whereas the respondent having a decision-making role showed borderline significance (p = 0.05 for all comparisons, data not shown).
Acceptability of novel rapid diagnostic tests for tuberculosis in relation to their performance characteristics
Although more than 80% of the 723 survey respondents indicated general acceptance of a novel rapid diagnostic test for tuberculosis-622 (86.0%) indicating acceptance of a molecular test and 591 (81.7%) indicating acceptance of a serological test-391 (54.1%) indicated that their acceptance depended on test accuracy. The results regarding the acceptability of novel tuberculosis tests based on their performance characteristics are summarized in Table 8. Nearly two thirds of the respondents indicated that they would expect a minimum sensitivity of > 90% (i.e., within the range of optimal sensitivity for the WHO TPPs for biomarker-based tests and rapid sputum-based tests). Fewer than 7% of the respondents indicated that they would be satisfied with a test sensitivity ≤ 80%. The expected sensitivity stated by respondents was not found to be associated with variables related to the respondent (years of experience in the area of tuberculosis, age, level of education, having a decision-making role, main area of expertise, and field of interest within the area of tuberculosis) or with the country income level (p > 0.05 for all comparisons, data not shown).
Table 8. Minimum sensitivity and specificity expected by survey respondents for novel tests for the diagnosis of active tuberculosis.a.
| Parameter | Total | Income level of the countries (World Bank classification) | p | |||
|---|---|---|---|---|---|---|
| High | Upper middle | Lower middle | Low | |||
| Expected sensitivity | ||||||
| > 50% | 2 (0.51) | 0 (0.00) | 0 (0.00) | 1 (1.35) | 1 (2.08) | 0.0976 |
| > 60% | 4 (1.03) | 1 (0.76) | 1 (0.74) | 0 (0.00) | 2 (4.17) | |
| > 70% | 21 (5.40) | 10 (7.63) | 6 (4.41) | 2 (2.70) | 3 (6.25) | |
| > 80% | 104 (26.74) | 38 (29.01) | 42 (30.88) | 19 (25.68) | 5 (10.42) | |
| > 90% | 243 (62.47) | 78 (59.54) | 84 (61.76) | 48 (64.86) | 33 (68.75) | |
| Do not know | 15 (3.86) | 4 (3.05) | 3 (2.21) | 4 (5.41) | 4 (8.33) | |
| Total | 389 | 131 | 136 | 74 | 48 | |
| Expected specificity | ||||||
| > 99% | 99 (25.65) | 31 (23.66) | 34 (25.37) | 23 (31.08) | 11 (23.40) | 0.2970 |
| > 95% | 174 (45.08) | 66 (50.38) | 57 (42.54) | 29 (39.19) | 22 (46.81) | |
| > 90% | 58 (15.03) | 20 (15.27) | 25 (18.66) | 10 (13.51) | 3 (6.38) | |
| > 80% | 41 (10.62) | 10 (7.63) | 16 (11.94) | 8 (10.81) | 7 (14.89) | |
| Do not know | 14 (3.63) | 4 (3.05) | 2 (1.49) | 4 (5.41) | 4 (8.51) | |
| Total | 386 | 131 | 134 | 74 | 47 | |
Values expressed as n (%), except where otherwise indicated.
Only 10.6% of the respondents stated that a specificity of 80-90%, the target specificity level stated in the WHO TPP for a triage test for active tuberculosis, would be acceptable. More than two thirds of the respondents stated that a novel test should have a minimum specificity of 95%. As with sensitivity, the level of specificity expected was not found to be associated with variables related to the respondent (years of experience in the area of tuberculosis, age, level of education, having a decision-making role, main area of expertise, and field of interest within the area of tuberculosis) or with the country income level (p > 0.05 for all comparisons, data not shown).
DISCUSSION
Tuberculosis control policies1,2 are intimately related to the availability of effective tests for the diagnosis of active tuberculosis and for the identification of latent tuberculosis infection. Improved tuberculosis diagnostics, together with other interventions, are key to reaching the goal of entering the pre-elimination phase by 2035 in countries with a low incidence of the disease.2,3,5 In this context, the WHO released indications for the TPP for tuberculosis tests in 2014, with the specific aim of setting the agenda for the development of rapid tests for the diagnosis of active tuberculosis.8 However, policy application and the acceptance of novel tests could face additional barriers, including the perceptions and needs of tuberculosis specialists.
In this paper, we have reported the results of a large global survey on tuberculosis diagnostics, including tests in current use and novel tests, establishing end-user acceptance based upon performance characteristics, the availability of validation data, and pricing, taking the WHO TPPs into account. The survey respondents comprised 723 tuberculosis specialists from 114 countries and territories, with good coverage of regions with a high incidence of tuberculosis (Figure 1), and we therefore believe that the data collected are representative. To our knowledge, this is the largest study to date on the opinions and perceptions of the end users of tuberculosis tests regarding novel tuberculosis diagnostics.
Our data show that AFB staining continues to be the most widely available test for tuberculosis, more than 90% of the survey respondents having access to this test. However, only three quarters of the respondents had access to culture and drug-susceptibility tests to properly identify the pathogen and determine the resistance pattern by phenotypic assays, which are still considered the gold standard. Our data also indicate that IGRAs are largely used by professionals for the diagnosis of tuberculosis infection mainly in high-income countries. Replacing tuberculin skin tests with IGRAs in middle- and low-income countries has been discouraged by the WHO, because IGRAs are technically complex and far more expensive, as well as because, despite their higher costs (because IGRAs usually also require laboratory technicians trained in their use), their performance is comparable to that of tuberculin skin tests.24 Despite their suboptimal performance,24,25 as well as the limitations to their use in young children, the elderly, and immunocompromised patients,26-30 IGRAs are still widely used in high-income countries. However, tuberculosis pre-elimination and elimination policies will require novel tests for the rapid identification of individuals infected with tuberculosis and of those progressing to active tuberculosis, ideally with high sensitivity, high specificity, and low costs.31
More than 70% of the survey respondents stated that they had access to in-house or commercial molecular assays for the diagnosis of tuberculosis. In high-income countries, the large majority of respondents had access to such molecular assays. Even in lower income countries, approximately two thirds of the respondents had access to such assays, likely as a reflection of the large-scale roll-out of the Xpert assay, driven by WHO policy and a preferential pricing structure for low resource settings.10 In addition, we found that the introduction of the Xpert assay at a subsidized price10,18,22 resulted in a general alignment of molecular assay prices. In fact, the prices of first-generation commercial molecular assays (e.g., Amplicor and GeneProbe) were in the range of US$30-50 per test during the 2000-2008 period.32,33 The present survey indicates that the current molecular assays are mostly in the US$11-20 price range, with common geographic pricing policies and no significant differences in price ranges between the Xpert assay and other molecular assays. A policy of sustained support and implementation of efficient second-generation assays will likely contribute to further increasing access to high-quality diagnostics, especially in low-income countries.
Due to the low reproducibility and poor specificity of the currently available serological tests for the diagnosis of active tuberculosis (lateral flow immunoessays in particular),19,20 the WHO has issued a recommendation against their use.21 It was therefore surprising to find that more than a quarter of the survey respondents stated that they were currently using such tests. This is a cause for concern, because the use of these poorly performing tests results not only in significant expenditures but also in inappropriate management of patients. However, given that serological tests for tuberculosis might have some key advantages (including short assay times and comparatively low prices), there is a need for further research on novel serological tests developed in line with the WHO TPPs. It was also of note that the clear majority of respondents stated that they would find a novel serological assay acceptable, as long as sufficient supporting data were available.
The survey results indicate that over 80% of tuberculosis specialists are likely to accept a novel test for the rapid diagnosis of active tuberculosis if it is offered at an affordable price. Our results suggest that there is a perceived need for rapid assays that are more efficient, as well as that the acceptability of such assays is influenced by cost, respondents wanting the prices to be lower than those of the existing assays. This underscores the fact that, even with the preferential pricing that is currently available to facilities in low-resource countries, the prices of the tests are still perceived as prohibitive by some tuberculosis experts.
Although the WHO developed TPPs for rapid tests for the diagnosis of tuberculosis three years ago,8 nearly half of the tuberculosis experts surveyed stated they would accept a novel test for the diagnosis of tuberculosis even in the absence of robust data on test performance (based on assurances from the manufacturer alone or on preliminary data obtained while the test is still undergoing validation). Our findings indicate that, in addition to setting policies, there is a need to educate the end users of rapid tests for the diagnosis of tuberculosis.
ACKNOWLEDGMENTS
We thank the Global Laboratory Initiative of the WHO, the Associazione Microbiologi Clinici Italiani (AMCLI, Italian Society of Clinical Microbiology), the European Society of Mycobacteriology (ESM), the Paediatric Tuberculosis Network European Trials Group (ptbnet), and the Tuberculosis Network European Trialsgroup (TBNET) Clinical Research Collaboration, for sharing the survey link among the tuberculosis specialists in their networks. We are also grateful to all of the survey respondents for kindly supporting this initiative.
The authors are immensely grateful for the contribution that Prof. Massimo Amicosante made as a man and as a scientist in the fight against tuberculosis.
May he rest in peace.
Study carried out under the auspices of the TB Diagnostic Survey Working Group.
Financial support: None.
The TB Diagnostic Survey Working Group members (in alphabetical order): Abdulraheem A. M. Al-Hattami (National TB Programme, Sana’a, Yemen); Abebaw Kebede (Ethiopian Public Health Institute, Addis Ababa, Ethiopia); Adrian Rendon (University Hospital of Monterrey UANL, Monterrey, Mexico); Alberto L. Garcia-Basteiro (Centro de Investigação em Saude de Manhiça, Manhiça, Mozambique); Aliyu Samuel Abdulmumuni (State Specialist Hospital Gombe, Gombe, Nigeria); Amos Nota (SADC HIV/AIDS Cross Border Initiative, Chirundu, Zambia); Analita Pace-Asciak (Infectious Disease Prevention and Control Unit, Ministry of Health, La Valletta, Malta); Andre Loxton (Stellenbosch University, Cape Town, South Africa); Angshu Bhowmik (Homerton University Hospital, London, UK); Antonino Catanzaro (University of California San Diego, San Diego, CA, USA); Aschalew Worku (St Peter Hospital, Addis Ababa, Ethiopia); Basirudeen Syed Ahamed Kabeer (National Institute for Research in Tuberculosis, Chennai, India); Branislava Savic (National reference laboratory for TB, Institute of Microbiology and Immunology, University of Belgrade, Belgrade, Serbia); Brian Bakoko Nselebete (National TB Programme, Kinshasa, Democratic Republic of the Congo); Carla Montesano (University of Rome “Tor Vergata”, Rome, Italy); Carlotta Montagnani (Anna Meyer Children’s University Hospital, Florence, Italy); Caterina Mammina (University of Palermo, Palermo, Italy); Celine Nkenfou (Centre Chantal Byia, Yaounde, Cameroon), Charlotte Kvasnovsky (University of Maryland Medical Center, Baltimore, MD, USA); Cristina Braz (Brazilian Thoracic Society, Brasilia, Brazil); Daniel Blázquez-Gamero (12 de Octubre University Hospital, Madrid, Spain); Daniela M Cirillo (IRCCS San Raffaele Scientific Institute, Milan, Italy); Dawit Kebede Huluka (Addis Ababa University College of Health Sciences, Addis Ababa, Ethiopia); Diah Handayani (University Indonesia, Jakarta, Indonesia); Dimitrios Papaventsis (National Reference Laboratory for Mycobacteria, Sotiria Chest Diseases Hospital of Athens, Athens, Greece); Domingo Palmero (Hospital Muñiz, Buenos Aires, Argentina); Donald Catanzaro (University of Arkansas, Fayetteville, AR, USA); Duncan Chanda (University of Zambia School of Medicine, Lusaka, Zambia); Elmira Gurbanova (Main Medical Department of the Ministry of Justice, Baku, Azerbaijan); Eman Sobh (Al-Azhar University, Cairo, Egypt); Fikru Melaku Gebremariam (Oromia Public Health Research Laboratory, Oromia, Ethiopia); Florence Komurian Pradel (Fondation Mérieux, Lyon, France); Gaetano Brindicci (Santa Maria della Misericordia Hospital, Urbino, Italy); Giovanni Sotgiu (University of Sassari, Sassari, Italy); Giuseppina De Iaco (“Ospedali Riuniti Ancona”, Ancona, Italy); Grace Kahenya (University of Lusaka, Lusaka, Zambia); Grace Nwankwo (Federal Teaching Hospital, Abakaliki, Nigeria); Harald Hoffmann (Synlab MVZ Gauting, Gauting, Germany); Hebert Mutunzi (Ministry of Health and Child Care, Harare, Zimbabwe); Ilora Kenechukwu (Lyienu Mission Hospital, Ogidi, Nigeria); Ivan Pavic (Children’s Hospital Zagreb, Zagreb, Croatia); Jean-Pierre Mukeba (Coordination Provinciale Lepre et Tuberculose du Haut-Katanga, Lubumbashi, Democratic Republic of Congo); Jesse Wambugu (Foundation for Innovative New Diagnostics [FIND], Nairobi, Kenya); Kedir Abdella Abdulsemed (Jimma University Mycobacteriology Research Center, Jimma, Ethiopia); Kingsley Nnanna Ukwaja (Federal Teaching Hospital, Abakaliki, Nigeria); Lanfranco Fattorini (Italian National Institute of Health, Rome, Italy); Lorenzo Guglielmetti (Bligny Hospital, Paris, France); Lorenzo Zammarchi (University of Florence, Florence, Italy); Luis Anibarro (Unidad de Tuberculosis, Complexo Hospitalario de Pontevedra, Pontevedra, Spain); Lynn S. Zijenah (University of Zimbabwe College of Health Sciences, Harare, Zimbabwe); Marc Lipman (University College London, London, UK); Mariya Ivanovska (Medical University of Plovdiv, Plovdiv, Bulgaria); Maria Nikolova (National Center of Infectious and Parasitic Diseases, Sofia, Bulgaria); Martin Castellanos Joya (Ministry of Health, Mexico City, Mexico); Maryline Bonnet (Institut de Recherche pour le Développement, INSERM U1175, Montpellier, France); Master Chisale (Mzuzu Central Hospital, Mzuzu, Malawi); Mathilde Frechet Jachym (Sanatorium Bligny, Briss Sous Forges, France); Mohamed Elmi (Ministry of Health, Mogadishu, Somalia); Muktar A. Gadanya (Aminu Kano Teaching Hospital/Bayero University, Kano, Nigeria); Muluwork Getahun (Ethiopian Public Health Institute, Addis Ababa, Ethiopia); Nicolas Veziris (Centre National de Référence des Mycobactéries, APHP, UPMC Paris, Paris, France); Nii Nortey Hanson-Nortey (National TB Programme, Accra, Ghana); Ogonna N.O. Nwankwo (University of Calabar teaching Hospital, Calabar, Nigeria); Paola Del Monte (University of Bologna, Bologna, Italy); Rachid Fourati (Direction de Soins de Sainte de Base, Tunis, Tunisia); Rafael Laniado-Laborín (Hospital General Tijuana, Tijuana, Mexico); Rakesh Lodha (All India Institute of Medical Sciences, New Delhi, India); Rebecca Wong (Society for Thoracic Disease, Beijing, China); Regina Bhebhe (National Tuberculosis Reference Laboratory, Harare, Zimbabwe); Roberto de la Tour (Medicine Sans Frontieres, OCG, Geneva, Switzerland); Roberto Targa Ferreira (Hospital N. S. da Conceição, Conceição, Brazil); Sambo Boy (National Center for Tuberculosis and Leprosy Control/WHO-Special Service Agreement [CENAT/WHO-SSA], Phnom Penh, Cambodia); Samuel Eyanu (National TB Reference Laboratory, Kampala, Uganda); Sarman Singh (All India Institute of Medical Sciences, New Delhi, India); Silva Tafaj (University Hospital “Shefqet Ndroqi”, Tirana, Albania); Simone A Joosten (Leiden University Medical Center, Leiden, the Netherlands); Steven Callens (Ghent University Hospital, Ghent, Belgium); Sylvester Moyo (Clinton Health Access Initiative, Mbabane, Swaziland); Teklu Molie Tao (Dire Dawa Regional Health Bureau, Dire Dawa, Ethiopia); Tewodros Haile Gebremariam (Addis Ababa University College of Health Sciences, Addis Ababa, Ethiopia); Thomas Panwal Meshak (Institute of Human Virology, Abuja, Nigeria); Tomas Perez-Porcuna (Hospital Universitaria Mútua Terrassa, Barcelona, Spain); Tuula Vasankari (Filha and University of Turku, Turku, Finland); Valeria Cavalcanti Rolla (National Institute of Infectious Diseases Evandro Chagas - Fundação Oswaldo Cruz [Fiocruz, Oswaldo Cruz Foundation], Rio de Janeiro, Brazil); Varinder Singh (Lady Hardinge Medical College, New Delhi, India); Vinod H Ratageri (Karnataka Institute of Medical Sciences, Karnataka, India); Vladimir Milanov (University Hospital for Respiratory Diseases “St. Sofia”, Sofia, Bulgaria); Yuri Rosati (Ospedale Provinciale Macerata, Macerata, Italy); and Zhenia Fuentes-Alcala (Hospital Dr Jose Ignacio Baldo, El Algodonal, Caracas, Venezuela).
REFERENCES
- 1.1 World Health Organization [homepage on the Internet]. Geneva: World Health Organization; [cited 2016 Oct 1]. Global tuberculosis report 2016. [Adobe Acrobat document, 214p.]. Available from: http://www.who.int/tb/publications/global_report/en/; World Health Organization . Global tuberculosis report 2016. Geneva: World Health Organization; 2016. http://www.who.int/tb/publications/global_report/en [Google Scholar]
- 2.2 D'Ambrosio L, Dara M, Tadolini M, Centis R, Sotgiu G, van der Werf MJ, et al. Tuberculosis elimination: theory and practice in Europe. Eur Respir J. 2014;43(5):1410-20. https://doi.org/10.1183/09031936.00198813 [DOI] [PubMed]; D'Ambrosio L, Dara M, Tadolini M, Centis R, Sotgiu G, van der Werf MJ. Tuberculosis elimination theory and practice in Europe. Eur Respir J. 2014;43(5):1410–1420. doi: 10.1183/09031936.00198813. https://doi.org/10.1183/09031936.00198813 [DOI] [PubMed] [Google Scholar]
- 3.3 Kunnath-Velayudhan S, Gennaro ML. Immunodiagnosis of tuberculosis: a dynamic view of biomarker discovery. Clin Microbiol Rev. 2011;24(4):792-805. https://doi.org/10.1128/CMR.00014-11 [DOI] [PMC free article] [PubMed]; Kunnath-Velayudhan S, Gennaro ML. Immunodiagnosis of tuberculosis a dynamic view of biomarker discovery. Clin Microbiol Rev. 2011;24(4):792–805. doi: 10.1128/CMR.00014-11. https://doi.org/10.1128/CMR.00014-11 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.4 Tiberi S, D'Ambrosio L, De Lorenzo S, Viggiani P, Centis R, Migliori GB. Tuberculosis elimination, patients' lives and rational use of new drugs: revisited. Eur Respir J. 2016;47(2):664-7. https://doi.org/10.1183/13993003.01297-2015 [DOI] [PubMed]; Tiberi S, D'Ambrosio L, De Lorenzo S, Viggiani P, Centis R, Migliori GB. Tuberculosis elimination, patients' lives and rational use of new drugs revisited. Eur Respir J. 2016;47(2):664–667. doi: 10.1183/13993003.01297-2015. https://doi.org/10.1183/13993003.01297-2015 [DOI] [PubMed] [Google Scholar]
- 5.5 Lönnroth K, Migliori GB, Abubakar I, D'Ambrosio L, de Vries G, Diel R et al. Towards tuberculosis elimination: an action framework for low-incidence countries. Eur Respir J. 2015;45(4):928-52. https://doi.org/10.1183/09031936.00214014 [DOI] [PMC free article] [PubMed]; Lönnroth K, Migliori GB, Abubakar I, D'Ambrosio L, de Vries G, Diel R. Towards tuberculosis elimination an action framework for low-incidence countries. Eur Respir J. 2015;45(4):928–952. doi: 10.1183/09031936.00214014. https://doi.org/10.1183/09031936.00214014 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.6 Gaspar RS, Nunes N, Nunes M, Rodrigues VP. Temporal analysis of reported cases of tuberculosis and of tuberculosis-HIV co-infection in Brazil between 2002 and 2012. J Bras Pneumol. 2016;42(6):416-422. https://doi.org/10.1590/s1806-37562016000000054 [DOI] [PMC free article] [PubMed]; Gaspar RS, Nunes N, Nunes M, Rodrigues VP. Temporal analysis of reported cases of tuberculosis and of tuberculosis-HIV co-infection in Brazil between 2002 and 2012. J Bras Pneumol. 2016;42(6):416–422. doi: 10.1590/S1806-37562016000000054. https://doi.org/10.1590/s1806-37562016000000054 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.7 Santos-Neto M, Yamamura M, Garcia MC, Popolin MP, Silveira TR, Arcêncio RA. Spatial analysis of deaths from pulmonary tuberculosis in the city of São Luís, Brazil. J Bras Pneumol. 2014;40(5):543-51. https://doi.org/10.1590/S1806-37132014000500011 [DOI] [PMC free article] [PubMed]; Santos-Neto M, Yamamura M, Garcia MC, Popolin MP, Silveira TR, Arcêncio RA. Spatial analysis of deaths from pulmonary tuberculosis in the city of São Luís, Brazil. J Bras Pneumol. 2014;40(5):543–551. doi: 10.1590/S1806-37132014000500011. https://doi.org/10.1590/S1806-37132014000500011 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.World Health Organization. High-priority target product profiles for new tuberculosis diagnostics. Report of a consensus meeting. Geneva: World Health Organization; 2014.; World Health Organization . High-priority target product profiles for new tuberculosis diagnostics. Report of a consensus meeting. Geneva: World Health Organization; 2014. [Google Scholar]
- 9.Frieden T, editor. Toman's tuberculosis: case detection, treatment, and monitoring: questions and answers. 2nd ed. Geneva: World Health Organization; 2004.; Frieden T. Toman's tuberculosis: case detection, treatment, and monitoring: questions and answers. 2. Geneva: World Health Organization; 2004. [Google Scholar]
- 10.10 Weyer K, Mirzayev F, Migliori GB, Van Gemert W, D'Ambrosio L, Zignol M, et al. Rapid molecular TB diagnosis: evidence, policy making and global implementation of Xpert MTB/RIF. Eur Respir J. 2013;42(1):252-71. https://doi.org/10.1183/09031936.00157212 [DOI] [PubMed]; Weyer K, Mirzayev F, Migliori GB, Van Gemert W, D'Ambrosio L, Zignol M, et al. Rapid molecular TB diagnosis evidence, policy making and global implementation of Xpert MTB/RIF. Eur Respir J. 2013;42(1):252–271. doi: 10.1183/09031936.00157212. https://doi.org/10.1183/09031936.00157212 [DOI] [PubMed] [Google Scholar]
- 11.11 Domínguez J, Boettger EC, Cirillo D, Cobelens F, Eisenach KD, Gagneux S, et al. Clinical implications of molecular drug resistance testing for Mycobacterium tuberculosis: a TBNET/RESIST-TB consensus statement. Int J Tuberc Lung Dis. 2016;20(1):24-42. https://doi.org/10.5588/ijtld.15.0221 [DOI] [PubMed]; Domínguez J, Boettger EC, Cirillo D, Cobelens F, Eisenach KD, Gagneux S. Clinical implications of molecular drug resistance testing for Mycobacterium tuberculosis a TBNET/RESIST-TB consensus statement. Int J Tuberc Lung Dis. 2016;20(1):24–42. doi: 10.5588/ijtld.15.0221. https://doi.org/10.5588/ijtld.15.0221 [DOI] [PubMed] [Google Scholar]
- 12.12 Albert H, Nathavitharana RR, Isaacs C, Pai M, Denkinger CM, Boehme CC. Development, roll-out and impact of Xpert MTB/RIF for tuberculosis: what lessons have we learnt and how can we do better? Eur Respir J. 2016;48(2):516-25. https://doi.org/10.1183/13993003.00543-2016 [DOI] [PMC free article] [PubMed]; Albert H, Nathavitharana RR, Isaacs C, Pai M, Denkinger CM, Boehme CC. Development, roll-out and impact of Xpert MTB/RIF for tuberculosis what lessons have we learnt and how can we do better? Eur Respir J. 2016;48(2):516–525. doi: 10.1183/13993003.00543-2016. https://doi.org/10.1183/13993003.00543-2016 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.13 Barreto LB, Lourenço MC, Rolla VC, Veloso VG, Huf G. Use of amplified Mycobacterium tuberculosis direct test in respiratory samples from HIV-infected patients in Brazil. J Bras Pneumol. 2014;40(2):148-54. https://doi.org/10.1590/S1806-37132014000200008 [DOI] [PMC free article] [PubMed]; Barreto LB, Lourenço MC, Rolla VC, Veloso VG, Huf G. Use of amplified Mycobacterium tuberculosis direct test in respiratory samples from HIV-infected patients in Brazil. J Bras Pneumol. 2014;40(2):148–154. doi: 10.1590/S1806-37132014000200008. https://doi.org/10.1590/S1806-37132014000200008 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.14 Furini AA, Pedro Hda S, Rodrigues JF, Montenegro LM, Machado RL, Franco C, et al. Detection of Mycobacterium tuberculosis complex by nested polymerase chain reaction in pulmonary and extrapulmonary specimens. J Bras Pneumol. 2013;39(6):711-8. https://doi.org/10.1590/S1806-37132013000600010 [DOI] [PMC free article] [PubMed]; Furini AA, Pedro Hda S, Rodrigues JF, Montenegro LM, Machado RL, Franco C. Detection of Mycobacterium tuberculosis complex by nested polymerase chain reaction in pulmonary and extrapulmonary specimens. J Bras Pneumol. 2013;39(6):711–718. doi: 10.1590/S1806-37132013000600010. https://doi.org/10.1590/S1806-37132013000600010 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.15 Moreira Ada S, Huf G, Vieira MA, Fonseca L, Ricks M, Kritski AL. Performance comparison between the mycobacteria growth indicator tube system and Löwenstein-Jensen medium in the routine detection of Mycobacterium tuberculosis at public health care facilities in Rio de Janeiro, Brazil: preliminary results of a pragmatic clinical trial. J Bras Pneumol. 2013;39(3):365-7. https://doi.org/10.1590/S1806-37132013000300014 [DOI] [PMC free article] [PubMed]; Moreira Ada S, Huf G, Vieira MA, Fonseca L, Ricks M, Kritski AL. Performance comparison between the mycobacteria growth indicator tube system and Löwenstein-Jensen medium in the routine detection of Mycobacterium tuberculosis at public health care facilities in Rio de Janeiro, Brazil preliminary results of a pragmatic clinical trial. J Bras Pneumol. 2013;39(3):365–367. doi: 10.1590/S1806-37132013000300014. https://doi.org/10.1590/S1806-37132013000300014 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.16 Telles MA, Menezes A, Trajman A. Bottlenecks and recommendations for the incorporation of new technologies in the tuberculosis laboratory network in Brazil. J Bras Pneumol. 2012;38(6):766-70. https://doi.org/10.1590/S1806-37132012000600013 [DOI] [PubMed]; Telles MA, Menezes A, Trajman A. Bottlenecks and recommendations for the incorporation of new technologies in the tuberculosis laboratory network in Brazil. J Bras Pneumol. 2012;38(6):766–770. doi: 10.1590/s1806-37132012000600013. https://doi.org/10.1590/S1806-37132012000600013 [DOI] [PubMed] [Google Scholar]
- 17.17 Albert H, Nathavitharana RR, Denkinger CM, Isaacs C, Boehme CC. Tuberculosis prevention must integrate technological and basic care innovation. Eur Respir J. 2016;48(5):1531-1532. https://doi.org/10.1183/13993003.01601-2016 [DOI] [PubMed]; Albert H, Nathavitharana RR, Denkinger CM, Isaacs C, Boehme CC. Tuberculosis prevention must integrate technological and basic care innovation. Eur Respir J. 2016;48(5):1531–1532. doi: 10.1183/13993003.01601-2016. https://doi.org/10.1183/13993003.01601-2016 [DOI] [PubMed] [Google Scholar]
- 18.18 McNerney R, Cunningham J, Hepple P, Zumla A. New tuberculosis diagnostics and rollout. Int J Infect Dis. 2015;32:81-6. https://doi.org/10.1016/j.ijid.2015.01.012 [DOI] [PubMed]; McNerney R, Cunningham J, Hepple P, Zumla A. New tuberculosis diagnostics and rollout. Int J Infect Dis. 2015;32:81–86. doi: 10.1016/j.ijid.2015.01.012. https://doi.org/10.1016/j.ijid.2015.01.012 [DOI] [PubMed] [Google Scholar]
- 19.19 Steingart KR, Flores LL, Dendukuri N, Schiller I, Laal S, Ramsay A, et al. Commercial serological tests for the diagnosis of active pulmonary and extrapulmonary tuberculosis: an updated systematic review and meta-analysis. PLoS Med. 2011;8(8):e1001062. https://doi.org/10.1371/journal.pmed.1001062 [DOI] [PMC free article] [PubMed]; Steingart KR, Flores LL, Dendukuri N, Schiller I, Laal S, Ramsay A. Commercial serological tests for the diagnosis of active pulmonary and extrapulmonary tuberculosis an updated systematic review and meta-analysis. PLoS Med. 2011;8(8):e1001062. doi: 10.1371/journal.pmed.1001062. https://doi.org/10.1371/journal.pmed.1001062 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Steingart KR, Ramsay A, Dowdy DW, Pai M. Serological tests for the diagnosis of active tuberculosis: relevance for India. Indian J Med Res. 2012;135(5):695-702. [PMC free article] [PubMed]; Steingart KR, Ramsay A, Dowdy DW, Pai M. Serological tests for the diagnosis of active tuberculosis relevance for India. Indian J Med Res. 2012;135(5):695–702. [PMC free article] [PubMed] [Google Scholar]
- 21.World Health Organization. Commercial serodiagnostic tests for diagnosis of tuberculosis. Policy Statement. Geneva: World Health Organization; 2001. [PubMed]; World Health Organization . Commercial serodiagnostic tests for diagnosis of tuberculosis. Policy Statement. Geneva: World Health Organization; 2001. [PubMed] [Google Scholar]
- 22.22 Migliori GB, Lienhardt C, Weyer K, van der Werf MJ, Blasi F, Raviglione MC. Ensuring rational introduction and responsible use of new TB tools: outcome of an ERS multisector consultation. Eur Respir J. 2014;44(6):1412-7. https://doi.org/10.1183/09031936.00132114 [DOI] [PubMed]; Migliori GB, Lienhardt C, Weyer K, van der Werf MJ, Blasi F, Raviglione MC. Ensuring rational introduction and responsible use of new TB tools outcome of an ERS multisector consultation. Eur Respir J. 2014;44(6):1412–1417. doi: 10.1183/09031936.00132114. https://doi.org/10.1183/09031936.00132114 [DOI] [PubMed] [Google Scholar]
- 23.United Nations. Department of Economic and Social Affairs; Population Division. World Population Ageing 2015. New York City: United Nations; 2015.; United Nations . Department of Economic and Social Affairs; Population Division. World Population Ageing 2015. New York City: United Nations; 2015. [Google Scholar]
- 24.24 Pai M, Denkinger CM, Kik SV, Rangaka MX, Zwerling A, Oxlade O, et al. Gamma interferon release assays for detection of Mycobacterium tuberculosis infection. Clin Microbiol Rev. 2014;27(1):3-20. https://doi.org/10.1128/CMR.00034-13 [DOI] [PMC free article] [PubMed]; Pai M, Denkinger CM, Kik SV, Rangaka MX, Zwerling A, Oxlade O. Gamma interferon release assays for detection of Mycobacterium tuberculosis infection. Clin Microbiol Rev. 2014;27(1):3–20. doi: 10.1128/CMR.00034-13. https://doi.org/10.1128/CMR.00034-13 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.25 Losi M, Knights AJ, Mariani F, Altieri AM, Paone G, Loxton AG, et al. QuantiFERON-TB performance enhanced by novel Mycobacterium tuberculosis-specific antigens. Eur Respir J. 2016;47(2):660-4. https://doi.org/10.1183/13993003.01015-2015 [DOI] [PubMed]; Losi M, Knights AJ, Mariani F, Altieri AM, Paone G, Loxton AG. QuantiFERON-TB performance enhanced by novel Mycobacterium tuberculosis-specific antigens. Eur Respir J. 2016;47(2):660–664. doi: 10.1183/13993003.01015-2015. https://doi.org/10.1183/13993003.01015-2015 [DOI] [PubMed] [Google Scholar]
- 26.26 Edwards A, Gao Y, Allan RN, Ball D, de Graaf H, Coelho T, et al. Corticosteroids and infliximab impair the performance of interferon-? release assays used for diagnosis of latent tuberculosis. Thorax. 2017;72(10):946-949. https://doi.org/10.1136/thoraxjnl-2016-209397 [DOI] [PubMed]; Edwards A, Gao Y, Allan RN, Ball D, de Graaf H, Coelho T. Corticosteroids and infliximab impair the performance of interferon- release assays used for diagnosis of latent tuberculosis. Thorax. 2017;72(10):946–949. doi: 10.1136/thoraxjnl-2016-209397. https://doi.org/10.1136/thoraxjnl-2016-209397 [DOI] [PubMed] [Google Scholar]
- 27.27 Tebruegge M, Ritz N, Curtis N, Shingadia D. Diagnostic Tests for Childhood Tuberculosis: Past Imperfect, Present Tense and Future Perfect? Pediatr Infect Dis J. 2015;34(9):1014-9. https://doi.org/10.1097/INF.0000000000000796 [DOI] [PubMed]; Tebruegge M, Ritz N, Curtis N, Shingadia D. Diagnostic Tests for Childhood Tuberculosis Past Imperfect, Present Tense and Future Perfect? Pediatr Infect Dis J. 2015;34(9):1014–1019. doi: 10.1097/INF.0000000000000796. https://doi.org/10.1097/INF.0000000000000796 [DOI] [PubMed] [Google Scholar]
- 28.28 Tebruegge M, Dutta B, Donath S, Ritz N, Forbes B, Camacho-Badilla K, et al. Mycobacteria-Specific Cytokine Responses Detect Tuberculosis Infection and Distinguish Latent from Active Tuberculosis. Am J Respir Crit Care Med. 2015;192(4):485-99. https://doi.org/10.1164/rccm.201501-0059OC [DOI] [PubMed]; Tebruegge M, Dutta B, Donath S, Ritz N, Forbes B, Camacho-Badilla K. Mycobacteria-Specific Cytokine Responses Detect Tuberculosis Infection and Distinguish Latent from Active Tuberculosis. Am J Respir Crit Care Med. 2015;192(4):485–499. doi: 10.1164/rccm.201501-0059OC. https://doi.org/10.1164/rccm.201501-0059OC [DOI] [PubMed] [Google Scholar]
- 29.29 Tebruegge M, Ritz N, Koetz K, Noguera-Julian A, Seddon JA, Welch SB, et al. Availability and use of molecular microbiological and immunological tests for the diagnosis of tuberculosis in Europe. PLoS One. 2014;9(6):e99129. https://doi.org/10.1371/journal.pone.0099129 [DOI] [PMC free article] [PubMed]; Tebruegge M, Ritz N, Koetz K, Noguera-Julian A, Seddon JA, Welch SB. Availability and use of molecular microbiological and immunological tests for the diagnosis of tuberculosis in Europe. PLoS One. 2014;9(6):e99129. doi: 10.1371/journal.pone.0099129. https://doi.org/10.1371/journal.pone.0099129 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.30 Tebruegge M, de Graaf H, Sukhtankar P, Elkington P, Marshall B, Schuster H, et al. Extremes of age are associated with indeterminate QuantiFERON-TB gold assay results. J Clin Microbiol. 2014;52(7):2694-7. https://doi.org/10.1128/JCM.00814-14 [DOI] [PMC free article] [PubMed]; Tebruegge M, de Graaf H, Sukhtankar P, Elkington P, Marshall B, Schuster H. Extremes of age are associated with indeterminate QuantiFERON-TB gold assay results. J Clin Microbiol. 2014;52(7):2694–2697. doi: 10.1128/JCM.00814-14. https://doi.org/10.1128/JCM.00814-14 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.31 Petruccioli E, Scriba TJ, Petrone L, Hatherill M, Cirillo DM, Joosten SA, et al. Correlates of tuberculosis risk: predictive biomarkers for progression to active tuberculosis. Eur Respir J. 2016;48(6):1751-1763. https://doi.org/10.1183/13993003.01012-2016 [DOI] [PMC free article] [PubMed]; Petruccioli E, Scriba TJ, Petrone L, Hatherill M, Cirillo DM, Joosten SA. Correlates of tuberculosis risk predictive biomarkers for progression to active tuberculosis. Eur Respir J. 2016;48(6):1751–1763. doi: 10.1183/13993003.01012-2016. https://doi.org/10.1183/13993003.01012-2016 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.32 Pinto M, Entringer AP, Steffen R, Trajman A. Cost analysis of nucleic acid amplification for diagnosing pulmonary tuberculosis, within the context of the Brazilian Unified Health Care System. J Bras Pneumol. 2015;41(6):536-8. https://doi.org/10.1590/s1806-37562015000004524 [DOI] [PMC free article] [PubMed]; Pinto M, Entringer AP, Steffen R, Trajman A. Cost analysis of nucleic acid amplification for diagnosing pulmonary tuberculosis, within the context of the Brazilian Unified Health Care System. J Bras Pneumol. 2015;41(6):536–538. doi: 10.1590/S1806-37562015000004524. https://doi.org/10.1590/s1806-37562015000004524 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.33 Ling DI, Flores LL, Riley LW, Pai M. Commercial nucleic-acid amplification tests for diagnosis of pulmonary tuberculosis in respiratory specimens: meta-analysis and meta-regression. PLoS ONE. 2008;3(2):e1536. https://doi.org/10.1371/journal.pone.0001536 [DOI] [PMC free article] [PubMed]; Ling DI, Flores LL, Riley LW, Pai M. Commercial nucleic-acid amplification tests for diagnosis of pulmonary tuberculosis in respiratory specimens meta-analysis and meta-regression. PLoS ONE. 2008;3(2):e1536. doi: 10.1371/journal.pone.0001536. https://doi.org/10.1371/journal.pone.0001536 [DOI] [PMC free article] [PubMed] [Google Scholar]