Abstract
背景与目的
本研究旨在探讨肺癌中miR-218的表达,研究miR-218在肺癌细胞中的功能及其可能的分子机制。
方法
应用实时荧光定量PCR(qRT-PCR)检测15例肺癌组织和15例癌旁组织中miR-218的表达。在肺癌细胞A549中转染miR-218的抑制物(Anti-miR-218),在肺癌细胞HCC4006中转染miR-218的模拟物后,用Transwell实验检测细胞的迁移侵袭能力的变化。用Targetscan和MiRanda软件预测miR-218的可能靶点,转染miR-218的抑制物及模拟物后用qRT-PCR和Western blot检测Robo1的mRNA和蛋白表达水平。用双荧光素酶报告基因方法鉴定miR-218和Robo1的调控关系。用Anti-miR-218、miR-218模拟物或阴性对照与Si-Robo1或Si-NC同时转染细胞,应用Transwell实验检测转染后细胞的侵袭迁移能力的变化。
结果
与癌旁组织比较,肺癌组织中miR-218在肺癌组织中表达水平显著降低(P < 0.01)。在A549细胞中转染miR-218的抑制物,能够显著降低miR-218的表达,促进了细胞的迁移侵袭。在HCC4006中转染miR-218的模拟物能够显著提高miR-218的表达,同时抑制了细胞的迁移侵袭能力。利用生物信息学预测出在Robo1的3′UTR区有miR-218的结合位点,双荧光素酶报告基因实验进一步证实miR-218能够调控Robo1的转录活性。抑制miR-218能够提高Robo1的表达;过表达miR-218显著降低Robo1的表达,且miR-218能够通过调控Robo1影响细胞的迁移侵袭。
结论
MiR-218在肺癌组织中呈现低表达状态,miR-218可能是通过抑制Robo1的表达抑制肺癌细胞侵袭迁移。
Keywords: 肺肿瘤, miR-218, Robo1, 迁移, 侵袭
Abstract
Background and objective
To explore the function and the potential molecular mechanism of miR-218 in lung cancer cell.
Methods
The expression of miR-218 mRNA was determined by real-time PCR in lung cancer tissues, adjacent tissues and lung cancer cells. Transwell assay was used to detect the migration and invasion of A549 cell after transfected with Anti-miR-218 or negative control and HC4006 cell after transfected with miR-218 mimics and miR-218 negative control. Targetscan and MiRanda were used to calculate the potential targets of miR-218 and Luciferase reporter assay was performed to identify that the Robo1 was one target genes of miR-218. Transwell assay was used to detect whether miR-218 regulated the invasion of lung cancer cell transfected with anti-miR-218 or negative control via Robo1.
Results
The expression of miR-218 in the lung cancer tissues was significantly lower than that in the adjacent tissues (P < 0.05). Inhibition of miR-218 improved the migration and invasion of A549 cell. Overexpression of miR-218 suppressed the migration and invasion of HCC4006 cell. The co-transfection of anti-miR-218 or miR-218 mimics and the Robo1 3′UTR increased or reduced the luciferase activity of Robo1 compared with the control group (P < 0.05). Inhibition of miR-218 and Robo1 recovered the invaded cells of A549. Overexpression of miR-218 and inhibition of Robo1 reduced the number of the invased cells of HCC4006. These results suggested that miR-218 banded Robo1 directly and inhibited lung cancer cell invasion by targeting Robo1.
Conclusion
MiR-218 inhibited the migration and invasion of lung cancer cells through regulating Robo1 expression.
Keywords: Lung neoplasms, miR-218, Robo1, Migration, Invasion
肺癌是死亡率最高的癌症之一,肺癌分为非小细胞肺癌和小细胞肺癌,其中80%属于非小细胞肺癌[1]。肺腺癌属于非小细胞肺癌,其侵袭和转移是一个多步骤、多基因参与的复杂过程,在这一过程中有大量的基因发生改变。尽管早期诊断技术有了很大的发展,放化疗技术不断的进步,但肺癌的5年生存率仍然很低[2]。MicroRNA(miRNA)是一类非编码小RNA,长度大约为22个核苷酸左右,越来越多的研究证明miRNA与肿瘤的发生和发展存在着密切的相关性[3]。近年研究发现miR-218能在多种肿瘤中表达,包括肺癌、膀胱癌、鼻咽癌等,且发挥着癌基因或者抑癌基因的作用[4-6],但其作用机制尚未清楚。因此,本实验研究miR-218的功能,寻找它的靶点,探究其在肺癌中的作用机制,以期为肺癌的治疗提供新的靶点和理论依据。
1. 材料与方法
1.1. 一般资料
选择2015年6月-2016年6月解放军总医院第一附属医院手术切除的15例肺腺癌组织及其相应的癌旁组织标本,年龄为32岁-77岁,中位年龄为53岁。按肿瘤-淋巴结-转移(tumor-node-metastasis, TNM)分期,Ⅰ期4例,Ⅱ期5例,Ⅲ期6例。所有患者手术前均未接受放疗、化疗及内分泌治疗。所有患者均己签署知情同意书,手术切除部分组织用于浸泡福尔马林中用于组织切片鉴定,其余组织马上放入液氮中存储待用。
1.2. 试剂
肺腺癌细胞系A549、NCI-H1299、Calu-3、NCI-H2228、NCI-H1975、HCC4006、NCI-H23、NCI-H1435均购于ATCC,DMEM培养液购自Gibic公司,miR-218的抑制物(Anti-miR-218)和对照组(Negative control);Robo-siRNA及对照组干扰片段均由上海吉玛有限公司合成。转染试剂Lipfectmine 2000购于Invitrogen公司,兔源性的一抗Robo1、E-cadherin、N-cadherin、鼠源性的一抗GAPDH抗体购自Santa Cruz公司,二抗均购自北京中杉金桥公司;TRIzol购自Invitrogen公司,反转录及PCR试剂盒购自TAKARA公司。Transwell小室购自美国corning公司。miRNA RT Kit和MiRNA qPCR kit购自上海天根生化公司。
1.3. 方法
1.3.1. 细胞培养
所用的肺腺癌细胞均用DMEM培养液(含10%胎牛血清,100 U/mL青霉素和0.1 mg/mL链霉素)培养,置于37 ℃、体积为5%的CO2培养箱中。
1.3.2. 转染
将Anti-miR-218和negative control,miR-218模拟物及miR-218阴性对照,Robo1-SiRNA和对照Si-Con片段分别与Lip2000混匀,在室温条件下混匀静置20 min后,慢慢滴入培养液中混匀,共培养细胞4 h后,换成新鲜的正常培养液继续培养24 h,再用于后续实验。Anti-miR-218序列为:5′-ACAUGGUUAGAUCAAGCACAA-3′,Negtive control序列为:5′-UUGUACUACACAAAAGUACUG-3′。Robo1 siRNA序列为:Sense: 5′-CCCAAGATTGTCGATCAAdtdt-3′,Antisense:5′-UUGAUCGACAAUCUUGGGdtdt-3′。对照序列si-NC序列为:Sense:5′-AGCGCGCTTTGTAGGATTC-Gdtdt-3′;Antisense:5′-GCAATCCTACAAAGCGCGCTdtdt-3′。miR-218模拟物(mi R-218 mimics)序列为:5′-UUGUGCUUGAUCUAAC-CAUGU-3′,miR-218阴性对照(miR-218 negative control, miR-218NC)序列为:5′-UCACAACCUCCUAGAAAGAGUAGA-3′。
1.3.3. qRT-PCR检测miRNA和mRNA的表达
用TRIzol提取经转染的A549,HCC4006细胞总RNA,分别测定RNA浓度及纯度。采用上海天根生化公司的miRNA RT Kit将miRNA逆转录为cDNA,按照上海天根生化公司的MiRNA qPCR kit说明进行miRNA的PCR反应及定量分析。mRNA定量分析按照TAKARA公司反转录和定量PCR试剂盒说明书操作。Robo1定量PCR引物序列:Forward:5′-CCTGTGTCTACAGACAGCAACATGA-3′,Reverse:5′-GCACTGGAGGTGGTGGAAGA-3′;β-actin Forward:5′-AGCGAGCATCCCCCAAAGTT-3′;Reverse:5′-GGGCACGAAGGCTCATCATT-3′。
1.3.4. 蛋白质印迹检测蛋白的表达
细胞转染培养24 h后,弃培养基,用PBS清洗细胞,加入蛋白裂解液RIPA,12, 000 rpm离心15 min,吸取上清液待测。用BCA试剂盒定量蛋白浓度。在10%的SDS-PAGE凝胶中进行电泳(电压100 V),之后在300 mA的电流下冰浴转膜。转膜后室温下用5%BSA-TBST封闭PVDF膜1 h,在4 ℃条件下孵育一抗(1:1, 000)过夜,0.1%的TBST洗3次,每次5 min。在室温条件下与二抗共孵育1 h,0.1%的TBST洗3次,每次5 min。用化学发光法来检测蛋白表达,试验重复3次。
1.3.5. Transell实验检测细胞迁移及侵袭
转染的细胞经0.25%胰酶消化,用无血清DMEM培养基制成单细胞悬液,用细胞计数板计数。稀释后,取400 µL(约含1×105个细胞)加入到Transwell上室中(孔径为8 μm),在下室中加入500 µL含有15%FBS的DMEM培养液,细胞继续培养20 h。用棉签擦去上室的上表面细胞,PBS清洗2遍,无水甲醇固定20 min;室温下用0.4%的结晶紫染液孵育2 h。在显微镜下拍照,每张膜随机选取上、中、下各3个视野,进行统计分析,每组设3个重复。侵袭实验唯一的区别在于在Transwell上室上表面涂有一层基质胶,能够模仿细胞外基质。其他步骤与迁移实验相同。
1.3.6. 萤光素酶报告基因载体构建
运用生物学信息软件预测miR-218的靶基因,发现Robo1为候选靶基因之一。提取A549细胞基因组DNA,通过PCR扩增Robo1全长的3′UTR序列,扩展引物分别添加Xho Ⅰ和Not Ⅰ酶切位点。Xho Ⅰ和Not Ⅰ双酶切PCR扩增产物,随后将扩增片段连接到psiCHECK-2载体上。连接产物转化感受态DH5α大肠杆菌,酶切鉴定正确的阳性克隆送测序。将构建好的psiCHECK-2-ROBO1-3′UTR与Neg contrtol及Anti-miR-218(100 nmol/L)按Lipofectamine 2000转染试剂盒说明书操作进行共转染A549;将构建好的psiCHECK-2-ROBO1-3′UTR与miR-NC及miR-218 mimics(100 nmol/L)组严格按Lipofectamine 2000转染试剂盒说明书操作进行共转染HCC4006,最后进行双荧光素酶检测。
1.4. 统计学方法
数据用SPSS 13.0软件分析,用均数±标准差(Mean±SD)表示计量资料,组间比较采用t检验,P<0.05为差异有统计学意义。
2. 结果
2.1. MiRNA-218在肺癌组织和肺癌细胞株中的表达
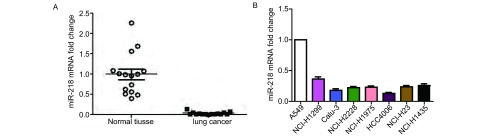
通过定量PCR检测了15例肺癌组织和15例癌旁组织内miR-218的表达,结果显示肺癌组织中miRNA-218的表达明显低于癌旁组织(P<0.05,图 1A)。对肺腺癌细胞株A549、NCI-H1299、Calu-3、NCI-H2228、NCI-H1975、HCC4006、NCI-H23、NCI-H1435中miRNA-218的检测发现细胞株A549中miRNA-218的表达高于其他细胞中miRNA-218的表达,而HCC4006细胞中miRNA-218的表达最低(图 1B)。
1.
miRNA-218在组织和细胞中的表达情况。A:qPCR检测miR-218在肺癌组织及癌旁组织中的表达情况;B:qPCR检测miR-218在肺癌细胞系中的表达情况
Expression of miRNA-218 in tissues and cells. A: qPCR analysis of miR-218 expression in lung cancer tissues and adjacent tissues; B: qPCR analysis of miR-218 expression in lung cancer cell lines.
2.2. 抑制miR-218对肺癌细胞株中的迁移侵袭的影响
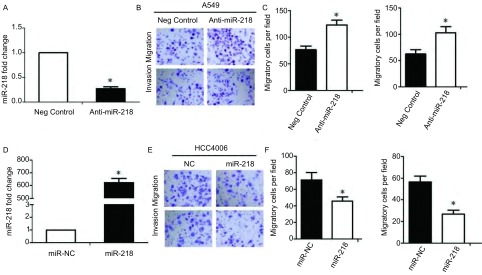
在肺癌细胞系A549中转染Anti-miR-218的实验组及对照组(negative control),用定量PCR检测干扰后的效果,结果显示:细胞转染Anti-miR-218后,miR-218的表达明显降低,为对照组的0.27倍(P<0.05,图 2A)。为了证实miR-218对于细胞迁移侵袭的影响,细胞转染后进行Transwell实验,结果显示转染Anti-miR-218组,细胞迁移数为(123.26±9.17),对照组胞迁移数为(76.62±6.81)(P<0.05,图 2B-图 2C);细胞侵袭数Anti-miR-218实验组为(102.83±11.67),对照组胞侵袭数为(62.43±8.44)(P<0.05,图 2B-图 2C)。同时,我们在HCC4006细胞中转染miR-218的模拟物(miR-218 mimics),结果显示转染后,miR-218表达较对照组显著升高(P<0.05,图 2D);转染组细胞迁移数为(45.58±5.22),对照组胞迁移数为(73.31±8.95)(P<0.05,图 2E-图 2F);转染组细胞侵袭数为(26.84±3.67),对照组胞侵袭数为(56.53±5.46)(P<0.05,图 2E-图 2F)。上述的迁移侵袭结果说明抑制miR-218能够显著增强A549细胞的迁移侵袭能力;过表达miR-218能够显著抑制HCC4006细胞的迁移侵袭能力。
2.
MiR-218影响肺癌细胞的迁移侵袭能力。A:qPCR检测在A549细胞中干扰miR-218后,miR-218的表达;B:干扰miR-218后,细胞的迁移侵袭实验(20×);C:干扰miR-218后,A549细胞迁移侵袭数量的统计分析;D:qPCR检测在HCC4006细胞中转染miR-218 mimics后,miR-218的表达情况;E:转染miR-218 mimics后,HCC4006细胞的迁移侵袭实验(20×);F:转染miR-218 mimics后,HCC4006细胞的迁移侵袭数量的统计分析。
MiR-218 affect the migration and invasion of lung cancer cells. A: qPCR analysis of miRNA-218 expression in A549 cell after transfected with Anti-miR-218; B: Transwell assay analysis of A549 cell after transfected with Anti-miR-218 (20×); C: Statistical analysis the migrated and invaded A549 cells after transfected with Anti-miR-218; D: qPCR analysis of miRNA-218 expression in HCC4006 cell after transfected with miR-218 mimics; E: Transwell assay analysis of HCC4006 cell after transfected with miR-218 mimics (20×); F: Statistical analysis the migrated and invaded HCC4006 cells after transfected with miR-218 mimics.
2.3. 肺癌细胞中miR-218的靶基因预测
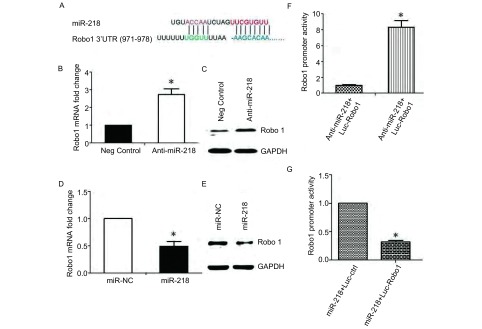
通过Targetscan和MiRanda软件预测miR-218的靶基因,我们发现miR-218能够识别Robo1基因的3′UTR区(图 3A)。我们应用qPCR和蛋白印迹方法,分别检测干扰miR-218后,A549肺癌细胞中Robo1的表达情况;过表达miR-218后,HCC4006细胞中Robo1的表达情况。结果显示Anti-miR-218组中Robo1的mRNA表达是对照组的2.87倍(图 3B,P<0.05);Western blot结果显示Anti-miR-218组中Robo1的蛋白表达量明显高于对照组(图 3C),结果提示我们抑制miR-218增加了A549细胞中Robo1的表达。在HCC4006细胞中转染miR-218 mimics,发现miR-218表达显著降低,为对照组的0.48倍(图 3D,P<0.05);Western blot结果显示转染组中Robo1的蛋白表达量明显低于对照组(图 3E)。我们进一步用双荧光素酶报告基因实验验证miR-218靶基因的准确性,将Anti-miR-218与psiCheck2-Robo1-3′UTR或对照质粒共转染A549细胞;将miR-218 mimics与psiCheck2-Robo1-3′UTR或对照质粒共转染HCC4006细胞培养,培养48 h后,检测荧光素表达水平。结果发现,在A549细胞中抑制miR-218能够显著增强Robo1的转录活性,而对照组的荧光素酶的表达不受影响(图 3F,P<0.05);在HCC4006细胞中过表达miR-218能够显著抑制Robo1的转录活性(图 3G,P<0.05)。结果提示miR-218能与Robo1基因的3′UTR区有结合,影响Robo1的表达。
3.
MiR-218靶基因的预测及验证。A:miR-218与Robo1的3’UTR结合示意图;B:干扰miR-218后,Robo1的mRNA变化情况;C:干扰miR-218后,Robo1蛋白的表达变化;D:qPCR检测在HCC4006细胞中转染miR-218 mimics后,Robo1的mRNA表达;E:在HCC4006细胞中转染miR-218 mimics后,Robo1的蛋白表达;F、G:双荧光素酶检测miR-218对Robo1转录活性的影响,其中F:干扰miR-218;G:过表达miR-218。
Predicting and verifying the target genes of miR-218. A: Schematic diagram for binding of miR-218 in 3'UTR of Robo1; B: qPCR analysis of Robo1 expression after Anti-miR-218 transfection; C: The protein level of Robo1 after Anti-miR-218 transfection; D: qPCR analysis of Robo1 expression in HCC4006 cell after transfected with miR-218 mimics; E: The protein level of Robo1 in HCC4006 cell after transfected with miR-218 mimics; F, G: Luciferase reporter assay analysis of the transcription activity of Robo1 in cells transfected with Anti-miR-218 (F) or over-expressed with miR-218 (G).
2.4. miR-218通过Robo1调控肺癌细胞的侵袭能力
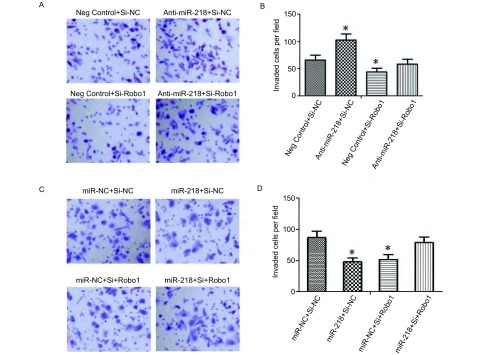
为了验证miRNA-218是否通过Robo1来调控细胞的侵袭能力,我们在A549细胞中将侵袭实验分为4个组,分别为:Negative control+Robo1的Si-NC组为第1组,Anti-miRNA-218+Robo1的Si-NC组为第2组,Negative control+Si-Robo1组为第3组,Anti-miRNA-218+Si-Robo1组为第4组。每组分别共转染A549细胞,继续培养24 h后。再用Transwell小室按照细胞侵袭实验步骤进行操作。结果显示第2组与第1组比较,穿越Matrigel胶的细胞数明显增多,分别为[(102.82±11.67), (66.43±8.45)](图 4A-图 4B,P<0.05);第3组细胞数为(44.36±7.02)与第1组比较明显减少(图 4A-图 4B,P<0.05);第4组细胞数为(58.62±9.15),与第1组比较没有统计学意义。在HCC4006中将侵袭实验也分为4组,分别为miR-NC+Si-NC组为A组,miRNA-218+Si-NC组为B组,miR-NC+Si-Robo1组为C组,miR-218+Si-Robo1组为D组。结果显示A组穿越Matrigel胶的细胞数(86.53±11.58),B组穿越Matrigel胶的细胞数(47.87±9.05),C组细胞数为(51.56±7.89),D组细胞数为(78.55±8.94)。B组及C组分别与A组比较差异显著,有统计学意义(图 4C-图 4D,P<0.05);D组与A组比较没有显著差异。提示miR-218是通过调控Robo1的表达来影响细胞的侵袭。
4.
MiR-218通过调控Robo1影响肺癌细胞的侵袭能力。A:Anti-miR-218和Si-Robo1及其对照组后,A549细胞侵袭能力的改变(20×);B:侵袭细胞的统计结果;C:转染miR-218 mimics和Si-Robo1及其对照组后,HCC4006细胞侵袭能力的改变(20×);D:HCC4006细胞侵袭能力统计结果分析。
MiR-218 can influence the invasion ability of lung cancer cells by regulating Robo1 expression. A: Comparing the invasion ability of A549 cell transfect with Anti-miR-218 or Si-Robo1 to their control (20×); B: Statistical analysis of invaded cells in A549; C: Comparing the invasion ability of HCC4006 cell transfect with Anti-miR-218 or Si-Robo1 to their control (20×); D: Statistical analysis of invaded cells in HCC4006.
3. 讨论
肺癌是世界上最常见的恶性肿瘤之一。随着现代化在我国进程的快速发展,肺癌的发病率呈持续升高的态势。尽管目前临床上对肿瘤诊治水平有了很大的进步,但针对肺癌的有效治疗效果不显著[7]。由于肺癌的发生发展机制目前并不清楚,患者生存预后较差。因此,深入研究肺癌发生发展的分子机制十分必要。
MiRNA参与到肿瘤的发生发展已被证实[8]。其中,miR-218不仅在多种组织中(如脂肪、皮肤等)发挥着重要的作用[9-11]。在人类多种恶性肿瘤中miR-218能够影响肿瘤细胞的增殖和凋亡,起着抑癌基因的作用[4-6]。本研究通过qPCR证明了miR-218在肺癌患者组织中是低表达的。已有的研究[12, 13]发现在人类多种肿瘤中miR-218均为低表达,并推测miR-218起着抑癌基因的作用。在肺癌中,有研究[4]认为miR-218低表达的是由于其甲基化作用的结果,并且miR-218是影响NSCLC生存和无复发预后的独立因素。本研究在miR-218高表达的A549细胞中抑制miR-218的表达发现细胞的转移侵袭功能增强,这与以前的研究[14, 15]结论相似。
MiR-218靶基因众多,包括Ecop、PAXILLIN、Robo1等,意味着miR-218有多种的调控通路。有研究已证实miRNA-218能通过调控Robo1参与多种癌症细胞侵袭和转移[6, 16]。在结直肠癌细胞中,miR-218可通过下调Bmi1的表达抑制细胞的增殖,促进细胞凋亡[17]。Wu等[4]研究发现miR-218通过靶向调控Paxillin基因表达来影响口腔鳞癌患者的生存及预后。miR-218可直接结合于ECOP的mRNA 3′-UTR,抑制ECOP基因表达,从而达到抑制胶质瘤细胞增殖的结果[18]。可见miR-218可参与多种调控肿瘤转移的机制中,但在肺癌中的调控机制尚不明确。
Robo1是轴突导向性受体,近来研究发现Robo1参与调控肿瘤的侵袭和转移[12, 19, 20]。我们用软件预测确实显示Robo1为miR-218靶基因之一,因此我们推测miR-218-Robo1通路可能也参与调控肺癌的侵袭和转移。我们通过外源性miR-218的抑制物瞬时干扰A549细胞中miR-218的表达,显著抑制了Robo1的表达。然后通过双荧光素酶报告基因实验进一步验证miR-218能够调控Robo1的转录活性,这些结果都明在肺癌细胞A549中Robo1是miR-218下游的靶基因之一。用miR-218抑制剂和Robo1的SiRNA同时转染细胞,发现抑制了miR-218增强细胞侵袭的能力,进一步证明了miR-218通过抑制Robo1的表达从而调控肿瘤细胞的迁移侵袭功能。在乳腺癌、胃癌和鼻咽癌等癌症中,同样存在miR-218-Robo1通路,且参与了调控肿瘤细胞的转移[6, 17, 21]。
综上所述,Robo1基因是miR-218的靶基因之一,miR-218能够通过调控Robo1基因的表达影响肺癌细胞的迁移侵袭,提示miR-218可通过调控下游靶基因来影响肺癌的发生发展。因此,miR-218可作为肺癌分子治疗中潜在的靶点,为临床治疗提供一个新思路及理论基础。
References
- 1.Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2007. CA Cancer J Clin. 2007;57(1):43–66. doi: 10.3322/canjclin.57.1.43. [DOI] [PubMed] [Google Scholar]
- 2.Jemal A, Bray F, Center MM, et al. Globalcancer statistics. CA Cancer J Clin. 2011;61(2):69–90. doi: 10.3322/caac.v61:2. [DOI] [PubMed] [Google Scholar]
- 3.Yanaihara N, Caplen N, Bowman E, et al. Unique microrna molecular profiles in lung cancer diagnosis and prognosis. Cancer Cell. 2006;9(3):189–198. doi: 10.1016/j.ccr.2006.01.025. [DOI] [PubMed] [Google Scholar]
- 4.Wu DW, Cheng YW, Wang J, et al. Paxillin predicts survival and relapse in non-small cell lung cancer by microrna-218 targeting. Cancer Res. 2010;70(24):10392–10401. doi: 10.1158/0008-5472.CAN-10-2341. [DOI] [PubMed] [Google Scholar]
- 5.Leite KR, Sousa-Canavez JM, Reis ST, et al. Change in expression of miR-let7c, miR-100, and miR-218 from high grade localized prostate cancer to metastasis. Urol Oncol. 2011;29(3):265–269. doi: 10.1016/j.urolonc.2009.02.002. [DOI] [PubMed] [Google Scholar]
- 6.Alajez NM, Lenarduzzi M, Ito E, et al. MiR-218 suppresses nasopharyngeal cancer progression through downregulation of survivin and the SLIT2-ROBO1 pathway. Cancer Res. 2011;71(6):2381–2391. doi: 10.1158/0008-5472.CAN-10-2754. [DOI] [PubMed] [Google Scholar]
- 7.Sugimura H, Yang P. Long-term survivorship in lung cancer. Chest. 2006;129(4):1088–1097. doi: 10.1378/chest.129.4.1088. [DOI] [PubMed] [Google Scholar]
- 8.Hayes J, Peruzzi PP, Lawler S. MicroRNAs in cancer: biomarkers, functions and therapy. Trends Mol Med. 2014;20(8):460–469. doi: 10.1016/j.molmed.2014.06.005. [DOI] [PubMed] [Google Scholar]
- 9.Botchkareva NY. MicroRNA/mRNA regulatory networks in the control of skin development and regeneration. Cell Cycle. 2012;11(3):468–474. doi: 10.4161/cc.11.3.19058. [DOI] [PubMed] [Google Scholar]
- 10.Gu J, Xuan Z. Inferring the perturbed microrna regulatory networks in cancer using hierarchical gene co-expression signatures. PLoS One. 2013;8(11):e81032. doi: 10.1371/journal.pone.0081032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Bengestrate L, Virtue S, Campbell M, et al. Genome-wide profiling of micrornas in adipose mesenchymal stem cell differentiation and mouse models of obesity. PLoS One. 2011;6(6):e21305. doi: 10.1371/journal.pone.0021305. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Schmid BC, Rezniczek GA, Fabjani G, et al. The neuronal guidance cue slit2 induces targeted migration and may play a role in brain metastasis of breast cancer cells. Breast Cancer Res Treat. 2007;106(3):333–342. doi: 10.1007/s10549-007-9504-0. [DOI] [PubMed] [Google Scholar]
- 13.Yang M, Liu R, Sheng J, et al. Differential expression profiles of micrornas as potential biomarkers for the early diagnosis of esophageal squamous cell carcinoma. Oncol Rep. 2013;29(1):169–176. doi: 10.3892/or.2012.2105. [DOI] [PubMed] [Google Scholar]
- 14.Yamasaki T, Seki N, Yoshino H, et al. MicroRNA-218 inhibits cell migration and invasion in renal cell carcinoma through targeting caveolin-2 involved in focal adhesion pathway. J Urol. 2013;190(3):1059–1068. doi: 10.1016/j.juro.2013.02.089. [DOI] [PubMed] [Google Scholar]
- 15.Sher YP, Wang LJ, Chuang LL, et al. ADAM9 up-regulates N-cadherin via miR-218 suppression in lung adenocarcinoma cells. PLoS One. 2014;9(4):e94065. doi: 10.1371/journal.pone.0094065. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.He X, Dong Y, Wu CW, et al. MicroRNA-218 inhibits cell cycle progression and promotes apoptosis in colon cancer by downregulating BMI1 polycomb ring finger oncogene. http://europepmc.org/articles/PMC3576472. Mol Med. 2013;18:1491–1498. doi: 10.2119/molmed.2012.00304. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Tie J, Pan YL, Zhao LN, et al. Mir-218 inhibits invasion and metastasis of gastric cancer by targeting the robol receptor. PLoS Genetics. 2010;6(3):e1000879. doi: 10.1371/journal.pgen.1000879. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Hongping X, Yukui Y, Minghua H, et al. MiR-218 sensitizes glioma cells to apoptosis and inhibits tumorigenicity by regulating ECOP-mediated suppression of NF-κB activity. Neuro Oncol. 2013;15(4):413–422. doi: 10.1093/neuonc/nos296. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Yang L, Li Q, Wang Q, et al. Silencing of mirna-218 promotes migration andinvasion of breast cancer via slit2-robol pathway. Biomed Pharmacother. 2012;66(7):535–540. doi: 10.1016/j.biopha.2012.04.006. [DOI] [PubMed] [Google Scholar]
- 20.Mertsch S, Schmitz N, Jeibmann A, et al. Slit2 involvement in glioma cellmigration is mediated by robol receptor. J Neurooncol. 2008;87(1):1–7. doi: 10.1007/s11060-007-9484-2. [DOI] [PubMed] [Google Scholar]
- 21.Wang B, Xiao Y, Ding BB, et al. Induction of tumor angiogenesis by slit-robosignaling and inhibition of cancer growth by blocking robo activity. Cancer Cell. 2003;4(1):19–29. doi: 10.1016/S1535-6108(03)00164-8. [DOI] [PubMed] [Google Scholar]