Abstract
背景与目的
人类棘皮动物微管相关蛋白样4(echinoderm microtubule-associated-protein-like 4, EML4)和人类间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)融合基因EML4-ALK是新发现的非小细胞肺癌的驱动基因,患者具有独特的临床病理生理特征,ALK基因下游信号通路的异常持续激活是其重要的下游信号通路,而导致其下游基因持续激活的原因不明。细胞因子信号转导抑制因子(suppressor of cytokine signaling, SOCS)是一类在细胞信号转导过程中起重要作用的负调控因子,主要通过抑制JAK蛋白酪氨酸激酶(janus protein tyrosine kinase, JAK)信号传导和转录激活因子(signal transducer and activator of transcription, STAT)即JAK-STAT等信号通路来调控细胞的增殖、分化和凋亡。肿瘤中常存在SOCS基因的甲基化异常导致的失活,从而导致JAK2-STAT等信号通路持续异常活化。本研究的目的在于探讨EML4-ALK阳性H2228细胞和肺癌组织中SOCS3启动子区甲基化状态。
方法
甲基化特异性PCR检测EML4-ALK阳性H2228肺癌细胞及肺癌组织中SOCS3启动子区的甲基化状态,并通过测序验证。DNA甲基转移酶抑制剂5’-Aza-dC处理H2228细胞,并通过Real-time PCR和Western blot检测SOCS3的表达水平变化。
结果
MSP及测序分析发现EML4-ALK阳性细胞株H2228中存在SOCS3启动子区甲基化;7例EML4-ALK阳性肺癌组织中的3例存在SOCS3启动子区甲基化,H2228细胞经过5’-Aza-dC去甲基化处理后SOCS3的表达明显增加。
结论
EML4-ALK(+)的H2228肺癌细胞及部分肺癌组织中存在SOCS3启动子区的异常甲基化,可能是EML4-ALK阳性肺癌的重要发病机制。
Keywords: 肺肿瘤, EML4, ALK, SOCS3, DNA甲基化
Abstract
Background and objective
The EML4-ALK fusion gene is a newly discovered driver gene of non-small cell lung cancer and exhibits special clinical and pathological features. The JAK-STAT signaling pathway, an important downstream signaling pathway of EML4-ALK, is aberrantly sustained and activated in EML4-ALK-positive lung cancer cells fusion gene, but the underlying reason remains unknown. The suppressor of cytokine signaling (SOCS) is a negative regulatory factor that mainly inhibits the proliferation, differentiation, and induction of apoptotic cells by inhibiting the JAK-STAT signaling pathway. The aberrant methylation of the SOCS gene leads to inactivation of tumors and abnormal activation of the JAK2-STAT signaling pathway. The aim of this study is to investigate the methylation status of the SOCS3 promoter in EML4-ALK-positive H2228 cells and lung cancer tissues.
Methods
The methylation status of the SOCS3 promoter in EML4-ALK-positive H2228 lung cancer cells and lung cancer tissues was detected by methylation-specific PCR (MSP) analysis and verified by DNA sequencing. The expression levels of SOCS3 in H2228 cells were detected by Western blot and Real-time PCR analyses after treatment with the DNA methyltransferase inhibitor 5'-Aza-dC.
Results
MSP and DNA sequencing assay results indicated the presence of SOCS3 promoter methylation in H2228 cells as well as in three cases of seven EML4-ALK-positive lung cancer tissues. The expression level of SOCS3 significantly increased in H2228 cells after 5′-Aza-dC treatment.
Conclusion
The aerrant methylation of the SOCS3 promoter region in EML4-ALK (+) H2228 cells and lung cancer tissues may be significantly involved in the pathogenesis of EML4-ALK-positive lung cancer.
Keywords: Lung neoplasms, Echinoderm microtubule-associated-protein-like 4 (EML4), Anaplastic lymphoma kinase (ALK), Suppressor of cytokine signaling 3 (SOCS3), DNA methylation
肺癌是我国发病率和死亡率增长最快,对人类健康和生命威胁最大的恶性肿瘤,总的5年生存率仅10%左右[1-3]。现在的研究[4-10]表明,表皮生长因子受体(epidermal growth factor receptor, EGFR)、KRAS(kirsten rat sarcoma viral oncogene, K-ras)、人类棘皮动物微管相关蛋白样4(echinoderm microtubule-associated-protein-like 4, EML4)和人类间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)重排形成的融合基因EML4-ALK等基因是肺癌发生发展的驱动基因(driver gene),应用针对这些驱动基因及信号通路的药物进行分子靶向治疗,在取得明显疗效的同时又避免对正常细胞伤害,显示了诱人的治疗前景。EML4-ALK融合基因2007年由日本学者发现,定位于2号染色体的短臂上(2p21和2p23)[5]。在非小细胞肺癌(non-small cell lung cancer, NSCLC)人群中EML4-ALK阳性率约为3%-7%左右,但在女性、无或仅少量吸烟史的肺腺癌患者中EML4-ALK融合基因阳性率高达15%[11]。
动物实验提示EML4-ALK融合基因具有潜在致瘤性,是肺癌发生的驱动基因,但其致瘤机制尚未阐明。EML4-ALK融合基因阳性患者对表皮生长因子受体酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitors, EGFR-TKIs)原发性耐药,而可能对ALK抑制剂有效[12, 13]。2011年8月美国食品药品管理局批准ALK抑制剂克唑替尼用于局部晚期或转移性ALK阳性NSCLC的一线治疗,对于ALK阳性的NSCLC患者,克唑替尼显示出了一定的治疗活性,并可延长患者的生存期,其无进展生存期为9.7个月,但是,克唑替尼与EGFR-TKI一样,使用一段时间后会产生获得性耐药,而揭示EML4-ALK的致瘤机理对EML4-ALK患者的治疗及克服耐药将产生重要作用[6, 9]。
细胞因子信号转导抑制因子(suppressor of cytokine signaling, SOCS)是一类在细胞信号转导过程中起重要作用的负调控因子,主要通过抑制JAK-STAT(janus protein tyrosine kinase, signal transducers and activators of transcription)等信号通路的持续激活来调控细胞的增殖、分化和凋亡[14-16]。由于JAK-STAT信号通路是多种肿瘤驱动基因重要下游信号通路,近年来的研究发现,SOCS启动子区异常甲基化在多种肿瘤发生发展中起重要作用,包括肝癌、胃癌、肺癌和血液系统肿瘤等,但是在EML4-ALK融合基因阳性肺癌中的情况却未见报道[17-21]。本研究的目的在于探讨人类EML4-ALK融合基因阳性肺癌组织和细胞中SOCS3启动子异常甲基化情况,为进一步阐明SOCS3在EML4-ALK阳性肺癌发生发展中的作用奠定基础。
1. 材料与方法
1.1. 细胞株及主要仪器
人NSCLC细胞株H2228细胞,A549细胞购于ATCC、人正常肺上皮细胞BEAS-2B细胞、人胚胎肾上皮细胞HEK293细胞由天津医科大学总医院,天津市肺癌研究所保存;7例ALK阳性患者来自于天津医科大学总医院肺部肿瘤外科的手术病例。RMPI1640和DMEM培养基、胎牛血清及Trizol试剂购自Life Technologies公司(Carlsbad, CA, USA);实时荧光定量PCR试剂盒、Premix Ex TaqHotstart Version购自Takara公司(Dalian, China);反转录试剂盒购自Promega公司(Madison, WI, USA);QIAampDNA Mini Kit和EpiTect Bisulfite Kit购自Qiagen公司(Hilden, Germany);甲基转移酶抑制剂5’-氮杂-2’-脱氧胞苷(5’-Aza-dC)购自Sigma-Aldrich公司(Kansas, Missouri, USA)。
1.2. 细胞培养及药物处理
除HEK293细胞用含10%胎牛血清(fetal bovine serum, FBS)的DMEM(dulbecco's modified eagle medium)培养,其他细胞均培养于含10%FBS的RPMI-1640培养基。细胞培养于10 cm培养皿,37 ℃、5%CO2饱和湿度的培养箱中,0.25%胰酶-EDTA(ethylenediamine tetracetic acid)消化传代,所有实验均采用对数生长期细胞。5’-Aza-dC溶于二甲基亚砜(dimethyl sulphoxide, DMSO)溶液中,10 μmoL/L处理6孔板中细胞(每孔2×105细胞),每个浓度3个孔,处理72 h。
1.3. 组织及细胞DNA提取
细胞及组织按QIAamp DNA Mini Kit说明书步骤进行DNA提取,DNA提取后琼脂糖电泳检测DNA纯度,并用紫外分光光度计进行定量。
1.4. 甲基化特异性PCR(methylation-specific PCR, MSP)
1.4.1. 基因组DNA亚硫酸盐修饰分别取800 ng
DNA按照EpiTect Bisulfite Kit(QINGEN)的说明书进行亚硫酸盐处理,反应在PCR仪上进行,处理条件:99 ℃、5 min,60 ℃、25 min,99 ℃、5 min,60 ℃、85 min,99℃、5 min,60 ℃、175 min,最后置20 ℃不超过24 h。纯化回收的DNA -20 ℃保存备用,用于甲基化特异PCR分析。
1.4.2. MSP-PCR扩增和产物的凝胶纯化取20 ng
DNA为模板进行启动子目的片段的扩增。采用巢式PCR法,第一轮PCR引物序列为: SOCS3-F 5'-GATTYGAGGGGGTTTAGTTTTAAGGA-3',SOCS3-R 5'-CCACTACCCCAAAAACCCTCTCCTAA-3',反应条件为:95 ℃、5 min,95 ℃、30 s,60 ℃、30 s,72 ℃、30 s,设置降落PCR,每个循环降落0.5 ℃,14个循环;再加20个循环的95 ℃、30 s,53 ℃、30 s,72 ℃、30 s。第二轮PCR取1 μL第一轮PCR产物为模板进行扩增,甲基化引物序列为:M-F 5'-GGAGATTTTAGGTTTTCGGAATATTTC-3',M-R 5'-CCCCCGAAACTACCTAAACGCCG-3',非甲基化引物序列为U-F 5'-GTTGGAGATTTTAGGTTTTTGGAATATTTT-3',U-R 5'-AAACCCCCAAAACTACCTAAACACCA-3',反应条件:95 ℃、5 min,95 ℃、30 s,55 ℃、30 s,72 ℃、30 s,30个循环;72 ℃、5 min,4 ℃保存。扩增产物经2%琼脂糖电泳进行鉴定,并设以双蒸水为模板的阴性对照。
1.4.3.
亚硫酸盐测序上述PCR产物经回收纯化后,交由北京华大基因公司测序,根据甲基化位点的个数计算分析SOCS3基因启动子甲基化水平。
1.5. Real-time PCR
Trizol法常规提取5'-Aza-dC处理细胞总RNA,紫外分光光度仪定量,以Reverse Transcriptase Kit(Promega)将2 μg RNA反转成cDNA。20 ng cDNA为模板,与ABI SYBR Green Master Mix(ABI)及相应引物混合,置于实时荧光定量PCR仪Applied Biosystems 7900HT Fast Real-Time PCR System instrument and software(Applied Biosystems, USA)进行Real-time PCR反应。反应条件:95 ℃、20 s;40个PCR循环(95 ℃、10 s;60 ℃、20 s;72 ℃、10 s)。以PGK作为内参照,未处理样本作为矫正因子,数据采用2-ΔΔCT法进行分析,ΔCT=CT-CT(PGK),ΔΔCT=ΔCT(24 h、48 h、72 h)-ΔCT(0 h)(H2228、A549、H460、B2B)[22]。
1.6. 蛋白免疫印迹(Western blot)
RIPA裂解收集细胞蛋白溶液,BCA法测浓度,与5×SDS-PAGE蛋白缓冲液充分混匀,100 ℃煮沸10 min使蛋白变性后,取30 μg蛋白上样量上样,进行SDS-聚丙烯酰胺凝胶(SDS-PAGE)电泳,100 V转膜65 min、5%脱脂牛奶的1×TBST中室温封闭1 h,加入鼠抗人SOCS3单克隆抗体,1:500稀释,4 ℃孵育过夜。加HRP标记的二抗,室温孵育1 h,显色曝光[23]。
1.7. 统计学方法
应用SPSS 21.0统计软件进行分析,同一细胞系两组间比较采用两样本均数t检验,P < 0.05为差异有统计学意义。
2. 结果
2.1. SOC3启动子区CpG岛的查找及MSP引物设计
应用USUC数据库预测人SOCS3 DNA启动子序列并获取启动子上游2, 000 bp,再通过MethPrimer在线分析网站和Methyl Primer Expressv 1.0软件分析这段序列的CPG岛,采用标准:碱基对 > 300,GC > 50%,观察值/预测值> 0.6。结果显示SOCS3启动子的CpG岛长度545 bp,位于871 bp-1, 415 bp。通过Methyl Primer Expressv 1.0软件设计出PCR引物。
2.2. MSP法检测细胞和肺癌肿瘤组织中SOCS3启动子甲基化状态
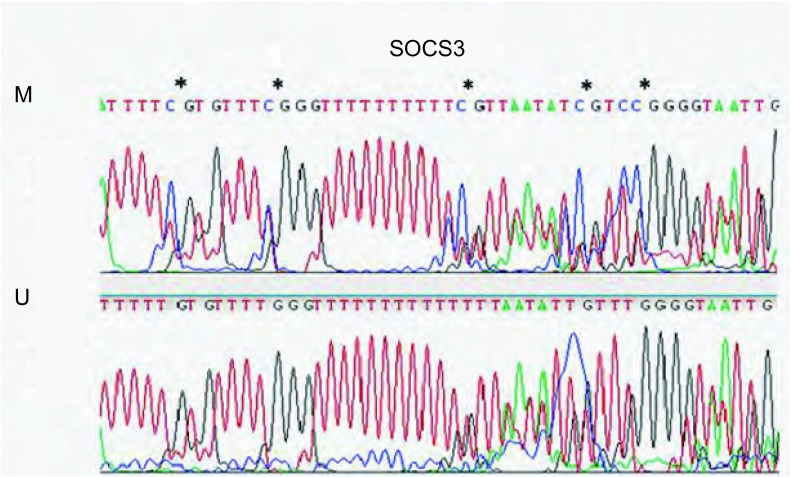
提取7例EML4-ALK阳性肺癌患者肿瘤组织和EML4-ALK阳性肿瘤细胞H2228、EML4-ALK阴性肿瘤细胞A549、HEK-293细胞、人胎盘细胞的DNA,应用重亚硫酸盐处理,未甲基化的胞嘧啶(C)将转变为尿嘧啶(U),而甲基化的胞嘧啶(C)不变。将上述经重亚硫酸盐处理后的DNA用MSP引物扩增,来检测SOCS3启动子区的甲基化情况。图 1所示MSP结果显示H2228细胞、A549细胞、HEK-293细胞、H460细胞和7例肿瘤组织中的3例SOCS3启动子区存在不同程度的甲基化,BEAS-2B细胞及人胎盘组织细胞中不存在SOCS3启动子区的甲基化情况。PCR产物经DNA测序分析,证实SOCS3启动子区存在DNA甲基化(图 2)。
1.
MSP方法检测肺癌细胞株及EML4-ALK阳性肺癌样品中SOCS3基因启动子甲基化状态。M:甲基化特异;U:非甲基化特异
MSP assay for SOCS3 promoter in different lung cancer cell lines and EML4-ALK (+) lung cancer tissues. M:methylated-specific; U: unmethylated-specific.
2.
H2228细胞SOCS3启动子MSP分析后测序验证
The MSP result of SOCS3 promotor were verified by DNA sequencing in H2228 cells
2.3.
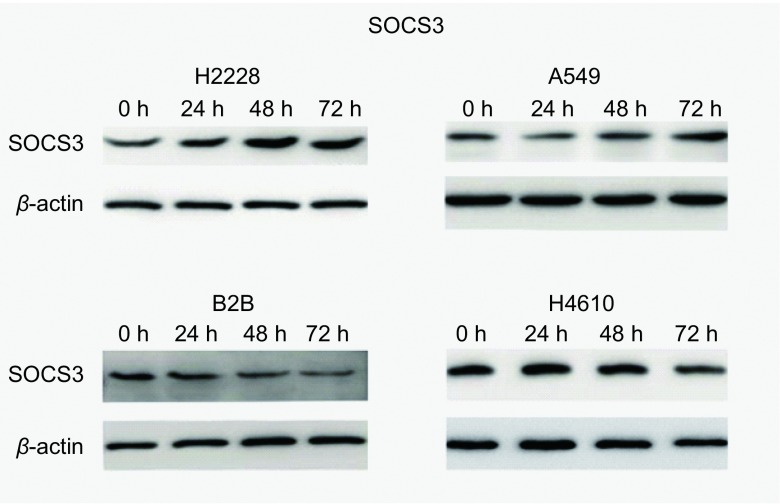
甲基转移酶抑制剂5’-Aza-dC处理,上调SOCS3表达为了进一步探讨DNA甲基化对SOCS3表达的调控情况,我们用甲基转移酶抑制剂5’-氮杂-2’-脱氧胞苷(5’-Aza-dC)处理上述细胞。以10 μm/孔连续处理不同的细胞72 h后分别提取RNA和蛋白,用Real-time PCR及Western blot检测SOCS3表达水平的变化情况,以DMSO处理组作为对照组。结果显示,与对照组相比,A549细胞和H2228细胞中SOCS3的表达水平有明显提高,分别提高了4.97倍(P < 0.05)和3.66(P < 0.05)倍。而在BEAS-2B细胞和H460细胞中SOCS3的表达则变化不明显甚至表现为降低(图 3)。进一步通过Western blot来验证去甲基化处理后SOCS3表达水平的变化,结果与Real-time PCR结果一致(图 4)。
3.
Real-time PCR检测5'-Aza-dC处理不同肺癌细胞后,SOCS3表达水平的变化情况。*P < 0.05
The analysis of SOCS3 expression by Real-time PCR in human lung cancer cell lines after 5'-Aza-dC treatment. *P < 0.05
4.
Western blot检测肺癌细胞株经5'-Aza-dC处理后SOCS3表达水平的变化
The analysis of SOCS3 expression by Western blot in human lung cancer cell lines after 5'-Aza-dC treatment
3. 讨论
SOCS3是经典的JAK-STAT信号通路负反馈调节蛋白之一,其可以通过抑制STAT的磷酸化及其二聚体的形成或者直接抑制JAK的磷酸化来负向调节JAK-STAT通路,从而抑制细胞的持续增殖和分化[14, 16, 24, 25]。SOCS功能异常导致其对JAK-STAT通路的抑制作用随之消失,而启动子异常甲基化是SOCS3功能异常的重要机制。
SOCS家族分子的超甲基化在多种肿瘤中被发现,如肺癌、肝癌、前列腺癌、食管癌等[26-29]。比如,日本的学者用实时定量PCR和免疫印迹的方法发现肝癌组织中SOCS3的表达低于正常肝组织,并且通过特异性敲除小鼠SOCS3基因,使得SOCS3对STAT3的抑制作用消失导致STAT3持续活化,其抗细胞凋亡的作用随之增强,致癌物诱导肝癌发生的作用也随之增加,证明了超甲基化导致的SOCS3表达缺失与肝癌的发生有关[20]。
我们的研究证实在EML4-ALK阳性细胞H2228及部分EML4-ALK阳性患者肿瘤组织中存在SOCS3基因的异常甲基化,转甲基化酶抑制剂5’-Aza-dC处理能在mRNA水平和蛋白水平增加SOCS3的表达,MSP及基因测序分析进一步证实这些细胞中存在异常甲基化修饰。因此,在上述肺癌细胞中SOCS3的表达受异常甲基化调控。
由于SOCS蛋白在肿瘤发生发展中的作用,现在已经有学者尝试将SOCS家族蛋白激活剂用于临床前研究,并取得了一定的进展,比如,有研究[15, 18, 30, 31]指出肿瘤的治疗中激活SOCS后再用JAK抑制剂的效果比单用JAK激酶抑制剂的效果要好;Kim等[30, 32, 33]学者发现恢复SOCS1和SOCS3的表达能够增加宫颈癌细胞对放疗的敏感性;在NSCLC中也发现恢复SOCS3的表达不仅能够促进肿瘤细胞的凋亡,而且还能增加其对放疗的敏感性。因此提示针对SOCS的靶向治疗的研究,将会为肿瘤靶向治疗提供新的思路。
Funding Statement
本研究受国家自然科学基金项目(No.81172233和No.81372306)、天津自然科学基金重点项目(No.12JCZDJC24400和No.16JCZDJC34200)、天津自然科学基金项目(No.13JCYBJC22600)、天津市科委抗癌重大专项攻关计划(No.12ZCDZSY16100)、教育部博士点基金(No.20131202110004)资助
This study was supported by grants from the National Natural Science Foundation of China (to Jun CHEN)(No.81172233)(to Hongyu LIU)(No.81372306), the Tianjin key project of Natural Science Foundation (to Jun CHEN)(No.12JCZDJC24400 and No.16JCZDJC34200), Tianjin Natural Science Foundation (to Hongyu LIU)(No.13JCYBJC22600), Tianjin Science and Technology Support Program(to Jun CHEN)(No.12ZCDZSY16100) and the Ph.D. Programs Foundation from Ministry of Education of China (to Jun CHEN)(No.20131202110004).
Contributor Information
刘 红雨 (Hongyu LIU), Email: liuhongyu123@hotmail.com.
陈 军 (Jun CHEN), Email: huntercj2004@yahoo.com.
References
- 1.Jemal A, Murray T, Samuels A, et al. Cancer statistics, 2003. CA Cancer J Clin. 2003;53(1):5–26. doi: 10.3322/canjclin.53.1.5. [DOI] [PubMed] [Google Scholar]
- 2.Tyczynski JE, Bray F, Parkin DM. Lung cancer in Europe in 2000: epidemiology, prevention, and early detection. Lancet Oncol. 2003;4(1):45–55. doi: 10.1016/S1470-2045(03)00960-4. [DOI] [PubMed] [Google Scholar]
- 3.Reck M, Heigener DF, Mok T, et al. Management of non-small-cell lung cancer: recent developments. Lancet. 2013;382(9893):709–719. doi: 10.1016/S0140-6736(13)61502-0. [DOI] [PubMed] [Google Scholar]
- 4.Wu SG, Liu YN, Tsai MF, et al. The mechanism of acquired resistance to irreversible EGFR tyrosine kinase inhibitor-afatinib in lung adenocarcinoma patients. http://europepmc.org/articles/PMC4914294/ Oncotarget. 2016;7(11):12404–12413. doi: 10.18632/oncotarget.7189. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature. 2007;448(7153):561–566. doi: 10.1038/nature05945. [DOI] [PubMed] [Google Scholar]
- 6.Nilsson RJ, Karachaliou N, Berenguer J, et al. Rearranged EML4-ALK fusion transcripts sequester in circulating blood platelets and enable blood-based crizotinib response monitoring in non-small-cell lung cancer. http://europepmc.org/articles/PMC4808052/ Oncotarget. 2016;7(1):1066–1075. doi: 10.18632/oncotarget.6279. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Wen M, Wang X, Sun Y, et al. Detection of EML4-ALK fusion gene and features associated with EGFR mutations in Chinese patients with non-small-cell lung cancer. Oncol Targets Ther. 2016;9:1989–1995. doi: 10.2147/OTT.S100303. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Wong DW, Leung EL, So KK, et al. The EML4-ALK fusion gene is involved in various histologic types of lung cancers from nonsmokers with wild-type EGFR and KRAS. Cancer. 2009;115(8):1723–1733. doi: 10.1002/cncr.v115:8. [DOI] [PubMed] [Google Scholar]
- 9.Xu Y, Liu H, Chen J, et al. Acquired resistance of lung adenocarcinoma to EGFR-tyrosine kinase inhibitors gefitinib and erlotinib. Cancer Biol Ther. 2010;9(8):572–582. doi: 10.4161/cbt.9.8.11881. [DOI] [PubMed] [Google Scholar]
- 10.Wei LL, Li XZ, Yu ZH. Mutations of EGFR gene and EML4-ALK fusion gene in superficial lymph node of non-small cell lung cancer. Zhonghua Yi Xue Za Zhi. 2015;95(26):2070–2073. doi: 10.3760/cma.j.issn.0376-2491.2015.26.007. [DOI] [PubMed] [Google Scholar]; 韦 丽丽, 李 幸洲, 于 忠和. 非小细胞肺癌患者浅表淋巴结组织中表皮生长因子受体基因和EML4-ALK融合基因的突变状态. 中华医学杂志. 2015;95(26):2070–2073. doi: 10.3760/cma.j.issn.0376-2491.2015.26.007. [DOI] [PubMed] [Google Scholar]
- 11.Li Y, Li Y, Yang T, et al. Clinical significance of EML4-ALK fusion gene and association with EGFR and KRAS gene mutations in 208 Chinese patients with non-small cell lung cancer. PLoS One. 2013;8(1):e52093. doi: 10.1371/journal.pone.0052093. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Mano H, Takeuchi K. EML4-ALK fusion in lung. Am J Pathol. 2010;176(3):1552–1553. doi: 10.2353/ajpath.2010.091057. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Horn L, Pao W. EML4-ALK: honing in on a new target in non-small-cell lung cancer. J Clin Oncol. 2009;27(26):4232–4235. doi: 10.1200/JCO.2009.23.6661. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Starr R, Willson TA, Viney EM, et al. A family of cytokine-inducible inhibitors of signalling. Nature. 1997;387(6636):917–921. doi: 10.1038/43206. [DOI] [PubMed] [Google Scholar]
- 15.Walker SR, Xiang M, Frank DA. Distinct roles of STAT3 and STAT5 in the pathogenesis and targeted therapy of breast cancer. Mol Cell Endocrinol. 2014;382(1):616–621. doi: 10.1016/j.mce.2013.03.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Al-Jamal HA, Jusoh SA, Yong AC, et al. Silencing of suppressor of cytokine signaling-3 due to methylation results in phosphorylation of STAT3 in imatinib resistant BCR-ABL positive chronic myeloid leukemia cells. Asian Pac J Cancer Prev. 2014;15(11):4555–4561. doi: 10.7314/APJCP.2014.15.11.4555. [DOI] [PubMed] [Google Scholar]
- 17.He B, You L, Uematsu K, et al. SOCS-3 is frequently silenced by hypermethylation and suppresses cell growth in human lung cancer. Proc Natl Acad Sci U S A. 2003;100(24):14133–14138. doi: 10.1073/pnas.2232790100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Souma Y, Nishida T, Serada S, et al. Antiproliferative effect of SOCS-1 through the suppression of STAT3 and p38 MAPK activation in gastric cancer cells. Int J Cancer. 2012;131(6):1287–1296. doi: 10.1002/ijc.v131.6. [DOI] [PubMed] [Google Scholar]
- 19.Chu PY, Yeh CM, Hsu NC, et al. Epigenetic alteration of the SOCS1 gene in hepatocellular carcinoma. http://europepmc.org/abstract/MED/20648401. Swiss Med Wkly. 2010;140:w13065. doi: 10.4414/smw.2010.13065. [DOI] [PubMed] [Google Scholar]
- 20.Ogata H, Kobayashi T, Chinen T, et al. Deletion of the SOCS3 gene in liver parenchymal cells promotes hepatitis-induced hepatocarcinogenesis. Gastroenterology. 2006;131(1):179–193. doi: 10.1053/j.gastro.2006.04.025. [DOI] [PubMed] [Google Scholar]
- 21.Yu H, Liu Y, McFarland BC, et al. SOCS3 deficiency in myeloid cells promotes tumor development: involvement of STAT3 activation and myeloid-derived suppressor cells. Cancer Immunol Res. 2015;3(7):727–740. doi: 10.1158/2326-6066.CIR-15-0004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Xiao F, Jiang M, Du D, et al. Orexin A regulates cardiovascular responses in stress-induced hypertensive rats. Neuropharmacology. 2013;67:16–24. doi: 10.1016/j.neuropharm.2012.10.021. [DOI] [PubMed] [Google Scholar]
- 23.Jiang M, Wang Q, Karasawa T, et al. Sodium-glucose transporter-2 (SGLT2; SLC5A2) enhances cellular uptake of aminoglycosides. PLoS One. 2014;9(9):e108941. doi: 10.1371/journal.pone.0108941. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Inagaki-Ohara K, Kondo T, Ito M, et al. SOCS, inflammation, and cancer. http://www.ncbi.nlm.nih.gov/pubmed/24069550. JAKSTAT. 2013;2(3):e24053. doi: 10.4161/jkst.24053. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Yasukawa H, Sasaki A, Yoshimura A. Negative regulation of cytokine signaling pathways. Annu Rev Immunol. 2000;18:143–164. doi: 10.1146/annurev.immunol.18.1.143. [DOI] [PubMed] [Google Scholar]
- 26.Hussain S, Singh N, Salam I, et al. Methylation-mediated gene silencing of suppressor of cytokine signaling-1 (SOCS-1) gene in esophageal squamous cell carcinoma patients of Kashmir valley. J Recept Signal Transduct Res. 2011;31(2):147–156. doi: 10.3109/10799893.2011.553836. [DOI] [PubMed] [Google Scholar]
- 27.Heller G, Babinsky VN, Ziegler B, et al. Genome-wide CpG island methylation analyses in non-small cell lung cancer patients. Carcinogenesis. 2013;34(3):513–521. doi: 10.1093/carcin/bgs363. [DOI] [PubMed] [Google Scholar]
- 28.Pierconti F, Martini M, Pinto F, et al. Epigenetic silencing of SOCS3 identifies a subset of prostate cancer with an aggressive behavior. Prostate. 2011;71(3):318–325. doi: 10.1002/pros.v71.3. [DOI] [PubMed] [Google Scholar]
- 29.Singh TD, Gupta S, Shrivastav BR, et al. Epigenetic profiling of gallbladder cancer and gall stone diseases: Evaluation of role of tumour associated genes. https://www.sciencedirect.com/science/article/pii/S037811191501197X. Gene. 2016;576(2 Pt 2):743–752. doi: 10.1016/j.gene.2015.10.004. [DOI] [PubMed] [Google Scholar]
- 30.Shimada K, Serada S, Fujimoto M, et al. Molecular mechanism underlying the antiproliferative effect of suppressor of cytokine signaling-1 in non-small-cell lung cancer cells. Cancer Sci. 2013;104(11):1483–1491. doi: 10.1111/cas.2013.104.issue-11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Iwahori K, Serada S, Fujimoto M, et al. SOCS-1 gene delivery cooperates with cisplatin plus pemetrexed to exhibit preclinical antitumor activity against malignant pleural mesothelioma. Int J Cancer. 2013;132(2):459–471. doi: 10.1002/ijc.27611. [DOI] [PubMed] [Google Scholar]
- 32.Kim MH, Kim MS, Kim W, et al. Suppressor of cytokine signaling (SOCS) genes are silenced by DNA hypermethylation and histone deacetylation and regulate response to radiotherapy in cervical cancer cells. PLoS One. 2015;10(4):e0123133. doi: 10.1371/journal.pone.0123133. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Lin YC, Lin CK, Tsai YH, et al. Adenovirus-mediated SOCS3 gene transfer inhibits the growth and enhances the radiosensitivity of human non-small cell lung cancer cells. http://www.ncbi.nlm.nih.gov/pubmed/21042758. Oncol Rep. 2010;24(6):1605–1612. doi: 10.3892/or_00001024. [DOI] [PubMed] [Google Scholar]