Abstract
背景与目的
间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)阳性非小细胞肺癌(non-small cell lung cancer, NSCLC)是肺癌的一个重要亚型。ALK阳性NSCLC脑转移患者的治疗尚无标准模式。
方法
本研究对我院2013年3月-2016年3月期间确诊的ALK阳性NSCLC脑转移患者的临床资料和治疗情况进行回顾性分析, 探讨不同治疗模式患者的转归。
结果
84例晚期ALK阳性NSCLC患者中, 22例初诊时有脑转移, 剔除3例合并表皮生长因子受体(epidermal growth factor receptor, EGFR)双突变患者, 共19例纳入分析。中位颅内疾病进展时间(progression-free survival, PFS)为12.0个月, 一线脑部局部治疗(P=0.021)及一线克唑替尼治疗(P=0.030)可延长PFS; 一线克唑替尼联合脑部局部治疗的中位颅内PFS为27.0个月, 而单纯克唑替尼治疗的PFS仅为4.2个月。
结论
一线克唑替尼联合脑部局部治疗有助于延长ALK阳性晚期NSCLC患者的颅内PFS, 因例数少, 尚有待大样本多中心前瞻性临床研究证实。
Keywords: 肺肿瘤, ALK, 脑转移
Abstract
Background and objective
Anaplastic lymphoma kinase (ALK)-positive non-small cell lung cancer (NSCLC) is an important subtype of lung cancer.The standard modality of ALK-positive NSCLC with brain metastases remains uncertain.
Methods
We collected data on clinical characteristics and treatment of patients with ALK-positive NSCLC and brain metastases between March 2013 and March 2016 and retrospectively analyzed patient outcomes.
Results
In 84 ALK-positive patients with advanced NSCLC, 22 (26.2%) had brain metastases during the initial diagnosis of lung cancer, among which 3 patients with EGFR mutation were excluded, and 19 patients were analyzed.Median intracranial progression-free survival (PFS) was 12.0 months.PFS for patients who received first-line local brain therapy (P=0.021) and crizotinib therapy (P=0.030) was superior to PFS for patients without such therapies.PFS for patients who received first-line crizotinib combined with local brain therapy was 27.0 months and only 4.2 months for those who received crizotinib alone.
Conclusion
First-line crizotinib therapy combined with local brain treatment can improve intracranial PFS for ALK-positive NSCLC with brain metastases.This finding should be confirmed further through multicenter, prospective clinical trials with large sample size.
Keywords: Lung neoplasms, ALK, Brain metastases
全球范围内, 肺癌的发病率和死亡率均居恶性肿瘤的前列。大多数患者由于确诊时已为晚期, 5年总生存率仅为16%。随着基础研究及药物研发的进展, 近10年来, 靶向治疗已成为晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)的重要治疗模式之一。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors, EGFR-TKIs)在EGFR突变患者中的显著疗效, 给肺癌的治疗带来革命性的改变[1, 2]。间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)重排是继EGFR突变之后被发现的肺癌另一个重要的驱动基因[3]。ALK阳性患者占NSCLC 5%-8%, 一系列ALK抑制剂的大样本随机对照试验结果奠定了克唑替尼一线治疗的地位, 克唑替尼治疗ALK阳性晚期NSCLC的客观缓解率为59.8%-74%, 中位疾病无进展生存期为7.7个月-10.9个月[4-6]。
肺癌脑转移比例超过40%, 脑部也是ALK阳性晚期NSCLC的常见转移部位, 脑转移的治疗效果是影响患者预后的重要因素。至此, ALK阳性脑转移患者的治疗模式尚无前瞻性随机对照的循证医学证据, 报告也较少。本研究对我院确诊的ALK阳性NSCLC脑转移患者进行回顾性分析, 了解ALK阳性脑转移患者的治疗状况及生存情况, 为临床医生提供思路。
1. 资料与方法
1.1. 入组患者
北京胸科医院2013年3月-2016年3月期间, 确诊Ⅳ期ALK阳性NSCLC患者共84例, 22例(26.2%)确诊时有脑转移, 3例合并EGFR突变被剔除, 19例纳入分析。全部患者接受胸计算机断层扫描(computed tomography, CT)、头核磁共振/CT、骨扫描、腹部CT或核磁、浅表淋巴结彩超等分期检查。记录患者的临床资料, 包括性别、年龄、吸烟状况、美国东部协作肿瘤组体力活动状态(Eastern Cooperative Oncology Group performance status, ECOG PS)评分、分期、组织学类型、治疗情况及转归等。肿瘤-淋巴结-转移(tumor-node-metastasis, TNM)分期以美国癌症联合会(American Joint Committee for Cancer, AJCC)第七版分期系统为标准。
1.2. 治疗方案
1.2.1. 化疗
化疗方案包括培美曲塞、吉西他滨、紫杉醇、多西紫杉醇、长春瑞滨等联合铂类的方案。
1.2.2. 靶向治疗
克唑替尼250 mg, bid, po, 如有明显药物相关不良反应, 可减量至200 mg, bid, po。
1.2.3. 放疗
全脑放疗(whole brain radiotherapy, WBRT)的剂量为30 GY/10 f; 立体定向放射外科治疗(stereotactic radiosurgery, SRS)在外院进行。
1.3. 疗效评价
疗效评价采用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1版。疗效判定包括完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)及疾病进展(progressive disease, PD)。客观缓解率(objective response rate, ORR)包括CR和PR, 疾病控制率(disease control rate, DCR)包括CR、PR和SD。初始治疗1个月后进行脑部病灶的疗效评价, 之后每2个月-3个月随访一次。
1.4. ALK重排检测方法
每例福尔马林固定石蜡包埋的组织标本或胸水细胞块切取4 μm厚度的切片, 采用D5F3兔克隆抗体(Cell Signal Technology, U.S.)、Optiview DAB IHC检测试剂盒和Optiview放大试剂盒在Benchmark XT(瑞士)自动免疫组化染色机上检测(操作方法按照Benchmark XT自动组化染色机操作规程及ALK检测程序进行), 每例设兔单克隆IgG阴性。由病理科医师负责判读结果, 任何比例的肿瘤细胞胞浆呈强染色即为ALK阳性, 肿瘤细胞胞浆无强染色为阴性。
1.5. 统计学方法
颅内疾病无进展生存期(progression-free survival, PFS)为一线治疗开始至脑部疾病进展或死亡的时间, 总生存期(overall survival, OS)为从确诊脑转移至任何原因导致死亡的时间, 全组随访日期截止至2016年5月31日。采用统计软件SPSS 22.0进行数据分析。PFS和OS采用Kaplan-Meier法计算, 组间差异采用Log-rank分析。P < 0.05为差异有统计学意义, P值均采用双侧检验。
2. 结果
2.1. 一般情况
84例患者Ⅳ期ALK阳性NSCLC中, 中位年龄52岁, 男性45例, 腺癌76例, 不吸烟57例。其中22例为初诊脑转移患者, 脑转移发生率为26.2%, 剔除3例EGFR与ALK双突变患者, 共19例患者可供分析, 其中2例为胸部病灶术后的脑转移患者, 17例为晚期。19例患者的一般情况见表 1。
1.
患者的一般情况
Patient characteristics (n= 19)
| n | |
| ECOG PS:Eastern Cooperative Oncology Group performance status. | |
| Age (year) | |
| Range | 36-73 |
| Median | 55 |
| Gender | |
| Male | 8 (42.1%) |
| Female | 11 (57.9%) |
| ECOG PS | |
| 0 | 2 (10.5%) |
| 1 | 14 (73.7%) |
| 2 | 3 (15.8%) |
| Smoking status | |
| Non-smoking | 15 (78.9%) |
| Smoking | 4 (21.1%) |
| Histology type | |
| Adenocarcinoma | 18 (94.7%) |
| Squamous | 1 (5.3%) |
| Source of sample | |
| Surgery sample | 2 (10.5%) |
| Bronchoscopy | 8 (42.1%) |
| Pulmonary biopsy | 5 (26.3%) |
| Pleural effusion | 3 (15.8%) |
| Lymph node | 1 (5.3%) |
| Symptoms of brain | |
| Yes | 8 (42.1%) |
| No | 11 (57.9%) |
| Number of brain metastases | |
| 1 | 10 (52.6%) |
| > 1 | 9 (47.4%) |
| Extracranial metastases | |
| Yes | 13 (68.4%) |
| No | 6 (31.6%) |
2.2. 治疗情况
19例脑转移患者中, 4例未接受任何抗肿瘤治疗, 其余15例患者的一线治疗情况:化疗5例(26.3%), 化疗+SRS 1例(5.3%), 克唑替尼3例(15.8%), 克唑替尼+WBRT 3例(15.8%), 克唑替尼+SRS 1例(5.3%), 手术2例(10.5%)。全程治疗中共10例接受局部治疗(WBRT/SRS/手术), 10例接受克唑替尼治疗, 其中一线7例, 二线及以上3例。
2.3. 疗效
15例中13例可评价疗效, 2例CR, 1例PR, 10例SD, 颅内ORR为23.1%(3/13), DCR为100%。
2.4. PFS
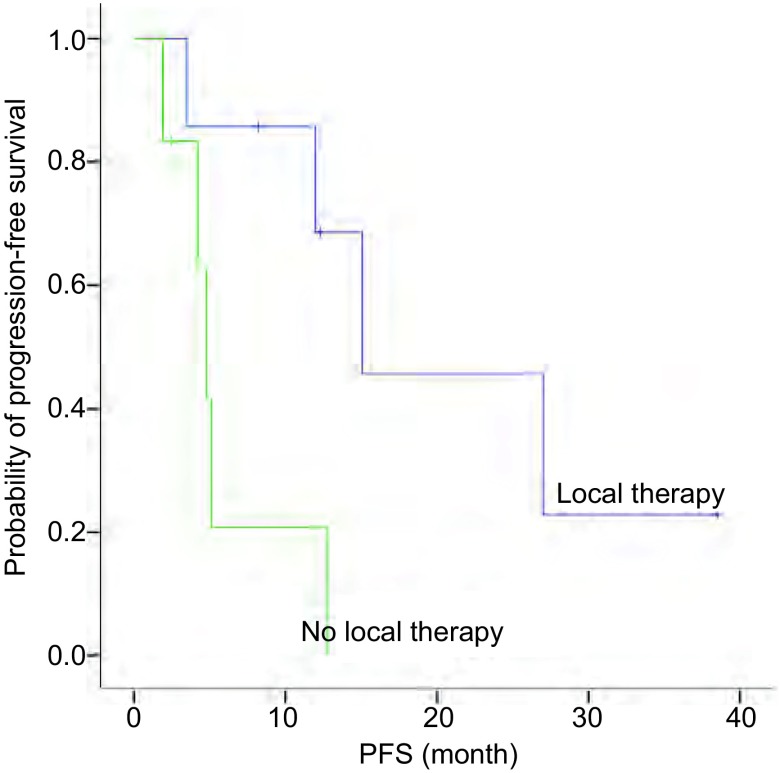
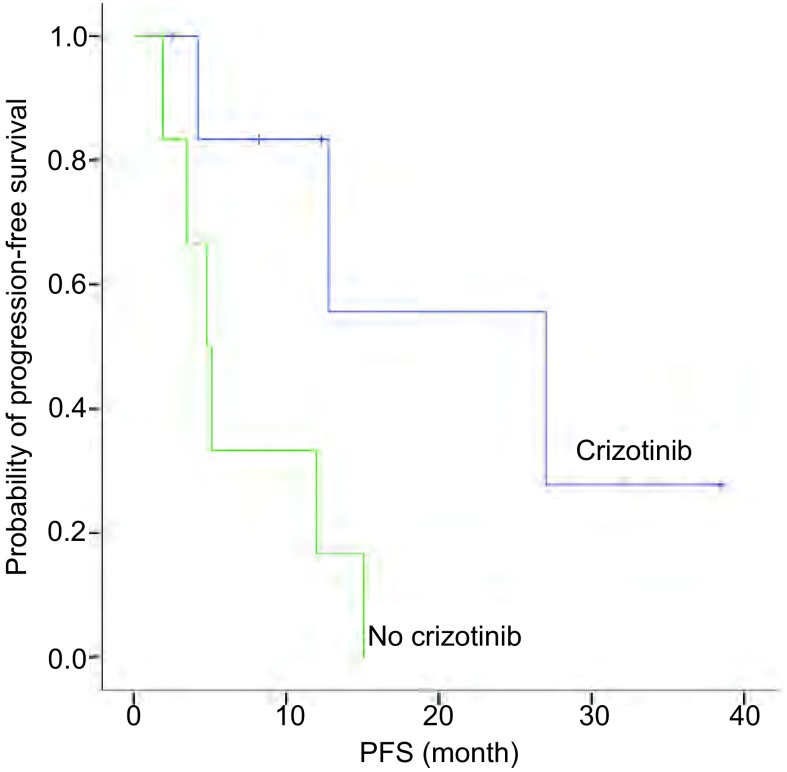
13例患者中9例(69.2%)进展, 4例(30.8%)未进展, 中位颅内PFS为12个月(95%CI:1.845-22.155)。分析显示, 患者的临床特征, 包括性别、年龄分组(< 60岁与≥60岁)、颅内转移灶数量、是否有神经系统症状、是否有颅外转移与PFS无相关性, 差异均无统计学意义(P > 0.05)。因PS评分、吸烟状态及病理类型各亚组例数不均衡, 未做统计学处理。一线接受局部治疗患者的PFS优于未接受局部治疗患者(图 1), 一线接受克唑替尼治疗的患者PFS优于未接受克唑替尼治疗患者(图 2)。因例数少未做Cox多因素分析(表 2)。但需注意的是, 一线接受克唑替尼治疗的7例患者中4例同时接受了脑部的局部治疗, 这4例患者的中位颅内PFS为27.0个月, 3例单纯克唑替尼治疗患者的中位PFS仅为4.2个月, 因例数少, 尚不能进行统计学分析, 但上述结果显示出克唑替尼联合局部治疗较单纯靶向治疗对延长PFS的明显优势。
1.
一线是否接受脑部局部治疗患者的颅内PFS
Intracranial PFS for patients according first-line brain local therapy
2.
一线是否接受克唑替尼治疗患者的颅内PFS
Intracranial PFS for patients according first-line crizotinib therapy
2.
患者的颅内PFS
Intracranial PFS for patients
| Characteristics | n | Events | Median PFS (Month) | 95%CI (Month) | P |
| PFS:progression-free survival. | |||||
| Gender | |||||
| Male | 5 | 5 | 5.1 | 3.168-7.032 | 0.050 |
| Female | 8 | 4 | 15.1 | 0-35.409 | |
| Age (year) | |||||
| < 60 | 9 | 6 | 12.0 | 2.992-21.008 | 0.931 |
| ≥60 | 4 | 3 | 4.8 | 0-21.199 | |
| Symptoms of brain | |||||
| Yes | 7 | 5 | 15.1 | 3.260-26.940 | 0.280 |
| No | 6 | 4 | 5.1 | 4.474-5.726 | |
| Number of brain metastases | |||||
| 1 | 6 | 4 | 15.1 | 0-34.700 | 0.133 |
| > 1 | 7 | 5 | 12.0 | 3.300-20.700 | |
| Extracranial metastases | |||||
| Yes | 7 | 4 | 12.0 | 6.874-17.126 | 0.588 |
| No | 6 | 5 | 5.1 | 0-18.183 | |
| Local therapy | |||||
| Yes | 7 | 4 | 15.1 | 0.683-29.517 | 0.021 |
| No | 6 | 5 | 4.8 | 3.548-6.052 | |
| Crizotinib therapy | |||||
| Yes | 7 | 3 | 27.0 | 3.714-50.286 | 0.030 |
| No | 6 | 6 | 4.8 | 2.880-6.720 | |
2.5. OS
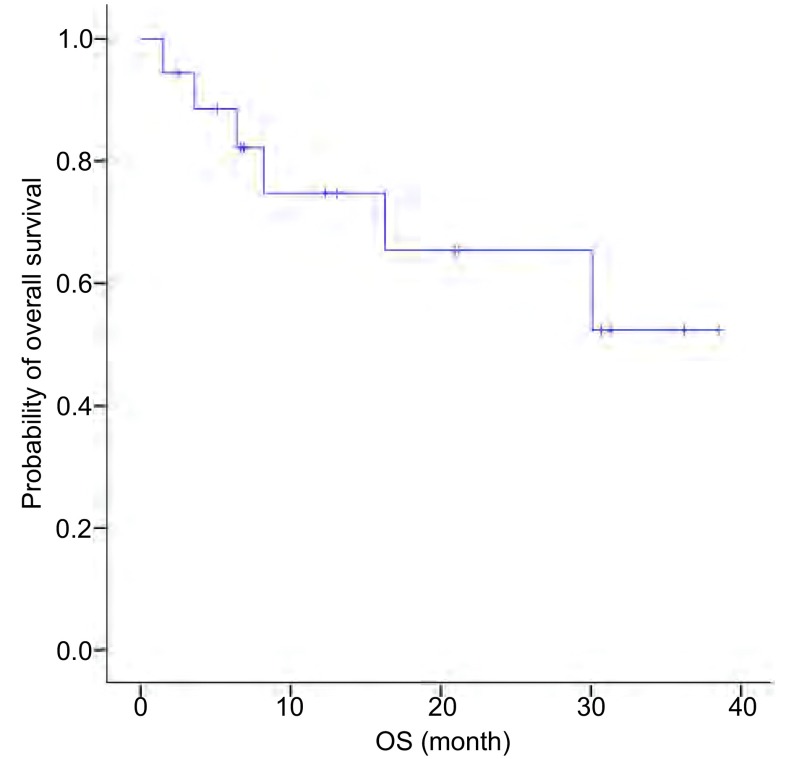
全组19例患者12例(63.2%)存活, 6例(31.6%)死亡, 1例(5.3%)失访, 因生存事件不足50%, 尚不能统计生存结果。12例存活中的9例均接受了克唑替尼和脑部的局部治疗(图 3)。
3.
全组患者的OS曲线
OS for all of patients.OS:overall survival.
2.6. 脑转移进展后的治疗
本组患者中6例脑转移进展后的治疗:1例克唑替尼, 1例WBRT, 1例靶向联合WBRT和SRS, 3例WBRT并继续服用克唑替尼, 其中3例患者均为既往接受过克唑替尼治疗, 6例患者均在随访中。
3. 讨论
肺癌脑转移患者的自然病程仅3个月, 尽管传统化疗对脑转移患者也有一定的效果, 但作用有限; WBRT、SRS和手术是脑转移患者重要的局部治疗方法, 其中WBRT应用最为广泛。随着肺癌驱动基因研究的进展, NSCLC患者分型越来越细, 靶向治疗成为EGFR突变、ALK阳性等患者的重要治疗手段, EGFR-TKIs和ALK抑制剂等均为小分子药物, 可通过血脑屏障, 起到治疗脑转移的作用, 因此对脑部转移病灶有很好的治疗作用。但是, 对于ALK阳性脑转移患者的治疗, 放疗、靶向药物如何选择, 尚无前瞻性随机对照临床研究证据。文献[5, 7, 8]报告, ALK阳性NSCLC脑转移的发生率为20%-35%, 而且脑转移也是克唑替尼治疗后发生耐药的主要进展部位, 约占60%, 研究探讨此类患者的治疗模式对于指导临床实践有重要意义。
本研究共入组84例Ⅳ期ALK阳性NSCLC患者, 临床特征分析显示中位年龄52岁, 多见于腺癌、不吸烟患者, 其中22例为初诊脑转移患者, 脑转移发生率为26.2%, 较以往研究相似。近些年来, 对于多驱动基因发生共突变的现象已屡有报道, Bar等[9]研究显示8.3%的NSCLC患者肿瘤组织中存在2种或者2种以上的驱动基因突变。在本研究中, 存在3.6%(3/84)的ALK/EGFR共突变。
我们对19例初诊ALK阳性NSCLC脑转移患者的临床资料进行回顾性分析, 15例经过化疗或克唑替尼联合或不联合WBRT/SRS, 颅内疾病ORR为23.1%, 中位颅内PFS为12.0个月, 存活患者为63.2%, 中位OS还未达到, 克唑替尼与局部治疗能良好地控制患者的颅内疾病, 延长生存期。
Costa等[8]对Profile1005和Profile1007两项前瞻性临床试验中的脑转移患者进行分析, 其中109例未治疗过的无症状脑转移患者, 克唑替尼治疗后的颅内ORR为18%, 12周的DCR为56%, 颅内PFS为7个月, 显示克唑替尼对ALK阳性NSCLC脑转移患者的良好控制。另外一项研究报告克唑替尼治疗40例脑转移的ORR为25%, PFS为7个月[10]。Solomon等[11]对Prolfile 1014研究中脑转移患者进行分析, 证实克唑替尼对全身疾病和颅内疾病的控制均优于化疗。本组患者颅内PFS为12.0个月, 高于上述文献报告的结果, 原因有两个, 一是本组例数较少, 二是与本组有些患者接受克唑替尼治疗, 有些患者同时接受克唑替尼及局部治疗(WBRT或SRS)有关, 本组患者中PFS较长的几例均接受了克唑替尼治疗联合WBRT或SRS治疗, 因此, 强烈提示靶向治疗联合局部治疗能够明显延长PFS。Johung等[12]对来自六个研究中心的90例ALK阳性NSCLC脑转移患者(包括27例初诊时脑转移及治疗后出现的63例脑转移)分析发现, 发生脑转移后的中位OS为49.5个月, 中位颅内PFS为11.9个月, 研究的结论是SRS和/或WBRT联合TKI可延长ALK阳性脑转移患者的生存, 同时研究者建议一线使用SRS。本文结果与此项研究相似。
三项研究显示ALK阳性NSCLC患者的OS超过4年, 也包括脑转移患者, 证实晚期ALK阳性NSCLC脑转移患者同样可以获得长期生存[12-14]。生存获益一方面来自于靶向治疗(包括一代、二代ALK抑制剂)、局部治疗, 另一方面也同样来自于化疗、重复使用ALK抑制剂及支持治疗等。本组患者由于存活患者比例占63.2%, 尚不能统计生存资料, OS范围为1.5个月-38.5个月, 存活时间最短的患者未做任何抗肿瘤治疗, 现仍存活的12例患者中9例接受了克唑替尼治疗和局部治疗, 提示ALK抑制剂与局部治疗联合可明显延长ALK阳性脑转移患者的生存。
文献[15-17]报告克唑替尼治疗后出现的脑内转移患者, 接受WBRT或SRS并继续克唑替尼口服仍可获得数月的PFS, 生存仍可获益。对于克唑替尼治疗的脑转移患者, 脑转移再次进展后的治疗, 目前尚无循证医学证据。本组9例治疗后颅内进展的患者中的6例接受了补救性治疗, 分别为1例WBRT, 1例靶向治疗, 1例口服克唑替尼联合SRS和WBRT治疗, 3例行WBRT同时继续靶向治疗, 其中3例患者均为既往接受过克唑替尼治疗, 目前这6例颅内疾病均得到控制, 处于随访中。脑转移再次进展后的治疗, 如局部治疗(WBRT/SRS/手术)、化疗、一代/二代ALK抑制剂等方案可根据患者的病情进行选择。研究证实, 二代ALK抑制剂, 色瑞替尼、alectinib对脑转移患者也有很好的疗效, 也包括对克唑替尼耐药的病例[18-20]。色瑞替尼(NCT02336451, Ⅱ期)、Brigatinib(NCT01449461, Ⅰ期/Ⅱ期)治疗ALK阳性NSCLC脑转移的临床研究正在进行中。此外, Alectinib、AP26113、PF-06463922也可透过血脑屏障, 对脑转移有效。
WBRT和SRS联合可提高颅内控制, 但有多项前瞻性研究证实对于转移数目少的患者仅行SRS并不降低OS[21, 22]。然而, 对于脑内多发转移, 应常规行WBRT。WBRT的缺点是局部控制劣于SRS或手术, 而且伴有神经认知的损害。日本一项大样本的研究显示, SRS对于5个-10个转移灶的控制并不劣于2个-4个[23]。ALK阳性患者生存期长, 需认真考虑WBRT对神经认知功能的损害。本组患者3例一线接受WBRT, 2例一线接受SRS, 补救性治疗中5例接受WBRT, 1例同时接受SRS, 本文统计分析显示, 接受一线脑部局部治疗的患者的PFS优于未接受一线局部治疗患者。局部治疗作为重要的脑转移控制手段, 如何与全身治疗配合, 使患者的生存获益是临床医生面临的挑战。
综上所述, 克唑替尼联合局部治疗可使ALK阳性NSCLC脑转移患者获得良好的颅内疾病控制, 脑转移进展后继续克唑替尼治疗联合局部治疗仍可继续延长PFS。本文的不足在于例数偏少, 治疗不统一, 尚不能做OS分析, 我们将对全组患者继续随访。鉴于在ALK阳性脑转移患者中, ALK抑制剂与局部治疗(WBRT/SRS)的最佳顺序尚不明确, 因此, 今后有必要开展多中心的前瞻性对照研究, 以靶向治疗为基础, 权衡靶向治疗与局部治疗的合理顺序, 探索最佳的治疗模式, 做好患者的全程管理, 使得患者生存获益最大化。
Contributor Information
王 敬慧 (Jinghui WANG), Email: jhwang@ccmu.edu.cn.
张 树才 (Shucai ZHANG), Email: sczhang@ccmu.edu.cn.
References
- 1.Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med. 2009;361(10):947–957. doi: 10.1056/NEJMoa0810699. [DOI] [PubMed] [Google Scholar]
- 2.Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802):a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011;12(8):735–742. doi: 10.1016/S1470-2045(11)70184-X. [DOI] [PubMed] [Google Scholar]
- 3.Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature. 2007;448(7153):561–566. doi: 10.1038/nature05945. [DOI] [PubMed] [Google Scholar]
- 4.Camidge DR, Bang YJ, Kwak EL, et al. Activity and safety of crizotinib in patients with ALK-positive non-small-cell lung cancer:updated results from a phase 1 study. Lancet Oncol. 2012;13(10):1011–1019. doi: 10.1016/S1470-2045(12)70344-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med. 2013;368(25):2385–2394. doi: 10.1056/NEJMoa1214886. [DOI] [PubMed] [Google Scholar]
- 6.Solomon BJ, Mok T, Kim DW, et al. First-Line Crizotinib versus Chemotherapy in ALK-Positive Lung Cancer. N Engl J Med. 2014;371(23):2167–2177. doi: 10.1056/NEJMoa1408440. [DOI] [PubMed] [Google Scholar]
- 7.Rangachari D, Yamaguchi N, VanderLaan PA, et al. Brain metastases in patients with EGFR-mutated or ALK-rearranged non-small-cell lung cancers. Lung Cancer. 2015;88(1):108–111. doi: 10.1016/j.lungcan.2015.01.020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Costa DB, Shaw AT, Ou SH, et al. Clinical experience with crizotinib in patients with advanced ALK-rearranged non-small-cell lung cancer and brain metastases. J Clin Oncol. 2015;33(17):1881–1888. doi: 10.1200/JCO.2014.59.0539. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Bar J, Damianovich M, Hout Siloni G, et al. Genetic mutation screen in early non-small-cell lung cancer (NSCLC) specimens. Clin Lung Cancer. 2014;15(2):159–165. doi: 10.1016/j.cllc.2013.11.005. [DOI] [PubMed] [Google Scholar]
- 10.Costa DB, Kobayashi S, Pandya SS, et al. CSF concentration of the anaplastic lymphoma kinase inhibitor crizotinib. J Clin Oncol. 2011;29(15):e443–e445. doi: 10.1200/JCO.2010.34.1313. [DOI] [PubMed] [Google Scholar]
- 11.Solomon BJ, Cappuzzo F, Felip E, et al. Intracranial efficacy of crizotinib versus chemotherapy in patients with advanced alk-positive non-small-cell lung cancer:results from PROFILE 1014. http://ascopubs.org/doi/abs/10.1200/JCO.2015.63.5888. J Clin Oncol. 2016 doi: 10.1200/JCO.2015.63.5888. [DOI] [PubMed] [Google Scholar]
- 12.Johung KL, Yeh N, Desai NB, et al. Extended survival and prognostic factors for patients with alk-rearranged non-small-cell lung cancer and brain metastasis. http://ascopubs.org/doi/pdf/10.1200/JCO.2015.62.0138. J Clin Oncol. 2015;34(2):123–129. doi: 10.1200/JCO.2015.62.0138. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Kris MG, Johnson BE, Berry LD, et al. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs. JAMA. 2014;311(19):1998–2006. doi: 10.1001/jama.2014.3741. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Gainor JF, Tan DS, De Pas T, et al. Progression-free and overall survival in alk-positive nsclc patients treated with sequential crizotinib and ceritinib. Clin Cancer Res. 2015;21(12):2745–2752. doi: 10.1158/1078-0432.CCR-14-3009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Takeda M, Okamoto I, Nakagawa K. Clinical Impact of continued crizotinib administration after isolated central nervous system progression in patients with lung cancer positive for ALK rearrangement. https://www.sciencedirect.com/science/article/pii/S1556086415328252. J Thorac Oncol. 2013;8(5):654–657. doi: 10.1097/JTO.0b013e31828c28e7. [DOI] [PubMed] [Google Scholar]
- 16.Weickhardt AJ, Scheier B, Burke JM, et al. Local ablative therapy of oligoprogressive disease prolongs disease control by tyrosine kinase inhibitors in oncogene-addicted non-small-cell lung cancer. J Thorac Oncol. 2012;7(12):1807–1814. doi: 10.1097/JTO.0b013e3182745948. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Ou SH, Jänne PA, Bartlett CH, et al. Clinical benefit of continuing ALK inhibition with crizotinib beyond initial disease progression in patients with advanced ALK-positive NSCLC. Ann Oncol. 2014;25(2):415–422. doi: 10.1093/annonc/mdt572. [DOI] [PubMed] [Google Scholar]
- 18.Gainor JF, Sherman CA, Willoughby K, et al. Alectinib salvages CNS relapses in ALK-positive lung cancer patients previously treated with crizotinib and ceritinib. J Thorac Oncol. 2015;10(2):232–236. doi: 10.1097/JTO.0000000000000455. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Kim DW, Mehra R, Tan DS, et al. Ceritinib in advanced anaplastic lymphoma kinase (ALK)-rearranged (ALK+) non-small cell lung cancer (NSCLC):results of the ASCEND-1 trial. https://www.nice.org.uk/guidance/ta395/resources/ceritinib-for-previously-treated-anaplastic-lymphoma-kinase-positive-nonsmallcell-lung-cancer-82602911852485 ASCO Meet.J Clin Oncol. 2014;32(Suppl.15):Abstr.8003. [Google Scholar]
- 20.Ou SI, Ahn JS, Petris LD, et al. Alectinib in crizotinib-refractory ALK-rearranged non-small-cell lung cancer:a phase Ⅱ global study. J Clin Oncol. 2016;34(7):661–668. doi: 10.1200/JCO.2015.63.9443. [DOI] [PubMed] [Google Scholar]
- 21.Aoyama H, Shirato H, Tago M, et al. Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases:a randomized controlled trial. JAMA. 2006;295(21):2483–2491. doi: 10.1001/jama.295.21.2483. [DOI] [PubMed] [Google Scholar]
- 22.Chang EL, Wefel JS, Hess KR, et al. Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation:a randomised controlled trial. Lancet Oncol. 2009;10(11):1037–1044. doi: 10.1016/S1470-2045(09)70263-3. [DOI] [PubMed] [Google Scholar]
- 23.Yamamoto M, Serizawa T, Shuto T, et al. Stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901):a multi-institutional prospective observational study. Lancet Oncol. 2014;15(4):387–395. doi: 10.1016/S1470-2045(14)70061-0. [DOI] [PubMed] [Google Scholar]