Résumé
Objectif
Décrire les enjeux cliniques liés à la santé des os chez les patients atteints de la maladie cœliaque (MC) et orienter la surveillance de la santé des os chez ces patients.
Sources d’information
Une recherche a été effectuée sur PubMed dans le but d’examiner les publications appropriées à la MC et la santé des os, y compris les lignes directrices publiées par des organisations professionnelles de gastro-entérologie.
Message principal
Le processus inflammatoire et la malabsorption du calcium et de la vitamine D compromettent la santé des os chez les adultes et les enfants atteints de la MC. La masse osseuse est réduite chez la plupart des adultes dont la MC est symptomatique au diagnostic. Il faut mesurer la densité minérale osseuse au diagnostic et au suivi, surtout chez les adultes. Il faut mesurer le taux de vitamine D au diagnostic et tous les ans, jusqu’à ce qu’il soit normal. Outre un régime strict sans gluten, il faut assurer la supplémentation en calcium et en vitamine D, et encourager les exercices contre résistance.
Conclusion
La santé des os peut être compromise chez les patients atteints de la MC. Ces patients ont besoin d’une supplémentation adéquate en calcium et en vitamine D, de même que de la surveillance du taux de vitamine D et de la densité minérale osseuse lors des suivis réguliers afin de prévenir l’ostéoporose et les fractures.
Description de cas
Une femme de 39 ans jusque-là en bonne santé s’est présentée avec diarrhée chronique, ballonnements, fatigue et perte pondérale de 3 kg. L’examen physique n’a révélé rien de remarquable. Les épreuves de laboratoire ont révélé l’anémie ferriprive. Le taux d’anticorps anti-transglutaminase tissulaire (TGt) de type IgA était élevé, soit supérieur à 250 U/mL (normale : < 15 U/mL). Le taux sérique de calcium était normal et le taux de vitamine D se situait à 16,4 nmol/L (normale : ≥ 50 nmol/L). Elle a reçu une recommandation en gastro-entérologie et une biopsie intestinale a révélé l’atrophie totale des villosités, confirmant la maladie cœliaque (MC). La densité minérale osseuse (DMO) était réduite, avec un score T de −2,9 ET. Elle a commencé à prendre des suppléments quotidiens de calcium (1000 mg) et de vitamine D (2000 UI). Une diététiste lui a donné les instructions nécessaires pour suivre un régime strict sans gluten et pour un apport en aliments riches en calcium. Au suivi de 6 mois, elle suivait son régime à la lettre et ses symptômes avaient disparu. Au suivi de 1 an, elle se portait bien, avec un taux négatif d’anticorps TGt et un taux normal de vitamine D. On lui a conseillé de prendre un rendez-vous de suivi dans un an et de subir une ostéodensitométrie.
La maladie cœliaque est un trouble chronique où le gluten (une protéine trouvée dans le blé, le seigle et l’orge) endommage la muqueuse de l’intestin grêle par l’entremise d’un mécanisme auto-immun chez les personnes génétiquement vulnérables1. Elle touche environ 1 % de la population. Alors que le tableau clinique de la malabsorption est dominé par la diarrhée et la perte pondérale (MC classique) chez certains patients, d’autres patients manifestent des caractéristiques extra-intestinales, dont l’ostéoporose et, en conséquence, un risque accru de fracture2. Le diagnostic de MC repose sur les critères établis suivants : épreuves sérologiques positives et histologie anormale de l’intestin grêle3. La dermatite herpétiforme « la MC de la peau » se caractérise par une éruption cutanée chronique prurigineuse, et la plupart des cas présentent aussi une atrophie des villosités, semblable à la MC.
Le traitement de la MC consiste en un régime strict sans gluten à vie. Les patients doivent être suivis régulièrement afin d’évaluer s’ils observent le régime alimentaire et de surveiller les complications nutritionnelles, y compris les maladies osseuses et l’apparition d’autres troubles auto-immuns, tels que la thyroïdite et le diabète de type 1. Une enquête menée auprès de gastro-entérologues canadiens a révélé qu’environ le quart d’entre eux ne dispensent pas systématiquement les soins de suivi à long terme aux patients atteints de la MC après le diagnostic, et la plupart (86 %) s’attendent à ce que l’omnipraticien du patient s’en occupe4. Les médecins de famille jouent donc un rôle important dans la surveillance prolongée de ces patients, y compris l’évaluation de la santé des os.
Sources d’information
Une recherche sur PubMed a été effectuée (jusqu’à mars 2017) pour examiner les publications pertinentes sur la MC et les problèmes osseux, dont les lignes directrices publiées par des organismes professionnels de gastro-entérologie. Les mots-clés anglais de la recherche étaient : celiac disease, osteopenia, osteoporosis, fracture, bone mineral density et treatment. L’information en matière de recommandations quant à l’apport en calcium et en vitamine D est tirée de Santé Canada et du Department of Agriculture des États-Unis.
Message principal
Santé des os chez les adultes atteints de MC.
La maladie cœliaque touche la structure osseuse. Cela se manifeste par une réduction de la DMO et l’apparition précoce d’ostéoporose et l’ostéomalacie, même chez les patients exempts de manifestations intestinales5. De nombreux mécanismes contribueraient à la perte osseuse dans la MC6–9. La malabsorption du calcium et l’hypocalcémie qui en résulte tracent une ligne directe vers l’ostéopénie et l’ostéoporose. Les taux sériques faibles de calcium précipitent la libération compensatoire de parathormone (hyperparathyroïdie secondaire) qui stimule la résorption osseuse médiée par les ostéoclastes. Bien que le taux sérique de calcium s’élève sous cet effet compensatoire, la stimulation des ostéoclastes altère la microstructure osseuse. L’effet direct des cytokines proinflammatoires (facteur de nécrose tumorale α, interleukines 1 et 6) stimulant l’activité des ostéoclastes est un autre facteur contribuant à la réduction de la DMO. Il pourrait aussi y avoir réduction de la sécrétion d’ostéoprotégérine, ce qui stimule l’activité des ostéoclastes. En outre, la MC a été liée à l’altération des hormones sexuelles chez les femmes, causée par les périodes d’aménorrhée ou la ménopause précoce, de même que chez les hommes, causée par une résistance androgénique réversible. Ces altérations contribuent à l’ostéoporose. La vitamine D favorise l’absorption du calcium et du phosphate à partir de l’intestin grêle, produisant ainsi un environnement optimal pour la minéralisation des os. La malabsorption de la vitamine D dans la MC entraîne l’ostéomalacie. Il importe de reconnaître les carences en vitamine D puisqu’une supplémentation adéquate améliore la DMO.
On rapporte que la prévalence d’ostéopénie ou d’ostéoporose mesurée par absorptiométrie biphotonique à rayons X chez les patients atteints de MC atteindrait 38 à 72 % au diagnostic; cette prévalence est réduite de 50 % durant le suivi chez les adultes qui observent leur régime strict sans gluten5,10. Le risque que la DMO soit réduite chez les adultes ayant reçu un diagnostic récent de MC augmente avec l’âge, avec un faible indice de masse corporelle et avec le nombre d’années écoulées depuis la ménopause10. En outre, la DMO est plus souvent réduite dans les cas classiques et non traités de MC, mais elle peut aussi être réduite chez les personnes asymptomatiques atteintes de la MC11. Par ailleurs, la prévalence de MC est 4 fois plus élevée chez les patients ostéoporotiques12. Des études récentes ayant eu recours à la tomodensitométrie (TDM) quantitative périphérique à haute résolution ont comparé la détérioration de la microarchitecture dans la région trabéculaire des os périphériques chez les femmes non ménopausées atteintes de la MC et chez les femmes d’âge comparable exemptes de MC13,14.
La réduction de la DMO augmente le risque de fracture. La méthodologie des études ayant évalué le risque de fracture chez les patients atteints de la MC est hétérogène, et les résultats de ces études sont controversés. Une méta-analyse a confirmé un risque presque 2 fois plus élevé de fractures chez les patients atteints de MC15,16. Certaines études laissent croire que le risque de fracture est plus élevé chez les patients atteints de la MC qui présentent des symptômes gastro-intestinaux (diarrhée chronique ou malabsorption) que chez les patients qui reçoivent un diagnostic d’affection liée à la MC dont les symptômes sont minimes17,18.
Après l’adoption d’un régime sans gluten, l’inflammation générale s’estompe, la muqueuse intestinale guérit progressivement et l’absorption des nutriments reprend. Conséquemment, la résorption osseuse ralentit à mesure que le calcium et la vitamine D reminéralisent la matrice5. Ce processus a été confirmé par plusieurs études, dont quelques-unes menées au Canada, qui montrent que la minéralisation osseuse s’améliore sous un régime sans gluten19–21, et qui montrent aussi une baisse du risque de fracture18. Un taux élevé de parathormone, d’ostéocalcine, de phosphatase alcaline spécifique aux os et d’anticorps TGt, de même qu’un faible taux de 25-hydroxyvitamine D3 ont été proposés comme marqueurs d’une atteinte osseuse et d’une piètre réponse au régime sans gluten durant le suivi19.
Recommandations concernant l’osteodensitometrie et le traitement chez les adultes.
Selon les données probantes présentées ci-dessus, l’énoncé canadien en matière de santé des os dans la MC recommande que les adultes souffrant de malabsorption subissent une ostéodensitométrie au diagnostic22. Il faut veiller à corriger la malabsorption du calcium, du phosphate et de la vitamine D22–27. Il faut organiser, dès le diagnostic, une rencontre avec une diététiste expérimentée dans les régimes sans gluten et la nutrition nécessaire pour rétablir la santé des os. Aux Tableaux 1 et 2 figurent les apports quotidiens recommandés en calcium et en vitamine D28, respectivement. L’apport de ces nutriments doit être optimisé à l’aide de sources alimentaires, en particulier les produits laitiers, autant que possible (Tableaux 3 et 4)28,29. Dans le but d’améliorer la densité et la robustesse des os, il faut aussi encourager les patients à participer à des exercices contre résistance, à limiter l’apport en alcool et à éviter la cigarette.
Tableau 1.
Apport quotidien recommandé de calcium
| POPULATION | APPORT ALIMENTAIRE RECOMMANDÉ DE CALCIUM PAR JOUR, mG | APPORT SUPÉRIEUR TOLÉRABLE DE CALCIUM PAR JOUR, mG |
|---|---|---|
| Nourrissons, mois | ||
| • 0–6 | 200 | 1000 |
| • 7–12 | 260 | 1500 |
| Enfants, ans | ||
| • 1–3 | 700 | 2500 |
| • 4–8 | 1000 | 2500 |
| • 9–18 | 1300 | 3000 |
| Adultes, ans | ||
| • 19–50 | 1000 | 2500 |
| • Hommes 51–70 | 1000 | 2000 |
| • Femmes 51–70 | 1200 | 2000 |
| • > 70 | 1200 | 2000 |
| Femmes enceintes et qui allaitent, ans | ||
| • 14–18 | 1300 | 3000 |
| • 19–50 | 1000 | 2500 |
Données tirées de Santé Canada28.
Tableau 2.
Apport quotidien recommandé de vitamine D
| POPULATION | APPORT ALIMENTAIRE RECOMMANDÉ DE VITAMINE D PAR JOUR, UI (μg) | APPORT SUPÉRIEUR TOLÉRABLE DE VITAMINE D PAR JOUR, UI (µg) |
|---|---|---|
| Nourrissons, mois | ||
| • 0–6 | 400 (10) | 1000 (25) |
| • 7–12 | 400 (10) | 1500 (38) |
| Enfants, ans | ||
| • 1–3 | 600 (15) | 2500 (63) |
| • 4–8 | 600 (15) | 3000 (75) |
| • 9–18 | 600 (15) | 4000 (100) |
| Adultes, ans | ||
| • 19–70 | 600 (15) | 4000 (100) |
| • > 70 | 800 (20) | 4000 (100) |
| Femmes enceintes et qui allaitent | 600 (15) | 4000 (100) |
Données tirées de Santé Canada28.
Tableau 3.
Sources de calcium (aliments et boissons)
| ALIMENT OU BOISSON | PORTION | CALCIUM, mG |
|---|---|---|
| Lait (écrémé) | 1 tasse | 316 |
| Lait d’amandes (enrichi de calcium)* | 1 tasse | 330 |
| Fromage Mozzarella (partiellement écrémé) | 2 oz | 443 |
| Fromage Cheddar | 2 oz | 403 |
| Yogourt (nature, faible en gras) | 6 oz | 311 |
| Yogourt (grec, nature, non gras) | 6 oz | 187 |
| Boisson de soja (enrichie de calcium)* | 1 tasse | 330 |
| Jus d’orange (enrichi de calcium)* | 1 tasse | 330 |
| Saumon (rose, en boîte avec arêtes) | 3,5 oz | 281 |
| Tofu (régulier, enrichi de calcium) | 0,5 tasse | 434 |
| Chou frisé (cuit) | 0,5 tasse | 47 |
| Haricots blancs (cuits) | 1 tasse | 161 |
| Amandes (entières, naturelles avec la peau) | 1 tasse | 385 |
Tableau 4.
Sources de vitamine D (aliments et boissons)
| ALIMENT OU BOISSON | PORTION | VITAMINE D, UI |
|---|---|---|
| Huile de foie de morue* | 1 c. à soupe | 1360 |
| Saumon (sockeye, en boîtes avec arêtes) | 3,5 oz | 834 |
| Maquereau (cuit) | 2,5 oz | 219 |
| Lait (enrichi de vitamine D) | 1 tasse | 117 |
| Jus d’orange (enrichi de vitamine D)† | 1 tasse | 100 |
| Boisson de soja (enrichie de vitamine D)† | 1 tasse | 90 |
| Lait d’amande (enrichi de vitamine D)† | 1 tasse | 90 |
| Margarine (enrichie de vitamine D) | 1 tasse | 20 |
| Yogourt (enrichi de vitamine D) | 6 oz | 88 |
| Thon blanc (en boîte avec de l’eau) | 2,5 oz | 60 |
| Œuf (entier cuit) | 1 gros | 44 |
Il faut aussi procéder à l’ostéodensitométrie dès le diagnostic chez les patients exempts de malabsorption, mais qui sont à risque d’atteinte osseuse22. Les facteurs de risque d’ostéoporose sont la périménopause ou la ménopause chez les femmes, l’âge de plus de 50 ans chez les hommes, le tabagisme, un faible indice de masse corporelle, des antécédents de fracture de fragilisation et des titres élevés d’anticorps TGt.
Bien que les données probantes ne soient pas robustes, il semble être prudent de soumettre les patients atteints de la MC subclinique ou asymptomatique à un régime sans gluten, y compris à la supplémentation adéquate en calcium et en vitamine D. Avant de prendre toute décision sur la prise en charge future, il faut répéter l’ostéodensitométrie après 1 an sous traitement22.
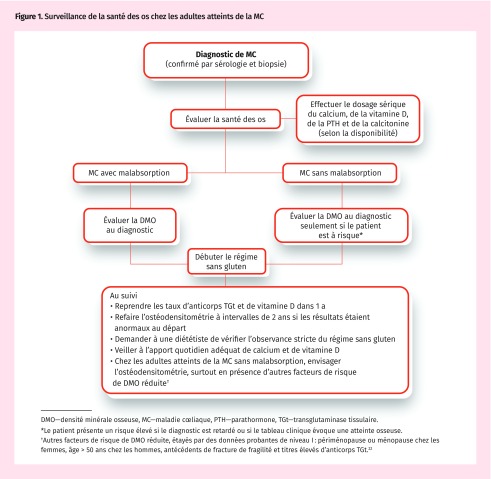
Chez les patients atteints d’ostéoporose ou d’ostéopénie au diagnostic, ou qui n’observent pas le régime sans gluten, il est recommandé de répéter l’ostéodensitométrie après un régime sans gluten avec supplémentation en calcium et vitamine D pendant 1 ou 2 ans. L’observance du régime sans gluten oscille entre 42 et 91 %30. Il faut systématiquement vérifier que le patient se conforme au régime sans gluten, préférablement avec l’aide d’une diététiste expérimentée dans ce type de régime. Si l’ostéodensitométrie est normale au diagnostic, on peut envisager une ostéodensitométrie de suivi 2 ou 3 ans après avoir entrepris un régime sans gluten22. Ces recommandations sont résumées à la Figure 122.
Figure 1.
Surveillance de la santé des os chez les adultes atteints de la MC
DMO—densité minérale osseuse, MC—maladie cœliaque, PTH—parathormone, TGt—transglutaminase tissulaire.
*Le patient présente un risque élevé si le diagnostic est retardé ou si le tableau clinique évoque une atteinte osseuse.
†Autres facteurs de risque de DMO réduite, étayés par des données probantes de niveau I : périménopause ou ménopause chez les femmes, âge > 50 ans chez les hommes, antécédents de fracture de fragilité et titres élevés d’anticorps TGt.22
Santé des os chez les enfants atteints de la MC.
Contrairement aux adultes, les enfants acquièrent leur masse osseuse durant la croissance. Les données canadiennes montrent que l’accumulation de la masse osseuse est maximale dans les 4 années avant et après la croissance linéaire de pointe31. Ainsi, la croissance optimale est la clé de l’accumulation maximale de masse osseuse. Les adolescents atteints de la MC sont à risque élevé puisqu’ils sont dans la période de pointe d’accumulation de la masse osseuse31. Pour cette raison, le diagnostic précoce de MC prévient probablement les enjeux à long terme en matière de santé des os.
Tout comme chez les adultes, la masse osseuse mesurée par ostéodensitométrie est réduite tant chez les enfants symptomatiques qu’asymptomatiques atteints de la MC22–25. Toutefois, lorsque la MC est diagnostiquée à un jeune âge, alors que les symptômes sont apparus depuis moins longtemps, la DMO retourne aux valeurs normales pour l’âge et la taille en 2 ans, à condition que l’enfant suive à la lettre son régime sans gluten avec supplémentation en calcium et vitamine D23. Il n’est donc pas nécessaire de refaire systématiquement l’ostéodensitométrie chez les enfants22. Après avoir posé le diagnostic, il convient d’observer le régime sans gluten et de surveiller la croissance et le taux de vitamine D31,32. Les anomalies de la DMO sont probables lorsque le tableau clinique inclut un retard de croissance, la malabsorption sévère, un retard prolongé du diagnostic ou des données cliniques évoquant une atteinte osseuse, dont douleur osseuse, rachitisme, tétanie ou fractures après un traumatisme minime. Dans ces cas, l’ostéodensitométrie peut être envisagée au diagnostic. Lorsque les anomalies sont dépistées et traitées, il est nécessaire d’assurer un suivi tous les 1 ou 2 ans jusqu’à ce que la DMO se normalise. Cela est particulièrement important chez les adolescents pour qui le rétablissement est plus lent et qui pourraient avoir plus de difficulté à suivre le régime sans gluten. L’interprétation de la DMO durant l’enfance est sujette à certaines considérations spéciales, dont la surveillance des scores z, et non des scores T, liés à l’âge33. Les os sont plus courts et la masse osseuse apparaît réduite chez les enfants en bonne santé qui sont petits, mais ils ne présentent pas un risque accru de fracture33.
L’apport en calcium et en vitamine D est insuffisant chez beaucoup d’enfants canadiens en raison d’une alimentation pauvre en produits laitiers et d’une exposition inadéquate au soleil. Au diagnostic de MC, il est recommandé de mesurer le taux de vitamine D et de fournir une supplémentation au besoin. Il faut expliquer aux enfants en quoi consiste un apport alimentaire adéquat de calcium et de vitamine D (Tableaux 1 et 2)28 et leur prescrire des exercices contre résistance. Les enfants et les adolescents qui n’observent pas strictement le régime sans gluten doivent subir une ostéodensitométrie après 1 an.
Recommandations pour optimiser la santé des os dans la MC.
Les données étayant la prise en charge de la DMO réduite et la prévention des fractures dans la MC sont limitées. L’observance stricte du régime sans gluten semble être le seul traitement efficace pour améliorer la DMO chez les adultes et pour normaliser la DMO chez les enfants22, pour abaisser le risque de fracture. Bien qu’on ne s’entende pas sur la prescription de suppléments de calcium et de vitamine D à tous les patients atteints de MC, il est prudent de s’assurer de l’apport adéquat de calcium et de vitamine D pour tous. Le rôle des inhibiteurs de la résorption osseuse pour réduire le risque de fracture chez les patients atteints de la MC est nébuleux. En l’absence de données probantes robustes liées précisément à la MC, il est recommandé de suivre les lignes directrices de l’Association canadienne de gastro-entérologie, de l’American Gastroenterological Association, de l’Endocrine Society, du Conseil consultatif scientifique d’Ostéoporose Canada et d’autres organisations diététiques22,34–38. Il faut aussi envisager, selon le cas, l’hormonothérapie substitutive chez les femmes en périménopause en s’assurant d’équilibrer les bienfaits potentiels et les risques.
Si après avoir suivi un régime sans gluten pendant 1 ou 2 ans avec supplémentation appropriée en calcium et en vitamine D le patient montre toujours des signes d’ostéoporose, il faut envisager d’ajouter un traitement ostéoactif spécifique, comme les bisphosphonates ou le tériparatide4. Les données étayant ces recommandations dans la MC sont limitées et il faut mener des études appropriées pour aborder cette question.
Résolution du cas
Notre patiente était atteinte de la MC classique avec diarrhée et anémie ferriprive. Parce que son tableau clinique incluait la malabsorption, une ostéodensitométrie a été effectuée au départ et les résultats étaient anormaux. Elle a bien répondu au régime sans gluten et a pris des suppléments de calcium et de vitamine D. Son taux d’anticorps TGt a chuté dans l’intervalle normal. Vu la DMO réduite au diagnostic, il serait raisonnable de répéter l’ostéodensitométrie dans 2 ans pour confirmer que la DMO est normalisée. Si cette patiente n’avait pas présenté les facteurs de risque additionnels d’ostéoporose et si son tableau clinique n’avait pas évoqué la malabsorption sévère, il n’aurait pas été nécessaire de faire l’ostéodensitométrie au diagnostic. La DMO de beaucoup de patients atteints de la MC s’améliore dans la première année après avoir entrepris un régime sans gluten.
Conclusion
La santé des os peut être compromise chez les adultes et les enfants atteints de la MC. Il faut envisager l’ostéodensitométrie dès le diagnostic, surtout chez les adultes. En plus d’un régime strict sans gluten, il faut prescrire des suppléments de calcium et de vitamine D. L’ajout d’un traitement ostéoactif précis, comme les bis-phosphonates ou le tériparatide, doit être réservé aux patients pour lesquels l’ostéoporose persiste malgré la supplémentation prolongée en calcium et vitamine D. Il importe d’assurer un suivi régulier pour surveiller la santé des os chez les patients atteints de MC.
Points de repère du rédacteur
▸ La maladie cœliaque (MC) est un trouble chronique touchant la structure osseuse. Elle nécessite de suivre à vie un régime strict sans gluten, et la surveillance à long terme des patients atteints de la MC doit inclure l’évaluation de la santé des os.
▸ L’évaluation de la santé des os dans la MC avec malabsorption consiste à mesurer la densité minérale osseuse (DMO) au diagnostic. Il faut s’assurer que la malabsorption du calcium, du phosphate et de la vitamine D est corrigée. Au diagnostic, les patients doivent recevoir de l’information sur le régime sans gluten et la nutrition nécessaire pour rétablir la santé des os. L’apport en calcium et en vitamine D doit être optimisé par des sources alimentaires autant que possible. Il faut encourager les patients à faire des exercices contre résistance, à limiter leur apport en alcool et à éviter la cigarette.
▸ Les données probantes en matière de prise en charge de la DMO réduite et de prévention des fractures dans la MC sont limitées. L’observance d’un régime strict sans gluten semble être le seul traitement efficace pour améliorer la DMO chez les adultes atteints de la MC et réduire le risque de fracture.
Footnotes
Collaborateurs
Tous les auteurs ont contribué à la revue et à l’interprétation de la littérature, et à la préparation du manuscrit aux fins de soumission.
Intérêts concurrents
Aucun déclaré
Cet article donne droit à des crédits d’autoapprentissage certifié Mainpro+. Pour obtenir des crédits, rendez-vous sur www.cfp.ca et cliquez sur le lien Mainpro+.
Cet article a fait l’objet d’une révision par des pairs.
The English version of this article is available at www.cfp.ca on the table of contents for the June 2018 issue on page 433.
Références
- 1.Ludvigsson JF, Leffler DA, Bai JC, Biagi F, Fasano A, Green PH, et al. The Oslo definitions for coeliac disease and related terms. Gut. 2013;62(1):43–52. doi: 10.1136/gutjnl-2011-301346. Publ. en ligne du 16 févr. 2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Pinto-Sánchez MI, Bercik P, Verdu EF, Bai JC. Extraintestinal manifestations of celiac disease. Dig Dis. 2015;33(2):147–54. doi: 10.1159/000369541. Publ. en ligne du 22 avr. 2015. [DOI] [PubMed] [Google Scholar]
- 3.Ludvigsson JF, Bai JC, Biagi F, Card TR, Ciacci C, Ciclitira PJ, et al. Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Gut. 2014;63(8):1210–28. doi: 10.1136/gutjnl-2013-306578. Publ. en ligne du 10 juin 2014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Silvester JA, Rashid M. Long-term management of patients with celiac disease: current practices of gastroenterologists in Canada. Can J Gastroenterol. 2010;24(8):499–509. doi: 10.1155/2010/140289. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Zanchetta MB, Longobardi V, Bai JC. Bone and celiac disease. Curr Osteoporos Rep. 2016;14(2):43–8. doi: 10.1007/s11914-016-0304-5. [DOI] [PubMed] [Google Scholar]
- 6.Corazza G, Di Stefano M, Mauriño E, Bai JC. Bones in coeliac disease: diagnosis and treatment. Best Pract Res Clin Gastroenterol. 2005;19(3):453–65. doi: 10.1016/j.bpg.2005.01.002. [DOI] [PubMed] [Google Scholar]
- 7.Bianchi ML, Bardella MT. Bone in celiac disease. Osteoporos Int. 2008;19(12):1705–16. doi: 10.1007/s00198-008-0624-0. Publ. en ligne du 17 avr. 2008. [DOI] [PubMed] [Google Scholar]
- 8.Di Stefano M, Mengoli C, Bergonzi M, Corazza GR. Bone mass and mineral metabolism alterations in adult celiac disease: pathophysiology and clinical approach. Nutrients. 2013;5(11):4786–99. doi: 10.3390/nu5114786. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Grace-Farfaglia P. Bones of contention: bone mineral density recovery in celiac disease—a systematic review. Nutrients. 2015;7(5):3347–69. doi: 10.3390/nu7053347. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Larussa T, Suraci E, Nazionale I, Abenavoli L, Imeneo M, Luzza F. Bone mineralization in celiac disease. Gastroenterol Res Pract. 2012;2012:198025. doi: 10.1155/2012/198025. Publ. en ligne du 18 avr. 2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Mazure R, Vazquez H, Gonzalez D, Mautalen C, Pedreira S, Boerr L, et al. Bone mineral affection in asymptomatic adult patients with celiac disease. Am J Gastroenterol. 1994;89(12):2130–4. [PubMed] [Google Scholar]
- 12.Rios LP, Khan A, Sultan M, McAssey K, Fouda MA, Armstrong D. Approach to diagnosing celiac disease in patients with low bone mineral density or fragility fractures. Multidisciplinary task force report. Can Fam Physician. 2013;59:1055–61. (Eng), e441–8 (Fr). [PMC free article] [PubMed] [Google Scholar]
- 13.Zanchetta MB, Costa F, Longobardi V, Longarini G, Mazure RM, Moreno ML, et al. Significant bone microarchitecture impairment in premenopausal women with active celiac disease. Bone. 2015;76:149–57. doi: 10.1016/j.bone.2015.03.005. Publ. en ligne du 14 mars 2015. [DOI] [PubMed] [Google Scholar]
- 14.Stein EM, Rogers H, Leib A, McMahon DJ, Young P, Nishiyama K, et al. Abnormal skeletal strength and microarchitecture in women with celiac disease. J Clin Endocrinol Metab. 2015;100(6):2347–53. doi: 10.1210/jc.2015-1392. Publ. en ligne du 13 avr. 2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Olmos M, Antelo M, Vazquez H, Smecuol E, Mauriño E, Bai JC. Systematic review and meta-analysis of observational studies on the prevalence of fractures in coeliac disease. Dig Liver Dis. 2008;40(1):46–53. doi: 10.1016/j.dld.2007.09.006. Publ. en ligne du 19 nov. 2007. [DOI] [PubMed] [Google Scholar]
- 16.Heikkilä K, Pearce J, Mäki M, Kaukinen K. Celiac disease and bone fractures: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2015;100(1):25–34. doi: 10.1210/jc.2014-1858. [DOI] [PubMed] [Google Scholar]
- 17.Moreno ML, Vazquez H, Mazure R, Smecuol E, Niveloni S, Pedreira S, et al. Stratification of bone fracture risk in patients with celiac disease. Clin Gastroenterol Hepatol. 2004;2(2):127–34. doi: 10.1016/s1542-3565(03)00320-3. [DOI] [PubMed] [Google Scholar]
- 18.Sánchez MI, Mohaidle A, Baistrocchi A, Matoso D, Vázquez H, Gonzalez A, et al. Risk of fracture in celiac disease: gender, dietary compliance, or both? World J Gastroenterol. 2011;17(25):3035–42. doi: 10.3748/wjg.v17.i25.3035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.González D, Mazure R, Mautalen C, Vazquez H, Bai JC. Body composition and bone mineral density in untreated and treated patients with celiac disease. Bone. 1995;16(2):231–4. doi: 10.1016/8756-3282(94)00034-w. [DOI] [PubMed] [Google Scholar]
- 20.Ferretti J, Mazure R, Tanoue P, Marino A, Cointry G, Vazquez H, et al. Analysis of the structure and strength of bones in celiac disease patients. Am J Gastroenterol. 2003;98(2):382–90. doi: 10.1111/j.1572-0241.2003.07237.x. [DOI] [PubMed] [Google Scholar]
- 21.Duerksen DR, Leslie WD. Longitudinal evaluation of bone mineral density and body composition in patients with positive celiac serology. J Clin Densitom. 2011;14(4):478–83. doi: 10.1016/j.jocd.2011.06.002. Publ. en ligne du 17 août 2011. [DOI] [PubMed] [Google Scholar]
- 22.Fouda MA, Khan AA, Sultan MS, Rios LP, McAssey K, Armstrong D. Evaluation and management of skeletal health in celiac disease: position statement. Can J Gastroenterol. 2012;26(11):819–29. doi: 10.1155/2012/823648. Errata dans : Can J Gastroenterol Hepatol 2017;2017:1323607. Publ. en ligne du 2 juil. 2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Mora S, Barera G, Ricotti A, Weber G, Bianchi C, Chiumello G. Reversal of low bone density with a gluten-free diet in children and adolescents with celiac disease. Am J Clin Nutr. 1998;67(3):477–81. doi: 10.1093/ajcn/67.3.477. [DOI] [PubMed] [Google Scholar]
- 24.Scotta MS, Salvatorre S, Salvatoni A, De Amici M, Ghiringhelli D, Broggini M, et al. Bone mineralization and body composition in young patients with celiac disease. Am J Gastroenterol. 1997;92(8):1331–4. [PubMed] [Google Scholar]
- 25.Kavak US, Yüce A, Koçak N, Demir H, Saltik IN, Gürakan F, et al. Bone mineral density in children with untreated and treated celiac disease. J Pediatr Gastroenterol Nutr. 2003;37(4):434–6. doi: 10.1097/00005176-200310000-00007. [DOI] [PubMed] [Google Scholar]
- 26.Ludvigsson JF, Michaelsson K, Ekbom A, Montgomery SM. Coeliac disease and the risk of fractures - a general population-based cohort study. Aliment Pharmacol Ther. 2007;25(3):273–85. doi: 10.1111/j.1365-2036.2006.03203.x. [DOI] [PubMed] [Google Scholar]
- 27.Scott EM, Gaywood I, Scott BB. Guidelines for osteoporosis in coeliac disease and inflammatory bowel disease. Gut. 2000;46(Suppl 1):i1–8. doi: 10.1136/gut.46.suppl_1.I1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Santé Canada . La vitamine D et le calcium : Révision des apports nutritionnels de référence. Ottawa, ON: Gouvernement du Canada; 2012. Accessible à : https://www.canada.ca/fr/sante-canada/services/aliments-nutrition/saine-alimentation/vitamines-mineraux/vitamine-calcium-revision-apports-nutritionnels-reference.html. Réf. du 24 avr. 2018. [Google Scholar]
- 29.United States Department of Agriculture [site Web] USDA Food Composition Databases. Beltsville, MD: United States Department of Agriculture; 2018. Accessible à : https://ndb.nal.usda.gov/ndb/. Réf. du 24 avr. 2018. [Google Scholar]
- 30.Hall NJ, Rubin G, Charnock A. Systematic review: adherence to a gluten-free diet in adult patients with coeliac disease. Aliment Pharmacol Ther. 2009;30(4):315–30. doi: 10.1111/j.1365-2036.2009.04053.x. Publ. en ligne du 26 mai 2009. [DOI] [PubMed] [Google Scholar]
- 31.Bailey DA. The Saskatchewan Pediatric Bone Mineral Accrual Study: bone mineral acquisition during the growing years. Int J Sports Med. 1997;18(Suppl 3):S191–4. doi: 10.1055/s-2007-972713. [DOI] [PubMed] [Google Scholar]
- 32.Blazina S, Bratanic N, Campa AS, Blagus R, Orel R. Bone mineral density and importance of strict gluten-free diet in children and adolescents with celiac disease. Bone. 2010;47(3):598–603. doi: 10.1016/j.bone.2010.06.008. Publ. en ligne du 19 juin 2010. [DOI] [PubMed] [Google Scholar]
- 33.Wasserman H, O’Donnell JM, Gordon CM. Use of dual energy x-ray absorptiometry in pediatric patients. Bone. 2017;104:84–90. doi: 10.1016/j.bone.2016.12.008. Publ. en ligne du 15 déc. 2016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.American Gastroenterological Association medical position statement: guidelines on osteoporosis in gastrointestinal diseases Gastroenterology. 2003;124(3):791–4. doi: 10.1053/gast.2003.50107. [DOI] [PubMed] [Google Scholar]
- 35.Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011;96(7):1911–30. doi: 10.1210/jc.2011-0385. Publ. en ligne du 6 juin 2011. Errata dans : J Clin Endocrinol Metab 2011;96(12):3908. [DOI] [PubMed] [Google Scholar]
- 36.Papaioannou A, Morin S, Cheung AM, Atkinson S, Brown JP, Feldman S, et al. 2010 Clinical practice guidelines for the diagnosis and management of osteoporosis in Canada: summary. CMAJ. 2010;182(17):1864–73. doi: 10.1503/cmaj.100771. Publ. en ligne du 12 oct. 2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Les diététistes du Canada [site Web] Sources alimentaires de calcium. Toronto, ON: Les diététistes du Canada; 2016. Accessible à : https://www.dietitians.ca/Your-Health/Nutrition-A-Z/Calcium/Food-Sources-of-Calcium.aspx. Réf. du 8 mai 2016. [Google Scholar]
- 38.Ostéoporose Canada . La nutrition. Une alimentation saine pour des os en santé. Toronto, ON: Ostéoporose Canada; 2012. Accessible à : https://osteoporosis.ca/wp-content/uploads/OC_Nutrition_FRE-1.pdf. Réf. du 23 avr. 2018. [Google Scholar]