Abstract
背景与目的
已有的研究表明结肠癌转移相关基因1(metastasis-associated in colon cancer 1, MACC1)是一个与肿瘤浸润转移相关的新基因,该基因能够调节肝细胞生长因子受体(hepatocyte growth factor receptor, c-met)的表达。本研究旨在探讨MACC1和c-met在非小细胞肺癌(non-small cell lung cancer, NSCLC)组织中的表达及其与浸润转移和预后的关系。
方法
采用免疫组化检测103例NSCLC组织及40例癌旁正常组织中MACC1和c-met蛋白的表达。
结果
MACC1和c-met在NSCLC组中的阳性表达率均明显高于正常肺组织(P < 0.001)。MACC1和c-met阳性率均与肺癌的分化程度、T分期、淋巴结转移和TNM分期相关(P < 0.05),而与性别、年龄、吸烟及组织学类型等无关(P > 0.05)。MACC1和c-met的表达呈正相关(r=0.403, P < 0.001)。Kaplan-Meier生存曲线显示MACC1和c-met阳性组5年生存率均明显低于阴性组(P < 0.05)。Cox多因素分析显示MACC1是NSCLC的独立预后因素(P=0.026)。
结论
MACC1和c-met的表达与肺癌的分化、浸润和转移密切相关,两者均对生存期有一定的影响,MACC1是NSCLC的独立预后危险因素。
Keywords: 肺肿瘤, MACC1, c-met, 浸润, 转移, 预后
Abstract
Background and objective
It has been proven that metastasis-associated in colon cancer 1 (MACC1) is a new gene that is related to the invasion and metastasis of tumors. MACC1 also regulates c-met expression. The aim of this study is to explore the expressions of MACC1 and hepatocyte growth factor receptor (c-met), and its relationship with invasion, metastasis, and prognosis of non-small cell lung cancer (NSCLC).
Methods
MACC1 and c-met expressions were detected in 103 cases of NSCLC and 40 cases of neighboring normal lung cancer tissue using immunohistochemistry.
Results
MACC1 and c-met expressions were significantly higher in lung cancer tissues than that in neighboring normal tissue (P < 0.001). MACC1 and c-met expressions were associated with poor differentiation, advanced T stages, lymph node metastasis, and advanced TNM stages (P < 0.05) of NSCLC, but not with sex, age, smoking, and histological classification (P > 0.05). In addition, a positive correlation between MACC1 and c-met expressions was observed (r=0.403, P < 0.001). The result from the Kaplan-Meier survival analysis showed that the five-year survival rate in patients with positive MACC1 and c-met expressions was remarkanly lower than that in patients with negative expressions (P < 0.05). The result from the Cox regression analysis showed that MACC1 expression was an independent prognostic factor for NSCLC (P=0.026).
Conclusions
MACC1 and c-met have an important function in the differentiation, invasion, and metastasis of NSCLC. MACC1 and c-met have poor prognosis in patients with NSCLC. Moreover, MACC1 expression is an independent prognostic factor for NSCLC.
Keywords: Lung neoplasms, MACC1, c-met, Invasion, Metastasis, Prognosis
目前,肺癌死亡率已位居男、女性恶性肿瘤的第一位[1],全球每年至少有160万的新发病例和130万的死亡病例。非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺癌总数的80%。侵润和转移是恶性肿瘤最重要的生物学特征之一,亦是导致患者死亡的主要原因。肺癌易发生浸润和转移,其5年生存率低。目前有关肺癌浸润转移的机制尚不完全清楚,因此探索与肺癌浸润转移尤其是与预后相关的生物学指标,显得尤为重要。研究[2]表明,结肠癌转移相关基因1(metastasis-associated in colon cancer 1, MACC1)是2009年新发现的,能够预测肿瘤浸润转移及预后的新基因,其机制可能与调节肝细胞生长因子(hepatocyte growth factor,HGF,又称离散因子)及其受体c-met表达有关。为此,我们采用免疫组化联合检测了MACC1和c-met在NSCLC组织中的表达情况,并分析了它们与肺癌临床病理特征及预后的关系。
1. 材料与方法
1.1. 材料
选取2003年1月-2006年1月在川北医学院第二临床学院胸心外科手术标本103例和同期40例距离癌肿边缘5 cm以上的正常组织。所有患者术前均未化疗或放疗,有完整的临床资料和明确的术后病理诊断。其中男性77例,女性26例; < 60岁51例,≥60岁52例;不吸烟42例,吸烟61例;鳞癌56例,腺癌47例;高分化15例,中分化68例,低分化20例;T1期+T2期78例,T3期+T4期25例;N0期70例,N1, 2, 3期33例;Ⅰ期56例,Ⅱ期12例,Ⅲ期35例。
随访:所有患者每3个月均进行电话、门诊或住院部随访,随访开始于2003年4月,2011年1月结束,最短随访时间为4个月,最长随访时间为5年。期间有9例失访。
1.2. 免疫组化检测MACC1和c-met蛋白的表达
手术标本经10%甲醛固定后,常规石蜡包埋、切片,厚度4 μm。采用免疫组化SP法(兔抗人MACC1多克隆抗体购自美国Sigma公司,兔抗人c-met多克隆抗体购自北京博奥森生物技术有限公司,免疫组化二抗SP试剂盒购自北京中杉生物公司)。用PBS液代替一抗作为阴性对照,按照试剂说明书进行操作。结果判断:所有切片均采用双盲法由两位病理科医师独立阅片。MACC1和c-met阳性表达均定位于细胞浆和细胞膜,呈浅黄色、黄色或棕黄色。随机选择10个高倍镜视野(400倍),每个视野连续计数100个细胞,共计数1, 000个细胞。最后表达以染色强度和阳性细胞率的得分之和进行判断:无染色记0分,弱染色记1分,中等染色记2分,强染色记3分;阳性细胞率 < 5%记0分,5%-25%记1分,26%-50%记2分, > 50%记3分。上述两项评分相加, < 3分为阴性,≥3分为阳性。
1.3. 统计学处理
采用SPSS 17.0统计学软件包分析。率的比较采用χ2检验或Fisher精确检验,单因素生存分析采用Kaplan-Meier生存曲线和Log-rank检验,多因素生存分析采用Cox多因素分析模型,以P < 0.05为差异有统计学意义。
2. 结果
2.1. MACC1和c-met蛋白检测结果
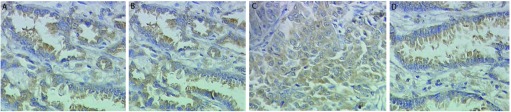
MACC1和c-met在癌组中的阳性率分别为67.9%(70/103)和68.9%(71/103),均明显高于其在正常组织中的表达5.0%(2/40)(χ2=45.684, P < 0.001)和7.5%(3/40)(χ2=43.545, P < 0.001)(图 1)。
1.
免疫组化检测MACC1在肺鳞癌(A)和腺癌(B)以及c-met在肺鳞癌(C)和腺癌(D)组织中的阳性表达(×400)
The positive expression of MACC1 in lung squamous carcinoma (A) and adenocarcinoma (B), c-met in lung squamous carcinoma (C) and adenocarcinoma (D) tissue by immunohistochemistry (×400).
2.2. MACC1蛋白表达与肺癌临床病理特征的联系
统计学结果显示,MACC1和c-met的阳性率均随肿瘤分化程度的降低、T分期的增加、淋巴结转移和TNM分期的增加而增加(P < 0.05),而与性别、年龄、吸烟及组织学类型等无关(P > 0.05)(表 1)。
1.
MACC1和c-met的表达与NSCLC的临床病理特征联系
Correlation of MACC1 and c-met expression with clinicopathologic characteristics of NSCLC
| Variable | n | MACC1+ (%) | χ2 | P | c-met+ (%) | χ2 | P |
| Sex | 0.666 | 0.414 | 0.666 | 0.414 | |||
| Male | 77 | 56 (72.7%) | 56 (72.7%) | ||||
| Female | 26 | 21 (80.8%) | 21 (80.8%) | ||||
| Age (year) | 0.320 | 0.571 | 0.025 | 0.875 | |||
| < 60 | 51 | 36 (70.6%) | 37 (72.5%) | ||||
| ≥60 | 52 | 34 (65.4%) | 37 (71.2%) | ||||
| Smoking | 1.195 | 0.274 | 0.006 | 0.938 | |||
| No | 42 | 26 (61.9%) | 30 (71.4%) | ||||
| Yes | 61 | 44 (72.1%) | 44 (72.1%) | ||||
| Pathological type | 0.064 | 0.800 | 0.604 | 0.437 | |||
| Squamous carcinoma | 56 | 30 (53.6%) | 42 (75.0%) | ||||
| Adenocarcinoma | 47 | 24 (51.1%) | 32 (68.1%) | ||||
| Differentiation | 5.536 | 0.019 | 4.044 | 0.044 | |||
| Well and moderate | 83 | 52 (62.7%) | 56 (67.5%) | ||||
| Poor | 20 | 18 (90.0%) | 18 (90.0%) | ||||
| T stage | 3.900 | 0.048 | 4.260 | 0.039 | |||
| T1-T2 | 78 | 49 (62.8%) | 52 (66.7%) | ||||
| T3-T4 | 25 | 21 (84.0%) | 22 (88.0%) | ||||
| Lymphatic metastasis | 4.282 | 0.039 | 4.059 | 0.044 | |||
| N0 | 70 | 43 (61.4%) | 46 (65.7%) | ||||
| N1-N2 | 33 | 27 (81.8%) | 28 (84.8%) | ||||
| TNM stages | 7.674 | 0.006 | 5.042 | 0.025 | |||
| Ⅰ+Ⅱ | 68 | 40 (58.8%) | 44 (64.7%) | ||||
| Ⅲ | 35 | 30 (85.7%) | 30 (85.7%) |
2.3. MACC1和c-met相关性分析
经Spearman秩相关分析发现,在103例肺癌组织中MACC1和c-met的表达呈正相关,(r=0.403, P < 0.001)。
2.4. 生存分析
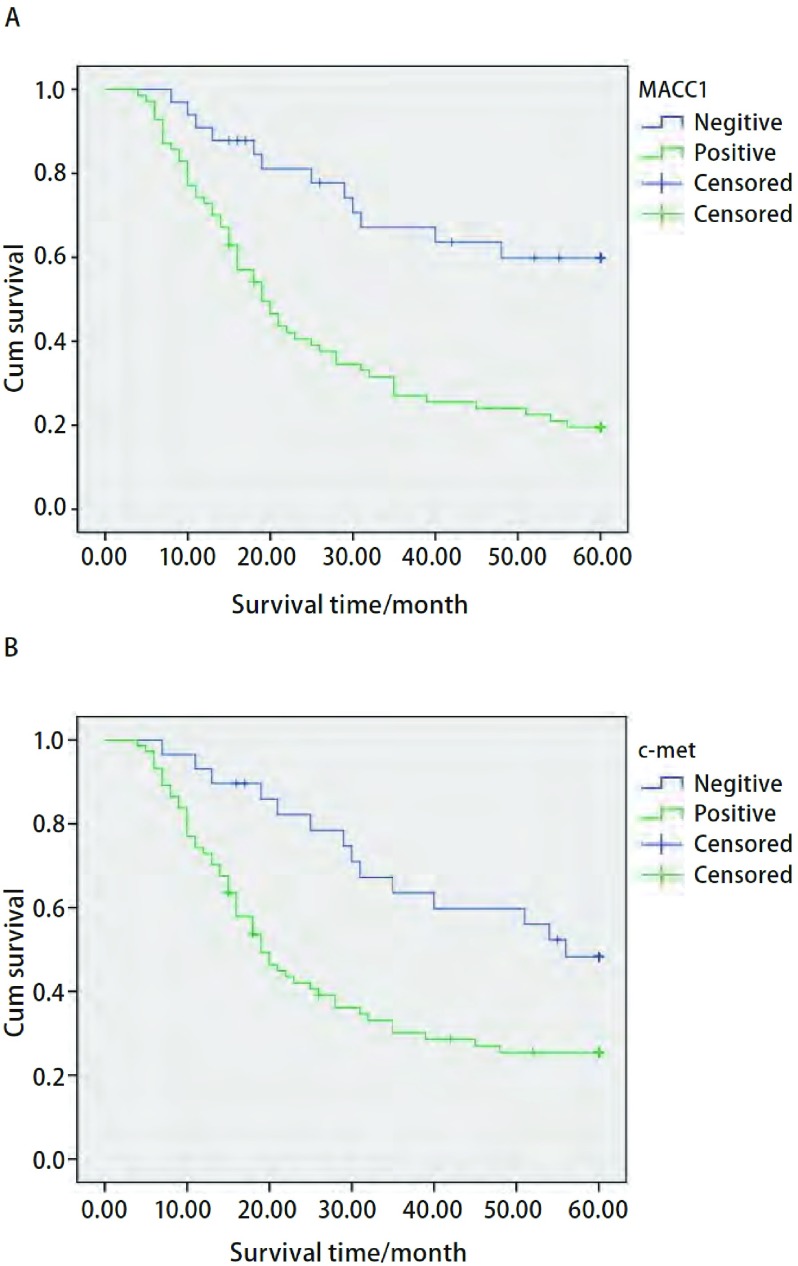
Kaplan-Meier生存曲线显示,MACC1阳性组的5年生存率为19.5%,明显低于阴性组的59.9%(χ2=15.093, P < 0.001)。c-met阳性组5年生存率为25.4%,明显低于阴性组的48.3%(χ2=8.230, P=0.004)(图 2)。
2.
Kaplan-Meier累计生存时间曲线分析。A:MACC1表达阳性和阴性NSCLC患者;B:c-met表达阳性和阴性NSCLC患者。
Kaplan-Meier cumulative survival time curves analysis. A: MACC1 positive and negative expression group of NSCLC petients; B: c-met positive and negative expression group of NSCLC petients; NSCLC: non-small cell lung cancer.
2.5. Cox多因素回归分析
Kaplan-Meier单因素分析发现,分化程度、T分期、淋巴结转移、TNM分期均与患者的生存期相关,故均纳入Cox多因素分析模型。Cox多因素分析结果显示,只有MACC1(P=0.026)和TNM分期(P=0.004)是肺癌患者的独立预后危险因素,其相对危险度(relative risk, RR)分别为2.178(95%CI: 1.097-4.327)和2.230(95%CI: 1.288-3.860),而c-met表达不是患者的独立危险因素(P > 0.05)(表 2)。
2.
Cox方程中的变量
Cox variables in the Equation
| Variables | B | SE | Wald | df | Sig. | RR | RR (95%CI) | |
| Lower limit | Upper limit | |||||||
| RR: relative risk. | ||||||||
| MACC1 | 0.779 | 0.350 | 4.943 | 1 | 0.026 | 2.178 | 1.097 | 4.327 |
| c-met | 0.236 | 0.338 | 0.487 | 1 | 0.485 | 1.266 | 0.653 | 2.455 |
| TNM stages | 0.802 | 0.280 | 8.209 | 1 | 0.004 | 2.230 | 1.288 | 3.860 |
| Lymphatic metastasis | 0.663 | 0.474 | 1.956 | 1 | 0.162 | 1.940 | 0.767 | 4.909 |
| T stages | 0.170 | 0.192 | 0.785 | 1 | 0.376 | 1.185 | 0.814 | 1.727 |
| Differentiation | 0.275 | 0.230 | 1.421 | 1 | 0.233 | 1.316 | 0.838 | 2.067 |
3. 讨论
MACC1基因定位于人染色体7p21.1。该基因是2009年由Stein等[2]发现并命名的一个新基因,研究表明它与结肠癌的浸润、转移及预后密切相关。Stein检测到MACC1在结肠癌组织中表达异常增高,在有远处转移病例中其表达明显高于无转移者,MACC1高表达者5年生存率为15%明显低于低表达者的80%,且是结肠癌转移的独立预后指标。后来研究表明,MACC1在胃癌[3]、肝癌[4-5]、卵巢癌[6]、肺腺癌[7]、前列腺癌[8]等腺癌组织及膀胱移行细胞癌[9]、脑胶质瘤[10]、小细胞肺癌细胞系[11]等非腺癌组织中过表达,并且与浸润转移密切相关。MACC1高表达的肝癌组患者总生存率和无病生存率均明显低于低表达组[5]。在肺癌的研究中,Chundong等[7]采用免疫组化方法对197例手术后肺腺癌患者研究结果显示,MACC1的阳性率为65.5%,在复发组中的阳性率为82.5%(33/40),明显高于非复发组的61.1%(96/157),阳性组无病生存期较阴性组降低。杨淑慧等[11]观察到MACC1在小细胞肺癌细胞系中高表达,用MACC1 siRNA抑制其表达后,能明显抑制癌细胞的增殖迁移能力。
HGF是一种多功能细胞活性因子,具有很强的促有丝分裂作用,可诱导上皮细胞和成纤维细胞发生离散和运动。c-met是由原癌基因编码的HGF受体,主要在各种上皮细胞中表达。c-met编码了酪氨酸激酶,可调节肿瘤细胞侵袭性生长。HGF须与c-met受体结合方能发挥作用,两者结合导致两个酪氨酸残端在羧基端的磷酸化,引起一系列信号转导蛋白的酶促反应,从而调节相应的生物学行为,如细胞的运动等。正常的HGF/c-met通路在调节胚胎发育及组织损伤修复,而异常激活促进肿瘤的转移。HGF/c-met在多种恶性肿瘤组织中异常表达,并且与肿瘤的进展密切相关[12, 13]。
MACC1是HGF/c-met信号通路的一个关键调节因子。c-met已被证明是MACC1的转录子靶点[2],它能通过扩增和(或)变异而不依赖与HGF的结合来激活。MACC1调节c-met的机制,可能是与c-met启动子区的SP1位点结合,从而激活c-met,促进其转录。HGF与c-met结合后,能启动下游3条信号途径:①磷脂酰肌醇3-激酶(PI3K);②信号转导及转录激活因子(STAT);③有丝分裂原活化激酶(MAPK)。这3条通路是细胞核内主要转录机构,从而促使肿瘤细胞增殖、运动、浸润、转移及血管生成等。另外,MACC1还可通过促进细胞外基质的降解、调节细胞骨架的结构[8]等方面,促进肿瘤的浸润和转移。
本研究结果显示,MACC1和c-met蛋白均在NSCLC组织中呈过表达。虽然文献多数报道MACC1在腺癌中高表达,但本研究首次报道了其在鳞癌组织中的高表达,与腺癌组织中的表达无统计学差异,这可能与MACC1(与c-met相关)在肿瘤的发展过程中普遍起作用相关,这已在膀胱癌[9]、脑胶质瘤[10]、小细胞肺癌细胞系[11]非腺癌中得到证实。本研究表明,MACC1和c-met蛋白的异常表达均与肺癌的分化程度、T分期、淋巴结转移和TNM分期密切相关,与文献报道基本一致。T分期是肿瘤体积的大小和侵袭能力的综合反应,提示MACC1参与了肿瘤的分化、增殖、侵袭和转移等。本研究中MACC1和c-met的表达呈正相关(r=0.403, P < 0.001),与Zhang[6]在卵巢癌中的报道(r=0.429, P=0.002)基本一致,但高于Qiu[5]在肝癌中对两者mRNA检测的报道(r=0.235, P=0.009),导致这种差异可能与肿瘤的类型、蛋白/mRNA检测的差异及样本量有关。本研究生存分析显示,MACC1和c-met的高表达均预示肺癌的不良预后,其中MACC1是肺癌独立预后危险因素,这与Stein[2]在结肠癌、Qiu[5]在肝癌及Chundong[7]在肺腺癌中的报道基本一致,提示MACC1可能是肿瘤的一个重要独立预后分子指标。
综上所述,我们的研究揭示了MACC1和c-met均在肺癌组织中过表达,其表达与肺癌的分化、浸润转移相关,它们对生存期均有一定的影响,而MACC1可能是肺癌的一项新的独立预后指标。因此,通过检测MACC1和c-met的表达可以更好的判断肺癌的恶性程度和预后,设想通过抑制MACC1的表达,抑制肿瘤浸润转移等,改善肺癌的不良预后,为肿瘤的靶向治疗提供新的靶点,为肿瘤发病机制的研究提供新的思路。
Contributor Information
付 曦 (Xi FU), Email: 2434771363@qq.com.
文 世民 (Shimin WEN), Email: wensmin@yahoo.cn.
References
- 1.Jema A, Bray F, Center MM, et al. Global Cancer Statistics. CA Cancer J Clin. 2011;61(2):69–90. doi: 10.3322/caac.v61:2. [DOI] [PubMed] [Google Scholar]
- 2.Stein U, Walther W, Arlt F, et al. MACC1, a newly identified key regulator of HGF-MET signaling, predicts colon cancer metastasis. Nature Med. 2009;15(1):59–67. doi: 10.1038/nm.1889. [DOI] [PubMed] [Google Scholar]
- 3.Shirahata A, Sakata M, Kitamura Y, et al. MACC 1 as a marker for peritoneal-disseminated gastric carcinoma. http://ar.iiarjournals.org/content/30/9/3441.figures-only. Anticancer Res. 2010;30(9):3441–3444. [PubMed] [Google Scholar]
- 4.Shirahata A, Fan W, Sakuraba K, et al. MACC1 as a marker for vascular invasive hepatocellular carcinoma. Anticancer Res. 2011;31(3):777–780. [PubMed] [Google Scholar]
- 5.Qiu J, Huang P, Liu Q, et al. Identification of MACC1 as a novel prognostic marker in hepatocellular carcinoma. J Transl Med. 2011;9:166. doi: 10.1186/1479-5876-9-166. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Zhang R, Shi H, Chen Z, et al. Effects of metastasis-associated in colon cancer 1 inhibition by small hairpin RNA on ovarian carcinoma OVCAR-3 cells. J Exp Clin Cancer Res. 2011;30:83. doi: 10.1186/1756-9966-30-83. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Chundong G, Uramoto H, Onitsuka T, et al. Molecular diagnosis of MACC1 status in lung adenocarcinoma by immunohistochemical analysis. Anticancer Res. 2011;31(4):1141–1145. [PubMed] [Google Scholar]
- 8.Lv X. The effect of MACC1 on invasion and metastasis in prostate cancer cell lines (1E8/2B4). Wu Han. Huazhong University of Science and Technology. 2011.; 吕煊. MACC1对前列腺癌体外侵袭转移能力的影响[M]. 武汉. 华中科技大学. 2011.
- 9.Wu J, Zhang X, Zhu YL. The expression of MACC1 in bladder carcinoma and clinicasignificance. http://d.wanfangdata.com.cn/Periodical_jsyy201101034.aspx Jiangsu Yi Yao. 2011;37(1):101–102. [Google Scholar]; 吴 健, 张 昶, 朱 亚宁. MACC1在膀胱癌中的表达及临床意义. http://d.wanfangdata.com.cn/Periodical_jsyy201101034.aspx 江苏医药. 2011;37(1):101–102. [Google Scholar]
- 10.Shang C, Hong Y, Xue YX. The expression of MACC1 gene in brain glioma and the influence to apoptosis in U87 cell. http://d.old.wanfangdata.com.cn/Periodical/jpkxjz201101001 Jie Pou Xue Jin Zhan. 2011;17(1):1–3. [Google Scholar]; 尚 超, 洪 杨, 薛 一雪. MACC1基因在脑胶质瘤中的表达及其对U87细胞凋亡和增殖的影响. http://d.old.wanfangdata.com.cn/Periodical/jpkxjz201101001 解剖科学进展. 2011;17(1):1–3. [Google Scholar]
- 11.Yang SH, Long YM, Wang YX, et al. Influence of MACC1 gene expression on the proliferation and migration of SBC-5 lung cancer cells. http://d.wanfangdata.com.cn/Periodical_sxzlyx201104004.aspx Xian Dai Zhong Liu Yi Xue. 2011;19(4):633–636. [Google Scholar]; 杨 淑慧, 龙 摇敏, 王 摇希, et al. MACC1基因siRNA对肺癌SBC-5细胞增殖和迁移的影响. http://d.wanfangdata.com.cn/Periodical_sxzlyx201104004.aspx 现代肿瘤医学. 2011;19(4):633–636. [Google Scholar]
- 12.Eder JP, Vande Woude GF, Boerner SA, et al. Novel therapeutic inhibitors of the c-met signaling pathway in cancer. Clin Cancer Res. 2009;15(7):2207–2214. doi: 10.1158/1078-0432.CCR-08-1306. [DOI] [PubMed] [Google Scholar]
- 13.Graveel CR, DeGroot JD, Su Y, et al. Met induces diverse mammary carcinomas in mice and is associated with human basal breast cancer. Proc Natl Acad Sci USA. 2009;106(31):12909–12914. doi: 10.1073/pnas.0810403106. [DOI] [PMC free article] [PubMed] [Google Scholar]