Abstract
背景与目的
肺癌位居全球癌症相关死亡率的首位,其中肿瘤转移是导致肺癌患者死亡的主要原因,研究表明miR-373与多种肿瘤细胞的侵袭转移有密切关系。本研究旨在探讨miR-373-3p在非小细胞肺癌(non-small cell lung cancer, NSCLC)中的表达情况及其对肺腺癌细胞侵袭转移能力的影响。
方法
利用qRT-PCR法检测miR-373-3p在NSCLC组织和肺腺癌细胞株中的表达。瞬时转染hsa-miR-373-3p的mimics和inhibitor至肺腺癌H1299和A549细胞株中,利用Transwell小室检测转染后肺腺癌细胞侵袭转移能力的改变,Western blot检测转染后肺腺癌细胞中基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)及MMP-14蛋白水平的改变。
结果
miR-373-3p在51例NSCLC组织和5种肺腺癌细胞株中均明显高表达。在miR-373-3p低表达的H1299细胞中过表达miR-373-3p,细胞的侵袭转移能力明显提高,同时MMP-9及MMP-14的表达上调;在miR-373-3p高表达的A549细胞中抑制miR-373-3p表达,细胞的侵袭转移能力下降,并且下调MMP-9和MMP-14的表达。
结论
miR-373-3p可能通过正向调节MMP-9、MMP-14的表达而促进肺腺癌细胞的侵袭转移能力。
Keywords: 肺肿瘤, MiR-373, MMP-9, MMP-14, 侵袭, 转移
Abstract
Background and objective
Lung cancer is the leading cause of cancer-related deaths worldwide, and metastasis is the major cause of death in lung cancer patients. MiR-373 is closely associated with invasion and metastasis in other tumor cells. This study explored the expression of miR-373-3p in non-small cell lung cancer (NSCLC) and its effect on the invasive and metastatic capabilities of lung adenocarcinoma cells, as well as their mechanisms of action.
Methods
The expression of miR-373-3p in NSCLC tissues and lung adenocarcinoma cell lines was detected by quantitative reverse transcription polymerase chain reaction. The roles of miR-373-3p in regulating lung adenocarcinoma cell invasion and metastatic properties were analyzed with miR-373-3p mimic/inhibitor-transfected cells via Transwell chamber assay. Matrix metalloproteinase MMP-9 and MMP-14 protein levels were detected by Western blot in lung cancer cells after transfection.
Results
MiR-373-3p was upregulated in 51 NSCLC tissues and 5 NSCLC cell lines. Gain-of-function and loss-of-function studies showed that overexpression of miR-373-3p promoted H1299 cell migration and invasion, which resulted in upregulation of MMP-9 and MMP-14. By contrast, miR-373-3p knockdown inhibited these processes in A549 cells and downregulated the expression of MMP-9 and MMP-14.
Conclusion
Our results demonstrated that miR-373-3p participated in the invasion and metastasis of lung adenocarcinoma cells, partly by upregulation of MMP-9 and MMP-14.
Keywords: Lung neoplasms, MiR-373, MMP-9, MMP-14, Invasion, Metastasis
肺癌位居全球男性和女性癌症病死率的首位,且呈逐年上升的趋势[1]。肺癌主要分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌是主要的发病类型,约占85%[2]。在非小细胞肺癌中,以肺腺癌的发病率最高。肺癌早期往往无明显症状,56%的肺癌患者在确诊时即伴有远处转移,仅15%的患者在病灶局限时被发现[2],因此肺癌细胞侵袭与转移的研究成为临床亟待解决的问题。近年来越来越多的研究发现肺癌侵袭转移的发生与microRNA有密切关系。
MicroRNA是生物体内一类长度约为20个-23个核苷酸的非编码小RNA,是由具有发夹结构的约70个-90个碱基大小的单链RNA前体(pre-miRNA)经过Dicer酶加工后生成的成熟体microRNA-3p和microRNA-5p,通过靶向结合mRNA的3’端非编码区(3’untranslated regions, 3’UTR),影响目的基因的蛋白表达水平,从而影响细胞的增殖、分化、凋亡与侵袭转移等生物学行为[3]。MicroRNA已被证实在多种肿瘤的转移形成中发挥重要作用,包括乳腺癌、肝癌、前列腺癌和结肠癌等[4]。
MiR-373是miRNAs-371-372-373家族的成员之一,miR-371/miR-372/miR-373的前体都是相同的,均由染色质19q13.42转录而来[5]。MiR-373的前体(pre-miR-373)在细胞质中经过Dicer酶加工后生成成熟体miR-373-3p(即miR-373)和miR-373-5p(即miR-373*),然而miR-373*在自然界中极少存在。MiR-373在不同的肿瘤中的作用不尽相同,具有组织特异性,扮演着癌基因和抑癌基因的角色,影响着肿瘤细胞的侵袭转移、增殖与周期等生物学行为。研究表明miR-373在乳腺癌[6]、人纤维肉瘤[7]及胰腺癌[8]中对肿瘤细胞的侵袭转移能力有重要调控作用。然而miR-373在肺癌中的作用机制尚未十分明确,为了探讨其与肺癌的关系,本研究通过检测成熟体hsa-miR-373-3p(又称miR-373)在非小细胞癌中的表达情况,同时比较在肺腺癌细胞系中过表达及干扰miR-373-3p后对肺腺癌细胞侵袭转移能力的影响。
1. 材料与方法
1.1. 材料
人肺腺癌细胞株A549、H1299、H1975、SPC-A1、PC9和正常支气管上皮细胞HBE均由本实验室提供;非小细胞肺癌组织标本51例和癌旁组织标本39例收集于广东医学院附属医院;RNA提取剂Trizol、反转录及荧光定量PCR试剂盒购自TAKARA;PCR引物合成及细胞培养用的1640培养基购自Invitrogen;胎牛血清(FBS)购自BI;miR-373-3p mimics和miR-373-3p inhibitor购自GenePharma;Lipofectamine® 3000 Transfection Reagent和OPTI-MEN减血清培养基购自Life Technologies;24孔transwell小室(孔径8 μm)购自Corning Costar;侵袭实验所用基质胶(Matrigel)购自BD;基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)和MMP14单克隆兔抗人抗体购自CST;RIPA裂解液、BCA蛋白定量及超敏发光试剂盒购自康为世纪公司。
1.2. 方法
1.2.1. 实时荧光定量PCR(qRT-PCR)
检测肺癌组织和肺癌细胞株中的miR-373-3p收集肺癌标本,冰上研磨成粉末状后加入Trizol提取总RNA,应用PrimeScript®miRNA cDNA Synthesis Kit将microRNA反转录成cDNA,通过荧光定量PCR法检测肺癌组织miR-373-3p的相对表达水平。收集处于对数生长期的肺腺癌细胞,PBS洗两遍,加入Trizol提取总RNA,反转录后进行qRT-PCR检测。Has-miR-373-3p和内参U6的上游引物序列分别为:5’-GAAGTGCTTCGATTTTGGGGTGT-3’和5’-CTCGCTTCGGCAGCACA-3’,其共同下游引物Uni-miR qPCR已包含在TAKARA试剂盒内。应用罗氏LightCycler®进行实时荧光定量PCR检测。每孔10 μL体系,设置3个平行样,U6作为内参。样本经过3次独立重复实验,所得数据使用2-ΔCt或者2-ΔΔCt(ΔCt=Ct目的基因-CtU6)进行相对定量分析。
1.2.2. 细胞转染
将处于对数生长期的A549和H1299细胞接种于6孔板中,待细胞生长汇合度达60%-70%时,利用lipo3000转染试剂将hsa-miR-373-3p mimics及其阴性对照(negative control, NC)瞬时转染至H1299细胞中,将hsa-miR-373-3p inhibitor和NC瞬时转染至A549细胞中。转染时换为无血清无双抗的1640培养基,6 h后换成含10%FBS的培养基,转染48 h后,收集细胞,提取RNA,用qRT-PCR法检测转染前后细胞中miR-373-3p及MMP-9、MMP-14基因mRNA的改变。转染序列如下:hsa-miR-373-3p mimics:sense 5’-GAAGUGCUUCGAUUUUGGGGUGU-3’,anti-sense 5’-ACCCCAAAAUCGAAGCACUUCUU-3’;mimics NC:sense 5’-UUCUCCGAACGUGUCACGUTT-3’;anti-sense 5’-ACGUGACACGUUCGGAGAATT-3’;hsa-miR-373-3p inhibitor:5’-ACACCCCAAAAUCGAAGCACUUC-3’,inhibitorNC:5’-CAGUACUUUUGUGUAGUACAA-3’。MMP-9上游引物:5’-GCAATGCTGATGGGAAACCC-3’;MMP-9下游引物:5’-AGAAGCCGAAGAGCTTGTCC-3’。MMP-14上游引物:5’-ATCTGCCTCTGCCTCACCTA-3’;MMP-14下游引物:5’-AAGCCCCATCCAAGGCTAAC-3’。
1.2.3. 迁移实验
取对数生长期的H1299和A549细胞接种于6孔板,转染48 h后,以每孔200 μL的0.25%胰酶消化细胞,用无血清的1640培养基重悬并调整细胞密度为3×105/mL,取100 μL细胞悬液加入24孔transwell小室的上室,下室预先加入500 μL含10%FBS的1640培养基,放置37 ℃、5%CO2培养箱培养24 h后取出小室,用PBS洗两遍,甲醇固定10 min,结晶紫染色10 min。用棉签小心搽拭小室上层细胞,将小室纤维膜取下,用中性树脂将膜封于载玻片中,100倍显微镜下取6个随机视野进行计数。
1.2.4. 侵袭实验
取对数生长期的A549和H1299细胞接种于6孔板,转染48 h后,以每孔200 μL的0.25%胰酶消化细胞,用无血清的1640培养基重悬并调整细胞密度为3×105/mL,取100 μL细胞悬液加入24孔transwell小室的上室。上室预先加入50 μL基质胶,室温下风干4 h;下室预先加入500 μL含10%FBS的1640培养基。于37 ℃、5%CO2培养箱培养24 h后取出小室,用PBS洗两遍,甲醇固定10 min,结晶紫染色10 min。用棉签小心搽拭小室上层细胞,将小室纤维膜取下,用中性树脂将膜封于载玻片中,100倍显微镜下取6个随机视野进行计数。
1.2.5. Western blot检测转染后细胞内MMP-9、MMP-14蛋白表达水平
收集转染72 h后的的A549和H1299细胞,加入RIPA裂解液和蛋白酶抑制剂提取总蛋白,BCA蛋白定量法检测蛋白浓度,进行SDS-PAGE电泳,将电泳分离的蛋白转至PVDF膜上,5%BSA室温封闭1 h,分别加入1:1, 000兔抗人MMP-9及MMP-14抗体,4 ℃孵育过夜,TBST洗3次,每次10 min,加入辣根过氧化酶偶联的抗兔二抗(1:1, 000稀释),置于室温摇床1 h,TBST洗膜3次,每次10 min,加入ECL发光液曝光显影,以β-actin为内参,用Quantity One软件分析结果[9]。
1.2.6. 统计学方法
所有试验均重复3次,采用SPSS 17.0统计软件分析数据。数据均用Mean±SD表示,两组样本间比较用t检验,多组样本间比较用单因素方差分析,P < 0.05为差异有统计学意义。
2. 结果
2.1. MiR-373-3p在肺癌组织中的表达水平
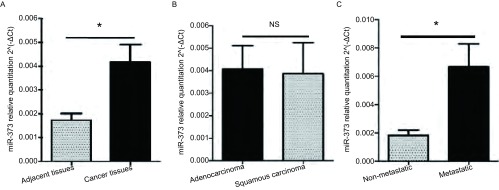
用qRT-PCR法检测miR-373-3p在51例NSCLC组织和39例癌旁组织中的表达,与癌旁组织相比,miR-373-3p在非小细胞肺癌组织中高表达(P=0.011, 9)(图 1),然而,miR-373-3p在腺癌与鳞癌中的表达无明显差异(P=0.904, 9)。有淋巴结转移的肺癌组织中miR-373-3p的表达是无淋巴结转移的3.7倍(P=0.008, 7)(图 1,表 1),这说明miR-373-3p可能与肿瘤细胞的转移能力相关。
1.
qRT-PCR检测miR-373-3p在肺癌标本中的表达。A:MiR-373-3p在肺癌组织(n=51)中较癌旁组织(n=39)高表达(P=0.011, 9);B:MiR-373-3p在肺腺癌和鳞癌间的表达差异无统计学意义(P=0.904, 9);C:MiR-373-3p在有淋巴结转移的癌组织中较无淋巴结转移的癌组织高表达(P=0.008, 7)。
qRT-PCR of miR-373-3p expression in lung cancer tissue. A: The expression of miR-373-3p was up-regulated in lung cancer; B: MiR-373-3p was not sinificantly different between adenocarcinoma and squamous carcinoma; C: Higher expression was shown in lung cancer with lymph node metastasis. *: P < 0.05; NS: P > 0.05.
1.
非小细胞肺癌患者的临床病理特征与miR-373-3p表达的关系
Clinicopathologic features of non-small cell lung cancer patients and the expression of miR-373-3p
| Clinicopathologic features | Case number | ∆Ct (Mean+SD) miR-373-3p | P value |
| Age (yr) | 0.188 | ||
| < 60 | 23 | 8.31±0.34 | |
| ≥60 | 28 | 8.98±0.33 | |
| Gender | 0.058 | ||
| Male | 31 | 8.40±1.17 | |
| Female | 20 | 9.39±0.78 | |
| Smoking history | 0.174 | ||
| Yes | 26 | 7.77±1.21 | |
| No | 25 | 8.68±1.42 | |
| Pathological type | 0.420 | ||
| Squamous carcinoma | 24 | 9.11±1.85 | |
| Adenocarcinoma | 27 | 8.54±1.76 | |
| Cell differentiation | 0.271 | ||
| Well | 15 | 8.32±1.30 | |
| Moderately | 16 | 9.16±1.35 | |
| Poorly | 20 | 8.33±1.26 | |
| Tumor stage | 0.014 | ||
| T1-T2 | 30 | 9.16±1.36 | |
| T3-T4 | 21 | 7.50±1.35 | |
| Lymph node metastasis | 0.004* | ||
| Present | 28 | 7.88±1.58 | |
| Absent | 23 | 9.45±0.98 |
2.2. MiR-373-3p在肺腺癌细胞株中的表达
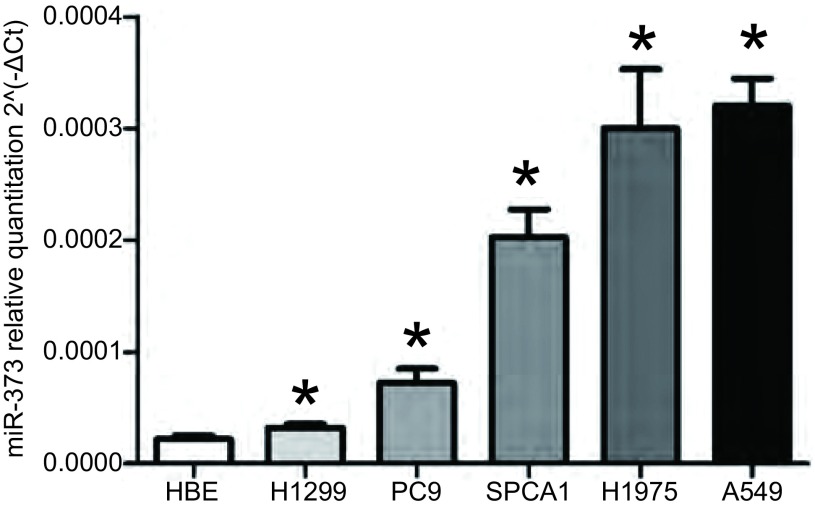
我们进一步检测miR-373-3p在肺腺癌细胞株中的表达情况(图 2),结果显示与正常支气管上皮细胞(HBE)相比,肺腺癌细胞株(H1299、A549、H1975、SPC-A1、PC9)中miR-373-3p的表达均明显上调(P=0.005, 8)。根据肺腺癌细胞中miR-373-3p的表达情况,我们选择在miR-373-3p相对表达水平最低的H1299细胞中过表达miR-373-3p,在miR-373-3p相对表达水平最高的A549细胞中抑制miR-373-3p的表达。
2.
qRT-PCR检测miR-373-3p在肺腺癌细胞株中的表达。MiR-373-3p在5种肺腺癌细胞株中的表达水平较正常支气管上皮细胞明显增高。相比HBE组,*P < 0.05。
qRT-PCR of miR-373-3p expression in lung adenocarcinoma cancer cell lines. The expression level of miR-373-3p is sinificantly higher in lung adenocarcinoma cancer cell lines (n=5) than in normal bronchial epithelial cell (HBE). *: P < 0.05, when compared with HBE.
2.3. 转染前后细胞中miR-373-3p及MMP-9、MMP-14基因mRNA水平的改变
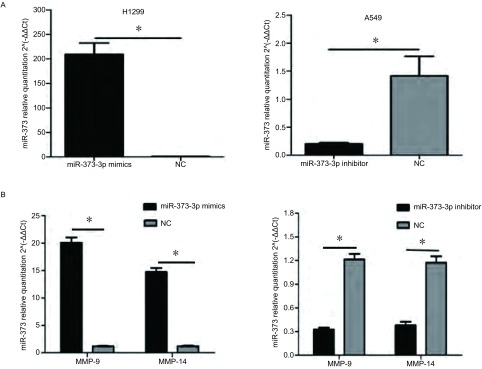
用瞬时转染法将miR-373-3p mimics转染至miR-373-3p表达量相对最低的H1299细胞中,与NC组相比,mimics组miR-373-3p(P=0.006)和MMP-9(P < 0.001)、MMP-14(P < 0.001)的表达明显增加;将miR-373-3p inhibitor转染至miR-373-3p表达量相对最高的A549细胞中,与NC组相比,inhibitor组miR-373-3p(P=0.019, 2)和MMP-9(P < 0.001)、MMP-14(P < 0.001)的表达明显下调(图 3)。
3.
转染后细胞中miR-373-3p、MMP-9和MMP-14基因的mRNA水平。A:瞬转miR-373-3p mimics后H1299细胞中miR-373-3p的表达明显增加,瞬转miR-373-3p inhibitor后A549细胞中miR-373-3p的表达明显减少。*:P < 0.05;B:过表达miR-373-3p后H1299细胞中MMP-9、MMP-14基因的mRNA明显上调;抑制miR-373-3p表达后A549细胞的MMP-9、MMP-14基因的mRNA明显下调。*:P < 0.05。
mRNA level of miR-373-3p, MMP-9 and MMP-14 in transfected lung cancer cell lines. A: H1299 cells transfected with miR-373-3p mimics showed an increase in miR-373-3p expression, while A549 cells transfected with miR-373-3p inhibitor resulted in significantly decreased miR-373-3p expression. *: P < 0.05 when compared with corresponding negative control. B: mRNA expression of MMP-9 and MMP-14 was up-regulation in H1299 cells with miR-373-3p overexpression, while these genes were down-regulation in A549 with miR-373-3p knock-down. *: P < 0.05.
2.4. miR-373-3p促进肺腺癌细胞的侵袭与迁移
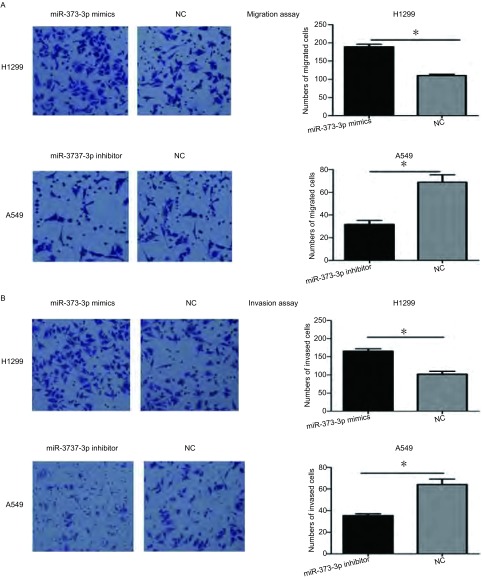
在Transwell小室迁移实验中,我们发现过表达miR-373-3p后H1299细胞的迁移能力增加1.72倍(P < 0.01),然而抑制miR-373-3p的表达后A549细胞的迁移能力下降54%(P=0.012)(图 4A);与迁移实验结果一致的是,在Transwell小室基质胶侵袭实验中,过表达miR-373-3p后H1299细胞的侵袭能力增加1.62倍(P < 0.01),抑制miR-373-3p的表达后A549细胞的侵袭能力下降45%(P=0.03)(图 4B)。
4.
miR-373对肺腺癌细胞迁移与侵袭能力的影响。A:迁移实验。转染miR-373 mimics后促进H1299细胞迁移,转染miR-373 inhibitor后抑制A549细胞迁移;B:侵袭实验。转染miR-373 mimics后H1299细胞的侵袭能力增强,转染miR-373 inhibitor后A549细胞的侵袭能力下降。*:P < 0.05。
Effects of miR-373 on the migration and invasion of lung adenocarcinoma cancer cells in vitro. A: Migration assay. H1299 cells transfected with miR-373 mimics showed an increase in migration capability, while A549 cells transfected with miR-373 inhibitor resulted in significantly decreased migration capability. *: P < 0.05 when compared with corresponding negative control. B: Invasion assay. Promotion of invasion ability was shown in H1299 transfected with miR-373 mimics, while A549 cells transfected with miR-373 inhibitor lead to the significantly decrease of invasion ability. *: P < 0.05 when compared with corresponding negative control.
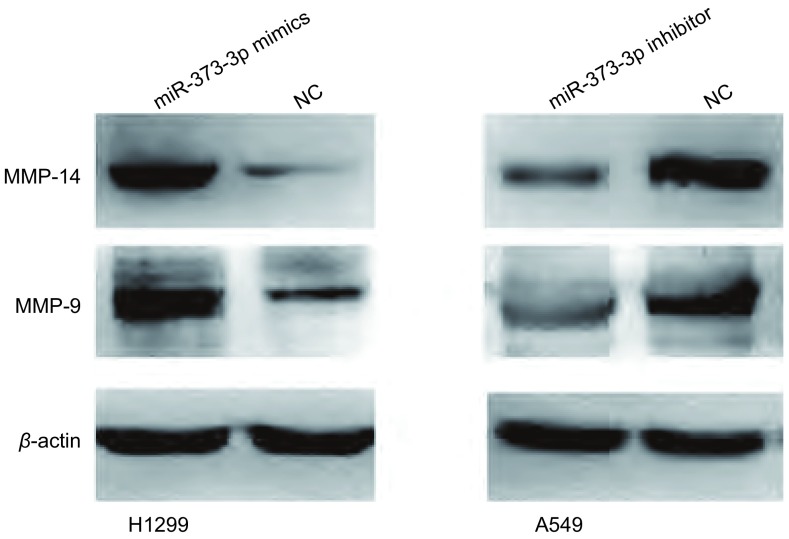
2.5. 改变miR-373-3p的表达对MMP-9、MMP-14蛋白的影响
相比对照组细胞,转染miR-373-3p mimics的细胞中MMP-9、MMP-14蛋白表达上调;与对照组相比,转染miR-373-3p inhibitor的细胞中MMP-9、MMP-14蛋白表达下调(图 5)。
5.
转染后细胞中MMP-9、MMP-14蛋白的表达水平。转染miR-373-3p mimics后H1299细胞中MMP-9、MMP-14蛋白表达上调;转染miR-373-p inhibitor后A549细胞中MMP-9、MMP-14蛋白表达下调。
Expression of MMP-9 and MMP-14 protein in cells after tranfection. Up-regulation of MMP-9 and MMP-14 protein in H1299 cells transfected with miR-373-3p mimics, while down-regulation of MMP-9 and MMP-14 protein in A549 cells transfected with miR-373-3p inhibitor.
3. 讨论
MiR-373在多种肿瘤中均出现异常表达,扮演着癌基因或者抑癌基因的角色,影响肿瘤细胞的增殖、侵袭和转移过程。有研究[6]报道miR-373在乳腺癌中表达上调,通过下调CD44的表达而促进肿瘤细胞的侵袭转移能力。在人纤维肉瘤HT1080细胞中,过表达的miR-373可直接通过靶向结合雷帕霉素靶蛋白(mechanistic target of rapamycin, mTOR)和去乙酰化酶1(sirtuin 1, SIRT1)mRNA的3'UTR而使mTOR和SIRT1的表达下调,进一步导致Ras/Raf/MEK/Erk信号通路和转录因子(nuclear factor kappa B, NF-κB)的激活,从而提高MMP-9的表达水平,增强肿瘤细胞的生长和迁移能力[7]。Zhang等[8]研究发现miR-373在胃癌中高表达,通过下调靶基因肿瘤坏死因子α诱导蛋白1(tumor necrosis factor, alpha-induced protein 1, TNFAIP1)的表达而促进胃癌细胞的增殖。然而,miR-373与肺癌的研究甚少,两者的关系尚未十分明确。
本研究发现miR-373-3p在非小细胞肺癌组织中较癌旁组织高表达,通过分析研究非小细胞肺癌组织标本的临床病理特征与miR-373-3p表达间的关系发现,有淋巴结转移的非小细胞肺癌组织中miR-373-3p的表达明显高于无淋巴结转移的,另外T3期-T4期的NSCLC组织中miR-373-3p的表达也高于T1期-T2期的,据此我们认为miR-373-3p可能对NSCLC的增殖转移有一定调控作用。而非小细胞肺癌中又以肺腺癌的发病率最高,因此本研究主要探讨miR-373-3p与肺腺癌侵袭转移的关系,进一步研究发现miR-373-3p在5种人肺腺癌细胞株中的表达水平也显著高于人正常支气管上皮细胞,其中以H1299细胞的相对表达水平最低,A549细胞的相对表达水平最高。为了探讨miR-373-3p对肺腺癌细胞的侵袭转移能力的影响,我们通过功能获得以及功能缺失研究发现过表达miR-373-3p可以促进H1299细胞的侵袭转移能力;相反,抑制miR-373-3p的表达可降低A549细胞的侵袭转移能力。以上数据表明miR-373-3p可以促进肺腺癌细胞的侵袭转移能力。与此同时,日本学者Seol等[9]在研究miR-373与肺癌的关系时发现过表达pre-miR-373可抑制肺癌细胞的侵袭能力,该研究结果和我们有所不同,存在差异的可能原因是他们的研究中用的是miR-373的前体,而pre-microRNA进入细胞后会在Dicer酶的加工下生成microRNA-5p和microRNA-3p而发挥生物学作用,事实上是否存在microRNA-5p和microRNA-3p的作用差异,这是一个有趣的问题,因为miR-373在不同的肿瘤中也扮演不同的角色,在有的肿瘤中促进转移,有的则是抑制肿瘤转移,例如miR-373促进乳腺癌[6]、人纤维肉瘤[7]及宫颈癌[10]细胞的转移能力,却抑制前列腺癌[11]和卵巢癌[12]细胞的转移,今后miR-373的亚型在肺癌中的作用仍需进一步研究。
肿瘤侵袭转移的形成涉及多种机制,研究发现基质金属蛋白酶家族(matrix metalloproteinases, MMPs)对于肿瘤转移有重要相关性,他们降解基底膜并在细胞外基质(extracellular matrix, ECM)中暴露出隐藏的多肽抗原,促进侵袭的发生。MMPs可在原发肿瘤处将可溶性肿瘤细胞释放至循环系统中,并在远处器官形成转移微环境以助于随后肿瘤细胞的克隆形成[13]。MMPs也可以直接修饰整合素和其他肿瘤细胞粘附分子,激活重要的细胞因子如转化生长因子β(transforming growth factor beta, TGF-β),诱导上皮-间质转化(epithelial-mesenchymal transition, EMT)的发生,EMT是由增强细胞运动而引起的广泛表型改变,是肿瘤转移的重要过程[13]。MMP-9是基质金属蛋白酶家族的成员之一,对肿瘤细胞的生长、增殖和侵袭迁移起着重要作用[14]。Peng等[15]发现MMP-9高表达与非小细胞肺癌患者的不良预后有密切关系。多项研究[16-18]表明MMP-9与增加患者淋巴结转移率、肿瘤远处转移率及缩短无复发生存率有关。MMP-14又称膜型基质金属蛋白酶-1(membrane-type matrix proteinase-1, MT1-MMP),是第一个被发现的膜型基质金属蛋白酶。MMP-14在正常组织与肿瘤组织的生物学行为中均发挥重要作用,例如侵袭[19]、增殖[20]与细胞外基质的重塑[21]等。研究[22]证实相比癌旁组织,MMP-14在非小细胞癌组织中明显高表达。Wang等[23]研究发现MMP-14高表达的非小细胞肺癌患者生存时间比MMP-14低表达者更短,是一个不良预后的指标。
为了进一步探讨miR-373-3p促进肺腺癌细胞侵袭转移能力的作用机制,我们对miR-373-3p与基质金属蛋蛋白酶间的关系进行了研究。结果发现过表达miR-373-3p的细胞中MMP-9及MMP-14蛋白的表达水平上调;抑制miR-373-3p的表达后细胞中MMP-9及MMP-14蛋白的表达水平下调。该结果表明,miR-373-3p可能通过上调MMP-9及MMP-14蛋白的表达水平而影响肿瘤细胞的侵袭转移能力。
本研究发现miR-373-3p在肺腺癌中表达上调并扮着癌基因的角色,可能通过上调MMP-9及MMP-14蛋白的表达水平而促进肺腺癌细胞的侵袭转移能力,阐明了肺腺癌细胞发生侵袭转移的机制之一,提示miR-373-3p可能作为抑制肺腺癌细胞侵袭转移能力的靶点,有望为临床上逆转肺腺癌的侵袭转移提供新的思路。
Funding Statement
本研究受国家自然基金项目(No.81201672)、广东省省级科技计划项目(No.2013B021800078, No.kz1153)和广东医学院博士研究启动基金项目(No.B2012032)资助
This study was supported by the grants from National Nature Science Foundation of China (to Aibing WU) (No.81201672), Science and Technology Planning Project of Guangdong Province (to Aibing WU)(No.2013B021800078), Science and Technology Planning Project of Guangdong Province (to Zhixiong YANG)(No.kz1153), and PhD Research Startup Foundation of Guangdong Medical College (to Aibing WU)(No.B2012032)
References
- 1.Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014. CA Cancer J Clin. 2014;64(1):9–29. doi: 10.3322/caac.21208. [DOI] [PubMed] [Google Scholar]
- 2.Jemal A, Bray F, Center M M, et al. Global cancer statistics. CA Cancer J Clin. 2011;61(2):69–90. doi: 10.3322/caac.v61:2. [DOI] [PubMed] [Google Scholar]
- 3.Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116(2):281–297. doi: 10.1016/S0092-8674(04)00045-5. [DOI] [PubMed] [Google Scholar]
- 4.Nicoloso MS, Spizzo R, Shimizu M, et al. MicroRNAs-the micro steering wheel of tumour metastases. Nat Rev Cancer. 2009;9(4):293–302. doi: 10.1038/nrc2619. [DOI] [PubMed] [Google Scholar]
- 5.Kwak MS, Lee DH, Cho Y, et al. Association of polymorphism in pri-microRNAs-371-372-373 with the occurrence of hepatocellular carcinoma in hepatitis B virus infected patients. PLoS One. 2012;7(7):e41983. doi: 10.1371/journal.pone.0041983. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Huang Q, Gumireddy K, Schrier M, et al. The microRNAs miR-373 and miR-520c promote tumour invasion and metastasis. Nat Cell Biol. 2008;10(2):202–210. doi: 10.1038/ncb1681. [DOI] [PubMed] [Google Scholar]
- 7.Liu P, Wilson MJ. miR-520c and miR-373 upregulate MMP9 expression by targeting mTOR and SIRT1, and activate the Ras/Raf/MEK/Erk signaling pathway and NF-κB factor in human fibrosarcoma cells. J Cell Physiol. 2012;227(2):867–876. doi: 10.1002/jcp.22993. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Zhang X, Li X, Tan Z, et al. MicroRNA 373 is upregulated and targets TNFAIP1 in human gastric cancer, contributing to tumorigenesis. Oncol Lett. 2013;6(5):1427–1434. doi: 10.3892/ol.2013.1534. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Seol H S, Akiyama Y, Shimada S, et al. Epigenetic silencing of microRNA-373 to epithelial-mesenchyma transition in non-small cell lung cancer through IRAK2 and LAMP1 axes. Cancer Lett. 2014;353(2):232–241. doi: 10.1016/j.canlet.2014.07.019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Wang LQ, Zhang Y, Yan H, et al. MicroRNA-373 functions as an oncogene and targets YOD1 gene in cervical cancer. Biochem Biophys Res Commun. 2015;459(3):515–520. doi: 10.1016/j.bbrc.2015.02.138. [DOI] [PubMed] [Google Scholar]
- 11.Nakata K, Ohuchida K, Mizumoto K, et al. Micro RNA-373 is down-regulated in pancreatic cancer and inhibits cancer cell invasion. https://link.springer.com/content/pdf/10.1245/s10434-014-3676-8.pdf. Ann Surg Oncol. 2014;21(4):564–574. doi: 10.1245/s10434-014-3676-8. [DOI] [PubMed] [Google Scholar]
- 12.Zhang Y, Zhao FJ, Chen LL, et al. MiR-373 targeting of the Rab22a oncogene suppresses tumor invasion and metastasis in ovarian cancer. Oncotarget. 2014;5(23):12291–12303. doi: 10.18632/oncotarget.2577. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Kessenbrock K, Plaks V, Werb Z. Matrix metalloproteinases: regulators of the tumor microenvironment. Cell. 2010;141(1):52–67. doi: 10.1016/j.cell.2010.03.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Radisky ES, Radisky DC. Matrix metalloproteinase-induced epithelial-mesenchymal transition in breast cancer. J Mammary Gland Biol. 2010;15(2):201–212. doi: 10.1007/s10911-010-9177-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Peng WJ, Zhang JQ, Wang BX, et al. Prognostic value of matrix metalloproteinase 9 expression in patients with non-small cell lung cancer. https://www.sciencedirect.com/science/article/pii/S0009898112001398. Clin Chim Acta. 2012;413(13):1121–1126. doi: 10.1016/j.cca.2012.03.012. [DOI] [PubMed] [Google Scholar]
- 16.Li HC, Cao DC, Liu Y, et al. Prognostic value of matrix metalloproteinases (MMP-2 and MMP-9) in patients with lymph node-negative breast carcinomar. Breast Cancer Res Treat. 2004;88(1):75–85. doi: 10.1007/s10549-004-1200-8. [DOI] [PubMed] [Google Scholar]
- 17.Vizoso FJ, Gonzalez LO, Corte MD, et al. Study of matrix metalloproteinases and their inhibitors in breast cancer. Br J Cancer. 2007;96(6):903–911. doi: 10.1038/sj.bjc.6603666. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Hao L, Zhang C, Qiu Y, et al. Recombination of CXCR4, VEGF, and MMP-9 predicting lymph node metastasis in human breast cancer. Cancer Lett. 2007;253(1):34–42. doi: 10.1016/j.canlet.2007.01.005. [DOI] [PubMed] [Google Scholar]
- 19.Jiang W G, Davies G, Martin T A, et al. Expression of membrane type-1 matrix metalloproteinase, MT1-MMP in human breast cancer and its impact on invasiveness of breast cancer cells. Int J Mol Med. 2006;17(4):583–590. [PubMed] [Google Scholar]
- 20.Takino T, Tsuge H, Ozawa T, et al. MT1-MMP promotes cell growth and ERK activation through c-Src and paxillin in three-dimensional collagen matrix. Biochem Biophys Res Commun. 2010;396(4):1042–1047. doi: 10.1016/j.bbrc.2010.05.059. [DOI] [PubMed] [Google Scholar]
- 21.Tolde O, Rösel D, Mierke CT, et al. Neoplastic progression of the human breast cancer cell line G3S1 is associated with elevation of cytoskeletal dynamics and upregulation of MT1-MMP. Int J Oncol. 2010;36(4):833–839. doi: 10.3892/ijo_00000560. [DOI] [PubMed] [Google Scholar]
- 22.Demidyuk IV, Shubin AV, Gasanov EV, et al. Alterations in gene expression of proprotein convertases in human lung cancer have a limited number of scenarios. PLoS One. 2013;8(2):e55752. doi: 10.1371/journal.pone.0055752. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Wang Y, Wu K, Wu A, et al. MMP-14 overexpression correlates with poor prognosis in non-small cell lung cancer. Tumor Biol. 2014;35(10):9815–9821. doi: 10.1007/s13277-014-2237-x. [DOI] [PubMed] [Google Scholar]