Abstract
背景与目的
维生素C作为一种抗氧化剂, 对多种肿瘤均有抑制作用, 本研究旨在探讨维生素C对肺癌细胞株A549的增殖、凋亡的影响及其诱导A549细胞凋亡的可能机制。
方法
在体外培养的肺癌A549细胞株中加入不同浓度的维生素C, 采用细胞生长曲线及克隆形成实验检测细胞生长情况; 用流式细胞仪检测细胞周期的影响及凋亡率; 用RT-PCR方法检测肺癌细胞株A549中Caspase-3、Survivin的表达差异。
结果
400 μg/mL、4 mg/mL浓度组维生素C明显抑制A549细胞的增殖, 流式细胞仪检测细胞被阻止在G0/G1期及S期, 且随着时间的延长细胞凋亡逐渐增多, RT-PCR检测维生素C可以上调Caspase-3 mRNA的表达, 并且随着时间的延长Caspase-3 mRNA的表达逐渐增强, 对Survivin mRNA的表达无确切作用。
结论
维生素C呈时间和剂量依赖性抑制A549细胞的增殖, 并使A549细胞阻止在G0/G1期及S期, 并呈时间依赖性诱导A549细胞凋亡, 其机制可能是通过上调Caspase-3的表达。
Keywords: 维生素C, 肺肿瘤, 细胞凋亡, Caspase-3, Survivin
Abstract
Background and objective
It was proven that Vitamin C could inhibit the growth of many types of tumors as an antioxidant.The aim of this study is to explore role of Vitamin C in proliferation and apoptosis of lung carcinoma cell line A549 and the underlying mechanism.
Methods
A549 cells were cultured in vitro and incubated with Vitamin C.The cell viability was measured by growth curve and clonogentic assay.Flow cytometry was used to analyze cell cycle and detect apoptosis.The levels of expression of Caspase-3 mRNA and Survivin mRNA were detected by RT-PCR.
Results
Vitamin C of 400 μg/mL, 4 mg/mL significantly inhibited the growth of A549 cell lines (P=0.024, P=0.015, respectively).Flow cytometry showed that the cells major stagnation stayed in the G0/G1 and S phase and the apoptotic rate increased with time prolonged.Vitamin C signifiantly up-ragulated the expression of Caspase-3 mRNA, but had no effect on Survivin mRNA.
Conclusion
Vitamin C can inhibit the proliferation of A549, block A549 cells in G0/G1 and S phase, and induce apoptosis of A549 cells.Apotosis occurred by up-ragulated the expressionof Caspase-3.
Keywords: Vitamin C, Lung carcinoma, Apoptosis, Caspase-3, Survivin
维生素C(Vitamin C, Vit C)是一种具有6个碳原子的酸性多羟基化合物。其分子中2位和3位碳原子的两个烯醇式羟基极易解离, 释放出H+, 而被氧化成脱氢Vit C。Vit C和脱氢Vit C在人体内形成可逆的氧化还原系统, 此系统在生物氧化、还原作用及细胞呼吸中起重要作用。Vit C作为细胞保护剂广泛应用于临床多种疾病(如坏血病、肝硬化等)的治疗。近年来, 研究[1]发现Vit C可以促进肿瘤细胞的凋亡, 但具体机制尚未完全阐明。本研究将探讨Vit C对肺癌A549细胞株的增殖、凋亡的影响及其可能机制。
1. 材料和方法
1.1. 实验材料与实验分组
1.1.1. 实验材料
肺癌细胞株A549由中山大学附属肿瘤医院惠赠, DMEM培养液(GIBICOL公司), 小牛血清(GIBICOL公司), Vit C(广州南国药业有限公司), CCK-8试剂(大连宝生物有限公司), RT-PCR反应体系(Promega公司), Caspase-3 mRNA及Survivin mRNA引物由上海赛百盛生物技术有限责任公司合成。
1.1.2. 实验分组
以50×D/5 000×2×103公式[2]计算出Vit C临床用药量为400 μg/mL。实验分为对照组及40 μg/mL、400 μg/mL、4 mg/mL三种浓度Vit C组。
1.2. 实验方法
1.2.1. 细胞培养
A549细胞置于含10%小牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养液中, 在37 ℃、5%CO2培养箱中传代培养。每两天换一次液, 4 d传代。
1.2.2. 细胞增殖测定(CCK-8法)
取指数期A549细胞, 待生长至近融合状态, 经0.25%EDTA的PBS消化后, 配成5 000/mL, 然后将细胞以1 000/孔接种于96孔板, 置于CO2培养箱培养24 h后加药, 在培养箱中继续培养24 h、48 h、72 h、96 h、120 h、144 h、168 h后, 加入10 μL CCK-8混合液, 震荡10 s, 继续培养2 h后吸出上清液450 nm测OD值, 绘制生长曲线。
1.2.3. 细胞集落形成测定(克隆形成法)
取对数生长期的A549细胞, 用0.25%胰蛋白酶消化并吹打成单个细胞, 离心后, 把细胞重悬在10%胎牛血清的DMEM培养液中备用。将细胞悬液稀释成500个/mL, 以1 000/孔接种于6孔板中, 并轻轻转动, 使细胞分散均匀。置37 ℃、5%CO2培养箱培养1周, 当培养皿中出现镜下可见的克隆时, 加入以上浓度药物培养1周。终止培养。弃去上清液, 用PBS小心浸洗2次。加纯甲醇5 mL, 固定15 min。然后去固定液, 加适量结晶紫应用染色液染30 min, 然后用流水缓慢洗去染色液, 空气干燥。将平皿倒置并叠加一张带网格的透明胶片, 用肉眼直接计数克隆, 并在显微镜(低倍镜)计数大于20个细胞的克隆数。
1.2.4. 流式细胞术检测细胞周期及细胞凋亡率
用含10%胎牛血清的DMEM培养液调整细胞浓度为1×106/mL接种于10 cm皿中, 置于5%CO2、37 ℃培养箱中培养12 h后, 用含0.5%小牛血清的DMEM培养液继续培养24 h, 使细胞周期同步化。加入Vit C(400 μg/mL), 对照组不加药, 分别作用6 h、12 h、24 h、48 h, 收集贴壁细胞, 制成单细胞悬液, 70%乙醇固定, 4 ℃保存过夜, -20 ℃保存(有效期为1周)。检测前用PBS洗去固定液, 加入20 μL RnaseA, 37 ℃孵育30 min后, 暗处加PI染液, 冰浴30 min, 染色后以300目筛网过滤。调整细胞浓度为1×105/mL-1×106/mL, 采用流式细胞仪检测, 激发光源为氩离子, 激发波长488 nm, 用Multicycle DNA分析软件行细胞周期的测定。
1.2.5. RT-PCR检测Caspase-3 mRNA、Survivin mRNA的表达水平
取对数生长期A549细胞加入400 μg/mL的Vit C作用6 h、12 h、24 h、48 h后TRIzol一步法提取总RNA, 取1 μL总RNA以10 μL体系逆转录, 制备cDNA, 并稀释30倍备用。Caspase-3 mRNA上游引物:5’-TGACCGAGGCTACATTCAGATGACACC-3’, 下游引物:5’-CAAGAGAGTTGGGCTGACCAGAAACAC-3’, 扩增产物365 bp; Survivin mRNA上游引物:5’-CCCTTTCTCAAGGACCACCGCATC-3’, 下游引物:5’-CACTGAGAACGAGCCAGACTTGGC-3’, 扩增产物133 bp; β-actin上游引物:5’-AGTGTGACGTGGACATCCGCA-3’, 下游引物:5’-ATCCACATCTGCTGGAAGGTGGAC-3’, 扩增产物243 bp。扩增后取扩增产物用琼脂糖凝胶电泳检测。应用凝胶成像系统对电泳条带进行扫描分析, 计算相对表达水平(与β-actin比值)。
1.2.6. 统计分析
所有实验均重复3次, 用Mean±SD表示, 经SPSS 10.0进行两两比较的t检验, P < 0.05为有统计学差异。
2. 结果
2.1. 细胞增殖情况及生长曲线
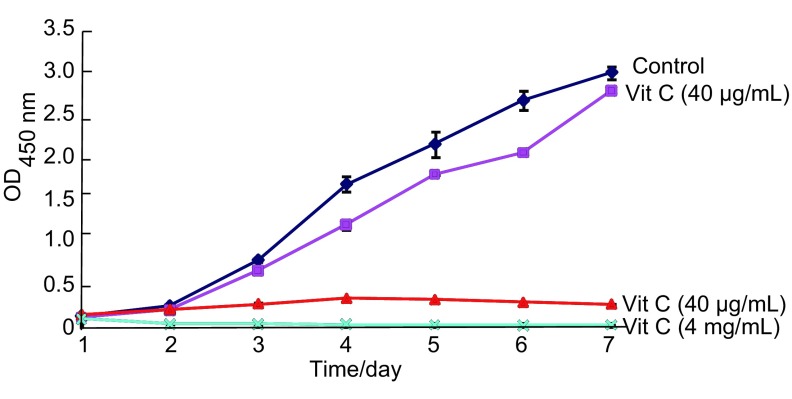
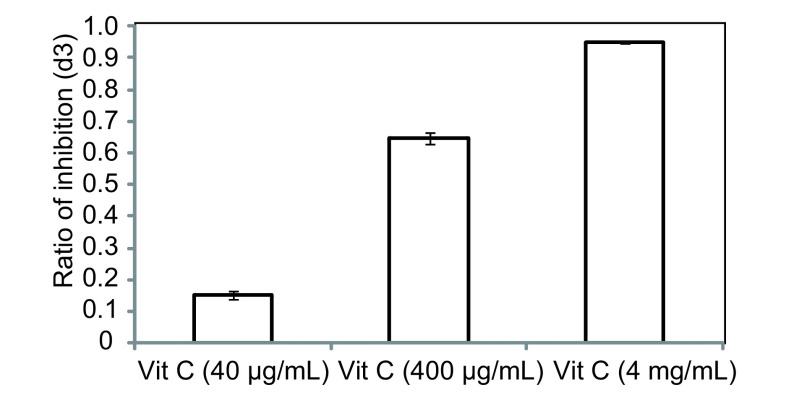
以40 μg/mL、400 μg/mL、4 mg/mL三种浓度Vit C干预A549抑制增殖情况见图 1, 结果表明400 μg/mL Vit C、4mg/mL Vit C明显抑制A549的增殖(P < 0.05), 而40 μg/mL Vit C抑制作用不明显(P > 0.05);随着浓度的增大, 3天抑瘤率明显增大, 见图 2。
1.
不同浓度Vit C作用A549细胞生长曲线
Cell proliferation curve of A549 cell with Vit C at different doses
2.
不同浓度Vit C作用A549瘤生长抑制率(第3天)
Ratio of inhibition of A549 cell with Vit C at different doses (d3)
2.2. 细胞集落形成观察
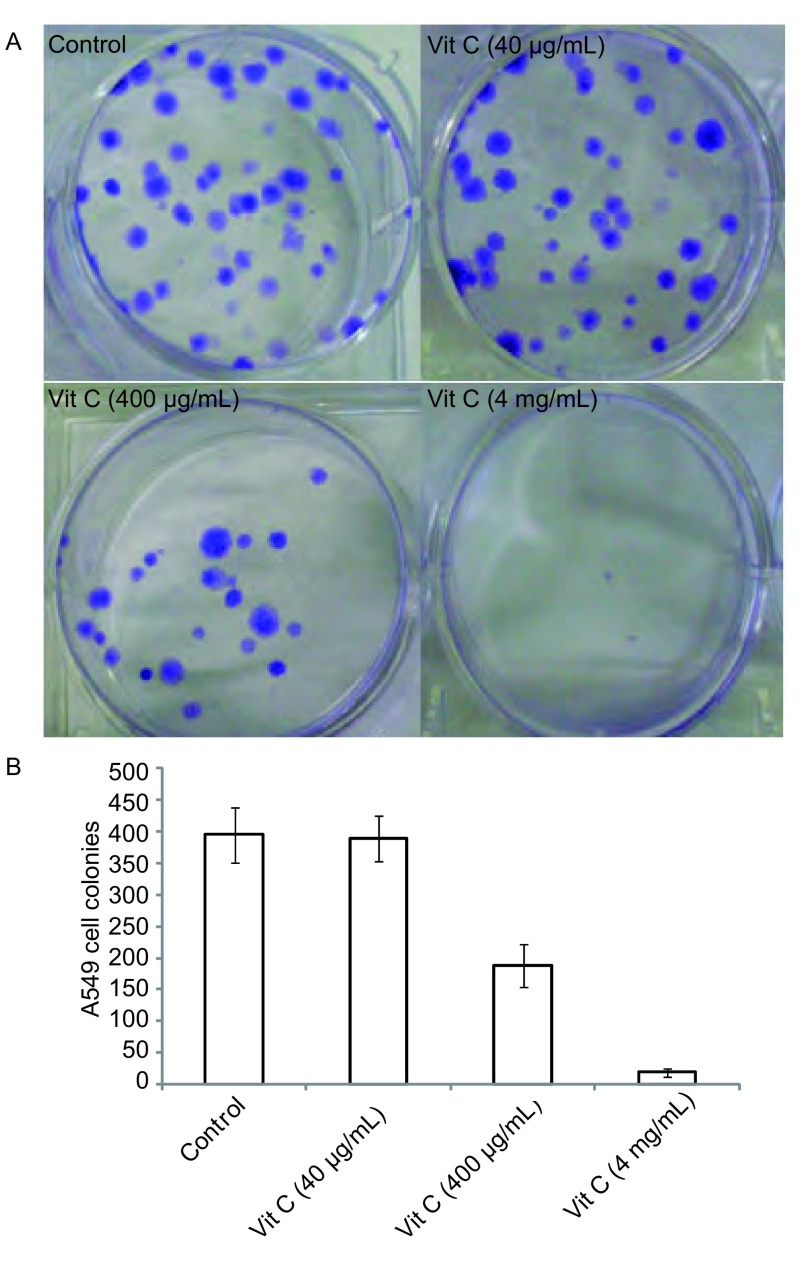
A549细胞分别加入40 μg/mL VitC、400 μg/mL Vit C、4 mg/mL Vit C, 肉眼克隆见图 3A, 镜下计数见图 3B, 400 μg/mL Vit C、4mg/mL Vit C组明显抑制了肺癌A549细胞克隆的形成, 与对照组、40 μg/mL Vit C组相比有统计学差异(P < 0.05)。
3.
不同浓度Vit C作用A549后集落形成数
Colony of A549 cell with Vit C at different doses
2.3. 流式细胞仪检测细胞周期及凋亡实相结果
图 4可见, 临床用药量(400 μg/mL)的Vit C随着作用时间的延长, G0/G1期、S期的细胞明显增多, 进入G2/M期的细胞明显减少, 说明Vit C可以延长A549的细胞周期, 从而抑制其增殖, 当作用24 h、48 h后G0/G1期、S期的细胞明显增多, 并且随着作用时间的延长细胞凋亡数明显增加。
4.
400 μg/mL Vit C干预A549细胞不同时间后流式细胞仪检测凋亡和细胞周期变化结果
Changes of cell cycle and apoptosis after 400 μg/mL Vit C treated A549 cell different time
2.4. RT-PCR检测Vit C对Caspase-3 mRNA、Survivin mRNA水平的影响
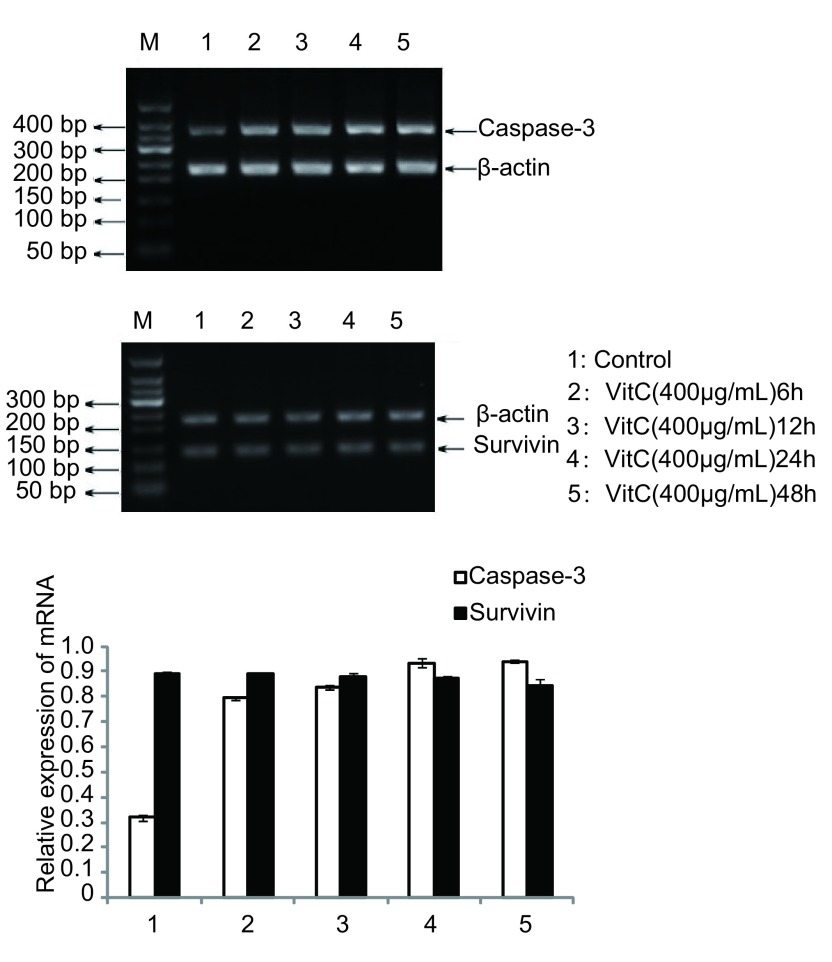
取对数生长期A549细胞, 加入400 μg/mL的Vit C培养6 h、12 h、24 h、48 h后提取总RNA进行RTPCR, 扩增产物用琼脂糖凝胶电泳检测, 结果表明Vit C作用6 h后Caspase-3 mRNA的表达增高, 随着作用时间的延长表达量无明显增多(P=0.001、0.002、0.002、0.003);随着Vit C作用时间的延长, Survivin mRNA的表达并未明显变化(P=0.959、0.552、0.23、0.173), 见图 5。
5.
400 μg/mL Vit C干预A549细胞不同时间对Caspase-3 mRNA、Survivin mRNA表达的影响
Expression of Caspase-3 mRNA, Survivin mRNA after 400 μg/mL Vit C treated A549 cell different time
3. 讨论
Vit C是具有许多生物学功能的水溶性己糖衍生物, 它的分子式是C6H8O6, 其分子中2位和3位碳原子的两个烯醇式羟基极易解离, 释放出H+。通常情况下, 我们普遍认为小剂量Vit C是天然抗氧化剂, 通过还原作用清除氧自由基, 而大剂量Vit C具有氧化作用[3-4]。而研究也主要集中于Vit C在小剂量时对肿瘤发生的预防作用, 对肿瘤的治疗作用的研究还处于初始阶段。本研究发现Vit C在400 μg/mL时即可以明显抑制肺癌A549细胞的增殖(P < 0.05), 流式细胞仪检测发现400 μg/mL Vit C可以将A549细胞阻滞在G0/G1期及S期, 使进入G2/M期的细胞明显减少, 从而延长了细胞周期, 并且发现随着作用时间的延长, 可以明显促进A549细胞的凋亡。
众所周知, 凋亡逃逸是肿瘤发生、发展的重要机制之一。细胞凋亡主要通过线粒体通路、死亡受体通路和内质网通路启动凋亡。线粒体通路主要是含BH3结构域的Bcl-2家族成员与另外的Bcl-2家族成员(Bax亚家族成员Bax、Bak)等作用, 导致后者的寡聚并插入线粒体膜, 引起线粒体膜通透性改变, 跨膜电位丢失, 释放细胞色素C(Cyt C)和其它蛋白[5], Cyt C在ATPPdATP存在的情况下, Cyt C与凋亡蛋白酶活化因子(apoptotic protease activating factor, Apaf-1)形成多聚复合体, 通过Apaf-1氨基端的Caspase募集结构域(caspase recruitment domain, CARD)募集胞质中的Caspase-9前体, 并使其自我剪切活化并启动Caspase级联反应, 激活下游的Caspase-3和Caspase-7, 完成其相应底物的剪切, 引起细胞凋亡[6]; 死亡受体通路主要机制是死亡配体与死亡受体激活无活性的pro-caspase-8变为有活性的Caspase-8。激活的Caspase-8不仅可激活下游效应Caspase裂解多种蛋白质而最终导致细胞凋亡, 同时还可以降低线粒体内膜电位使Bc1-2家族成员裂解, 导致Cyt C的释放[7], 后者可与Apaf-1结合, 在dATP的存在下活化Caspase-9, Caspase-9能激活下游效应Caspase-3[8]。而Caspase-3作为这两条通路上的下游共同基因, 在细胞凋亡过程中起着至关重要的作用。本研究发现, 随着作用时间的延长Vit C可以上调Caspase-3的表达, 提示Vit C可能通过氧化作用进一步减少肿瘤细胞内本来就缺乏的过氧化物酶, 并增加过氧化氢(H2O2)的产生[9]从而作用于pro-caspase激活Caspase-3诱导A549细胞凋亡。而作为最强的凋亡抑制基因, Survivin在肿瘤逃逸凋亡过程中有着不可忽视的作用, 可直接与Caspase-3、Caspase-7结合并抑制它们的活性[10]而阻止肿瘤细胞凋亡的发生。本研究亦观察了Vit C对Survivin的影响, 发现其并不明显下调Survivin mRNA的表达。因此我们认为, Vit C可能虽然未能下调Survivin mRNA的表达, 但可能阻止Survivin蛋白与Caspase-3的结合, 从而影响肿瘤细胞的凋亡过程。综上所述, 我们认为在临床治疗量的Vit C即可以明显抑制肺癌A549的增殖, 并将其阻滞在G0/G1期及S期, 并且随着作用时间的延长, 可以明显诱导肺癌A549的凋亡, 其机制可能是通过上调Caspase-3的表达。因此, 我们有理由相信Vit C作为肿瘤化疗的辅助用药在临床应用中有广阔的前景。
Funding Statement
本研究受广西自然科学基金(No.2009AM9807)资助
This study was supported by grant from the Natural Science Foundation of Guangxi (to Jinrong ZENG)(No.2009AM9807)
References
- 1.Kang JH, Shi YM, Zheng RL. Effects of ascorbic acid on human hepatoma cell proliferation and redifferentiation. http://www.chinaphar.com/article/view/8314. Acta Pharmacologica Sinica. 1999;20(11):1019–1024. [PubMed] [Google Scholar]
- 2.Tang DP, Chen XQ. MTT assay as a test of chemosensitivity in human ovarian carcinoma. Guangxi Med J. 1996;18(6):666–667. [Google Scholar]; 唐 东平, 陈 心秋. MTT法药敏试验预测卵巢癌对化疗药物的敏感性. 广西医学. 1996;18(6):666–667. [Google Scholar]
- 3.Casiciari J, Riordan NH, Schmidt TL, et al. Lytotoxicity of ascorbate, lipoic acid and other antioxidants in hollow fibre in vitro tumours. Br J Cancer. 2001;84(11):1544–1550. doi: 10.1054/bjoc.2001.1814. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Cui NJ, Cui NQ, Fu Q, et al. Bidirectional effect of vitamin C on pro oxidation/antioxidation. http://d.old.wanfangdata.com.cn/Periodical/zgzxyjhwkzz200406005 Chin J Surg Integrated Trad Western Med. 2004;10(6):419–421. [Google Scholar]; 崔 乃杰, 崔 乃强, 傅 强, et al. 维生素C抗氧化促氧化双向作用的研究. http://d.old.wanfangdata.com.cn/Periodical/zgzxyjhwkzz200406005 中国中西医结合外科杂志. 2004;10(6):419–421. [Google Scholar]
- 5.Eskes R, Desagher S, Antonsson B, et al. Bid induces theoligomerization and insertion of Bax into the outermitochondrial membrane. Mol Cell Biol. 2000;20(3):929–935. doi: 10.1128/MCB.20.3.929-935.2000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Miramar MD, Costantini P, Ravagnan L, et al. NADH oxidaseactivity of mitochondrial apoptosis-inducing factor. J Biol Chem. 2001;276(19):16391–16398. doi: 10.1074/jbc.M010498200. [DOI] [PubMed] [Google Scholar]
- 7.Li J, Bombeck CA, Yang S, et al. Nitric oxide suppresses apoptosis via interrupting caspase activation and mitochondrial dysfunction incultured hepatocytes. http://www.jbc.org/content/274/24/17325.short?274/24/17325. Biol Chem. 1999;274(1):17325–17333. doi: 10.1074/jbc.274.24.17325. [DOI] [PubMed] [Google Scholar]
- 8.Zhuang S, Lynch MC, Kochevar IE. Caspase-8 medicates caspase-3 activation and cytochrome release during singlet oxygen induced apoptosis of Hl260 cells. Exp Cell Res. 1999;250(1):203–212. doi: 10.1006/excr.1999.4501. [DOI] [PubMed] [Google Scholar]
- 9.Zheng QS, Zhang YT, Zheng RL. Ascorbic acid induces redifferentiation and growth inhibition in human hepatoma cells byincreasing endogenous hydrogen peroxide. https://www.researchgate.net/publication/8120053_Ascorbic_acid_induces_redifferentiation_and_growth_inhibition_in_human_hepatoma_cells_by_increasing_endogenous_hydrogen_peroxide. Pharmazie. 2002;57(11):753–757. [PubMed] [Google Scholar]
- 10.Xu ZX, Zhao RX, Ding T, et al. Promyelocytic leukemia protein 4 induces apoptosis by inhibition of survivin expression. J Biol Chem. 2004;279(3):1838–1844. doi: 10.1074/jbc.M310987200. [DOI] [PubMed] [Google Scholar]