Abstract
背景与目的
已有的研究表明COX-2在肺癌发生发展过程中起关键作用, 它被一些细胞因子和生长因子所诱导产生, 并受到JAK/STAT等信号通路的调控, 抑制COX-2的表达能阻止肺癌的发展。本研究旨在探讨表皮生长因子(epidermal growth factor, EGF)在人肺腺癌A549细胞中对STAT5激活效应, 以及STAT5信号通路对COX-2调控机制。
方法
应用免疫荧光法及Western印迹法检测人肺腺癌A549细胞中EGF对STAT5的激活现象。分别用野生型STAT5(AdWT STAT5), STAT5显性负突变体(AdCMV5 Stat5a△740)以及STAT5 siRNA转染A549细胞, 并用EGF对后两组转染细胞加以刺激, 使STAT5及p-STAT5的表达发生变化, 再用RT-PCR检测A549细胞中的COX-2 mRNA表达。
结果
在体外A549细胞中STAT5无激活; EGF可以诱导STAT5的激活, 促使磷酸化的STAT5穿梭入核; STAT5的激活是EGF诱导COX-2上调表达的必要条件; 非磷酸化的STAT5可能通过非转录激活的途径参与了COX-2表达的调控。
结论
在A549细胞中STAT5可以通过磷酸化和非磷酸化两种途径来实现对COX-2的调控。
Keywords: STAT5, COX-2, 肺肿瘤, A549, EGF
Abstract
Background and objective
It has been proved that cyclooxygenase-2 (COX-2) is a key factor in lung cancer oncogenesis.COX-2 can be induced by a number of cytokines and growth factors and can be regulated by the JAK/STAT signaling pathway.Inhibiting the expression of COX-2 can prevent the development of lung cancer.The aim fo this study is to investigate whether the epidermal growth factor (EGF) can stimulate the signal transducers and activators of transcription 5 (STAT5) as well as to discover the effects of the STAT5 signaling pathway on the COX-2 in human lung adenocarcinoma A549 cells.
Methods
The phenomenon of STAT5 activation stimulated by the EGF was assayed through immunofluorescence and Western blot.The adenovirus containing the wild-type (WT)-STAT5 (AdWT-STAT5) plasmid, dominant-negative (DN)-STAT5 (Ad-CMV5Stat5aΔ740) plasmid, and STAT5 siRNA were transfected into A549 cells.The latter two groups were stimulated using EGF. Reverse transcriptase polymerase chain reaction was used to detect the mRNA expression of COX-2.
Results
STAT5 was not activated in A549 cells in vitro.EGF stimulation significantly increased the level of the p-STAT5 protein and induces the shuttling of p-STAT5 from the cytoplasm into the nucleus.STAT5 activation was crucial for the COX-2 expression induced by the EGF.STAT5 was required for COX-2 expression, but can mediated the effects of the COX-2 expression through pathways that were independent of transcriptional activation.
Conclusion
COX-2 expression is dependent on STAT5 phosphorylation.A second pathway does not require STAT5 phosphorylation.
Keywords: STAT5, COX-2, Lung neoplasms, A549, EGF
肺癌是导致人类死亡的第一高发癌症。肺腺癌是非小细胞肺癌(non-small cell lung cancer, NSCLC)的一种, 虽然可以通过手术切除和放化疗进行治疗, 但患者预后通常较差。近几年随着小分子靶向药物治疗的兴起, 使部分肺腺癌患者的生存期明显延长, 生活质量得到改善。然而临床研究[1]表明, 表皮生长因子受体(epidermal growth factor receptor, EGFR)突变阳性的肺腺癌患者对EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)的有效率可达70%-80%, 而野生型的患者有效率仅约10%-20%, 治疗存在局限性。即便EGFR-TKI初始治疗有效的患者, 随着治疗时间的延长, 最终几乎都会出现获得性耐药, 而且, 严重的皮肤副反应等并发症常使很多患者被迫停药。以上种种问题限制了EGFR-TKI的推广使用, 在不久的将来, EGFR-TKI必将被副作用小、适用人群广的靶向药物所取代。
STAT5是STAT家族中的成员, 受细胞因子或生长因子激活后发生磷酸化改变, 由细胞浆穿梭入细胞核, 参与转录调控, 并在细胞的生长及分化过程中起到关键作用。在人体内很多组织存在STAT5的表达, 而且血液、乳腺、头颈部及前列腺肿瘤等存在STAT5的激活, 其参与了肿瘤细胞的增殖、分化及凋亡等生物学行为。COX-2是COX家族中的一员, COX-2在多种实体瘤如肺癌、乳腺癌、前列腺癌、膀胱癌中均存在较高表达, 并参与了肿瘤细胞的调亡、肿瘤侵袭、血管发生及肿瘤转移等过程。越来越多的研究表明COX-2在肺癌发生过程中起关键作用, COX-2的过度表达可以抑制细胞调亡, 刺激血管生成, 促进肿瘤细胞的浸润与转移, 导致肺癌疾病进展[2], 并可作为判断肺癌预后的指标[3]。而COX-2抑制剂无论与其它药物联合治疗或单独使用, 均因其对肺癌血管生成的抑制而具有治疗作用[2]。因此, COX-2成为肺癌未来诊断与治疗研究的新热点。但在肺腺癌中COX-2是否受到细胞因子的刺激后表达发生改变, 以及STAT5是否参与了COX-2表达的调控等机制至今仍不明确。带着这些疑问, 我们对肺腺癌A549细胞中STAT5对COX2的调控机制进行了研究。
1. 材料与方法
1.1. 材料
人肺癌细胞株A549购自中国科学院典型培养物保藏委员会细胞库。STAT5和p-STAT5a/b兔抗人抗体购自美国Santa Cruz公司, FITC标记的羊抗兔二抗购自美国Sigma公司。STAT5短片断干扰RNA(small interfer RNA, siRNA)(ON-TARGETplus SMARTpool siRNA), ON-TARGETplus Non-targeting siRNA(阴性对照)及DharmaFECT siRNA转染试剂均购自美国Dharmacon公司。STAT5显性负突变体(AdCMV5 Stat5a△740)及野生型STAT5(AdWTSTAT5)质粒由名古屋市立大学医学科学院Hiroko Yamashita教授惠赠。ProteoJETTM细胞浆和细胞核蛋白提取试剂盒购自加拿大Fermentas公司。蛋白提取试剂盒购自美国Milipore公司。Bradford蛋白定量试剂盒购自美国Pierce公司。含有STAT5结合位点的生物素标记双链探针(5' -biotin-AGATTTCTAGGAATTCGCAG-3' )购自美国Affymetrix公司。DuoSet IC(Intracellular)Active Transcription Factor Assays(用于检测转录因子结合实验)购自英国R & D公司。辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗兔抗体购自美国Chemicon公司。Trizol试剂购自Invitrogen公司。RT-PCR试剂盒购自大连TaKaRa公司。PCR所用引物均由大连TaKaRa公司提供。
1.2. 方法
1.2.1. 细胞培养
人肺癌细胞株A549用含有10%胎牛血清、100 μg/mL青霉素、100 μg/mL链霉素的RPMI-1640完全培养基(美国Gibco公司)在37 ℃、5%CO2、相对湿度为90%的培养箱中培养。随后将细胞接种于12孔板中进行EGF(Invitrogen公司, 100 ng/mL)激活实验及转染研究。
1.2.2. 免疫荧光法检测STAT5核穿梭现象
A549细胞爬片24 h, 待细胞伸展并牢固贴附玻片后用磷酸缓冲盐溶液(phosphate buffer saline, PBS)洗涤细胞, 更换为含0.1%血清的培养基饥饿培养过夜。次日更换为含100 ng/mL EGF和10%胎牛血清的完全培养基, 1 h后, 用PBS冲洗, 4%多聚甲醛固定10 min, 0.25% Triton X-100透化处理细胞, 5%胎牛血清封闭1 h, 用兔抗人STAT5或p-STAT5a/b一抗(1:100稀释)4 ℃孵育过夜。PBS洗涤后, 用FITC标记的羊抗兔二抗(1:200稀释)孵育2 h。Hoechst33258细胞核染色后, 在荧光显微镜下观察并拍照。
1.2.3. STAT5 siRNA的转染及分组研究
待A549细胞铺满板底约80%-90%时, 根据商品说明书使用DharmaFECT siRNA转染试剂对细胞进行STAT5 siRNA转染(50 nM)。ON-TARGETplus Non-targeting siRNA作为阴性对照进行转染, 转染72 h后Western blot法验证沉默效率。并根据研究需要分为6组:未转染组; 转染阴性对照siRNA组; EGF刺激组; 转染阴性对照siRNA加EGF刺激组; 转染STAT5 siRNA加EGF刺激组; 转染STAT5 siRNA组。
1.2.4. STAT5显性负突变体(dominant negative mutant, DN)及野生型STAT5的转染及分组研究
腺病毒介导的Stat5a△740 Stat5a能够阻断STAT5的信号通路的激活[4]。待A549细胞铺满板底约70%-80%时, 准备转染质粒。取2支EP管, 于一管中加入10 μg质粒和500 μL无血清、无抗生素的RPMI-1640培养基, 另一管加入20 μg Lipofectamine 2000和500 μL无血清、无抗生素的RPMI-1640培养基。两管混合后, 室温放置30 min, 再加1 mL RPMI-1640培养基, 混匀。吸出孔板中旧培养基, 用无血清、无抗生素的RPMI-1640培养基洗涤一遍, 然后加入已混匀的上述两种混合液。2 h后, 倒掉混合液, 更换为含10%血清的RPMI-1640培养基, 转染72 h后Western blot法验证转染效率。并根据研究需要分为5组:未转染组; 转染野生型STAT5组; EGF刺激组; 转染STAT5显性负突变体加EGF刺激组; 转染STAT5 siRNA加EGF刺激组。
1.2.5. 转录因子结合实验
将干预后细胞分为如下5组:未转染组; 转染野生型STAT5组; EGF刺激组; 转染STAT5显性负突变体加EGF刺激组; 转染STAT5 siRNA加EGF刺激组。根据试剂盒说明书提取各组细胞核蛋白。使用Bradford蛋白定量试剂盒进行蛋白质浓度测定。根据文献[5]指导进行操作。一抗为兔抗人p-STAT5(100 μL/1:100), 二抗为HRP标记的羊抗兔抗体(100 μL/ 1:200)。
1.2.6. Western blot实验
细胞经上述处理后, 根据试剂盒说明书分别提取细胞核蛋白, 细胞浆蛋白和总蛋白, 首先进行蛋白定量, 从每组中取50 μg蛋白提取物进行SDS聚丙烯酰胺凝胶电泳, 转膜, 以5%脱脂奶粉PBS/0.1% Tween20封闭30 min, 加入1:1, 000倍稀释的一抗(STAT5或p-STAT5), 以β-actin或Histone H1为内参, 4 ℃孵育过夜。PBS/0.1% Tween20洗膜后加入二抗室温孵育2 h。PBS/0.1% Tween20洗膜后ECL发光, 用Chemi-genius凝胶成像系统分析目的蛋白的表达量。
1.2.7. 半定量RT-PCR检测
细胞经过上述处理后, 收集细胞, 用Trizol试剂一步法提取细胞总RNA。取总RNA 500 ng进行cDNA第一链合成, 根据RT-PCR试剂盒说明书合成模板。引物序列如下:COX-2(forward:5’-TTCAAATGAGATTGTGGGAAAATTGCT-3' ;reverse:5' -AGATCATCTCTGCCTGAGTATCTT-3' ), β-actin(forward:5’-AAATCGTGCGTGACATTAA-3’; reverse:5’-CTCGTCATACTCCTGCTTG-3’)。PCR体系在94 ℃下变性2 min, 循环条件为94 ℃、30 s, 55 ℃、30 s, 72 ℃、30 s, 共25个循环, 最后延伸10 min。取产物5 μL通过电泳利用琼脂糖凝胶进行分离, 并在紫外线灯下照相。最后通过凝胶灰度分析仪进行统计分析。
1.3. 统计分析
利用SPSS 13.0软件进行统计学处理, 统计学数据用Mean±SD表示, 多组间均数比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2. 结果
2.1. EGF对肺腺癌A549细胞中STAT5活化的影响
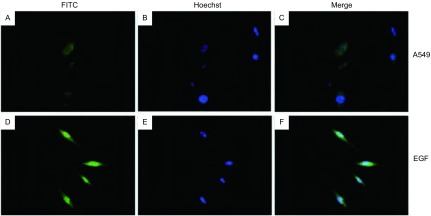
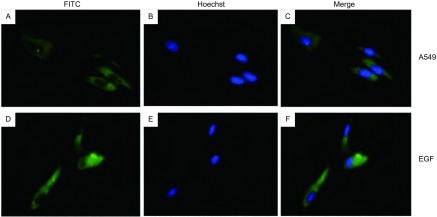
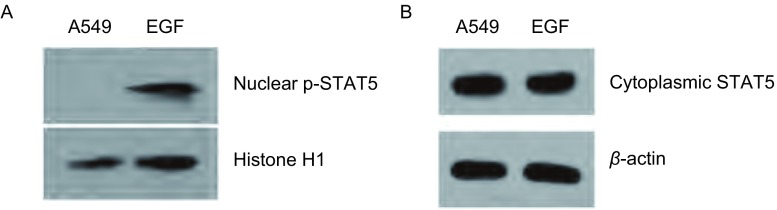
为明确在体外A549细胞中是否存在STAT5的激活, 以及EGF是否可以促进STAT5的活化, 我们用EGF对细胞刺激后进行了免疫荧光染色。在荧光显微镜下, 我们发现在部分未经处理的A549细胞中活化的STAT5(p-STAT5)主要位于细胞浆, 且处于极低的激活水平, 而在部分细胞则无p-STAT5的表达。EGF刺激A549细胞后STAT5部分活化穿梭入细胞核, 而且呈高水平激活(图 1)。在未经处理的A549细胞中STAT5位于细胞浆内, 呈高水平表达。EGF刺激A549细胞后细胞浆内STAT5的表达无明显改变(图 2)。经Western blot分析, 结果显示, 在未经处理的A549细胞核中无p-STAT5的表达, 而经EGF激活后, 细胞核中的p-STAT5呈高表达(图 3A)。在EGF刺激A549细胞前后, 细胞浆内的STAT5均呈高表达, 且无明显差异(图 3B)。
1.
A549细胞和EGF刺激A549细胞后p-STAT5的免疫荧光染色分析。A:p-STAT5在A549细胞中的表达; B:A549细胞的核染色; C:A与B的重叠图像; D:EGF刺激后p-STAT5在A549细胞中的表达; E:A549细胞的核染色; F:D与E的重叠图像。
Immunofluorescence of p-STAT5 in resting and EGF-stimulated human lung adenocarcinoma A549 cells.Upper panels, no EGF stimulation; lower panels, EGF stimulation.(A) and (D), p-STAT5 staining; (B) and (E), Hoechst33258 staining of nuclei; (C) and (F), merged images.
2.
A549细胞和EGF刺激A549细胞后STAT5的免疫荧光染色分析。A:STAT5在A549细胞中的表达; B:A549细胞的核染色; C:A与B的重叠图像; D:EGF刺激后STAT5在A549细胞中的表达; E:A549细胞的核染色; F:D与E的重叠图像。
Immunofluorescence of STAT5 in resting and EGF-stimulated human lung adenocarcinoma A549 cells.Upper panels, no EGF stimulation; lower panels, EGF stimulation.(A) and (D), STAT5 staining; (B) and (E), Hoechst33258 staining of nuclei; (C) and (F), merged images.
3.
EGF刺激对A549细胞核p-STAT5(A)和细胞浆STAT5(B)表达影响的免疫印迹分析
P-STAT5 (A) and STAT5(B) expression induced by EGF in human lung adenocarcinoma A549 cells.Western blot analysis of nucleus extracts from EGF-stimulated and resting A549 human lung adenocarcinoma cells showing upregulation of nucleus p-STAT5 (A) and no significant of cytoplasmic STAT5 (B).
2.2. STAT5 siRNA对A549细胞中STAT5蛋白表达的影响及对COX-2 mRNA表达的影响
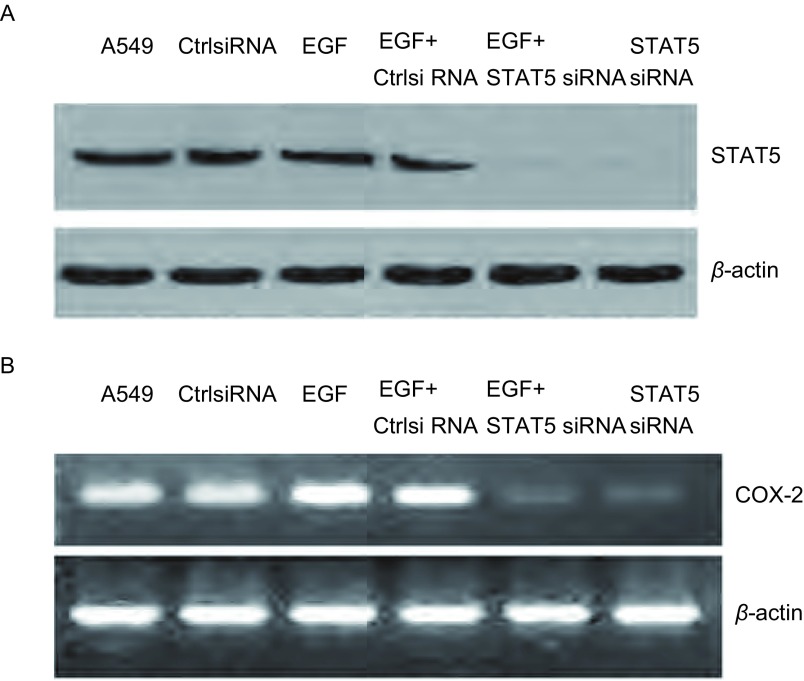
Western blot检测结果表明, 与未转染及转染阴性对照siRNA的细胞相比, 转染STAT5 siRNA细胞中STAT5蛋白表达水平明显降低(P < 0.05), 提示STAT5 siRNA能明显阻断STAT5的表达, 而EGF刺激后对STAT5的表达无明显影响(图 4A)。另一方面, 与未转染及转染阴性对照siRNA的细胞相比, 转染STAT5 siRNA细胞中COX-2 mRNA的表达明显降低(P < 0.05)。EGF虽然可以使COX-2 mRNA表达明显升高, 但在转染STAT5 siRNA细胞中, 此作用被明显削减(P < 0.05, 图 4B)。
4.
A549细胞转染STAT5 siRNA后以及受到EGF刺激后对STAT5表达影响的免疫印迹分析(A)和COX-2 mRNA表达影响的电泳分析(B)。A549:未转染组; CtrlsiRNA:转染阴性对照siRNA组; EGF:EGF刺激组; EGF+CtrlsiRNA:转染阴性对照siRNA加EGF刺激组; EGF+siRNA:转染STAT5 siRNA加EGF刺激组; STAT5 siRNA:转染STAT5 siRNA组。
Western blot analysis of STAT5 expression (A) and electrophoresis analysis of COX-2 expression (B) in A549 cells transfected with STAT5 siRNA together with or without EGF stimulation.A549:untransfected; CtrlsiRNA:transfected with control siRNA; EGF:stimulation with EGF; EGF+CtrlsiRNA:transfected with control siRNA and stimulation with EGF; EGF+STAT5 siRNA:transfected with STAT5 siRNA and stimulation with EGF; STAT5 siRNA:transfected with STAT5siRNA.
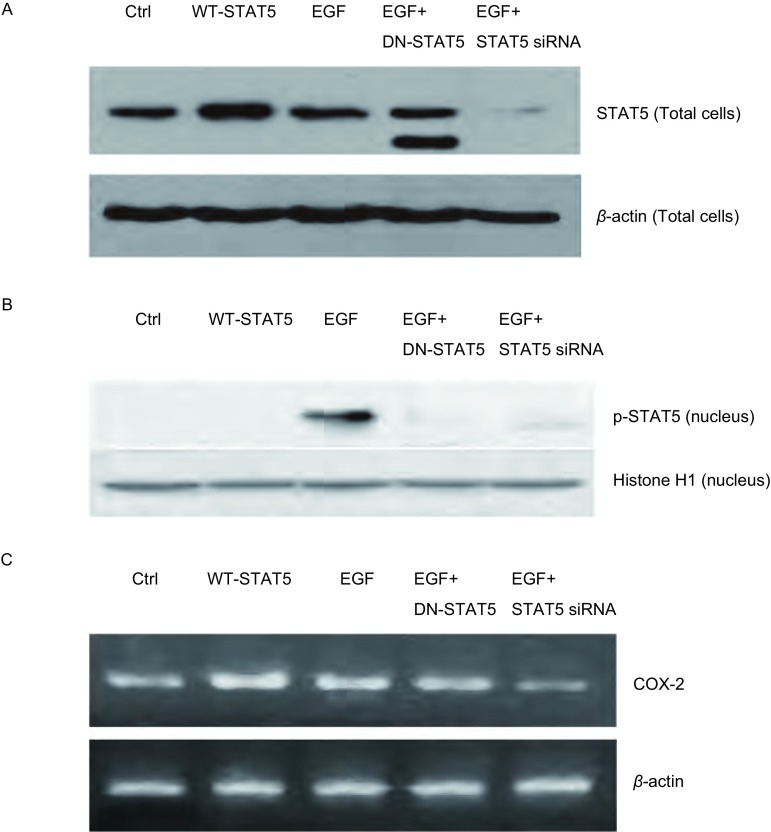
2.3. 野生型STAT5及STAT5显性负突变体对A549细胞中STAT5、p-STAT5蛋白及COX-2 mRNA表达的影响
Western blot检测结果表明, 与未处理组的细胞相比, 转染野生型STAT5细胞中STAT5蛋白表达水平明显升高(P < 0.05), 而对p-STAT5蛋白表达无明显影响。转染STAT5显性负突变体细胞对STAT5表达无明显影响, 但Western blot可见突变体条带, 而且, 转染STAT5显性负突变体后, EGF对STAT5的活化作用也被明显削弱(P < 0.05, 图 5A, 图 5B), 提示STAT5显性负突变体有阻断STAT5激活的作用。另一方面, 与未转染的细胞相比, 转染野生型STAT5细胞中COX-2 mRNA的表达明显升高(P < 0.05), 提示非磷酸化的STAT5在A549细胞中有调节COX-2表达的作用。转染STAT5显性负突变体细胞中, EGF上调COX-2 mRNA的作用被明显削弱(P < 0.05, 图 5C), 提示p-STAT5在A549细胞中同样具有调节COX-2表达的功能。
5.
A549细胞转染野生型STAT5, STAT5显性负突变体和STAT5 siRNA后以及受到EGF刺激后对STAT5(A)、p-STAT5(B)表达影响的免疫印迹分析和COX-2 mRNA表达影响的电泳分析(C)。Ctrl:未转染组; WT-STAT5:转染野生型STAT5组; EGF:EGF刺激组; EGF+DN-STAT5:转染STAT5显性负突变体加EGF刺激组; EGF+STAT5 siRNA:转染STAT5 siRNA组加EGF刺激组。
Western blot analysis of STAT5 (A), p-STAT5 (B) and electrophoresis analysis of COX-2 (C) expression in A549 cells transfected with WT-STAT5, DN-STAT5 and STAT5 siRNA together with or without EGF stimulation.Ctrl, transfected with control adenovirus; WT-STAT5, transfected with wild-type STAT5;EGF, stimulation with EGF; EGF+DN-STAT5, transfected with dominant negative STAT5 and stimulation with EGF; EGF+STAT5 siRNA, transfected with STAT5 siRNA and stimulation with EGF.
2.4. A549细胞中STAT5表达的变化和STAT5活化对DNA结合活性的影响
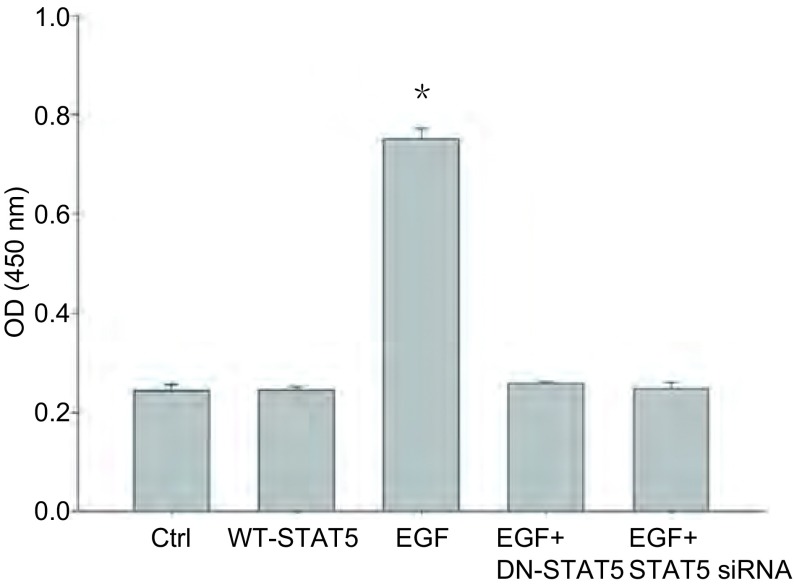
转录因子结合实验结果显示, 与未处理组的细胞相比, EGF刺激后的细胞的STAT5 DNA结合活性明显升高(P < 0.05)。转染野生型STAT5的细胞未发现STAT5 DNA结合活性发生改变。而转染STAT5显性负突变体和STAT5 siRNA的细胞中, EGF对STAT5 DNA结合活性的刺激作用被抑制(图 6)。提示STAT5显性负突变体和STAT5 siRNA有抑制STAT5 DNA结合活性的作用, 从而影响STAT5的转录活性。
6.
A549细胞转染野生型STAT5, STAT5显性负突变体和STAT5 siRNA后以及受到EGF刺激后对STAT5 DNA结合力表达影响的分析。与其它组相比, *P < 0.05, n=3。
STAT5 DNA binding assay in A549 cells nuclei transfected with WT-STAT5, DN-STAT5 and STAT5 siRNA with or without EGF stimulation.Data are means± SEM.*P < 0.05 when compared with the other four groups.n=3.
3. 讨论
自1992年Fu发现了信号转导和转录激活因子以来, 国内外医学工作者对STAT家族进行了大量研究, 证实STAT家族成员参与了多种细胞因子、生长因子的信号转导, 并调节人体免疫反应、炎症反应和细胞的生长、分化等。研究显示, 在许多恶性肿瘤中, 包括白血病[6]、乳腺癌[7]、前列腺癌[8]、头颈癌[9]及NSCLC[10]中均存在STAT的异常激活。STAT激活后发生磷酸化, 形成二聚体并穿梭入细胞核, 入核后的STAT与同源的DNA结合区域相结合诱导转录激活[11]。在NSCLC中已被证实存在STAT酪氨酸磷酸化现象[12]。
在STAT家族的7个成员中, 目前研究最为深入和广泛的是STAT3和STAT5。STAT5分为STAT5a和STAT5b两种亚型, STAT5位于细胞浆内, 受细胞因子或生长因子刺激, 在酪氨酸激酶, 特别是JAK激酶的作用下, 其羧基末端结构域的酪氨酸残基发生磷酸化, 从而使STAT5发生活化[13]。磷酸化的STAT5形成同源或异源的二聚体, 穿梭入细胞核内, 识别并结合到靶基因特异启动子的反应元件中[14]。
RNA干扰(RNA interference, RNAi)技术是用来研究基因功能的最常用工具, 属于转录后基因沉默(post-transcriptonal gene silencing, PTGS)。而显性负突变体是通过显性负性作用而产生负性调节效应, 在蛋白水平起竞争性抑制作用, 对目的基因表达无影响, 能够和正常受体竞争结合配体, 但是显性负突变体无信号传导功能, 因此对该受体功能起到抑制作用, 并对该受体的表达未造成影响, 而siRNA则会导致该受体表达水平下降。因此, siRNA和显性负突变体是在不同水平起作用的。STAT5是通过磷酸化及去磷酸化来实现其作用的, 磷酸化后生成的蛋白量很少, 若仅用siRNA来抑制目的基因表达并不能完全阐释STAT5的功能。而用显性负突变体则可以代替功能蛋白来研究其缺失后状态, 并对研究人类癌细胞的基因功能非常有用。STAT5显性负突变体的特点是使激活域的C末端的部分或完全失活。Stat5a△740是表达负显性STAT5的质粒, 保留了二聚体形成及DNA结合区域中保守的酪氨酸残基, 可对STAT5a和STAT5b介导的转录产生干扰[15]。我们通过对A549细胞进行STAT5显性负突变体转染, 使细胞过表达显性负STAT5, 从而减弱DNA结合活性, 抑制EGF介导的DNA结合活性的增加, 以此研究STA5活化后对COX-2的调节作用。通过对细胞进行野生型STAT5的转染可以使STAT5的表达升高, 借助此方法, 我们可以更深一步地为非磷酸化STAT5对COX-2的调控作用进行阐释。
本研究中, 通过对A549细胞进行EGF的刺激, STAT5 siRNA、野生型STAT5及STAT5显性负突变体的转染, 从多层次多角度探讨了STAT5对COX-2的调控作用, 从而得出如下结论:EGF的刺激可诱导A549细胞中STAT5的活化, 使COX-2 mRNA的表达明显升高, 但STAT5的表达未增加; STAT5 siRNA可抑制STAT5蛋白及COX-2 mRNA的表达, 并可削减EGF对STAT5的激活效应; 野生型STAT5可使STAT5蛋白和COX-2 mRNA的表达升高, 但不能使STAT5发生活化; STAT5显性负突变体可削减EGF对STAT5的活化作用和EGF上调COX-2 mRNA的作用。这些结果提示, 在肺腺癌A549细胞中, STAT5的激活参与了COX-2的调控, 而且是COX-2上调表达的必须条件。另一方面, 非磷酸化的STAT5的表达也是COX-2表达的必要条件, 其可能通过不依赖于磷酸化和转录激活途径来实现其调控作用。COX-2表达很可能受非磷酸化STAT5及磷酸化STAT5双途径的调控。据文献[16]报道, STAT5可被EGFR家族激酶激活, 这也与我们得出的STAT5可以通过EGFR信号通路发生活化这一结论相符。
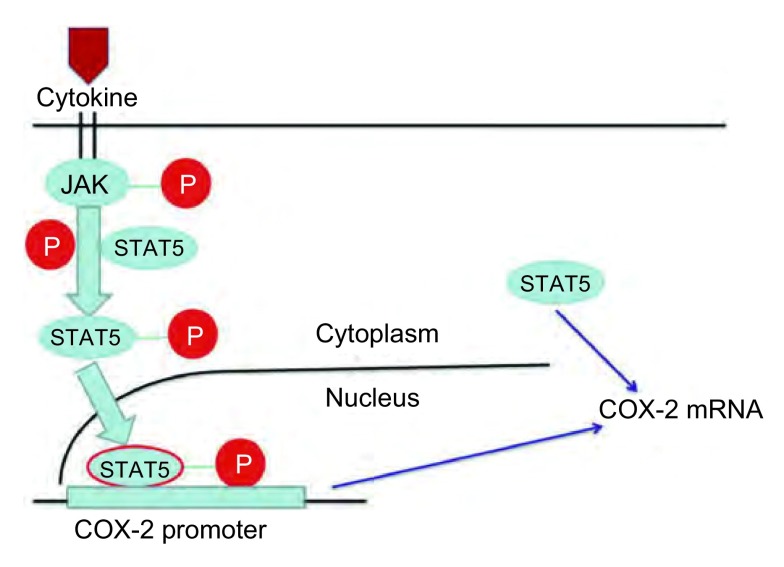
综上所述, 通过我们研究, 有如下新发现:①在体外A549细胞中STAT5无激活; ②EGF能够诱导STAT5的激活, 促使磷酸化的STAT5穿梭入核; ③STAT5的激活是EGF诱导COX-2上调表达的必要条件; ④非磷酸化状态的STAT5可能通过非转录激活的途径参与了COX-2表达的调控。更令我们感兴趣的是在研究中发现非磷酸化STAT5也可能参与了COX-2表达的调控, 还有一个尚未明确的信号通路需要我们继续去探求。我们可以利用STAT5通过磷酸化及非磷酸化双途径来实现对COX-2的调控(图 7)这一特点, 探求一条以STAT5为靶点治疗肺腺癌的新途径, 为更多肺腺癌患者的治疗寻求到新出路。
7.
STAT5对COX-2可能存在的两种调控机制。STAT5通过磷酸化及非磷酸化双途径来实现对COX-2的调控。
Schematic depiction of two different potential mechanisms of regulation.STAT5 regulates COX-2 by pathways dependent of phosphorylation and unphosphorylation.
Funding Statement
本研究受黑龙江省卫生厅课题项目(No.2011-157)资助
This study was supported by the grant from Science Foundation of Heilongjiang Health Department (to Shouqiang CAO)(No.2011-157)
References
- 1.Mitsudomi T, Yatabe Y. Mutations of the epidermal growth factor receptor gene and related genes as determinants of epidermal growth factor receptor tyrosine kinase inhibitors sensitivity in lung cancer. Cancer Sci. 2007;98(12):1817–1824. doi: 10.1111/cas.2007.98.issue-12. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Castelao JE, Bart RD, 3rd, DiPerna CA, et al. Lung cancer and cyclooxygenase-2. Ann Thorac Surg. 2003;76(4):1327–1335. doi: 10.1016/S0003-4975(03)00334-5. [DOI] [PubMed] [Google Scholar]
- 3.Jiang H, Wang J, Zhao W. Cox-2 in non-small cell lung cancer:A meta-analysis. https://www.sciencedirect.com/science/article/pii/S000989811300034X. Clin Chim Acta. 2013;419C:26–32. doi: 10.1016/j.cca.2013.01.012. [DOI] [PubMed] [Google Scholar]
- 4.Yamashita H, Iwase H, Toyama T, et al. Naturally occurring dominant-negative Stat5 suppresses transcriptional activity of estrogen receptors and induces apoptosis in T47D breast cancer cells. Oncogene. 2003;22(11):1638–1652. doi: 10.1038/sj.onc.1206277. [DOI] [PubMed] [Google Scholar]
- 5.Wu A, Ericson K, Chao W, et al. NFAT and AP1 are essential for the expression of a glioblastoma multiforme related IL-13Ra2 transcript. https://experts.umn.edu/en/publications/nfat-and-ap1-are-essential-for-the-expression-of-a-glioblastoma-m. Cell Oncol. 2010;32(5-6):313–329. doi: 10.3233/CLO-2010-0524. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Casetti L, Martin-Lanneree S, Najjar I, et al. Differential contributions of STAT5A and STAT5B to stress protection and tyrosine kinase inhibitor resistance of chronic myeloid leukemia stem/progenitor cells. Cancer Res. 2013;73(7):2052–2058. doi: 10.1158/0008-5472.CAN-12-3955. [DOI] [PubMed] [Google Scholar]
- 7.Barash I. Stat5 in breast cancer:potential oncogenic activity coincides with positive prognosis for the disease. Carcinogenesis. 2012;33(12):2320–2325. doi: 10.1093/carcin/bgs362. [DOI] [PubMed] [Google Scholar]
- 8.Liao Z, Nevalainen MT. Targeting transcription factor Stat5a/b as a therapeutic strategy for prostate cancer. http://www.ncbi.nlm.nih.gov/pmc/articles/instance/3056559/ Am J Transl Res. 2011;3(2):133–138. [PMC free article] [PubMed] [Google Scholar]
- 9.Cohen-Kaplan V, Jrbashyan J, Yanir Y, et al. Heparanase induces signal transducer and activator of transcription (STAT) protein phosphorylation:preclinical and clinical significance in head and neck cancer. J Biol Chem. 2012;287(9):6668–6678. doi: 10.1074/jbc.M111.271346. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Sanchez-Ceja SG, Reyes-Maldonado E, Vazquez-Manriquez ME, et al. Differential expression of STAT5 and Bcl-xL, and high expression of Neu and STAT3 in non-small-cell lung carcinoma. Lung Cancer. 2006;54(2):163–168. doi: 10.1016/j.lungcan.2006.07.012. [DOI] [PubMed] [Google Scholar]
- 11.Vinkemeier U. Getting the message across, STAT! Design principles of a molecular signaling circuit. J Cell Biol. 2004;167(2):197–201. doi: 10.1083/jcb.200407163. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Chang KT, Tsai CM, Chiou YC, et al. IL-6 induces neuroendocrine dedifferentiation and cell proliferation in non-small cell lung cancer cells. Am J Physiol Lung Cell Mol Physiol. 2005;289(3):L446–453. doi: 10.1152/ajplung.00089.2005. [DOI] [PubMed] [Google Scholar]
- 13.Rui H, Djeu JY, Evans GA, et al. Prolactin receptor triggering.Evidence for rapid tyrosine kinase activation. http://www.jbc.org/content/267/33/24076.short. J Biol Chem. 1992;267(33):24076–24081. [PubMed] [Google Scholar]
- 14.Ihle JN. The Stat family in cytokine signaling. Curr Opin Cell Biol. 2001;13(2):211–217. doi: 10.1016/S0955-0674(00)00199-X. [DOI] [PubMed] [Google Scholar]
- 15.Kazansky AV, Raught B, Lindsey SM, et al. Regulation of mammary gland factor/Stat5a during mammary gland development. https://academic.oup.com/mend/article/9/11/1598/2715108. Mol Endocrinol. 1995;9(11):1598–1609. doi: 10.1210/mend.9.11.8584036. [DOI] [PubMed] [Google Scholar]
- 16.Mirmohammadsadegh A, Hassan M, Bardenheuer W, et al. STAT5 phosphorylation in malignant melanoma is important for survival and is mediated through SRC and JAK1 kinases. J Invest Dermatol. 2006;126(10):2272–2280. doi: 10.1038/sj.jid.5700385. [DOI] [PubMed] [Google Scholar]