Summary
Nous rapportons l’observation d’une patiente brûlée grave qui a présenté une asystolie au cours d’une greffe dermo-épidermique des deux membres supérieurs. Le saignement per-opératoire, l’hypovolémie et l’hypothermie sont à l’origine de cette asystolie. Nous rappelons la prise en charge d’un arrêt cardio-circulatoire au bloc opératoire au cours d’une chirurgie du brûlé grave.
Keywords: arrêt circulatoire peropératoire, brûlé, hémorragie, hypothermie
Abstract
We report the case of a severe burn patient who presented an asystole during a dermo-epidermal graft of the two upper limbs. Perioperative bleeding, hypovolemia and hypothermia are at the origin of this incident. We review the management of cardiopulmonary arrest in the operating theatre during burns surgery
Introduction
La survenue d’un arrêt cardiaque au bloc opératoire est un événement redoutable. Chez le patient brûlé, le saignement, l’hypovolémie et l’hypothermie restent les causes les plus fréquentes. Néanmoins la démarche diagnostic et la prise en charge doivent suivre les recommandations des sociétés savantes.
Observation
Me D.M, patiente de 30 ans, sans antécédents pathologiques particuliers (notamment pas de notion d’allergie médicamenteuse ni au latex) est hospitalisée pour brûlures thermiques graves. Le 6 Février 2017 les habits de la patiente ont pris feu suite à une explosion de bonbonnes de gaz sur un marché dans la région de Rabat. Elle s’est mise à courir sur une distance de quelques mètres avant de tomber. Prise en charge par l’équipe des sapeurs pompiers elle a été transférée au CHU Avicenne de Rabat. La surface cutanée brûlée est estimée à 50%. Un remplissage vasculaire est initié avec du sérum salé isotonique 20 ml/kg la première heure associe à une oxygénothérapie, une couverture isotherme et une analgésie par morphine. La patiente est admise dans le service des brûlés de l’hôpital militaire d’instruction Mohammed V de Rabat à la 3ème heure.
A l’admission, la patiente est consciente avec un GCS à 15 /15. On note une détresse hémodynamique (TA = 72 /50 mm Hg FC =135/min). Il n’y a pas de détresse respiratoire : Fr = 14/min SaO2 = 98% en air ambiant. Sur le plan cutané, on constate des brûlures du 2éme degré superficiel de la face, du cou et du thorax, des brûlures du 2ème degré profond des 2 membres supérieurs, circulaires et des 2 mains sans signe de compression et du membre inférieur gauche. Il n’y a pas d’oedème de la face, les voies aériennes supérieures sont libres. Le remplissage vasculaire est poursuivi (après pose d’une voie veineuse centrale fémorale droite) par des cristalloïdes (2ml/kg/%) permettant une stabilisation de l’état hémodynamique avec une TA = 90 /58 mm Hg. La diurèse est de 300 ml. La patiente est admise au bloc opératoire où sont réalisées des incisions de décharge des deux membres supérieurs, sous anesthésie générale après induction et intubation en séquence rapide. Les suites en réanimation des brûlés sont simples. Un examen ophtalmologique élimine toute lésion oculaire. Des pansements occlusifs des brûlures sont réalisés un jour sur deux avec de la sulfadiazine argentique. Une indication opératoire de greffe dermo-épidermique des deux membres supérieurs est posée par le chirurgien plasticien. Au cours de la consultation pré-anesthésique (CPA), l’examen clinique était normal avec un abdomen souple. La radiographie thoracique et l’électrocardiogramme (ECG) ne montrent pas d’anomalies. Le bilan biologique préopératoire est normal avec une hémoglobine à 11,4 g/dl, l’albumine est 22 g/l. Le bilan de coagulation est normal, la patiente est de groupe O positif.
Au bloc opératoire, la patiente est installée en décubitus dorsal avec mise en place d’un monitorage de la température, d’une capnographie et d’une saturation pulsée en oxygène. Une voie veineuse périphérique et un cathéter radial (pour monitorage de la pression artérielle sanglante) sont posés au membre supérieur droit. Quatre concentrés érythrocytaires sont mis en réserve. L’induction est réalisée par propofol, fentanyl et cisatracurium. Une intubation orotrachéale et une sonde nasogastrique sont posées. Les courbes de capnographie (PETCO2) et de la pression artérielle invasive sont satisfaisantes. L’entretien de l’anesthésie est réalisé par du sévoflurane. Le chirurgien réalise des excisions tangentielles des deux membres supérieurs sous garrot et une prise de greffe au niveau du membre inférieur droit. L’hémostase en est partie assurée par des compresses imbibées d’adrénaline. Pendant l’excision des membres supérieurs, la patiente présente un saignement massif, avec une hypotension artérielle instantanée. Puis apparaît une bradycardie suivie d’une asystolie. Les pressions de ventilation et l’auscultation restent normales. On ne note pas de rash cutané. Un massage cardiaque externe associé à une ventilation manuelle en oxygène pur est immédiatement entrepris. On réalise en outre l’injection de 1 mg d’adrénaline toutes les 3 minutes et un remplissage par 1 000 ml de Ringer Lactate. Dès réception, la transfusion à haut débit de 4 concentrés érythrocytaires et 4 plasma frais congelés est réalisée. Ces manoeuvres permettent la récupération d’un rythme sinusal ainsi que d’une courbe de pression artérielle et d’ETCO2. Le taux d’hémoglobine est à 8,4 g/dl après transfusion. L’équipe chirurgicale a pu ensuite réaliser la greffe dermo-épidermique des deux membres supérieurs. L’installation brutale d’une asystolie juste après l’excision nous laisse supposer que l’étiologie est l’hypovolémie engendrée par le saignement massif et brutal, aggravée par l’hypothermie (température mesuré à 32°C).
Discussion
Le saignement peropératoire. Au cours de l’intervention chirurgicale, un saignement diffus est apparu dés la réalisation des excisions. L’excision-greffe du brûlé est une chirurgie hémorragique, le saignement provenant de la zone excisée peut être majeur. La perte de sang dépend de la surface excisée, du type de chirurgie, du délai entre la chirurgie et la brûlure. Les prélèvements cutanés pour autogreffe sont très hémorragiques mais se tarissent rapidement. L’excision tangentielle entraine un saignement en nappe, dont le contrôle chirurgical est plus délicat.1 Les excisions « au fascia » (avulsions) permettent une meilleure hémostase chirurgicale mais sont plus délabrantes. Les pertes sanguines induites par une excision sont estimées de 1,3 à 3 ml/cm² de surface corporelle excisée en peropératoire. Dans les premières 24 heures, le saignement est en moyenne de 80 à 100 ml pour 1% de surface excisée, alors qu’il peut être supérieur à 150 ml à partir du troisième jour. L’expérience nous montre que le volume du saignement chirurgical est difficile tant à prédire qu’à évaluer. L’évaluation du saignement per-opératoire est en effet difficile en raison de son caractère diffus si bien que, lors des excisions ou des prélèvements cutanés dépassant 10% de surface corporelle, il est souhaitable de mesurer les pertes sanguines par pesée des compresses et des champs ou par méthode colorimétrique.1,2 L’hémostase au sérum adrénaliné est souvent utilisée. Dans l’étude de Schaden, le saignement chirurgical nécessite 4,8 CG, 5 PFC et 4 CP par séance chirurgicale.3 Une hypocalcémie peut survenir lors d’une transfusion massive, en raison du citrate utilisé comme anticoagulant dans les produits sanguins labiles. La baisse du calcium ionisé, biologiquement actif expose à une aggravation de la défaillance cardio-vasculaire et à la survenue d’un arrêt cardio-circulatoire. La concentration de calcium ionisé doit être maintenue au dessus de 0,9 mmol/L par un apport de chlorure de calcium. L’acide tranexamique est un antifibrinolytique, analogue synthétique de la lysine. Sa demi-vie d’élimination plasmatique est courte (80–120 mn après injection intraveineuse). Différents travaux ont montré son utilité en situation hémorragique.
L’hypothermie profonde peropératoire est une cause d’asystolie et nécessite le monitorage de la température centrale chez les brûlés. La transfusion de concentres érythrocytaires, conservés à 4°C est un facteur aggravant l’hypothermie. La transfusion sanguine à travers une voie jugulaire interne du sang froid à 4° arrive directement aux cavités cardiaques est peut être responsable d’asystolie en majorant l’hypothermie myocardique. La voie fémorale semble meilleure en entrainant moins de refroidissement myocardique. L’hypothermie aggravant le saignement en obérant l’hémostase, il convient d’opérer dans une salle maintenue à plus de 25°C (idéalement 30°C), d’utiliser des moyens de réchauffement externes et internes (réchauffement des liquides perfusés), de recouvrir les zones non opérées et de réaliser le pansement dés qu’une zone est opérée.
Les excisions tangentielles et les zones donneuses saignent d’autant plus que la pression artérielle est élevée. Une pression artérielle systolique à 120 mm Hg est le maximum. Étiologies de l’ACR peropératoire (Tableau I). La recherche de l’étiologie de l’arrêt circulatoire est fondamentale car elle peut permettre de proposer un traitement spécifique, indispensable.4-6 Il est nécessaire de réaliser une série de vérification en fonction du contexte et de la fréquence des évènements: dans notre cas il s’agit d’une chirurgie à fort potentiel hémorragique (Fig. 1).
Fig 1.

La première étape consiste à rechercher une orientation en fonction du contexte : le geste chirurgical (hypovolémie, pertes sanguines), le type d’anesthésie, le terrain (coronarien par exemple), la clinique (signe d’anaphylaxie) et enfin les données du monitorage (désaturation, hyperthermie). En l’absence d’orientation évidente, la recherche d’une cause ventilatoire constitue la deuxième étape, notamment chez le patient intubé. En effet les causes les plus fréquentes sont l’obstruction ou le déplacement de la sonde d’intubation, le bronchospasme et le pneumothorax. Le moindre doute sur le bon fonctionnement du circuit de ventilation conduit à une ventilation manuelle en oxygène pur. La troisième étape demande une vérification rapide du plateau d’anesthésie afin de détecter une erreur d’administration. La quatrième étape repose sur un bilan cardiovasculaire avec analyse de l’ECG à la recherche d’un trouble du rythme, d’un trouble de la repolarisation ou de la conduction. Quelques études ont analysé l’intérêt de l’échocardiographie pendant un arrêt cardiaque notamment pour la détection des causes réversibles (tamponnade, embolie pulmonaire, dissection aortique, hypovolémie etc.). Enfin un bilan biologique (ionogramme, numération formule sanguine, gaz du sang, bilan d’anaphylaxie) peut être réalisé à la recherche d’une déglobulisation, d’un trouble métabolique ou d’un mécanisme allergique. Optimisation de la réanimation cardio-pulmonaire. Le monitorage est précieux pour évaluer la qualité de la RCP. Ainsi, la mesure continue de la pression artérielle invasive et surtout la mesure de la PETCO2, inconstamment disponibles en médecine pré-hospitalière, sont des éléments essentiels pour l’évaluation de la RCP au BO. Lorsqu’elle est mesurée de façon continue avant l’AC, la pression artérielle sanglante représente le meilleur moyen de monitorer l’efficacité du massage cardiaque. Elle permet la mesure continue de la pression artérielle diastolique, qui est un bon déterminant de la pression de perfusion coronaire (pression de perfusion de coronaire = pression artérielle diastolique - pression auriculaire droite). La pression de perfusion de coronaire est un des meilleurs facteurs hémodynamiques prédictifs de la survenue d’une récupération d’activité circulatoire spontanée (RACS) chez l’homme et chez l’animal. Il existe une valeur seuil de cette pression de perfusion de coronaire, aux alentours de 15mmHg, qui correspond à une pression diastolique aortique d’environ 35mmHg. Une telle pression assure un débit sanguin myocardique théoriquement suffisant pour les besoins métaboliques du coeur pendant la RCP. La mesure de la PETCO2 reste le paramètre le plus intéressant pour monitorer en routine la RCP.7 Elle permet d’évaluer l’efficacité du massage cardiaque, de détecter une éventuelle RACS, et certains l’ont proposée comme indice pronostic. La présence obligatoire d’un capnographe au BO permet ainsi de guider la réanimation efficacement, en l’absence de monitorage invasif. En effet, de nombreuses publications ont montré que la PETCO2 est proportionnelle au débit cardiaque chez un patient sous AG, lorsque la ventilation contrôlée est stable et lorsqu’il n’existe pas de variations métaboliques. Au cours de la RCP, quand le patient est ventilé de façon mécanique, le CO2 expiré est alors le reflet direct de l’efficacité du massage cardiaque en termes de débit cardiaque (Fig. 2).
Fig 2.
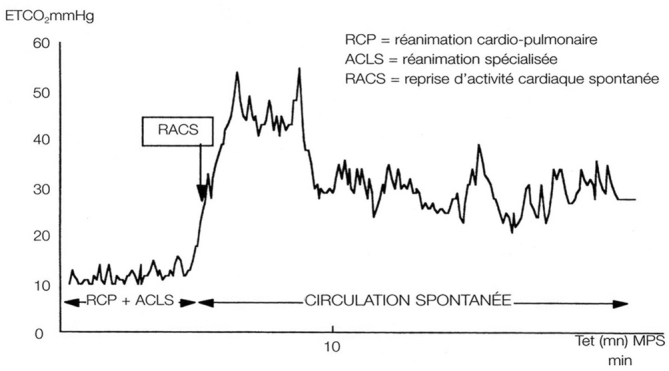
La PETCO2 a été proposée comme facteur prédictif de RACS : la valeur minimale pour espérer une RACS est, selon les auteurs, de 10 à 15mm Hg. Néanmoins, ces valeursseuil ne peuvent pas être considérées comme des indicateurs suffisamment fiables pour décider de la poursuite ou non de la RCP. L’évolution du chiffre de PETCO2 au cours de la RCP paraît aussi importante que le chiffre lui-même : la dégradation de la PETCO2 au cours de la RCP, quelle que soit la valeur initiale, est un facteur péjoratif et inversement.8,9 Il existe des limites à l’utilisation de laPETCO2: toute modification du rapport ventilation/perfusion (par exemple en cas d’embolie pulmonaire), de la ventilation, du métabolisme interfère avec la PETCO2. L’utilisation de bicarbonates pour traiter l’acidose métabolique au cours de l’AC et l’injection de fortes doses d’adrénaline modifient également la PETCO2. Chez notre patiente, les manoeuvres de MCE, de réchauffement et de remplissage vasculaire ainsi que la correction de l’anémie ont permis la récupération d’un rythme sinusal, d’une courbe de pression artérielle et de l’ETCO2. L’évaluation de l’efficacité du massage cardiaque fondée sur l’amplitude du tracé cardioscopique est illusoire; de même l’oxymétrie de pouls est rarement utilisable au cours de la RCP. La mesure de la pression artérielle non invasive discontinue est également peu fiable. En revanche, il ne faut pas oublier la possibilité de prélever des gaz du sang artériel, afin d’évaluer l’équilibre acidobasique et la qualité de l’hématose. Ainsi, la prescription d’alcalinisant pour le traitement d’un ACBO ne devra être envisagée qu’avec la mesure du pH artériel. L’utilisation de l’échocardiographietransoesophagienne au cours de l’AC a été décrite ponctuellement, en particulier pour évaluer certaines techniques de massage cardiaque externe (MCE). Cette technique délicate est peu applicable au cours du MCE. La mesure continue du débit aortique par méthode non invasive, grâce à une sonde oesophagienne écho-Doppler, a été également rapportée au cours d’ACBO: cette méthode, associée à la mesure de l’ETCO2 présente essentiellement un intérêt pour détecter précocement la survenue de la défaillance circulatoire avant l’AC et pour apprécier la RACS. Toutefois, sa fiabilité pour évaluer la RCP paraît discutable.10-12 Les moyens de monitorage de la fonction cérébrale paraissent avoir un intérêt encore limité au cours de la RCP. La pression d’oxygène conjonctivale, qui est un reflet indirect du débit sanguin cérébral n’est pas un bon indice de la circulation cérébrale pendant la RCP.13 Le Doppler transcrânien a été proposé expérimentalement comme monitorage non invasif de la perfusion cérébrale pendant la RCP. La vélocité moyenne du flux carotidien au Doppler est corrélée avec le débit de la carotide interne, mais il n’existe pas actuellement d’application clinique de cette méthode. L’intérêt de l’analyse bispectrale n’a pas été évalué dans cette indication. Le massage cardiaque per opératoire. Le MCE au bloc opératoire n’a pas de spécificité particulière. Le patient est en décubitus dorsal sur un plan dur, le talon de la main de l’intervenant en appui sur le tiers inférieur du sternum sur la ligne médiane, l’autre main étant posée perpendiculairement au-dessus. Le sternum doit être déprimé de façon franche mais non brutale d’environ 4 à 5 cm en utilisant la force musculaire des bras et au besoin le poids du corps. Le rythme de compression doit être de 80 à 100/min. Le temps de compression doit être égal au temps de relaxation.13-15 L’utilisation d’une cardio-pompe permet la réalisation d’une décompression active. Son association à la compression habituelle du MCE permet, en théorie, d’améliorer le retour veineux et d’augmenter la pression artérielle diastolique au cours de la RCP. Ainsi, la pression de perfusion coronaire optimisée augmenterait les chances de RACS.13-15 Malheureusement, à ce jour, une seule étude randomisée multicentrique confirme l’intérêt clinique de la cardio-pompe. Par ailleurs, aucune étude n’a actuellement porté sur la RCP au bloc opératoire. Les médicaments de l’ACR sont repris dans le Tableau II.
Tableau I.

Tableau II.

Conclusion
L’excision chez un brûlé grave est souvent hémorragique. L’anesthésiste-réanimateur doit anticiper la survenue de toute hypovolémie du à un saignement chirurgical par un remplissage vasculaire et une transfusion de concentrés érythrocytaires. La réanimation cardio-pulmonaire de l’arrêt cardiaque au bloc opératoire doit être entreprise sans délai. Le monitorage du patient anesthésié, en particulier avec l’apport du capnographe permet d’anticiper ou de détecter précocement l’AC et de monitorer de façon efficace une RCP mise en route sans délai.
References
- 1.Table ronde hémostase et transfusion du patient brûlé. Congrès 2014 de la SFETB. Brûlures. 2014;15:71–73. [Google Scholar]
- 2.Siah S. Mécanismes et traitement de l’anémie aiguë chez le brûlé grave. Ann Burns and Fire Disasters. 2016;29:108–110. [PMC free article] [PubMed] [Google Scholar]
- 3.Schaden E, Kimberger O, Kraincuk Perioperative treatment algorithm for bleeding burn patients reduces allogenic blood product requirements. Br J Anaesth. 2012;109:376–381. doi: 10.1093/bja/aes186. [DOI] [PubMed] [Google Scholar]
- 4.Vivien B. Arrêt cardiaque au bloc opératoire. Douxièmes journées lilloises d’anesthésie, réanimation et médecine d’urgence, 2015. Available from:http://www.jlar.com/Congres_anterieurs/jlar2015/JLAR_2015_PEC_ACR_au_Bloc.pdf . [Google Scholar]
- 5.Moitra VK, Gabrielli A, Maccioloi G, O’Connor M. Anesthesia advanced circulatory life support. Can J Anesth. 2012;59:586–603. doi: 10.1007/s12630-012-9699-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Lena-Quintard D. Arrêt circulatoire au bloc opératoire. Le Praticien en anesthésie réanimation. 2015;19:136–142. [Google Scholar]
- 7.Gudipati C, Weil M, Bisera J, Deshmukh H, Rackow E. Expired carbon dioxide: noninvasive monitor of cardiopulmonary resuscitation. Circulation. 1988;77:234–239. doi: 10.1161/01.cir.77.1.234. [DOI] [PubMed] [Google Scholar]
- 8.Callaham M, Barton C. Prediction of outcome of cardiopulmonary resuscitation from end-tidal carbon dioxide concentration. Crit Care Med. 1990;18:358–362. doi: 10.1097/00003246-199004000-00002. [DOI] [PubMed] [Google Scholar]
- 9.Guerci A, Thomas K, Hess D, Halperin H. Correlation of transconjunctival PcjO2 with cerebral oxygenation delivery during cardiopulmonary resuscitation in dogs. Crit Care Med. 1988;16:612–614. doi: 10.1097/00003246-198806000-00010. [DOI] [PubMed] [Google Scholar]
- 10.Ornato JP. Hemodynamic monitoring during CPR. Ann Emerg Med. 1993;22:289–294. doi: 10.1016/s0196-0644(05)80458-5. [DOI] [PubMed] [Google Scholar]
- 11.Gueugniaud PY, Muchada R, Bertin-Maghit M, Griffith N, Petit P. Non invasive continuous haemodynamic monitoring and PETCO2 monitoring during a peroperative cardiac arrest. Can J Anaesth. 1955;42:910–913. doi: 10.1007/BF03011039. [DOI] [PubMed] [Google Scholar]
- 12.Snyder A, Salloum L, Barone J, Conley M, Todd M, Digiacomo J. Predicting short-term outcome of cardiopulmonary resuscitation using central venous oxygen tension measurements. Crit Care Med. 19;1991:111–113. doi: 10.1097/00003246-199101000-00024. [DOI] [PubMed] [Google Scholar]
- 13.Carli P, Petit P, Wilkening M, Freysz M. Réanimation des arrêts cardio-respiratoires de l’adulte. Ann Fr Anesth Réanim. 1994;13:876–887. doi: 10.1016/s0750-7658(05)80931-1. [DOI] [PubMed] [Google Scholar]
- 14.Carli P, Lejay M. Arrêt cardiaque et anesthésie. Carli P, Gueugniaud PY: L’arrêt circulatoire. 1998:111–115. [Google Scholar]
- 15.ALS Working Party of the European Resuscitation Council (ERC). Guidelines for advanced life support. Resuscitation. 1992;24:111–121. [PubMed] [Google Scholar]


