Summary
La résistance bactérienne est une préoccupation majeure et le bon usage des antibiotiques est une priorité de santé publique mondiale. L’utilisation inappropriée de l’antibiothérapie peut avoir de graves conséquences en termes écologique et pharmaco-économique. L’objectif de notre travail était d’étudier la réévaluation de l’antibiothérapie probabiliste au sein de l’unité de réanimation des brûlés. Une étude prospective concernant la réévaluation clinico-biologique de l’antibiothérapie à a été mise en place dans l’unité de réanimation des brûlés de l’Hôpital Militaire d’Instruction Mohammed V de Rabat. Les données ont été recueillies sur une période de 6 mois, du premier juin au 30 Novembre 2017. Pendant la période d’étude, 142 patients ont bénéficié d’une prescription antibiotique, dont 68, septiques graves, ont été inclus dans notre étude. La population est à prédominance masculine (75%). L’âge moyen de nos patients était de 36 ans avec des extrêmes allant de 15 à 56 ans. La durée moyenne de l’hospitalisation en réanimation était de 10 jours. Sur les 68 antibiothérapies mises en place, le taux de réévaluation a été de 72,06%. Les ¾ des traitements étaient justifiés, 25% non justifiées. Une désescalade thérapeutique a été réalisée dans 8 cas (11,76%) quand elle aurait pu être effectuée 25 fois (36,76%). Ceci est expliqué par la forte prévalence de BMR (Klebsiella pneumoniæ, Acinetobacter baumannii, Escherichia coli) et de Staphylocoques coagulase négatifs dans l’unité, ce qui restreint le choix de l’antibiothérapie. La réévaluation clinico-biologique de l’antibiothérapie s’avère indispensable pour lutter contre le mauvais usage des antibiotiques. Cette étude nous a amené a réaliser plusieurs actions : la désignation d’un pharmacien réfèrent en antibiothérapie au sein du Pole Pharmacie de l’hôpital militaire d’instruction Mohammed V de Rabat, l’activation d’un Comité Anti-Infectieux et la dispensation nominative des antibiotiques via Pyxis MedStation.La résistance bactérienne est une préoccupation majeure et le bon usage des antibiotiques est une priorité de santé publique mondiale. L’utilisation inappropriée de l’antibiothérapie peut avoir de graves conséquences en termes écologique et pharmaco-économique. L’objectif de notre travail était d’étudier la réévaluation de l’antibiothérapie probabiliste au sein de l’unité de réanimation des brûlés. Une étude prospective concernant la réévaluation clinico-biologique de l’antibiothérapie à a été mise en place dans l’unité de réanimation des brûlés de l’Hôpital Militaire d’Instruction Mohammed V de Rabat. Les données ont été recueillies sur une période de 6 mois, du premier juin au 30 Novembre 2017. Pendant la période d’étude, 142 patients ont bénéficié d’une prescription antibiotique, dont 68, septiques graves, ont été inclus dans notre étude. La population est à prédominance masculine (75%). L’âge moyen de nos patients était de 36 ans avec des extrêmes allant de 15 à 56 ans. La durée moyenne de l’hospitalisation en réanimation était de 10 jours. Sur les 68 antibiothérapies mises en place, le taux de réévaluation a été de 72,06%. Les ¾ des traitements étaient justifiés, 25% non justifiées. Une désescalade thérapeutique a été réalisée dans 8 cas (11,76%) quand elle aurait pu être effectuée 25 fois (36,76%). Ceci est expliqué par la forte prévalence de BMR (Klebsiella pneumoniæ, Acinetobacter baumannii, Escherichia coli) et de Staphylocoques coagulase négatifs dans l’unité, ce qui restreint le choix de l’antibiothérapie. La réévaluation clinico-biologique de l’antibiothérapie s’avère indispensable pour lutter contre le mauvais usage des antibiotiques. Cette étude nous a amené a réaliser plusieurs actions : la désignation d’un pharmacien réfèrent en antibiothérapie au sein du Pole Pharmacie de l’hôpital militaire d’instruction Mohammed V de Rabat, l’activation d’un Comité Anti-Infectieux et la dispensation nominative des antibiotiques via Pyxis MedStation.
Keywords: antibiothérapie probabiliste, réévaluation, désescalade, brules
Abstract
Bacterial resistance is a major concern and the proper use of antibiotics is a global public health priority. Inappropriate use of antibiotic therapy can have serious ecological and pharmaco-economic consequences. The objective of our work was to study the reevaluation of probabilistic antibiotherapy in the burns intensive care unit. A prospective study concerning the clinical-biological reassessment of antibiotic therapy was set up in the burns intensive care unit at the Military Hospital Instruction Mohammed V of Rabat. The data was collected over a period of 6 months, from June 1, 2017 to November 30, 2017. During the study period, 142 patients received an antibiotic prescription. Only 68 serious hospitalized septic patients were included in our study. The population was predominantly male (75%). The average age of our patients was 36 years, ranging from 15 to 56 years old. The average length of hospitalization in intensive care was 10 days. Of the 68 antibiotic regimens implemented, the reassessment rate was 72.06%, with 75% justified treatment rates, and 25% not justified. Therapeutic de-escalation was performed in 8 cases (11.76%), when it could have been performed 25 times (36.76%). This is justified by the nosocomial context of the burns intensive care unit with a bacterial ecosystem of BMR type (Klebsiella pneumoniae, Acinetobacter baumanii, Escherichia coli and Staphylococcus coagulase negative), which restricts the choice of antibiotic therapy to some molecules. Clinico-biological re-evaluation of antibiotic therapy is essential to fight the misuse of antibiotics. This study allowed us to evaluate the re-evaluation practices of antibiotic therapy at 48-72h in burns resuscitation. Subsequently, several actions were carried out: the appointment of a pharmacist in antibiotherapy within the Pole Pharmacy of the Mohammed V Military Hospital in Rabat, the activation of an Anti-Infectious Committee and the dispensing of antibiotics via Pyxis MedStation.
Introduction
Apparus durant le XXème siècle, les antibiotiques ont énormément contribué à la lutte contre les maladies infectieuses qui, jusqu’alors, constituaient une des premières causes de mortalité dans le monde. Mais ce moyen thérapeutique voit son efficacité se restreindre en raison de l’apparition des résistances bactériennes qui constituent actuellement un sérieux problème de santé publique, auquel doivent faire face les praticiens au quotidien. La résistance bactérienne aux antimicrobiens est un phénomène qui n’est ni nouveau ni surprenant.1 En effet, les bactéries ont la capacité à s’adapter aux changements de leur environnement en développant des mécanismes pour se protéger des modifications délétères de leur milieu.2 Ainsi, les propos de Charles Darwin restent encore d’actualité : « les espèces qui survivent ne sont ni les plus fortes, ni les plus intelligentes, mais celles qui s’adaptent le mieux aux changements de leur environnement ».3 Tout usage d’un antibiotique, qu’il soit approprié ou non, exerce donc une pression dite « de sélection » sur les colonies bactériennes, qui fait que seules les mieux adaptées survivent. La pression de sélection est ainsi proportionnelle à l’utilisation des antibiotiques au sens que plus ceux-ci sont utilisés plus la pression est forte.1 De facto, réduire la prescription d’antibiotiques permet de diminuer la pression de sélection et de faire reculer les résistances bactériennes.4 La résistance bactérienne est une préoccupation émergente au point que le thérapeute peut se retrouver face à une impasse. Ce problème est tellement d’actualité que l’OMS a fait de la lutte contre la résistance bactérienne le thème de la journée mondiale de la santé en 2011. La résistance aux antibiotiques est devenue un phénomène planétaire et l’émergence des bactéries multi résistantes (BMR) n’est plus cantonnée aux établissements de soins mais concerne tous les milieux. L’infection est un aléa majeur de la prise en charge des brûlés et en particulier des brûlés graves. En effet la diffusion hématogène à partir la colonisation du tissu brûlé peut être à l’origine de phénomènes infectieux que le déficit immunitaire associé aux brûlures graves peut rendre particulièrement préoccupants. En pratique clinique, le médecin est, de ce fait, volontiers amené à recourir à des traitements anti-infectieux puissants mais souvent empiriques, car l’antibiothérapie est une urgence thérapeutique dans un contexte où l’infection peut conduire au décès du patient.5 L’utilisation inappropriée de l’antibiothérapie peut ainsi avoir de graves conséquences, non seulement en termes de morbi-mortalité mais aussi en matière de séquelles, allongement de la durée de séjour et surcoûts. Il est donc essentiel, une fois le diagnostic d’infection posé, d’avoir recours à des antibiotiques efficaces, prescrits de manière probabiliste dans un premier temps puis adaptés aux micro-organismes en cause et à leur sensibilité aux antibiotiques dans un deuxième temps, ainsi que de toujours les utiliser à une posologie suffisante, selon des modes d’administration adaptés à leur pharmacodynamie, contrôlés par des dosages sanguins. L’objectif de notre travail était d’étudier cette réévaluation de l’antibiothérapie probabiliste en service de réanimation des brûlés chez les patients septiques graves, par l’estimation de la pertinence du recours à l’antibiothérapie, du choix des molécules prescrites en probabiliste et de l’adaptation secondaire éventuelle au germes en cause et à leurs phénotypes de résistance (antibiogramme). Cette évaluation des choix thérapeutiques se fonde sur les recommandations des sociétés savantes et les données de la littérature.6 Au final il s’agira de corriger les pratiques du centre des brûlés afin d’élaborer des protocoles d’antibiothérapie plus efficaces.
Materials and methods
Étude prospective observationnelle réalisée dans le service des brûlés de l’Hôpital Militaire d’Instruction Mohammed V de Rabat, inauguré en 1998. C’est une structure unique et récente dans le plateau technique du Service de Santé des Forces Armées Royales. Sa capacité d’accueil est de 10 lits, pouvant aller jusqu’à 15 lits en cas d’afflux massif. Le service est constitué d’une aile destinée à la réanimation des grands brûlés comprenant 5 chambres, dont chacune est équipée de matériel de réanimation (moniteur multiparamétrique, respirateur) et d’un lit fluidisé.7 Chaque chambre dispose d’une centrale individuelle de traitement d’air. Cela permet de lutter contre la contamination croisée. Une vigilance environnementale régulière a été instauré, à savoir le contrôle microbiologique des surfaces, du linge, de l’eau et de l’air. Une aile est dédiée aux brûlés ne nécessitant pas de soins de réanimation, comprenant cinq chambres avec un lit chacune. L’équipement du service comprend trois baignoires, un appareil d’épuration extrarénale et un appareil mobile de radiologie. Le service dispose d’un bloc opératoire autonome avec flux laminaire. Les données ont été recueillies sur une période de 6 mois, du premier juin au 30 Novembre 2017. Le recueil de données a été effectué grâce à la « fiche de recueil » créée à cet effet (Annexe 1), à partir des dossiers patients. Nous avons inclus l’ensemble des patients hospitalisés au sein de la réanimation des brûlés pour lesquels une antibiothérapie probabiliste avait été instaurée, identifiés comme en choc septique. Le recueil a été débuté au 5ème jour, afin de pouvoir prendre en compte la réévaluation. L’analyse des prescriptions de l’antibiothérapie probabiliste et de sa réévaluation a été basée sur les critères suivants : La clinique ; fonctions supérieures: présence d’une encéphalopathie ou syndrome confusionnel, qui peut être confirmée par la mesure du score de Glasgow < 14 ; fonction rénale: Oligurie (diurèse < 0,5 mL/kg/h pendant 3 heures), Créatinine > 177 μmol/L (20 mg/L) ou élévation de 50% par rapport au taux de base ; fonction respiratoire: PaO2 < 60 mmHg ou SpO2 < 90%, PaO2/FiO2 < 300 ou baisse de ce rapport > 20% (malade sous ventilation mécanique) ; coagulation: Thrombopénie < 100 000/mm3 ou TP < 50%, ou chute de plus de 30% du taux de plaquettes ou du TP lors de 2 prélèvements successifs, Score de Coagulation IntraVasculaire Disséminée (International Society on Thrombosis and Haemostasis) > 4; fonction hépatique: Hyperbilirubinémie > 34 μmol/L ; Fonction circulatoire: Hypotension systolique < 90 mm Hg (ou baisse de 40 mmHg par rapport au chiffre de base) ou moyenne < 70 mmHg ; hyperlactatémie artérielle > 2 mmol/L ; chez le malade sous surveillance hémodynamique, apparition d’un état hyperdynamique (i.e. augmentation de l’index cardiaque > 3,5 L/min/m2 ), score SOFA (Sepsis-related Organ Failure Assessment) au moins égal à deux points,10 les résultats microbiologiques (documentation bactériologique), les référentiels et les recommandations des sociétés savantes et des conférences de consensus.6,8,9 La prescription antibiotique était jugée « justifiée », lorsqu’une antibiothérapie était effectivement indiquée par rapport aux recommandations de la Société Française de Brûlologie (en d’autres termes, lorsque les critères retenus permettaient de porter le diagnostic de sepsis, le recours à l’antibiothérapie était jugé recevable) ; « pertinente » lorsque le choix de la molécule était correct par rapport à la documentation bactériologique (en d’autres termes, lorsque chaque germe était évalué par l’antibiogramme comme sensible aux molécules mises en place, le choix des molécules était jugé pertinent) ; « adaptée » si l’antibiothérapie en place correspondait au spectre antibactérien le plus étroit possible l’antibiothérapie était considérée comme adaptée (en d’autres termes si l’antibiothérapie initiale a été modifiée au profit de molécules de spectre plus étroit -désescalade effectuée-, l’antibiothérapie est dite adaptée.6 Si l’antibiothérapie probabiliste initiale ne pouvait être modifiée faute de proposition thérapeutique à spectre plus étroit, l’antibiothérapie initiale est considérée comme adaptée (désescalade impossible) ; « efficace » si les posologies et le mode d’administration respectent la pharmacocinétique et la pharmacodynamie, en accord avec les propositions de la SFB, l’antibiothérapie est présumée efficace.4 Les résultats issus de cette étude ont été exploités grâce au logiciel SPSS 10 par le Laboratoire de Biostatistiques et de Recherche Clinique de la Faculté de Médecine et de Pharmacie de Rabat. L’élaboration de la fiche d’exploitation s’est inspirée de la grille d’évaluation des pratiques professionnelles proposée par la Haute Autorité de Santé française.11
Results
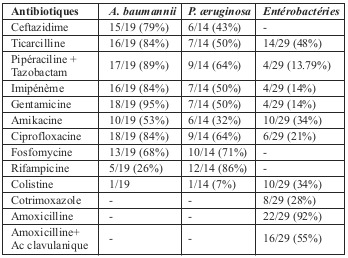
Pendant la période d’étude, 142 patients pris en charge ont bénéficié d’une prescription antibiotique, dont 68 patients septiques graves ont été inclus, avec une prédominance masculine (75%). L’âge moyen de nos patients était de 36 ans avec des extrêmes allant de 15 à 56 ans. La durée moyenne de l’hospitalisation était de 10 jours. Dans 75% des cas, une infection cutanée motivait la prescription d’antibiotiques, une infections pulmonaire dans 10,29%, une bactériémie dans 8,82%, une infection urinaire dans 5,88% des prescriptions. Quarante neuf (72,06%) >72h, et 16 cas (23,53%) plus tard. L’adaptation de la prescription aux germes identifiés représentait le motif d’évaluation dans 62 cas parmi les 68 prescriptions soit (91,17%). Suite à la réévaluation, la prescription initiale a été maintenue 56 fois (82,35%) raison de l’efficacité clinique de l’antibiothérapie initiale. Le changement d’au moins un antibiotique a été opéré dans 13,23% des cas (9/68). Le changement des modalités d’administration n’a représenté que 1,47% (1/68). L’arrêt de l’antibiothérapie a été opéré dans 2,94% des cas (2/68), tandis que la modification des posologies n’a été réalisée chez aucun des 68 patients. Quatre familles d’antibiotiques représentent 94,38% des prescriptions : les ßlactamines dépassent la moitié des prescriptions (57,35%) dont 35,29% pour les céphalosporines et 22,05% pour les pénicillines, les polymyxines (colimycine) arrivent en deuxième position avec (19,11%), les aminosides (19,11%), et enfin les fluoroquinolones (5,88%). Pour chaque famille d’antibiotique, la voie intraveineuse était utilisée de manière systématique. Les posologies utilisées étaient conformes aux résumés des caractéristiques des produits (autorisation de mise sur le marché). Les prélèvements bactériologiques ont permis l’isolement de 72 espèces bactériennes. Pseudomonas æruginosa, Acinetobacter baumannii, Escherichia coli et Klebsiella pneumonie sont les quatre espèces les plus fréquemment isolées (Tableau 1). Le profil de résistance des bactéries isolées est résumé dans le Tableau 2. Pendant la période d’étude, 142 patients ont bénéficié d’une prescription antibiotique dont 68 patients septiques graves ont été inclus dans notre étude. Un référentiel a été retrouvé applicable à la situation clinique dans 56 cas, ce qui rend l’antibiothérapie mise en route justifiée dans 82,35% des situations. Le choix de l’antibiothérapie n’a cependant été jugé pertinent que dans 51 cas (75%). Les motifs de non pertinence des antibiothérapies étaient principalement : prescription d’une molécule non recommandé (8/68 cas), association non recommandée ou inadaptée à la situation clinique (4/68 des cas d’antibiothérapies non pertinentes). Cent quarante deux antibiotiques ont été prescrits en probabiliste dont 116 (81,69%) sont conformes, et 26 (18,31%) non conformes. Une désescalade a été réalisée dans 8 cas (11,76%) quand les résultats bactériologiques qui auraient permis une désescalade représentaient 25 cas (36,76%).
Tableau 1. Répartition par espèces des isolats bactériens (n=72).
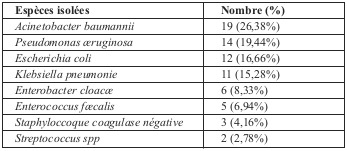
Tableau 2. Profil de résistance des bactéries isolées.
Discussion
L’efficacité d’une antibiothérapie se juge principalement sur une amélioration rapide de la clinique (disparition de la fièvre et des signes cliniques), une négativation des prélèvements microbiologique et une normalisation des paramètres inflammatoires (CRP). Il est recommandé de réévaluer toute antibiothérapie 48 à 72 heures après son initiation de façon à juger de son efficacité (échec si persistance de signes locaux et généraux de l’infection) et à pouvoir adapter l’antibiothérapie probabiliste éventuellement mise en place en choisissant l’antibiotique avec le spectre le plus étroit, en prenant aussi en compte leur diffusion au site de l’infection, leurs effets secondaire et leur coût. Le seul critère de guérison est l’absence de rechute à l’arrêt du traitement. Donc les règles d’utilisation des antibiothérapies doivent permettre de limiter la pression de sélection et ainsi l’émergence de bactéries résistantes, non seulement dans le foyer initial mais aussi dans les flores commensales. La réévaluation, point incontournable dans le bon usage de l’antibiothérapie, doit être clinique, microbiologique et pharmacologique (voie d’administration, posologie, mode d’administration, concentrations sériques). Or il existe un réel manque de recommandations pour les situations où le résultats biologiques sont négatifs alors que la suspicion clinique est grand. La réévaluation à 48-72h permet d’apprécier l’évolution clinique, d’obtenir les données microbiologiques, de s’assurer de la preuve ou non d’une infection et de sa nature bactérienne. Cette réévaluation est essentielle au bon usage, en particulier dans le cadre des antibiothérapies probabilistes.8
Notre étude a montré un taux de réévaluation globale à 48-72h de 72,06%, plus élevé que ceux retrouvés dans la littérature : 34,9% dans l’étude de Garnacho-Montero en 2014 concernant les septicémies et 45% dans l’étude de Morel en 2010 concernant toute pathologie infectieuse survenant en soins intensifs.12,13 Ceci peut être expliqué par la définition de la réévaluation de l’antibiothérapie. En effet, a été considéré comme réévaluation toute transcription sur le dossier patient de l’évaluation de l’état clinique du patient et de la modification de l’antibiothérapie. Il n’était jamais clairement indiqué dans les dossiers patients que les changements de posologie ou d’antibiothérapie étaient dus à une réévaluation. Il est clairement relevé que même si de toute évidence la réévaluation est bien effectuée dans le service, il manque une traçabilité dans le dossier patient. La désescalade antibiotique est une stratégie répondant à un double objectif : assurer un bénéfice individuel pour le patient en instaurant le plus rapidement possible une antibiothérapie efficace et, à l’échelle de la collectivité, diminuer l’émergence de BMR en réduisant la pression de sélection. Cette stratégie de désescalade antibiotique consiste à passer d’un traitement empirique initial à large spectre à un traitement antibiotique ayant un spectre plus étroit après une réévaluation systématique dans les 48-72 premières heures après le début de l’antibiothérapie, selon les données microbiologiques obtenues.14 L’antibiothérapie probabiliste est guidée par les recommandations usuelles de traitement, adaptée aux données épidémiologiques locales. La grande diversité des pathogènes rencontrés et leur fréquente multirésistance conduisent généralement à une antibiothérapie à large spectre afin de s’assurer d’un traitement rapidement efficace chez ces patients graves. Les modalités de la désescalade sont multiples : réduction du nombre d’antibiotiques, rétrécissement du spectre voire arrêt du traitement en cas de non confirmation de l’origine bactérienne du tableau infectieux.15 Plusieurs études montrent que les patients «désescaladés» ont un taux de mortalité significativement plus faible que ceux pour lesquels l’antibiothérapie n’était pas modifiée.16,17 Cette étude a permis de montrer que seules 75% des prescriptions antibiotiques étaient à la fois justifiées et pertinentes. Le taux de pertinence (75%), est dans la fourchette haute de la littérature (30 à 80%), les études s’intéressant le plus souvent à un seul type de pathologie ou à une seule famille d’antibiotiques, d’où l’amplitude des variations observées.18-24 Deux causes majeures de non pertinence des antibiothérapies ont été identifiées : la prescription d’une molécule inadaptée et la mise en route d’associations non recommandées. Les céphalosporines et les pénicillines viennent au premier rang des prescriptions, suivies des aminosides et les fluoroquinolones. Cette dernière classe d’antibiotiques est fréquemment prescrite en probabiliste du fait de son large spectre d’activité, de sa facilité d’administration et de son excellente tolérance, mais qui pose problème de posologies insuffisantes qui rendent la molécule inefficace car le germe n’est pas tué, donc la taille de l’inoculum reste suffisante pour qu’apparaissent des mutants résistants. Leur préservation pour des indications ciblées et conforme aux recommandations et non au dossier d’AMM est indispensable afin de maintenir leur efficacité, et limiter l’émergence et le développement de résistances.25 L’établissement de quelques règles simples de prescription sur les 4 familles d’antibiotiques les plus utilisées permettraient, de fait, une amélioration notable de la pertinence et de la conformité des prescriptions ainsi qu’une réduction du surcoût relatif aux erreurs de prescriptions. Concernant le retentissement de la pertinence des prescriptions antibiotiques, plusieurs études ont montré une diminution de la durée d’hospitalisation et une augmentation des taux de guérison lorsque l’antibiothérapie initiale était correcte. 26-29
Conclusion
La prise de conscience du mauvais usage des antibiotiques, de ces conséquences économiques et de l’évolution des résistances bactériennes a conduit la promotion de méthodes concernant l’organisation et les modalités de la prescription des antibiotiques à l’hôpital. Après 72 h, la part des prises en charge probabilistes diminue, la réévaluation de l’antibiothérapie s’avère indispensable. Cette étude nous a permis d’évaluer les pratiques de réévaluation de l’antibiothérapie à 48-72h au sein de la réanimation des brules. Ce qui noua a ramené a réaliser plusieurs actions : la désignation d’un pharmacien réfèrent en antibiothérapie au sein du Pole Pharmacie de l’hôpital militaire d’instruction Mohammed V de rabat, l’activation d’un Comité Anti-Infectieux et la dispensation nominatif des antibiotiques via Pyxis MedStation.
References
- 1.Guide pharmaceutique PSF-CI : Comprendre et promouvoir les bonnes pratiques pharmaceutiques, Décembre 2003. Available from: psfci.acted.org/images/PSF_dossiers_pdf/guides_techniques/guidepsf_bpp.pdf . [Google Scholar]
- 2.Sjölund M, Bonnedahl J, Hernandez J. Dissemination of Multidrug-Resistant Bacteria into the Arctic. Emerg Infect Dis. 2008;14:70–72. doi: 10.3201/eid1401.070704. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Charles Darwin / 1809-1882. Citation Evolution. Available from: www.atheisme.free.fr . [Google Scholar]
- 4.Ravat F, Le Floch R, Vinsonneau C. Antibiotics and the burn patient. Burns. 2011;37:16–26. doi: 10.1016/j.burns.2009.10.006. [DOI] [PubMed] [Google Scholar]
- 5.Dellinger P, Carlet PJ, Masur H. Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock. Intensive Care Med. 2004;30:536–555. doi: 10.1007/s00134-004-2210-z. [DOI] [PubMed] [Google Scholar]
- 6.Ravat F. Recommandations relatives à l’utilisation des antibiotiques chez le brûlé à la phase aiguë, texte long. Ann Fr Anesth Reanim. 2009;28:265–274. doi: 10.1016/j.annfar.2008.12.020. [DOI] [PubMed] [Google Scholar]
- 7.Ihrai A, Moussaoui Y, Oufroukh Y. Prise en charge des brûlés au Maroc. Expérience du service des brûlés de l’hôpital militaire d’instruction Mohammed V. Médecine et Armées. 2003;31:395–398. [Google Scholar]
- 8.Bakhtiari K, Meijers JCM, de Jonge E. Prospective validation of the International Society of Thrombosis and Haemostasis scoring system for disseminated intravascular coagulation. Critical Care Medicine. 2004;32:2416–2421. doi: 10.1097/01.ccm.0000147769.07699.e3. [DOI] [PubMed] [Google Scholar]
- 9.Taylor FB, Toh CH, Hoots WK, Wada H, Levi M. Towards definition clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation - On behalf of the Scientific Subcommittee on Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Thromb Haemost. 2001;86:1327–1330. [PubMed] [Google Scholar]
- 10.Singer M. The third international consensus definitions for sepsis and septic shock (sepsis-3). Jama. 2016;315(8):801–810. doi: 10.1001/jama.2016.0287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Haute Autorité de Santé : “Stratégie d’antibiothérapie et prévention des résistances bactériennes en établissement de santé.” 2008. Téléchargeable sur: https://www.has-sante.fr/portail/upload/docs/application/pdf/bon_usage_des_antibiotiques_rapport_complet.pdf . [Google Scholar]
- 12.Garnacho-Montero J, Gutiérrez-Pizarraya A, Escoresca-Ortega A. De-escalation of empirical therapy is associated with lower mortality in patients with severe sepsis and septic shock. Intensive Care Med. 2014;40:32–40. doi: 10.1007/s00134-013-3077-7. [DOI] [PubMed] [Google Scholar]
- 13.Morel J, Casoetto J, Jospé R. De-escalation as part of a global strategy of empiric antibiotherapy management. A retrospective study in a medico-surgical intensive care unit. Crit Care. 2010;14:R225. doi: 10.1186/cc9373. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Leone M, Bechis C, Baumstarck K. De-escalation versus continuation of empirical antimiùcrobial treatment in severe sepsis: a multicenter non-blinded randomized noninferiority trial. Intensive Care Med. 2014;40:1399–1408. doi: 10.1007/s00134-014-3411-8. [DOI] [PubMed] [Google Scholar]
- 15.Masterton RG. Antibiotic de-escalation. Crit Care Clin. 2011;27:149–156. doi: 10.1016/j.ccc.2010.09.009. [DOI] [PubMed] [Google Scholar]
- 16.Joung M, Lee J, Moon S. Impact of de-escalation therapy on clinical outcomes for intensive care unit-acquired pneumonia. Crit Care. 2011;15:R79. doi: 10.1186/cc10072. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Kollef MH, Morrow L, Niederman M. Clinical characteristics and treatment patterns among patients with ventilator-associated pneumonia. Chest. 2006;129(5):1210–1218. doi: 10.1378/chest.129.5.1210. [DOI] [PubMed] [Google Scholar]
- 18.Pavese P, Bonadona A, Vittoz JP. Apport d’une consultation systématique d’infectiologie à la maîtrise de l’antibiothérapie en réanimation. Réanimation. 2005;14:281–287. [Google Scholar]
- 19.Etienne P, Roger PM, Brofferio P. Antimicrobial stewardship program and quality of antibiotic prescriptions. Med Mal Infect. 2011;41:608–612. doi: 10.1016/j.medmal.2011.07.010. [DOI] [PubMed] [Google Scholar]
- 20.Mechkour S, Vinat A, Yilmaz M. Qualité des prescriptions antibiotiques (fluoroquinolones, aminosides et amoxicilline-acide clavulanique); évaluation dans les secteurs de médecine d’un centre hospitalier universitaire. Pathol Biol. 2011;59:9–15. doi: 10.1016/j.patbio.2010.07.017. [DOI] [PubMed] [Google Scholar]
- 21.Roger PM, Brofferio P, Labate C. Évaluation prospective des associations antibiotiques d’un centre hospitalier général. Med Mal Infect. 2010;40:165–171. doi: 10.1016/j.medmal.2009.08.019. [DOI] [PubMed] [Google Scholar]
- 22.Deconinck L, Maillard H, Lemaitre M. Évaluation de la qualité de l’antibiothérapie des infections urinaires dans le service de médecine polyvalente post-urgence du CHRU de Lille: une étude de cohorte rétrospective. La Revue de Médecine Interne. 2015;36:728–735. doi: 10.1016/j.revmed.2015.07.012. [DOI] [PubMed] [Google Scholar]
- 23.Afekouh H, Baune P, Abbas R. Antibiotic prescription evaluation in the rehabilitation ward of a geriatric hospital. Med Mal Infect. 2015;45:427–435. doi: 10.1016/j.medmal.2015.09.010. [DOI] [PubMed] [Google Scholar]
- 24.Alloussi H. Évaluation de la prescription des antibiotiques au service des urgences de l’hôpital militaire d’instruction Mohammed V De Rabat: étude prospective a propos de 105 cas. Thèse de doctorat. 2014 [Google Scholar]
- 25.Chidiac C. Update on a proper use of systemic fluoroquinolones in adult patients (ciprofloxacin, levofloxacin, moxifloxacin, norfloxacin, ofloxacin, pefloxacin). Médecine et maladies infectieuses. 2015;45(9):348. doi: 10.1016/j.medmal.2015.07.003. [DOI] [PubMed] [Google Scholar]
- 26.Augustin P, Kermarrec N, Muller-Serieys C. Risk factors for multidrug resistant bacteria and optimization of empirical antibiotic therapy in postoperative peritonitis. Critical Care. 2010;14:R20. doi: 10.1186/cc8877. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Sturkenboom M, Goettsch W, Picelli G. Inappropriate initial treatment of secondary intra-abdominal infections leads to increased risk of clinical failure and costs. Br J Clin Pharmacol. 2005;60:438–443. doi: 10.1111/j.1365-2125.2005.02443.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Garnacho-Montero J, Ortiz-Leyba C, Herrera-Melero I. Mortality and morbidity attributable to inadequate empirical antimicrobial therapy in patients admitted to the ICU with sepsis: a matched cohort study. J Antimicrob Chemother. 2007;61:436–441. doi: 10.1093/jac/dkm460. [DOI] [PubMed] [Google Scholar]
- 29.Edelsberg J, Berger A, Weber D. Clinical and economic consequences of failure of initial antibiotic therapy for hospitalized patients with complicated skin and skin-structure infections. Infec Control Hosp Epidemiol. 2008;29:160–169. doi: 10.1086/526444. [DOI] [PubMed] [Google Scholar]


