Le surdiagnostic était bien reconnu durant la moitié du 20e siècle à la suite de l’avènement du dépistage généralisé des cancers1,2. Par ailleurs, au 21e siècle, le surdiagnostic a fait l’objet d’une attention bien plus grande de la part des professionnels de la santé et des décideurs en raison des travaux charnières de Welch et Black3. Initialement, tous s’étonnaient que le diagnostic d’un problème comme le cancer puisse ne pas être bénéfique.
Le surdiagnostic demeure un concept difficile à communiquer à la population, dont la majorité n’est pas au courant du problème4. Le public et de nombreux membres de la profession médicale sont d’accord avec l’idée qu’il vaut mieux prévenir que guérir. En outre, le surdiagnostic crée un cycle de renforcement positif. Si on inclut, dans les statistiques sur la survie, des personnes qui n’étaient pas destinées à mourir dans la période de suivi mesurée, le taux de survie est gonflé et devient une conséquence trompeuse du surdiagnostic. En retour, cette apparente amélioration dans les taux de survie incite à subir plus de tests et à poser plus de surdiagnostics5.
Il est extrêmement important de reconnaître le phénomène du surdiagnostic et de mieux le faire connaître, parce qu’il est l’une des conséquences les plus fréquentes du dépistage et de la détection précoce de tout problème, quel qu’il soit. Par conséquent, dans la prise de décisions conjointe, le surdiagnostic devrait être une composante essentielle des renseignements discutés avec des personnes qui envisagent un dépistage. Il devrait aussi être pris en compte avant de prescrire un test de diagnostic.
Scénarios de cas
Cas 1.
Linda est une femme de 74 ans atteinte d’une hémiparésie du côté droit à la suite d’un AVC. On lui a diagnostiqué l’an dernier un petit cancer du sein après qu’elle eut passé une mammographie de dépistage. Elle a subi une tumorectomie et de la radiothérapie. Linda croit que la mammographie lui a sauvé la vie et fait maintenant la promotion du dépistage du cancer du sein. Elle insiste depuis un an auprès de sa fille Sarah, de 50 ans, pour qu’elle subisse une mammographie. Votre collègue, qui est son médecin, revient d’une conférence et se demande si Linda n’aurait pas reçu le diagnostic d’un cancer qui n’aurait pas nui à sa vie s’il n’avait pas été diagnostiqué (c.-à-d. s’agit-il d’un surdiagnostic?) Il soulève le cas comme sujet de discussion lors de la séance scientifique mensuelle de votre clinique.
Cas 2.
Gérald est un homme de 65 ans qui vient pour son examen médical périodique, à la demande de son épouse. Il dit se sentir bien et ne pas avoir d’inquiétudes ou de problèmes de santé particuliers. Il travaille présentement et participe à diverses activités de plein air. Durant l’examen, vous lui mentionnez la possibilité de subir une échographie de dépistage des anévrismes de l’aorte abdominale (AAA) comme partie intégrante des investigations habituelles. Gérald accepte votre suggestion. Il revient par la suite pour une discussion de suivi et pour recevoir les résultats de son échographie abdominale, qui a révélé un AAA de 33 mm. Gérald exprime des sentiments de déception, d’anxiété et d’appréhension à propos de son diagnostic. Il dit s’inquiéter de mourir soudainement et de constituer un risque pour autrui. Gérald change subséquemment son mode de vie et diminue ses activités physiques, prend sa retraite et réduit ses projets de voyage. Il subit chaque année une échographie qui révèle une augmentation minimale dans la taille de l’AAA. Gérald meurt à l’âge de 85 ans d’un tout autre problème médical.
Définition
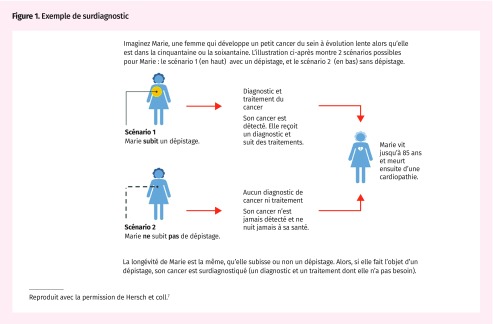
Le surdiagnostic désigne le diagnostic d’un problème qui, s’il n’avait pas été trouvé, n’aurait pas causé de symptômes ni de décès6. Autrement dit, c’est la détection d’un problème sans qu’il y ait de bienfaits possibles à tirer du traitement précoce de la personne concernée (Figure 1)7.
Figure 1.
Exemple de surdiagnostic
Reproduit avec la permission de Hersch et coll.7
Ce qui n’est pas considéré un surdiagnostic
Le diagnostic erroné et les faux positifs sont des concepts apparentés mais distinctement différents. Le diagnostic erroné est l’identification incorrecte d’un problème, souvent attribuable à un manque de spécificité diagnostique, comme l’attribution d’une enflure et d’une rougeur au gros orteil à la cellulite plutôt qu’à la goutte. Des faux positifs se produisent lorsque les résultats initiaux d’un test subi pour investiguer une anomalie, comme une microcalcification observée à la mammographie, se révèlent positifs, mais que les résultats d’une épreuve de suivi (p. ex. une biopsie) ne révèlent aucune pathologie. Les diagnostics erronés et les faux positifs peuvent aussi causer des torts en raison des investigations subséquentes et des traitements inutiles.
Conséquences
Le surdiagnostic peut entraîner de sérieux préjudices, notamment les répercussions psychologiques et comportementales de la stigmatisation; les conséquences des examens (y compris les tests invasifs), des traitements et du suivi subséquents; et les impacts financiers pour la personne qui a reçu un surdiagnostic et pour la société. Les traitements démesurés à la suite d’un surdiagnostic peuvent engendrer des conséquences cliniques importantes, y compris la mort due aux effets secondaires de la thérapie, comme un sepsis chez un patient suivant une chimiothérapie pour traiter un cancer surdiagnostiqué. Des taux plus élevés d’infarctus du myocarde et de suicide ont été signalés chez les hommes durant l’année suivant un diagnostic de cancer de la prostate8,9.
Le surdiagnostic se perpétue de lui-même. Les personnes qui pourraient avoir reçu un surdiagnostic, comme Linda, encouragent les autres à subir des tests sans prendre en compte les préjudices potentiels des test et des investigations ou des traitements qui s’ensuivent.
Conditions préalables
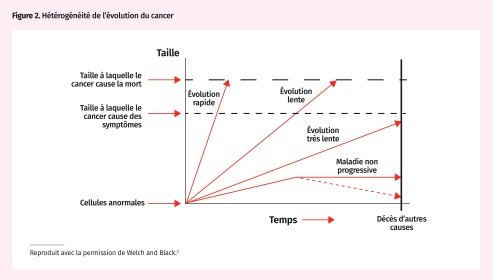
Le surdiagnostic est beaucoup plus probable dans le cas des problèmes dont la progression est hétérogène, y compris ceux dont l’évolution vers l’apparition de symptômes ou la survenance du décès est très lente ou nulle (Figure 2)3. Essentiellement, pour que ce soit un surdiagnostic, il faut qu’un test détecte le problème alors qu’il en est à un stade précoce et asymptomatique. Pour être efficace, le dépistage exige une longue étape asymptomatique et un test pour détecter le problème durant cette période. Étant donné que ce ne sont pas toutes les personnes asymptomatiques qui deviendront éventuellement symptomatiques, le surdiagnostic est inhérent à toute forme de dépistage efficace. La proportion de cas surdiagnostiqués varie selon chaque maladie (Tableau 1)10–18.
Figure 2.
Hétérogénéité de l’évolution du cancer
Reproduit avec la permission de Welch and Black.3
Tableau 1.
Exemples de problèmes médicaux souvent surdiagnostiqués, par trajectoire menant au surdiagnostic
| INTERVENTION CLINIQUE | DIAGNOSTIC | AMPLEUR DES SURDIAGNOSTICS SIGNALÉS | PRÉJUDICES |
|---|---|---|---|
| Incidentalomes | |||
| • Imagerie de la thyroïde | Cancer de la thyroïde | On estime que 75 % des cas de cancer de la thyroïde au Canada ont été surdiagnostiqués10 | Intervention chirurgicale et ses complications |
| • TMD abdominale | Cancer du rein | Il a été signalé que l’incidence du cancer du rein aux États-Unis est liée au taux de TDM abdominales11 | Traitement de tumeurs non dangereuses11 |
| Définition élargie de la pathologie | |||
| • Abaissement de la cible de traitement et du seuil pour amorcer le traitement | Hypertension | SPRINT a signalé de meilleurs résultats cardiovasculaires au moyen d’un contrôle plus intensif pour abaisser la pression artérielle systolique en deçà de 120 mm Hg12, mais avec plus d’effets secondaires. La stratégie intensive n’a pas produit de bienfaits cliniques nets13 | Le traitement cause de l’hypotension et d’autres effets secondaires. Il faut user de prudence dans l’imposition de « contrôles serrés » aux patients souffrant d’hypertension et peutêtre limiter ces mesures aux personnes dont les risques cardiovasculaires sont plus élevés |
| • Tests de dépistage cognitif | Démence | On croit que la prévalence actuelle de la démence est de 10 à 30 % chez les personnes de 80 ans et plus, mais l’adoption de nouveaux critères diagnostiques fera grimper cette proportion à 65 % de personnes ce groupe d’âge qui recevront un diagnostic de maladie d’Alzheimer, et jusqu’à 23 % des personnes plus âgées sans démence qui recevront un diagnostic de démence14 | Investigations inutiles et traitements causant des effets secondaires; issues défavorables sur les plans psychologique et social; déviation des ressources et du soutien au détriment de ceux qui ont une démence manifeste et ont des besoins plus considérables14 |
| Surdiagnostics détectés par dépistage | |||
| • Tests de Papanicolaou chez les femmes < 25 ans | Cellules précancéreuses du col qui disparaissent dans la plupart des cas | 10 % ou plus des femmes < 25 ans ont des résultats de test anormaux15 | Anxiété accrue, demande de consultation, colposcopie, biopsie |
| • Test de l’APS | Cancer de la prostate | 33,2 % des cancers de la prostate ont été surdiagnostiqués dans l’étude ERSPC16, et 50,4 % des cancers détectés par dépistage durant l’étape du dépistage étaient des surdiagnostics17 | Stigmatisation due à la maladie et traitement excessif, y compris une intervention chirurgicale inutile |
| • Échographie abdominale | AAA | On a rapporté que 49 hommes dépistés sur 10 000 ont été surdiagnostiqués, tandis que 2 sur 10 000 éviteraient de mourir d’un AAA18 | Stigmatisation; surveillance; 19 sur 10 000 subiront une intervention chirurgicale inutile18 |
AAA—anévrisme de l’aorte abdominale, APS—antigène prostatique spécifique, ERSPC—European Randomized Study of Screening for Prostate Cancer, SPRINT—Étude Systolic Blood Pressure Intervention Trial. TDM—tomodensitométrie.
Facteurs menant à la hausse des surdiagnostics
Les taux plus élevés d’examens (fréquence ou utilisation accrues de tests dans des groupes à faible risque), l’exécution de tests d’une sensibilité accrue, le désir du médecin ou du patient de ne pas échapper un diagnostic, la définition élargie des pathologies (p. ex. seuils diagnostiques plus bas du diabète) et les incitatifs financiers (p. ex. paiement versé pour les demandes plus nombreuses de tests ou de dépistages) peuvent tous mener à l’augmentation des surdiagnostics19.
Le surdiagnostic peut survenir lorsque les critères de définition d’une pathologie sont modifiés pour inclure un plus grand nombre de personnes. Ces changements sont souvent apportés sans avoir confirmé les bienfaits pour une proportion substantielle de ceux à qui on attribue une maladie selon ces nouvelles définitions20.
L’utilisation plus fréquente ou excessive des tests peut se traduire par la détection d’incidentalomes sans rapport, soit une autre version du surdiagnostic. Par exemple, le recours accru aux études par imagerie (p. ex. tomodensitométrie [TDM], y compris la colonographie par TDM) entraîne la détection de problèmes asymptomatiques sans rapport, comme un carcinome rénal ou un petit anévrisme aortique11. Ainsi, il a récemment été démontré que les néphrectomies étaient liées au nombre de TDM effectuées plutôt qu’à une hausse réelle de l’incidence du cancer du rein. Le traitement excessif par intervention chirurgicale est désormais reconnu comme étant l’un des risques de l’utilisation excessive de l’imagerie par TDM.
Le surdiagnostic peut aussi se produire en présence d’une maladie concomitante entraînant la mort, mais la pathologie surdiagnostiquée n’aurait pas eu le temps d’évoluer vers un état symptomatique, comme c’est probablement le cas dans les 2 scénarios décrits précédemment.
Le surdiagnostic ne se limite pas au dépistage et à la détection du cancer
Le surdiagnostic a initialement été décrit dans le contexte du diagnostic de cancers, mais il peut se produire pour de nombreux autres problèmes21, surtout ceux qui ont un stade indolent prolongé. Quoi qu’il en soit, un plus grand nombre d’études portant sur le surdiagnostic se sont intéressées davantage au diagnostic du cancer plutôt qu’à la détection d’autres maladies.
Détermination des diagnostics ayant des conséquences cliniques et atténuation du surdiagnostic
Malheureusement, la science n’a pas encore assez évolué pour que nous soyons capables de déterminer si un problème chez une personne en particulier aura des conséquences cliniques. Par ailleurs, des efforts ont été déployés pour identifier les versions à progression très lente ou nulle de divers problèmes, car il est plus probable que ces pathologies fassent l’objet d’un surdiagnostic, et leur prise en charge pourrait prendre la forme d’un suivi sans traitement5. Au nombre des exemples figurent la reconnaissance récente et la surveillance accrue des cancers de la prostate à faible risque, de même que les études en cours pour déterminer quand les carcinomes canalaires in situ (CCIS) peuvent faire l’objet d’une surveillance sans traitement22. Il a été proposé de soustraire le mot cancer dans la définition des néoplasmes de bas grade et précancéreux, et de les catégoriser plutôt sous l’expression lésions indolentes d’origine épithéliale23.
Le surdiagnostic est réel et commun
On s’attendrait à ce que les volets d’intervention des études randomisées contrôlées (ERC) sur le dépistage démontrent initialement des taux de détection et d’incidence plus élevés. Si ces hausses étaient dues à la détection précoce des maladies, cela devrait se traduire plus tard par une baisse équivalente de l’incidence. Il devrait aussi y avoir une diminution concomitante de l’incidence de ces pathologies à un stade avancé. De plus, si l’intervention de dépistage détecte des problèmes précancéreux et prévient le développement de cancers ou de maladies, il devrait donc se produire une réduction globale de l’incidence cumulative de ces maladies24. Par conséquent, s’il n’y avait pas de surdiagnostics, après une période de suivi assez longue, l’incidence globale des cas devrait être la même dans les 2 groupes ou moins grande dans le groupe ayant fait l’objet d’un dépistage. L’Étude nationale sur le dépistage du cancer du sein au Canada démontre que l’incidence cumulative accrue dans les volets de dépistage et d’intervention persiste habituellement sans que soit observée une diminution de l’incidence plus tard, même lorsque les résultats d’un suivi à long terme sont accessibles; il s’agit là d’un exemple de surdiagnostics dans le groupe ayant fait l’objet du dépistage25. Le but du dépistage est de détecter l’état préalable à la maladie ou son stade précoce et d’en changer l’issue. Malheureusement, il y a toujours un balancier entre les cas où il pourrait être possible de changer l’issue et les cas surdiagnostiqués à qui nous causons des préjudices.
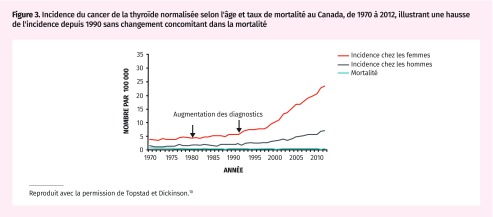
La tendance en pratique clinique la plus souvent observée et indicatrice du surdiagnostic se confirme lorsqu’avec le temps, on observe une incidence accrue, surtout aux stades précoces de la maladie, sans qu’il y ait de progression ou seulement une évolution minimale vers une maladie grave (c’est-à-dire une maladie avancée ou une mortalité de cause spécifique). Citons, par exemple, l’avènement de l’échographie de la thyroïde, en 1980. L’incidence du cancer de la thyroïde est à la hausse au Canada depuis le début des années 1990, et la réduction de la mortalité due au cancer de la thyroïde est minime (Figure 3)10. Ces tendances font valoir l’existence du surdiagnostic en raison de l’utilisation des tests diagnostiques.
Figure 3.
Incidence du cancer de la thyroïde normalisée selon l’âge et taux de mortalité au Canada, de 1970 à 2012, illustrant une hausse de l’incidence depuis 1990 sans changement concomitant dans la mortalité
Reproduit avec la permission de Topstad et Dickinson.10
Estimations de l’étendue
L’étendue du surdiagnostic est estimée à partir des suivis effectués dans les ERC, des études observationnelles (comme les études écologiques et les tendances dans les diagnostics fortuits et le décès concomitant avec le temps), de même que des études de modélisation26. Chaque méthode comporte ses limites. Dans le cas des ERC, les estimations exigent un suivi à long terme (qui n’est pas toujours effectué) et une évaluation dans un milieu expérimental idéal. Les études écologiques sont vulnérables aux facteurs de confusion non identifiés. De nombreuses hypothèses sont posées comme variables d’intrants dans les études de modélisation. De fait, dans la conception de toutes les études, des postulats sont intrinsèquement posés, ce qui entraîne des estimations variables.
De plus, les estimations varient en raison des formules différentes utilisées pour calculer le surdiagnostic. Par exemple, une revue portant sur le dépistage du cancer de la prostate par le test de l’antigène prostatique spécifique17 utilisait 2 dénominateurs différents : tous les cancers de la prostate détectés par le dépistage durant l’étape du dépistage des études, et les cancers de la prostate diagnostiqués dans l’ensemble, en utilisant comme numérateur pour les 2 calculs le nombre excédentaire de cas de cancers diagnostiqués, comme il a été déterminé durant le suivi à long terme. La première approche estimait le pourcentage de cas de cancers détectés par le dépistage qui avaient été surdiagnostiqués à 50,4 % dans l’étude ERSPC (European Randomized Study of Screening for Prostate Cancer). La deuxième approche estimait que le pourcentage de tous les cas de cancers surdiagnostiqués se situait à 33,2 % dans l’étude ERSPC. D’autres études utilisaient les cas détectés fortuitement dans le groupe n’ayant pas fait l’objet d’un dépistage comme dénominateur; une telle approche se traduisait par des estimations plus élevées du surdiagnostic par rapport à l’utilisation comme dénominateur du nombre plus élevé de cas de cancers diagnostiqués dans le groupe dépisté. Les estimations les plus faibles sont obtenues lorsque toute la population dépistée est utilisée dans le dénominateur27,28.
Les débats se poursuivent concernant la meilleure méthode pour mesurer le surdiagnostic27,28. À l’heure actuelle, il est recommandé de citer la plage d’amplitude du surdiagnostic, le dénominateur choisi et la méthode d’estimation utilisée.
Suggestions pour les médecins de famille
Dans la prise de décisions conjointe, les médecins de famille devraient discuter de la possibilité d’un surdiagnostic. Le surdiagnostic peut être néfaste pour les patients; par conséquent, il faut en discuter avec eux avant qu’ils s’aventurent dans une cascade de dépistages. Une étude réalisée en Australie signalait que plus de 90 % des femmes qui avaient eu une mammographie et 82 % des hommes qui avaient subi le test de l’antigène prostatique spécifique n’avaient pas été informés de la possibilité d’un surdiagnostic. Lorsque ce concept a été expliqué aux patients, un pourcentage élevé d’entre eux ont indiqué que cette information était cruciale dans la prise de décisions29. Lorsque des femmes de 48 à 50 ans ont été informées de l’ampleur possible des surdiagnostics, elles étaient bien moins enclines à subir un dépistage par mammographie7. Il est difficile d’expliquer le concept du surdiagnostic parce qu’il est intrinsèquement paradoxal. Une explication préalable et l’imagerie de la tortue pour expliquer que certains cancers progressent très lentement peuvent aider à faire comprendre cette notion. La vidéo par le Dr Mike Evans, intitulée « The Prostate Specific Antigen (PSA) Test » 30, illustre ce genre d’approche.
Une récente revue, qui mérite d’être lue, décrit les efforts en santé publique pour contrer les facteurs qui alimentent le surdiagnostic31.
Retour à nos cas
Cas 1.
Il est très difficile d’expliquer le concept du surdiagnostic à des personnes qui croient en avoir bénéficié et avoir survécu grâce au dépistage, même s’il est fort probable qu’elles aient été surdiagnostiquées. Vous souhaiterez sans doute ne pas aborder la question avec Linda. Par contre, Sarah n’a pas encore subi de dépistage et, avant tout, elle devrait être informée des bienfaits et des préjudices de l’intervention. Notre rôle est de l’aider à en arriver à une décision congruente avec ses valeurs et ses préférences, après l’avoir renseignée sur les données probantes connues étayant les bienfaits et les torts possibles. Il serait déplorable pour elle de prendre une décision sans l’information pertinente et sans avoir eu la possibilité de réfléchir à ses valeurs et à ses préférences à propos de ce type de dépistage.
Cas 2.
Il est évident que Gérald a reçu un surdiagnostic d’AAA et en a subi les préjudices. Même si, traditionnellement, la mesure de 30 mm a servi de seuil pour un diagnostic d’AAA, il a été proposé d’abaisser ce critère, ce qui ferait pencher la balance du dépistage des AAA du côté des torts nets32. Il est important de discuter des bienfaits et des préjudices potentiels, y compris ceux du surdiagnostic, avant de mettre en application des recommandations peu convaincantes comme celles concernant le dépistage des AAA.
Conclusion
Le surdiagnostic est inhérent à la plupart des activités touchant le dépistage et le diagnostic. Son ampleur varie selon le problème de santé. Il y a lieu d’envisager la possibilité d’un surdiagnostic dans la prise de décisions cliniques avant de prescrire un examen de dépistage ou de diagnostic, et il importe de communiquer la possibilité d’un surdiagnostic dans la prise de décisions conjointe avant que les personnes s’engagent dans une cascade de dépistages.
Points de repère
▸ Le surdiagnostic désigne la détection d’un problème qui n’aurait autrement pas causé de symptômes ou de décès. Il s’agit d’une conséquence inévitable des tests de diagnostic et de dépistage, qui peut s’expliquer par la plus grande sensibilité des tests de diagnostic ou des définitions excessivement élargies des maladies.
▸ Le surdiagnostic cause des torts en raison des tests de diagnostic, des traitements et des suivis inutiles en échange desquels le patient ne reçoit aucun bienfait.
▸ Les estimations des surdiagnostics peuvent varier en raison des différences dans les méthodes et les sources utilisées pour en calculer les taux.
▸ Il est recommandé que les patients et les médecins prennent conjointement des décisions bien étayées par des aides à la décision bien conçues pour atténuer les torts associés au surdiagnostic.
Footnotes
Suggestion de lectures additionnelles
1. Welch HG, Schwartz LM, Woloshin S. Overdiagnosed. Making people sick in the pursuit of health. Boston, MA: Beacon Press; 2011.
2. Pathirana T, Clark J, Moynihan R. Mapping the drivers of overdiagnosis to potential solutions. BMJ 2017;358:j3879. Publ. en ligne du 6 août 2017.
3. Brodersen J, Schwartz LM, Heneghan C, O’Sullivan JW, Aronson JK, Woloshin S. Overdiagnosis: what it is and what it isn’t. BMJ Evid Based Med 2018;23(1):1-3.
4. Too much medicine [collection]. Londres, Angl: BMJ Publishing Group; 2018. Accessible à : www.bmj.com/specialties/too-much-medicine. Réf. du 24 juill. 2018
Intérêts concurrents
Tous les auteurs ont rempli les formulaires normalisés concernant les conflits d’intérêts de l’International Committee of Medical Journal Editors (accessibles sur demande auprès de l’auteur correspondant). Le Dr Singh déclare avoir reçu des subventions de Merck Canada et des honoraires personnels de Pendopharm et de Ferring Canada, sans rapport avec les travaux soumis. Les autres auteurs déclarent n’avoir aucun intérêt concurrent.
Cet article donne droit à des crédits d’autoapprentissage certifié Mainpro+. Pour obtenir des crédits, rendez-vous sur www.cfp.ca et cliquez sur le lien Mainpro+.
The English version of this article is available at www.cfp.ca on the table of contents for the September 2018 issue on page 654.
Références
- 1.Feinleib M, Zelen M. Some pitfalls in the evaluation of screening programs. Arch Environ Health. 1969;19(3):412–5. doi: 10.1080/00039896.1969.10666863. [DOI] [PubMed] [Google Scholar]
- 2.Fox MS. On the diagnosis and treatment of breast cancer. JAMA. 1979;241(5):489–94. [PubMed] [Google Scholar]
- 3.Welch HG, Black WC. Overdiagnosis in cancer. J Natl Cancer Inst. 2010;102(9):605–13. doi: 10.1093/jnci/djq099. Publ. en ligne du 22 avr. 2010. [DOI] [PubMed] [Google Scholar]
- 4.Ghanouni A, Meisel SF, Renzi C, Wardle J, Waller J. Survey of public definitions of the term ‘overdiagnosis’ in the UK. BMJ Open. 2016;6(4):e010723. doi: 10.1136/bmjopen-2015-010723. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Ebell M, Herzstein J. Improving quality by doing less: overdiagnosis. Am Fam Physician. 2015;91(3):162–3. [PubMed] [Google Scholar]
- 6.Welch HG, Schwartz LM, Woloshin S. Overdiagnosed. Making people sick in the pursuit of health. Boston, MA: Beacon Press; 2011. [Google Scholar]
- 7.Hersch J, Barratt A, Jansen J, Irwig L, McGeechan K, Jacklyn G, et al. Use of a decision aid including information on overdetection to support informed choice about breast cancer screening: a randomised controlled trial. Lancet. 2015;385(9978):1642–52. doi: 10.1016/S0140-6736(15)60123-4. Publ. en ligne du 18 févr. 2015. Erratum dans : Lancet 2015;385(9978):1622. Publ. en ligne du 26 mars 2015. [DOI] [PubMed] [Google Scholar]
- 8.Fall K, Fang F, Mucci LA, Ye W, Andrén O, Johansson JE, et al. Immediate risk for cardiovascular events and suicide following a prostate cancer diagnosis: prospective cohort study. PLoS Med. 2009;6(12):e1000197. doi: 10.1371/journal.pmed.1000197. Publ. en ligne du 15 déc. 2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Fang F, Keating NL, Mucci LA, Adami HO, Stampfer MJ, Valdimarsdóttir U, et al. Immediate risk of suicide and cardiovascular death after a prostate cancer diagnosis: cohort study in the United States. J Natl Cancer Inst. 2010;102(5):307–14. doi: 10.1093/jnci/djp537. Publ. en ligne du 2 févr. 2010. [DOI] [PubMed] [Google Scholar]
- 10.Topstad D, Dickinson JA. Thyroid cancer incidence in Canada: a national cancer registry analysis. CMAJ Open. 2017;5(3):E612–6. doi: 10.9778/cmajo.20160162. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Welch HG, Skinner JS, Schroeck FR, Zhou W, Black WC. Regional variation of computed tomographic imaging in the United States and the risk of nephrectomy. JAMA Intern Med. 2018;178(2):221–7. doi: 10.1001/jamainternmed.2017.7508. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.SPRINT Research Group. A randomized trial of intensive versus standard blood-pressure control. N Engl J Med. 2015;373(22):2103–16. doi: 10.1056/NEJMoa1511939. Publ. en ligne du 9 nov. 2015. Erratum dans : N Engl J Med 2017;377(25):2506. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Chi G, Jamil A, Jamil U, Balouch MA, Marszalek J, Kahe F, et al. Effect of intensive versus standard blood pressure control on major adverse cardiac events and serious adverse events: a bivariate analysis of randomized controlled trials. Clin Exp Hypertens. 2018 Apr 10; doi: 10.1080/10641963.2018.1462373. Publ. en ligne avant impression. [DOI] [PubMed] [Google Scholar]
- 14.Le Couteur DG, Doust J, Creasey H, Brayne C. Political drive to screen for pre-dementia: not evidence based and ignores the harms of diagnosis. BMJ. 2013;347:f5125. doi: 10.1136/bmj.f5125. [DOI] [PubMed] [Google Scholar]
- 15.Dickinson JA, Ogilvie G, Van Niekerk D, Popadiuk C. Evidence that supports policies to delay cervical screening until after age 25 years. CMAJ. 2017;189(10):E380–1. doi: 10.1503/cmaj.160636. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Schröder FH, Hugosson J, Roobol MJ, Tammela TL, Zappa M, Nelen V, et al. Screening and prostate cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow-up. Lancet. 2014;384(9959):2027–35. doi: 10.1016/S0140-6736(14)60525-0. Publ. en ligne du 6 août 2014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Fenton JJ, Weyrich MS, Durbin S, Liu Y, Bang H, Melnikow J. Prostate-specific antigen-based screening for prostate cancer: evidence report and systematic review for the US Preventive Services Task Force. JAMA. 2018;319(18):1914–31. doi: 10.1001/jama.2018.3712. [DOI] [PubMed] [Google Scholar]
- 18.Johansson M, Zahl PH, Siersma V, Jørgensen KJ, Marklund B, Brodersen J. Benefits and harms of screening men for abdominal aortic aneurysm in Sweden: a registry-based cohort study. Lancet. 2018;391(10138):2441–7. doi: 10.1016/S0140-6736(18)31031-6. [DOI] [PubMed] [Google Scholar]
- 19.Moynihan R, Doust J, Henry D. Preventing overdiagnosis: how to stop harming the healthy. BMJ. 2012;344:e3502. doi: 10.1136/bmj.e3502. [DOI] [PubMed] [Google Scholar]
- 20.Ioannidis JPA. Diagnosis and treatment of hypertension in the 2017 ACC/AHA guidelines and in the real world. JAMA. 2018;319(2):115–6. doi: 10.1001/jama.2017.19672. [DOI] [PubMed] [Google Scholar]
- 21.Jenniskens K, de Groot JAH, Reitsma JB, Moons KGM, Hooft L, Naaktgeboren CA. Overdiagnosis across medical disciplines: a scoping review. BMJ Open. 2017;7(12):e018448. doi: 10.1136/bmjopen-2017-018448. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Kanbayashi C, Iwata H. Current approach and future perspective for ductal carcinoma in situ of the breast. Jpn J Clin Oncol. 2017;47(8):671–7. doi: 10.1093/jjco/hyx059. Publ. en ligne du 9 mai 2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Esserman LJ, Thompson IM, Reid B, Nelson P, Ransohoff DF, Welch HG, et al. Addressing overdiagnosis and overtreatment in cancer: a prescription for change. Lancet Oncol. 2014;15(6):e234–42. doi: 10.1016/S1470-2045(13)70598-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Atkin W, Wooldrage K, Parkin DM, Kralj-Hans I, MacRae E, Shah U, et al. Long term effects of once-only flexible sigmoidoscopy screening after 17 years of follow-up: the UK Flexible Sigmoidoscopy Screening randomised controlled trial. Lancet. 2017;389(10076):1299–311. doi: 10.1016/S0140-6736(17)30396-3. Publ. en ligne du 22 févr. 2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Baines CJ, To T, Miller AB. Revised estimates of overdiagnosis from the Canadian National Breast Screening Study. Prev Med. 2016;90:66–71. doi: 10.1016/j.ypmed.2016.06.033. Publ. en ligne du 29 juin 2016. [DOI] [PubMed] [Google Scholar]
- 26.Carter JL, Coletti RJ, Harris RP. Quantifying and monitoring overdiagnosis in cancer screening: a systematic review of methods. BMJ. 2015;350:g7773. doi: 10.1136/bmj.g7773. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Davies L, Petitti DB, Martin L, Woo M, Lin JS. Defining, estimating, and communicating overdiagnosis in cancer screening. Ann Intern Med. 2018;169(1):36–43. doi: 10.7326/M18-0694. Publ. en ligne du 26 juin 2018. [DOI] [PubMed] [Google Scholar]
- 28.Carter SM, Rogers W, Heath I, Degeling C, Doust J, Barratt A. The challenge of overdiagnosis begins with its definition. BMJ. 2015;350:h869. doi: 10.1136/bmj.h869. [DOI] [PubMed] [Google Scholar]
- 29.Moynihan R, Nickel B, Hersch J, Beller E, Doust J, Compton S, et al. Public opinions about overdiagnosis: a national community survey. PLoS One. 2015;10(5):e0125165. doi: 10.1371/journal.pone.0125165. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Evans M. The prostate specific antigen (PSA) test. YouTube; 2014. Accessible à : https://www.youtube.com/watch?v=bTgS0DuhaUU. Réf. du 26 juin 2018. [Google Scholar]
- 31.Pathirana T, Clark J, Moynihan R. Mapping the drivers of overdiagnosis to potential solutions. BMJ. 2017;358:j3879. doi: 10.1136/bmj.j3879. Publ. en ligne du 6 août 2017. [DOI] [PubMed] [Google Scholar]
- 32.Johansson M, Hansson A, Brodersen J. Estimating overdiagnosis in screening for abdominal aortic aneurysm: could a change in smoking habits and lower aortic diameter tip the balance of screening towards harm? BMJ. 2015;350:h825. doi: 10.1136/bmj.h825. Publ. en ligne du 4 mars 2015. [DOI] [PubMed] [Google Scholar]