RESUMEN
La incidencia de la neumonía adquirida en la comunidad (NAC) oscila entre 2-15 casos/1.000 habitantes/año, siendo más elevada en los mayores de 65 años o en pacientes con comorbilidades. En los servicios de urgencias hospitalarios (SUH) supone hasta el 1,35% de las atenciones. Aproximadamente el 75% de todas las NAC diagnosticadas son atendidas en los SUH. La NAC representa el origen de la mayoría de sepsis y shock sépticos diagnosticados en los SUH, la principal causa de muerte y de ingreso en la unidad de cuidados intensivos (UCI) por enfermedad infecciosa. Se le atribuye una mortalidad global del 10-14% según la edad y factores de riesgo asociados. El 40-60% de las NAC requerirán ingreso hospitalario, incluyendo las áreas de observación (con rangos muy variables del 22-65% según centros, época del año y características de los pacientes), y de ellos entre el 2-10% será en la UCI. De todo lo dicho se traduce la importancia que tiene la NAC en los SUH, y también del “impacto de la atención en urgencias sobre el enfermo con NAC”, al ser el dispositivo donde se toman las decisiones iniciales, pero fundamentales, para la evolución del proceso.
Es conocida la gran variabilidad entre los clínicos en el manejo de los aspectos diagnóstico-terapéuticos en la NAC, lo que constituye una de las razones que explican las grandes diferencias en las tasas de ingreso, de consecución del diagnóstico microbiológico, solicitud de estudios complementarios, la elección de la pauta antimicrobiana o la diversidad de cuidados aplicados. En este sentido, la implementación de las guías de práctica clínica con el uso de las escalas pronósticas de gravedad y las nuevas herramientas disponibles en los SUH como lo son los biomarcadores pueden mejorar la atención del paciente con NAC en los SUH. Por ello, a partir de un grupo multidisciplinar de profesionales de urgencias y especialistas que participan en el proceso asistencial de la NAC, se ha diseñado esta guía clínica con diversas recomendaciones para las decisiones y momentos clave en proceso de atención del paciente con NAC en Urgencias.
Keywords: guías, neumonía adquirida comunidad, servicio de urgencias, diagnóstico, tratamiento
ABSTRACT
The incidence of community-acquired pneumonia (CAP) ranges from 2-15 cases / 1,000 inhabitants / year, being higher in those older than 65 years and in patients with high comorbidity. Around 75% of all CAP diagnosed are treated in the Emergency Department (ED). The CAP represents the main cause for sepsis and septic shock in ED, and the most frequent cause of death and admission to the Intensive Care Unit (ICU) due to infectious disease. Overall mortality is 10-14% according to age and associated risk factors. Forty to 60% of CAP will require hospital admission, including observation units (with very variable ranges from 22-65% according to centers, seasonal of the year and patients´ characteristics). Between the admissions, 2-10% will be in the ICU. All of previously mentioned reflects the importance of the CAP in the ED, as well as the “impact of the emergency care on the patient with CAP”, as it is the establishment where the initial, but key decisions, are made and could condition the outcome of the illness.
It is known the great variability among physicians in the diagnostic and therapeutic management of CAP, which is one of the reasons that explains the great differences in the admission rates, achievement of the microbiological diagnosis, request for complementary studies, the choice of antimicrobial treatment, or the diversity of applied care. In this sense, the implementation of clinical practice guidelines with the use of the severity scores and the new tools available, such as biomarkers, can improve patient care with CAP in ED. Therefore, a multidisciplinary group of emergency professionals and specialists involved in the care process of CAP has designed a guideline with several recommendations for decisions-making during the key moments in patients with CAP attended in the ED.
Keywords: guidelines, community-acquired pneumonia, emergency department, diagnosis, treatment
INTRODUCCIÓN Y CONCEPTOS
La incidencia de la neumonía adquirida en la comunidad (NAC) oscila entre 2-15 casos/1.000habitantes/año, según el área geográfica y la estación del año [1,2], siendo mayor en pacientes fumadores, en los menores de 5 años y en los mayores de 65 años (hasta 25-35 casos/1.000 hab/año), con comorbilidades, inmunodeprimidos o con hábito enólico [3]. En los servicios de urgencias hospitalarios (SUH) su diagnóstico ha aumentado del 0,85% de los pacientes vistos en 2001 al 1,35% en 2011 [3]. De ellos, el 51% de los corresponden a pacientes con ≥ 70 años [3], subgrupo con un diagnóstico más difícil [4] , mayor gravedad clínica y mortalidad a medio-largo plazo [1,3]. Por ello, según las características de la población atendida en cada SUH y la época del año, pueden existir variaciones significativas en su incidencia.
La NAC representa el origen de la mayoría de sepsis y shock sépticos diagnosticados en los SUH [3] y supone la principal causa de muerte por enfermedad infecciosa en los países occidentales y la primera causa infecciosa (9%) de ingreso en la unidad de cuidados intensivos (UCI) [3,5]. Se le atribuye una mortalidad global del 10-14% según la edad y factores de riesgo asociados; menor del 1-2% en jóvenes sin comorbilidad, 14% en hospitalizados y alrededor del 25-50% en los ingresados en la unidad de cuidados intensivos (UCI) [1,2].
Aproximadamente el 75-80% de todas las NAC son atendidas en los SUH [6]. De éstas, el 40-60% requerirán ingreso hospitalario, incluyendo las áreas de observación (con rangos muy variables del 22-65% según centros, época del año y características de los pacientes), y de ellos entre el 2-10% será en la UCI [3,5].
De todo lo dicho se traduce la importancia que tiene la NAC en los SUH, y también del “impacto de la atención en urgencias sobre el enfermo con NAC”, al ser el dispositivo donde se toman las decisiones iniciales, pero fundamentales, para la evolución del proceso y la seguridad del paciente [6,7]. Es conocida la gran variabilidad entre los clínicos en el manejo de los aspectos diagnóstico-terapéuticos en la NAC [6,8], lo que constituye una de las razones que explican las diferencias en las tasas de ingreso (22-61%) desde los SUH, la consecución del diagnóstico microbiológico, la solicitud de estudios complementarios, la elección de la pauta antimicrobiana o la diversidad de cuidados aplicados [6,8,9]. Por ello, es el modelo de infección más relevante en los SUH, por lo que determinar correctamente la necesidad de ingreso (el cuándo), la ubicación (el dónde) y la intensidad de cuidados (el cómo) va a condicionar el pronóstico, la mortalidad, la solicitud de pruebas y estudios microbiológicos, la pauta antibiótica, la intensidad de observación clínica y la utilización de recursos sociosanitarios (así como sus costes asociados) [6]. En este sentido, la implementación de las guías de práctica clínica (GPC) [8,9] con el uso de las escalas pronósticas de gravedad (EPG) [6] y las nuevas herramientas disponibles en los SUH como lo son los biomarcadores de respuesta inflamatoria e infección (BMRII) [10,11] mejoran la adecuación del tratamiento y disminuyen los errores de prescripción [12], de los ingresos, la evolución, la estancia hospitalaria y la mortalidad [13].
De forma genérica, cuando hablamos de neumonía lo hacemos de un proceso inflamatorio agudo del parénquima pulmonar, provocado por agentes infecciosos, aunque también puede ser originado por agentes físicos o químicos, bien inhalados o por aspiración del contenido gástrico, cuando el nivel de consciencia es bajo o existe algún trastorno de la deglución [14].
Por su parte, definimos NAC como una lesión inflamatoria del parénquima pulmonar que aparece como respuesta a la llegada de microorganismos a la vía aérea distal, que se produce en aquellas personas inmunocompetentes y que no han estado ingresadas en ninguna institución. En la práctica clínica se asume cuando existe “una presentación clínica infecciosa aguda compatible y su demostración radiológica” [15,16].
ETIOLOGÍA
En general, el diagnóstico microbiológico es difícil de establecer, incluso cuando se emplean métodos complejos e invasivos (solo se consigue identificar la causa en el 30-60% de los casos) [1,9,14,15,17-19]. Cuanto más grave es el proceso, más técnicas se emplean y más diagnóstico etiológico se logra. Los aislamientos varían según la gravedad de la NAC, la indicación de tratamiento ambulatorio o de ingreso hospitalario o en UCI, y los factores del huésped tanto clínicos como epidemiológicos [17-19].
De forma global, el agente más frecuente es Streptococcus pneumoniae (30-65%), incluso se estima que hasta en el 30-40% de casos no diagnosticados por métodos convencionales la etiología es neumocócica. Por ello y por su morbimortalidad se considera a S. pneumoniae como el “patógeno clave” [1,9,18]. Otros microorganismos habituales son: Mycoplasma pneumoniae, Chlamydophila pneumoniae, Legionella pneumophila, Haemophilus influenzae, virus influenza A, Coxiella burnetii, Chlamydophila psittaci, Staphylococcus aureus y bacilos gramnegativos [1,9,14,15,17-19].
Es conocido que la estratificación pronóstica de la NAC (que condiciona el destino) se correlaciona con la etiología [18] (tabla 1). Ésta suele ser monomicrobiana excepto en las neumonías aspirativas (múltiples microorganismos de la orofaringe) [20,21]. Hay que tener en cuenta que en el 12-18% de NAC los virus aparecen implicados, y que en el 8-14% se encuentran asociaciones de patógenos (“etiología bacteriana mixta”: la mayoría S. pneumoniae más M. pneumoniae o C. pneumoniae) [18,22]. Esto último, junto con la frecuencia de M. pneumoniae (similar o mayor que el propio S. pneumoniae) en los pacientes con tratamiento domiciliario, hará necesario que cualquier tratamiento empírico oral tenga una cobertura y actividad adecuada para ambos (S. pneumoniae y M. pneumoniae) [1,14,18].
Tabla 1.
Etiología de la NAC
| Microorganismo | Total | Tratamiento en el domicilio | Hospitalizados | Ingresados en UCI |
|---|---|---|---|---|
| No identificados | 40-60% | ≥ 60% | 44% | 40% |
| S. pneumoniae | 20-26% | 20% | 26% | 22% |
| Atípicosa | 5-25% | 25% | 18% | 5% |
| Legionella spp | 2-8% | 2% | 4% | 8% |
| H. influenzae | 3-5% | 3% | 4% | 5% |
| S. aureus | 0,2-6% | 0,2% | 1% | 6% |
| Enterobacterias | 0,4-7% | 0,4% | 3% | 7% |
| Virus | 5-18% | 12-18% | 11% | 5% |
| Mixtasb | 8-14% | - | - | - |
NAC: neumonía adquirida en la comunidad; UCI: unidad de cuidados intensivos
Considerando a M. pneumoniae (el más frecuente), C. pneumoniae, C. psittaci y C. burnetii, ya que separamos a Legionella spp., por sus características clínico-epidemiológicas particulares.
Asociaciones más habituales: S. pneumoniae más C. pneumoniae o M. pneumoniae
Por otro lado, debemos recordar que existen una serie de condicionantes epidemiológicos que predisponen a los pacientes a padecer NAC por determinados patógenos [14,15,24-25] (tabla 2).
Tabla 2.
Condiciones clínico-epidemiológicas relacionadas con patógenos específicos
| Pacientes ancianos | S. pneumoniae, H. influenzae, bacilos gramnegativos, L. pneumophila, anaerobios, virus influenza A y B, M. catarrhalis |
| Pacientes ancianos e institucionalizados | S. pneumoniae, H. influenzae, S. aureus, bacilos gramnegativos, P. aeruginosa, C. pneumoniae, anaerobios |
| EPOC, tabaquismo | S. pneumoniae, H. influenzae, C. pneumoniae, L.pneumophila |
| Bronquiectasias, fibrosis quística | P. aeruginosa, S. aureus |
| Etilísmo | S. pneumoniae, K. pneumoniae, anaerobios, S. aureus |
| Internos en prisiones | S. pneumoniae, M. tuberculosis |
| Contacto con pájaros, aves y animales de granja | Chlamydophila psittaci |
| Contacto con caballos o ganado | Coxiella burnetii |
| Contacto con conejos | Francisella tularensis |
| Epidemia de gripe | Virus influenza, S. pneumoniae, H. influenzae, S. aureus |
| Boca séptica, aspiración | Polimicrobiana, anaerobios |
| Infección VIH avanzada | S. pneumoniae, H. influenzae, P. jiroveci, M. tuberculosis |
| Usuarios de drogas vía parenteral | S. aureus, anaerobios |
| Tratamiento esteroideo | S. aureus, Aspergillus spp, L. pneumophila |
| Comorbilidad (diabetes, hepatopatía, Insuficiencia renal) | S. pneumoniae, H. influenzae, bacilos gramnegativos |
| Uso reciente de antibióticos | S. pneumoniae resistente, P. aeruginosa |
| Mediterráneo: Levante y Cataluña | L. pneumophila |
| Exposición aire acondicionado, torres de refrigeración, SPAs | L. pneumophila |
| Zona norte: País Vasco, Cantabria, norte de Castilla-León y Aragón | Coxiella burnetii |
| Viajes al sudeste asiático | B. pseudomallei, coronavirus (SARS), virus gripe aviar |
| Viajes al sudeste de EE.UU | Coccidioides immitis |
CRITERIOS DE DERIVACIÓN Y EVALUACIÓN HOSPITALARIA DE LA NAC
En una primera valoración del paciente se realizará una primera estratificación inicial en función de la gravedad, evaluando el nivel de consciencia, la situación respiratoria y la situación hemodinámica del paciente. Para ello, es preciso comprobar los signos vitales y la saturación de oxígeno [14,15,26].
La tabla 3 recoge algunos de los criterios de derivación al hospital y de probable ingreso. En el caso de atención primaria, como no se dispone habitualmente de analítica, es importante valorar la gravedad del episodio y decidir el destino más adecuado de tratamiento [16,27-31].
Tabla 3.
Criterios a considerar para derivación al hospital y valoración en el Servicio de Urgencias del paciente con neumonía adquirida en la comunidad
| Saturación de oxígeno por pulsioximetría < 93% |
Signos clínicos independientes de NAC grave o de alarma:
|
| Valoración individual de alto riesgo de morbimortalidad: |
| Descompensación de enfermedades de base |
| Pacientes inmunodeprimidos |
| Paciente embarazada |
| Pacientes con factores de riesgo para patógenos resistentes. |
| Sospecha de NAC por aspiración |
| Antecedentes de ingreso reciente (posible origen nosocomial) |
| Intolerancia oral (incapacidad para la ingesta) |
| Situaciones o problemas para cumplimentar el tratamiento domiciliario (ejemplo: falta de apoyo familiar) |
| Complicaciones radiológicas (afectación bilobar, bilateral, derrame pleural, cavitación, etc.) |
| Respuesta clínica ausente o insuficiente (tras 48-72 horas de tratamiento correcto). |
NAC: neumonía adquirida en la comunidad; PAS: presión arterial sistólica; lmp: latidos por minuto; rpm: respiraciones por minuto; CRB-65: acrónimo de confusión, frecuencia respiratoria ≥ 30 rpm, presión arterial sistólica (PAS) < 90 mmHg o diastólica (PAD) ≤ 60 mmHg y edad ≥ 65 años
Criterios de sepsis clásicos: síndrome de respuesta inflamatoria sistémica (SRIS) más infección. SRIS con 2 de los 4 criterios: Temperatura > 38°C o < 36°C; leucocitosis > 12.000 o <4.000/mm3 o >10% cayados; taquipnea >20 respiraciones por minuto (rpm) o PaCO2< 32mmHg; y taquicardia > 90 latidos por minuto.
qSOFA: quick - Sequential Organ Failure Assessment. Criterios: alteración nivel de consciencia con escala del coma de Glasgow ≤ 13, Presión arterial sistólica ≤ 100 mmHg y frecuencia respiratoria ≥ 22 rpm
EVALUACIÓN Y DECISIONES A TOMAR
Pasos a seguir en el SUH ante la sospecha o confirmación de una NAC [14,15]:
1.- Sospecha tras la anamnesis.
2.- Exploración física: valoración hemodinámica y respiratoria: prensión arterial (PA), frecuencia cardiaca (FC), frecuencia respiratoria (FR), temperatura (Tª) y saturación de oxigeno (Sat O2) por pulsioximetría.
3.- Confirmación diagnóstica y estudios complementarios.
4.- Valoración pronóstica y decisión del destino del paciente: alta o ingreso en observación, unidad de corta estancia (UCE), planta o UCI.
5.- Elección y administración del tratamiento adecuado y precoz en el SUH.
ANAMNESIS, EXPLORACIÓN FÍSICA Y MANIFESTACIONES CLÍNICAS
Se valorará el estado general del paciente y su nivel de consciencia, comprobando si existen criterios de sepsis [30,31] (tabla 3) y reflejando inmediatamente la PA, FC, FR, Tª y Sat O2, así como su estado de hidratación, perfusión periférica y nutrición. A continuación, se realizará una exploración física completa y sistemática incidiendo en la auscultación cardiopulmonar. Debemos buscar signos de gravedad y anotar la existencia de disnea, taquipnea, cianosis, uso de musculatura accesoria, respiración paradójica y edemas [14].
En los casos críticos se priorizará el soporte ventilatorio y hemodinámico necesario, manteniendo permeable la vía aérea e incluso se iniciará la reanimación cardiopulmonar si es preciso, trasladando al enfermo a la sala de reanimación [15].
La anamnesis se realizará siempre que la situación clínica lo permita. Para llegar a un diagnóstico de neumonía se requiere ante todo una anamnesis detallada que permita poner de manifiesto condiciones epidemiológicas o clínicas relacionadas con patógenos específicos (tabla 2) y así clasificar al paciente en función de sus factores pronósticos, de riesgo y enfermedades asociadas de base [1,12,15]. En el interrogatorio se hará especial énfasis en: edad, situación basal, tratamientos antibióticos recientes, enfermedades asociadas, fiebre, tos, expectoración, dolor pleurítico, sospecha de aspiración y comorbilidad que precise tratamiento teniendo en cuenta los fármacos que toma en ese momento el paciente. El diagnóstico sindrómico de NAC se basa en la existencia de una clínica de infección aguda acompañada de un infiltrado pulmonar de reciente aparición en la radiografía de tórax, no atribuible a otra causa. Ante la dispar presentación clínica de la NAC se necesita conocer la epidemiología del área geográfica en la que se trabaja [14,23].
En relación a las manifestaciones clínicas del cuadro, suelen considerarse clásicamente tres síndromes en función de la forma de presentación clínico-radiológica (tabla 4). Esta diferenciación entre neumonías típicas y atípicas no siempre es aceptada por todos los autores ni es clínicamente evidente, sobre todo en ancianos y enfermos con comorbilidades, por lo que cada vez es menos determinante en el manejo global del proceso y su “utilidad se reduce a adultos jóvenes sin enfermedades asociadas” [1,14,26].
Tabla 4.
Síndromes en función de la forma de presentación clínico-radiológica
| Síndrome típico |
|
| Síndrome atípico |
|
| Síndrome mixto o indeterminado |
|
En el caso de los ancianos, la forma de presentación puede ser aún más inespecífica y es en ellos donde debe elevarse el grado de sospecha: la fiebre puede estar ausente (entre otros factores, muchos toman medicación con antitérmicos o antiinflamatorios), suele faltar la expectoración e incluso la tos puede ser escasa [32,33]. No es infrecuente que la clínica inicial de una neumonía en estos enfermos sea el deterioro cognitivo, una caída, incontinencia de esfínteres de comienzo reciente o descompensación inexplicada de sus patologías previas. Además, la presencia de cardiopatía, enfermedad cerebrovascular, deterioro cognitivo y broncopatía crónica son factores de riesgo añadidos para determinados tipos de neumonía como la neumocócica en la población geriátrica [32].
Aunque no son específicos de la NAC neumocócica, cuando se presentan dos o más de los siguientes criterios aumentan significativamente las posibilidades de que la bacteria causante sea S. pneumoniae: fiebre de comienzo súbito y escalofríos, dolor pleurítico, expectoración purulenta o herrumbrosa, herpes labial, auscultación de soplo tubárico, imagen de condensación lobar con broncograma aéreo en la radiografía de tórax, leucocitosis (> 10.000 leucocitos/mm3) o leucopenia (< 4.000 leucocitos/mm3) [14,15]. Por otro lado, una concentración de procalcitonina (PCT) > 0,85 ng/ml también obliga a considerar al neumococo como el agente etiológico de la NAC [34,35].
ESTUDIOS COMPLEMENTARIOS EN EL SERVICIO DE URGENCIAS
Las exploraciones diagnósticas que se le deben practicar a un paciente con sospecha o confirmación de NAC dependen en gran medida de la gravedad estimada, y, por tanto, de si el manejo va a ser ambulatorio u hospitalario. También podrán variar de acuerdo a: la dificultad en orientar cada caso, la presencia o ausencia de complicaciones, la existencia de circunstancias individuales y las características clínico-epidemiológicas [1,15,24,26]. En el caso de NAC de bajo riesgo con tratamiento domiciliario podría iniciarse la administración de antibióticos sin más pruebas que la radiografía en el Centro de Salud [28,29]. Se debe apelar asimismo al juicio del médico de urgencias para tomar la decisión de cuáles realizar. “Se deben emplear más técnicas diagnósticas cuanto más grave es la neumonía”.
Con objeto de unificar el manejo de la NAC en los SUH se recomienda, siempre que exista disponibilidad, solicitar y valorar [1,14,15,35,36]:
- A todos los enfermos: radiografía de tórax posteroanterior y lateral, hemograma y bioquímica básica [que incluya glucosa, iones, urea, creatinina, bilirrubina, GOT(ATS), GPT(ALT)] y gasometría arterial [si Sat O2 ≤ 93% o la FR > 20 respiraciones por minuto (rpm) o existe comorbilidad cardiorrespiratoria].
Y si están disponibles, valorar individualmente solicitar en el SUH: PCT y proadrenomedulina (proADM), así como antígeno de neumococo y Legionella en orina.
- A todos los que ingresen y/o cumplan criterios de sepsis (descritos en la tabla 3), además de los estudios anteriores solicitar: cultivo de esputo, dos hemocultivos y antígenos en orina para neumococo y Legionella spp., estudio de coagulación, lactato, PCT y proADM.
Y si se sospecha virus de la gripe y/o está indicado el tratamiento: aspirado nasofaríngeo.
- Si existe derrame pleural significativo, se hará toracocentesis solicitando: pH, bioquímica, células, Gram, cultivo. Valorar antígenos de neumococo y Legionella spp y técnicas de biología molecular.
- Individualmente y según disponibilidad en determinadas circunstancias (NAC que no responde al tratamiento o sospecha de patógenos resistentes o poco frecuentes) obtener muestras para serologías (primera muestra) y otras técnicas como tinción de Ziehl-Neelsen, cultivo de micobacterias, técnicas moleculares, cultivo para hongos, tinción de Giemsa o de Kinyoun, etc.
Ver utilidades e indicaciones de las exploraciones complementarias en la tabla 5.
Tabla 5.
Exploraciones complementarias en el abordaje inicial de la neumoniía en Urgencias
| Radiografiía de tórax posteroanterior y lateral: debe solicitarse en todos los casos para el diagnóstico y establecer la extensión y localización, así como la posible existencia de complicaciones (cavitación o derrame pleural) y descartar otras enfermedades que pueden cursar con manifestaciones clínicas similares. La afectación bilateral o multilobar o la existencia de derrame son indicadores de gravedad y de ingreso. En ocasiones, si se realiza precozmente al inicio de los síntomas, puede faltar el infiltrado radiológico que suele aparecer a partir de las 12 horas. Y, por lo tanto, puede ser poco demostrativa en fases iniciales de la neumonía, como puede ocurrir también en casos de deshidratación, neutropenia e infección por determinados patógenos (P. jiroveci en inmunodeprimidos). No hay un patrón radiológico que permita reconocer la etiología (se puede ver condensación o infiltrado alveolar único o múltiple, con distribución anatómica, segmentaria o lobar, o parcheado o intersticial). En ocasiones el paciente consulta por un dolor torácico de características pleuríticas que resulta desproporcionado a los escasos hallazgos de la radiografía; en dichos casos debe prestarse atención a los senos costofrénicos ya que puede tratarse de la fase inicial de un derrame metaneumónico. Además, se deben valorar otros posibles hallazgos como la presencia de adenopatías hiliares o mediastínicas o zonas de atelectasia que pueden orientar hacia la presencia de una neoplasia pulmonar subyacente no objetivada hasta el momento. Por último, no debe asumirse que todo infiltrado pulmonar se corresponde con una neumonía. La resolución radiológica suele ser posterior a la clínica, pero siempre deberemos indicar la realización de una radiografía para confirmar su resolución a partir de la 4ª semana tras finalizar el tratamiento. |
| Hemograma: leucocitosis o leucopenia intensas pueden orientar sobre la gravedad del cuadro; la presencia de anemia o trombopenia pueden servir para valorar la situación general del paciente. |
| Bioquímica básica: la presencia de hiponatremia, insuficiencia renal o hiperglucemia pueden tener valor pronóstico. La alteración de la función hepática puede orientar al patógeno causal o influir en la decisión de la pauta de tratamiento elegido. |
| Saturación de oxiígeno mediante pulsioximetriía y/o gasometriía arterial: debe realizarse cuando haya datos de insuficiencia respiratoria en sujetos jóvenes y siempre en pacientes mayores o con patologías de base, ya que será un dato de gran valor para decidir la necesidad de ingreso hospitalario. La gasometría también será útil cuando se sospeche alteración del equilibrio ácido-base por retención de CO2 o existan signos de hipoperfusión tisular. |
| Coagulación elemental: puede ser útil en casos seleccionados y obligada en situación de sepsis. |
| Hemocultivos: se recomienda la extracción de 2 muestras en los pacientes que vayan a ingresar y siempre antes del inicio del tratamiento antibiótico (que no debe ser demorado por la obtención de los cultivos). Resultan útiles para ajustar el tratamiento e identificar a un subgrupo de pacientes de alto riesgo ya que la bacteriemia se asocia con una mayor mortalidad. |
| Análisis del esputo (tinción de Gram y cultivo): en casos seleccionados (reingreso) puede resultar útil (la presencia de abundantes diplococos gram positivos como especie predominante sugiere el diagnóstico de neumonía neumocócica); la mayor rentabilidad se obtiene cuando la muestra es de buena calidad (grados IV y V de Murray, con < de 10 cél. escamosas y > 25 PMN/campo a 100 aumentos), se toma antes del inicio del tratamiento antibiótico y se transporta con rapidez al laboratorio (en menos de 30 minutos). En pacientes graves o con sospecha de microorganismo no habitual o resistente es conveniente su realización. |
| Antígeno de neumococo en orina es un método rápido y puede ser útil sobre todo en casos graves. Su sensibilidad en orina directa está en torno al 66% y del 75-85% cuando existe bacteriemia, mientras que la especificidad es > 95%. El resultado se puede obtener en poco tiempo (15 minutos). Algunas limitaciones incluyen la posibilidad de falsos positivos en casos de colonización por neumococo o infecciones por otras especies de Streptococcus spp. |
| Antígeno de Legionella en orina debe solicitarse sobre todo en casos graves y epidemiológicamente posibles; normalmente tras comprobar la negatividad del antígeno de neumococo. Debe tenerse en cuenta que sólo detecta serogrupos del tipo 1 (responsable de >90% de casos en humanos). |
| Debemos tener en cuenta que la positividad de la antigenuria puede durar semanas o meses tras una neumonía (por lo que habrá que valorar esta cuestión si surge un nuevo episodio en un paciente previamente diagnosticado de NAC por S. pneumoniae o Legionella serotipo 1). |
| Estudio antigénico de la gripe en periodo estacional |
La accesibilidad y rapidez para determinar BMRII en muchos SUH hacen que estos se postulen como criterios añadidos a las EPG y a la exploración clínica para valorar la gravedad y mejorar la toma de decisiones al predecir el diagnóstico de NAC bacteriana [34,35], bacteriemia [38,39], así como para decidir el lugar apropiado para el tratamiento [9]. De hecho, hoy en día se considera la combinación de EPG y BMRII como la mejor estrategia para la valoración pronóstica y predicción de mortalidad en el paciente con NAC [35]. En la tabla 6 se muestran las recomendaciones y utilidades para su uso. La PCT sérica es un marcador de infección bacteriana más específico que la proteína C reactiva (PCR). Las concentraciones de PCT aumentan a las 4 horas del inicio de una infección bacteriana y no en la inflamación o en la infección vírica. Así, puede ser útil para el diagnóstico de infección bacteriana en la NAC [35]. Pero, se debe considerar que un valor único de PCT, sobre todo en fases precoces, podría ser negativo. La seriación de la PCT ofrece mayor capacidad diagnóstica [34]. En cuanto a la proADM se trata de un gran predictor de mortalidad a los 28-30 días, de forma que se está utilizando en combinación con las escalas pronósticas y la PCT para confirmar la implicación bacteriana y decidir el ingreso del paciente [40].
Tabla 6.
Recomendaciones del uso de los biomarcadores en los pacientes con NAC en los SUH
| BMRII | Valores | Significado clínico | Utilidades/limitaciones |
|---|---|---|---|
| PCT (ng/ml) | < 0,05 | Predicción de otros procesos o NAC viral | -Determinar para diagnóstico de NAC, su etiología, descartar bacteriemia, indicación adecuada de alta o ingreso. |
| 0,10-0,5 | Sospecha de patógenos atípicos | ||
| >0,85 | Sospecha de Streptococcus pneumoniae | -Mayor rendimiento que el resto de BMRII para diagnóstico de NAC, su etiología y bacteriemia. | |
| > 1 | Predicción de bacteriemia. Indicación de ingreso. Mayor mortalidad. Posible evolución a sepsis-SS. | -Menor rendimiento que proADM en predicción de mortalidad con/sin EPG. | |
| > 5 | Mayor mortalidad a 30 días | ||
| > 10 | Valorar ingreso en UCI | ||
| proADM (nmol/L) | <0,75 | Posibilidad de tratamiento domiciliario | -Determinar para pronóstico de complicaciones y mortalidad e indicación de alta o ingreso. |
| 0,75-1,5 | Observación hospitalaria | -Mayor rendimiento que el resto de BMRII en predicción de mortalidad con/sin EPG. | |
| > 1,5 | Necesidad de ingreso. Mayor mortalidad. Posible evolución a sepsis-SS. | ||
| PCR (mg/ml) | ≥ 60 | Predicción de NAC frente a otros procesos cardiorrespiratorios. | -Menor rendimiento que la PCT para etiología, bacteriemia y pronóstico. |
| ≥ 125 | Sospecha NAC típica frente a NAC atípica, mayor mortalidad a los 30 días. | -Menor rendimiento que lactato, PCT y proADM en predicción de mortalidad. | |
| ≥ 200 | Predicción de bacteriemia. | -Utilizar si no hay disponibilidad de otros BMRII | |
| Lactato (mmol/L) | > 2 | Monitorizar lactato arterial | -Determinar si existen criterios de gravedad clínica (sepsis-SS) |
| > 2,5 | Mayor mortalidad. Monitorizar para ver respuesta al tratamiento | -Seriación a las 8-12 horas para comprobar aclaramiento en pacientes con lactato inicial >2 mmol/L a su llegada al SU. | |
| > 3,5-4 | Mortalidad > 25% a 7 y 30 días, independiente de la situación hemodinámica | ||
BMRII: Biomarcador de respuesta inflamatoria e infección; NAC: Neumonía adquirida en la comunidad; SUH: Servicio de Urgencias Hospitalario; PCT: Procalcitonina; PCR: Proteína C reactiva; proADM: proadrenomedulina; EPG: Escalas pronósticas de gravedad; SS: shock séptico.
En relación al lactato como marcador de gravedad en el SUH en la NAC, su elevación nos indica un estado de hipoperfusión tisular (que puede estar asociado a distintas etiologías, no solo la infección bacteriana grave) que debe correlacionarse con la acidosis comprobada en la gasometría [35,41].
VALORACIÓN PRONÓSTICA Y DECISIÓN DE DESTINO DEL PACIENTE
(ALTA O INGRESO EN OBSERVACIÓN, PLANTA O MEDICINA INTENSIVA)
VALORACIÓN PRONÓSTICA Y DE GRAVEDAD DEL PACIENTE CON NAC
La valoración de la gravedad o valoración pronóstica es una herramienta fundamental en el SUH para estimar tanto la intensidad de tratamiento que necesita el paciente con NAC, como la decisión de destino adecuado para el paciente (alta, ingreso en observación-UCE, planta o UCI) [6]. Inicialmente, la mayoría de las EPG surgieron con la idea de convertirse en reglas clínicas que pretendían estratificar a los pacientes en grupos de riesgo en relación con la mortalidad observada a los 30 días, considerando distintos factores pronósticos relacionados con la morbimortalidad como son los dependientes del paciente (edad, enfermedades asociadas, aspectos epidemiológicos, etc.) o los dependientes del proceso (hallazgos clínicos, analíticos y radiológicos) [6,27]. Estas tienen el objetivo de determinar con seguridad qué pacientes pueden ser tratados en su domicilio. Y una vez que se decide o no la necesidad de ingreso, se deben estimar otros aspectos como la duración de la estancia hospitalaria, de reingreso a los 30 días, la necesidad de reconocer a los pacientes que precisan vigilancia en una UCI al tratarse de una NAC grave (NACG) o de riesgo [6,27].
Hoy en día, el evitar al máximo tanto los ingresos innecesarios como las altas improcedentes, reto nada fácil en los casos dudosos, constituye un objetivo irrenunciable (el 38-62% de los pacientes con NAC de bajo riesgo son ingresados y se decide tratamiento ambulatorio en el 3-13% de las NAC de alto riesgo) [6]. Por ello, es indispensable individualizar cada caso valorando en su justa medida, como una ayuda complementaria, las EPG, los criterios y circunstancias adicionales (derrame pleural, cavitación, afectación multilobar, inestabilidad hemodinámica, sepsis, hiperlactacidemia, etc.) y considerar, además, los aspectos epidemiológicos, personales y condicionamientos sociales de cada paciente que pueden impedir un tratamiento domiciliario (intolerancia oral, hipoxemia, soporte familiar, comorbilidades, hábitos tóxicos, alteraciones psiquiátricas, etc.) [6,14,15]. Todo ello valorando los recursos asistenciales disponibles por cada centro. El juicio clínico solo, es impreciso e insuficiente, pero las EPG tienen grandes limitaciones y sólo son herramientas de ayuda para tomar la decisión de ingresar o dar de alta al paciente con NAC [27].
ESCALAS PRONÓSTICAS DE GRAVEDAD
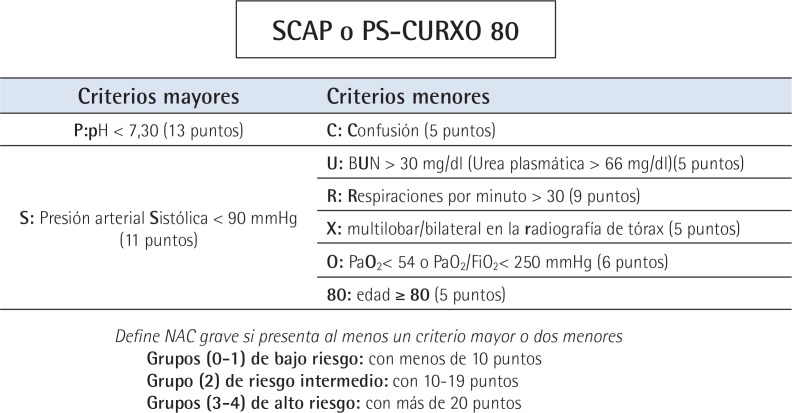
Aunque existen múltiples EPG, las escalas de Fine o Pneumonia Severity Index (PSI) [42] y la CURB-65 [43] son las más validadas y recomendadas, y se ha demostrado que poseen una capacidad similar para reconocer a los pacientes con riesgo de fallecer a los 30 días [6]. Aunque, en la actualidad, la EPG conocida como SCAP (Severity Community Acquired Pneumonia) o “PS-CURXO80” [44], está siendo utilizada con mayor frecuencia por la clasificación de riesgo que realiza y por predecir gravedad, necesidad de ventilación mecánica (VM) y posible evolución a shock séptico e ingreso en UCI.
El Pneumonia Severity Index (PSI) o índice de severidad de la neumonía elaborado por Fine et al. combina 20 variables demográficas, de morbilidad, hallazgos exploratorios, de laboratorio y radiológicos definiendo 5 clases de riesgo (figura 1) en relación con la mortalidad a los 30 días [42]. En función de la clase de riesgo asignada, recomienda tratamiento ambulatorio en los grupos I–II, observación en el SUH o en la UCE en la clase III, e ingreso hospitalario en las clases IV-V. El PSI identifica bien el bajo riesgo de mortalidad en las clases I-III y nos ayuda a decidir “el alta”, pero puede infraestimar la gravedad, sobre todo en jóvenes con hipoxia, y no valora criterios y circunstancias adicionales que deben ser tenidas en cuenta [2,6,8,9,14]. De ahí que surgiera el concepto de “Escala de Fine o PSI modificado (PSIm)” [6], como una actualización necesaria del clásico PSI, que indica el ingreso de los pacientes de bajo riesgo (I-III) que presentan insuficiencia respiratoria (PaO2 <60 mmHg) o concentraciones de PCT > 1 ng/ml (al menos en observación) o bien alguno de los criterios adicionales señalados en la tabla 7. De esta forma, se salvan la mayoría de las limitaciones y debilidades de la escala PSI. El 16-27% de los pacientes ingresados en UCI por NAC son clasificados inicialmente con un PSI I-III y en ellos el motivo de ingreso más frecuente es por insuficiencia respiratoria (PaO2<60 mmHg y/o Sat O2<90%). La utilización del PSIm en los SUH mejora la adecuación de los ingresos [6-9].
Figura 1.
Escala pronóstica de gravedad PSI (Fine)
* (Criterios de PSI modificado) Si PaO2 <60 mmHg o criterios de sepsis o hipotensión aislada: al menos observación en urgencias o en unidad de corta estancia y reevaluación a las 12-24 horas. Además se debe tener en cuenta cualquier otro factor o situación que impida un tratamiento ambulatorio (ver criterios adicionales en la tabla 7).
PSI: Pneumonia Severity Index; NAC: Neumonía Adquirida en la Comunidad; PA: presión arterial; FC: frecuencia cardiaca; lpm: latidos por minuto; FR: frecuencia respiratoria; rpm: respiraciones por minuto; OU: observación de Urgencias; UCE: unidad de corta estancia; UCI: unidad de cuidados intensivos.
Tabla 7.
Criterios adicionales y factores de riesgo que condicionan el ingreso de los pacientes con PSI I-III
|
Por lo tanto, además de los factores señalados en las EPG comentadas, que confieren una valoración puntual y estática de la NAC, y los dependientes del propio estado funcional del paciente, se deben tener en cuenta otros criterios adicionales independientes y dinámicos, como lo es la propia infección y la respuesta inflamatoria sistémica, que influyen y determinan el pronóstico en las primeras horas de estancia del paciente en el SUH [2,6,34]. Entre estos se encuentran: la estimación de la probabilidad de bacteriemia, la existencia de sepsis o shock séptico como estadíos de un proceso dinámico, y la inclusión de los BMRII para colaborar en la decisión de ingreso y/o ubicación más adecuada [6,14,35].
La situación clínica del paciente con NAC, de acuerdo con los criterios de sepsis y shock séptico es esencial [30,31], y determina que el paciente debe ser valorado de nuevo tras unas horas (8-12-24), y, por lo tanto, al menos, permanecer en observación del SUH o en la UCE [6]. Además, la frecuencia de bacteriemia aumenta con la gravedad del cuadro clínico (17-31% en sepsis y 30-45% en el shock séptico) [45]. Aunque todos los signos vitales se han asociado como predictores individuales de mortalidad [(FR ≥ 26 rpm, FC ≥120 lpm, Tª >38,3ºC y PAS ≤ 90 mmHg]. La PAS es el mejor marcador, como signo hemodinámico, predictor independiente de mortalidad a los 30 días y de necesidad de VM y/o soporte con agentes inotrópicos [36,44]. Es importante recordar que es necesario una búsqueda constante de indicios clínicos previos a la hipotensión para identificar al paciente grave, ya que si bien la PAS es un buen marcador pronóstico, no lo es precoz de shock [46]. De hecho, los nuevos criterios de sepsis (SOFA) no son suficientes en los pacientes que clasifican con bajo riesgo para pronosticar una mala evolución [47], lo que si pueden adelantar los BMRII [35].
Por su parte, la British Thoracic Society (BTS) confeccionó la escala CURB-65 [43], acrónimo de confusión, urea >44 mg/dl, FR ≥30 rpm, PAS < 90 mmHg o PAD ≤ 60 mmHg y edad ≥ 65 años (tabla 8), definiendo 6 grupos de riesgo. Detecta mejor a los pacientes de alto riesgo (clases 3-5) que deberían ser ingresados, pero también presenta grandes limitaciones, entre las que se encuentran el poder sobreestimar e indicar el ingreso en muchos de los mayores de 65 años por el criterio de la edad, que no debe ser único indicador del ingreso en la actualidad, y tampoco valora la saturación de oxígeno o la PaO2 [6]. La valoración de la “confusión” se puede realizar con un cuestionario de diez preguntas o de forma sencilla valorando la aparición de desorientación en tiempo, espacio o persona. El cálculo se hace sumando 1 punto por cada variable presente con un rango entre 0-5 puntos [43].
Tabla 8.
Escala CURB-65
| C | Confusión. Desorientación en tiempo, espacio y personaa | |
| U | Urea plasmática > 44 mg/dl (BUN > 19,4 mg/dl o > 7 mmol/l) | |
| R | Frecuencia Respiratoria ≥ 30 rpm | |
| B | PA Sistólica < 90 mmHg o PA diastólica ≤ 60 mmHg | |
| 65 | Edad ≥ 65 años | |
| Puntuación | Estratificación | Mortalidad |
| 0 | Posible tratamiento ambulatorio | Baja 0,7 % |
| 1 | Posible tratamiento ambulatorio | Baja 2,1 % |
| 2 | Ingreso hospitalario (observación-UCE-planta) | Intermedia 9,2 % |
| 3 | Ingreso hospitalario en planta (valorar UCI) | Alta 14,5 % |
| 4 - 5 | Ingreso hospitalario (considerar UCI) | Muy alta > 40 % |
En el caso de existencia de alguno de los criterios adicionales señalados en la tabla 7, aún con CURB65 0-1 se debería ingresar al paciente.
En el Cuestionario, preguntar por: 1. Edad, 2. Tiempo (hora aproximada), 3. Dirección (repetir al final del test), 4. Año, 5. Nombre del centro donde se atiende al paciente, 6. Reconocer a dos personas (médico, enfermera), 7. Día del cumpleaños, 8. Año de inicio de la guerra civil, 9. Nombre del Rey o Presidente del gobierno, 10. Contar desde 20 a 1. (Por cada respuesta correcta se le da un punto. Si menos de 6 puntos se determina que padece “confusión”).
En Atención Primaria se recomienda la escala CRB-65 [1,6,29], acrónimo de confusión, FR ≥ 30 rpm, PAS < 90 mmHg o PAD ≤ 60 mmHg y edad ≥ 65 años, de forma que se indicaría el ingreso (por tanto la derivación hospitalaria como se señaló previamente) con ≥ 2 criterios. En los casos con CRB-65 =1 se debería valorar de forma individual (y tener en cuenta la existencia de criterios o situaciones incluidas en las tablas 3 y 7) [6,28,29].
Además, debe hacerse una valoración individual en cada caso por el médico de urgencias, y es por ello por lo que la mayoría de las guías recomiendan seguir 3 pasos para decidir el ingreso o el tratamiento domiciliario de la NAC [1,6]:
1.- Valorar posibles condicionantes que dificulten o comprometan la asistencia domiciliaria (problemas sociales o psiquiátricos que hagan sospechar mala cumplimentación del tratamiento o intolerancia al tratamiento oral o la insuficiencia respiratoria) y los llamados criterios adicionales.
2.- Una vez valorado lo anterior evaluar el riesgo en las escalas pronósticas PSIm o CURB-65.
3.- Por último se debe aplicar una juiciosa valoración clínica con todos los elementos disponibles incluyendo las características y posibilidades de cada hospital (existencia o no de observación, UCE, consultas, hospital de día, etc.), optando en casos dudosos por la decisión más segura para el paciente. Los casos de pacientes con NAC que cumplan criterios de sepsis deberían, al menos, permanecer en observación para ver su evolución inmediata [6,26,30].
En los últimos años han surgido otras EPG. Entre ellas destaca la conocida como SCAP (Severity Community Acquired Pneumonia) o “PS-CURXO80” [44] que contiene 2 variables mayores y 6 menores (figura 2) y que ya es utilizada en múltiples centros y recomendada por muchos expertos. Esto es así porque además de pronosticar la mortalidad como lo hace el PSI y la CURB-65, ha sido validada y es capaz de predecir la necesidad de VM y la evolución a shock séptico [6]. La escala SCAP define una NAC como grave (NACG) si el paciente presenta al menos un criterio mayor o dos menores [44].
Figura 2.
Escala SCAP
Predice el riesgo de mala evolución (desarrollo de sepsis grave o shock séptico, la necesidad de ventilación mecánica o fallo de tratamiento, y la necesidad de ingreso en Medicina Intensiva. SCAP: Severity Community Acquired Pneumonia
NAC GRAVE (NACG) Y LA DECISIÓN DE INGRESO EN MEDICINA INTENSIVA
Es muy importante identificar precozmente a los pacientes más graves y aquellos cuyo estado puede empeorar rápidamente en el SUH a fin de decidir si deben ser tratados en la UCI. Pero, ¿qué se entiende por NACG? Se denomina así a los casos propensos a tener peor evolución y/o complicaciones, con inestabilidad hemodinámica y/o respiratoria, que requieren gran vigilancia y continuos cuidados sanitarios o mayor requerimiento de intervenciones (que solo se ofrecen en una UCI) y una mayor probabilidad de fallecer [6,48].
Si tanto el PSIm como el CURB-65 son útiles para valorar el riesgo de muerte, ninguna de ellas fue diseñada para evaluar la necesidad de ingreso en la UCI [6,16]. Por contra, los criterios de gravedad ATS/IDSA (American Thoracic Society-Infectious Diseases Society of America) de 2007 [2], así como la escala SCAP [44], sí son apropiados para identificar a los candidatos a precisar soporte inotrópico y/o ventilatorio y/o ingreso en la UCI.
En la actualidad, la mayoría de las Sociedades Científicas recomiendan los criterios ATS/IDSA de 2007 de ingreso en UCI en la NACG [1,2], (tabla 9) que con un criterio mayor (necesidad de VM invasiva o existencia de shock séptico con vasopresores) o con tres menores, indica el ingreso en UCI. Los criterios mayores son obvios, los menores se han validado recientemente. Además la propia ATS/IDSA nos recuerda que hay otros criterios a considerar individualmente como “menores” como son la hipoglucemia (en no diabéticos), hiperglucemia, hiponatremia, acidosis metabólica e hiperlactacidemia (lactato >3 mmol/L o >27 mg/dl) e incluso se señala la ingestión aguda de alcohol y el delirium tremens [2]. El motivo de ingreso en la UCI es en un 60% por insuficiencia respiratoria aguda y en un 28% por inestabilidad hemodinámica con una mortalidad global del 32%. Los criterios ATS/IDSA-2007 identifican casi el 90% de los pacientes que requieren ingreso en UCI (68% por los criterios mayores y el 21% por criterios menores) [49].
Tabla 9.
Criterios ATS/IDSA 2007 de ingreso en UCI de las NACG.
| Criterios mayores | Criterios menores |
|---|---|
| Necesidad de ventilación mecánica | PAS < 90 mmHg (que requiere fluidoterapia agresiva) |
| Afectación multilobar (≥ 2 lóbulos) o bilateral | |
| Frecuencia respiratoria ≥ 30 rpm | |
| Confusión/desorientación | |
| Urea ≥ 45 mg/dl (BUN ≥ 20 mg/dL) | |
| Shock séptico con vasopresores | PaO2 / FiO2 ≤ 250 |
| Leucopenia < 4.000/mm3 | |
| Trombocitopenia < 100.000/mm3 | |
| Hipotermia (temperatura < 36º C) | |
Se debe cumplir un criterio mayor o tres menores para indicar su ingreso en una unidad de cuidados intensivos.
ATS/IDSA: American Thoracic Society-Infectious Diseases Society of America); NACG: neumonía adquirida en la comunidad grave; PAS: presión arterial sistólica; rpm: respiraciones por minuto; PaO2: presión arterial parcial de oxígeno; FiO2: fracción inspirada de oxígeno.
Otras escalas han intentado mejorar el poder predictivo de la ATS/IDSA 2007 de necesidad de ingreso en UCI, como APACHE, PIRO-NAC, etc., pero ésta sigue siendo la recomendada por la sensibilidad (71%) y especificidad (88%) de los criterios menores (los mayores son claros) [6,49], aunque estos están en revisión por los expertos de la ATS/IDSA, ya que podrían sobreestimar la necesidad de ingreso en UCI y está en discusión la próxima inclusión de otros criterios menores ya comentados [24].
TRATAMIENTO
La dificultad en el diagnóstico etiológico hace que en la mayoría de las ocasiones se indique un tratamiento empírico, salvo cuando podemos confirmar un diagnóstico microbiológico desde el SUH, lo que nos permite instaurar un tratamiento dirigido. Las recomendaciones terapéuticas se establecen en general según clasificación del PSI y el destino del paciente decidido [15,50-53].
Independientemente de la pauta y los antimicrobianos indicados, las primeras dosis adecuadas de antibiótico deberán administrarse siempre lo más precozmente posible en el propio SUH (de forma inmediata si existe sepsis o shock séptico), lo que disminuye la estancia hospitalaria y la mortalidad tanto en pacientes leves como en los que se presentan con sepsis o con shock séptico [54].
La tabla 10 muestra las recomendaciones de tratamiento empírico vía oral (vo) o intravenoso (iv) según el destino del paciente. Esta tabla será aplicable para la mayoría de los casos de NAC que atendamos en los SUH [1,14,15,50-52].
Tabla 10.
Recomendaciones de tratamiento antimicrobiano empírico en la NAC
|
TRATAMIENTO ANTIBIÓTICO EMPÍRICO SEGÚN LA CLASIFICACIÓN DE PSI:
PSI modificado I y II (recomendación de tratamiento domiciliario directamente): Si no tiene criterio estricto de ingreso por otra razón, se puede tratar en el domicilio durante 7 días con una de las 5 siguientes pautas:
PSI III (requerirá observación -24 horas- o ingreso en unidad de corta estancia -1 a 3 días- previo al alta) y tratamiento durante 7 días (salvo la azitromicina que se administrará solo 5 días) con una de las 4 siguientes pautas (primera/s dosis iv y después vo):
PSI IV y V (requerirá ingreso en hospitalización en planta), salvo que por otras razones se decida tratar en residencia, centro socio-sanitario, o en hospitalización a domicilio (asumiendo el mal pronóstico). Se realizará durante 7-10 días (salvo para la azitromicina que se administrará solo 5 días) con una de las 4 siguientes pautas:
Si el paciente requiere ingreso en UCI: se realizará durante 10-14 días (salvo si se utiliza la azitromicina que se administrará solo 5 días) con una de las siguientes pautas:
|
La tabla 11 muestra las recomendaciones de tratamiento en situaciones especiales [1,4,21,50-56].
Tabla 11.
Recomendaciones de tratamiento antimicrobiano en la NAC en situaciones especiales
|
TRATAMIENTO ANTIBIÓTICO EN LAS SIGUIENTES SITUACIONES:
Si antigenuria positiva frente a Legionella spp. (y se descartan otras etiologías): se realizará durante 10-14 días con una de las siguientes pautas):
Si antigenuria positiva para neumococo y existe sospecha de bacteriemia: se realizará durante 10-14 días (salvo para la azitromicina que se administrará solo 5 días):
Si sospecha de neumonía aspirativa, absceso de pulmón o implicación de patógenos anaerobios: se realizará durante 14 días de tratamiento, al menos) con una de las siguientes pautas:
Si sospecha de Pseudomonas aeruginosa: se realizará durante 10-14 días con una de las siguientes pautas:
* Considerar en pacientes graves con factores de riesgo o con aislamiento previo de Pseudomonas aeruginosa la indicación de los nuevos antimicrobianos antipseudomónicos como el ceftolozano-tazobactam iv (1-2/0,5-1 g/8 h)
Si existen factores o situaciones predisponentes para SARM: valorar de forma individual añadir al tratamiento:
|
NAC: neumonía adquirida en la comunidad; PSI: Pneumonia Severity Index; iv: intravenosa; vo: vía oral; UCI: unidad de cuidados intensivos; EPOC: enfermedad pulmonar obstructiva crónica; SARM: Staphylococcus aureus resistente a meticilina.
Nota: consultar y ajustar la dosis de los antimicrobianos cuando sea necesario en caso de insuficiencia renal.
Si el estudio antigénico de la gripe en periodo estacional resulta positivo se indicará oseltamivir 75 mg/ 12 horas vo [50].
Algunas consideraciones importantes en la elección de la pauta antimicrobiana en la NAC:
- La decisión de la pauta antibiótica (monoterapia o terapia combinada) debe tener en cuenta los antimicrobianos administrados en los tres meses previos al paciente para seleccionar una clase de antimicrobianos diferente, así como la gravedad de la situación clínica que podría recomendar la terapia combinada hasta el aislamiento del agente etiológico o la mejoría del paciente [1,14].
- Para establecer el tratamiento antimicrobiano se debe considerar la existencia de factores de riesgo para patógenos resistentes (tabla 12) que pueden hacer cambiar la decisión de la pauta antibiótica [1,20,21,50,56-59].
Tabla 12.
Factores de riesgo para patógenos menos habituales
| MICROORGANISMOS | SITUACIONES O FACTORES DE RIESGO |
|---|---|
| Anaerobios (y enterobacterias) | Mala higiene oral (“boca séptica”). |
| Enfermedad periodontal. | |
| Aspiración contenido gastroesofágico (vómitos, reflujo, disfagia o problemas de deglución, etc.). | |
| Deterioro funcional. | |
| Enfermedades neurológicas: demencia, cerebrovasculares, etc. | |
| Etilismo. | |
| Situaciones de disminución del nivel de consciencia. | |
| Imágenes radiológicas compatibles con lesiones necrotizantes o abscesos pulmonares. | |
| Pseudomonas aeruginosa | EPOC grave o muy grave. |
| EPOC con > 4 ciclos de tratamiento antibiótico en el último año. | |
| Bronquiectasias con colonización previa. | |
| Sonda nasogástrica para la alimentación enteral. | |
| Ingreso en Unidad de Cuidados Intensivos. | |
| Pacientes con VIH con < 50 CD4, trasplantados, neutropénicos, con fibrosis quística. | |
| Enterobaterias portadoras de betalactamasas de espectro extendido | Hemodiálisis. |
| Diabetes mellitus. | |
| Sonda urinaria permanente. | |
| Infecciones urinarias de repetición. | |
| Residencia en centro de larga estancia. | |
| Hospitalización reciente y/o Antibiótico previo. | |
| SARM | Sospecha de infección por bacterias grampositivas y resistencia a meticilina > 10% en el área sanitaria. |
| Sometidos a cuidados en úlceras por decúbito o heridas. | |
| Colonización previa. | |
| Sobreinfección de neumonía por virus influenza durante epidemia gripal. | |
| Residencia en centro de larga estancia (institucionacilación) ± gravedad clínica ± hospitalización reciente ± antibiótico endovenoso previo. | |
- En relación a los “antibióticos concentración dependientes”: dentro de este grupo, buscando la opción más adecuada, debemos señalar que moxifloxacino (400 mg/24 h) es 4-8 veces más activo que levofloxacino frente a S. pneumoniae. Si bien la concentración sérica de levofloxacino (Cmax) es superior a la de moxifloxacino, para obtener un valor del área bajo la curva similar a la de éste, levofloxacino debería administrarse a dosis de 500 mg/12 h [14,60]. El tiempo de exposición durante las 24 h del día o área bajo la curva inhibitoria conseguida (ABC24/CMI), es trascendental para estimar la eficacia clínica, ya que, cuanto mayor sea ésta (para S. pneumoniae debe ser siempre ≥ 30 mg/h/l), aumentará el éxito clínico y disminuirá la posibilidad de desarrollo de mutantes y aparición de resistencias, hecho crucial que ocurre con moxifloxacino vía oral (según las CMIs su ABC24/CMI se sitúa entre 96-384 mg/h/l), mientras que para levofloxacino o azitromicina (por vía oral) son de 35 y 3 mg/h/l, respectivamente [14,60-62].
- En relación a los “antibióticos tiempo dependientes”: para las aminopenicilinas y cefalosporinas es preciso que al menos el T>CMI (tiempo sobre la CMI) sea del 40-50% del tiempo entre dos dosis del fármaco para que sean eficaces. Dentro de este grupo y frente a S. pneumoniae, cefditoreno es varias veces más activo que amoxicilina-clavulánico, aunque en la práctica los parámetros FC-FD (farmacocinética/farmacodinámica) de ambos son superponibles con dosis de 400 mg/12 h de cefditoreno y dosis de 2.000/125 mg/12 h de la formulación retardada de amoxicilina-clavulánico durante 10 días para una NAC. Así según sus CMIs, la actividad in vitro previsible de cefditoreno es de 94% con dosis de 200 mg/12 h y de 99,8% a dosis de 400 mg/12 h, lo que le convierte con esta última pauta en la mejor opción entre las cefalosporinas vía oral [14,60,62,63].
- En pacientes ancianos evitar la utilización de fluoroquinolonas si existe riesgo de infección por enterobacterias debido al elevado porcentaje de resistencias que presentan [50].
- En ocasiones, cuando el paciente permanece en el hospital, aplicamos la terapia secuencial en función de los criterios de estabilidad clínica de Halm et al. (tabla 13) [64].
Tabla 13.
Criterios de estabilidad clínica para terapia secuencial
|
Lpm: latidos por minuto; rpm: respiraciones por minuto.
Adaptada de referencia [64]
Tras alcanzar la estabilidad clínica se puede instaurar una terapia secuencial. Se deben aplicar de forma adecuada dichos criterios para realizar el cambio a la vo. Esto ha demostrado disminuir la estancia hospitalaria sin aumentar los riesgos para el enfermo [1,64]. La presencia de bacteriemia no parece ser un factor determinante para decidir prolongar el tratamiento antibiótico endovenoso una vez alcanzados los criterios. En caso de obtenerse el aislamiento del microorganismo causal, el tratamiento antibiótico oral debe ajustarse a la sensibilidad de éste [50]. Cuando no se logra identificar el patógeno causal es aconsejable utilizar el mismo tratamiento empleado inicialmente por vía iv o antibióticos equivalentes con respecto al espectro de actividad [52,64]. Así, los pacientes en tratamiento con amoxicilina-clavulánico, quinolonas, macrólidos o clindamicina continuarán con el mismo antibiótico administrado por vía iv, ya que disponen de una formulación oral con una buena biodisponibilidad [50-52]. Los pacientes en tratamiento con cefalosporinas (ceftriaxona-cefotaxima) pueden continuar el tratamiento oral con cefditoreno, ya que dispone de un espectro similar. En pacientes que estén recibiendo tratamiento antibiótico endovenoso sin posibilidad de cambiar a tratamiento oral por la ausencia de formulación oral adecuada para la cobertura que éstos ofrecen, se puede plantear el alta con hospitalización a domicilio y completar allí el tiempo de tratamiento antibiótico necesario [14].
OTROS ASPECTOS FINALES A CONSIDERAR
Para finalizar, debemos tener en cuenta en la atención al paciente con NAC:
1.- Otras medidas terapéuticas necesarias que han de acompañar al correcto tratamiento antimicrobiano: el cuidado de los problemas asociados (descompensación diabética, insuficiencia cardiaca, etc.), oxigenoterapia adecuada, balance cuidadoso de líquidos, corrección de las alteraciones electrolíticas, prevención de procesos tromboembólicos mediante la utilización de heparina de bajo peso molecular y en los pacientes con EPOC y con NAC grave considerar inicialmente la oxigenoterapia con gafas nasales de alto flujo o la ventilación mecánica no invasiva antes de plantearse la intubación y ventilación mecánica invasiva [1,14,15].
2.- Seguimiento del episodio de NAC [1,14,15]:
- Valorar al paciente a los 2-4 días de iniciado el tratamiento (para valorar si existe fracaso terapéutico definido como la persistencia de fiebre elevada o agravamiento de los signos/síntomas clínicos), así como a los 7 días (o al finalizar tratamiento)
- Comprobar, a partir de la 4ª semana con radiografía de control, la resolución total del cuadro. En función de las características del paciente y la organización y posibilidades de cada centro, esto se hará por el médico de Atención Primaria, el especialista oportuno o el médico de urgencia hospitalaria.
FINANCIACIÓN
Los autores declaran no haber recibido financiación para la realización de este trabajo.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
BIBLIOGRAFÍA
- 1.Torres A, Barberán J, Falguera M, Menéndez R, Molina J, Olaechea P, et al. Guía multidisciplinar para la valoración pronóstica, diagnóstico y tratamiento de la neumonía adquirida en la comunidad. Med Clin (Barc). 2013;140:223e1-223.e19. DOI: 10.1016/j.medcli.2012.09.034 [DOI] [PubMed] [Google Scholar]
- 2.Mandell LA, Wunderink RG, Anzueto A, Bartlett JG, Campbell D, Dean NC, et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults. Clin Infect Dis. 2007;44 Suppl. 2:S27–72. DOI: 10.1086/511159 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Julián-Jiménez A, González del Castillo J, Martínez Ortiz de Zárate M, Candel González FJ, Piñera Salmerón P, Moya Mir M, (en representación del grupo INFURG-SEMES). Características y cambios epidemiológicos de los pacientes con neumonía adquirida en la comunidad en los servicios de urgencias hospitalarios. An Sist Sanit Navar. 2013;36:387–395. PMID: [DOI] [PubMed] [Google Scholar]
- 4.González-del-Castillo J, Martín-Sánchez FJ, Llinares P, Menéndez R, Mujal A, Navas E, et al. Guidelines for the management of community-acquired pneumonia in the elderly patient. Rev Esp Quimioter. 2014;27:69-86. PMID: [PubMed] [Google Scholar]
- 5.Monclús Cols E, Capdevilla Reniu A, Roedberg Ramos D, Pujol Fontrodona G, Ortega Romero M. Manejo de la sepsis grave y shock séptico en un servicio de urgencias de un hospital urbano de tercer nivel. Oportunidades de mejora. Emergencias. 2016;28:229–234. PMID: [PubMed] [Google Scholar]
- 6.Julián-Jiménez A, González del Castillo J, Candel González FJ. ¿Cuándo, dónde y cómo ingresar al paciente con neumonía adquirida en la comunidad? Rev Clin Esp. 2013;213:99-107. DOI: 10.1016/j.rce.2012.02.006 [DOI] [PubMed] [Google Scholar]
- 7.Tejedor Fernández M, Ferrer Higueras MJ, Tejedor Benítez R. Seguridad del paciente, resultados clínicos y eficiencia en los servicios de emergencias. Emergencias. 2016;28:141–142. PMID: [PubMed] [Google Scholar]
- 8.Julián-Jiménez A, Palomo MJ, Parejo R, Laín-Terés N, Cuena-Boy R, Lozano-Ancín A. Mejora del manejo de la neumonía adquirida en la comunidad en el servicio de urgencias. Arch Bronconeumol. 2013;49:230–240. DOI: 10.1016/j.arbres.2012.12.008 [DOI] [PubMed] [Google Scholar]
- 9.Julián-Jiménez A, Parejo R, Cuena-Boy R, Palomo MJ, Laín-Terés N, Lozano-Ancín A. Intervenciones para mejorar el manejo de la neumonía adquirida en la comunidad desde el servicio de urgencias. Emergencias. 2013;25:379–392. [Google Scholar]
- 10.Kolditz M, Ewig S, Höffken G. Management-based risk prediction in community-acquired pneumonia by scores and biomarkers. Eur Respir J. 2013;41:974–984. DOI: 10.1183/09031936.00104412 [DOI] [PubMed] [Google Scholar]
- 11.Schuetz P, Litke A, Albrich C, Mueller B. Blood biomarkers for personalized treatment and patient management decisions in community-acquired pneumonia. Curr Opin Infect Dis. 2013;26:159–167. DOI: 10.1097/QCO.0b013e32835d0bec [DOI] [PubMed] [Google Scholar]
- 12.Pérez-Díez C, Real-Campaña JM, Noya-Castro MC, Andrés-Aparicio F, Abad-Sazatornil MR, Povar-Marco JB. Errores de medicación en un servicio de urgencias hospitalario: estudio de situación para mejorar la seguridad de los pacientes. Emergencias. 2017;29:412-415. PMID: [PubMed] [Google Scholar]
- 13.Freund Y, Ortega M. Sepsis y predicción de mortalidad. Emergencias 2017;29:79-80. PMID: [PubMed] [Google Scholar]
- 14.Julián-Jiménez A, Candel González FJ, Piñera Salmerón P, González del Castillo J, Moya Mir MS, Martínez Ortiz de Zárate M. Recomendaciones INFURG-SEMES: manejo de la infección respiratoria de vías bajas en urgencias. Monografías de Emergencias. 2009; 3:1-21. [Google Scholar]
- 15.Julián-Jiménez A, Parejo Miguez R, González del Castillo J. Neumonía adquirida en la comunidad. En: Julián Jiménez A, Coordinador. Manual de protocolos y actuación en urgencias, 4ª ed. Madrid: Edicomplet-Saned; 2014p.691-706. [Google Scholar]
- 16.Wunderink RG, Waterer GW. Community-Acquired Pneumonia. N Engl J Med. 2014;370:543-551. DOI: 10.1056/NEJMcp1214869. [DOI] [PubMed] [Google Scholar]
- 17.Johansson N, Kalin M, Tiveljung-Lindell A,Giske CG,Hedlund J. Etiology of Community-Acquired Pneumonia: Increased Microbiological Yield with New Diagnostic Methods. Clin Infect Dis. 2010;50:202-209. DOI: 10.1086/648678 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Cillóniz C, Ewing S, Polverino E, Marcos MA, Esquinas C, Gabarrús A, et al. Microbial aetiology of community-acquired pneumonia and its relation to severity. Torax. 2011;66:340-346. DOI: 10.1136/thx.2010.143982 [DOI] [PubMed] [Google Scholar]
- 19.Woodhead M, Blasi F, Ewig S, Huchon G, Leven M, Ortqvist A, et al. ERS Task Force in collaboration with ESCMID. Guidelines fot the management of adult lower respiratory tract infections. Eur Respir J. 2005;26:1138-1180. DOI: 10.1183/09031936.05.00055705 [DOI] [PubMed] [Google Scholar]
- 20.Di Bardino DM, Wunderink RG. Aspiration pneumonia: a review of modern trends. J Crit Care. 2015;30:40-48. [DOI] [PubMed] [Google Scholar]
- 21.Moore A. Aspiration Pneumonia and Pneumonitis. Hosp Med Clin. 2017;6:16-27. [Google Scholar]
- 22.Julián-Jiménez A, Palomo MJ, Parejo R, Laín N. Neumonía mixta bacteriana: ¿realidad no reconocida? Rev Clin Esp. 2011;211:375-376. DOI: 10.1016/j.rce.2010.12.011 [DOI] [PubMed] [Google Scholar]
- 23.Julián-Jiménez A, Flores Chacartegui M, Piqueras-Martínez AN. Patrón etiológico de la neumonía adquirida en la comunidad: importancia del factor geográfico. Arch Bronconeumol. 2014;50:156-157. DOI: 10.1016/j.arbres.2013.08.001 [DOI] [PubMed] [Google Scholar]
- 24.Musher DM, Thorner AR. Community-acquired pneumonia. N Engl J Med. 2014;371:1619-1628. DOI: 10.1056/NEJMra1312885 [DOI] [PubMed] [Google Scholar]
- 25.Herrera-Lara S, Fernández-Fabrellas E, Cervera-Juan A, Blanquer-Olias R. ¿Influyen la estación y el clima en la etiología de la neumonía adquirida en la comunidad? Arch Bronconeumol. 2013;49:140-145. DOI: 10.1016/j.arbres.2012.11.001 [DOI] [PubMed] [Google Scholar]
- 26.Long B, Long D, Koyfman A. Emergency Medicine Evaluation of Community-Acquired Pneumonia: History, Examination, Imaging and Laboratory Assessment, and Risk Scores. J Emerg Med. 2017;53:642-652. DOI: 10.1016/j.jemermed.2017.05.035 [DOI] [PubMed] [Google Scholar]
- 27.Julián Jiménez A. ¿Cuándo y dónde ingresar las neumonías adquiridas en la comunidad? Emergencias 2011;23:161-163. DOI: 10.1016/j.sdentj.2011.02.003 [DOI] [Google Scholar]
- 28.Trobbiani J. Eops: utilidad de una regla de predicción clínica en pacientes con neumonía adquirida en la comunidad en atención primaria. Evid Act Pract Ambul. 2014:17:104-106. [Google Scholar]
- 29.Vila Córcoles A, Ochoa Gondar O, Rodríguez Blanco T. Utilidad de la escala CRB-65 en la evaluación pronóstica de los pacientes mayores de 65 años con neumonía adquirida en la comunidad. Med Clin (Barc). 2010;135:97-102. DOI: 10.1016/j.medcli.2009.09.049 [DOI] [PubMed] [Google Scholar]
- 30.Levy MM, Fink MP, Marshall JC, Abraham E, Angus D, Cook D et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med. 2003; 31:1250-1256. DOI: 10.1097/01.CCM.0000050454.01978.3B [DOI] [PubMed] [Google Scholar]
- 31.Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315:801-810. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Martín-Sánchez FJ, Julián-Jiménez A, Candel González FJ, Llopis Roca F, Martínez Ortiz de Zárate M, González del Castillo J; en representación del grupo INFURG-SEMES. Profile and initial management of infection in elderly patients in an Emergency Department. Rev Esp Geriatr Gerontol. 2017;52:9-14. DOI: 10.1016/j.regg.2016.02.006 [DOI] [PubMed] [Google Scholar]
- 33.Chiarella F, González-Del Castillo J, Candel FJ, García-Lamberechts EJ, Núñez-Orantos MJ,Martín-Sánchez FJ; Infectious Disease Group of Spanish Emergency Medicine Society. Key issues in the infected patient care in the Emergency Department.Rev Esp Quimioter. 2016;29:318-327. PMID: [PubMed] [Google Scholar]
- 34.Julián-Jiménez A, Candel-González FJ, González del Castillo J. Utilidad de los biomarcadores de inflamación e infección en los servicios de urgencias. Enferm Infecc Microbiol Clin. 2014;32:177–190. [DOI] [PubMed] [Google Scholar]
- 35.Julián-Jiménez A, González del Castillo J, Candel-González FJ. Utilidad y valor pronóstico de los biomarcadores en los pacientes con neumonía adquirida en la comunidad en los servicios de urgencias. Med Clin (Barc). 2017;148:501–510. DOI: 10.1016/j.medcli.2017.02.024 [DOI] [PubMed] [Google Scholar]
- 36.Moran GJ, Rothman RE, Volturo GA. Emergency management of community-acquired bacterial pneumonia: what is new since the 2007 Infectious Diseases Society of America/American Thoracic Society guidelines. Am J Emerg Med. 2013;31:602-612. DOI: 10.1016/j.ajem.2012.12.002 [DOI] [PubMed] [Google Scholar]
- 37.Alba GA, Truong QA, Gaggin HK, Gandhi PU, de Berardinis B, Magrini L, et al. Diagnostic and prognostic utility of procalcitonin in patients presenting to the emergency department with dyspnea. Am J Med. 2016;129:96–104. DOI: 10.1016/j.amjmed201506 037 [DOI] [PubMed] [Google Scholar]
- 38.Julián-Jiménez A, Candel-González FJ, González del Castillo J. Utilidad de los biomarcadores para predecir bacteriemia en los pacientes con infección en urgencias. Rev Esp Quimioter. 2017;30:245-256. PMID: [PubMed] [Google Scholar]
- 39.Julián-Jiménez A, Timón Zapata J, Laserna Mendieta EJ, Parejo Miguez R, Flores Chacartegui M, Gallardo Schall P. Capacidad de la procalcitonina para predecir bacteriemia en pacientes con neumonía adquirida en la comunidad. Med Clin (Barc). 2014;142:285-292. DOI: 10.1016/j.medcli.2013.05.046 [DOI] [PubMed] [Google Scholar]
- 40.Liu D, Xie L, Zhao H, Liu X, Cao J. Prognostic value of mid-regional pro-adrenodedullin (MR-proADM) in patients with community-acquired pneumonia: A systematic review and meta-analysis. BMC Infect Dis. 2016;16:232 DOI: 10.1186/s12879-016-1566-3 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Jo S, Jeong T, Lee JB, Jin Y, Yoon J, Park B. Validation of modified early warning score using serum lactate level in community-acquired pneumonia patients. The National Early Warning Score-Lactate score. Am J Emerg Med. 2016;34:536–541. DOI: 10.1016/j.ajem.2015.12.067 [DOI] [PubMed] [Google Scholar]
- 42.Fine MJ, Auble TE, Yealy DM, Hanusa BH, Weissfeld LA, Singer DE, et al. A prediction rule to identify low-risk patients with community-adquired pneumonia. N Engl J Med. 1997;336:243-250. DOI: 10.1056/NEJM199701233360402 [DOI] [PubMed] [Google Scholar]
- 43.Lim WS, van der Eerden MM, Laing R, Boersma WG, Karalus N, Town GI, et al. Defining community acquired pneumonia severity on presentation to hospital: An international derivation and validation study. Thorax. 2003;58:377–382. PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.España PP, Capelastegui A, Gorordo I, Esteban C, Oribe M, Ortega M, et al. Development and validation of a clinical prediction rule for severe community- acquired pneumonia. Am J Respir Crit Care Med. 2006;174:1249–1256. DOI: 10.1164/rccm.200602-177OC [DOI] [PubMed] [Google Scholar]
- 45.Julián-Jiménez A, Laserna-Mendieta EJ, Timón-Zapata J, Cabezas-Martínez A. Importancia de la sospecha clínica y confirmación de bacteriemia en los servicios de urgencias. Med Clin (Barc). 2011;137:424–429. PMID: [DOI] [PubMed] [Google Scholar]
- 46.Londoño J, León AL, Rodríguez F, Barrera L, de la Rosa G, Dennis R, et al. Lactato sérico en urgencias como factor pronóstico en pacientes con sepsis sin hipotensión. Med Clin (Barc). 2013;141:246–251. DOI: 10.1016/j.medcli.2012.05.033 [DOI] [PubMed] [Google Scholar]
- 47.García-Villalba E, Cano-Sánchez A, Alcaraz-García A, Cinesi-Gómez A, Piñera-Salmerón P, Marín I, et al. Nomograma para predecir mal pronóstico en pacientes procedentes de urgencias con sepsis y bajo riesgo de daño orgánico evaluado mediante SOFA. Emergencias 2017;29:81-86. PMID: [PubMed] [Google Scholar]
- 48.Restrepo MI, Anzueto A. Severe community-acquired pneumonia. Infect Dis Clin North Am. 2009;23:503-520. DOI: 10.1016/j.idc.2009.04.003 [DOI] [PubMed] [Google Scholar]
- 49.Sabatier C, Peredo R, Villagrá A, Bacelat N, Mariscal D, Ferrer R, et al. Neumonía comunitaria grave. Estudio descriptivo de 7 años y utilidad de los criterios de la Infectious Diseases Society of America y la Americam Thoracic Society 2007 en la identificación de los pacientes que requieren ingreso en una unidad de cuidados intensivos. Med Intensiva. 2010;34: 237-245. DOI: 10.1016/j.medin.2009.11.008 [DOI] [PubMed] [Google Scholar]
- 50.Mensa J, Gatell JM, García-Sánchez JE, Letang E, López-Suñé E, Marco F. Guía de Terapéutica Antimicrobiana 2017. Barcelona: Ediciones Antares; 2017. [Google Scholar]
- 51.Eliakim-Raz N, Robenshtok E, Shefet D. Empiric antibiotic coverage of atypical pathogens for community-acquired pneumonia in hospitalized adults. Cochrane Database Syst Rev. 2012;9:CD004418 DOI: 10.1002/14651858.CD004418.pub4 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Lee JS, Giesler DL, Gellad WF, Fine MJ. Antibiotic Therapy for Adults Hospitalized With Community-Acquired Pneumonia. A Systematic Review. JAMA. 2016;315:593-602. DOI: 10.1001/jama.2016.0115 [DOI] [PubMed] [Google Scholar]
- 53.González del Castillo J, Martín-Sánchez FJ. Microorganismos resistentes en urgencias: ¿cómo afrontar el reto? Emergencias 2017;29:303-305. PMID: [PubMed] [Google Scholar]
- 54.González-Castillo J, Candel FJ, Julián-Jiménez A. Antibióticos y el factor tiempo en la infección en urgencias. Enferm Infecc Microbiol Clin. 2013; 31:173-180. DOI: 10.1016/j.eimc.2012.01.025 [DOI] [PubMed] [Google Scholar]
- 55.Vardakas KZ, Trigkidis KK, Apiranthiti KN, Falagas ME. The dilemma of monotherapy or combination therapy in community-acquired pneumonia. Eur J Clin Invest. 2017;e12845 DOI: 10.1111/eci.12845 [DOI] [PubMed] [Google Scholar]
- 56.Díaz E, Martín-Loeches I, Vallés J. Neumonía nosocomial. Enferm Infecc Microbiol Clin. 2013;31:692-698. [DOI] [PubMed] [Google Scholar]
- 57.Torres Bonafonte OH, Gil Olivas E, Pérez Macho E, Pacho Pacho C, Meto Roca M, Casademont Pou J, et al. Predictores de patógenos resistentes en las neumonías procedentes de la comunidad: ¿es útil en urgencias el concepto de neumonía asociada a cuidados sanitarios? Emergencias 2017; 29:306-312. PMID: [PubMed] [Google Scholar]
- 58.Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB, et al. Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016;63:e61 DOI: 10.1093/cid/ciw504. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Wunderink RG. “How important is methicillin-resistant Sthapylococcus aureus as a cause of community-acquired pneumonia and what is best antimicrobial therapy?” Infect Dis Clin North Am. 2013;27:177-188. DOI: 10.1016/j.idc.2012.11.006 [DOI] [PubMed] [Google Scholar]
- 60.Aguado García JM, Martín Herrero JE, Lumbreras Bermejo C. Resistencias bacterianas y farmacodinamia como bases de la prescripción de antibióticos en infecciones respiratorias. Enferm Infecc Microbiol Clin 2004;22:230-237. PMID: [DOI] [PubMed] [Google Scholar]
- 61.Julián Jiménez A. Eficacia y seguridad de moxifloxacino en Urgencias. Emergencias 2006;18:355-362. [Google Scholar]
- 62.Schaper KJ, Schubert S, Dalhoff A. Kinetics and quantification of antibacterial effects of betalactams, macrolides, and quinolones againts gram-positive and gram-negative RTI pathogens. Infection 2005; 33(Suppl 2):3-14. DOI: 10.1007/s15010-005-8202-2 [DOI] [PubMed] [Google Scholar]
- 63.Gómez-Guiu A, Azanza JR, Sádaba B, García-Quetglas E. Farmacocinética/farmacodinamia de los principales antimicrobianos utilizados por vía oral. Rev Clin Esp 2008;208(Supl 3):22-27. [Google Scholar]
- 64.Halm EA, Tierstein AS. Management of community adquired pneumonia. N Engl J Med. 2002;347:2039-2045. DOI: 10.1056/NEJMcp020499 [DOI] [PubMed] [Google Scholar]