RESUMEN
Introducción
Candida puede llegar a ser el segundo microorganismo responsable de la infección del tracto urinario nosocomial. Aunque sigue destacando Candida albicans entre todas las especies, otras han surgido como patógenos emergentes. En este trabajo se analizó la presencia de candiduria en pacientes hospitalizados.
Material y Métodos
Se estudiaron, de forma retrospectiva, todos los aislamientos de Candida procedentes de los urocultivos en pacientes adultos hospitalizados durante un periodo de 5 años. Se recogieron los datos referentes a la especie, sensibilidad frente a los fármacos antifúngicos fluconazol, anfotericina B y voriconazol (Vitek2, BioMerieux), presencia de sonda urinaria, servicio de procedencia, edad y sexo del paciente.
Resultados
Se detectaron 289 episodios de candidurias, con un incremento anual. En 134 (46,4%), fueron levaduras no C. albicans, siendo 57 (19,7%) Candida glabrata, 37 (12,8%) Candida tropicalis, 25 (8,6%) Candida parapsilosis y 10 (3,5%) Candida lusitaniae. La mayoría provenían de pacientes sondados (240; 83,0%) y hospitalizados en el Servicio de Medicina Interna (118; 40,8%). Los aislados procedentes de varones fueron 152 (52,6%) y la edad media superior a los 65 años. La sensibilidad a los fármacos antifúngicos fue superior al 85%.
Conclusiones
Los estudios de urocultivos en pacientes hospitalizados deben incluir la posible presencia de candiduria, que es más prevalente en los procedentes de los Servicios de Medicina Interna, portadores de sonda urinaria y con una edad superior a los 65 años. Dada la elevada prevalencia de levaduras no C. albicans, se recomienda incorporar estudios de identificación de especie.
Palabras claves: Candida albicans, levaduras no Candida albicans, fármacos antifúngicos, orina, sonda urinaria
ABSTRACT
Introduction
Candida could become the second most frequent cause of nosocomial urinary tract infection. Although Candida albicans is the most important species, others have arisen as emerging pathogens. The aim of this study was to analyze the presence of candiduria in inpatients.
Material and methods
We performed a retrospective study of Candida isolates from adult inpatient urocultures over five years, gathering and tabulating data on: the species; susceptibility to fluconazole, amphotericin B, and voriconazole (Vitek2, BioMerieux); presence of catheter; hospital department of origin; and patient age and sex.
Results
We detected 289 yeast episodes, observing an annual increase: 134 (46.4%) were non-C. albicans yeasts, with 57 (19.7%) being Candida glabrata, 37 (12.8%) Candida tropicalis, 25 (8.6%) Candida parapsilosis, and 10 (3.5%) Candida lusitaniae. Most isolates derived from catheterized (240, 83.0%) and Internal Medicine Department (118, 40.8%) patients, observing an annual increase; 152 (52.6%) isolates were from males, and the mean age was >65 years. Susceptibility to antifungals was >85%.
Conclusions
Inpatient urocultures should include data on the presence of Candida, which is more prevalent in Internal Medicine Department inpatients, in those with urinary catheter, and in over 65-year-olds. Almost half of the isolates were non-C. albicans yeasts, and we recommend complete identification of the species involved.
Key words: Candida albicans, no Candida albicans yeasts, antifungal drugs, urine, urinary catheter
INTRODUCCIÓN
Las especies de Candida son la causa más común de infecciones por hongos, siendo entre ellas Candida albicans la más frecuente. Se trata de levaduras comensales, que forman parte de la microbiota de la piel, gastrointestinal y genital. Otras especies del género Candida han surgido como patógenos emergentes [1] y también pueden formar parte de la microbiota mucocutánea. La patogenicidad de este grupo de microrganismos está muy influenciada por el estado inmune y la enfermedad de base del hospedador.
La presencia de candiduria en pacientes hospitalizados es un hallazgo frecuente, con particular importancia en aquellos pacientes ingresados en la Unidad de Cuidados Intensivos y en los pacientes sondados [2]. La candiduria hay que valorarla cuidadosamente ya que puede corresponder a una colonización. La utilización de criterios estrictos, como recuentos superiores a 100.000 UFC/ml y el carácter monomicrobiano, ayudan a excluir esta situación [3]. Además, la presencia de levaduras en orina está claramente relacionado con un aumento de la morbilidad y mortalidad en pacientes con enfermedades de base, de ahí la importancia de valoración correcta [4]. Se considera que Candida pueden ser los segundos patógenos responsables de las infecciones del tracto urinario (ITU) nosocomiales tras Escherichia coli [2]. En la comunidad, menos de 1% de las muestras de orina contienen una cantidad considerable de Candida [5].
Se han descrito diferentes factores de riesgo para la candiduria [6]: inmunodepresión, diabetes mellitus, ingreso hospitalario prolongado, presencia de sonda urinaria, antibioterapia de amplio espectro, sexo femenino y edad superior a los 65 años. Finalmente, la decisión de tratar la candiduria puede ser controvertida, si no se descarta un estado de colonización. La recomendación actual es administrar tratamiento antifúngico si el paciente tiene un riesgo de desarrollar candidemia, como ocurre en trasplantados renales, recién nacidos prematuros, inmunodeprimidos y pacientes sometidos a instrumentación quirúrgica urinaria. En estos casos el tratamiento de elección ha sido fluconazol [5].
En los estudios realizados, la principal especie aislada en la candiduria es C. albicans, seguida por especies del mismo género: Candida tropicalis, Candida parapsilosis y Candida glabrata. Estas especies representan un posible mayor riesgo de resistencia a los fármacos antifúngicos, sobre todo a fluconazol [1, 7].
El objetivo de este trabajo fue la descripción de los episodios de candidurias en adultos hospitalizados registrados en un Hospital Regional, su perfil de sensibilidad a los fármacos antifúngicos, y su relación con la presencia de sonda urinaria, servicio de procedencia, edad y sexo del paciente.
MATERIAL Y MÉTODOS
Se analizaron de forma retrospectiva los episodios de candiduria, ocurridos en el Hospital Universitario Virgen de las Nieves de Granada en adultos, durante un periodo de 5 años (enero de 2011-diciembre de 2015). Este Hospital es un centro de tercer nivel que, además, atiende a una población de unas 440.000 personas en la provincia de Granada (Andalucía, España).
Se incluyeron los episodios de ITU con urinocultivo positivo identificados desde las Salas de Hospitalización, excluyendo los procedentes de las Unidades de Urgencias o consultas externas del hospital. De la revisión se excluyeron los episodios detectados en los 30 días posteriores tras la primera detección, incluyendo sólo el primer episodio de ITU para el estudio. La detección de levaduras en las muestras de orina se hizo según el procedimiento habitual [8]. Diez colonias de aspecto compatible con levaduras en el medio cromogénico del urocultivo se subcultivaron en medio cromogénico para levaduras para demostrar su carácter monomicrobiano. La identificación definitiva de las especies, C. albicans y levaduras no C. albicans (LNCA), y la sensibilidad a los fármacos antifúngicos se realizó mediante el sistema Vitek2 (bioMerieux, Madrid, España) según protocolo del fabricante, que investiga la sensibilidad a micafungina, caspofungina, voriconazol, fluconazol y anfotericina B [9], pero sólo los resultados frente a estos tres últimos fueron analizados. En caso de resultado indeterminado en la identificación se usó espectrometría de masas (MALDI-TOF Byotiper, Brucker-Daltonics, Billerica, EEUU) desde 2012. La sensibilidad a los fármacos antifúngicos se interpretó según los criterios del EUCAST [10]. Se consideró un aislado sensible cuando los valores de CMI fueron iguales o inferiores a 1mg/L para anfotericina B; a 2 mg/L para fluconazol en los aislados de C. albicans, C. parapsilosis y C. tropicalis; a 0,002 mg/L para fluconazol en los aislados de C. glabrata; y 0,125 mg/L para voriconazol, sin interpretación para C. glabrata.
Los datos se analizaron con el paquete de programa estadístico SPSS por MS Windows versión 17.0 (Chicago, IL, EE. UU.). Las variables cuantitativas se describen como la frecuencia de distribución de cada una de las categorías.
Consideraciones éticas. El protocolo del estudio se llevó a cabo con arreglo a la Declaración de Helsinki. Este fue un estudio no intervencionista, con ninguna investigación adicional a los procedimientos rutinarios. El material biológico se utilizó sólo para el diagnóstico estándar de ITU, siguiendo las prescripciones de los médicos. No se realizó muestreo adicional ni modificación del protocolo de rutina. Se hicieron los análisis de datos utilizando una base de datos anónima. Por lo tanto, la aprobación fue considerada innecesaria según las pautas de nuestro país. La entidad que concedió el permiso para acceder y utilizar los datos fue la «Unidad de Gestión Clínica de Enfermedades Infecciosas y Microbiología Clínica del Hospital Virgen de las Nieves de Granada, España».
RESULTADOS
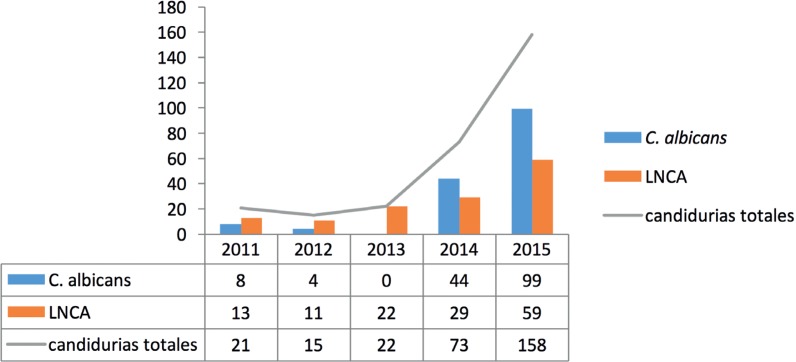
Se detectaron 289 episodios de candiduria durante el periodo de estudio. Del total de muestras de orina con presencia de levaduras, 240 (83,0%) pertenecían a pacientes con algún tipo de sonda urinaria y en 49 (17,0%) no constaba el uso de sonda. Un total de 152 (52,6%) aislados procedían de muestras de orina pertenecientes a hombres, mientras que 137 (47,4%) pertenecían a mujeres. Hasta 155 aislados (53,6%) pertenecían a la especie C. albicans, el resto, 134 (46,4%), eran LNCA: 57 (19,7%) C. glabrata, 37 (12,8%) C. tropicalis, 25 (8,6%) C. parapsilosis, 10 (3,5%) Candida lusitaniae, 2 (0,7%) Candida krusei, y 3 (1,0%) de otras especies de Candida. En la figura 1 se observa la distribución de los aislamientos en C. albicans y LNCA por años: 21 en el año 2011; 15 en el 2012; 22 en el 2013; 73 en el 2014 y 158 en el 2015. La edad media de los pacientes con candiduria fue de 75,8 años en 2011; 64,8 en 2012; 73,3 en el año 2013; 65,6 en el año 2014 y finalmente, 71,9 en 2015.
Figura 1.
Distribución de los aislamiento de Candida en los diferentes años del periodo de estudio.
LNCA: levaduras no C. albicans
Del total de candidurias, 62 provenían de pacientes ingresados en la Unidad de Cuidados Intensivos (21,4%), 118 (40,8%) de ingresados en Medicina Interna, y 38 (13,1%) de los servicios de Nefrología y Urología. Cuando se estudió la evolución anual, entre 2011 y 2015, de las candidurias diagnosticadas en los servicios se observó un incremento en valores absolutos en el servicio de Medicina Interna (6, 5, 9, 33 y 65, respectivamente) y un descenso en la Unidad de Cuidados Intensivos (8, 7, 8, 16 y 23, respectivamente).
En la tabla 1 se observa la sensibilidad total del periodo de estudio a fluconazol, anfotericina B y voriconazol de 116 (40,1% del total) aislados de las 4 principales especies.
Tabla 1.
Sensibilidad total del periodo de estudio a fluconazol, anfotericina B y voriconazol.
| Especies | Aisladosa | Porcentajea | Porcentaje de sensibilidadb |
||
|---|---|---|---|---|---|
| Fluconazol | Anfotericina B | Voriconazol | |||
| C. albicans | 16 | 10,3 | 100% | 100% | 100% |
| C. glabrata | 46 | 80,7 | 85,9% | 98,4% | --- |
| C. parapsilosis | 21 | 84,0 | 86,9% | 95,6% | 100% |
| C. tropicalis | 33 | 89,2 | 92,1% | 94,7% | 89,5% |
Número y porcentaje de aislados estudiados, sobre el total de los obtenidos durante el periodo de estudio para esta especie.
Por obtener valores de CMI en mg/l de anfotericina B < 1; de fluconazol < 2 para C. albicans, C. parapsilosis y C. tropicalis, < 0,002 para C. glabrata; y de voriconazol < 0,125, sin interpretación para C. glabrata.
DISCUSIÓN
En este trabajo se revisa la presencia de candiduria en pacientes hospitalizados debido a la relativamente escasa existencia de trabajos sobre series recientes en pacientes hospitalizados. Un estudio a nivel europeo determinó que el 9,4% de las ITU nosocomiales están causadas por Candida [11], cifra que justifica el interés por la comunidad científica.
Se trata de un problema clínico posiblemente subestimado ya que el urocultivo estándar puede resultar poco sensible si no se actúa de manera correcta, y puede llevar a la infraestimación de la candiduria, sobre todo en aquellas especies LNCA.
Así C. glabrata puede tardar más de 48horas en crecer en el medio de cultivo de agar sangre de cordero al 5%. Además, los métodos automatizados de cribado mediante citometría suelen tener problemas de sensibilidad para la detección de candiduria por C. glabrata debido a su pequeño tamaño [12].
En la mayoría de los estudios C. albicans es el microorganismo más aislado, con porcentajes entre el 50% y el 70%, 53,6 % en nuestro área, seguida por C. glabrata (19,7% en este estudio) y en tercer lugar C. tropicalis (37 aislamientos, 12,8%) [13].
Actualmente, E. coli sigue siendo el microorganismo más aislado en las muestras de orina de pacientes sondados, pero las especies Candida le siguen, destacando dentro de ellas C. albicans. Cuando se ha obtenido crecimiento de Candida en muestras de orina se abre un debate clínico acerca de su posible significación, pues puede tratarse de una contaminación, por una recogida errónea de la muestra, una colonización o de una verdadera ITU [14]. Los procedimientos básicos del laboratorio, como los criterios estrictos de significación microbiológica y una buena recogida de muestra, sin duda ayudan a resolver la cuestión. La contaminación puede diferenciarse de otros procesos mediante la obtención adecuada de una nueva muestra de orina [5]. Esto ocurre con frecuencia en pacientes femeninos de edad avanzada, cuyo introito suele estar colonizado por Candida y que tienen dificultad para la obtención adecuada de una muestra de orina de micción media. En estos casos, si en la segunda muestra, obtenida en adecuadas condiciones, no hay crecimiento de levaduras no es necesario proseguir con el diagnóstico.
Existen diversos estudios que enumeran los diferentes factores de riesgo para la candiduria: inmunodepresión, diabetes mellitus, ingreso hospitalario prolongado, sondaje urinario, antibioterapia de amplio espectro previa, sexo femenino y edad superior a los 65 años [6]. En nuestro trabajo, en el año 2012, tenemos una media de edad de los pacientes con candiduria inferior a lo observado en estudios previos, de 64,8 años, aunque es muy cercana a los 65 años, de modo que en nuestro área sanitaria la edad también podría ser un factor de riesgo como indican estudios previos. En este trabajo no parece que el sexo influya en la presencia de candiduria, ya que la distribución por sexos es prácticamente la misma. También en otros estudios previos se ha visto igual distribución por sexos [15]. Sin embargo, sí observamos una gran presencia de candiduria entre pacientes con sonda urinaria (83,0%). También se sabe que el uso de antibióticos de amplio espectro facilita la colonización por Candida tras reducir la carga bacteriana propia, intestinal y genital, y posiblemente también en áreas cercanas a la uretra; pero en este estudio no hemos recogido la información sobre la ingesta previa de antibióticos.
Generalmente, la mayoría de pacientes con candiduria se encuentran escasamente sintomáticos [2]. Pero en aquellos pacientes con sintomatología, estos son indistinguibles de los que aparecen en la ITU bacteriana. Hay síntomas poco frecuentes pero muy sugestivos de ITU por levaduras, como son la oliguria, la eliminación de material floculoso y la pneumaturia, que se presentan cuando hay una bola fúngica vesical, típico de los pacientes diabéticos [16].
En un estudio español se encontró que la candiduria aparece tardíamente durante la estancia hospitalaria, alrededor de la segunda semana [6], y solo entre el 1% y el 8% de los pacientes con candiduria desarrollan candidemia, con mayor riesgo en pacientes ingresados en UCI [17]. De este modo, globalmente, la mayoría de los pacientes con candiduria no presentarán candidemia. Pero en pacientes críticos, la candiduria siempre ha de considerarse como un potencial marcador de riesgo de infección fúngica invasiva [18]. En tal caso, es muy importante la obtención de muestras de hemocultivo y la minuciosa exploración en busca de lesiones sugerentes de candidiasis invasiva [3]. Se ha comprobado que la candiduria aumenta la mortalidad en los pacientes ingresados en UCI [19]. Hasta un 22% de los pacientes ingresados en este servicio desarrollan candiduria tras 7 días de estancia [6]. En nuestro trabajo el porcentaje de candidurias totales procedentes de UCI al final del periodo de estudio fue bajo, con respecto a estudios previos, del 21,4%, sobre todo si comparamos la incidencia con la procedente del Servicio de Medicina Interna. Podemos observar que se trató de una disminución relativa de las candidurias en UCI con respecto a las producidas en otros servicios, principalmente en el Servicio de Medicina Interna, ya que realmente van aumentando en otros lugares del hospital con los años. Al inicio del periodo, en Medicina Interna la incidencia de candidurias fue inferior a UCI (año 2011, 8 en UCI frente a 6 en MI), pero ya en el año 2015 las candidurias en Medicina Interna fueron casi el triple que en la UCI (65 frente a 23). Esto podría deberse a un aumento de los pacientes sondados en Medicina Interna, muy frecuente en los pacientes pluripatológicos o paliativos. Los porcentajes de candiduria en los servicios de Urología y Nefrología son los más elevados tras los Servicios de UCI y Medicina Interna, pero a lo largo del periodo de estudio se han mantenido fluctuantes.
C. albicans es un microorganismo tanto comensal como patógeno, que puede colonizar e invadir diferentes espacios anatómicos. La morfología de levadura se asocia con la diseminación, mientras que la morfología de pseudohifa se relaciona con la adhesión, invasión y actividad proteolítica [20, 21]. Durante muchos años C. albicans ha sido la especie más aislada en el tracto urinario, y en nuestro estudio continuó siéndolo, pero pensamos que quizás debido al aumento del uso del antifúngico fluconazol, las LNCA han aparecido haciéndose cada vez más dominantes. Así, muchos estudios aportan ya aislamientos de LNCA superiores al 50% [2], no en nuestro caso con un 46,36%. Estas especies son más difíciles de erradicar y están mejor adaptadas al tracto urinario, como ocurre con C. glabrata, con una mejor adaptación al pH y osmolaridad de esa zona [22]. El único factor de riesgo que se ha asociado de forma significativa con la selección de especies de LNCA es la administración previa de fármacos antifúngicos; y el uso de fluconazol se ha asociado específicamente a la presencia de C. glabrata [1]. El aislamiento de C. glabrata ha aumentado de forma importante en las candidurias, y en este estudio es la segunda especie más identificada, con un total de 57 aislamientos (19,7%).
Para tratar la candiduria habitualmente se tiene en cuenta su carácter sintomático o no. Actualmente, en los pacientes asintomáticos se recomienda disminuir los factores de riesgo, si es posible, y hacer un recambio de la sonda urinaria si la poseen, ya que esto puede ser suficiente para eliminar la candiduria sin necesidad de tratamiento antifúngico [23]. Sin embargo, aquellos pacientes asintomáticos pero con elevado riesgo de diseminación, como los inmunodeprimidos y los recién nacidos prematuros deben ser tratados con altas dosis fluconazol intravenoso o anfotericina B en caso de tratarse de LNCA resistentes [24]. Si se trata de candiduria sintomática el tratamiento dependerá de la presentación clínica [16]. Fluconazol es el principal antifúngico para las candidurias, en adultos o recién nacidos, por su elevada biodisponibilidad, superior al 90%, concentrándose tanto en la piel como en la orina [7, 25]. En escasas ocasiones el tratamiento recomendado es la irrigación intravesical con anfotericina B. En nuestro estudio sólo C. albicans sigue teniendo una sensibilidad del 100% a estos fármacos antifúngicos.
En nuestro medio, fluconazol, tratamiento de elección en candidurias, fue el antifúngico al que los aislamientos de LNCA fueron menos sensibles, con valores del 85,9%, 86,9% y 92,1% para C. glabrata, C. parapsilosis y C. tropicalis, respectivamente. La anfotericina B tiene un amplio espectro, pero se trata de un antifúngico con gran toxicidad renal, limitando su uso. Para disminuir la nefrotoxicidad se crearon las formulaciones lipídicas. Aunque la resistencia a anfotericina B es rara en Candida ya se ha registrado en estudios previos [26]. En nuestro estudio se obtuvo una resistencia a este antifúngico en las especies C. glabrata, C. parapsilosis y en C. tropicales, que no superó el 10%. Todos los aislamientos de C. albicans fueron sensibles a anfotericina B. Pensamos que la sensibilidad podría, independientemente de la especie, estudiarse en todos los aislamientos de pacientes con candiduria y terapia antifúngica previa debido a que esta puede suponer un factor de riesgo para la presencia de especies farmacorresistentes. Las técnicas comerciales, como Vitek 2® (bioMérieux), se han implantado en muchos laboratorios clínicos, aunque se ha descrito la posibilidad de falsos positivos en la detección de resistencia de C. tropicalis frente a fluconazol y voriconazol [27]. Entonces, en base a los datos obtenidos, fluconazol puede seguir siendo el tratamiento de elección para las candidurias, siendo especialmente válido para C. albicans, aunque también para el resto de LNCA sería válido como tratamiento empírico en nuestro entorno ya que la resistencias son menores al 15%.
En conclusión, los estudios de urocultivos en pacientes hospitalizados deben incluir la posible presencia de candiduria, que es más prevalente en los procedentes de los Servicios de Medicina Interna, portadores de sonda urinaria y con una edad superior a los 65 años. Aunque la resistencia a fluconazol es baja en nuestro medio, dada la elevada prevalencia de LNCA, se recomienda incorporar, al menos, estudios de identificación de especie para predecir la posible resistencia a aquel.
FINANCIACIÓN
Los autores no han recibido financiación para la realización de este trabajo.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
BIBLIOGRAFÍA
- 1.Sobel JD. The emergence of non-albicans Candida species as causes of invasive candidiasis and candidemia. Curr Infect Dis Rep 2006;8:427-33. PMID: . [DOI] [PubMed] [Google Scholar]
- 2.Richards MJ, Edwards JR, Culver DH, Gaynes RP. Nosocomial infections in combined medical-surgical intensive care units in the United States. Infect Control Hosp Epidemiol 2000; 21:510-5. DOI: 10.1086/501795. [DOI] [PubMed] [Google Scholar]
- 3.Kauffman CA, Fisher JF, Sobel JD, Newman CA. Candida urinary tract infections--diagnosis. Clin Infect Dis 2011; 52 Suppl 6: S452-456. DOI: 10.1093/cid/cir111. [DOI] [PubMed] [Google Scholar]
- 4.Kauffman CA, Vazquez JA, Sobel JD, Gallis HA, McKinsey DS, Karchmer AW, et al. . Prospective multicenter surveillance study of funguria in hospitalized patients. The National Institute for Allergy and Infectious Diseases (NIAID) Mycoses Study Group. Clin Infect Dis 2000; 30:14-18. DOI: 10.1086/313583. [DOI] [PubMed] [Google Scholar]
- 5.Maldonado I, Arechavala A, Guelfand L, Relloso S, Garbasz C; de la Red de Micología de la Ciudad de Buenos Aires . Yeast urinary tract infections. Multicentre study in 14 hospitals belonging to the Buenos Aires City Mycology Network. Rev Iberoam Micol 2016; 33:104-9. DOI: 10.1016/j.riam.2015.07.004. [DOI] [PubMed] [Google Scholar]
- 6.Alvarez-Lerma F, Nolla-Salas J, Leon C, Palomar M, Jordá R, Carrasco N, et al. . Candiduria in critically ill patients admitted to intensive care medical units. Intens Care Med 2003; 29:1069-76. DOI: 10.1007/s00134-003-1807-y. [DOI] [PubMed] [Google Scholar]
- 7.Sobel JD, Kauffman CA, McKinsey D, Zervos M, Vazquez JA, Karchmer AW, et al. . Candiduria: a randomized, double-blind study of treatment with fluconazole and placebo. The National Institute of Allergy and Infectious Diseases (NIAID) Mycoses Study Group. Clin Iinfect Dis 2000; 30:19-24. DOI: 10.1086/313580. [DOI] [PubMed] [Google Scholar]
- 8.Rojo MD, Bautista MF, Gutiérrez-Fernández J. Procedimiento normalizado de trabajo. Cultivo cuantitativo de orina para estudio de microorganismos aerobios/ facultativos de crecimiento rápido. PNT-OR-01; 8.a ed. 2015. Acreditado por ENAC. Disponible en: 10.6084/m9.figshare.1317411. Recuperado 1 Abr 2016. Granada; Servicio Andaluz de Salud. [DOI] [Google Scholar]
- 9.Heras-Cañas V, Ros L, Sorlózano A, Gutiérrez-Soto B, Navarro-Marí JM, Gutiérrez-Fernández J. Isolated yeast species in urine samples in a spanish regional hospital. Rev Argent Microbiol. 2015;47:331-4. doi: 10.1016/j.ram.2015.07.004. [DOI] [PubMed] [Google Scholar]
- 10. http://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/AFST/Clinical_breakpoints/Antifungal_breakpoints_v_8.0.pdf. Recuperado 10 Abr 2017.
- 11.Bouza E, San Juan R, Munoz P, Voss A, Kluytmans J. A European perspective on nosocomial urinary tract infections II. Report on incidence, clinical characteristics and outcome (ESGNI-004 study). European Study Group on Nosocomial Infection. Clin Microbiol Infect 2001; 7:532-42. PMID: . [DOI] [PubMed] [Google Scholar]
- 12.Gutiérrez-Fernández J, Riazzo C, Sanbonmatsu S, Luna JD, Sorlózano A, Miranda C, et al. . Sysmex UF-1000i’ performance for screening yeasts in urine. APMIS 2014; 122:324-8. DOI: 10.1111/apm.12148. [DOI] [PubMed] [Google Scholar]
- 13.Achkar JM, Fries BC. Candida infections of the genitourinary tract. Clin Microbiol Rev 2010; 23:253-73. DOI: 10.1128/CMR.00076-09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Fisher JF, Sobel JD, Kauffman CA, Newman CA. Candida urinary tract infections--treatment. Clin Infect Dis 2011; 52 Suppl 6: S457-6. DOI: 10.1093/cid/cir112. [DOI] [PubMed] [Google Scholar]
- 15.Mladenovic J, Veljovic M, Udovicic I, Lazić S, Segrt Z, Ristić P, et al. . Catheter-associated urinary tract infection in a surgical intensive care unit. Vojnosanit Pregl 2015;72:883-8. PMID: . [DOI] [PubMed] [Google Scholar]
- 16.Donders GG. Lower genital tract infections in diabetic women. Curr Infect Dis Rep 2002; 4:536-9. PMID: . [DOI] [PubMed] [Google Scholar]
- 17.Bougnoux ME, Kac G, Aegerter P, d’Enfert C, Fagon JY. Candidemia and candiduria in critically ill patients admitted to intensive care units in France: incidence, molecular diversity, management and outcome. Intens Care Med 2008; 34:292-9. DOI: 10.1007/s00134-007-0865-y. [DOI] [PubMed] [Google Scholar]
- 18.Aubron C, Suzuki S, Glassford NJ, Garcia-Alvarez M, Howden BP, Bellomo R. The epidemiology of bacteriuria and candiduria in critically ill patients. Epidemiol Infect 2015; 143: 653-62. DOI: 10.1017/s0950268814000934. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Kauffman CA, Vazquez JA, Sobel JD, Gallis HA, McKinsey DS, Karchmer AW, et al. . Prospective multicenter surveillance study of funguria in hospitalized patients. The National Institute for Allergy and Infectious Diseases (NIAID) Mycoses Study Group. Clin Infect Dis 2000; 30:14-8. DOI: 10.1086/313583. [DOI] [PubMed] [Google Scholar]
- 20.Whiteway M, Bachewich C. Morphogenesis in Candida albicans. Ann Rev Microbiol 2007; 61:529-53. DOI: 10.1146/annurev.micro.61.080706.093341. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Lachke SA, Joly S, Daniels K, Soll DR. Phenotypic switching and filamentation in Candida glabrata. Microbiology 2002; 148:2661-74. DOI: 10.1099/00221287-148-9-2661. [DOI] [PubMed] [Google Scholar]
- 22.Sobel JD, Fisher JF, Kauffman CA, Newman CA. Candida urinary tract infections-epidemiology. Clin Infect Dis 2011; 52 Suppl 6:S433-6. DOI: 10.1093/cid/cir109. [DOI] [PubMed] [Google Scholar]
- 23.Sobel JD, Kauffman CA, McKinsey D, Zervos M, Vazquez JA, Karchmer AW, et al. . Candiduria: a randomized, double-blind study of treatment with fluconazole and placebo. The National Institute of Allergy and Infectious Diseases (NIAID) Mycoses Study Group. Clin Iinfect Dis 2000; 30:19-24. DOI: 10.1086/313580. [DOI] [PubMed] [Google Scholar]
- 24.Healy CM, Baker CJ, Zaccaria E, Campbell JR. Impact of fluconazole prophylaxis on incidence and outcome of invasive candidiasis in a neonatal intensive care unit. J Ped 2005; 147:166-71. DOI: 10.1016/j.jpeds.2005.04.016. [DOI] [PubMed] [Google Scholar]
- 25.Pappas PG, Kauffman CA, Andes DR, Clancy CJ, Marr KA, Ostrosky-Zeichner L, et al. . Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis 2016; 62:e1-50. DOI: 10.1093/cid/civ933. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Goncalves SS, Souza AC, Chowdhary A, Meis JF, Colombo AL. Epidemiology and molecular mechanisms of antifungal resistance in Candida and Aspergillus. Mycoses 2016; 59:198-219. DOI: 10.1111/myc.12469. [DOI] [PubMed] [Google Scholar]
- 27.Alfouzan W, Al-Enezi T, AlRoomi E, Sandhya V, Chandy R, Khan ZU. Comparison of the VITEK 2 antifungal susceptibility system with Etest using clinical isolates of Candida species. Rev Iberoam Micol 2017;34:171-4. DOI: 10.1016/j.riam.2016.12.002. [DOI] [PubMed] [Google Scholar]